Postholecistektomijas sindroms: problēmas klīniskie aspekti. Postholecistektomijas sindroms: vai mēs vienmēr to pilnībā diagnosticējam un nodrošinām adekvātu terapiju? Holecistektomija pēc mkb 10
Definīcija. Postholecistektomijas sindroms (PCES) ietver slimību grupu, kas galvenokārt sastāv no holedohopankreatīvās un žultsceļu sistēmas un rodas vai pasliktinās pēc holecistektomijas vai citas ilgstošas operācijas. žults ceļu, kas tika veikti galvenokārt holelitiāzes gadījumā.
ICD-10: K91.5 - Postholecistektomijas sindroms.
Etioloģija un patoģenēze. Lielākā daļa izplatīts iemesls PCES veidošanās ir nepilnīga pārbaude pirms operācijas un tās laikā, kas noved pie nepilnīgas ķirurģiskās aprūpes apjoma. Operācijas veikšanas tehnikas defekti ir svarīgi (cauruļvadu bojājumi, nepareiza kanalizācijas ievadīšana, gara cistiskā kanāla atstāšana, Vater nipeļa stenoze, akmeņu atstāšana žults traktā) utt. operācijas laikā lielai divpadsmitpirkstu zarnas papillai ir īpaša loma. Diezgan bieži PCES attīstās, ja pirms operācijas netiek atpazīts Vater nipelis kanāla caurspīdīgums un operācijas laikā tas netiek koriģēts.
Klasifikācija. Slimības, kas iekļautas postholecistektomijas sindromā:
· Patiesi akmeņu jaunveidojumi bojātajā kopējā žultsvadā;
• nepatiesa akmeņu veidošanās recidīvs vai žultsvada "aizmirsti" akmeņi;
· Stenozējošs divpadsmitpirkstu zarnas papilīts (lielo divpadsmitpirkstu zarnas papillas cicatricial-iekaisuma sašaurināšanās, kas izraisa žults un dažreiz aizkuņģa dziedzera hipertensijas attīstību);
· Aktīvs līmēšanas process subhepatiskajā telpā;
· Hronisks holepankreatīts;
· Hepatogēnas gastroduodenālās čūlas;
· Kopējā žultsvada sašaurināšanās;
· Cistiskā kanāla garā celma sindroms (palielinās izmērs žults hipertensijas ietekmē, cistiskā kanāla celms, kas ir akmeņu neoplazmas vieta, sāpju cēlonis labajā hipohondrijā);
Pastāvīgs pericholedochial limfadenīts.
Klīniskā aina. Norāde uz izmeklēšanu postholecistektomijas sindromam ir sāpju sindroms un / vai obstruktīva dzelte agri un vēlu pēcoperācijas periods.
Ar reālu akmeņu veidošanās recidīvu hepatoholedohos PCES klīniskās izpausmes tiek reģistrētas 3-4 gadus pēc operācijas. Tie sastāv no monotona, retāk paroksizmāla sāpju sindroma labajā hipohondrijā vai epigastriskā reģiona labajā pusē. Bieži vien sāpju lēkmes pavada īslaicīgs ādas icterus un intermitējoša dažādas intensitātes hiperbilirubinēmija. Ir iespējama pastāvīga obstruktīva dzelte ar pieaugošiem infekcijas un iekaisuma procesa simptomiem žultsvados.
Parastā žultsvada (hepatoholedoka "aizmirstie akmeņi") akmeņu veidošanās kļūdainai atkārtošanai raksturīgas tādas pašas klīniskās izpausmes kā ar patiesu akmeņu veidošanās atkārtošanos. Atšķirība sākuma datumos klīniskās izpausmes, kas viltus recidīva gadījumā tiek reģistrēti agrāk, parasti pirmajos 2 gados pēc operācijas.
Vietēja duodenīta-papalīta gadījumā, veidojoties lielā divpadsmitpirkstu zarnas sprauslas kanāla stenozei, pacientam rodas sāpju sindroms, lokalizējoties sāpes pa labi un virs nabas, dažreiz epigastrijā. Ir iespējami trīs veidu sāpes:
Divpadsmitpirkstu zarnas: izsalkušas vai vēlīnas sāpes, ilgstošas, vienmuļas;
Sfinkteris: krampjveida, īslaicīgs;
Choledochal: spēcīgs, vienmuļš, notiek 30-45 minūtes pēc ēšanas, īpaši bagātīgs, bagāts ar taukiem.
Sāpju sindromu raksturo noturība, apvienojumā ar sliktu dūšu un vemšanu, mokoša grēmas. Lielākajā daļā pacientu epigastriskā reģiona palpācija un perkusija sniedz maz diagnostikas informācijas. Tikai 40-50% pacientu vietējās sāpes nosaka ar palpāciju 4-6 cm virs nabas un 2-3 cm pa labi no viduslīnijas.
Perifērās asinīs izmaiņas nav izplatītas. Leikocītu skaits var palielināties, ESR mēreni palielinās. Tikai ar papilīta saasināšanos, īslaicīgi (1-3 dienas), bet ievērojami palielinot aminotransferāžu (ASAT un ALAT) aktivitāti, ir iespējama mērena sārmainās fosfatāzes aktivitātes palielināšanās serumā. Bilirubīna satura palielināšanās ne vienmēr tiek novērota un reti izteikta. Raksturīga atšķirība starp Vater sprauslas striktūru un funkcionālo spazmu ir anestēzijas (spazmolītiskā) efekta neesamība, lietojot perorāli nitroglicerīnu.
Ar aktīvu adhezīvu procesu pacients ir noraizējies Neasas sāpes labajā hipohondrijā, saasināts pēc smagas pacelšanas, ilgstošas sēdēšanas, pēc kratīšanas, dažreiz pēc smagas maltītes. Palpāciju labajā hipohondrijā labā taisnās vēdera muskuļa ārējā malā nosaka sāpes. Netieši par labu aktīvam saķeres procesam liecina irrigoskopijas un enterogrāfijas dati, ar kuru palīdzību tiek atklāta zarnu cilpu fiksācija iepriekš veiktās operācijas zonā.
Sekundārās gastroduodenālās čūlas rodas 2-12 mēnešus pēc holecistektomijas. Pavadot grēmas, slikta dūša (refluksa parādības). Čūlu lokalizācija ir parapilora un postbulāra. Veidojoties post-čūlas rētai netālu no lielā divpadsmitpirkstu zarnas sprauslas, kopēja žultsvada papilārā segmenta cicatricial sašaurināšanās, klīniskā aina ir atkarīga no žults ceļu attīstītās obstrukcijas pakāpes. Smagi žults aprites traucējumi izpaužas kā sāpes labajā hipohondrijā, ādas nieze, hiperaminotransferāzēmija un hiperbilirubinēmija, sārmainās fosfatāzes aktivitātes palielināšanās. Noņemtā urīnpūšļa zonas palpācija un perkusija labā puse epigastrijs izraisa mērenas sāpes.
Cistiskā kanāla garā celma sindroms rodas un progresē ar žultsceļu hipertensiju, ko bieži izraisa stenozējošs duodenīts-papilīts. Žultspūšļa kakla paplašinātā celma lūmenā bieži veidojas akmeņi. Šādos gadījumos pacientus var traucēt pastāvīgas sāpes labajā hipohondrijā un labajā jostas rajonā, aknu kolikas uzbrukumi.
Ar pastāvīgu pericholedochial limfadenītu pacientiem traucē pastāvīgas sāpes epigastrijā, labajā hipohondrijā kombinācijā ar subfebrīla stāvokli, svīšana. Palpāciju labajā hipohondrijā aknu vārtu projekcijā var noteikt ar blīvu, jutīgu veidojumu. Šāds atklājums var izraisīt nepareizu iekaisuma infiltrāta diagnozi - audzēju choledochopancreatoduodenal zonā. Pārbaudot pacientu asinis ar šo PCES formu, tiek reģistrēts pastāvīgi palielināts ESR, periodiski - neitrofīla leikocitoze.
Diagnostika un diferenciāldiagnoze. Nosakot galīgo diagnozi, diferenciāldiagnoze Atsevišķām PCES formām vadošo lomu spēlē ultraskaņas, EGDS, endoskopiskās retrogradās holedohopankreatogrāfijas (ERPCG) un laparoskopijas rezultāti.
Apsekojuma plāns.
· Vispārēja asins analīze.
· Bioķīmiskais asins tests: bilirubīns, holesterīns, alfa-amilāze, sārmainā fosfatāze.
· Aknu, žults ceļu, aizkuņģa dziedzera ultraskaņa.
· Laparoskopija.
Ārstēšana. Pacientu ārstēšana ar PCES tiek veikta, izmantojot gan konservatīvas metodes, gan ķirurģisku iejaukšanos.
Parastie žultsvada akmeņi, smagas divpadsmitpirkstu zarnas papilīta stenozējošas formas, izteikta koprīta žultsvada sašaurināšanās ir indikācijas ķirurģiskai korekcijai. Citos gadījumos pacientu ārstēšanu ar PCES veic ar konservatīvām metodēm.
Lai novērstu iekaisuma procesu aizkuņģa dziedzera un žultsceļu rajonā, tiek nozīmēts nikotīns - tabletes 0,5 - 3 reizes dienā 20 minūtes pirms ēšanas, košļāt un norīt ar 1/2 glāzi ūdens.
Bakteriālās infekcijas nomākšana tiek veikta, lietojot eritromicīnu (0,25), triholopolu (0,25), 1 tableti 3 reizes dienā pirms ēšanas 9-12 dienu ciklos.
Duodenītu-papilītu labi ārstē, mazgājot Vater nipeli ar furacilīna šķīdumu caur endoskopiski ievietotu katetru.
Sekundāro gastroduodenālo čūlu veidošanās gadījumā zālēm no H-2 blokatoru grupas ir augsta terapeitiskā efektivitāte - ranitidīns (0,15 - 2 reizes dienā), famotidīns (0,04 - 1 reizi dienā), protonu sūkņa bloķētājs omeprozols (0,02 - 1 reizi dienā) 30 dienu laikā.
Ar aizkuņģa dziedzera disfunkciju tiek noteikti fermentu preparāti - panzinorm, enzistal, pankreatīns - 1 tablete 3 reizes dienā ēdienreizes laikā.
Ieteicams izmantot daļēju (5-6 reizes dienā) ēdienreižu režīmu, pārtiku, kas bagāta ar šķiedrvielām. Akmens veidošanās atkārtošanās novēršanai tiek noteikta uzņemšana kviešu klijas 1 tējkaroti tvaicēti 1/3 glāzes verdoša ūdens, 3 reizes dienā
ēdiens Laiks.
Prognoze. Ar savlaicīgu un pareizi izvēlētu konservatīvo un, ja nepieciešams, ķirurģiska ārstēšana prognoze ir labvēlīga. Bez ārstēšanas ir iespējama aknu sekundārās žultsceļu cirozes veidošanās, smagas, sarežģītas hroniska pankreatīta formas, peptiska čūla.
LOCĪTAVU SLIMĪBAS
REIMATOĪDAIS ARTRĪTS
Definīcija.Reimatoīdais artrīts(RA) ir hroniska imūnkompleksa slimība, kas noved pie progresējošas locītavu un periartikulāru struktūru iznīcināšanas, sistēmisku traucējumu veidošanās.
ICD 10: M05. - seropozitīvs reimatoīdais artrīts.
M05.3 - Reimatoīdais artrīts, iesaistot citus orgānus un sistēmas.
M06. - Cits reimatoīdais artrīts.
M06.0 - seronegatīvs reimatoīdais artrīts.
Etioloģija. RA etioloģiskais faktors var būt 4. tipa herpes vīrusi (Ebstein-Bar vīruss) un 5. tipa (citomegalovīruss), mikobaktērijas. Nav izslēgta citu vīrusu un baktēriju etioloģiskā loma. Jāuzsver, ka infekcijas izraisītāji ir spējīgi izraisīt slimības mehānismu tikai uz iedzimtas vai, visticamāk, iegūtas ģenētiskās noslieces fona. Lielākajai daļai RA pacientu ir HLA DRW 4 histokompatibilitātes antigēns.
Patoģenēze. RA patoģenētisko mehānismu iedarbināšana parasti notiek pēc hipotermijas, īslaicīgas jebkuras ģenēzes imūnsupresijas, pēc tam aktivizējot latentu infekciju, kas uzņēmīgiem indivīdiem var izraisīt slimības. Etioloģiski nozīmīgi infekcijas faktori uz bojāta ģenētiskā fona izraisa reimatoīdā faktora veidošanos - IgM un IgG antivielas pret IgG F C fragmentu. Reimatoīdo faktoru zemā koncentrācijā var atrast arī veseliem cilvēkiem... Bet ar tā saukto seropozitīvo RA reimatoīdo faktoru asins serumā nosaka lielā atšķaidījumā, kas nav novērojams veseliem cilvēkiem.
RA gadījumā rodas un sāk pārmērīgi cirkulēt asinīs IgG (FC) -IgG un IgG (FC) -IgM imūnkompleksi, kuros antigēns ir imūnglobulīna IgG FC fragments, un antivielas ir imūnglobulīni IgG un IgM. . Imūnkompleksi ir fiksēti locītavu skrimšļa struktūrās un sinoviālajā membrānā, asinsvadu sieniņā. IgG (F C) -IgM kompleksi. var būt krioglobulīnu īpašības. Viņi spēj konjugēt ar komplementu un aktivizēt to. Tādējādi tiek aktivizēti imūnā iekaisuma šūnu un humorālie mehānismi, kas imūnkompleksu eliminācijas procesā izraisa destruktīvas izmaiņas locītavās un asinsvados.
Raksturīgs ir pārsvarā simetrisks, divpusējs locītavu erozīvi-destruktīvs bojājums ar skrimšļa, sinoviālās membrānas un kapsulas iesaistīšanos. Parādās un aug granulācijas audi - pannus, kas iznīcina kaulu skrimšļus un epifīzes, veidojot līkumus, veidojot rupjas deformācijas un locītavu ankilozi.
Notiek sekundārā imūnkompleksa vaskulīts - galvenais cēlonis patoloģiskas izmaiņas iekšējie orgāni pacientiem ar RA - plaušas, sirds, gremošanas orgāni, nervu sistēma utt.
Proteolītisko mehānismu pārslodze un līdz ar to funkcionāla nepietiekamība akūtas fāzes olbaltumvielu un imūnkompleksu likvidēšanai ir RA iekšējo orgānu amiloidozes veidošanās cēlonis.
Reimatoīdais faktors bieži nav RA pacientu asinīs. Šis RA variants ir seronegatīvs. Tomēr reimatoīdo faktoru šādos gadījumos var atrast sinoviālais šķidrums iekaisušas locītavas.
Mūsdienu starptautiskā ICD 10 klasifikācija izšķir divas RA grupas: seropozitīvu reimatoīdo artrītu (M05.) Un citus reimatoīdo artrītu (M06.).
Seropozitīvā RA grupa ietver:
· Felty sindroms.
· Reimatoīdā plaušu slimība.
· Reimatoīdais vaskulīts.
· RA, iesaistot citus orgānus un sistēmas.
· Cita seropozitīva RA.
Neprecizēts seropozitīvs RA.
Citu RA grupā ietilpst:
Seronegatīvs RA.
· Pieaugušajiem iestājusies Stila slimība.
· Reimatoīdais bursīts.
· Reimatoīdais mezgls.
· Iekaisuma poliartropātija.
· Citi norādītie RA.
· RA, nenoteikta.
Klīniskajā praksē visbiežāk: seropozitīvs RA, seronegatīvs RA, RA ar citu orgānu un sistēmu iesaistīšanu, t.i. ar sistēmiskām izpausmēm.
Klīniskā aina. Līdz šim vietējie reimatologi ievēro šādu RA klīnisko klasifikāciju, kas ir ļoti ērti, lai izveidotu funkcionāli pilnīgu klīnisko diagnozi:
RA klīniskais un patoģenētiskais variants:
§ poliartrīts (daudzu locītavu bojājums);
§ oligoartrīts (vairāku locītavu bojājums);
§ monoartrīts (vienas locītavas bojājums).
2. RA ar sistēmiskām izpausmēm:
§ reimatoīdie mezgli;
§ limfadenopātija;
§ serozīts;
§ vaskulīts;
§ amiloidoze;
§ pneimonīts;
§ kardīts;
§ neiropātija;
§ oftalmopātija;
§ īpaši sindromi:
Ø pseidoseptiskais sindroms;
Ø Felty sindroms.
3. RA kombinācijā ar osteoartrītu, difūzām slimībām saistaudi, reimatisms.
4. Nepilngadīgo RA (ieskaitot Stila slimību).
§ Imunoloģiskās īpašības RA:
Ø seropozitīvs;
Ø seronegatīvs.
§ slimības gaita:
Ø lēnām progresē;
Ø strauji progresē;
Ø bez progresēšanas.
§ Darbības pakāpe:
Ø minimums (I st.);
Ø vidēja (II st.);
Ø augsts (III gs.);
Ø nav aktivitātes, remisija (0 ēdamk.).
§ rentgena stadija:
Ø periartikulāra osteoporoze (I pakāpe);
Ø osteoporoze, locītavas telpas sašaurināšanās, vienreizējas lietošanas (II pakāpe);
Ø osteoporoze, locītavas telpas sašaurināšanās, vairāki uzurpējumi (III pakāpe);
Ø osteoporoze, locītavas telpas sašaurināšanās, daudzveidīga usūrija, ankiloze (IY stadija).
§ Locītavu disfunkcijas:
Ø FN 0 - netiek traucēta locītavu funkcija, tiek saglabāta profesionālā darba spēja.
Ø FN 1 - tiek traucēta locītavu funkcija, bet daļēji tiek saglabāta profesionālā darba spēja.
Ø ФН 2 - tiek zaudētas profesionālās spējas strādāt.
Ø FN 3 - pacients ir invalīds, viņam nepieciešama aprūpe ārpusē.
Klīniskās diagnozes piemērs, pamatojoties uz iepriekš minēto klasifikāciju: “Reimatoīdais artrīts, poliartrīts ar sistēmiskām izpausmēm: limfadenopātija, reimatoīdie mezgli; seropozitīvs, lēnām progresējošs kurss, aktivitāte - II pakāpe, rentgena stadija - III pakāpe, locītavu disfunkcija - FN 2. "
Pēc pacientu anamnēzes ir iespējams noteikt hipotermijas faktu, iekaisuma slimība, nomācoša stresa situācija, kas notika vairākas nedēļas pirms pirmo RA pazīmju parādīšanās.
Slimības sākums var būt akūts, subakūts, gauss.
Ar akūtu sākumu dominē vispārējie traucējumi. Drudzis parādās pēkšņi, bieži drudžains. Vispārējs vājums ir asi izteikts. Tajā pašā laikā dienas laikā ir intensīvas sāpes, stīvums locītavās.
Ar subakūtu RA debiju gadā klīniskā aina pārsvarā ir locītavu sindroms. Mēģinot pārvietoties skartajās locītavās, artralģijas ir nemainīgas, intensīvas, saasinātas. Bažas par stīvumu, kas var samazināties tikai pēcpusdienā. Labklājības pasliktināšanās ir mazāk izteikta. Ķermeņa temperatūra ir mēreni paaugstināta.
RA gauso sākumu pavada vidēji stipras sāpes, īss rīta stīvums locītavās. Ķermeņa temperatūra paliek normāla.
Sākotnējam RA periodam raksturīgs simetrisks divpusējs poliartrīts ar bojājumiem. mazas locītavas: plaukstas, metakarpofalangeālā, proksimālā starpfalangea. Retāk tiek ietekmēti karpometakarpālais un metatarsofalangeālais. Vēl retāk slimība sākas ar oligo- vai monoartrītu, iesaistot plaukstas, elkoņa, ceļa locītavas. Pleca, gūžas locītavas, starpskriemeļu locītavas slimības sākotnējā periodā netiek ietekmētas. Šo locītavu iekaisums notiek ar ilgstošu RA.
Artrīts sākas ar eksudatīvām izmaiņām. Iekaisušo locītavu dobumā parādās izsvīdums, par ko liecina pozitīvs svārstību simptoms. Eksudatīvie procesi periartikulārajos audos izraisa ādas pietūkumu, pastainību, hiperēmiju. Savienojumi ir deformēti. Notiek subluksācijas. Sāpes un patoloģiskie procesi locītavās ierobežo pacienta kustību. Tad sāk dominēt proliferācijas procesi. Veidojas panuss, kam seko skarto locītavu ankiloze. Atrofē muskuļi, kas saistīti ar imobilizētām locītavām. Ar katru nākamo RA saasināšanos iekaisuma procesā var iesaistīties jaunas locītavas. Ir vairākas izpausmes locītavu patoloģija, kas raksturīga tikai RA.
Reimatoīdā roka:
Ø "valzirga spuras" simptoms - rokas elkoņa kaula novirze - rokas novirze uz apakšdelma elkoņa kaulu.
Ø Gulbja kakla simptoms - rokas deformācija, ko izraisa fleksijas kontraktūra metakarpofalangeālajās locītavās, hiperekstensija proksimālajā un locīšana distālajos starpfalangu locītavās.
Ø "Pogas cilpas" simptoms - rokas deformācija, ko izraisa proksimālās starpfalangu locītavas locīšanas kontraktūra vienlaikus ar hiperekstensiju distālajā starpfalango locītavā (pirkstu stāvoklis, nospiežot pogu).
Ø amiotrofijas simptoms ir rokas aizmugures muskuļu atrofija un ievilkšana, ko izraisa kustību ierobežošana metakarpofalangeālajās locītavās.
Ø “izslēgšanas locītavu” simptoms - RA gadījumā nav distālo starpfalangālo locītavu, mazā pirksta proksimālā starpfalangu locītavas un īkšķa pirmās metakarpofalangeālās locītavas bojājumu.
Reimatoīdā pēda:
Ø potītes locītavas bojājums kombinācijā ar pēdas valgus novirzi.
Ø Pirkstu āmura formas deformācija, metatarsofalangeālo locītavu subluksācija, plakanās pēdas.
Reimatoīdais ceļgals:
Ø Ceļa locītavas fleksijas kontraktūra kombinācijā ar četrgalvu muskuļa atrofiju.
Ø Beikera cistas veidošanās (locītavu maisa aizmugurējā volvula izvirzīšanās rezultāts popliteal fossa).
Kopā ar locītavām tiek ietekmētas cīpslas un to sinoviālie apvalki. Biežāk pirkstu saliekumu un pagarinātāju cīpslu maisi kļūst iekaisuši. Tas izpaužas ar pietūkumu, sāpīgumu. Mēģinot kustināt pirkstus, pār cīpslām dzirdams krepīts. Rokas saliektais tendovaginīts var izraisīt vidējā nerva saspiešanu, veidojoties karpālā kanāla sindromam. Šo sindromu var apspriest, kad kopā ar kustību grūtībām rodas vidējā un rādītājpirksta parastēzijas, sāpes, kas apakšdelmu izpleš līdz elkonim.
Papildus locītavu patoloģijai RA ir virkne sistēmisku traucējumu, kas galvenokārt raksturīgi seropozitīvai RA. Parādās reimatoīdie mezgli, limfadenopātija, reimatoīdais vaskulīts, ādas, plaušu, sirds, gremošanas orgānu, aknu, nieru, nervu sistēmas un acu bojājumi. Daudziem pacientiem veidojas dzelzi pārdaloša hipohromiska anēmija un iekšējo orgānu sekundārā amiloidoze.
Reimatoīdie mezgli ir specifiska RA iezīme. Tie rodas iekaisuma procesa augstas aktivitātes periodā. Slimības remisijas laikā samazinās izmērs vai pazūd. Tās ir blīvas, nesāpīgas saistaudu struktūras, kuru izmērs svārstās no 2-3 mm līdz 2-3 cm.Tās var būt kustīgas, izvietotas zemādas vai pielipušas kaulam, muskuļu aponeirozēm. Bieži atrodas paaugstinātas traumas vietās - ārējā virsma elkonis, ischial tuberosities, Achilles cīpsla. Dažreiz reimatoīdie mezgli parādās plaušās, miokardā, uz sirds vārstiem. Atrodoties cīpslās, tie var izraisīt cīpslu plīsumu.
Limfadenopātija ir raksturīga ļoti aktīvam RA. Bieži vien kopā ar splenomegāliju. Palielināti submandibular, kakla, paduses, elkoņa un cirkšņa limfmezgli. Plaši izplatīta limfadenopātija ir raksturīga RA variantiem, piemēram, Felty sindroms un Stila slimība pieaugušajiem.
Reimatoīdais vaskulīts ir galvenais sistēmisko bojājumu cēlonis pacientiem ar seropozitīvu RA. Daudziem pacientiem tas izpaužas kā Reino sindroms. Šajos gadījumos roku atdzišana provocē izteiktu zemādas artēriju spazmu. Pirksti kļūst bāli, bez asinīm, un pēc neilga laika asinsvadu gultnes kompensējošās postischēmiskās dilatācijas dēļ purpursarkani ciānveidīgi, tūskaini.
Ādas trauku vaskulīts izraisa retikulārā livido parādīšanos uz apakšējām ekstremitātēm - mazu sapenozu vēnu kontūras rakstu uz bālas, novājētas ādas fona. Uz kājām rodas intradermālas asiņošanas, nekrozes perēkļi, čūlas, ko izraisa atkārtoti ādas infarkti. Brūngani mikroinfarktu plankumi ir atrodami uz pirkstu un pirkstu nagu gultas.
Reimatoīdā plaušu slimība rodas pacientiem ar augstu reimatoīdā faktora titru. Iespējama pneimonīta, fibrozējoša alveolīta attīstība. Šādiem pacientiem rodas elpošanas mazspējas simptomi. Plaušās ir dzirdamas mitras, skanīgas, smalkas burbuļojošas rales, neskaņas krepitācijas.
Var veidoties pleirīts, parasti sauss, ar asimptomātisku gaitu. Vienīgā šīs patoloģijas izpausme var būt pleiras berzes troksnis.
Sirds patoloģija RA ietver zemu simptomu, biežāk fokālu granulomatozu miokardītu. Tas var izpausties ar ekstrasistolu, sirds vadīšanas sistēmas aizsprostojumiem. Dažreiz sausais perikardīts tiek veidots ar perikarda berzes troksni, kas raksturīgs šai patoloģijai, ST intervāla palielināšanos uz EKG. Dažreiz rodas hemodinamiski kompensēti defekti - nepietiekamība mitrālais vārsts, aortas mutes vārstu nepietiekamība.
Reimatoīdā nieru slimība - hronisks imūnkomplekss glomerulonefrīts - neattīstās bieži un parasti nenoved pie nieru mazspēja... Nefrotiskā sindroma simptomu rašanās RA visbiežāk ir saistīta ar nieru amiloidozi.
Perifēra polineiropātija, kas bieži rodas RA pacientiem, izpaužas ar jutības traucējumiem, retāk - ar kustību traucējumiem. Bieži tiek ietekmēts peroneālais nervs.
Dažos gadījumos pacientiem ar RA var attīstīties Sjogrena sindroms. To raksturo siekalu un citu eksokrīno dziedzeru funkcionāls deficīts un kompensējoša hiperplāzija. Ir gļotādu sausums, konjunktīvas ar redzes traucējumiem, gremošana.
Anēmija, kas bieži rodas pacientiem ar RA, nav saistīta ar dzelzs satura samazināšanos organismā. Tas pieder pie dzelzs pārdales kategorijas. Pacientiem ar imūnkompleksu slimībām, tostarp RA, ievērojamu daļu dzelzs, kas nogulsnējas hemosiderīna kompleksu veidā, uztver aktīvie makrofāgi ārpus kaulu smadzenēm. Kaulu smadzenes ir noplicinātas dzelzs sastāvā, kas galu galā noved pie nepietiekamas hemoglobīna un sarkano asins šūnu produkcijas.
RA bieži sarežģī sekundārs osteoartrīts un amiloidoze.
Sekundāro osteoartrītu papildina šai slimībai raksturīgu osteofītu parādīšanās Bušāra mezgliņu veidā uz proksimālās un Heberdenas uz pirkstu distālajām starpfalangu locītavām.
Sekundārās amiloidozes klīniskie simptomi ir saistīti ar bojājumiem galvenokārt nierēs, zarnās un aknās. Nieru amiloidoze parasti izpaužas ar nefrotisko sindromu. Nefrotiskā sindroma gadījumā tipisks ir tetrads: tūska, proteīnūrija, hipoproteinēmija, hiperholesterinēmija. Zarnu amiloidoze izraisa blāvas vai krampjveida sāpes vēderā bez īpašas lokalizācijas, izkārnījumu traucējumiem aizcietējumu vai caurejas formā. Aknu amiloidozei raksturīga hepatomegālija, aknu sabiezējums. Var parādīties traucētas portāla hemodinamikas, ascīta simptomi.
Diagnostika. Pilnīga asins analīze: hipohromiska anēmija. Leikocītu skaits perifērajās asinīs parasti ir normāls. Neitrofilā leikocitoze ir iespējama ar paaugstinātu drudzi. Leikopēnija rodas ar smagu splenomegāliju (Felty sindroms). ESR palielinās.
Asins ķīmija: paaugstināts līmenis fibrīns, fibrinogēns, palielināts alfa-2-globulīna, seromukoīda, haptoglobīnu saturs, PSA parādīšanās.
Imunoloģiskā analīze: augsts reimatoīdā faktora titrs asinīs pacientiem ar seropozitīvu RA (vismaz 1:32 Vaaler-Rose reakcijā). Seronegatīvā RA gadījumā reimatoīdais faktors ir atrodams tikai skarto locītavu sinoviālajā šķidrumā. Raksturīgs ir palielināts cirkulējošo imūno kompleksu saturs. Krioglobulinēmija ir izplatīta. Tiek noteiktas antikeratīna antivielas, kas ir diezgan specifiskas RA.
Skarto locītavu satura punkcija un morfoloģiskā analīze: palielināta duļķainība, zema sinoviālā šķidruma viskozitāte, palielināts šūnu elementu skaits, neitrofīli, reimatoīdais faktors augstā titrā, rogocīti (neitrofīli reimatoīdo saturošu imūno kompleksu fagocitozes procesā) faktors).
Ietekmēto locītavu sinoviālās membrānas biopsijas paraugu biopsija un morfoloģiskā analīze: villous hiperplāzija, nekrozes perēkļi, fibrīna nogulsnes uz sinoviālās virsmas, sinoviālo šūnu daudzslāņu proliferācija ar RA raksturīgu polisadiformu izvietojumu attiecībā pret fibrīna pārklājumiem.
Sekundārās amiloidozes diagnosticēšanai tiek veikta smaganu gļotādas un taisnās zarnas preparātu biopsija un morfoloģiskā izmeklēšana. Tiek veikts tests ar Kongo-rotyu krāsas parenterālu ievadīšanu. Tiek novērtēts tā klīrenss no organisma caur urīnceļiem. Jo vairāk krāsvielas paliek ķermenī, jo vairāk amiloido veidojas iekšējos orgānos.
Ultraskaņas izmeklēšana liecina par nieru amiloidozi, kad tiek konstatētas palielinātas, raibas nieres - "lielas tauku nieres" vai saruktas - amiloidālā nefroskleroze.
Nieru un aknu amiloidozes pārbaudi veic ar punkcijas biopsiju, kam seko biopsijas paraugu morfoloģiskais novērtējums.
Rentgena izmeklēšana izšķir 5 patoloģiskā procesa posmus skartajās locītavās: periartikulārā osteoporoze (1. pakāpe); osteoporoze, locītavu telpas sašaurināšanās, viena usūrija (II pakāpe); osteoporoze, locītavu telpas sašaurināšanās, daudzveidīga usūrija (III pakāpe); osteoporoze, locītavu telpas sašaurināšanās, daudzveidīga usūrija, ankiloze (IY pakāpe). Subhondrālās sklerozes un sānu osteofītu pazīmju noteikšana locītavās norāda uz RA kombināciju ar sekundāru osteoartrītu.
RA klīniskā diagnoze ir iespējama, ja ir kādi no šiem 4 (1., 2., 3. pozīcijas kritērijiem ir jāsaglabājas vismaz 6 nedēļas).
1. Rīta stīvums locītavās, kas ilgst vismaz 1 stundu.
2. Jebkuru trīs vai vairāk locītavu pietūkums.
3. Plaukstas, metakarpofalangeālās (izņemot īkšķa) un / vai pirkstu proksimālo starpfalangu locītavu pietūkums (izņemot mazo pirkstu).
4. Locītavu iekaisuma simetrija.
5. Tipiskas regntgenoloģiskas izmaiņas skartajās locītavās (osteoporoze, usūrija utt.).
6. Reimatoīdie mezgliņi.
7. Reimatoīdais faktors asinīs diagnostiski nozīmīgā titrā.
Ņemot vērā klīniskos un laboratoriskos parametrus, RA aktivitātes pakāpi nosaka:
0 ēd.k. (nav aktivitātes, remisija) - nav rīta stīvuma, normālu laboratorijas un bioķīmisko asins parametru;
I Art. (minimāla aktivitāte) - rīta stīvums līdz 30 minūtēm; neliela hipertermija un locītavu pietūkums; ESR līdz 20–24 mm / stundā; PSA (+); alfa-2 globulīnu mazāk nekā 12%.
II Art. (vidēja aktivitāte) - stīvums ilgst līdz pusdienlaikam, locītavu sāpes miera stāvoklī, ko pastiprina kustība; mērena hipertermija, locītavu pietūkums; leikocitoze līdz 10 * 10 9 / l; ESR no 25 līdz 40 mm / stundā; PSA (++); alfa-2-globulīni 12-15%.
III Art. (augsta aktivitāte) - stīvums visu diennakti, intensīvas, nekustīgas locītavu sāpes; stipra tūska, ādas hipertermija virs skartajām locītavām; ESR virs 40 mm / stundā; leikocitoze 12-45 mm / stundā; hipohromiska anēmija; PSA (+++); alfa-2-globulīni, kas pārsniedz 15%.
Felty sindroma diagnostikas kritēriji:
· Seropozitivitāte - reimatoīdais faktors asinīs ar augstu titru.
· Augsts drudzis.
· Smags destruktīvs poliartrīts, amiotrofija.
· Reimatoīdie mezgliņi, citas RA sistēmiskas izpausmes.
· Splenomegālija (pastāvīgs simptoms).
· Leikopēnija ar absolūtu neitropēniju, anēmija, augsta ESR.
· Neitropēnisks imūndeficīts ar tendenci uz infekcioziem iekaisuma procesiem.
Stila slimības diagnostiskie kritēriji pieaugušajiem:
Pamata -
Ø Seronegativitāte - negatīvi testi reimatoīdā faktora klātbūtnei asinīs.
Ø ilgstošs drudzis.
Ø Artrīts vai pastāvīga artralģija, bieži saistīta ar mugurkaula kakla daļu.
Ø makulopapulāri izsitumi.
Papildu -
Ø Neitrofilija.
Ø limfadenopātija.
Ø Hepatosplenomegālija.
Ø poliserozīts.
Ø tieksme uz nazofaringeālu infekcijām.
Diferenciāldiagnoze. To galvenokārt veic ar reimatismu, primāro osteoartrītu, Reitera slimību, ankilozējošo spondilītu.
Reimatisms no RA atšķiras ar īsu locītavu lēkmes ilgumu sākotnējā slimības periodā, ja to nav destruktīvas izmaiņas locītavas, ankiloze. Eksudatīvas izmaiņas, locītavu sāpes reimatisma gadījumā ātri un pilnīgi pārtrauc nesteroīdie pretiekaisuma līdzekļi. Reimatisma gadījumā priekšplānā izvirzās smagi hemodinamikas traucējumi, ko izraisa sirds defekti, kas nenotiek RA gadījumā.
Atšķirībā no RA primārā osteoartrīta gadījumā biežāk tiek ietekmēti pirkstu distālās starpfalangu locītavas, veidojoties periartikulāriem osteofītiem - Heberdena mezgliem. Atšķirībā no RA, pirmās mainās noslogotās locītavas - ceļgals, gūžas. Primārajam osteoartrītam nav raksturīga stīvums, tūska, ādas hiperēmija virs skartās locītavas un drudzis. Iekaisuma procesa aktivitātei praktiski nav laboratorijas un bioķīmisko pazīmju. Asinīs un sinoviālajā šķidrumā nav reimatoīdā faktora. Radiogrāfiski noteikta subhondrālā skleroze, osteofīti, kas nav RA gadījumā. Diferenciāldiagnozes grūtības var rasties pacientiem ar RA, ko sarežģī sekundārs osteoartrīts. Šādos gadījumos RA un osteoartrīta simptomi summējas.
Reitera slimību raksturo artrīta kombinācija ar hronisku hlamīdiju uretrītu, konjunktivītu, dažreiz kopā ar keratodermītu. Atšķirībā no RA, Reitera slimība locītavas ietekmē asimetriski. apakšējās ekstremitātes- pirmā pirksta, potītes, ceļa metakarpofalangeālā locītava. Iespējams plantārais fascīts, Ahileja cīpslas sakāve, sacroiliitis. Simetriski RA mazo roku mazo locītavu destruktīvie bojājumi nenotiek. Reimatoīdais faktors asinīs netiek atklāts.
Bechterevas slimība vai ankilozējošais spondilartrīts tipiskos gadījumos no RA atšķiras ar dominējošu mugurkaula locītavu bojājumu. Slimība sākas ar sacroiliītu un tālāk izplatās "uz augšu" līdz mugurkaula kakla daļai. Ankiloze pārvērš mugurkaulu par "bambusa nūju", kas nespēj ne mazākās lieces. Pacientiem ir raksturīga "lūdzēja" poza ar saliektu muguru un noliektu galvu. Ankilozējošā spondilīta perifēra forma var sākties ar potītes, ceļa, gūžas locītavas iekaisumu, kas RA gadījumā ir reti sastopams.
Apsekojuma plāns.
· Vispārēja asins analīze.
· Bioķīmiskais asins tests: fibrinogēns, fibrīns, haptoglobīni, seromukoīds, alfa-2-globulīns, SRP, dzelzs serums.
· Imunoloģiskā analīze: reimatoīdais faktors, cirkulējošie imūnkompleksi, krioglobulīni, anti-keratīna antivielas.
· Locītavu rentgens.
· Skartās locītavas punkcija, kam seko punkcijas morfoloģiskā analīze.
· Skartās locītavas sinoviālās membrānas biopsija, biopsijas morfoloģiskā analīze.
· Nieru, aknu ultraskaņas izmeklēšana.
· Ehokardiogrāfiskā izmeklēšana.
Ārstēšana. Pamata terapija ietver individuāli izvēlētas ārstēšanas fona lietošanu ar nesteroīdiem pretiekaisuma līdzekļiem (NPL), zelta preparātiem, imūnsupresantiem, D-penicilamīnu (cuprenilu), sulfanilamīda pretiekaisuma un aminohinolīna līdzekļiem.
Tiek piemēroti šādi NPL:
· Ariletiķskābes atvasinājumi.
Ø diklofenaka nātrijs (ortofēns) 0,025-0,05 - 3 reizes dienā iekšķīgi.
· Arilpropionskābes atvasinājumi.
Ø Ibuprofēns 0,8 - 3-4 reizes dienā iekšķīgi.
Ø Naproksēns 0,5-0,75 2 reizes dienā iekšķīgi.
· Indoletiķskābes atvasinājumi.
Ø Indometacīns 0,025-0,05 - 3 reizes dienā iekšķīgi.
· Pacientiem ar kuņģa un divpadsmitpirkstu zarnas erozīviem un čūlas bojājumiem tiek izmantoti nesteroīdie pretiekaisuma līdzekļi, kuriem ir selektīva COX-2 bloķējoša iedarbība.
Ø Nimesulīds 0,1 - 2 reizes dienā iekšķīgi.
Ar seropozitīvu RA tiek norādīti zelta preparāti. Krīzes terapijas efekts rodas ne agrāk kā pēc 6-8 nedēļām. Piesakies:
· Hrizanols - izmēģinājuma deva 17 mg, terapeitiskā deva 34 mg vienu reizi nedēļā, uzturošā deva 34 mg reizi 2-3 nedēļās. Ievada intramuskulāri.
· Tauredon - intramuskulāri 2 reizes nedēļā. Katrā no pirmajām 3 injekcijām injicē 10 mg, 4-6 injekcijas - 20 mg, pēc tam 50 mg. Pēc remisijas sasniegšanas viņi pāriet uz uzturošo terapiju - 50 mg vienu reizi nedēļā.
· Auranofīns - 6 mg dienā. Dienas devu lieto iekšķīgi 1-2 devās ēšanas laikā.
Imūnsupresanti tiek nozīmēti mērenai un augstai RA aktivitātei, sistēmiskām slimības izpausmēm 3-6 mēnešu laikā. Imūnsupresīvas terapijas efekts ir sagaidāms pēc 3-4 ārstēšanas nedēļām. Zāles lieto iekšķīgi:
· Metotreksāts - 7,5-15 mg nedēļā.
Azatioprīns - 50-150 mg dienā.
Ciklofosfamīds - 100-150 mg dienā.
D-penicilamīnu (cuprenilu) lieto pacientiem ar seropozitīvu RA, smagām sistēmiskām slimības izpausmēm. Tas ir īpaši paredzēts pacientiem ar reimatoīdo plaušu slimību, ar Felty sindromu.
· Cuprenil - 0,25-0,75 dienā 6-9 mēnešus. Pirmās 8 nedēļas dod maksimālo panesamo devu. Ja 4 mēnešu laikā efekta nav, zāles tiek atceltas.
Sulfanilamīda pretiekaisuma līdzekļus RA pacientiem lieto bez sistēmiskām izpausmēm. Ārstēšanas ilgums ir 4-6 mēneši.
· Sulfasalazīns - pirmā nedēļa, iekšķīgi lietojot 1,0 g dienā, otrā - 1,5 g dienā, no trešās nedēļas - 2,0 g dienā.
· Salazopiridazīns -. pirmajā nedēļā iekšķīgi lietojot 1,0 g dienā, otrajā - 1,5 g dienā, no trešās nedēļas - 2,0 g dienā.
Aminohinolīna zāles ieteicams izrakstīt ar mērenu un minimālu RA aktivitāti. To lietošanas ietekme ir iespējama pēc 6-12 mēnešiem ilgstošas ārstēšanas.
· Delagil 0,25 dienā iekšķīgi.
Postholecistektomijas sindroms (PCES) ir patoloģija, kas izriet no holecistektomijas - ķirurģiskas žultspūšļa noņemšanas. Tas ir klīnisko pazīmju kopums žults izdalīšanās sistēmas disfunkcijas dēļ: Oddi sfinktera kontraktilitātes izmaiņas, aizkuņģa dziedzera sulas un žults plūsmas grūtības zarnās.
Žultspūslis ir dobs orgāns vai rezervuārs, kurā uzkrājas un koncentrējas hepatocītu radītais žults. Periodiski urīnpūslis saraujas, žults caur kanāliem izdalās divpadsmitpirkstu zarnā, kur tā ir iesaistīta gremošanas procesā. Daži žults komponenti uzsūcas caur urīnpūšļa sienām atpakaļ asinīs, un tā šūnas izdala vairākas gremošanai svarīgas vielas. Kad žultspūslis tiek noņemts, ķermenis sāk pielāgoties un atjauno visu gremošanas sistēmu. Ja kāda iemesla dēļ tiek samazinātas ķermeņa adaptācijas spējas, attīstās postholecistektomijas sindroms. Vīriešiem patoloģija notiek uz pusi biežāk nekā sievietēm. Slimībai nav skaidri noteikts vecuma vai dzimuma diapazons. Bērniem tas notiek ārkārtīgi reti.

PCES izpaužas ar paroksizmālām sāpēm labajā hipohondrijā, dispepsiju, izkārnījumu traucējumiem, hipovitaminozes pazīmēm, svara zudumu. Katrs ceturtais pacients, kuram veikta holecistektomija, uzrāda līdzīgas sūdzības... Patoloģijas diagnostika balstās uz vēdera dobuma ultraskaņas, EGD, CT datiem. Ārstēšana sastāv no saudzīgas diētas ievērošanas, spazmolītisko un fermentu preparātu lietošanas. Smagos gadījumos tiek veikta operācija.
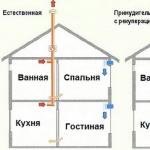
Postholecistektomijas sindromam ir cits nosaukums - Oddi disfunkcijas sfinkteris. Parasti, pateicoties ritmiskai muskuļu šķiedru kontrakcijai, žults savlaicīgi un vienādās daļās nonāk zarnās, kur tas izpilda savu mērķi. Oddi sfinktera saraušanās aktivitātes pārkāpuma gadījumā attīstās PCES.
Slimībai ir kods saskaņā ar ICD-10 K 91.5 un nosaukums "Postcholecystectomy syndrome".
Etioloģija
PCES etiopatoģenētiskais pamats pašlaik nav pilnībā izprasts. Galvenais slimības izraisītājs ir žults sistēmas disfunkcija, kas izpaužas kā parastās žults plūsmas pārkāpums.

Faktori, kas veicina PCES attīstību:
- Izmaiņas žults sastāvā, tendence uz akmeņu veidošanos;
- Žults hipersekrēcija ar hepatocītiem;
- Žults stagnācija divpadsmitpirkstu zarnā iekaisuma vai gastroezofageālā refluksa slimības dēļ;
- Oddi sfinktera spazmas;
- Kopējā žults ceļu striktūra;
- Zarnu disbioze;
- Vēlīna holecistektomija;
- Nepietiekama un savlaicīga pirmsoperācijas diagnostika;
- Nepilnīgs operācijas apjoms;
- Ķirurga operācijas kļūdas;
- Patoloģiskais process kanāla celmā;
- Adhēzijas vēdera dobumā
- Infekcija.
Slimības, kas veicina PCES attīstību:
- pankreatīts,
- iekaisums dažādās nodaļās zarnas,
- refluksa ezofagīts,
- divertikulīts;
- papilīts;
- kopēja žults ceļu cista;
- žults ceļu fistulas;
- zarnu aizsprostojums;
- taukainas aknas.
Pēc holecistektomijas žultspūšļa funkcija izkrīt. Iekļautas vairākas kompensējošas reakcijas. Ja šādi mehānismi neizdodas, PCES attīstās.
PCES patoģenētiskās saites:
- Holecistektomija,
- Hroniskas divpadsmitpirkstu zarnas obstrukcijas attīstība,
- Hipertensija divpadsmitpirkstu zarnā,
- Divpadsmitpirkstu zarnas un gastroezofageālā reflukss,
- Žults stagnācija
- Zarnu baktēriju piesārņojums,
- Hipertensijas pasliktināšanās
- Asimhronisms timiāna, žults un aizkuņģa dziedzera sulas plūsmai zarnās,
- Sekundāras aizkuņģa dziedzera mazspējas attīstība.
Simptomi

Pacientiem ar PCES rodas tādi paši simptomi kā pirms operācijas. Patoloģijas klīniskās pazīmes ir plašas un mainīgas.
- Galvenais slimības simptoms ir dažādas intensitātes griešanas sāpes. Krampji stipras sāpes var ilgt 20 minūtes un atkārtot 3 mēnešus. Atkarībā no lokalizācijas tas atgādina sāpes ar žultsakmeņu slimību, pankreatītu vai vienlaikus ar abām slimībām. Sāpīgas sajūtas rodas pēc ēšanas un bieži parādās naktī.
- Dispeptiskais sindroms izpaužas kā slikta dūša, vemšana, vēdera uzpūšanās, rīboņa vēderā, atraugas, sausa un rūgta mute, grēmas, nepatīkamas sajūtas pēc taukainas pārtikas ēšanas, caurejas, tauku parādīšanās izkārnījumos.
- Pakāpeniski pacientiem malabsorbcijas dēļ rodas malabsorbcijas sindroms barības vielas zarnās. Pacienti dramatiski zaudē svaru līdz galējam izsīkumam, viņiem rodas stomatīts, heilīts un citas hipovitaminozes pazīmes. Šajā periodā sāk dominēt vispārējās ķermeņa astenizācijas simptomi. Pacienti piedzīvo smagu nespēku, nogurumu, viņu darbaspējas strauji samazinās, parādās miegainība, apātija, apetīte un interese par notikumiem. Izkārnījumi kļūst ūdeņaini vai mīksti, aizskaroši un ļoti bieži.
- Dažiem pacientiem ir drudzis, drebuļi, hiperhidroze, tahikardija.
- Dzelte ar ādas dzeltenumu, sklēras injekcija, ādas nieze.
- Neiroloģiski traucējumi - sāpju sindroms, piemēram, neiralģija trijzaru nervs, starpribu neiralģija, muguras sāpes.
- Psihoemocionālie traucējumi - iekšēja spriedze, trauksmes un baiļu sajūta, aizkaitināmība vai emocionāla labilitāte.
Pastāv klīniski asimptomātisks variants, kurā pacientiem nav sūdzību, bet laboratorijas asins analīžu rezultātos ir raksturīgas izmaiņas.
PCES komplikācijas:
- valdziņu novirze pēc operācijas,
- sekundāras bakteriālas infekcijas pievienošanās,
- abscesa audu veidošanās,
- agrīna aterosklerozes attīstība,
- anēmija,
- kaheksija,
- skeleta deformācija,
- avitaminoze,
- impotence.
Diagnostika
PCES diagnostika sākas ar pacienta sūdzību uzklausīšanu un slimības anamnēzes apkopošanu. Ir jānoskaidro, cik ilgi pēc holecistektomijas parādījās pirmie simptomi? Kad operācija tika veikta?

Speciālisti analizē ģimenes vēsturi un uzzina, kādas kuņģa un zarnu trakta slimības ir pacienta radinieki.
- Fiziskās pārbaudes metodes ietver pacienta intervēšanu un pārbaudi, kā arī vēdera orgānu palpāciju.
- Vispārējā klīniskajā asins analīzē - eritrocītu, hemoglobīna skaita samazināšanās, leikocītu un ESR palielināšanās.
- Bioķīmiskais asins tests - kopējā bilirubīna, tā frakciju, ALAT, ASAT, ALP, glikozes līmeņa asinīs, amilāzes noteikšana asinīs.
- Coprogram - izkārnījumu analīze par nesagremotu pārtikas fragmentu, tauku, rupju uztura šķiedrvielu klātbūtni.
- Pēc indikācijām tiek veikti žults mikroskopiskie, bakterioloģiskie un bioķīmiskie pētījumi.
- CT un MRI ļauj vizualizēt vēdera dobuma traukus un orgānus.
- Vēdera dobuma ultraskaņa atklāj akmeņus žultsvados, to iekaisumu, izplešanos un deformāciju.
- Papildu metodes ietver plaušu rentgenstaru, kas tiek veikts, lai izslēgtu pneimoniju un mediastītu.
- Kuņģa rentgena kontrasta pārbaude nosaka čūlu klātbūtni.
- Lai izslēgtu citas gremošanas sistēmas patoloģijas, tiek veikta gastroskopija un EGD.
- Scintigrāfija ļauj identificēt žults aprites pārkāpumus.
- Elektrokardiogrāfija.
- Transabdomināla ultrasonogrāfija.
- Daudzfunkcionāla divpadsmitpirkstu zarnas skanēšana.
- Holegrāfija.
- Oddi manometrijas sfinkteris.
- Holangiopankreatogrāfija.
Ārstēšana
Pacientu ar PCES ārstēšana ir sarežģīta. Tas ir vērsts uz esošo gremošanas sistēmas traucējumu novēršanu, kas pacientam piespieda apmeklēt ārstu. Patoloģijas ārstēšana sastāv no stingras diētas ievērošanas, konservatīvas terapijas un, ja tā ir neefektīva, operācijas.
Diētas terapija
 Pacientiem jāievēro diēta: ēdiens jāņem nelielās porcijās 5-6 reizes dienā, jāierobežo tauku daudzums un no uztura pilnībā jāizslēdz cepti, skābi, pikanti, pikanti ēdieni. alkoholiskie dzērieni... Uzturs jāpapildina ar A un B vitamīniem, kā arī ar šķiedrvielām, šķiedrvielām un pektīniem.
Pacientiem jāievēro diēta: ēdiens jāņem nelielās porcijās 5-6 reizes dienā, jāierobežo tauku daudzums un no uztura pilnībā jāizslēdz cepti, skābi, pikanti, pikanti ēdieni. alkoholiskie dzērieni... Uzturs jāpapildina ar A un B vitamīniem, kā arī ar šķiedrvielām, šķiedrvielām un pektīniem.
Atļautie produkti ir kompoti, augļu dzērieni, žāvēta maize, piena produkti ar zemu tauku saturu, dārzeņu zupas, liesa liellopa gaļa, vistas gaļa, berami graudaugi, augļu un dārzeņu salāti, zaļumi, pupas. Aizliegts: ceptas preces, bekons, cūkgaļa, treknas zivis, garšvielas, stipra tēja un kafija, alkoholiskie dzērieni, pusfabrikāti, kūpināta gaļa, marinādes.
Video: par uzturu pēc žultspūšļa noņemšanas
Narkotiku terapija

Fizioterapija
Lai stimulētu reparatīvos un reģeneratīvos procesus, pacientiem ar PCES tiek nozīmētas šādas fizioterapeitiskās procedūras:
- Ultraskaņa žultspūšļa zonā katru otro dienu,
- Magnetoterapija,
- Lāzerterapija,
- Radona vannas.
- Ampulsu terapija,
- Pretsāpju un spazmolītisko līdzekļu elektroforēze,
- Cinkošana,
- Parafīna terapija,
- Ozokerīta lietojumi.
Fizioterapija ir kontrindicēta personām, kuras cieš no akūta holangīta, aknu cirozes ar ascītu, akūtas aknu distrofijas.
Tiek parādīti visi pacienti Spa procedūra sešus mēnešus pēc operācijas un regulāras nodarbības Vingrojumu terapija.
etnozinātne
Līdzekļi tradicionālā medicīna pacientu stāvokļa uzlabošana pēc holecistektomijas:

- kliņģerīšu ziedu, baldriāna saknes, apiņu rogas,
- kentaura, putnu kalnāju, kalmes saknes, strutenes, kukurūzas zīda tinktūra,
- asinszāles, kumelīšu, elecampane,
- choleretic kolekcija kliņģerīšu, piparmētru, biškrēsliņu, kumelīšu, pelašķu,
- mežrozīšu tēja.
Šie līdzekļi atvieglo stāvokli ar PCES, novērš žults stagnāciju, nodrošina choleretic efektu un atvieglo iekaisumu. Ārstēšanai ar tautas līdzekļiem jānotiek tikai kombinācijā ar galveno terapiju.
Pieņemt tautas līdzekļi seko mēneša laikā pusstundu pirms ēšanas vai stundu pēc tās. Lai izvairītos no atkarības, dzērieni jāmaina pārmaiņus.
Operatīva ārstēšana
Operācija tiek veikta gadījumos, kad konservatīvās metodes kļūst neefektīvas.
Lai novērstu pastāvīgo Oddi sfinktera spazmu, tiek veiktas dažādas manipulācijas:
- izgriez to vaļā,
- injicēt botulīna toksīnu,
- paplašināties ar balonu,
- uzstādiet stentu,
- noņem rupjas rētas.
Profilakse

- pilnīga un savlaicīga pacienta pārbaude pirms operācijas,
- savlaicīga identifikācija blakus slimības,
- cīņa pret sliktiem ieradumiem,
- pareiza uztura ierobežošana ar taukainu pārtiku,
- regulāras 4-6 ēdienreizes dienā,
- uztura bagātināšana ar uztura šķiedrvielām,
- vitamīnu un minerālu kompleksu lietošana,
- ķermeņa svara normalizēšana,
- aktīvs dzīvesveids,
- aizcietējumu novēršana,
- regulāra gastroenterologa novērošana pēc operācijas.
PCES ir patoloģija, ko izraisa funkcionāla vai organiska rakstura gremošanas traucējumi. Slimības simptomatoloģija ir daudzveidīga un nespecifiska. Funkcionālie traucējumi tiek ārstēti konservatīvi, bet organiskie traucējumi - operatīvi.
Video: par pareizu rehabilitāciju un pēc holecistektomijas
Video: lekcijas par postholicistektomijas sindromu
K40-K46 trūce
K50-K52 Neinfekciozs enterīts un kolīts
K55-K64 Citas zarnu slimības
K65-K67 vēderplēves slimības
K70-K77 Aknu slimības
K80-K87 Žultspūšļa, žults ceļu un aizkuņģa dziedzera slimības
K90-K93 Citas gremošanas sistēmas slimības
K80-K87 Žultspūšļa, žults ceļu un aizkuņģa dziedzera slimības
K80 Holelitiāze [holelitiāze]K81.0 Akūts holecistīts
Bez akmeņiem:K81.1 Hronisks holecistītsžultspūšļa abscess
angioholecistīts
holecistīts:žultspūšļa empīēma
- emfizematozs (akūts)
- gangrēns
- strutojošs
žultspūšļa gangrēna
K81.8 Cits holecistīts
K81.9 Holecistīts, nenoteikts
K82 Citi žultspūšļa traucējumi
Izslēgts:
žultspūšļa kontrasta trūkums rentgenogrammā (R93.2)K82.0 Žultspūšļa aizsprostojums
K91.5)
Cistiskais kanāls vai žultspūslis bez akmeņiem:Izslēgts: kopā ar holelitiāzi ()oklūzija
stenoze
sašaurināšanās
K82.1 Žultspūšļa piliens
Žultspūšļa mukoceleK82.2 Žultspūšļa perforācija
Cistiskā kanāla vai žultspūšļa pārrāvumsK82.3 Žultspūšļa fistula
Fistula:K82.4 Žultspūšļa holesterozeveziko-resnās zarnas
holecistoduodenāls
Žultspūšļa gļotāda, kas atgādina avenes ["aveņu" žultspūslis]K82.8 Citi specifiski žultspūšļa traucējumi
Cistiskais kanāls vai žultspūslis:K82.9 Nav precizēta žultspūšļa slimībasaķeres
atrofija
cista
diskinēzija
hipertrofija
funkciju trūkums
čūla
K83 Citas žults ceļu slimības
Izslēgts:
uzskaitītie nosacījumi, kas saistīti ar postholecistektomijas sindroms (K91.5)K83.0 Holangīts
HolangītsIzslēgts: holangīta aknu abscess (K75.0)
- augšupejošs
- primārs
- atkārtojas
- sklerozēšana
- sekundārs
- stenozēšana
- strutojošs
holangīts ar holedoholitiāzi ()
hronisks nesaturošs destruktīvs holangīts (K74.3)
K83.1 Žultsvada aizsprostojums
Žultsvads bez akmeņiem:Izslēgts: ar holelitiāzi ()
- oklūzija
- stenoze
- sašaurināšanās
K83.2 Žultsvada perforācija
Plīsis žultsvadsK83.3 Žultsvada fistula
Holedokoduodenālā fistulaK83.4 Oddi sfinktera spazmas
K83.5 Žults cista
K83.8 Citas noteiktas žults ceļu slimības
Žultsvads:K83.9 Neprecizēta žults ceļu slimība
- saķeres
- atrofija
- hipertrofija
K85 Akūts pankreatīts
Iekļauts: Aizkuņģa dziedzera abscess
Aizkuņģa dziedzera nekroze:
Pankreatīts:
K85.0 Idiopātisks akūts pankreatīts
- akūta (atkārtota)
- hemorāģisks
- subakūts
- strutojošs
K85.1 Akūts žultsceļu pankreatīts
Žultsakmeņu pankreatītsK85.2 Akūts pankreatītsalkohola etioloģija
K85.3 Ārstniecisks akūts pankreatīts
Ja nepieciešams identificēt narkotiku, kas izraisīja pārkāpumu, izmantojiet papildu kodu ārējie cēloņi(XX klase)K85.8 Cits akūts pankreatīts
K85.9 Neprecizēts akūts pankreatīts
K86 Citas aizkuņģa dziedzera slimības
Izslēdza: K86.0 Hronisks alkoholisko etioloģiju pankreatīts
K86.1 Cits hronisks pankreatīts
Hronisks pankreatīts:K86.2 Aizkuņģa dziedzera cista
- infekciozs
- atkārtojas
- atkārtojas
K86.3 Aizkuņģa dziedzera pseidocista
K86.8 Citas noteiktas aizkuņģa dziedzera slimības
Aizkuņģa dziedzeris:K86.9 Neprecizēta aizkuņģa dziedzera slimībaatrofijaAizkuņģa dziedzeris:
akmeņi
ciroze
fibroze
- izstrādes stadijā
- nekroze:
- aseptisks
- trekns
K87 * Žultspūšļa, žults ceļu un aizkuņģa dziedzera traucējumi citur klasificētās slimībās
K87.0 * Žultspūšļa un žults ceļu traucējumi citur klasificētu slimību gadījumā
K87.1 * Aizkuņģa dziedzera traucējumi citur klasificētās slimībās
Citomegalovīrusa pankreatīts (B25.2 †)Piezīmes. 1. Šī versija atbilst PVO 2016. gada versijai (ICD-10 Version: 2016), kuras dažas nostājas var atšķirties no Krievijas Veselības ministrijas apstiprinātās ICD-10 versijas.
Pankreatīts ar epidēmisku parotītu (B26.3 †)
2. Šajā rakstā dažu terminu tulkojums krievu valodā var atšķirties no Krievijas Veselības ministrijas apstiprinātā ICD-10. Visi komentāri un skaidrojumi par tulkošanu, dizainu utt. Tiek pieņemti ar pateicību pa e-pastu.
3. NOS - nav papildu paskaidrojumu.
4. Krusts † iezīmē galvenos slimības galvenos kodus, kuri jāizmanto bez kļūdām.
5. Zvaigznīte apzīmē izvēles papildu kodus, kas saistīti ar slimības izpausmi atsevišķā orgānā vai ķermeņa zonā, kas ir neatkarīga klīniska problēma.
Izdevums: 2008. gada decembris
A.A. Ilčenko
Centrālais gastroenteroloģijas pētījumu institūts, Maskava
Žultsakmeņu slimības (GSD) diagnostika izveidoto žultsakmeņu stadijā ir cēlonis lielai šīs slimības operatīvai aktivitātei. Neskatoties uz to, ka klīniskajā praksē tiek ieviestas tehnoloģijas, kas ir mazāk invazīvas nekā dobuma holecistektomija, dažiem pacientiem rodas tā sauktie postholecistektomijas traucējumi, kurus dēvē par postholecistektomijas sindromu (PCES).
Neskatoties uz to, ka PCES ir iekļauta mūsdienu slimību klasifikācijā ICD-10 (kods K.91.5), joprojām nav precīzas izpratnes par šī sindroma būtību.
Saskaņā ar Romas konsensu par gremošanas sistēmas funkcionālajiem traucējumiem 1999. gadā terminu "postholecistektomijas sindroms" parasti lieto, lai apzīmētu Oddi sfinktera disfunkciju, ko izraisa tā saraušanās funkcija novēršot normālu žults un aizkuņģa dziedzera sekrēcijas aizplūšanu uz divpadsmitpirkstu zarnas ja nav organisku šķēršļu. Šādai interpretācijai varētu piekrist, ja starp žults sistēmu un citiem gremošanas orgāniem nebūtu ciešas anatomiskas un funkcionālas attiecības. Žultspūšļa noņemšana ir ārkārtīgi piespiedu pasākums, un žultspūšļa patoloģija, kas noveda pie holecistektomijas, parasti attīstās ilgu laiku un gandrīz vienmēr ir saistīta ar citu gremošanas orgānu, galvenokārt pankreatoduodenālās zonas, patoloģiju. Tāpēc ir grūti iedomāties, ka žultspūšļa zudums neietekmēs pirms operācijas izveidojušos patoloģisko procesu gaitu.
Pamatojoties uz to, no praktiskā viedokļa PCES ieteicams ņemt vērā, ņemot vērā visu patoloģisko stāvokļu kompleksu, kas saistīts ar ilgstošu holelitiāzi. Šajā sakarā var izdalīt šādas galvenās PCES attīstības iemeslu grupas:
1. Pirms operācijas un / vai operācijas laikā pieļautās diagnostikas kļūdas, kas saistītas ar žults sistēmu saistītās patoloģijas identificēšanu.
2. Operācijas laikā pieļautās tehniskās kļūdas un taktiskās kļūdas.
3. Funkcionālie traucējumi, kas attīstījās pēc žultspūšļa noņemšanas vai ko pastiprināja holecistektomija.
4. Pirms operācijas pastāvējušo hepatopankreatoduodenālās zonas slimību saasināšanās un / vai progresēšana.
Pirmā grupa
Žults ceļu funkcionālie traucējumi ir neaizstājams holelitiāzes atribūts, nodrošinot tā veidošanos un progresēšanu. Žultsakmeņu slimības gadījumā vissvarīgākie ir pārkāpumi Lutkensa sfinktera un Oddi sfinktera koordinētajā darbā. Tāpēc žultsceļu disfunkciju diagnostika un to korekcija pirms operācijas veicina ātrāku ķermeņa pielāgošanos žultspūšļa funkciju zudumam. Funkcionālo traucējumu nenovērtēšana pirmsoperācijas stadijā agrīnā pēcoperācijas periodā var izpausties dažādos Oddi sfinktera disfunkciju variantos (žults, aizkuņģa dziedzera vai jaukta tipa).
Strukturālās izmaiņas žults traktā parasti attēlo kopēja žultsvada gala sekcijas stenoze vai stenozējošs papilīts, kas veidojas gļotādas un tieši sfinktera aparāta traumas rezultātā, migrējot mikrolītus vai mazus akmeņus. Šo un citu izmaiņu (holangīta, holedoholitiāzes un citu) identificēšana pirms operācijas ir īpaši svarīga, jo tā nosaka ne tikai klīniskie simptomi, bet arī taktika, kā vadīt pacientu, kas gatavojas holecistektomijai.
Ķirurģiskā iejaukšanās ir pēdējais diagnostikas posms, tāpēc pēc iespējas pilnīgāk jānoskaidro patoloģisko izmaiņu raksturs operācijas laikā, izmantojot mūsdienīgas intraoperatīvās diagnostikas metodes - intraoperatīvo holangiogrāfiju, tiešo holangioskopiju un pēdējos gados intraoperatīvo sonogrāfiju. Šādu diagnostikas kļūdu rezultātā patoloģiskas izmaiņas kopējā žults ceļā paliek neatzītas. Tā, piemēram, nepietiekams žultsvadu izpēte bez rentgena monitoringa par to stāvokli noved pie tā, ka pusē gadījumu akmeņi kanālu sistēmā paliek nepamanīti.
Otrā grupa
Šī kļūdu grupa ir galvenais cēlonis tā sauktā "patiesā postholecistektomijas sindroma" veidošanai un atkārtotām žults ceļu operācijām, un tās ir sīki aprakstītas operācijas praktiskajās vadlīnijās.
Trešā grupa
Pēc holecistektomijas attīstās Oddi sfinktera hipertoniskums, un pirmajā mēnesī pēc operācijas šī patoloģija tiek novērota 85,7% pacientu. Oddi sfinktera hipertoniskumu klīniski papildina žultsceļu hipertensija, holestāze, sāpes labajā hipohondrijā un dažos gadījumos attīstās žults pankreatīta saasināšanās klīnika.
Oddi sfinktera hipertoniskuma attīstības mehānisms ir saistīts ar Lutkens un Sfinktera sfinktera regulatīvās lomas izslēgšanu. muskuļu aktivitātežultspūšļa, jo Oddi sfinktera tonuss refleksīvi samazinās žultspūšļa kontrakcijas laikā, kas nodrošina visu žults ceļu sfinktera aparāta koordinētu darbību. Eksperimentāli tika konstatēta Oddi sfinktera reakcijas samazināšanās, reaģējot uz holecistokinīnu pēc holecistektomijas. Oddi sfinktera disfunkcija hipertoniskuma formā pēc holecistektomijas parasti ir īslaicīga un parasti izpaužas pirmajos mēnešos pēc operācijas. Oddi sfinktera motora disfunkcija ir viens no akūtu vai hronisku vēdera sāpju un dispepsijas sindroma veidošanās cēloņiem pēcoperācijas periodā. Jāatzīmē, ka dzīves kvalitāte pēc holecistektomijas pacientiem ar samazinātu žultspūšļa saraušanās funkciju pirms operācijas ir labāka nekā ar konservētām vai paaugstinātām. Piemēram, ir zināms, ka pacientiem ar tā sauktajiem invalīdiem žultspūšļa, gan pirms, gan pēc operācijas reti tiek novērota kopējā žultsvada paplašināšanās. Pakāpeniska adaptācija noved pie tā, ka šādiem pacientiem PCES attīstās reti.
Ceturtā grupa
Pēc žultspūšļa noņemšanas hroniska žultsceļu nepietiekamība, kas pavada holelitiāzi, saglabājas. Turklāt šīs izmaiņas tiek konstatētas 100% pacientu pirmajās 10 dienās pēc operācijas un 81,2% pacientu ilgstoši neizzūd pēc holecistektomijas. Jāatzīmē, ka hroniska žults mazspēja tiek noteikta jau sākotnējā holelitiāzes stadijā. Tātad, pēc O.V. Delyukina, pacientiem ar žultsceļu nogulsnēm hiperohoisko daļiņu suspensijas veidā, to atklāja 91,7%, ar vieglu - 50% un mērenu - 41,7%.
Žultsskābju deficīts pēc holecistektomijas zināmā mērā tiek papildināts, paātrinot to enterohepātisko apriti. Tomēr ievērojamu enterohepatiskās cirkulācijas paātrinājumu papildina žultsskābju sintēzes nomākšana, kas noved pie tā galveno sastāvdaļu proporcijas nelīdzsvarotības un žults solubilizējošo īpašību pārkāpuma.
Žultspūšļa noņemšanu papildina žults veidošanās un žults sekrēcijas procesu pārstrukturēšana. Pēc R.A. Ivanchenkova, pēc holecistektomijas, holerēze palielinās gan no skābes, gan no skābes neatkarīgu frakciju dēļ. Žults sekrēcijas palielināšanās notiek 2 nedēļu laikā pēc holecistektomijas. Paaugstināta holēze ir galvenais aukstās caurejas cēlonis pēc holecistektomijas.
Starp hepatopankreatoduodenālās zonas orgāniem žultspūšļa noņemšana visvairāk ietekmē aizkuņģa dziedzera darbību. Hroniska žults etioloģijas pankreatīta attīstību veicina bieži sastopami funkcionāli traucējumi (žults ceļu sfinktera aparāta disfunkcija) vai kanālu sistēmas organiskas slimības, kas traucē žults pāreju (sašaurināšanās, saspiešana ar cistu vai palielinātu limfmezglu, akmeņi, kas lokalizēti kopējā žultsvada gala daļā, iekaisuma procesi, īpaši ar lokalizāciju tā distālajās daļās utt.). Šajā sakarā hroniska pankreatīta saasināšanās pacientiem, kuriem tika veikta holecistektomija, notiek diezgan bieži. Pēc V.A. Zorina u.c. , kurš pacientus pārbaudīja 4-10 dienas pēc holecistektomijas, 85% pacientu palielinājās seruma b1-antitripsīna saturs, un 34,7% gadījumu rādītāji pārsniedza normu vairāk nekā 2 reizes.
Hronisks gastrīts ir visbiežāk sastopamā gremošanas sistēmas patoloģija. Tiek uzskatīts, ka tā loma postholecistektomijas sindroma veidošanā ir maza, un to galvenokārt nosaka funkcionālie traucējumi. Hronisks gastrīts bieži ir saistīts ar Helicobacter pylori (HP). Šajā sakarā tiek apspriests jautājums par anti-Helicobacter pylori terapijas nepieciešamību pacientiem, kuriem jāveic holecistektomija. Uzkrātā pieredze, ka anti-Helicobacter pylori terapija, kas veikta, piemēram, pirms kuņģa rezekcijas, ievērojami samazina pēcoperācijas komplikāciju skaitu, pārliecina to pašu nepieciešamību saistībā ar gaidāmo holecistektomiju.
Nepieciešamību pēc anti-Helicobacter pylori terapijas pārliecina arī jaunākie pētījumi, kas norāda uz iespējamu saistību starp Helicobacter pylori infekciju ar žults ceļu patoloģiju un jo īpaši ar hepatobiliāru vēzi. Pēc F. Fukudas u.c. , kurš pārbaudīja 19 pacientus ar aknu un žultsceļu vēzi un 19 pacientus ar labdabīgām aknu un žultsceļu sistēmas slimībām, izmantojot PCR, žults paraugos atklāja H. pylori DNS attiecīgi 52,6% un 15,7% gadījumu. Tika iegūti pirmie pierādījumi par HP klātbūtni žultspūšļa žults un gļotādās cilvēkiem, kā arī dati no eksperimentāliem pētījumiem ar dzīvniekiem, kas apstiprināja enterohepātisko helikobaktēriju (H. bilis, H. hepaticus, H. rodentium) lomu. žults ceļu litoģenēzē. Jautājuma par Helicobacter pylori lomu žults patoloģiju etioloģijā atrisināšana var ievērojami mainīt pieeju pacientu ar žults ceļu trakta ārstēšanai, tostarp postholecistektomijas sindroma novēršanas jautājumu.
Hronisks duodenīts un baktēriju aizaugšanas sindroms (SIBO). Holecistektomiju papildina žults baktericīdo īpašību samazināšanās, kas noved pie baktēriju aizaugšanas divpadsmitpirkstu zarnā. To veicina kuņģa barjeras funkcijas samazināšanās sālsskābes hiposekrēcijas dēļ. Hroniska žults mazspēja, žults baktericīdo īpašību samazināšanās un pievienotā SIBO izraisa ievērojamu gremošanas traucējumus, kas izraisa atbilstošo simptomu attīstību un prasa zāļu korekciju.
Tādējādi, analizējot ar holecistektomiju saistīto patoloģisko procesu būtību, var sniegt šādu postholecistektomijas sindroma definīciju: PCES ir funkcionālu un / vai organisku izmaiņu kopums, kas saistīts ar žultspūšļa vai kanālu sistēmas patoloģiju, ko pastiprina holecistektomija vai attīstīta tehnisku kļūdu rezultātā tās īstenošanā.
Šāda definīcija novirza ārstu uz rūpīgāku pacientu pārbaudi pirms operācijas, lai identificētu dažādas vienlaicīgas gan gremošanas sistēmas, gan citu orgānu un sistēmu patoloģijas, ļauj izprast patoģenētisko saistību starp operāciju un attīstītajiem klīniskajiem simptomiem pēc to.
Klīnisko simptomu analīze ļāva identificēt šādus PCES kursa variantus:
Dispeptiskais variants - ar dispepsijas simptomiem nelabuma formā, rūgtuma sajūtu mutē un neizteiktu sāpju sindromu;
sāpju iespēja - ar dažāda smaguma sāpju sindromu;
ikteriskais variants - periodiski ādas un sklēras subekteritāte ar vai bez sāpju sindroma;
klīniski asimptomātisks variants - bez sūdzībām, ar asins bioķīmisko parametru izmaiņām (paaugstināts sārmainās fosfatāzes, bilirubīna, ASAT, ALAT, amilāzes līmenis) un / vai CBD dilatāciju saskaņā ar ultraskaņas datiem, kas pārsniedz 6 mm.
820 pacientu ar PCES izmeklēšanas rezultāti parādīja, ka dispepsijas variants notiek visbiežāk salīdzinājumā ar citiem (attēls).
Diagnostika
PCES diagnostikai tiek izmantotas metodes, lai identificētu žults ceļu funkcionālos un strukturālos traucējumus, kas rodas gan neatkarīgi, gan kopā ar citām gremošanas sistēmas slimībām. Kā skrīnings tiek izmantotas laboratorijas (GGTP, ALP, bilirubīna, AST, ALT, amilāzes līmeņa noteikšana) un instrumentālās (ultraskaņas, EGDS) diagnostikas metodes. Kā papildu metodes - endoskopiskā retrograde cholangiopancreaticography (ERCP), tai skaitā ar Oddi manometrijas sfinkteru, dinamisko holeskintigrāfiju, magnētiskās rezonanses holangiogrāfiju, endoskopisko ultrasonogrāfiju, pakāpenisko hromatisko divpadsmitpirkstu zarnas intubāciju un citas metodes.
Rūpīga pacientu ar PCES pārbaude, izmantojot ļoti informatīvas diagnostikas metodes, ļauj savlaicīgi un adekvāti koriģēt anatomiskos un funkcionālos traucējumus, kas izveidojās pēc žultspūšļa noņemšanas vai ko pastiprināja holecistektomija.
Ārstēšana
Vairumā gadījumu konservatīva ārstēšanaļauj koriģēt galvenos patofizioloģiskos traucējumus PCES, tomēr dažādos laikos pēc holecistektomijas var parādīties indikācijas ķirurģiskai ārstēšanai.
Svarīgi agrīnā pēcoperācijas periodā ir veselīgs ēdiens... Uztura ieteikumi ir bieži (līdz 6 reizēm dienā) un daļējas ēdienreizes. Ir nepieciešams ierobežot taukus līdz 60-70 g dienā. Ar aizkuņģa dziedzera saglabāto funkciju uzturā var būt līdz 400-500 g ogļhidrātu dienā. Lai adekvāti funkcionāli pielāgotu gremošanas sistēmu žultspūšļa funkciju zaudēšanai, diētu ieteicams paplašināt pēc iespējas agrāk (atkarībā no blakus esošajām slimībām). Konservatīvās terapijas pamatprincipi ir atjaunot normālu žults bioķīmisko sastāvu, žults aizplūšanu un aizkuņģa dziedzera sekrēciju divpadsmitpirkstu zarnā, kā arī slimību ārstēšanā, kas saistītas ar žults ceļu patoloģiju.
Hroniskas žultsceļu nepietiekamības klātbūtnē ir nepieciešama aizstājterapija ar ursodeoksiholskābes (UDCA) zālēm. Mūsu pieredze rāda, ka UDCA izmantošana vidēja dienas deva 10-15 mg uz 1 kg svara efektīvi samazina žultsceļu nepietiekamības pakāpi un disholijas smagumu. UDCA devu un ilgumu nosaka žultsceļu nepietiekamības pakāpe un holesterīna līmeņa izmaiņu dinamika terapijas laikā.
Lai nodrošinātu adekvātu žults aizplūšanu, tiek parādīti miotropie spazmolītiskie līdzekļi: himekromons - 200-400 mg 3 reizes dienā vai mebeverīna hidrohlorīds 200 mg 2 reizes dienā, vai pinaverium bromīds 50-100 mg 3 reizes dienā 2-4 nedēļas.
Šīs grupas medikamentiem galvenokārt ir spazmolītiska iedarbība un tie neietekmē patoloģisko izmaiņu raksturu aknās. Šajā sakarā uzmanība ir pelnījusi hepabēnu - kombinētas zāles augu izcelsmes, kas sastāv no aptiekas dūmu ekstrakta un piena dadža ekstrakta.
Fumaria officinalis ekstraktam, kas satur alkaloīdu fumarīnu, ir choleretic efekts, tai ir spazmolītiska iedarbība, pazemina Oddi sfinktera tonusu, veicinot žults plūsmu zarnās.
Piena dadžu augļu ekstrakts (Fructus Silybi mariani) satur silimarīnu - flavonoīdu savienojumu grupu, ieskaitot izomērus: silibinīnu, silidianīnu un silikristīnu. Silimarīnam ir hepatoprotektīvs efekts: tas saista brīvos radikāļus aknu audos, tam piemīt antioksidanta membrānu stabilizējoša darbība, stimulē olbaltumvielu sintēzi, veicina hepatocītu atjaunošanos, tādējādi normalizējot dažādas aknu funkcijas akūtu un hronisku aknu slimību gadījumā. Uz hepabēna terapijas fona žults bioķīmiskais sastāvs stabilizējas, un žultspūšļa holesterīna piesātinājuma indekss samazinās. Divkāršais hepabēna (spazmolītiskais un hepatoprotektīvais) darbības mehānisms padara to par vienu no izvēlētajām zālēm pacientiem ar PCES. Hepabene tiek nozīmēts 1-2 kapsulas 3 reizes dienā, ārstēšanas kurss ir 1-3 mēneši.
Baktēriju pāraugšanas sindroma klātbūtnē tiek nozīmēti antibakteriāli līdzekļi - kotrimoksazols, intretriks, furazolidons, nifurokskābe, ciprofloksacīns, eritromicīns, klaritromicīns, kurus lieto vispārpieņemtās devās. Ārstēšanas kurss ir 7 dienas. Ja nepieciešams, nākamajā kursā tiek veikti vairāki antibiotiku terapijas kursi, mainot zāles. Neuzsūcamas antibiotikas var būt ļoti daudzsološas SIBO ārstēšanā. Pirmie eksperimenti ar rifaksimīna lietošanu klīnikā liecina, ka zāles normalizē baktēriju mikrofloru, mazina divpadsmitpirkstu zarnas hipertensijas simptomus, kas ir svarīgi arī pacientiem ar PCES. Pēc antibakteriālā kursa tiek nozīmēti probiotikas (bififorms, bifidumbakterīns, sporobakterīns utt.), Prebiotikas - hilak-forte, kas normalizē zarnu mikrofloru, stimulē dekonjugēto žultsskābju bojāto zarnu sienas epitēlija šūnu atjaunošanos.
Lai saistītu lieko žulti un citas organiskās skābes, īpaši aukstas caurejas gadījumā, alumīniju saturošu antacīdu lietošana 3-4 reizes dienā 1-2 stundas pēc ēšanas 7-14 dienas ir parādīts. Saskaņā ar norādēm ir iespējams lietot fermentu preparātus (pankreatīnu utt.).
Vēlīnā pēcoperācijas periodā var rasties vairākas komplikācijas, kas prasa atkārtotas operācijas. Akmeņu atkārtošanās ir diezgan reti sastopama un rodas, ja ir iemesli, kas veicina to veidošanos (traucēta žults aizplūšana un litogēnas žults sekrēcija). Kopējie žults ceļu akmeņi tiek noņemti, izmantojot balona dilatāciju, papilotomiju vai papilosfinkterotomiju. Dažos gadījumos šīs darbības tiek kombinētas ar kontaktlitotripsiju. Striktūru recidīvs, pēc E.I. Halperīns ir visizplatītākā komplikācija, un pēc operācijām ar rētas izmainītiem žultsvadiem tā ir 10–30%. Lielās divpadsmitpirkstu zarnas papillas restenoze attīstās arī pēc papilosfinkterotomijas, saistībā ar kuru var rasties jautājums par holedokoduodenoanastomozes uzlikšanas lietderību.
Profilakse
Preventīvie pasākumi ir visaptveroša pacientu pārbaude operācijas sagatavošanas procesā, lai identificētu un savlaicīga ārstēšana galvenokārt hepatopankreatoduodenālās zonas slimības. Svarīga ir tehniski kompetenta un pilnībā veikta operācija, ja nepieciešams, izmantojot intraoperatīvās diagnostikas metodes, un kuras mērķis ir novērst pēcoperācijas komplikācijas un it īpaši postholecistektomijas sindromu. Viens no galvenajiem PCES profilakses nosacījumiem ir savlaicīga ķirurģiska iejaukšanās pirms slimības komplikāciju attīstības, kā arī nepieciešamais pirmsoperācijas sagatavošanās daudzums, lai izlabotu identificētos traucējumus. Tomēr augsta operatīvā aktivitāte holelitiāzes gadījumā ir saistīta ar augstām veselības aprūpes ekonomiskajām izmaksām (tabula). Šajā ziņā visefektīvākais veids, kā novērst holelitiāzi, un PCES rezultātā ir identificēt un ārstēt pacientus ar holelitiāzi agrīnā stadijā (pirmsakmeņu stadijās). Līdz šīm beigām Centrālais pētījumu institūts gastroenteroloģija, ir izstrādāta mūsdienīga žultsakmeņu klīniskā klasifikācija:
I posms - sākotnējais vai pirmsakmens: kā parādīja pētījumi, var izmantot īsus terapijas kursus, kuru mērķis ir novērst žults darbības traucējumus un atjaunot žults normālu bioķīmisko sastāvu. efektīvs līdzeklis primārā holelitiāzes profilakse.
Literatūra
1. Galperin E.I., Volkova N.V. Žults ceļu slimības pēc holecistektomijas. M.: Medicīna. 1998. gads; 272.
2. Tarasovs K.M. Žultsceļu nepietiekamības klīniskais un laboratoriskais novērtējums pacientiem, kuriem tiek veikta holecistektomija. Darba tēze. Medicīnas zinātņu kandidāts Maskava, 1994; 22.
3. Delyukina O.V. Žults ceļu motora disfunkcijas un žults bioķīmiskā sastāva īpatnības žults dūņās, to korekcijas metodes. Darba tēze. Cand. mīļā. zinātnes. Maskava, 2007; 25.
4. Gastroenteroloģijas ceļvedis / Red. F.I. Komarova un A.L. Grebenev. M.: Medicīna, 1995; 2.
5. Zorina V.A., Kononova N.Yu., Zubkovskaya NS, Kononov Yu.N. Antitripsīnu aktivitātes izpēte, veicot visaptverošu balneoterapijas efektivitātes novērtēšanu postholecistektomijas apstākļos. 7. Starptautiskā slāvu un Baltijas valstu zinātniskā foruma "Sanktpēterburga - Gastro-2005" materiāli. Sanktpēterburgas gastroenteroloģija. 2005. gads; 1-2: M52.
6. Fukuda K., Kuroki T., Tajima Y. et al. Helicobacter DNS un žultsvadu patoloģiju salīdzinošā analīze pacientam ar un bez hepatobiliary vēža // Karcinogenez. 2002. gads; 23: 1927-31.
7. Lin T.T., Yeh C. T., Wu C.S., Liaw Y.F. Helicobacter pylori DNS noteikšana un daļēja secības analīze žults paraugos // Dig. Dis. Sci. 1995. gads; 40: 3: 2214-2219.
8. Kawaguchi M., Saito T., Ohno H. et al. Baktērijas, kas ļoti atgādina Helicobacter pylori, imūnhistoloģiski un ģenētiski konstatētas rezektētā žultspūšļa gļotādā // J. Gastroenterol. 1996. gads; 31: 1: 294-298.
9. Maurer KJ, Ihrig MM, Rogers AB. un citi. Holelitogēno enterohepātisko helikobaktēriju sugu identifikācija un to loma peles holesterīna žultsakmeņu veidošanā // Gastroenteroloģija. 2005. gada apr.; 128: 4: 1023-33.
10. Vikhrova T.V. Žultsceļu dūņas un to klīniskā nozīme. Darba tēze. Medicīnas zinātņu kandidāts Maskava, 2003; 28.
Postholecistektomijas sindroms apvieno dažādu žults sistēmas funkciju traucējumu kompleksu, kas rodas pacientiem pēc holecistektomijas.
ICD-10: K91.5
Galvenā informācija
"Postholecistektomijas sindroma" jēdzienā iepriekš bija iekļauti gan organiski patoloģiski apstākļi, kas saistīti ar veikto ķirurģisko iejaukšanos (akmeņu atlikumi žults traktā, cistiskā kanāla garš celma, kopējā žultsvada gala daļas vai Vatera sprauslas stenoze, jatrogēni bojājumi. cauruļvadiem, cicatricial striktūras, žults ceļu fistulas) un funkcionālie traucējumi, kas attīstās saistībā ar žultspūšļa funkcijas prolapsu. Organisko traucējumu diagnozes tiek kodētas ar viņu pašu kodiem. Pašlaik termins "postholecistektomijas sindroms" tiek lietots vienīgi attiecībā uz patoloģisko sindromu, kas izveidojās žultspūšļa neesamības dēļ, un atspoguļo funkcionālos traucējumus, nevis organiskos procesus.Galveno vietu funkcionālajos traucējumos, kas veido postholecistektomijas sindromu, aizņem Oddi sfinktera disfunkcija - tā saraušanās funkcijas pārkāpums, kas novērš normālu žults un aizkuņģa dziedzera sekrēcijas aizplūšanu divpadsmitpirkstu zarnā.
Epidemioloģiskajiem pētījumiem ir pretrunīgi rezultāti: Oddi sfinktera disfunkcijas biežums pēc holecistektomijas ir 1-14%.
Komplikācija: hronisks atkārtots pankreatīts.
Patoģenēze
Atkarībā no viena vai otra noslēpuma aizplūšanas dominējošā pārkāpuma un sāpju sindroma rakstura tiek izdalīti žults un aizkuņģa dziedzera Oddi disfunkcijas sfinktera veidi. Pēc holecistektomijas hroniska divpadsmitpirkstu zarnas obstrukcija attīstās ar hipertensiju divpadsmitpirkstu zarnas lūmenā, duodenogastrālajā un pēc tam gastroezofageālā refluksa. Šajā gadījumā tiek saasināts žults plūsmas un aizkuņģa dziedzera sekrēcijas pārkāpums divpadsmitpirkstu zarnā. Divpadsmitpirkstu zarnas hipertensijas izzušana tiek uzskatīta par obligātu ārstēšanas virzienu pacientiem ar Oddi sfinktera disfunkciju. Šo hipertensiju vēl vairāk pastiprina divpadsmitpirkstu zarnas mikrobu piesārņojums, kas attīstās arī pēc holecistektomijas.
Ķimenes, žults un aizkuņģa dziedzera sekrēcijas plūsmas asinhronisma rezultātā divpadsmitpirkstu zarnā, kā arī mikrobu piesārņojuma dēļ attīstās sekundāra aizkuņģa dziedzera nepietiekamība.
Klīniskā aina
Abi Oddi disfunkcijas sfinktera veidi (žults un aizkuņģa dziedzera) pēc klīniskā attēla parasti tiek iedalīti trīs grupās atbilstoši sāpju raksturam un objektīvajām pazīmēm, kā arī instrumentālo testu rezultātiem.Pirmais Oddi sfinktera žults disfunkcijas veids(noteikti) - pacienti ar tipiskām žults sāpēm (piemēram, žults kolikām), kuriem žultsvads ir paplašināts (vairāk nekā 12 mm) vai ir traucēta žults izplūde - kontrasta izdalīšanās laiks ERCP ir ilgāks par 45 minūtēm, un ir arī aknu funkcionālo testu rādītāju novirze (vairāk nekā divkārša sārmainās fosfatāzes un / vai aminotransferāžu aktivitātes palielināšanās divos vai vairākos pētījumos).
Otrais Oddi sfinktera žults disfunkcijas veids(domājams) - tipiskas žultsceļu sāpes, kā arī 1 vai 2 pirmā tipa kritēriji.
Trešais Oddi sfinktera žults disfunkcijas veids(iespējams) - tikai tipiskas žults sāpes bez objektīviem kritērijiem, kas apstiprina attiecīgos traucējumus.
Arī Oddi sfinktera hipertensijas traucējumi aizkuņģa dziedzera segmentā ir sadalīti trīs veidos.
Pirmais tips (noteikts)- pacienti ar idiopātisku recidivējošu pankreatītu un / vai tipiskām aizkuņģa dziedzera sāpēm (aizkuņģa dziedzera lēkmes) ar amilāzes / lipāzes aktivitātes palielināšanos 2 reizes virs normas vai vairāk, palielinātu aizkuņģa dziedzera kanālu (vairāk nekā 5 mm) un palielinātu sekrēcija caur aizkuņģa dziedzera kanālu divpadsmitpirkstu zarnā vairāk nekā 10 minūtes.
Otrais veids (domājams)- pacientiem ir tipiskas aizkuņģa dziedzera sāpes un 1 vai 2 pirmā tipa kritēriji.
Trešais veids (iespējams)- pacienti ar aizkuņģa dziedzera sāpēm, bet bez objektīvām pazīmēm, kas raksturīgas pirmajam tipam (virsungodiskinēzija).
Pacientiem ar pirmā veida Oddi sfinktera disfunkciju ir paša sfinktera vai Vater sprauslas strukturāli traucējumi (piemēram, stenozējošs papilīts), pacientiem ar otro un trešo tipu ir Oddi sfinktera funkcionālie traucējumi.
Ar žults ceļu sāpēm parasti ir iespējams palpēt nedaudz palielinātas un nedaudz sāpīgas aknas, ar aizkuņģa dziedzera tipu tiek noteiktas palpācijas sāpes aizkuņģa dziedzera projekcijā.
Diagnostika
Fiziskās pārbaudes metodes:intervija;
pārbaude;
vēdera orgānu palpācija.
Laboratorijas pētījumi
Obligāts:
vispārēja asins analīze;
vispārējā urīna analīze + bilirubīns + urobilīns;
kopējais bilirubīna līmenis asinīs un tā frakcijas;
AlAT, AsAT;
ALF;
GGTP;
cukurs asinīs;
asiņu un urīna amilāze;
koprogramma.
Ja norādīts:
žults mikroskopiski, bakterioloģiski, bioķīmiski pētījumi;
Debrija un Nardi provokatīvie testi;
izkārnījumu aizkuņģa dziedzera elastāze-1.
Instrumentālās un citas diagnostikas metodes
Obligāts:
Aknu (ieskaitot žultsvadus), aizkuņģa dziedzera ultraskaņa.
Ja norādīts:
daudzfunkcionāla divpadsmitpirkstu zarnas skanēšana;
dinamiska ultraskaņa pirms un pēc taukainas pārtikas ēšanas;
EKG;
vēdera dobuma vispārējā rentgena izmeklēšana un krūtīs;
holegrāfija;
ERCP;
Oddi sfinktera endoskopiskā manometrija;
Vēdera dobuma un retroperitoneālo orgānu datortomogrāfija;
MRI un holangiopankreatogrāfija.
Speciālistu konsultācijas
Ja norādīts:
ķirurgs.
Ārstēšana
FarmakoterapijaObligāti (ieteicams)
Ja norādīts:
žults kolikām: miotropais spazmolītiskais līdzeklis (papaverīna hidrohlorīds vai drotaverīns) kombinācijā ar M 1 -holinolītisku līdzekli (atropīna sulfāts vai pirenzepīns) kombinācijā ar pretsāpju līdzekli (pēc vajadzības);
ar intensīvām, bet nesasniedzošām žults kolikas sāpēm, ar mērķi tās mazināt, ir norādīta Drotaverine 40 mg 2-3 r / dienā uzņemšana; ar biežām intensīvu žults sāpju epizodēm - 80 mg 2 r dienā 5-7 dienas;
pret aizkuņģa dziedzera sāpēm sekundāras hologēniskas aizkuņģa dziedzera mazspējas attīstība - minimosfēras formas divu apvalku enzīmu preparāts (līdz divām nedēļām, un pēc tam pēc pieprasījuma);
ar divpadsmitpirkstu zarnas mikrobu piesārņojumu - sulfametoksazola un trimetoprima (biseptola) kombinācija, 2 tabletes. 2 r / dienā vai doksiciklīns 0,1 g 2 r / dienā, vai ciprofloksacīns 250 mg 2 r / dienā 5-7 dienas, kam seko antidiarrāla pretmikrobu zāles kombinācijā ar probiotiku 2 nedēļas; paralēli zarnu antiseptiķiem, pro- un prebiotikiem - alumīniju saturošiem antacīdiem līdzekļiem līdz 2 nedēļām;
ar reaktīvā hepatīta attīstību - hepatotropiskas zāles;
ar hroniska recidivējoša pankreatīta attīstību - (sk. "Aizkuņģa dziedzera slimības: hronisks pankreatīts" (K86.0, K86.1)
Citas procedūras
organiska Oddi sfinktera disfunkcijas cēloņa (papilostenoze uc) klātbūtnē - endoskopiska ārstēšana (papilosfinkterotomija, Oddi sfinktera balona dilatācija, kopējā žultsvada un / vai Wirsung kanāla stentēšana).
ar smagu Oddi sfinktera hipertoniskumu, biežiem žults sāpju uzbrukumiem un aizkuņģa dziedzera uzbrukumiem - botulīna toksīna (botox 100 peles vienības) injicēšana Vatera sprauslā.
fizioterapeitiskā ārstēšana (ja nav aizkuņģa dziedzera uzbrukuma pazīmju) - UHF, induktotermija, mikroviļņu terapija, novokaīna, magnija sulfāta elektroforēze, parafīna un ozokerīta lietošana.
akupunktūra.
Ārstēšanas efektivitātes kritēriji
Klīnisko izpausmju atvieglošana, sāpju lēkmju samazināšana vai izzušana, laboratorijas un instrumentālo testu rezultātu uzlabošana.
Ārstēšanas ilgums
Ambulatorā - 3-4 nedēļas.
Profilakse
Lai novērstu Oddi disfunkcijas sfinktera attīstību pēc holecistektomijas, žultsvadu dūņu veidošanās, ieteicams:
ierobežojošie (bet neizslēdzošie) pārtikas produkti, kas bagāti ar holesterīnu un taukskābēm;
regulāras 4-6 ēdienreizes dienā;
uztura bagātināšana ar uztura šķiedrām;
sākotnēji palielināta ķermeņa svara lēna samazināšanās;
ikdienas izkārnījumu nodrošināšana;
lietojot mazkaloriju diētas, badojoties vai lietojot biliodigestīvas anastomozes, ieteicams 2-3 mēnešus lietot ursodeoksiholskābi 10 mg / kg dienā.