A nekrózis fő morfológiai típusai. Koagulatív nekrózis: leírás, okok és kezelés.
A nekrózis a sejtek, az emberi szervek pusztulásának és elpusztulásának visszafordíthatatlan folyamata, amelyet kórokozó baktériumoknak való kitettség okoz. A fejlődés oka lehet: magas hőmérsékletnek való kitettség (égéssel), vegyi vagy fertőző ágensek, mechanikai sérülés. A nekrózis lehet koagulatív (száraz) vagy koagulatív (nedves). A cikkben részletesebben megvizsgáljuk a száraz nekrózis okait, valamint a kezelési módszereket.
Mi az a koagulációs nekrózis
A száraz nekrózis gyakran fehérjében gazdag, de alacsony folyadéktartalmú szerveket érint. Ezek tartalmazzák:
- vese;
- mellékvesék;
- lép;
- szívizom.
A szervsejtek elhalása az elégtelen vérellátás és oxigéndúsulás miatt következik be termikus, kémiai, mechanikai, toxikus károsodások következtében. Ennek eredményeként az elhalt sejtek kiszáradnak, és megtörténik a mumifikációs folyamat. Az elhalt sejteket világos vonal választja el az élő sejtektől.
A száraz nekrózis kialakulásának okai
Száraz nekrózis alakul ki, ha:
- egy bizonyos szerv meghatározott területének vérellátásának megsértése történt, ennek eredményeként oxigénhiány és alapvető tápanyagok hiánya keletkezett;
- a betegség fokozatosan fejlődött ki;
- a szervek érintett részei nem rendelkeztek elegendő folyadékkal (zsírréteg, izomszövetek);
- patogén mikrobák nem voltak jelen a sejtek érintett területén.
A száraz nekrózis kialakulása érzékenyebb az erős immunitással és alultápláltsággal rendelkező emberekre.
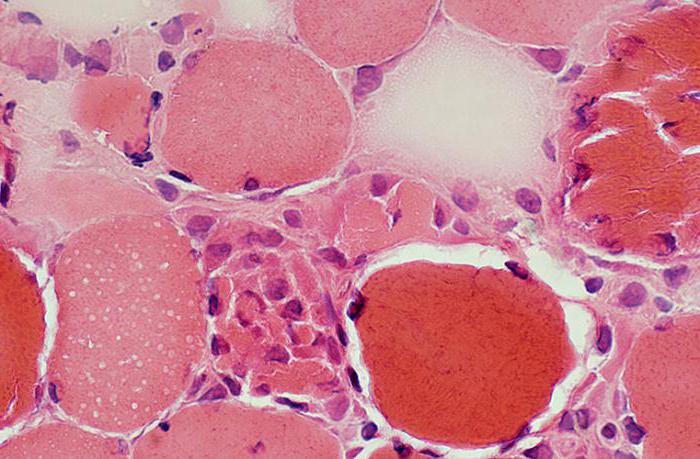
Koagulatív nekrózis: fejlődési mechanizmus
A sejtek elégtelen oxigéntelítettsége és a károsodott vérellátás miatt a protoplazma koagulációs és tömörödési folyamata következik be, majd az érintett terület kiszárad. A sérült részek mérgező hatással vannak a szomszédos élő szövetekre.
Az érintett területnek sajátossága van kinézet: az elhalt sejtek világos vonallal körvonalazódnak, és kifejezett sárgásszürke vagy agyagsárga színűek. Ez a terület idővel megvastagodik. Vágáskor láthatjuk, hogy a szövetek teljesen szárazak, alvó állagúak, míg a minta homályos. A sejtmag bomlása következtében homogén citoplazmatömegnek tűnnek. Továbbá a nekrózis és a gyulladás kialakulásával észrevehető az elhalt szövetek kilökődése. Ha a betegség egy személy fülét vagy csontjait érinti, fisztula képződik. A koagulatív nekrózis kialakulásának mechanizmusa azonban még nem teljesen ismert.
A koagulációs nekrózis fajtái
A koagulatív nekrózis többféle típust foglal magában:
- A szívinfarktus a leggyakoribb típus. Ischaemiás betegség következtében alakul ki. Nem fejlődik az agyszövetben. Szívroham esetén lehetséges a sérült szövetek teljes regenerációja.
- Viaszos (Zenker) - súlyos fertőző károsodás következtében alakul ki. A betegség az izomszöveteket érinti, gyakran a comb izmait és az elülső hasfalat vezeti. A nekrózis kialakulását korábbi betegségek provokálják, például kiütések vagy Az érintett területek szürkék.
- A kazeos nekrózis a betegség sajátos típusa. A tuberkulózis, a szifilisz, a lepra, a Wegener társa. Az ilyen típusú nekrózis esetén a stroma és a parenchyma (rostok és sejtek) elhalnak. Sajátosság ezt a betegséget abban, hogy a száraz területeken kívül pépes vagy aludt granulomák képződnek. Az érintett szövetek élénk rózsaszín színűek. A kazeos nekrózis az egyik legveszélyesebb típus, mivel hatalmas területeket képes "megölni".
- Fibrinoid - olyan betegség, amelyben a kötőszövet károsodik. A nekrózis olyan autoimmun betegségekben alakul ki, mint a lupus vagy a reuma. A betegség legsúlyosabban az erek simaizmait és rostjait érinti. A fibrinoid nekrózist a kollagénrostok normál állapotának megváltozása és a nekrotikus anyag felhalmozódása jellemzi. Mikroszkópos vizsgálat során az érintett szövetek fibrinnek tűnnek. Ugyanakkor a halottak élénk rózsaszín színűek. A fibrinoid nekrózis által érintett területek nagy mennyiségben tartalmaznak immunglobulint, valamint fibrint és kollagén bomlástermékeket.
- Zsíros - a betegség zúzódások és vérzések, valamint a szövetek pusztulása következtében alakul ki pajzsmirigy. Nekrózis esetén a peritoneum és az emlőmirigyek érintettek.
- Gangrénás - lehet száraz, nedves, gáz. Az ágyhoz kötött betegek felfekvése is ehhez a típusú nekrózishoz tartozik. Leggyakrabban a betegség kialakulását olyan baktériumok segítik elő, amelyek bejutnak az érintett területekre.
Száraz gangréna, mint a koagulációs nekrózis egyik fajtája
A száraz gangréna olyan betegség, amelyben a külső környezettel érintkező bőr nekrózisa alakul ki. A betegség kialakulásában általában nem vesznek részt mikroorganizmusok. A száraz gangréna leggyakrabban a végtagokat érinti. A sérült szövetek sötét, majdnem fekete színűek és jól körülhatárolható körvonalúak. A szín megváltozik a hidrogén-szulfid hatására. Ez azért történik, mert a hemoglobin pigmentek vas-szulfiddá alakulnak. A száraz gangréna a következő körülmények között alakul ki:
- A végtagok artériás trombózisával és érelmeszesedésével.
- Ha magas vagy alacsony hőmérsékletnek van kitéve a végtagokon (égési vagy fagyási sérülésekkel).
- A fejlesztéssel
- Fertőzések jelenlétében, mint pl
A kezelést csak az elhalt szövetek műtéti eltávolításával végezzük.

Nedves gangréna
A nedves gangréna olyan betegség, amely akkor alakul ki bakteriális fertőzés a sérült szöveteken. A betegség nedvességben gazdag szerveket érint, előfordulhat a bőrön, de gyakrabban átterjed a belső szervekre. A nedves gangréna a beleket (az artériák elzáródásával) és a tüdőt (tüdőgyulladás következtében) érinti.
A betegség gyakran gyermekeknél fordul elő, mivel immunitásuk, amikor fertőzés kapcsolódik, érzékenyebb a gangréna kialakulására. Az arc és a perineum lágy szövetei érintettek. Ezt a betegséget vízráknak nevezik. Az érintett területek nagyon megduzzadnak és megvannak sötét szín. Nincs határoló kontúr, így a betegség nehezen kezelhető sebészi kezelés, mivel nehéz meghatározni, hol végződnek az érintett szövetek. Gangrénás területek nagyon rossz szagés a betegség gyakran halálhoz vezet.
Gáz gangréna és felfekvés
Megnyilvánulásaiban nagyon hasonlít a nedveshez, de a fejlődés okai eltérőek. Ez a fajta gangréna akkor alakul ki, ha a Clostridium perfringens fajba tartozó baktériumok bejutnak az érintett kezdőkbe és aktívan szaporodnak. A baktériumok élettevékenységük során speciális gázt bocsátanak ki, amely az érintett szövetekben található. A halálozás ebben a betegségben nagyon magas.
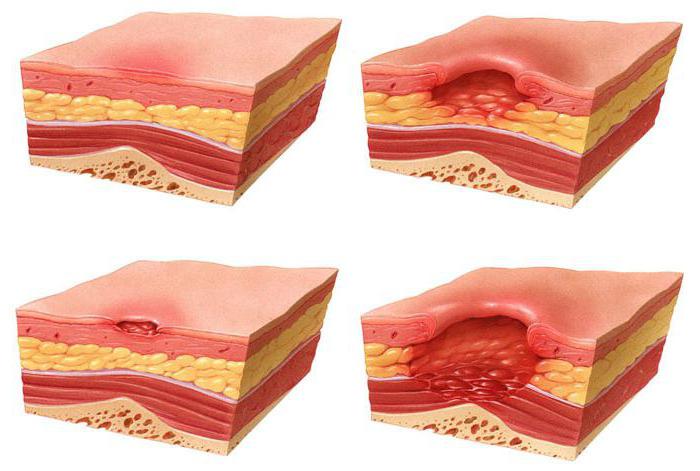 A felfekvés az üszkösödés egyik fajtája, amelyben a szövetelhalás folyamata következik be. A betegségek leginkább az ágyhoz kötött betegekre érzékenyek, mivel bizonyos testrészek nyomás alatt vannak a hosszan tartó immobilizáció miatt, és nem kapják meg a vérrel együtt a szükséges anyagokat. Ennek eredményeként a bőrsejtek elhalnak. A keresztcsont, a sarok és a combcsont területe a leginkább érzékeny a sérülésekre.
A felfekvés az üszkösödés egyik fajtája, amelyben a szövetelhalás folyamata következik be. A betegségek leginkább az ágyhoz kötött betegekre érzékenyek, mivel bizonyos testrészek nyomás alatt vannak a hosszan tartó immobilizáció miatt, és nem kapják meg a vérrel együtt a szükséges anyagokat. Ennek eredményeként a bőrsejtek elhalnak. A keresztcsont, a sarok és a combcsont területe a leginkább érzékeny a sérülésekre.
A koagulatív nekrózis diagnózisa
A "koagulációs nekrózis" diagnózisához, ha a károsodás felületes, elegendő, ha az orvos vért és mintát vesz a sérült szövetből elemzés céljából.
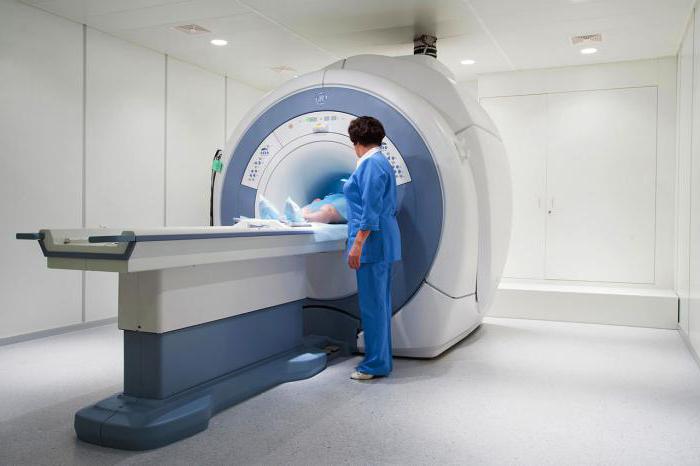
Ha fennáll a szervi nekrózis gyanúja, kiterjedtebb vizsgálatot végeznek. Ehhez szüksége van:
- Készítsen röntgenfelvételt. Különösen releváns ez a tanulmány ha gáz gangréna gyanúja merül fel.
- Végezzen radioizotópos vizsgálatot. Akkor írják fel, ha a röntgen nem mutatott fel semmilyen változást (be kezdeti szakaszban betegségek). Radioaktív anyag kerül az emberi szervezetbe. Ha nekrotikus elváltozás van a szerv szöveteiben, akkor azt egy sötét folt emeli ki.
- Csinálj egy CT-vizsgálatot. Csontkárosodás gyanúja esetén hajtják végre.
- Vegyél egy MRI-t. A leghatékonyabb kutatási módszer, hiszen a vérkeringés zavarával járó kisebb elváltozásokat is kimutatja.
A nekrózis szövődményei
A nekrózis a sérült szervek és szövetek "halála". Ezért különféle típusai, mint például a szívroham, az agy, a vese vagy a máj elhalása, egy személy halálához vezethet.
Ezenkívül a kiterjedt nekrózis súlyos szövődményekhez vezethet, például több felfekvés esetén veszélyes fertőzés is hozzáadható. Az elhalt szövetek bomlástermékeiket a szervezetbe bocsátják, így toxikus szövődményekhez vezetnek. A betegség enyhébb formái is kellemetlen következményekkel járhatnak, mint például hegesedés a szívizomban vagy cisztaképződés az agyban.
Nekrózis kezelése
A nekrózis kezelése a típusának meghatározásával, az általa okozott károsodás felmérésével és a kísérő betegségek azonosításával kezdődik.
A száraz bőr nekrózisának diagnosztizálása során helyi kezelést írnak elő:
- Az érintett területek kezelése zöld festékkel.
- A bőr felületének tisztítása antiszeptikumokkal.
- Kötözés alkalmazása "klórhexidin" oldattal.
A betegnek gyógyszert írnak fel és sebészi kezelés a normál vérkeringés helyreállítása érdekében, beleértve az érintett területeket is. Az elhalt sejtek eltávolítására leggyakrabban sebészeti beavatkozást végeznek az érintett területek eltávolítására. A végtag amputációját azért végezzük, hogy az egészséges területeket megóvjuk a betegség terjedésétől.

A belső szervek száraz nekrózisát gyulladáscsökkentő gyógyszerek, értágítók, chondroprotectors alkalmazásával kezelik. A terápia hatástalansága esetén sebészeti kezelést végeznek.
Elhalás (görögből. necros- elhalt) - nekrózis, sejtek és szövetek halála élő szervezetben patogén tényezők hatására. Az ilyen típusú sejthalál genetikailag nem szabályozott.
A nekrózist okozó tényezők:
ü fizikai (lőtt seb, sugárzás, elektromosság, alacsony és magas hőmérséklet - fagyás és égési sérülések);
ü mérgező (savak, lúgok, nehézfémek sói, enzimek, gyógyszerek, etil-alkohol stb.);
ü biológiai (baktériumok, vírusok, protozoonok stb.);
ü allergiás (endo- és exoantigének, pl. fibrinoid nekrózis fertőző-allergiás és autoimmun betegségekben, Arthus-jelenség);
ü vaszkuláris (szívroham - vaszkuláris nekrózis);
ü trofoneurotikus (nyomásfekélyek, nem gyógyuló fekélyek).
A patogén faktor hatásmechanizmusától függően a következők:
- közvetlen nekrózis a faktor közvetlen hatása miatt (traumás, toxikus és biológiai nekrózis);
- indirekt nekrózis, amely az érrendszeren és a neuro-endokrin rendszeren keresztül közvetetten fordul elő (allergiás, vaszkuláris és trofoneurotikus nekrózis).
A nekrózis morfológiai jelei
A nekrózist a necrobiosis időszaka előzi meg, melynek morfológiai szubsztrátja a disztróf elváltozások.
Kernel változások.
Az elhalt sejt kromatinja nagy csomókká kondenzálódik. A mag térfogata csökken, ráncossá, sűrűvé válik, intenzíven bazofil, vagyis hematoxilinnel sötétkékre fest. Ennek a folyamatnak a neve kariopiknózis(ráncolás). A piknotikus mag ezután számos kis bazofil részecskére szakadhat. (karyorrhexis) vagy lízisen (feloldódáson) megy keresztül a lizoszómális dezoxiribonukleáz hatására (kariolízis). Ezután megnövekszik a térfogata, gyengén hematoxilinnel festődik, a mag körvonalai fokozatosan elvesznek. Gyorsan fejlődő nekrózis esetén a sejtmag piknotikus stádium nélkül lízisen megy keresztül.
citoplazmatikus változások.
- a sejt citoplazmája a citoplazmatikus fehérjék koagulációja és a riboszómák elpusztulása (eltűnése) következtében homogénné és kifejezetten acidofilné válik.
- a mitokondriumok duzzanata és az organellummembránok pusztulása (pusztulása) a citoplazma vakuolizációját okozza.
- a sejt emésztése a saját lizoszómáiból felszabaduló enzimekkel sejtlízist (autolízist) okoz.
Így a fehérjék koagulációja a citoplazmában megy végbe, amit általában kollikvációjuk vált fel.
Változások az intercelluláris anyagban kiterjed mind az intersticiális anyagra, mind a rostos struktúrákra. Leggyakrabban a fibrinoid nekrózisra jellemző elváltozások alakulnak ki: a kollagén-, rugalmas- és retikulinrostok sűrű, homogén rózsaszínű, esetenként bazofil tömegekké alakulnak át, amelyek fragmentálódáson, csomós bomláson, lízisen mennek keresztül. Ritkábban rostos struktúrák ödémája, lízise és nyálka is megfigyelhető, ami a colliquat nekrózisra jellemző.
A nekrózis klinikai és morfológiai formái
Különbséget kell tenni a koagulációs (száraz) nekrózis és a kollikvatív (nedves) nekrózis között.
A. Koagulációs (száraz) nekrózis.
A véralvadási nekrózis általában fehérjében gazdag és folyadékban szegény szervekben fordul elő, például a vesében, a szívizomban, a mellékvesékben, a lépben, általában az elégtelen keringés és anoxia, fizikai, kémiai és egyéb károsító tényezők hatására, pl. például májsejtek koagulációs nekrózisa víruskárosodással vagy bakteriális és nem bakteriális eredetű toxikus ágensek hatására. A koagulációs nekrózist száraznak is nevezik, mivel az jellemzi, hogy az elhalt területek szárazak, sűrűek, omladozóak, fehérek vagy sárgák.
A koagulációs nekrózis magában foglalja:
szívroham- a belső szervek (az agy kivételével) egyfajta vaszkuláris (ischaemiás) nekrózisa. Ez a nekrózis leggyakoribb típusa.
Szívinfarktus (a lat. infarcire- tömés, tömés) egy szerv vagy szövet elhalt területe, amely a véráramlás hirtelen leállása (ischaemia) következtében kikapcsolt a vérkeringésből. A szívroham a vaszkuláris (ischaemiás) koagulációs vagy koagulációs nekrózis egyik fajtája. Ez a nekrózis leggyakoribb típusa.
Mind a parenchymalis sejtek, mind az intersticiális szövet nekrózison megy keresztül. Leggyakrabban szívroham lép fel trombózissal vagy embóliával, görcsökkel, kompresszióval artériás erek. Nagyon ritkán a szívroham oka a vénás kiáramlás megsértése lehet.
A szívinfarktus kialakulásának okai:
- akut ischaemia elhúzódó görcs, trombózis vagy embólia, az artéria összenyomódása miatt;
- a szerv funkcionális feszültsége annak elégtelen vérellátása esetén. A szívinfarktus előfordulása szempontjából nagy jelentősége van az anasztomózisok és kollaterálisok elégtelenségének, amely függ az artériák falának károsodásának mértékétől és lumenszűkületétől (atherosclerosis, obliteráló endarteritis), a keringési zavarok mértékétől. (például vénás pangás) és az artéria trombus vagy embolus általi leállásának szintjén.
Ezért a szívroham általában azokban a betegségekben fordul elő, amelyeket az artériák falának súlyos elváltozásai és általános keringési zavarok jellemeznek. Ez:
- reumás betegségek;
- szívhibák;
- érelmeszesedés;
- hipertóniás betegség;
- bakteriális (fertőző) endocarditis.
A szívroham morfológiája
Szívinfarktus makroszkopikus képe. A szívroham alakja, mérete, színe és konzisztenciája eltérő lehet.
szívroham formája. Az infarktusok jellemzően ék alakúak. Ilyenkor az ék hegyes része az orgona kapui felé néz, ill széles rész a perifériára kerül, például a szerv kapszula alá, a peritoneum alá (lépinfarktusok), a mellhártya alá (tüdőinfarktusok) stb. A vesékben, a lépben és a tüdőben előforduló szívroham jellegzetes formáját e szervek angioarchitektonikájának jellege határozza meg - az artériák elágazásának fő (szimmetrikus dichotóm) típusa. Ritkán a szívrohamok szabálytalan alakúak. Ilyen szívinfarktus a szívben, az agyban, a belekben fordul elő, hiszen ezekben a szervekben nem a fő, hanem az artériák laza vagy vegyes elágazása az uralkodó.
A szívroham mérete. A szívroham kiterjedhet egy szerv nagy részére vagy egészére (részösszeg vagy teljes szívroham), vagy csak mikroszkóp alatt észlelhető (mikroinfarktus).
Az infarktusok színe és textúrája. Ha a szívinfarktus koagulációs nekrózisként alakul ki, akkor a nekrózis területén a szövet megvastagodik, száraz, fehér-sárga színűvé válik (miokardiális infarktus, vese, lép). Ha az infarktus a kollikvát nekrózis típusa miatt jön létre, akkor az elhalt szövet meglágyul és cseppfolyósodik (agyi infarktus vagy szürke lágyulás fókusza).
A fejlődés és a megjelenés mechanizmusától függően a következők vannak:
- fehér (ischaemiás) infarktus;
- vörös (vérzéses) szívroham;
- fehér infarktus vérzéses corolla.
A fehér (ischaemiás) infarktus az artériás véráramlás teljes leállása eredményeképpen következik be a szervekben, például a szívben, a vesékben, a lépben, az agyban a Willis kör felett. Általában olyan területeken fordul elő, ahol egyetlen véráramlási rendszer van (az artériák elágazásának fő típusa), ahol a kollaterális keringés rosszul fejlett. Az ischaemiás szövetből történő zavartalan vénás kiáramlás és az artériák disztális részének görcsössége miatt a véráramlás megszűnése után ezen infarktusok sápadtsága figyelhető meg. A fehér (ischaemiás) infarktus a környező szövetektől egyértelműen elhatárolt terület, fehér-sárga, szerkezet nélküli.
A vérzéses corollal járó fehér infarktust fehér-sárga terület képviseli, de ezt a területet vérzéses zóna veszi körül. Ennek eredményeként alakul ki, hogy az infarktus perifériáján fellépő érgörcsöt felváltja azok paretikus kiterjedése és vérzések kialakulása. Ilyen szívroham fordulhat elő a vesékben, a szívizomban.
A vörös (vérzéses) szívinfarktus jellemzője, hogy a nekrózis helye vérrel telített, sötétvörös, jól körülhatárolt. Az infarktus az infarktus zónában lévő mikrovaszkulatúra nekrotikus ereiből vér felszabadulása miatt vörössé válik. A vörös infarktus kialakulásához fontosak a szerv angioarchitektonikájának sajátosságai - két vagy több véráramlási rendszer, kollaterálisok kialakulása: a tüdőben - anasztomózisok jelenléte a hörgők és a hörgők között. pulmonalis artériák, a bélben - rengeteg anasztomózis a mesenterialis artériák ágai között, az agyban a Willis körben a belső nyaki verőér és a basilaris artériák ágai között. Vörös infarktusok is előfordulhatnak a szövetben, amikor az elzáró trombus feloldódik vagy feldarabolódik (szétbomlik), ami újraindítja az artériás véráramlást az infarktus területén.
Ritka a vérzéses infarktus a vesékben és a szívben. Az ilyen vérzéses impregnálás szükséges feltétele a vénás pangás.
Vénás infarktus akkor következik be, amikor a szövet teljes vénás elvezető rendszere elzáródik (pl. superior sagittalis sinus trombózis, vesevéna trombózis, felső mesenterialis véna trombózis). Ez súlyos ödémát, torlódást, vérzést és a hidrosztatikus nyomás fokozatos növekedését eredményezi a szövetekben. A hidrosztatikus nyomás erős növekedése esetén az artériás vér beáramlása a szövetbe megnehezül, ami ischaemiához és infarktushoz vezet. A vénás infarktus mindig vérzéses.
Mikroszkóposan az elhalt területet a szerkezet, a sejtkontúrok elvesztése és a sejtmagok eltűnése jellemzi.
A szív (szívizom), az agy, a belek, a tüdő, a vese és a lép infarktusainak van a legnagyobb klinikai jelentősége.
Szívben Az infarktus általában fehér, vérzéses corolla, szabálytalan alakú, gyakrabban fordul elő a bal kamrában és az interventricularis septumban, rendkívül ritkán a jobb kamrában és a pitvarban. A nekrózis lokalizálható az endocardium (szubendokardiális infarktus), epicardium (subepicardialis infarktus), a szívizom vastagságában (intraramális) vagy a szívizom teljes vastagságában (transzmurális infarktus). Az infarktus területén gyakran trombotikus lerakódások képződnek az endocardiumon, és gyakran fibrinózus lerakódások képződnek a szívburkon, ami a nekrózisos területek körüli reaktív gyulladás kialakulásához kapcsolódik. Leggyakrabban a szívinfarktus az érelmeszesedés hátterében és magas vérnyomás az artériák görcsének vagy trombózisának hozzáadásával, lévén akut forma ischaemiás szívbetegség.
Az agyban Willis köre felett fehér infarktus lép fel, amely gyorsan lágyul (az agy szürke lágyulásának fókusza). Ha a szívinfarktus jelentős keringési rendellenességek, vénás pangás hátterében alakul ki, akkor az agyi nekrózis fókusza vérrel telítődik és pirosra vált (az agy vörös lágyulásának fókusza). Az agytörzs régiójában, a Willis köre alatt vörös infarktus is kialakul. A szívroham általában a kéreg alatti csomópontokban lokalizálódik, tönkretéve az agy pályáit, ami bénulással nyilvánul meg. Az agyi infarktus, akárcsak a szívinfarktus, leggyakrabban érelmeszesedés és magas vérnyomás hátterében fordul elő, és az agyi érrendszeri betegségek egyik megnyilvánulása.
A tüdőben az esetek túlnyomó többségében vérzéses infarktus alakul ki. Ennek oka gyakran thromboembolia, ritkábban - trombózis vasculitisben. Az infarktus területe jól körülhatárolt, kúp alakú, amelynek alapja a mellhártya felé néz. Fibrinrétegek jelennek meg a mellhártyán az infarktus területén (reaktív mellhártyagyulladás). A kúp csúcsán néz tüdőgyökér, trombust vagy embólust gyakran találnak a pulmonalis artéria ágában. Az elhalt szövet sűrű, szemcsés, sötétvörös. A vérzéses tüdőinfarktus általában a vénás pangás hátterében fordul elő, és kialakulását nagymértékben meghatározzák a tüdő angioarchitektonikájának jellemzői, a tüdő- és hörgőartériák rendszerei közötti anasztomózisok jelenléte. Pangásos bőség és a tüdőartéria ágának lumenének záródása esetén a vér belép a tüdőszövet nekrózisának területére a hörgőartériából, amely megtöri a kapillárisokat és az alveolusok lumenébe önti. A szívroham körül gyakran alakul ki a tüdőszövet gyulladása (periinfarktusos tüdőgyulladás). Masszív vérzéses tüdőinfarktus okozhatja a suprahepatikus sárgaságot. A fehér szívinfarktus a tüdőben kivételes ritkaság. Szklerózissal és a hörgő artériák lumenének eltüntetésével fordul elő.
a vesékben infarktus, általában fehér, vérzéses korollal, a kúp alakú nekrózis területe vagy a kérgi anyagot, vagy a parenchyma teljes vastagságát lefedi. Amikor a fő artériás törzs zárva van, teljes vagy részösszeg veseinfarktus alakul ki. A szívinfarktusok sajátos fajtája a vese kérgi anyagának szimmetrikus nekrózisa, ami akut szívinfarktus kialakulásához vezet. veseelégtelenség. Az ischaemiás veseinfarktusok kialakulása általában thromboemboliával, ritkábban a veseartéria ágainak trombózisával jár reuma, bakteriális endocarditis, magas vérnyomás, szívkoszorúér-betegség esetén. Ritkán vesevénás trombózis esetén vénás infarktus fordul elő.
a lépben fehérinfarktusok fordulnak elő, gyakran a kapszula reaktív fibrinális gyulladásával, majd a rekeszizom, a parietális peritoneum, a bélhurok tapadásának kialakulásával.A lép ischaemiás infarktusai trombózissal és embóliával társulnak. A lépvéna trombózisával néha, nagyon ritkán, vénás infarktusok alakulnak ki.
A belekben a szívrohamok vérzésesek, és mindig szeptikus bomláson mennek keresztül, ami a bélfal perforációjához és hashártyagyulladás kialakulásához vezet. Az ok leggyakrabban a volvulus, a bélinvagináció, a fojtott sérv, ritkábban az érelmeszesedés trombózissal.
Caseous (túrós) nekrózis tuberkulózis, szifilisz, lepra, valamint limfogranulomatózis esetén alakul ki. Specifikusnak is nevezik, mivel leggyakrabban specifikus fertőző granulomákban található meg. Ban ben belső szervek fehéres-sárga szövet száraz, omladozó korlátozott területe látható. A szifilitikus granulomákban az ilyen területek nagyon gyakran nem morzsalékosak, hanem pépesek, emlékeztetnek az arab ragasztóra. Ez egy vegyes (azaz extra- és intracelluláris) típusú nekrózis, amelyben a parenchyma és a stroma (a sejtek és a rostok egyaránt) egyszerre hal el. Mikroszkóposan egy ilyen szövetterület szerkezet nélküli, homogén, hematoxilinnel és eozinnal festett rózsaszínűnek tűnik, jól láthatóak a magkromatin csomói (kariorrhexis).
Viaszos vagy Zenker nekrózis(izomnekrózis, gyakran elülső hasfalés a combok, súlyos fertőzésekkel - tífusz és tífusz, kolera);
fibrinoid nekrózis- a kötőszöveti nekrózis típusa. Allergiás és autoimmun betegségekben (például reuma, rheumatoid arthritisés szisztémás lupus erythematosus). A kollagénrostok és az erek középső membránjának simaizomzata károsodik. Malignus hypertoniában az arteriolák fibrinoid nekrózisa figyelhető meg. Ezt a nekrózist a normál kollagénrostszerkezet elvesztése és egy homogén, élénk rózsaszínű nekrotikus anyag felhalmozódása jellemzi, amely mikroszkopikusan utánozza a fibrint.
Zsírnekrózis.
Enzimatikus zsírnekrózis: A zsírelhalás leggyakrabban akut hasnyálmirigy-gyulladás és hasnyálmirigy-sérülés esetén fordul elő, amikor a hasnyálmirigy enzimek a csatornákból a környező szövetekbe szivárognak. Ugyanakkor a hasnyálmirigyet körülvevő zsírszövetben átlátszatlan, fehér (mint kréta) plakkok és csomók (steatonecrosis) jelennek meg.
Nem enzimatikus zsírnekrózis: nem enzimatikus zsírelhalás figyelhető meg az emlőmirigyben, a bőr alatti zsírszövetben és hasi üreg. A legtöbb beteg kórtörténetében trauma szerepel. A nem enzimatikus zsírnekrózis gyulladásos választ okoz, amelyet számos makrofág, habos citoplazmával, neutrofilekkel és limfociták jelenléte jellemez. Ezt fibrózis követi, és ezt a folyamatot nehéz megkülönböztetni a daganattól.
Üszkösödés(görögből. gangraina- tűz): olyan szövetek nekrózisa, amelyek kommunikálnak a külső környezettel és megváltoznak annak hatására. Vannak száraz, nedves, gázüst és felfekvések.
Száraz gangréna- ez a külső környezettel érintkező szövetek nekrózisa, amely mikroorganizmusok részvétele nélkül megy végbe. A száraz gangréna leggyakrabban a végtagokon fordul elő ischaemiás koagulatív szöveti nekrózis következtében. A nekrotikus szövet feketének, száraznak tűnik, és egyértelműen elhatárolódik a szomszédos életképes szövetektől. Az egészséges szövetek határán demarkációs gyulladás lép fel. A színváltozás annak köszönhető, hogy a hemoglobinogén pigmentek hidrogén-szulfid jelenlétében vas-szulfiddá alakulnak. Ilyen például a száraz gangréna:
- a végtagok érelmeszesedése és artériáinak trombózisa (atheroscleroticus gangréna), az endarteritis eltüntetése;
- fagyási vagy égési sérülésekkel;
- az ujjak Raynaud-kórban vagy vibrációs betegségben;
- tífuszban és más fertőzésekben szenvedő bőr.
Nedves gangréna: súlyos bakteriális fertőzés nekrotikus szövetelváltozásaira rétegződés eredményeként alakul ki. A mikrobiális enzimek hatására másodlagos kollikváció következik be. A nedves gangréna általában a nedvességben gazdag szövetekben alakul ki. Előfordulhat a végtagokon, de gyakrabban a belső szervekben, például a belekben a mesenterialis artériák elzáródásával (trombózis, embólia), a tüdőben tüdőgyulladás szövődményeként (influenza, kanyaró). Legyengült fertőző betegség(általában kanyaró) gyermekeknél kialakulhat az orcák lágy szöveteinek nedves gangrénája, a perineum, amelyet nomának (a görög nome-ból - vízrák) neveznek.
Decubitus (decubitus): egyfajta gangrénaként a felfekvéseket izolálják - a szövetek (bőr, lágy szövetek) nekrózisa hosszan tartó nyomásnak van kitéve. Felfekvések gyakran megjelennek a keresztcsont régiójában, a csigolyák tövisnyúlványai, a nagyobb trochanter combcsont(ágyhoz kötött betegeknél). Eredeténél fogva ez a trofoneurotikus nekrózis, mivel az erek és az idegek összenyomódnak, ami súlyosbítja a szív- és érrendszeri, onkológiai, fertőző vagy idegrendszeri betegségekben szenvedő súlyos betegek szöveti trofikus rendellenességeit.
B. Kollikvációs (nedves) nekrózis
Jellemzője az elhalt szövetek megolvadása. A viszonylag fehérjében szegény, folyadékban gazdag szövetekben fejlődik ki, ahol a hidrolitikus folyamatokhoz kedvező feltételek vannak. A sejtlízis saját enzimjei (autolízis) hatására megy végbe. A nedves kollikvatív nekrózis tipikus példája az agy szürke lágyulásának (ischaemiás infarktus) fókusza.
nekrózis kimenetele.
A nekrózis kedvező következményei:
- lízis;
- szervezet, a nekrózis helyén ilyenkor heg keletkezik (szívinfarktus helyén heg).
- Egységbezárás;
- megkövesedés;
- csontosodás;
- ciszta kialakulása.
A nekrózis káros következményei:
- a nekrózis fókuszának gennyes (szeptikus) olvadása;
- A szekvesztrálás az elhalt szövet területének kialakulása, amely nem esik át autolízisen és szerveződésen. A szekveszterek általában a csontokban fordulnak elő csontvelő-gyulladással - osteomyelitis. Az ilyen szekveszter körül szekvesztrális tok és gennyel töltött üreg keletkezik;
- csonkítás - a nekrotikus szövetek elutasítása.
apoptózis A programozott sejthalál egy olyan folyamat, amelynek során a genetikai programot aktiváló belső vagy külső tényezők sejthalálhoz vezetnek. hatékony eltávolítása szövetből. Morfológiailag az apoptózis egyetlen, véletlenszerűen elrendezett sejtek elpusztulásával jár, amihez kerek, membránnal körülvett testek („apoptotikus testek”) képződnek, amelyeket a környező sejtek azonnal fagocitizálnak.
Ez egy energiafüggő folyamat, amelynek során a nem kívánt és hibás sejteket eltávolítják a szervezetből. Fontos szerepet játszik a morfogenezisben, és a szervek méretének állandó szabályozásának mechanizmusa. Az apoptózis csökkenésével sejtek felhalmozódása következik be, például a tumor növekedése. Az apoptózis növekedésével a szövetben a sejtek számának progresszív csökkenése figyelhető meg, erre példa az atrófia.
Az apoptózis morfológiai megnyilvánulásai
Az apoptotikus sejtek intenzíven eozinofil citoplazma kerek vagy ovális csomóiként jelennek meg, a magkromatin sűrű fragmentumaival. Mivel a sejtkompresszió és az apoptotikus testek képződése gyorsan megy végbe, és gyorsan fagocitizálódnak, szétesnek vagy a szerv lumenébe lökődnek, jelentős súlyossága esetén a szövettani készítményeken megtalálható. Ráadásul az apoptózist - a nekrózissal ellentétben - soha nem kíséri gyulladásos reakció, ami a szövettani kimutatását is megnehezíti.
A nekrózis és az apoptózis összehasonlító jellemzői
|
Indukció |
Fiziológiás vagy kóros ingerek aktiválják |
A károsító tényezőtől függően eltérő |
|
Prevalencia |
egyetlen ketrec |
Sejtcsoport |
|
Biokémiai változások |
Energiafüggő DNS fragmentáció endogén endonukleázok által. |
Az ioncsere megsértése vagy megszüntetése. |
|
DNS bomlás |
Intranukleáris kondenzáció töredékekre való felosztással |
Diffúz lokalizáció nekrotikus sejtben |
|
A sejtmembrán integritása |
Mentett |
Megsértve |
|
Morfológia |
A sejtek zsugorodása és fragmentációja apoptotikus testek képződésével tömörített kromatinnal |
Duzzanat és sejtlízis |
|
Gyulladásos válasz |
Általában ott |
|
|
Elhalt sejtek eltávolítása |
Felszívódás (fagocitózis) a szomszédos sejtek által |
Fagocitózis neutrofilek és makrofágok által |
Rizs. 1. Ultrastrukturális változások sorrendje apoptózis (jobb) és nekrózis (bal) során
1 - normál sejt; 2 - az apoptózis kezdete; 3 - apoptotikus sejt fragmentációja; 4 - apoptotikus testek fagocitózisa a környező sejtek által; 5 - az intracelluláris struktúrák halála a nekrózis során; 6 - a sejtmembrán megsemmisítése.
Az apoptózis a következő fiziológiai és kóros folyamatokban vesz részt:
ü programozott sejtpusztulás az embriogenezis során (beleértve az implantációt, az organogenezist is);
ü a szervek hormonfüggő involúciója felnőtteknél, például az endometrium kilökődése menstruációs ciklus, tüszők atresia a petefészekben menopauzában és az emlőmirigy regressziója a laktáció megszűnése után;
egyes sejtek eltávolítása a sejtpopuláció proliferációja során;
ü az egyes sejtek elpusztulása daganatokban, főként annak regressziója során, de aktívan növekvő daganatban is;
o sejthalál immunrendszer, mind a B-, mind a T-limfociták, a citokinek kimerülése után, valamint az autoreaktív T-sejtek elpusztulása a csecsemőmirigyben történő fejlődés során;
ü parenchymalis szervek kóros sorvadása a kiválasztó utak elzáródása után, amely a hasnyálmirigyben, ill. nyálmirigyek, vesék;
ü citotoxikus T-sejtek hatása által okozott sejthalál, például graft kilökődés és graft-versus-host betegség esetén;
sejtkárosodás egyeseknél vírusos betegségek például mikor vírusos hepatitisz amikor apoptotikus sejtek fragmentumait találják a májban, mint például Kaunsilman testében.
Apoptózis szabályozása
Az apoptózis genetikailag szabályozott sejthalál. Jelenleg számos gént azonosítottak, amelyek az apoptózis szabályozásához szükséges anyagokat kódolják.
Az apoptózis szabályozható:
- külső tényezők,
- autonóm mechanizmusok.
NEKRÓZIS, APOPTOZIS, ATROFIA
A téma relevanciája
A halál mint biológiai fogalom egy szervezet élete visszafordíthatatlan megszűnésének kifejeződése. A halál beálltával az ember holttestté, holttestté (hullává) változik. Jogi szempontból a legtöbb országban egy szervezetet halottnak tekintenek, ha az agyi tevékenység teljes és visszafordíthatatlan leállása következik be. Ugyanakkor a legálisan elhalt szervezetben számos sejt és szövet életképes marad egy ideig a halál után. Ezek a szervek és szövetek jelentik a transzplantáció fő forrását.
Tudni kell, hogy a sejthalál a szervezet élettevékenységének állandó megnyilvánulása és egészséges állapotban a sejtek élettani regenerációja egyensúlyozza ki. Mind a sejtek szerkezeti összetevői, mind az egész sejtek elhasználódnak, elöregednek, elhalnak és cserére szorulnak. A különböző szervek és szövetek egészséges állapotban tartása lehetetlen „természetes” fiziológiai megújulás, következésképpen az egyes sejtek elpusztulása nélkül. Ezt a sejthalált „apoptózisnak” nevezték 1972-ben. Az apoptózis programozott sejthalál. Az apoptózis és számos kóros állapot közötti közvetlen kapcsolat ma már nem kétséges. Számos, az apoptózist szabályozó gén diszfunkciójának vizsgálata teljesen új irányok kidolgozását teszi lehetővé e betegségek kezelésében. Fejlesztés gyógyszerek, amely képes szabályozni az apoptózist, új lehetőségeket nyit meg a rosszindulatú daganatok, vírusfertőzések, egyes idegrendszeri betegségek, immunhiányos és autoimmun betegségek kezelésében. Például rosszindulatú daganatokban és limfoproliferatív betegségekben az apoptózis fokozása, a sejtkárosodással jellemezhető betegségekben pedig annak gyengítése szükséges.
De a sejthalál előfordulhat élő szervezetben külső károsító (patogén) tényezők "erőszakos" fellépése következtében. Ezt a sejthalált nekrózisnak nevezik. Az elhalt sejtek működése teljesen leáll. A sejthalál visszafordíthatatlan biokémiai és szerkezeti változásokkal jár.
És így, sejthalál kétféleképpen történhet: nekrózis és apoptózis. Mivel a nekrózis és az apoptózis biológiai jelei és jelentősége eltérő, ezekkel a folyamatokkal ebben a fejezetben külön foglalkozunk.
A tanulás fő célja – képes felismerni a nekrózis, apoptózis és sorvadás főbb makro- és mikroszkopikus jeleit, elmagyarázni azok okait és fejlődési mechanizmusát, felmérni várható kimenetelüket és meghatározni e folyamatok jelentőségét a szervezet számára.
Miért kell tudnia:
– a nekrózis és apoptózis megkülönböztető morfológiai jeleinek meghatározása mind fény-optikai, mind ultrastrukturális szinten;
- makroszkópos jelekkel diagnosztizálni a koagulációs és koagulációs nekrózis fajtáit;
– a különböző lokalizációjú nekrózis és apoptózis jelentőségének értékelése;
– az atrophia agenesistől, aplasiától és hypoplasiától megkülönböztető morfológiai jellemzőinek meghatározása, jelentőségének felmérése különböző típusok a szerv és az egész szervezet működésének sorvadása.
Hagyományosan a sejthalál vizsgálata a nekrózissal kezdődik, bár az apoptózis minden bizonnyal sokkal gyakoribb, mivel kíséri és néha szabályozza a szervezet általános kóros és élettani folyamatait.
Elhalás(görögből. necros- elhalt) - nekrózis, sejtek és szövetek halála élő szervezetben patogén tényezők hatására. Az ilyen típusú sejthalál genetikailag nem szabályozott.
a nekrózis okai. A nekrózist okozó tényezők:
-fizikai(lőtt seb, sugárzás, elektromosság, alacsony és magas hőmérséklet - fagyás és égési sérülések);
-mérgező(savak, lúgok, nehézfémek sói, enzimek, gyógyszerek, etil-alkohol stb.);
-biológiai(baktériumok, vírusok, protozoonok stb.);
-allergiás ( endo- és exoantigének, például fibrinoid nekrózis fertőző-allergiás és autoimmun betegségekben, Arthus-jelenség);
-ér-(szívroham - vaszkuláris nekrózis);
-trofeurótikus(nyomásfekélyek, nem gyógyuló fekélyek).
A patogén faktor hatásmechanizmusától függően a következők:
-közvetlen nekrózis, a faktor közvetlen hatása miatt (traumás, toxikus és biológiai nekrózis),
-indirekt nekrózis amely közvetve az érrendszeren és a neuro-endokrin rendszeren keresztül fordul elő (allergiás, vaszkuláris és trofoneurotikus nekrózis).
A nekrózis morfológiai jelei
A nekrózist a necrobiosis időszaka előzi meg, melynek morfológiai szubsztrátja a disztróf elváltozások.
V. Korai változások: A necrobiosis kezdeti időszakában a sejt morfológiailag változatlan. 1-3 órának kell eltelnie, amíg elektronmikroszkóppal vagy hisztokémiailag felismerhető változások következnek be, és legalább 6-8 órának a fénymikroszkóppal észlelhető elváltozások megjelenéséig; makroszkópos változások még később alakulnak ki. Például, ha egy szívinfarktuson átesett beteg néhány perccel az anginás roham (a szívizomba való elégtelen véráramlással járó fájdalom) kezdete után meghal, akkor a boncolás nem fogja feltárni a nekrózis szerkezeti bizonyítékát; ha a halál az akut roham utáni 2. napon következik be, akkor a változások nyilvánvalóak lesznek.
B. Hisztokémiai változások: a kalciumionok beáramlása a sejtbe szorosan összefügg a visszafordíthatatlan károsodással és a nekrózis morfológiai jeleinek megjelenésével. Normál sejtben az intracelluláris kalciumkoncentráció körülbelül 0,001-e az extracelluláris folyadékban lévő koncentrációjának. Ezt a gradienst a sejtmembrán tartja fenn, amely aktívan szállítja ki a kalciumionokat a sejtből. Kísérletileg bebizonyosodott, hogy ha a sejtek ischaemia következtében vagy különböző toxikus szerek hatására károsodnak, a sejteken belüli kalcium felhalmozódás csak akkor figyelhető meg, ha a változások visszafordíthatatlanok. A kalcium aktiválja az endonukleázokat (hidrolízis, DNS hasítás), a foszfolipázokat (membránpusztulás) és a proteázokat (a citoszkeleton roncsolása, emésztése). Aktivitásuk növekedését hisztokémiai módszerekkel mutatják ki. A redox enzimek (például a szukcinát-dehidrogenáz) aktivitása meredeken csökken vagy eltűnik.
B. Kernel változásai: a sejtnekrózis egyik fontos és nyilvánvaló morfológiai jele a sejtmag szerkezetének megváltozása. Az elhalt sejt kromatinja nagy csomókká kondenzálódik. A mag térfogata csökken, ráncossá, sűrűvé válik, intenzíven bazofil, vagyis hematoxilinnel sötétkékre fest. Ezt a folyamatot kariopiknózisnak (ráncosodásnak) nevezik. A piknotikus mag ezután számos kis bazofil részecskére szakadhat (kariorrhexis), vagy lízisen (feloldódáson) megy keresztül a lizoszómális dezoxiribonukleáz hatására (kariolízis). Ezután megnövekszik a térfogata, gyengén hematoxilinnel festődik, a mag körvonalai fokozatosan elvesznek. Gyorsan fejlődő nekrózis esetén a sejtmag piknotikus stádium nélkül lízisen megy keresztül.
D. Citoplazmatikus változások: körülbelül 6 órával azután, hogy a sejt nekrózison ment keresztül, a citoplazmája homogénné válik, és kifejezetten acidofil lesz, azaz intenzíven savas festékekkel festődik, például eozinnal festve rózsaszínre. Ez az első fénymikroszkóppal kimutatott változás, amely a citoplazmatikus fehérjék koagulációja és a riboszómák pusztulása (eltűnése) eredményeként következik be. A riboszóma RNS bazofil árnyalatot kölcsönöz a normál citoplazmának. A speciális sejtszervecskék, például a szívizomsejtekben található myofibrillumok tűnnek el először. A mitokondriumok duzzanata és az organellummembránok pusztulása (pusztulása) a citoplazma vakuolizációját okozza. Végül a sejt emésztése a saját lizoszómáiból felszabaduló enzimekkel sejtlízist (autolízist) okoz. Így a fehérjék koagulációja a citoplazmában megy végbe, amit általában kollikvációjuk vált fel.
D. Változások az intercelluláris anyagban kiterjed mind az intersticiális anyagra, mind a rostos struktúrákra. Leggyakrabban a fibrinoid nekrózisra jellemző elváltozások alakulnak ki: a kollagén-, rugalmas- és retikulinrostok sűrű, homogén rózsaszínű, esetenként bazofil tömegekké alakulnak át, amelyek fragmentálódáson, csomós bomláson, lízisen mennek keresztül. Ritkábban rostos struktúrák ödémája, lízise és nyálka is megfigyelhető, ami a colliquat nekrózisra jellemző.
A nekrózis klinikai és morfológiai formái
A nekrózist különböző klinikai és morfológiai változások manifesztálják. Az eltérések a szervek és szövetek szerkezeti és funkcionális jellemzőitől, a nekrózis gyakoriságától és típusától, valamint előfordulásának okaitól és fejlődési körülményeitől függenek. A nekrózis klinikai és morfológiai formái közül megkülönböztetik a koagulációs (száraz) nekrózist és a kollikvációs (nedves) nekrózist.
Koagulatív (száraz) nekrózis
Az ilyen típusú nekrózis esetén az elhalt sejtek több napig megtartják alakjukat. A sejtmag nélküli sejtek koagulált, homogén, rózsaszínű citoplazma tömegeként jelennek meg.
A koagulatív nekrózis mechanizmusa nem teljesen ismert. A citoplazmatikus fehérjék koagulációja ellenállóvá teszi őket a lizoszómális enzimek hatásával szemben, és ennek következtében cseppfolyósodásuk lelassul.
A véralvadási nekrózis általában fehérjében gazdag és folyadékban szegény szervekben fordul elő, mint a vese, szívizom, mellékvese, lép, általában az elégtelen keringés és az anoxia, fizikai, kémiai és egyéb károsító tényezők hatására, pl. májsejtek koagulációs nekrózisa (6.1. ábra) vírusfertőzéssel vagy bakteriális és nem bakteriális eredetű toxikus ágensek hatására. A koagulációs nekrózist száraznak is nevezik, mivel az jellemzi, hogy az elhalt területek szárazak, sűrűek, omladozóak, fehérek vagy sárgák.
A koagulációs nekrózis magában foglalja:
Egy szívroham- a belső szervek (az agy kivételével) egyfajta vaszkuláris (ischaemiás) nekrózisa. Ez a nekrózis leggyakoribb típusa.
B. Caseous (túrós) nekrózis tuberkulózis, szifilisz, lepra, valamint limfogranulomatózis esetén alakul ki. Specifikusnak is nevezik, mivel leggyakrabban specifikus fertőző granulomákban található meg. A belső szervekben fehéres-sárga szövet száraz, omladozó korlátozott területe látható. A szifilitikus granulomákban az ilyen területek nagyon gyakran nem morzsalékosak, hanem pépesek, emlékeztetnek az arab ragasztóra. Ez egy vegyes (azaz extra- és intracelluláris) típusú nekrózis, amelyben a parenchyma és a stroma (a sejtek és a rostok egyaránt) egyszerre hal el. Mikroszkóposan egy ilyen szövetterület szerkezet nélküli, homogén, hematoxilinnel és eozinnal festett rózsaszínűnek tűnik, jól láthatóak a magkromatin csomói (kariorrhexis).
B. Waxy vagy Zenker nekrózis(izomnekrózis, gyakran az elülső hasfal és a comb adductor izmai, súlyos fertőzésekkel - tífusz és tífusz, kolera);
D. Fibrinoid nekrózis- fibrinoid duzzanat eredményeként kialakuló kötőszöveti nekrózis típusa. A fibrinoid nekrózist allergiás és autoimmun betegségekben (pl. reuma, rheumatoid arthritis és szisztémás lupus erythematosus) észlelik. A legsúlyosabban a kollagénrostok és az erek középső membránjának simaizomzata károsodik. Malignus hypertoniában az arteriolák fibrinoid nekrózisa figyelhető meg. Ezt a nekrózist a normál kollagénrostszerkezet elvesztése és egy homogén, élénk rózsaszínű nekrotikus anyag felhalmozódása jellemzi, amely mikroszkopikusan utánozza a fibrint. Vegye figyelembe, hogy a „fibrinoid” különbözik a „fibrinoidtól”, mivel az utóbbi a fibrin felhalmozódására utal, például a véralvadásban vagy a gyulladásban. A fibrinoid nekrózis területei változó mennyiségű immunglobulint és komplementet, albumint, kollagén és fibrin bomlástermékeket tartalmaznak.
D. Zsírnekrózis:
1. Enzimatikus zsírelhalás: A zsírelhalás leggyakrabban akut hasnyálmirigy-gyulladás és hasnyálmirigy-sérülés esetén fordul elő, amikor a hasnyálmirigy enzimek a csatornákból a környező szövetekbe szivárognak. A hasnyálmirigy-lipáz a zsírsejtekben lévő trigliceridekre hat, glicerinre és zsírsavakra bontja azokat, amelyek a plazma kalcium-ionjaival kölcsönhatásba lépve kalcium-szappanokat képeznek. Ugyanakkor a hasnyálmirigyet körülvevő zsírszövetben átlátszatlan, fehér (mint kréta) plakkok és csomók (steatonecrosis) jelennek meg.
Hasnyálmirigy-gyulladás esetén a lipáz bejuthat a véráramba, majd széles körben eloszlik, ami a test számos részén zsírelhalást okoz. A leggyakrabban károsodott bőr alatti zsír és csontvelő.
2. Nem enzimatikus zsírelhalás: nem enzimatikus zsírelhalás figyelhető meg az emlőmirigyben, a bőr alatti zsírszövetben és a hasüregben. A legtöbb beteg kórtörténetében trauma szerepel. A nem enzimatikus zsírnekrózist traumás zsírnekrózisnak is nevezik, még akkor is, ha a traumát nem azonosítják a kiváltó okként. A nem enzimatikus zsírnekrózis gyulladásos választ okoz, amelyet számos makrofág, habos citoplazmával, neutrofilekkel és limfociták jelenléte jellemez. Ezt fibrózis követi, és ezt a folyamatot nehéz megkülönböztetni a daganattól.
E. Gangréna(görögből. gangraina- tűz): olyan szövetek nekrózisa, amelyek kommunikálnak a külső környezettel és megváltoznak annak hatására. A „gangréna” kifejezést széles körben használják olyan klinikai és morfológiai állapotok megjelölésére, amelyekben a szöveti nekrózist gyakran bonyolítja egy változó súlyosságú másodlagos bakteriális fertőzés, vagy a külső környezettel érintkezve másodlagos változásokon megy keresztül. Vannak száraz, nedves, gázüst és felfekvések.
1. Száraz gangréna- ez a külső környezettel érintkező szövetek nekrózisa, amely mikroorganizmusok részvétele nélkül megy végbe. A száraz gangréna leggyakrabban a végtagokon fordul elő ischaemiás koagulatív szöveti nekrózis következtében. A nekrotikus szövet feketének, száraznak tűnik, és egyértelműen elhatárolódik a szomszédos életképes szövetektől. Az egészséges szövetek határán demarkációs gyulladás lép fel. A színváltozás annak köszönhető, hogy a hemoglobinogén pigmentek hidrogén-szulfid jelenlétében vas-szulfiddá alakulnak. Ilyen például a száraz gangréna:
A végtagok érelmeszesedése és artériáinak trombózisa (atheroscleroticus gangréna), az endarteritis eltüntetése;
Fagyás vagy égési sérülés esetén;
Raynaud-kórban vagy vibrációs betegségben szenvedő ujjak;
Tífuszban és egyéb fertőzésekben szenvedő bőr.
A kezelés az elhalt szövetek sebészi eltávolításából áll, a demarkációs vonal iránymutatóként szolgál.
2. Nedves gangréna: súlyos bakteriális fertőzés nekrotikus szövetelváltozásaira rétegződés eredményeként alakul ki. A mikrobiális enzimek hatására másodlagos kollikváció következik be. Heterolízisnek nevezzük a nem a sejtben képződő, hanem kívülről behatoló enzimek általi sejtlízist. A mikroorganizmusok típusa a gangréna lokalizációjától függ. A nedves gangréna általában a nedvességben gazdag szövetekben alakul ki. Előfordulhat a végtagokon, de gyakrabban a belső szervekben, például a belekben a mesenterialis artériák elzáródásával (trombózis, embólia), a tüdőben tüdőgyulladás szövődményeként (influenza, kanyaró). Fertőző betegség (általában kanyaró) által legyengült gyermekeknél az orcák lágy szöveteiben, a perineumban nedves gangrén alakulhat ki, amelyet nomának (a görög nome - vízrákból) neveznek. Az akut gyulladás és a baktériumok szaporodása következtében a nekrotikus terület ödémássá és vöröses-feketévé válik, az elhalt szövetek kiterjedt elfolyósodásával. Nedves gangrénában terjedő nekrotizáló gyulladás léphet fel, amely nem határol el egyértelműen a szomszédos egészséges szövetektől, ezért műtétileg nehezen kezelhető. A baktériumok létfontosságú tevékenysége következtében sajátos szag keletkezik. Nagyon magas halálozási arány.
3. Gáz gangréna: gázgangréna akkor fordul elő, ha a sebet anaerob flóra fertőzi meg, pl. Clostridium perfringensés ebbe a csoportba tartozó más mikroorganizmusok. A bakteriális enzimaktivitás következtében kiterjedt szöveti nekrózis és gázképződés jellemzi. A fő megnyilvánulások hasonlóak a nedves gangrénához, de további gáz jelenléte van a szövetekben. Crepitus (reccsenő érzés tapintásra) - gyakori klinikai tünet nál nél gáz gangréna. A halálozási arány is nagyon magas.
4. Decubitus (decubitus): egyfajta gangrénaként a felfekvéseket izolálják - a test felszíni részeinek (bőr, lágyszövetek) nekrózisa, amelyek az ágy és a csont közötti összenyomásnak vannak kitéve. Ezért a felfekvések gyakran megjelennek a keresztcsont régiójában, a csigolyák tövisnyúlványaiban és a combcsont nagyobb trochanterében. Eredeténél fogva ez a trofoneurotikus nekrózis, mivel az erek és az idegek összenyomódnak, ami súlyosbítja a szív- és érrendszeri, onkológiai, fertőző vagy idegrendszeri betegségekben szenvedő súlyos betegek szöveti trofikus rendellenességeit.
Kollikvációs (nedves) nekrózis
A kollikvációs (nedves) nekrózist az elhalt szövetek összeolvadása jellemzi. A viszonylag fehérjében szegény, folyadékban gazdag szövetekben fejlődik ki, ahol a hidrolitikus folyamatokhoz kedvező feltételek vannak. A sejtlízis saját enzimjei (autolízis) hatására megy végbe. A nedves kollikvatív nekrózis tipikus példája az agy szürke lágyulásának (ischaemiás infarktus) fókusza.
Az agyi infarktust gyakran lágyulásnak nevezik, mivel a fő makroszkopikus jel az agyszövet rugalmasságának mindenkori csökkenése a lézióban. Az első napon egy elmosódottan korlátozott, cianotikus árnyalatú, puha tapintású terület képviseli. Az első nap végére a fókusz tisztábbá válik és elsápad. A következő napokban ezen a területen az agy anyaga még petyhüdtebbé válik, sárgás színű, néha még zöldes árnyalattal is. Az első hetekben az agy térfogata kissé megnő az ödéma miatt. 1-1,5 hónap után. az infarktus helyén meglehetősen világosan meghatározott üreg képződik, amely tartalmazza zavaros folyadékés törmelék. A szívinfarktus pontos időpontjának meghatározása nagyon nehéz, nem csak megjelenésben, hanem szövettani képben is.
Mikroszkóposan az agyszövet homogén, szerkezet nélküli, hematoxilinnel és eozinnal festve enyhén rózsaszín színű. Az elhalt szövetek reszorpcióját makrofágok végzik, amelyek úgy néznek ki, mint a zsírszemcsés golyók.
A nekrózis klinikai megnyilvánulásai
Szisztémás megnyilvánulások: nekrózis esetén általában láz jelentkezik (a pirogén anyagok nekrotikus sejtekből és szövetekből való felszabadulása miatt) és neutrofil leukocitózis (akut gyulladásos reakció jelenléte miatt - demarkációs gyulladás). Nekrotikus sejttartalom felszabadulása: A nekrotikus sejtek citoplazmatartalmának felszabaduló komponensei (pl. enzimek) a véráramba kerülnek, ahol jelenlétük diagnosztikus a nekrózis lokalizációjára. Ezek az enzimek különféle laboratóriumi módszerekkel kimutathatók (6.1. táblázat). Az enzimek megjelenésének specifitása az enzim túlnyomó lokalizációjától függ a test különböző szöveteiben; például a kreatin-kináz MB izoenzim szintjének emelkedése jellemző a szívizom nekrózisára, mivel ez az enzim csak a szívizomsejtekben található meg. Az aszpartát-aminotranszferáz (AST) szintjének növekedése kevésbé specifikus, mivel ez az enzim nemcsak a szívizomban, hanem a májban és más szövetekben is megtalálható. A transzaminázok megjelenése a májsejt-nekrózisra jellemző.
Helyi megnyilvánulások: A gyomor-bél traktus nyálkahártyájának fekélyesedését vérzés vagy vérzés bonyolíthatja (például vérző peptikus fekély). Az ödéma következtében fellépő szövettérfogat-növekedés súlyos nyomásnövekedést okozhat zárt térben (például a koponyaüregben ischaemiás vagy vérzéses nekrózissal).
Működési károsodás: a nekrózis a szerv funkcionális elégtelenségéhez vezet, például akut szívelégtelenség kialakulása a szívizom kiterjedt nekrózisa (infarktusa) következtében (akut ischaemiás betegség szívek). A klinikai megnyilvánulások súlyossága az érintett szövet típusától, összmennyiségéhez viszonyított térfogatától, valamint a fennmaradó élő szövet funkcióinak megőrzésétől függ. Az egyik vese nekrózisa nem okoz veseelégtelenséget, még akkor sem, ha az egész vese elveszett, mert a másik vese képes kompenzálni a veszteséget. Az agykéreg megfelelő szakaszának kis területének nekrózisa azonban a megfelelő izomcsoport bénulásához vezet.
nekrózis kimenetele. A nekrózis visszafordíthatatlan folyamat. Viszonylag kedvező eredménnyel az elhalt szövet körül reaktív gyulladás lép fel, amely az elhalt szövetet körülhatárolja. Az ilyen gyulladást demarkációnak, a demarkációs zónát demarkációs zónának nevezik. Ebben a zónában véredény kitágul, rengeteg, ödéma jelenik meg, nagyszámú leukocita jelenik meg, amelyek hidrolitikus enzimeket szabadítanak fel és nekrotikus tömegeket olvasztanak. A nekrotikus tömegeket a makrofágok szívják fel. Ezt követően a kötőszövet sejtjei szaporodnak, ami helyettesíti vagy túlnői a nekrózis területét. Amikor az elhalt tömegeket kötőszövettel helyettesítik, a szervezetükről beszélnek. A nekrózis helyén ilyen esetekben heg képződik (szívroham helyén heg). A nekrózis területének elszennyeződése kötőszöveti kapszulázásához vezet. A kalciumsók a száraz nekrózis során holt tömegben és a szerveződésen átesett nekrózis középpontjában rakódnak le. Ebben az esetben a nekrózis fókuszának meszesedése (kövesedés) alakul ki. Egyes esetekben a nekrózis területén csontképződés figyelhető meg - csontosodás. A szöveti törmelék felszívódásával és a kapszula képződésével, amely általában nedves nekrózissal és leggyakrabban az agyban fordul elő, a nekrózis helyén üreg-ciszta jelenik meg.
A nekrózis kedvezőtlen következménye a nekrózis fókuszának gennyes (szeptikus) olvadása. A szekvesztrálás az elhalt szövet olyan területének kialakulása, amely nem megy át autolízisen, nem helyettesíti kötőszövettel, és szabadon helyezkedik el az élő szövetek között. A szekveszterek általában a csontokban fordulnak elő csontvelő-gyulladással - osteomyelitis. Az ilyen szekveszter körül szekvesztrális tok és gennyel töltött üreg képződik. Gyakran a szekveszter sipolyokon keresztül hagy egy üreget, amelyet csak a teljes kiosztás után zárnak be. Az ujjvégek egyfajta lefoglalása - megcsonkítása - elutasítása.
A nekrózis jelentése. Lényege - a „helyi halál” és az ilyen zónák kizárása a funkcióból - határozza meg, ezért a létfontosságú szervek, különösen nagy területeinek nekrózisa gyakran halálhoz vezet. Ilyenek a szívinfarktusok, az agy ischaemiás nekrózisa, a vesék kérgi anyagának nekrózisa, progresszív májelhalás, akut hasnyálmirigy-gyulladás, amelyet hasnyálmirigy-elhalás bonyolít. A szöveti nekrózis gyakran számos betegség súlyos szövődményeinek okozója (szívrepedés myomalacia esetén, bénulás vérzéses és ischaemiás stroke esetén, fertőzések masszív felfekvések esetén, mérgezés a szöveti bomlástermékek testének való kitettsége miatt, például a gangréna miatt). végtag stb.). Klinikai megnyilvánulások a nekrózis nagyon változatos lehet. Az agy vagy a szívizom nekrózisos területein fellépő kóros elektromos aktivitás epilepsziás rohamokhoz vagy szívritmuszavarokhoz vezethet. A perisztaltika megsértése a nekrotikus bélben funkcionális (dinamikus) bélelzáródást okozhat. Gyakran megfigyelhető vérzés a nekrotikus szövetben, például hemoptysis (hemoptysis) tüdőnekrózissal.
A sejthalál a szervezetben kétféleképpen fordulhat elő: nekrózis és apoptózis. Az apoptózis a sejthalál egy fajtája, amelyben a sejt maga is aktívan részt vesz a halálának folyamatában, azaz. a sejt önmagát elpusztítja. Az apoptózis a nekrózistól eltérően aktív folyamat, etiológiai tényezők hatására genetikailag programozott reakciókaszkád indul be, amelyet bizonyos gének aktiválása, fehérjék, enzimek szintézise kísér, ami a sejt hatékony és gyors eltávolításához vezet. a szövetből.
Az apoptózis okai:
1. Az embriogenezis során az apoptózis fontos szerepet játszik a különböző szöveti primordiumok elpusztításában és a szervek kialakulásában.
2. Az apoptózis olyan öregedő sejteken megy keresztül, amelyek befejezték fejlődési ciklusukat, például limfocitákon, amelyek kimerítették citokinkészletüket.
3. A növekvő szövetekben a leánysejtek egy bizonyos része apoptózison megy keresztül. A haldokló sejtek százalékos aránya szisztémás és helyi hormonokkal szabályozható.
4. Az apoptózis oka lehet a károsító tényezők gyenge hatása, amely nagyobb intenzitás esetén nekrózishoz vezethet (hipoxia, ionizáló sugárzás, toxinok, stb.)
Apoptózis patogenezise:
Egy sejt apoptózison megy keresztül, ha olyan DNS-károsodás lép fel a sejtmagban, amelyet a javítórendszer nem képes helyrehozni. Ezt a folyamatot a p53 gén által kódolt fehérje figyeli. Ha a p53 fehérje hatására a DNS-hibát nem lehet megszüntetni, akkor az apoptózis program aktiválódik.
Sok sejtnek vannak receptorai, amelyek hatására az apoptózis aktiválódik. A legjobban tanulmányozott a limfocitákon található Fas-receptor és a számos sejten megtalálható tumornekrózis-faktor-alfa (TNF-α) receptor. Ezek a receptorok fontos szerepet játszanak az autoreaktív limfociták eltávolításában és a sejtpopuláció méretállandóságának visszacsatolásos szabályozásában.
Különféle metabolitok és hormonok aktiválhatják az apoptózist: gyulladásgátló citokinek, szteroid hormonok, nitrogén-monoxid (NO) és szabad gyökök.
A sejtapoptózis akkor aktiválódik, ha a szövetekben oxigénhiány van. Aktiválásának oka lehet a szabad gyökök hatása, a DNS-javítás energiafüggő folyamatainak megzavarása stb.
Az apoptózis olyan sejteken megy keresztül, amelyek elvesztették a kapcsolatot az intercelluláris mátrixszal, az alapmembránnal vagy a szomszédos sejtekkel. Az apoptózis ezen mechanizmusának elvesztése a tumorsejtekben a metasztázis képességének megjelenéséhez vezet.
Egyes vírusfehérjék aktiválhatják a sejt apoptózisát, miután a vírus önmagában összeáll a fertőzött sejtben. Az apoptotikus testek szomszédos sejtek általi felszívódása vírusfertőzéshez vezet. Az AIDS-vírus aktiválhatja a nem fertőzött sejtek apoptózisát is, amelyek felületén CD4 receptor található.
Vannak olyan tényezők is, amelyek megakadályozzák az apoptózist. Számos metabolit és hormon, mint például a nemi hormonok és a gyulladást elősegítő citokinek, lelassíthatják az apoptózist. Az apoptózist drámaian lelassíthatják a sejthalál mechanizmusának hibái, például a p53 gén mutációja vagy az apoptózist gátló gének aktiválása (bcl-2). Sok vírus képes gátolni az apoptózist, miután saját DNS-ét integrálja a sejtgenomba a saját szerkezeti fehérjéinek szintézisének időszakára.
Az apoptózis morfológiai megnyilvánulásai
ELHALÁS
A nekrózis egy visszafordíthatatlan folyamat, amelyet az élő szervezet egyes sejtjeinek, szerveinek és szöveteinek elpusztulása jellemez. A kóros állapotok nekrózisa különféle betegségekben figyelhető meg, és ennek a folyamatnak az általános mintázatainak, morfológiai és klinikai jeleinek ismerete segít a nekrózis folyamatával fellépő betegségek diagnosztizálásában és kezelésében, ezért különféle szakterületek képviselői foglalkoznak a nekrózis tanulmányozása. Fő célja ezen folyamatok irányításának képessége, olyan eszközök felkutatása, amelyek lehetővé tennék a sejtek, szövetek, szervek fokozatos pusztulását saját enzimeik hatására. Ezért természetesen különös érdeklődésre tart számot a nekrózis morfo- és patogenezisének, valamint a genotípusos jellemzők által programozott sejthalálnak fiziológiás körülmények között (apoptózis) történő vizsgálata, különös tekintettel a kezdeti változásokra és a leginkább. korai szakaszaiban. Ezért a nekrózis és apoptózis különböző szintű tanulmányozása távlatokat nyit a haldoklás folyamatainak mélyebb megismerésére. Ugyanakkor fontos látni a nekrózis okait, megnyilvánulási mechanizmusait, kimenetelét, valamint sajátosságait a szervek, szövetek, sejtek szerkezeti és funkcionális sajátosságaitól, valamint a makroorganizmus egyedi jellemzőitől függően.
Terminológia
Gangréna (gangraina - tűz) - a külső környezettel érintkező szövetek nekrózisa.
Szívinfarktus (infarcire - tömni) - belső szervek szöveti nekrózisa (1), szövetelhalás, amely a vérkeringés megzavarásakor jelentkezik (2). A nekrózis egy fajtája, amely akut keringési rendellenességekben (trombózis, embólia, elhúzódó érgörcs) alakul ki funkcionális terminális erekkel rendelkező szervekben (azaz érelhalás). A belső szervek elhalt szöveteinek makroszkóposan látható területe (3).
Marantic necrosis - felfekvés alultáplált betegeknél, idős embereknél, cachexia és őrültség tüneteivel.
Myomalacia (malakas - puha) - az elhalt szövetek olvadása.
Mumifikáció (mumificatio - szárítás) - szárítás, elhalt szövetek tömörítése.
Noma (nome - "vízrák") - az arc lágy szöveteinek nedves gangrénája gyermekeknél.
Nekrózis (nekros - elhalt) - nekrózis, sejtek és szövetek elhalása élő szervezetben.
Necrobiosis (nekros - halott, bios - élet) - nekrózist megelőző változások, reverzibilis disztrófiás folyamatok. lassú haldoklási folyamat.
Sequestrum (sequestrum) - az elhalt szövetek olyan része, amely nincs kitéve autolízisnek, nem helyettesíti kötőszövet, és szabadon helyezkedik el az élő szövetek között.
Elasztolízis - duzzanat, szétesés, rugalmas rostok olvadása.
HALÁL
Halál mint biológiai fogalom a szervezet élete visszafordíthatatlan megszűnésének kifejeződése. A halál beálltával az ember holttestté, holttestté változik (hulla).
VAL VEL jogi szempontból a legtöbb országban egy szervezet akkor tekinthető halottnak, ha az agyi tevékenység teljes és visszafordíthatatlan leáll .
Ugyanakkor a legálisan elhalt szervezetben számos sejt és szövet életképes marad egy ideig a halál után.
Ezek a szervek és szövetek jelentik az átültetésre szánt szervek fő forrását.
NEKRÓZIS (HELYI HALÁL)
Tudni kell, hogy a sejthalál a szervezet élettevékenységének állandó megnyilvánulása és egészséges állapotban a sejtek élettani regenerációja egyensúlyozza ki. Mind a sejtek szerkezeti összetevői, mind az egész sejtek elhasználódnak, elöregednek, elhalnak és cserére szorulnak. A különböző szervek és szövetek egészséges állapotban tartása lehetetlen „természetes” fiziológiai megújulás, következésképpen az egyes sejtek elpusztulása nélkül. Ezt a sejthalálnak nevezték 1972-ben apoptózis". Apoptózis - programozott sejthalál. . De a sejthalál előfordulhat élő szervezetben külső károsító (patogén) tényezők „erőszakos” fellépése következtében. Ezt a sejthalált nevezik "elhalás". Az elhalt sejtek működése teljesen leáll. A sejthalál visszafordíthatatlan biokémiai és szerkezeti változásokkal jár.
Apoptózis - sejthalál a sejtek előzetes visszafordíthatatlan károsodása nélkül, de egy genetikai program beépítése következtében, amely előre meghatározza a halálukat, 1964-ben programozott sejthalálnak nevezték. Programozott sejthalálról akkor beszélünk, ha a fejlődés, növekedés és túlélés során szövetek, valamint a morfogenezis során kialakuló struktúrák felépítése során szükségessé válik egyes sejtek (beleértve a károsodott, életciklusukat befejezett) megszabadulása. Paradox helyzet áll elő: egy sejt feláldozza életét, öngyilkosságot követ el az egész - szövet, szerv, szervezet - megőrzése érdekében. Így a programozott sejthalál biológiai jelentősége az élet fenntartásában rejlik. A programozott sejthalál szerves része olyan biológiai folyamatoknak, mint embrionális fejlődés, élőlények morfogenezise és metamorfózisa. BAN BEN többsejtű élőlények a programozott sejthalál és a mitózis közötti egyensúly biztosítja a szöveti homeosztázist.
A „programozott sejthalál” és „apoptózis” kifejezések nem szinonimák. A „programozott sejthalál” kifejezést a szakirodalom a szó szűk és tágabb értelmében is használja.
Szűk értelemben a programozott sejthalál ellentétes az apoptózissal, mivel az előbbi normálisan a szervezet fejlődése során és a szöveti homeosztázis fenntartása közben következik be. Ugyanakkor a patológia körülményei között apoptózis - sejt-öngyilkosság - alakul ki.
Tágabb értelemben a „programozott sejthalál” fogalma nemcsak az apoptózis általi sejthalált jelenti, hanem a sejthalál számos más típusát is: vakuoláris vagy autofágiás, atrófiás halált, valamint a sejt terminális differenciálódását követő halált. .
És így, sejthalál kétféleképpen történhet: nekrózis és apoptózis. Mivel a biológiai jelek, valamint a nekrózis és apoptózis jelentősége jelentősen eltér egymástól, ezeket a folyamatokat külön-külön vizsgáljuk.
Elhalás(görögből. necros- elhalt) - nekrózis, sejtek és szövetek halála élő szervezetben patogén tényezők hatására. Ez a fajta sejthalál nem genetikailag szabályozott.
A nekrózis okai. A nekrózist okozó tényezők:
- fizikai (lőtt seb, sugárzás, elektromosság, alacsony és magas hőmérséklet - fagyás és égési sérülések);
- mérgező (savak, lúgok, nehézfémek sói, enzimek, gyógyszerek, etil-alkohol stb.);
- biológiai (baktériumok, vírusok, protozoonok stb.);
- allergiás (endo- és exoantigének, például fibrinoid nekrózis fertőző-allergiás és autoimmun betegségekben, Arthus-jelenség);
- ér- (szívroham - vaszkuláris nekrózis);
- trofeurótikus (nyomásfekélyek, nem gyógyuló fekélyek).
Attól függően, hogy a a patogén faktor hatásmechanizmusa megkülönböztetni:
- közvetlen nekrózis, a faktor közvetlen hatása miatt (traumás, toxikus és biológiai nekrózis),
- indirekt nekrózis amely közvetve az érrendszeren és a neuro-endokrin rendszeren keresztül fordul elő (allergiás, vaszkuláris és trofoneurotikus nekrózis).
A nekrózis etiológiai típusai:
1. Traumás - fizikai és kémiai tényezők hatására következik be.
2. Mérgező - bakteriális és egyéb természetű toxinok hatására fordul elő.
3. Trophoneurotic - a mikrocirkuláció és a szöveti beidegzés károsodásával jár.
4. Allergiás - immunpatológiai reakciókkal alakul ki.
5. Vaszkuláris - egy szerv vagy szövet vérellátásának zavarával jár.
A nekrózis mechanizmusai
A nekrózis mechanizmusai eltérnek az autolízis mechanizmusaitól, változatosak, nagymértékben függenek a károsító faktor természetétől, valamint azon sejtek, szövetek és szervek szerkezeti és funkcionális jellemzőitől, amelyekben a nekrózis kialakul. A nekrózis összes patogenetikai mechanizmusának végeredménye az intracelluláris káosz kialakulása. A nekrózis patogenetikai útjainak sokféleségéből valószínűleg az öt legjelentősebbet különböztetjük meg: 1) sejtfehérjék kötődése az ubiquitinhez, 2) ATP-hiány, 3) reaktív oxigénfajták képződése, 4) a kalcium homeosztázis zavara és 5) a sejtmembránok szelektív permeabilitásának elvesztése.
• Az ubiquitin, az egyik legkonzerváltabb fehérje, a proteaszómák részeként kovalens kötéseket képez más fehérjék polipeptidláncainak lizin-maradékaival. Az ubiquitin szintézise, valamint a hősokk-fehérje családból származó fehérjék különböző károsodásokat potencíroznak. Tehát az Alzheimer-kór és a Parkinson-kór központi idegrendszerének sejtjeiben, valamint az alkoholos májkárosodásban szenvedő hepatocitákban proteoszómák találhatók - fehérjék komplexei ubiquitinnel. Az ilyen komplexeket a májsejtekben régóta Mallory testekként ismerik.
• Az elhaló sejtekben folyamatosan ATP-hiány található. Sokáig azt hitték, hogy a kardiomiociták nekrózisának fő oka az ischaemia során a makroerg vegyületek képződésének egy bizonyos szintre történő csökkenése. Az elmúlt években kimutatták, hogy más mechanizmusok is szerepet játszanak az ischaemiás sérülésben. Tehát, ha az ischaemiás szívizom reperfúziónak van kitéve, akkor a nekrotikus változások sokkal gyorsabban és nagy léptékben fordulnak elő. A leírt elváltozásokat reperfúziós sérüléseknek nevezték. Kalciumgátlók (pl. klórpromazin) és antioxidánsok alkalmazása ellenére alacsony szint Az ATP csökkenti a reperfúziós károsodást, ami azt jelzi, hogy az ATP-hiány önmagában nem elegendő a nekrózis kialakulásához.
• Az élő sejtekben folyamatosan képződnek reaktív oxigénfajták (szingulett oxigén, szuperoxid anion gyök, hidroxil anion, hidrogén-peroxid stb.). A membrán lipidekkel, DNS molekulákkal kölcsönhatásba lépve, oxidatív stresszt okozva, a reaktív oxigénfajták növelik a membrán permeabilitását, gátolják a kationpumpákat, fokozzák az ATP hiányt és a felesleges intracelluláris kalciumot, ami sejt- és szövetkárosodás kialakulásához vezet. Legmagasabb érték reaktív oxigénfajták játszanak szerepet a pneumocita nekrózis patogenezisében újszülöttkori distressz szindrómában, amely oxigénterápia, szívinfarktusban bekövetkezett reperfúziós sérülések, valamint paracetamol túladagolással járó hepatocita nekrózis következtében alakul ki.
• A kalcium homeosztázis megsértését az intracelluláris kalcium felhalmozódása jellemzi a haldokló sejtekben. Az élő sejtekben a kalciumionok intracelluláris koncentrációja körülbelül ezerszer kisebb, mint az extracellulárisé. A károsodás kezdeti változásai a kationos szivattyúk ATP-hiány miatti meghibásodásával járnak. Ebben az esetben a kalcium a sejtek belsejében halmozódik fel, elsősorban a mitokondriumokban. A Ca2+-függő proteázok és foszfolipázok aktiválódnak, ami a membránok (mitokondriális, citoplazmatikus) irreverzibilis károsodásához, permeabilitásának még nagyobb károsodásához és sejthalálhoz vezet.
A citoplazma membránok szelektív permeabilitásának elvesztése az egyik jellegzetes vonásait komplement expozícióval járó nekrózis, vírusfertőzések és hipoxiás sérülés. Ebben az esetben a transzmembrán fehérjék, receptorok és enzimrendszerek károsodnak, amelyek szabályozzák bizonyos anyagok átjutását a sejtbe. A komplement és a perforinok hatására a protein polimerázok beépülnek a citoplazma membránjába. A lítikus vírusok kölcsönhatásba lépnek a membránlipidekkel is, víruskapszid fehérjéket építve beléjük, ami a citoplazma membránok pusztulásához vezet abban a pillanatban, amikor a vírus elhagyja a fertőzött sejtet. Az ischaemiának kitett sejtekben a transzmembrán fehérjék elrendeződése megzavarodik, és jellegzetes fehérje "hipoxiás" tömítések képződnek.
A NEKRÓZIS MORFOGENÉZISE A nekrotikus folyamat számos morfogenetikai szakaszon megy keresztül: paranekrózis, necrobiosis, sejthalál, autolízis.
Paranekrózis - hasonló a nekrotikus, de reverzibilis változásokhoz.
A nekrobiózis egy visszafordíthatatlan degeneratív elváltozás, amelyet a katabolikus reakciók túlsúlya jellemez az anabolikus reakciókkal szemben.
Sejthalál, melynek időpontját nehéz megállapítani.
Autolízis - az elhalt szubsztrát lebomlása az elhalt sejtek és a gyulladásos infiltrátum sejtjeinek hidrolitikus enzimeinek hatására.
A sejthalál meghatározására leggyakrabban morfológiai kritériumokat alkalmaznak. A sejtkárosodás visszafordíthatatlanságának megbízható kritériumai az EM-ben a fehérjéket és kalcium-sókat tartalmazó elektronsűrű lerakódások mitokondriumokban való lerakódása és belső membránjainak elpusztulása. SM-ben a sejtszerkezet változásai csak az autolízis szakaszában válnak láthatóvá. Ezért, ha a nekrózis mikroszkopikus jeleiről beszélünk, valójában az autolízis szakaszában bekövetkező morfológiai változásokról beszélünk.
A NEKRÓZIS MORFOLÓGIÁJA
A nekrózis makroszkópos jelei
A nekrózis minden formájára jellemző a nekrotikus szövetek színének, állagának és bizonyos esetekben szagának megváltozása. Az elhalt szövet sűrű és száraz szerkezetű lehet, ami koagulációs nekrózis esetén figyelhető meg. Ebben az esetben a szövet mumifikálódhat. Más esetekben az elhalt szövet petyhüdt, nagy mennyiségű folyadékot tartalmaz, myomalacián megy keresztül (a görög malakas - puha). Az ilyen konzisztenciájú nekrózist kollikvatívnak nevezik. A nekrotikus tömegek színe a vérszennyeződések és a különböző pigmentek jelenlététől függ, valamint az elhalt és az élő szövetek határán egy vörösesbarna színű, demarkációs gyulladásos zóna kialakulásának köszönhető. Az elhalt szövet fehér vagy sárgás színű, gyakran vörösesbarna korolla veszi körül. Vérrel impregnálva a nekrotikus tömegek vöröstől barnáig, sárgáig és zöldig színezhetnek (az egyes hemoglobin pigmentek túlsúlyától függően). Egyes esetekben a nekrózis gócai epével festődnek. A rothadó olvasztással az elhalt szövet jellegzetes rossz szagot bocsát ki. Szín szerint a szívroham lehet fehér (lép, agy), fehér vérzéses corolla (szív, vese) és vörös (vérzéses). A vérzéses corolla a demarkációs gyulladás zónája miatt jön létre, amely természetesen az elhalt és élő szövetek határán jelentkezik. Az infarktus vörös színe a nekrotikus szövetek vérrel való impregnálásának köszönhető, akárcsak a tüdőinfarktusok esetében, a krónikus vénás plethora hátterében.
A nekrózis morfológiai jelei
A nekrózist a necrobiosis időszaka előzi meg, melynek morfológiai szubsztrátja a disztróf elváltozások.
V. Korai változások: A necrobiosis kezdeti időszakában a sejt morfológiailag változatlan. 1-3 órának kell eltelnie, amíg elektronmikroszkóppal vagy hisztokémiailag felismerhető változások következnek be, és legalább 6-8 órának a fénymikroszkóppal észlelhető elváltozások megjelenéséig; makroszkópos változások még később alakulnak ki. Például, ha egy szívinfarktuson átesett beteg néhány perccel az anginás roham (a szívizomba való elégtelen véráramlással járó fájdalom) kezdete után meghal, akkor a boncolás nem fogja feltárni a nekrózis szerkezeti bizonyítékát; ha a halál az akut roham utáni 2. napon következik be, akkor a változások nyilvánvalóak lesznek.
B. Hisztokémiai változások: a kalciumionok beáramlása a sejtbe szorosan összefügg a visszafordíthatatlan károsodással és a nekrózis morfológiai megnyilvánulásainak megjelenésével. Normál sejtben az intracelluláris kalciumkoncentráció körülbelül 0,001-e az extracelluláris folyadékban lévő koncentrációjának. Ezt a gradienst a sejtmembrán tartja fenn, amely aktívan szállítja ki a kalciumionokat a sejtből. Kísérletileg bebizonyosodott, hogy ha a sejtek ischaemia következtében vagy különböző toxikus szerek hatására károsodnak, a sejteken belüli kalcium felhalmozódás csak akkor figyelhető meg, ha a változások visszafordíthatatlanok. A kalcium aktiválja az endonukleázokat (hidrolízis, DNS hasítás), a foszfolipázokat (membránpusztulás) és a proteázokat (a citoszkeleton roncsolása, emésztése). Aktivitásuk növekedését hisztokémiai módszerekkel mutatják ki. A redox enzimek (például a szukcinát-dehidrogenáz) aktivitása meredeken csökken vagy eltűnik.
B. Kernel változásai: a sejtmagokban bekövetkezett változások a legjobb bizonyíték a sejtnekrózisra. Az elhalt sejt kromatinja nagy csomókká kondenzálódik, és a sejtmag térfogata csökken, ráncos lesz, sűrű, intenzíven bazofil, azaz hematoxilinnel sötétkékre festődik. Ennek a folyamatnak a neve kariopiknózis (ráncosodás). A piknotikus mag ezután számos kis bazofil részecskére szakadhat ( karyorrhexis) vagy lízisen (feloldódáson) megy keresztül a lizoszómális dezoxiribonukleáz hatására (kariolízis). Ezután megnövekszik a térfogata, gyengén hematoxilinnel festődik, a mag körvonalai fokozatosan elvesznek. Gyorsan fejlődő nekrózis esetén a sejtmag piknotikus stádium nélkül lízisen megy keresztül.
D. Citoplazmatikus változások: körülbelül 6 órával azután, hogy a sejt nekrózison ment keresztül, a citoplazmája homogénné és erősen acidofilné válik, azaz intenzíven savas festékekkel festődik, például eozinnal festve rózsaszínre. Ez az első fénymikroszkóppal kimutatott változás, amely a citoplazmatikus fehérjék koagulációja és a riboszómák pusztulása (eltűnése) eredményeként következik be. A riboszóma RNS bazofil árnyalatot kölcsönöz a normál citoplazmának. A speciális sejtszervecskék, például a szívizomsejtekben található myofibrillumok tűnnek el először. A mitokondriumok duzzanata és az organellummembránok pusztulása (pusztulása) a citoplazma vakuolizációját okozza. Végül a sejt emésztése a saját lizoszómáiból felszabaduló enzimekkel sejtlízist (autolízist) okoz. Így a citoplazmában fehérje koaguláció, általában helyettesíti kollikválás.
D. Változások az intercelluláris anyagban kiterjed mind az intersticiális anyagra, mind a rostos struktúrákra. Leggyakrabban a fibrinoid nekrózisra jellemző elváltozások alakulnak ki: a kollagén-, rugalmas- és retikulinrostok sűrű, homogén rózsaszínű, esetenként bazofil tömegekké alakulnak át, amelyek fragmentálódáson, csomós bomláson, lízisen mennek keresztül. Ritkábban rostos struktúrák ödémája, lízise és nyálka is megfigyelhető, ami a colliquat nekrózisra jellemző.
A nekrózis klinikai és morfológiai formái
A nekrózist különböző klinikai és morfológiai változások manifesztálják. Az eltérések a szervek és szövetek szerkezeti és funkcionális jellemzőitől, a nekrózis gyakoriságától és típusától, valamint előfordulásának okaitól és fejlődési körülményeitől függenek. A nekrózis klinikai és morfológiai formái között vannak koaguláció (száraz) nekrózis és kollikváció (nedves) elhalás.
A. Alvadási (száraz) nekrózis: ilyen típusú nekrózis esetén az elhalt sejtek több napig megtartják alakjukat. A sejtmag nélküli sejtek koagulált, homogén, rózsaszínű citoplazma tömegeként jelennek meg.
A koagulatív nekrózis mechanizmusa nem teljesen ismert. A citoplazmatikus fehérjék koagulációja ellenállóvá teszi őket a lizoszómális enzimek hatásával szemben, és ennek következtében cseppfolyósodásuk lelassul.
koagulációs nekrózis általában ben történik fehérjében gazdag és folyadékban szegény szervek például a vesékben, szívizomban, mellékvesékben, lépben, általában az elégtelen vérkeringés és anoxia, fizikai, kémiai és egyéb károsító tényezők hatására, például májsejtek koagulációs nekrózisa víruskárosodás során vagy alatt bakteriális és nem bakteriális eredetű mérgező szerek hatása. koagulációs nekrózis más néven száraz , hiszen jellemző rá, hogy a vele előforduló elhalt területek szárazak, sűrűek, omladozóak, fehérek vagy sárgák.
A koagulációs nekrózis magában foglalja:
- szívroham - fajta vaszkuláris (ischaemiás) nekrózis belső szervek (az agy kivételével - stroke). Ez a nekrózis leggyakoribb típusa.
- kazeos (túrós) nekrózis alakul ki tuberkulózis, szifilisz, lepra és limfogranulomatosis esetén is. Specifikusnak is nevezik, mivel leggyakrabban specifikus fertőző granulomákban található meg. A belső szervekben a szövet korlátozott területe látható, száraz, omladozó, fehéres-sárga színű. A szifilitikus granulomákban az ilyen területek nagyon gyakran nem morzsalékosak, hanem pépesek, emlékeztetnek az arab ragasztóra. Ez egy vegyes (azaz extra- és intracelluláris) típusú nekrózis, amelyben a parenchyma és a stroma (a sejtek és a rostok egyaránt) egyszerre hal el. Mikroszkóposan egy ilyen szövetterület szerkezet nélküli, homogén, hematoxilinnel és eozinnal rózsaszínre festett, jól láthatóak a magkromatin csomói (kariorrhexis).
- viaszos, vagy Zenker-féle nekrózis(izomnekrózis, gyakrabban az elülső hasfal és a comb, súlyos fertőzésekkel - tífusz és tífusz, kolera);
- fibrinoid nekrózis- a kötőszöveti nekrózis egy fajtája, amelyet fibrinoid duzzanat következményeként már vizsgáltak, leggyakrabban allergiás és autoimmun betegségekben (például reuma, rheumatoid arthritis és szisztémás lupus erythematosus) figyelhető meg. A legsúlyosabban a kollagénrostok és az erek középső membránjának simaizomzata károsodik. Malignus hypertoniában az arteriolák fibrinoid nekrózisa figyelhető meg. A fibrinoid nekrózist a normál szerkezet elvesztése és egy homogén, élénk rózsaszínű nekrotikus anyag felhalmozódása jellemzi, amely mikroszkopikusan úgy néz ki, mint a fibrin. Vegye figyelembe, hogy a „fibrinoid” különbözik a „fibrinoidtól”, mivel az utóbbi a fibrin felhalmozódására utal, például a véralvadásban vagy a gyulladásban. A fibrinoid nekrózis területei változó mennyiségű immunglobulint és komplementet, albumint, kollagén és fibrin bomlástermékeket tartalmaznak.
- zsírnekrózis:
1. Enzimatikus zsírelhalás: A zsírelhalás leggyakrabban akut hasnyálmirigy-gyulladás és hasnyálmirigy-sérülés esetén fordul elő, amikor a hasnyálmirigy enzimek a csatornákból a környező szövetekbe szivárognak. A hasnyálmirigy-lipáz a zsírsejtekben lévő trigliceridekre hat, glicerinre és zsírsavakra bontja azokat, amelyek a plazma kalcium-ionjaival kölcsönhatásba lépve kalcium-szappanokat képeznek. Ugyanakkor a hasnyálmirigyet körülvevő zsírszövetben átlátszatlan, fehér (mint kréta) plakkok és csomók (steatonecrosis) jelennek meg.
Hasnyálmirigy-gyulladás esetén a lipáz bejuthat a véráramba, majd széles körben eloszlik, ami a test számos részén zsírelhalást okoz. A leggyakrabban károsodott bőr alatti zsír és csontvelő.
2. Nem enzimatikus zsírelhalás: nem enzimatikus zsírelhalás figyelhető meg az emlőmirigyben, a bőr alatti zsírszövetben és a hasüregben. A legtöbb beteg kórtörténetében trauma szerepel. A nem enzimatikus zsírnekrózist traumás zsírnekrózisnak is nevezik, még akkor is, ha a traumát nem azonosítják a kiváltó okként. A nem enzimatikus zsírnekrózis gyulladásos választ okoz, amelyet számos makrofág, habos citoplazmával, neutrofilekkel és limfociták jelenléte jellemez. Ezt fibrózis követi, és ezt a folyamatot nehéz megkülönböztetni a daganattól.
- gangréna ( a görögből gangraina- Tűz) : ez a külső környezettel kommunikáló és annak hatására megváltozó szövetek nekrózisa. A „gangréna” kifejezést széles körben használják olyan klinikai és morfológiai állapotok megjelölésére, amelyekben a szöveti nekrózist gyakran bonyolítja egy változó súlyosságú másodlagos bakteriális fertőzés, vagy a külső környezettel érintkezve másodlagos változásokon megy keresztül. Vannak száraz, nedves, gázüst és felfekvések.
1. Száraz gangréna - ez a külső környezettel érintkező szövetek nekrózisa, amely mikroorganizmusok részvétele nélkül megy végbe. A száraz gangréna leggyakrabban a végtagokon fordul elő ischaemiás koagulatív szöveti nekrózis következtében. A nekrotikus szövet feketének, száraznak tűnik, és egyértelműen elhatárolódik a szomszédos életképes szövetektől. Az egészséges szövetek határán demarkációs gyulladás lép fel. A színváltozás annak köszönhető, hogy a hemoglobinogén pigmentek hidrogén-szulfid jelenlétében vas-szulfiddá alakulnak. Példák lehetnek száraz gangréna :
érelmeszesedésben szenvedő végtagok és artériák trombózisa ( atheroscleroticus gangréna ), eltüntető endarteritis;
Fagyás vagy égési sérülés esetén;
Raynaud-kórban vagy vibrációs betegségben szenvedő ujjak;
Tífuszban és egyéb fertőzésekben szenvedő bőr.
A kezelés az elhalt szövetek sebészi eltávolításából áll, a demarkációs vonal iránymutatóként szolgál.
2. Nedves gangréna : súlyos bakteriális fertőzés nekrotikus szövetelváltozásaira rétegződés eredményeként alakul ki. A mikrobiális enzimek hatására másodlagos kollikváció következik be. A sejtnek a nem magából a sejtből eredő, hanem kívülről behatoló enzimek általi lízisét ún. heterolízis. A mikroorganizmusok típusa a gangréna lokalizációjától függ. A nedves gangréna általában a nedvességben gazdag szövetekben alakul ki. Előfordulhat a végtagokon, de gyakrabban a belső szervekben, például a belekben a mesenterialis artériák elzáródásával (trombózis, embólia), a tüdőben tüdőgyulladás szövődményeként (influenza, kanyaró). Fertőző betegség (általában kanyaró) által legyengült gyermekeknél az orcák lágy szöveteiben, a perineumban nedves gangrén alakulhat ki, amelyet nomának (görögül) neveznek. nem én- vízi rák). Az akut gyulladás és a baktériumok szaporodása következtében a nekrotikus terület ödémássá és vöröses-feketévé válik, az elhalt szövetek kiterjedt elfolyósodásával. Nedves gangrénában terjedő nekrotizáló gyulladás léphet fel, amely nem határol el egyértelműen a szomszédos egészséges szövetektől, ezért műtétileg nehezen kezelhető. A baktériumok létfontosságú tevékenysége következtében sajátos szag keletkezik. Nagyon magas halálozási arány.
3. gáz gangréna : gázgangréna akkor fordul elő, ha a sebet anaerob flóra fertőzi meg, pl. Clostridium perfringensés ebbe a csoportba tartozó más mikroorganizmusok. A bakteriális enzimaktivitás következtében kiterjedt szöveti nekrózis és gázképződés jellemzi. A fő megnyilvánulások hasonlóak a nedves gangrénához, de további gáz jelenléte van a szövetekben. A crepitus (tapintáskor recsegő jelenség) a gázgangréna gyakori klinikai tünete. A halálozási arány is nagyon magas.
4. Decubitus (decubitus): egyfajta gangrénaként a felfekvéseket izolálják - a test felszíni részeinek (bőr, lágyszövetek) nekrózisa, amelyek az ágy és a csont közötti összenyomásnak vannak kitéve. Ezért a felfekvések gyakran megjelennek a keresztcsont régiójában, a csigolyák tövisnyúlványaiban és a combcsont nagyobb trochanterében. Eredeténél fogva ez a trofoneurotikus nekrózis, mivel az erek és az idegek összenyomódnak, ami súlyosbítja a szív- és érrendszeri, onkológiai, fertőző vagy idegrendszeri betegségekben szenvedő súlyos betegek szöveti trofikus rendellenességeit.
B. Kolliquált (nedves) nekrózis: az elhalt szövetek megolvadása jellemzi. A viszonylag fehérjében szegény és folyadékban gazdag szövetekben fejlődik ki, ahol kedvező feltételek vannak hidrolitikus folyamatok . sejtlízis saját enzimei működésének eredményeként fordul elő ( autolízis). A nedves kollikvatív nekrózis tipikus példája az agy szürke lágyulásának (ischaemiás infarktus) fókusza.
Az agyi infarktust gyakran lágyulásnak nevezik, mivel a fő makroszkopikus jele az agyszövet rugalmasságának mindenkori csökkenése az elváltozásban. Az első napon egy elmosódottan korlátozott, cianotikus árnyalatú, puha tapintású terület képviseli. Az első nap végére a fókusz tisztábbá válik és elsápad. A következő napokban ezen a területen az agy anyaga még petyhüdtebbé válik, színe sárgássá, sőt zöldes árnyalatúvá válik. Az első hetekben az agy térfogata kissé megnő az ödéma miatt. 1-1,5 hónap után. az infarktus helyén egy meglehetősen jól körülhatárolható üreg képződik, amely zavaros folyadékot és törmeléket tartalmaz. A szívinfarktus pontos időpontjának meghatározása nagyon nehéz, nem csak megjelenésben, hanem szövettani képben is.
Mikroszkóposan az agyszövet homogén, szerkezet nélküli, hematoxilinnel és eozinnal festve enyhén rózsaszín színű. Az elhalt szövetek reszorpcióját makrofágok végzik, amelyek úgy néznek ki, mint a zsírszemcsés golyók.
A nekrózis klinikai megnyilvánulásai
Szisztémás megnyilvánulások: nekrózis esetén általában láz jelentkezik (a pirogén anyagok nekrotikus sejtekből és szövetekből való felszabadulása miatt) és neutrofil leukocitózis (akut gyulladásos reakció jelenléte miatt - demarkációs gyulladás). A nekrotikus sejtek tartalmának felszabadulása: a nekrotikus sejtek citoplazmatikus tartalmának felszabadult komponensei (például enzimek) bekerülnek a véráramba, ahol jelenlétük diagnosztikai érték a nekrózis helyének meghatározására. Ezek az enzimek különféle anyagokban megtalálhatók laboratóriumi módszerek. Az enzimek megjelenésének specifitása az enzim túlnyomó lokalizációjától függ a test különböző szöveteiben; például a kreatin-kináz MB izoenzim szintjének emelkedése jellemző a szívizom nekrózisára, mivel ez az enzim csak a szívizomsejtekben található meg. Az aszpartát-aminotranszferáz (AST) szintjének növekedése kevésbé specifikus, mivel ez az enzim nemcsak a szívizomban, hanem a májban és más szövetekben is megtalálható. A transzaminázok megjelenése a májsejt-nekrózisra jellemző.
Helyi megnyilvánulások: A gyomor-bél traktus nyálkahártyájának fekélyesedését vérzés vagy vérzés bonyolíthatja (például vérző peptikus fekély). Az ödéma következtében fellépő szövettérfogat-növekedés súlyos nyomásnövekedést okozhat zárt térben (például a koponyaüregben ischaemiás vagy vérzéses nekrózissal).
Funkciósértés: a nekrózis a szerv funkcionális elégtelenségéhez vezet, például akut szívelégtelenség kialakulása a szívizom kiterjedt nekrózisa (infarktusa) következtében (akut koszorúér-betegség). A klinikai megnyilvánulások súlyossága az érintett szövet típusától, összmennyiségéhez viszonyított térfogatától, valamint a fennmaradó élő szövet funkcióinak megőrzésétől függ. Az egyik vese nekrózisa nem okoz veseelégtelenséget, még akkor sem, ha az egész vese elveszett, mert a másik vese képes kompenzálni a veszteséget. A motoros kéreg egy kis területének nekrózisa azonban a megfelelő izomcsoport bénulásához vezet.
nekrózis kimenetele. A nekrózis visszafordíthatatlan folyamat. Nál nél viszonylag kedvező végeredmény az elhalt szövet körül következik be reaktív gyulladás , amely elhatárolja az elhalt szöveteket. Ezt a gyulladást nevezik elhatárolás , és a demarkációs zóna demarkációs zóna. Ebben a zónában az erek kitágulnak, sok, ödéma lép fel, nagyszámú leukocita jelenik meg, amelyek hidrolitikus enzimeket szabadítanak fel és nekrotikus tömegeket olvasztanak. A nekrotikus tömegeket a makrofágok szívják fel. Ezt követően a kötőszövet sejtjei szaporodnak, ami helyettesíti vagy túlnői a nekrózis területét. Amikor az elhalt tömegeket kötőszövetre cserélik, a sajátjukról beszélnek szervezetek . Ilyen esetekben a nekrózis helyén sebhely (heg az infarktus helyén). A nekrózis területének kötőszövettel való elszennyeződése ahhoz vezet Egységbezárás És. A kalciumsók a száraz nekrózis során holt tömegben és a szerveződésen átesett nekrózis középpontjában rakódnak le. Ilyenkor kialakul meszesedés (kövesedés) nekrózis fókusza . Egyes esetekben csontképződés figyelhető meg a nekrózis helyén - csontosodás . A szöveti törmelék felszívódásával és a kapszula képződésével, amely általában nedves nekrózissal és leggyakrabban az agyban fordul elő, üreg jelenik meg a nekrózis helyén - ciszta.
Kedvezőtlen eredmény elhalás - a nekrózis fókuszának gennyes (szeptikus) olvadása. Sequestration - ez az elhalt szövet egy szakaszának kialakulása, amely nem esik ki autolízisnek, nem helyettesíti kötőszövet, és szabadon helyezkedik el az élő szövetek között. A szekveszterek általában a csontokban fordulnak elő csontvelő-gyulladással - osteomyelitis. Az ilyen szekveszter körül szekvesztrális tok és gennyel töltött üreg képződik. Gyakran a szekveszter sipolyokon keresztül hagy egy üreget, amelyet csak a teljes kiosztás után zárnak be. A zárolás egyik fajtája csonkítás - az ujjvégek elutasítása.
A nekrózis jelentése. Lényege - a "helyi halál" és az ilyen zónák kizárása a funkcióból - határozza meg, ezért a létfontosságú szervek nekrózisa, különösen nagy területeik, gyakran halálhoz vezet. Ilyenek a szívinfarktusok, az agy ischaemiás nekrózisa, a vesék kérgi anyagának nekrózisa, progresszív májelhalás, akut hasnyálmirigy-gyulladás, amelyet hasnyálmirigy-elhalás bonyolít. A szöveti nekrózis gyakran számos betegség súlyos szövődményeinek okozója (szívrepedés myomalacia esetén, bénulás vérzéses és ischaemiás stroke esetén, fertőzések masszív felfekvések esetén, mérgezés a szöveti bomlástermékek testének való kitettsége miatt, például a gangréna miatt). végtag stb.). A nekrózis klinikai megnyilvánulásai nagyon változatosak lehetnek. Az agy vagy a szívizom nekrózisos területein fellépő kóros elektromos aktivitás epilepsziás rohamokhoz vagy szívritmuszavarokhoz vezethet. A perisztaltika megsértése a nekrotikus bélben funkcionális (dinamikus) bélelzáródást okozhat. Gyakran vannak vérzések a nekrotikus szövetben, például hemoptysis (hemoptysis) tüdőnekrózissal.
apoptózis
apoptózis, vagy programozott sejthalál , az a folyamat, amelynek során belső vagy külső tényezők a genetikai program aktiválása vezet a sejthalálhoz és annak hatékony eltávolításához a szövetből. apoptózis- ez a sejthalál mechanizmusa, amelynek számos jellegzetes biokémiai és morfológiai jellemzője van a nekrózis miatt.
apoptózis- Ezt biokémiailag specifikus sejthalál , amelyet az aktiválás jellemez nem lizoszómális endogén endonukleázok , amely kettévált nukleáris DNS apró darabokra. Morfológiailag apoptózis Megjelenik egyetlen, véletlenszerűen elrendezett sejtek halála , amelyet lekerekített, membránnal körülvéve Bika ("apoptotikus testek"), amelyeket a környező sejtek azonnal fagocitizálnak.
Ez egy energiafüggő folyamat, amelynek során a nem kívánt és hibás sejteket eltávolítják a szervezetből. Nagy szerepet játszik a morfogenezisben és a szervek méretének állandó szabályozására szolgáló mechanizmus. Az apoptózis csökkenésével sejtfelhalmozódás következik be, például - daganat növekedése. Az apoptózis növekedésével a szövetben a sejtek számának fokozatos csökkenése figyelhető meg, például - sorvadás .
Az apoptózis morfológiai megnyilvánulásai
Az apoptózisnak megvannak a maga jellegzetes morfológiai jellemzői mind optikai, mind ultrastrukturális szinten. Ha hematoxilin-eozinnal festjük, az apoptózist in egysejtű vagy kis sejtcsoportok . Az apoptotikus sejtek intenzíven eozinofil citoplazma kerek vagy ovális csomóiként jelennek meg, a magkromatin sűrű fragmentumaival. Mivel a sejtösszehúzódás és -képződés apoptotikus testek gyorsan megtörténik, és ugyanolyan gyorsan fagocitizálódnak, szétesnek vagy kilökődnek a szerv lumenébe, majd szövettani preparátumok, jelentős súlyossága esetén található meg. kívül apoptózis - szemben a nekrózissal - soha nem kísért gyulladásos reakció ami a szövettani azonosítását is megnehezíti.
A nekrózis és az apoptózis összehasonlító jellemzői
| jel | apoptózis | Elhalás |
| Indukció | Fiziológiás vagy kóros ingerek aktiválják | Különféle, a károsító tényezőtől függően |
| Prevalencia | egyetlen ketrec | Sejtcsoport |
| Biokémiai változások | Energiafüggő DNS fragmentáció endogén endonukleázok által. A lizoszómák épek. |
Az ioncsere megsértése vagy megszüntetése. A lizoszómákból enzimek szabadulnak fel. |
| DNS bomlás | Intranukleáris kondenzáció töredékekre való felosztással | Diffúz lokalizáció nekrotikus sejtben |
| A sejtmembrán integritása | Mentett | Megsértve |
| Morfológia | A sejtek zsugorodása és fragmentációja apoptotikus testek képződésével tömörített kromatinnal | A sejtek duzzanata és lízise. |
| Gyulladásos válasz | Nem | Általában ott |
| Elhalt sejtek eltávolítása | Felszívódás (fagocitózis) a szomszédos sejtek által | Felszívódás (fagocitózis) neutrofilek és makrofágok által. |
A legvilágosabban morfológiai jellemzők derülnek ki elektronmikroszkóppal. Az apoptózison áteső sejtet a következők jellemzik: apoptózis morfogenezis ):
Sejtösszehúzódás. A sejt mérete csökken; a citoplazma megvastagodik; a viszonylag normálisnak tűnő organellumok tömörebbek.
Feltételezzük, hogy a sejt alakjának és térfogatának megsértése az apoptotikus sejtekben a transzglutamináz aktiválásának eredményeként következik be. Ez az enzim a citoplazmatikus fehérjékben fokozatosan keresztkötések kialakulását idézi elő, ami egyfajta héj kialakulásához vezet a sejtmembrán alatt, hasonlóan a keratinizáló hámsejtekhez.
kromatin kondenzáció. Ez az apoptózis legjellemzőbb megnyilvánulása. A kromatin a periféria mentén, a magmembrán alatt kondenzálódik, jól körülhatárolható sűrű tömegeket képezve. különféle formákés méretek. A mag két vagy több részre bontható.
Gépezet kromatin kondenzáció jól tanult. Ezek a változások a nukleáris DNS hasításával járnak az egyes nukleoszómákat kötő helyeken, ami nagyszámú fragmentum kialakulásához vezet, amelyekben a bázispárok száma 180-200-zal osztható. Ezek a töredékek jellegzetes képet adnak a lépcsőről az elektroforézis során. Ez a mintázat eltér a sejtnekrózistól, ahol a DNS-fragmensek hossza változó. A nukleoszómákban a DNS fragmentáció kalcium-érzékeny endonukleáz hatására megy végbe. Az endonukleáz egyes sejtekben (például timocitákban) tartósan tartózkodik, ahol a szabad kalcium citoplazmában való megjelenése aktiválja, míg más sejtekben az apoptózis megkezdése előtt szintetizálódik. Azt azonban még nem állapították meg, hogy a kromatin kondenzációja miként megy végbe a DNS endonukleáz általi hasítása után.
Üregek és apoptotikus testek kialakulása a citoplazmában. Egy apoptotikus sejtben a mély felszíni invaginációk kezdetben üregeket képeznek, amelyek sejtfragmentációhoz vezetnek, és membránnal körülvett apoptotikus testek képződnek, amelyek citoplazmából és sűrűn csomagolt organellumokból állnak, nukleáris fragmentumokkal vagy anélkül.
Apoptózisos sejtek vagy testek fagocitózisa körülvevő egészséges sejteket, vagy parenchimális, vagy makrofágokat . Az apoptotikus testek gyorsan elpusztulnak a lizoszómákban, és a környező sejtek vagy vándorolnak, vagy osztódnak, hogy kitöltsék a sejthalál után felszabaduló teret.
Fagocitózis A makrofágok vagy más sejtek által okozott apoptotikus testeket ezeken a sejteken lévő receptorok aktiválják, amelyek befogják és elnyelik az apoptotikus sejteket. Az egyik ilyen receptor a makrofágokon a vitronektin receptor, amely egy b3-integrin, és aktiválja az apoptotikus neutrofilek fagocitózisát.
apoptózis részt vesz a következőkben fiziológiai és kóros folyamatok:
Programozott sejtpusztulás az embriogenezis során (beleértve az implantációt, az organogenezist) és metamorfózis. Annak ellenére, hogy az embriogenezis során az apoptózis nem mindig tükrözi a „programozott sejthalált”, az apoptózisnak ezt a definícióját széles körben alkalmazzák a különböző kutatók.
Hormonfüggő szervi involúció felnőtteknél , például a méhnyálkahártya leválása a menstruációs ciklus alatt, a petefészek tüszőinek atresiája a menopauza idején és az emlőmirigy visszafejlődése a laktáció megszűnése után.
Egyes sejtek eltávolítása a sejtpopuláció szaporodása során
Az egyes sejtek elpusztulása a daganatokban főleg a regressziójában, de egy aktívan növekvő daganatban is.
Az immunrendszer sejtjeinek halála , mind a B-, mind a T-limfociták, a citokinek kimerülése után, valamint az autoreaktív T-sejtek elpusztulása a csecsemőmirigyben történő fejlődés során.
A hormonfüggő szervek kóros sorvadása, például a prosztata atrófiája kasztráció után és a limfociták kimerülése a csecsemőmirigyben glükokortikoid terápia során.
A parenchymalis szervek kóros atrófiája a kiválasztó csatornák elzáródása után , mit figyelnek meg a hasnyálmirigyben és a nyálmirigyekben, a vesékben.
A citotoxikus T-sejtek hatása által okozott sejthalál , például a transzplantátum kilökődése és a graft versus-host betegség.
Sejtkárosodás egyes vírusos betegségekben , például vírusos hepatitisben, amikor apoptotikus sejtek fragmensei Kaunsilman testek formájában találhatók meg a májban.
sejthalál különböző károsító tényezők hatására, amelyek képesek elhalást előidézni, de kis dózisban hatnak, például az akcióval magas hőmérsékletű, ionizáló sugárzás, rákellenes szerek.
Apoptózis szabályozása
Az apoptózis genetikailag szabályozott sejthalál. . Jelenleg számos gént azonosítottak, amelyek az apoptózis szabályozásához szükséges anyagokat kódolják. E gének közül sok megmaradt az evolúció során – a kerekférgektől a rovarokig és emlősökig. Egy részük a vírusok genomjában is megtalálható. Így a fő biokémiai folyamatok Az apoptózis a különböző kísérleti rendszerekben (többnyire orsóférgeken és legyeken végeznek vizsgálatokat) azonosak, így a vizsgálatok eredményei közvetlenül átvihetők más rendszerekre (például az emberi szervezetre).
apoptózisállítható:
- külső tényezők ,
- autonóm mechanizmusok .
A. Külső tényezők hatása.
Az apoptózist számos külső tényező szabályozhatja, amelyek a DNS károsodás. Nál nél pótolhatatlan DNS károsodás apoptózissal a szervezet számára potenciálisan veszélyes sejtek eliminálódnak. Ebben a folyamatban fontos szerepet játszik p53 tumorszuppresszor gén . az apoptózis aktiválásához is vezet vírusos fertőzések, a sejtnövekedés szabályozási zavara, a sejt károsodása és a szövetet körülvevő vagy földi anyaggal való kapcsolat elvesztése. Az apoptózis a szervezet védekezése a sérült sejtek fennmaradása ellen, ami potenciálisan veszélyes lehet egy többsejtű szervezet számára.
A szövetek stimulálásakor bármilyen mitogén sejtjei fokozott mitotikus aktivitás állapotába kerülnek, amihez szükségszerűen társul néhány az apoptózis aktiválása . A leánysejtek sorsa attól függ, hogy életben maradnak-e vagy apoptózison mennek keresztül az apoptózis aktivátorainak és gátlóinak aránya :
inhibitorok tartalmazza növekedési faktorok, sejtmátrix, nemi szteroidok, egyes vírusfehérjék;
aktivátorok közé tartozik a növekedési faktorok hiánya, a mátrixkötés elvesztése, glükokortikoidok, egyes vírusok, szabad gyökök, ionizáló sugárzás.
Aktivátorok hatásának kitéve vagy inhibitorok hiányában, aktiválás endogén proteázokÉs endonukleázok . Ez a citoszkeleton pusztulásához, a DNS fragmentációjához és a mitokondriumok működésének károsodásához vezet. A sejt zsugorodik, de membránja sértetlen marad, károsodása azonban a fagocitózis aktiválásához vezet. Az elhalt sejtek membránnal körülvett kis darabkákra bomlanak szét, amelyeket apoptotikus testeknek neveznek. Az apoptotikus sejtekre adott gyulladásos válasz nem fordul elő .
B. Az apoptózis autonóm mechanizmusa.
Az embrionális fejlődés során az autonóm apoptózis három kategóriáját különböztetjük meg: morfogenetikai, hisztogenetikai és filogenetikai.
Morfogenetikus apoptózis részt vesz a különböző szöveti rudimentumok elpusztításában. Példák:
- sejtek elpusztítása az interdigitális terekben;
sejthalál a felesleges hám pusztulásához vezet a palatinus folyamatok összeolvadása során a kemény szájpad kialakulása során.
- sejtpusztulás az idegcső dorsalis részében a záródás során, ami a hám, az idegcső két oldala és a hozzátartozó mezoderma egységének eléréséhez szükséges.
A morfogenetikus apoptózis megsértése ebben a három lokalizációban vezet a fejlődéshez syndactyly, szájpadhasadék és spina bifida, ill.
Hisztogenetikus apoptózis a szövetek és szervek differenciálódása során figyelhető meg, ami például a nemi szervek hormonfüggő differenciálódásában figyelhető meg a szöveti primordiáktól. Tehát férfiaknál a magzati herékben lévő Sertoli-sejtek egy hormont szintetizálnak, amely apoptózissal a Mueller-csatornák visszafejlődését okozza (amelyből a petevezetékek, a méh és a felső hüvely képződik a nőknél).
Filogenetikai apoptózis részt vesz az embrió kezdetleges struktúráinak, például a pronephros eltávolításában.
Különféle körülmények között megfigyelhető, mint az apoptózis gyorsulása és lassulása. Habár apoptózis azonban bizonyos sejttípusokra specifikus különféle tényezők aktiválhatják az apoptózis végső útját jól megalapozott gének szabályozzák, és az apoptózis aktiválásának okától függetlenül gyakori.
Minden olyan tényező hathat, amely fokozza vagy gyengíti az apoptózist
- közvetlenül a sejthalál mechanizmusához ,
- közvetve a transzkripciós szabályozás befolyásolásával .
Egyes esetekben ezeknek a tényezőknek az apoptózisra gyakorolt hatása döntő (például amikor glükokortikoid-függő timocita apoptózis ), míg másoknál nincs különösebb jelentősége (például mikor Fas- és TNF-függő apoptózis ). A szabályozási folyamatban nagyszámú anyag vesz részt, ezek közül a legtöbbet tanulmányozott anyagok a től származó anyagok családok bcl-2
Bcl-2 gén először olyan génként írták le, amely a follikuláris limfóma sejtekben transzlokálódik és gátolja az apoptózist. A további kutatások során kiderült A Bcl-2 egy multigén, ami még a gömbférgeknél is megtalálható. Egyes vírusokban homológ géneket is találtak. Az ebbe az osztályba tartozó összes anyag fel van osztva az apoptózis aktivátorai és gátlói .
NAK NEK inhibitorok viszonyul: bcl-2, bcl-xL, Mcl-1, bcl-w, adenovírus E1B 19K, Epstein-Barr vírus BHRF1.
Az aktivátorokhoz viszonyul bax, bak, Nbk/Bik1, Rossz, bcl-xS.
Ennek a családnak a tagjai kölcsönhatásba lépnek egymással. Az egyik szabályozási szintek Az apoptózis kölcsönhatás fehérje-fehérje. A bcl-2 család fehérjéi homo- és heterodimereket is alkotnak. Például a bcl-2 inhibitorok dimereket képezhetnek a bcl-2 aktivátorokkal. És így A sejtek életképessége az apoptózis aktivátorainak és gátlóinak arányától függ. Például a bcl-2 kölcsönhatásba lép a bax-szal, míg az első túlsúlyával a sejtek életképessége nő, a második feleslegével csökken. Ezenkívül a bcl-2 család fehérjéi kölcsönhatásba léphetnek olyan fehérjékkel, amelyek nem tartoznak ehhez a rendszerhez. Például a bcl-2 párosítható az R- ras amely aktiválja az apoptózist. Egy másik fehérje, a Bag-1, fokozza a bcl-2 azon képességét, hogy gátolja az apoptózist.
Jelenleg ez elfogadott gének részt a daganatok növekedésének és fejlődésének szabályozásában (onkogének és tumorszuppresszor gének ), játszani szabályozó szerepe V indukció apoptózis. Ezek tartalmazzák:
bcl-2 onkogén , melyik gátolja hormonok és citokinek által okozott apoptózis, amely a sejtek életképességének növekedéséhez vezet;
fehérje bax (a családból is bcl-2 ) dimereket képez bax-bax , amelyek fokozzák az apoptózis aktivátorok hatását. A bcl-2 és a bax aránya határozza meg a sejtek apoptotikus faktorokkal szembeni érzékenységét, és egy „molekuláris kapcsoló”, amely meghatározza, hogy a szövetek növekedni fognak-e vagy sorvadnak-e.
c-myc onkogén , akinek fehérje termék serkentheti akár az apoptózist, akár a sejtnövekedést (más túlélési jelek jelenlétében, pl. bcl-2)
p53 gén , amely normál esetben aktiválja az apoptózist (vad típusú - vad típusú), de mutáció esetén (mutáns típus - általában immunhisztokémiai vizsgálatokat végeznek rajta tumorsejtekben, ilyenkor figyelmen kívül hagyják a vad típus mennyiségét, ez alapján a viselkedés előrejelzése a tumorszövet beépült, azaz sok a p53 gén fehérjeterméke - a prognózis kedvezőtlen, mert az apoptózis gátlásáról beszélünk) vagy hiánya (amely egyes daganatokban megtalálható) növeli a sejtek túlélését. Megállapítást nyert, hogy a p53 szükséges az ionizáló sugárzás által okozott sejtkárosodás esetén az apoptózishoz, de nem szükséges a glükokortikoidok és az öregedés által kiváltott apoptózishoz.
Csökkent apoptózis
A p53 géntermék figyeli a genom integritását a mitózis során. A genom integritásának megsértése cella átvált a apoptózis. Oda-vissza, fehérje bcl-2 gátolja az apoptózist. És így, a p53 hiánya vagy a bcl-2 feleslege sejtek felhalmozódásához vezet : ezek a rendellenességek különböző daganatokban figyelhetők meg. A fejlesztésben fontos az apoptózist szabályozó tényezők vizsgálata gyógyszerek amelyek fokozzák a rosszindulatú daganatos sejtek pusztulását.
Az autoimmun betegségek a saját antigénjeikkel reagálni képes limfoid sejtek apoptózisának indukciójában fellépő zavarokat tükrözhetik. Például szisztémás lupus erythematosus esetén megsértés van Fas receptorok a limfociták sejtfelszínén, ami az apoptózis aktiválásához vezet. Néhány a vírusok növelik túlélésüket azáltal, hogy gátolják a fertőzött sejtek apoptózisát, például az Epstein-Barr vírus befolyásolhatja az anyagcserét bcl-2 .
Az apoptózis felgyorsulása
Az apoptózis felgyorsulása bizonyított a szerzett immunhiányos szindróma (AIDS), a neurotrófiás betegségek és néhány olyan vérbetegség esetében, amelyekben bármely képződött elem hiánya áll fenn. AIDS-ben az immunhiányos vírus aktiválódhat CD4 receptor a nem fertőzött T-limfocitákon , ezáltal felgyorsítja az apoptózist, ami az ilyen típusú sejtek kimerüléséhez vezet.
Az apoptózis jelentősége a szervezet és a kóros folyamatok fejlődésében
Az apoptózis fontos szerepet játszik az emlősök fejlődésében és a különböző kóros folyamatokban. Működés bcl-2 szükséges a limfociták, melanociták, a bélhám és a vesesejtek életképességének fenntartásához az embrionális fejlődés során. A bcl-x szükséges a sejthalál gátlásához az embriogenezis során, különösen az idegrendszerben. A Bax szükséges a timociták apoptózisához és a spermiumok életképességének fenntartásához fejlődésük során. A p53 egy tumorszuppresszor gén, ezért az embriogenezisben nem játszik különösebb szerepet, de a tumornövekedés gátlásához szükséges. Azokban az egerekben, amelyekben mindkét p53 gén hiányzott, rendkívül nagy hajlamot figyeltek meg rosszindulatú daganatok kialakulására a tumor előtti sejtek apoptózisának teljes vagy részleges károsodása következtében. A bcl-2 gén által kódolt fehérje fokozott szintézise az apoptózis elnyomásához és ennek megfelelően daganatok kialakulásához vezet; ez a jelenség a B-sejtes follikuláris limfóma sejtekben található.
Limfoproliferatív betegségekben és szisztémás lupus erythematosus-szerű betegségekben egerekben a Fas ligandum vagy a Fas receptor funkciója károsodott. A megnövekedett Fas-ligandum szintézis megakadályozhatja a graft kilökődését.
Az apoptózis a kóros folyamat része, amikor egy sejt adenovírusokkal, HIV-vel és influenzavírusokkal fertőzött. Az apoptózis gátlása a fertőzés fennállása esetén, a látens időszakban, valamint az adenovírusok, esetleg a herpeszvírusok, az Epstein-Barr vírus és a HIV fokozott replikációja mellett az apoptózis aktiválódása figyelhető meg, ami hozzájárul a vírus széles körű elterjedéséhez. nyilvánvaló az apoptózis és számos kóros állapot közötti közvetlen kapcsolat. Számos, az apoptózist szabályozó gén diszfunkciójának vizsgálata lehetőséget ad e betegségek kezelésében teljesen új irányok kidolgozására. Az apoptózis szabályozására alkalmas gyógyszerek kifejlesztése új lehetőségeket nyit a rosszindulatú daganatok, vírusfertőzések és egyes betegségek kezelésében. idegrendszer, immunhiányos betegségek és autoimmun betegségek. Például mikor rosszindulatú daganatokés limfoproliferatív betegségek esetén szükséges az apoptózis fokozása, a sejtkárosodással jellemezhető betegségekben pedig annak gyengítése.
Részletek
Elhalás- nekrózis, sejtek és szövetek elpusztulása élő szervezetben, miközben élettevékenységük teljesen leáll.
A nekrotikus folyamat egy sorozaton megy keresztül szakasz :
- paranecrosis - a nekrotikushoz hasonló reverzibilis változások
- necrobiosis - visszafordíthatatlan disztrófiás változások (ugyanakkor a katabolikus reakciók érvényesülnek az anabolikus reakciókkal szemben)
- sejthalál
- autolízis - az elhalt szubsztrát bomlása hidrolitikus enzimek és makrofágok hatására
A nekrózis mikroszkópos jelei:
1) Kernel változások
- Karyopyknosis- a sejtmag ráncosodása. Ebben a szakaszban intenzíven bazofil lesz - hematoxilinnel sötétkékre festik.
- Karyorrhexis- a mag szétesése bazofil töredékekre.
- Kariolízis- a mag feloldódása
A sejtmag piknózisa, rexisa és lízise egymás után következik, és a proteázok - ribonukleáz és dezoxiribonukleáz - aktiválódásának dinamikáját tükrözik. Gyorsan fejlődő nekrózis esetén a mag lízisen megy keresztül a kariopiknózis stádiuma nélkül.
2) Változások a citoplazmában
- plazma koaguláció. Először a citoplazma homogénné és acidofilné válik, majd fehérje koaguláció következik be.
- plazmorhexis
- plazmolízis
Az olvadás bizonyos esetekben az egész sejtet befogja (citolízis), másokban pedig csak egy részét (fókuszos kollikvációs nekrózis vagy ballon dystrophia)
3) Változások az intercelluláris anyagban
A) kollagén, rugalmas és retikulin rostok plazmafehérjékkel átitatva sűrű, homogén masszává alakulnak, amelyek vagy fragmentálódnak, vagy csomós szétesésnek, vagy lízisznak.
A rostos struktúrák lebontása a kollagenáz és az elasztáz aktiválásával jár.
A retikulin rostok nagyon hosszú ideig nem mennek keresztül nekrotikus elváltozásokon, ezért számos nekrotikus szövetben megtalálhatók.
b) a köztes anyag megduzzad és megolvad a glikozaminoglikánjainak depolimerizációja és a vérplazmafehérjékkel való impregnálása következtében
A szöveti nekrózis során konzisztenciájuk, színük és szaguk megváltozik. A szövet sűrűsödhet és kiszáradhat (mumifikáció), vagy petyhüdtté és megolvadhat.
Az anyag gyakran fehér és fehér-sárga színű. És néha sötétvörös, ha vérrel telített. A bőr, a méh, a bőr nekrózisa gyakran szürkés-zöld, fekete színűvé válik.
a nekrózis okai.
A nekrózis okától függően a következő típusokat különböztetjük meg:
1) traumás nekrózis
Fizikai és kémiai tényezők (sugárzás, hőmérséklet, elektromosság stb.) szövetére gyakorolt közvetlen hatás eredménye.
Példa: magas hőmérsékletnek kitéve szöveti égési sérülések, alacsony hőmérsékleten pedig fagyási sérülések következnek be.
2) mérgező elhalás
Ez a bakteriális és nem bakteriális eredetű toxinok szövetekre gyakorolt közvetlen hatásának eredménye.
Példa: szívizomsejtek nekrózisa diftéria exotoxin hatására.
3) trofoneurotikus elhalás
Akkor fordul elő, ha az idegszövet trofizmusa megzavarodik. Az eredmény keringési zavar, disztrófiás és nekrobiotikus elváltozások, amelyek nekrózishoz vezetnek.
Példa: felfekvés.
4) allergiás elhalás
Ez egy azonnali túlérzékenységi reakció kifejeződése érzékeny szervezetben.
Példa: Arthus-jelenség.
5) vaszkuláris elhalás- szívroham
Akkor fordul elő, ha az artériákban a véráramlás megsértése vagy megszűnése tromboembólia, hosszan tartó görcs miatt. Az elégtelen véráramlás ischaemiát, hipoxiát és szövetelhalást okoz a redox folyamatok leállása miatt.
NAK NEK közvetlen a nekrózisok közé tartozik a traumás és a toxikus nekrózis. A közvetlen nekrózis a kórokozó faktor közvetlen befolyásának köszönhető.
Közvetett a nekrózis közvetve az érrendszeren és a neuroendokrin rendszeren keresztül történik. A nekrózis kialakulásának ez a mechanizmusa a 3-5. fajokra jellemző.
A nekrózis klinikai és morfológiai formái.
Megkülönböztetik őket, figyelembe véve azon szervek és szövetek szerkezeti és funkcionális jellemzőit, amelyekben a nekrózis előfordul, előfordulásának okait és a fejlődés feltételeit.
1) koagulációs (száraz) nekrózis
A száraz nekrózis a fehérjék denaturációs folyamatán alapul, olyan nehezen oldódó vegyületek képződésével, amelyek hosszú ideig nem esnek át hidrolitikus hasításon.
A keletkező elhalt területek szárazak, sűrűek, szürkéssárga színűek.
A koagulációs nekrózis fehérjében gazdag és folyadékban szegény szervekben (vese, szívizom, mellékvese stb.) fordul elő.
Általános szabály, hogy az elhalt szövet és az élő szövet között világos határvonal húzható meg. A határon erős demarkációs gyulladás van.
Példák:
viaszos (Zenker-féle) nekrózis (a rectus hasi izmokban akut fertőző betegségekben)
szívroham
Caseous (sajtos nekrózis) szifilisz, tuberkulózis
Száraz gangréna
Fibrinoid - a kötőszövetek nekrózisa, amelyet allergiás és autoimmun betegségekben figyelnek meg. A kollagénrostok és az erek középső membránjának simaizomzata súlyosan károsodik. Jellemzője a kollagénrostok normál szerkezetének elvesztése és a fibrinhez hasonló (!) élénk rózsaszín színű homogén nekrotikus anyag felhalmozódása.
2) kollikvációs (nedves) nekrózis
Jellemzője az elhalt szövetek megolvadása, ciszták kialakulása. A viszonylag fehérjében szegény és folyadékban gazdag szövetekben fejlődik ki. A sejtlízis saját enzimjei (autolízis) hatására megy végbe.
Nincs tiszta zóna az elhalt és az élő szövetek között.
Példák:
Ischaemiás agyi infarktus
Amikor a száraz nekrózis tömegei megolvadnak, másodlagos kollikvációról beszélnek.
3) Gangréna
Üszkösödés- a külső környezettel érintkező szövetek nekrózisa (bőr, belek, tüdő). Ebben az esetben a szövetek szürkésbarnává vagy feketévé válnak, ami a vér pigmenteinek vas-szulfiddá alakulásával jár.
a) száraz gangréna
A külső környezettel érintkező szövetek nekrózisa mikroorganizmusok részvétele nélkül. Leggyakrabban a végtagokban fordul elő ischaemiás koagulációs nekrózis következtében.
Az elhalt szövetek a levegő hatására kiszáradnak, összezsugorodnak, tömörödnek, egyértelműen elhatárolódnak az életképes szövetektől. Az egészséges szövetek határán demarkációs gyulladás lép fel.
Demarkációs gyulladás- reaktív gyulladás az elhalt szövetek körül, amely elhatárolja az elhalt szöveteket. A korlátozási zóna a demarkáció.
Példa: - végtag gangréna érelmeszesedésben és trombózisban
Fagyás vagy égési sérülés
b) nedves gangréna
Bakteriális fertőzés nekrotikus szövetelváltozásaira rétegződés eredményeként alakul ki. Az enzimek hatására másodlagos kollikváció következik be.
A szövet megduzzad, ödémás lesz, büdös.
A nedves gangréna kialakulását elősegíti a keringési zavarok, a nyirokkeringés.
Nedves gangrénában nincs egyértelmű különbség az élő és az elhalt szövetek között, ami bonyolítja a kezelést. A kezeléshez a nedves gangrénát szárazra kell vinni, csak ezután kell amputálni.
Példák:
A bél gangrénája. A mesenterialis artériák elzáródásával (trombusok, embólia), ischaemiás vastagbélgyulladással, akut hashártyagyulladással alakul ki. A savós membrán fénytelen, fibrinnel borított.
Felfekvések. Felfekvés - a nyomásnak kitett test felszíni területeinek nekrózisa.
A Noma egy vizes rák.
c) gáz gangréna
Akkor fordul elő, amikor a sebet anaerob flóra fertőzi meg. Kiterjedt szöveti nekrózis és a baktériumok enzimaktivitása következtében gázképződés jellemzi. Gyakori klinikai tünet a crepitus.
4) szekveszter
Az elhalt szövetek azon területét, amely nem esik át autolízisen, nem helyettesíti kötőszövet, és szabadon helyezkedik el az élő szövetek között.
Példa: - oszteomyelitisz sequester. Az ilyen szekveszter körül kapszula és gennyel töltött üreg képződik.
lágy szövetek
5) szívroham
Vaszkuláris nekrózis, az ischaemia következményei és extrém kifejeződése. A szívroham kialakulásának okai az elhúzódó görcs, trombózis, artériás embólia, valamint a szerv funkcionális stressze elégtelen vérellátás esetén.
a) szívinfarktus formái
Leggyakrabban a szívrohamok ék alakúak (az ék alapja a kapszula felé, a hegye pedig a szerv kapuja felé néz). Az ilyen szívrohamok a lépben, a vesékben, a tüdőben alakulnak ki, amelyet e szervek architektonikája - az artériák elágazásának fő típusa - határoz meg.
Ritkán a nekrózis szabálytalan alakú. Az ilyen nekrózis a szívben, a belekben fordul elő, vagyis azokban a szervekben, ahol az artériák nem fő, laza vagy vegyes típusú elágazása dominál.
b) érték
A szívroham kiterjedhet egy szerv nagy részére vagy egészére (részösszeg vagy teljes szívroham), vagy csak mikroszkóp alatt észlelhető (mikroinfarktus).
c) megjelenés
- fehér
Ez egy fehér-sárga terület, jól elhatárolható a környező szövetektől. Általában az elégtelen kollaterális keringéssel rendelkező szövetekben fordul elő (lép, vese).
- fehér vérzéses glóriával
Fehér-sárga terület képviseli, de ezt a területet vérzéses zóna veszi körül. Ennek eredményeként alakul ki, hogy az infarktus perifériáján az erek görcsét felváltja azok kiterjedése és vérzések kialakulása. Az ilyen szívroham a szívizomban található.
- vörös (vérzéses)
A nekrózis helye vérrel telített, sötétvörös, jól körülhatárolt. Azokban a szervekben fordul elő, ahol a vénás pangás jellemző, ahol nincs fő vérellátás. A tüdőben (mert a hörgő- és a pulmonalis artériák között anastomosisok vannak), a belekben fordul elő.
A nekrózis klinikai megnyilvánulásai.
1) szisztémás megnyilvánulások: láz, neutrofil leukocitózis. Az intracelluláris enzimek a vérben határozódnak meg: a kratinkináz MB-izoenzimje a szívizom nekrózisával növekszik.
2) Helyi megnyilvánulásai
3) Károsodott működés
A nekrózis következményei:
1) elhatárolás
Viszonylag kedvező eredménnyel az elhalt szövet körül reaktív gyulladás lép fel, amely elhatárolja az elhalt szövetet az egészségestől. Ebben a zónában az erek kitágulnak, rengeteg és ödéma jelentkezik, nagyszámú leukocita jelenik meg.
2) szervezés
Az elhalt tömegek pótlása kötőszövettel. Ilyen esetekben a nekrózis helyén heg képződik.
3) tokozás
A nekrózis területének eltömődése kötőszövettel.
4) megkövesedés
Meszesedés. Kalcium sók felhalmozódása a kapszulában.
5) csontosodás
Extrém fokú megkövesedés. Csontképződés a nekrózis helyén.
6) gennyes fúzió
Ilyen a szívrohamok gennyes fúziója szepszisben.