पेट में कार्बोहाइड्रेट का पाचन प्रभावित होता है। कार्बोहाइड्रेट का पाचन। पाचन में सेलुलोज की भूमिका
प्रोटीन और लिपिड के साथ कार्बोहाइड्रेट, जीवित जीवों की कोशिकाओं के आवश्यक घटक हैं। उनमें, वे बहुत विविध और महत्वपूर्ण कार्य करते हैं: ऊर्जा (उच्च ऊर्जा वाले यौगिकों और ऊष्मा के स्रोत के रूप में सेवा करें), रक्षात्मक(पॉलीसेकेराइड कोशिका झिल्ली, एंटीबॉडी का हिस्सा हैं), संरचनात्मक(ऊतक, सेलुलर और उपकुलर संरचनाओं के निर्माण में भाग लेते हैं), न्यूक्लिक एसिड (राइबोज और डीऑक्सीराइबोज), लिपिड, प्रोटीन और कई अन्य जैविक रूप से महत्वपूर्ण यौगिकों के जैवसंश्लेषण के लिए उपयोग किया जाता है।
शरीर में कार्बोहाइड्रेट का स्रोत खाद्य कार्बोहाइड्रेट है, जिनमें से मुख्य स्टार्च है। स्टार्च (पॉलीसेकेराइड) पौधों द्वारा कार्बोहाइड्रेट के भंडारण का मुख्य रूप है, यह प्रकाश संश्लेषण के परिणामस्वरूप उनमें बनता है। ग्लाइकोजन पशु ऊतकों में कार्बोहाइड्रेट के जमाव का एक रूप है। लैक्टोज (डिसैकराइड) दूध में पाया जाता है और शिशुओं के आहार में मुख्य कार्बोहाइड्रेट होता है। शहद और फलों में मोनोसेकेराइड्स ग्लूकोज और फ्रुक्टोज होते हैं। आहार में कार्बोहाइड्रेट का मान 400-500 ग्राम है।
ग्लाइकोप्रोटीन एपोप्रोटीन और एक कार्बोहाइड्रेट भाग से मिलकर बनता है, जो शायद ही कभी 30% से अधिक होता है (ग्लूकोज, मैनोज, गैलेक्टोज, फूकोस, उनके एमिनो डेरिवेटिव, न्यूरैमिनिक और सियालिक एसिड)। ग्लाइकोप्रोटीन में सेल द्वारा स्रावित अधिकांश प्रोटीन, साथ ही रक्त प्लाज्मा प्रोटीन (सेरुलोप्लास्मिन, हैप्टोग्लोबिन, ट्रांसफिरिन, रक्त जमावट प्रोटीन, इम्युनोग्लोबुलिन, आदि) शामिल हैं। कोशिका के बाहरी झिल्ली के लगभग सभी प्रोटीन ग्लाइकोप्रोटीन के वर्ग से संबंधित हैं। वे कोशिकाओं की "मान्यता" प्रदान करते हैं, उनके संपर्कों और चिपकने वाले गुणों की विशिष्टता। प्रोटियोग्लाइकन। जटिल प्रोटीन के इस परिवार में, ग्लाइकोसामिनोग्लाइकेन्स (म्यूकोपॉलीसैकराइड्स) द्वारा दर्शाए गए पॉलीसेकेराइड का हिस्सा कुल आणविक भार का 95% से अधिक है। प्रोटिओग्लिसन्स ऊतकों के अंतरकोशिकीय पदार्थ में मौजूद होते हैं और एक "सीमेंट" के रूप में काम करते हैं जो सभी कोशिकाओं को एक पूरे - एक अंग में रखता है। उनमें से कई उपास्थि और टेंडन्स की संरचना में निहित हैं, श्लेष तरल पदार्थ में, जहां वे जोड़ों की रगड़ सतहों को चिकनाई करने का कार्य करते हैं। प्रोटीनग्लास में हेपरिन (थक्कारोधी) भी शामिल हैं।
स्टार्च और ग्लाइकोजन की हाइड्रोलिसिस (पाचन) लार एमाइलेज के प्रभाव में मौखिक गुहा में शुरू होती है। ज्ञात α, β, γ - लार एमाइलेज के रूप हैं। पहले (α-amylase) पॉलीसैकराइड अणु में आंतरिक बंधों को हाइड्रोलाइज करता है, जिससे एक ओलिगोसेकेराइड बनता है। द्वितीय ( β -माइलेज़), माल्टोज़ अणु के पॉलीसैकराइड श्रृंखला के अंत में दरारें; γ -माइलेस, पॉलीसैकराइड से ग्लूकोज अणुओं को साफ करता है। इन सभी एमाइलेज के लिए इष्टतम पीएच 6.8-7.0 की सीमा में है। पेट में, जहां वातावरण अत्यधिक अम्लीय होता है (पीएच 1.5-2.5), ये एंजाइम निष्क्रिय होते हैं, और इसमें कार्बोहाइड्रेट पच नहीं पाते हैं। केवल भोजन की गांठ के अंदर, लार एमाइलेज क्रिया करता रहता है। ग्रहणी में, कार्बोहाइड्रेट तीव्रता से टूटना शुरू कर देते हैं, क्योंकि आंत के इस खंड में माध्यम का पीएच मान तटस्थ या थोड़ा क्षारीय होता है, और अग्न्याशय के α-amylase अतिरिक्त रूप से यहां आपूर्ति की जाती है। ग्लाइकोजेनिक और अमाइलोपेक्टिन (1-6 बांड) के शाखा बिंदुओं पर स्थित ग्लाइकोसिडिक बॉन्ड हाइड्रोलाइज्ड हैं; एमिलो-1,6-ग्लूकोसिडेज़ और ऑलिगो-1,6-ग्लूकोसिडेज़।
यदि माल्टोज को जठरांत्र संबंधी मार्ग में ग्लाइकोजन से मिलाया जाता है, तो यह प्रभाव में है माल्टेज़में विभाजित है 2 ग्लूकोज अणु.
दूध लैक्टोज प्रभाव के तहत टूट गया है लैक्टेजपर ग्लूकोज और गैलेक्टोज.
यदि सुक्रोज भोजन के साथ निगला जाता है, तो यह प्रभाव में है sucraseअणुओं में विभाजित होता है फ्रुक्टोज और ग्लूकोज।
अंततः, सभी पॉली-, ओलीगो- और भोजन से लिए गए डिसैकेराइड्स हाइड्रोलाइज्ड (डाइजेस्टेड) \u200b\u200bसे मोनोसैकराइड्स - मुख्य रूप से ग्लूकोज, फ्रुक्टोज और गैलेक्टोज के लिए होते हैं। इसके अलावा, उन सभी को एटीपी, सोडियम आयनों, एंजाइमों और अन्य अणुओं की सक्रिय भागीदारी के साथ, आंतों के लुमेन से श्लेष्म झिल्ली की कोशिकाओं (सुगम प्रसार, लक्षण) में स्थानांतरित किया जाता है।
पाचन तंत्र में पचने वाले कार्बोहाइड्रेट: फाइबर, पेक्टिन, लिग्निन। पाचन तंत्र में कोई एंजाइम नहीं होते हैं जो 1--1-4-ग्लाइकोसिडिक बंधन को हाइड्रोलाइज करते हैं। सेल्युलोज (सेलुलोज) की जैविक भूमिका: बैक्टीरिया वनस्पतियों का वातावरण, आंतों के पेरिस्टलसिस को उत्तेजित करता है, मल का आधार है और विभिन्न विषाक्त पदार्थों का एक adsorbent है।
अवशोषित मोनोसैकराइड्स का भाग्य अलग है। यह माना जाता है कि 90% से अधिक वे यकृत में प्रवेश करते हैं और ग्लाइकोजन में परिवर्तित हो जाते हैं। केवल ग्लूकोज को ग्लाइकोजन संरचना में शामिल किया जा सकता है, लेकिन फ्रुक्टोज और गैलेक्टोज नहीं कर सकते। इस संबंध में, आंतों की कोशिकाओं के साइटोप्लाज्म में बाद को आइसोमेराइज्ड किया जाता है और ग्लूकोज में परिवर्तित किया जाता है।
जिन रास्तों के साथ इन अणुओं के आगे रूपांतरण शुरू होंगे, वे कई हैं: ये एरोबिक और एनारोबिक ऑक्सीकरण हैं, गैर-संवेदी अमीनो एसिड, ग्लाइकोसिमिग्लाइकेन्स, राइबोस और डीऑक्सीराइबोस, उच्च फैटी एसिड, ग्लाइकोजन के जैवसंश्लेषण के लिए उनका उपयोग; साथ ही शरीर के लिए कई अन्य पदार्थ महत्वपूर्ण हैं।
ग्लाइकोजन- पशु कोशिकाओं में मुख्य आरक्षित पॉलीसेकेराइड। ग्लूकोज के अवशेष α-1-4-ग्लाइकोसिडिक बांड द्वारा रैखिक वर्गों में α-1-6-ग्लाइकोसिडिक बांड द्वारा शाखाओं में बंटे हुए होते हैं। ग्लाइकोजन मुख्य रूप से यकृत और कंकाल की मांसपेशी में जमा होता है। पाचन के दौरान ग्लाइकोजन को संश्लेषित किया जाता है (कार्बोहाइड्रेट भोजन खाने के 1-2 घंटे बाद)। ग्लाइकोजन का संश्लेषण एटीपी और यूटीपी के खर्च के साथ ऊर्जा के व्यय के साथ होता है। ग्लाइकोजन संश्लेषण हार्मोन इंसुलिन द्वारा प्रेरित होता है।
ग्लाइकोजन का जुटानाभोजन के बीच, व्यायाम के दौरान और तनाव के दौरान होता है। यह प्रक्रिया हार्मोन एड्रेनालाईन और ग्लूकागन की कार्रवाई के तहत फॉस्फोरिलस बी एंजाइम की सक्रियता के कैस्केड तंत्र के परिणामस्वरूप होती है। लिवर ग्लाइकोजन रक्त में ग्लूकोज छोड़ता है, क्योंकि, मांसपेशियों के विपरीत, एंजाइम ग्लूकोज -6-फॉस्फेटेस यकृत में कार्य करता है। मांसपेशियों के ग्लूकोज-6-फॉस्फेट का उपयोग ऊर्जा के लिए किया जाता है।
ग्लाइकोजन जैवसंश्लेषण भोजन के बाद होता है, इसे जमा करने के लिए रक्त में ग्लूकोज की वृद्धि हुई एकाग्रता की स्थितियों में। इस प्रक्रिया में जिगर और मांसपेशियां विशेष रूप से गहन होती हैं। नियामक एंजाइम ग्लाइकोजन सिंथेटेस है, जिसकी गतिविधि इंसुलिन द्वारा बढ़ जाती है।
शर्करा का अंतर्संबंध फ्रुक्टोज और गैलेक्टोज के ग्लूकोज या इसके डेरिवेटिव में परिवर्तन की प्रक्रिया है। ऊतक प्रकार और उम्र के आधार पर, फ्रुक्टोज और गैलेक्टोज को ग्लूकोज में परिवर्तित करने के लिए कई विकल्प हैं।
मानव शरीर में ग्लूकोज के चयापचय पथ और उपयोग कई हैं। जिन दिशाओं में ग्लूकोज को कैटाबलाइज़ किया जाएगा, वे कोशिकाओं के प्रकार पर निर्भर करते हैं (एनारोब, एरोबेस या संकाय कोशिकाएं), पर्यावरण में उनके अस्तित्व की स्थिति, साथ ही साथ विभिन्न यौगिकों के लिए अंगों और ऊतकों की आवश्यकताएं जो कार्बोहाइड्रेट से संश्लेषित की जा सकती हैं।
मनुष्यों में, ग्लूकोज को मुख्य रूप से एरोबिक स्थितियों के तहत, यानी सेल में ऑक्सीजन की उपस्थिति में कैटाबोल किया जाता है। एरोबिक परिस्थितियों में कार्बोहाइड्रेट ऑक्सीकरण का मार्ग ऊर्जा के दृष्टिकोण से अधिक अनुकूल है, क्योंकि ग्लूकोज के प्रत्येक तिल लगभग 686 किलो कैलोरी प्रदान करता है। एनारोबिक मार्ग के माध्यम से ग्लूकोज की समान मात्रा के अपचय के साथ, केवल 47 किलो कैलोरी जारी किए जाते हैं। हालांकि, ग्लूकोज रूपांतरण का एनारोबिक मार्ग मानव शरीर के लिए बेहद महत्वपूर्ण है। ऑक्सीजन की कमी के साथ, अधिकांश अंगों और ऊतक कुछ समय के लिए केवल अवायवीय ग्लाइकोलाइसिस की दर में वृद्धि के कारण कार्य करते हैं। कुछ ऊतक एक ऊर्जा स्रोत (उदाहरण के लिए, मस्तिष्क कोशिकाओं) के रूप में ग्लूकोज अपचय पर सबसे अधिक निर्भर हैं। ग्लूकोज या हाइपोक्सिया के साथ मस्तिष्क की अपर्याप्त आपूर्ति चक्कर आना, आक्षेप, चेतना की हानि से प्रकट होती है।
चयापचय और कार्बोहाइड्रेट का कार्य।
मानव शरीर में कई दर्जन अलग-अलग मोनोसैकराइड और कई अलग-अलग ओलिगो और पॉलीसेकेराइड हैं। शरीर में कार्बोहाइड्रेट के कार्य निम्नानुसार हैं:
1) कार्बोहाइड्रेट ऊर्जा के स्रोत के रूप में काम करते हैं: उनके ऑक्सीकरण के कारण, ऊर्जा की पूरी मानव जरूरत का लगभग आधा हिस्सा संतुष्ट होता है। ऊर्जा चयापचय में, मुख्य भूमिका ग्लूकोज और ग्लाइकोजन की है।
2) कार्बोहाइड्रेट कोशिकाओं के संरचनात्मक और कार्यात्मक घटकों का हिस्सा हैं। इनमें न्यूक्लियोटाइड और न्यूक्लिक एसिड, ग्लाइकोलिपिड्स और ग्लाइकोप्रोटीन के कार्बोहाइड्रेट, इंटरसेल्युलर पदार्थ के हेटरोपोलिसैकेराइड शामिल हैं।
3) विशेष रूप से लिपिड और कुछ अमीनो एसिड में अन्य वर्गों के यौगिकों को शरीर में कार्बोहाइड्रेट से संश्लेषित किया जा सकता है।
इस प्रकार, कार्बोहाइड्रेट विभिन्न प्रकार के कार्य करते हैं, और उनमें से प्रत्येक शरीर के लिए महत्वपूर्ण है। लेकिन अगर हम मात्रात्मक पक्ष के बारे में बात करते हैं, तो पहला स्थान ऊर्जा के स्रोत के रूप में कार्बोहाइड्रेट के उपयोग के अंतर्गत आता है।
जानवरों में सबसे आम कार्बोहाइड्रेट ग्लूकोज है। यह कार्बोहाइड्रेट की ऊर्जा और प्लास्टिक कार्यों के बीच एक जोड़ने वाली कड़ी की भूमिका निभाता है, क्योंकि अन्य सभी मोनोसेकेराइड को ग्लूकोज से बनाया जा सकता है, और इसके विपरीत, विभिन्न मोनोसैकराइड को ग्लूकोज में परिवर्तित किया जा सकता है।
कार्बोहाइड्रेट के शरीर का स्रोत खाद्य कार्बोहाइड्रेट हैं - मुख्य रूप से स्टार्च, साथ ही सुक्रोज और लैक्टोज। इसके अलावा, ग्लूकोज शरीर में अमीनो एसिड, साथ ही ग्लिसरॉल से बनाया जा सकता है, जो वसा का हिस्सा है।
कार्बोहाइड्रेट का पाचन
पाचन तंत्र में खाद्य कार्बोहाइड्रेट ग्लाइकोसिडेसिस की कार्रवाई के तहत मोनोमर्स में टूट जाते हैं - एंजाइम जो ग्लाइकोसिडिक बॉन्ड के हाइड्रोलिसिस को उत्प्रेरित करते हैं।
स्टार्च पाचन पहले से ही मौखिक गुहा में शुरू होता है: लार में एंजाइम एमाइलेज (α-1,4-ग्लाइकोसिडेज़) होता है, जो α-1,4-ग्लाइकोसिडिक बॉन्ड को क्लीवेज करता है। चूंकि भोजन थोड़े समय के लिए मौखिक गुहा में होता है, स्टार्च केवल आंशिक रूप से यहां पचता है। स्टार्च के पाचन के लिए मुख्य स्थान छोटी आंत है, जहां अग्नाशयी अग्नाशय के रस में प्रवेश करती है। एमाइलेज डिसैक्राइड में ग्लाइकोसिडिक बांड को हाइड्रोलाइज नहीं करता है।
माल्टोस, लैक्टोज और सुक्रोज को क्रमशः ग्लाइकोसिडेस - माल्टेज, लैक्टेज और सुक्रेज द्वारा हाइड्रोलाइज्ड किया जाता है। इन एंजाइमों को आंतों की कोशिकाओं में संश्लेषित किया जाता है। कार्बोहाइड्रेट (ग्लूकोज, गैलेक्टोज, फ्रुक्टोज) के पाचन उत्पाद रक्तप्रवाह में प्रवेश करते हैं।
चित्र .1 कार्बोहाइड्रेट का पाचन
रक्त में ग्लूकोज की निरंतर एकाग्रता बनाए रखना दो प्रक्रियाओं के एक साथ होने का परिणाम है: यकृत से रक्त में ग्लूकोज का प्रवाह और ऊतकों द्वारा रक्त से इसकी खपत, जहां यह ऊर्जा सामग्री के लिए उपयोग किया जाता है।
विचार करें ग्लाइकोजन संश्लेषण.
ग्लाइकोजन - पशु उत्पत्ति का एक जटिल कार्बोहाइड्रेट, एक बहुलक, जिसका मोनोमर α- ग्लूकोज अवशेष है, जो 1-4, 1-6 ग्लाइकोसिडिक बंधों के माध्यम से जुड़े हुए हैं, लेकिन स्टार्च (3000 ग्लूकोज अवशेषों तक) की तुलना में अधिक शाखित संरचना है। ग्लाइकोजन का आणविक भार बहुत अधिक है - OH 1 से 15 मिलियन तक है। शुद्ध ग्लाइकोजन एक सफेद पाउडर है। यह पानी में अच्छी तरह से घुल जाता है, और शराब के साथ घोल से बनाया जा सकता है। "मैं" के साथ यह एक भूरा रंग देता है। यकृत में, यह कोशिका प्रोटीन के साथ एक जटिल में कणिकाओं के रूप में होता है। यकृत में ग्लाइकोजन की मात्रा 50-70 ग्राम तक पहुंच सकती है - यह है सामान्य रिजर्व ग्लाइकोजन; यकृत द्रव्यमान का 2 से 8% तक बनाता है। ग्लाइकोजन मांसपेशियों में भी पाया जाता है जहां यह बनता है स्थानीय रिजर्व, कम मात्रा में यह वसा ऊतकों सहित अन्य अंगों और ऊतकों में पाया जाता है। जिगर में ग्लाइकोजन कार्बोहाइड्रेट का एक मोबाइल आरक्षित है, 24 घंटे के लिए उपवास पूरी तरह से इसे कम कर देता है। व्हाइट एट अल के अनुसार, कंकाल की मांसपेशी में शरीर में कुल ग्लाइकोजन का लगभग 2/3 भाग होता है (मांसपेशियों के बड़े द्रव्यमान के कारण, अधिकांश ग्लाइकोजन उनमें होता है) - 120 ग्राम तक (एक आदमी का वजन 70 किलोग्राम तक), लेकिन कंकाल की मांसपेशियों में इसकी सामग्री 0 से है , वजन से 5 से 1%। यकृत ग्लाइकोजन के विपरीत, मांसपेशी ग्लाइकोजन उपवास द्वारा आसानी से समाप्त नहीं होता है, यहां तक \u200b\u200bकि विस्तारित अवधि के लिए भी। ग्लूकोज से जिगर में ग्लाइकोजन के संश्लेषण के लिए तंत्र को अब अलग कर दिया गया है। यकृत कोशिकाओं में, ग्लूकोज एक एंजाइम की भागीदारी के साथ फॉस्फोराइलेटेड होता है hexokinase ग्लूकोज -6-एफ के गठन के साथ।

रेखा चित्र नम्बर 2 ग्लाइकोजन संश्लेषण योजना
1. ग्लूकोज + एटीपी हेक्सोसिनेज ग्लूकोज-6-एफ + एडीपी
2. ग्लूकोज -6-एफ फॉस्फोग्लुकोमुटेस ग्लूकोज -1-एफ
(संश्लेषण में शामिल)
3. ग्लूकोज-1-एफ + यूटीपी ग्लूकोज-1-एफ यूरिडाइल ट्रांसफरेज यूडीपी-1-ग्लूकोज + एच 4 0 2 2 7
4. यूडीपी-1-ग्लूकोज + ग्लाइकोजन ग्लाइकोजन सिंथेज़ ग्लाइकोजन + यूडीपी
(बीज)
गठित यूडीपी को एटीपी द्वारा फिर से फॉस्फोराइलेट किया जा सकता है, और ग्लूकोज-1-एफ परिवर्तनों का पूरा चक्र फिर से दोहराया जाता है।
एंजाइम ग्लाइकोजन सिंथेज़ की गतिविधि को सहसंयोजक संशोधन द्वारा नियंत्रित किया जाता है। यह एंजाइम दो रूपों में हो सकता है: ग्लाइकोजन सिंथेज I (स्वतंत्र - ग्लूकोज -6-एफ से स्वतंत्र) और ग्लाइकोजन सिंथेज डी (आश्रित - ग्लूकोज-6-एफ पर निर्भर)।
प्रोटीन कीनेस एटीपी की भागीदारी के साथ फॉस्फोराइलेट्स (आई-एंजाइम फॉर्म को फॉस्फोराइलेट नहीं करता है, इसे डी-एंजाइम के फॉस्फोराइलेटेड रूप में परिवर्तित किया जाता है, जिसमें सेरीन के हाइड्रॉक्सिल समूह फॉस्फोरिलेटेड होते हैं)।
एटीपी + जीएस - ओएच प्रोटीन कीनेस एडीपी + जीएस - ओ - पी - ओह
ग्लाइकोजन सिंथेज़ I ग्लाइकोजन सिंथेज़ डी
ग्लाइकोजन सिंथेज़ का आई-फॉर्म डी-फॉर्म की तुलना में अधिक सक्रिय है, हालांकि, डी-फॉर्म एक विशिष्ट प्रदाता द्वारा सक्रिय किया जाने वाला एलोस्टरिक एंजाइम है - ग्लूकोज-6-एफ... एटी आराम मांसपेशी एंजाइम में है I-form फॉस्फोराइलेटेड नहीं है। सक्रिय रूप, पर कमी मांसपेशियों में, एंजाइम डी-फॉर्म द्वारा फॉस्फोराइलेटेड होता है और लगभग निष्क्रिय होता है। ग्लूकोज-6-फॉस्फेट की पर्याप्त उच्च एकाग्रता की उपस्थिति में, डी-फॉर्म पूरी तरह से सक्रिय है। इसके फलस्वरूप, फास्फोरिलीकरण और डिफॉस्फोरिलीकरण ग्लाइकोजन सिंथेज़ ग्लाइकोजन संश्लेषण के ठीक विनियमन में एक महत्वपूर्ण भूमिका निभाता है।
ग्लाइकोजन संश्लेषण का विनियमन:
अंतःस्रावी ग्रंथियों की एक संख्या, विशेष रूप से अग्न्याशय, रक्त शर्करा के नियमन में महत्वपूर्ण भूमिका निभाती है।
अग्न्याशय में लैंगरहंस के आइलेट्स की बी कोशिकाओं में इंसुलिन का उत्पादन होता है proinsulin... जब इंसुलिन में परिवर्तित किया जाता है, तो प्रोन्सुलिन पॉलीपेप्टाइड श्रृंखला को दो बिंदुओं पर चढ़ाया जाता है, और 22 अमीनो एसिड अवशेषों के मध्य निष्क्रिय टुकड़े को अलग किया जाता है।
इंसुलिन रक्त शर्करा को कम करता है, यकृत में ग्लाइकोजन के टूटने में देरी करता है, और मांसपेशियों में ग्लाइकोजन के भंडारण को बढ़ावा देता है।
हार्मोन ग्लूकागन हाइपरग्लिनेमिक के रूप में इंसुलिन के विपरीत कार्य करता है।
अधिवृक्क ग्रंथि रक्त शर्करा के नियमन में भी भाग लेते हैं। केंद्रीय तंत्रिका तंत्र से आवेगों के कारण एड्रेनालाईन की एक अतिरिक्त रिहाई होती है, जो अधिवृक्क मज्जा में बनती है। एपिनेफ्रीन एंजाइम गतिविधि को बढ़ाता है phosphogylase, जो ग्लाइकोजन के टूटने को उत्तेजित करता है। नतीजतन, रक्त शर्करा बढ़ जाता है। तथाकथित hyperglycelin (परीक्षा से पहले, शुरुआत से पहले भावनात्मक उत्तेजना)।
Corticosteroids एड्रेनालाईन के विपरीत, वे नाइट्रोजन-मुक्त अमीनो एसिड अवशेषों से ग्लूकोज के निर्माण को उत्तेजित करते हैं।
glycogenolysis
मुख्य रूप से जिगर और मांसपेशियों में ग्लाइकोजन जमा करने की क्षमता के कारण, और अन्य अंगों और ऊतकों में कुछ हद तक, आदर्श में कार्बोहाइड्रेट भंडार के संचय के लिए स्थितियां बनती हैं। ऊर्जा की खपत में वृद्धि के साथ, ग्लाइकोजन के ग्लूकोज के टूटने में वृद्धि होती है।
ग्लाइकोजन के दो तरीकों से आगे बढ़ सकते हैं: पहला - फॉस्फोरोलिटिक और 2 - hydrolytic.
फॉस्फोरोलिसिस ग्लाइकोजन के एकत्रीकरण में एक महत्वपूर्ण भूमिका निभाता है, इसे स्टोरेज से फॉस्फोरिलस एंजाइम की उपस्थिति में चयापचय रूप से सक्रिय रूप में परिवर्तित करता है।

चित्र 3 ग्लाइकोजन से ग्लूकोज अवशेषों के फॉस्फोरोलिटिक दरार का हार्मोनल विनियमन।
ग्लाइकोजन टूटने की प्रक्रिया हार्मोन एड्रेनालाईन और ग्लूकागन की कार्रवाई से शुरू होती है, जो निष्क्रिय एडिनाइलेट साइक्लेज को सक्रिय में बदल देती है। यह बदले में, एटीपी से सीएमपी के गठन को बढ़ावा देता है। सक्रिय प्रोटीन काइनेज और फॉस्फोरिलस कीनेज "बी" की कार्रवाई के तहत, निष्क्रिय फॉस्फोरिलस "बी" सक्रिय "ए" में परिवर्तित हो जाता है।
फॉस्फोराइलेज एंजाइम दो रूपों में मौजूद है: फॉस्फोरिलस "बी" - निष्क्रिय (डिमेरर), फॉस्फोराइलेज "ए" - सक्रिय (टेट्रामर)। प्रत्येक सबयूनिट्स में एक फॉस्फोसरीन अवशेष होता है, जो उत्प्रेरक गतिविधि के लिए महत्वपूर्ण है, और एक पाइरिडोक्सल फॉस्फेट कोएंजाइम अणु सहसंयोजक एक लाइसिन अवशेषों से जुड़ा हुआ है।
2 मीटर फॉस्फोरिलस "बी" + 4 एटीपी एमजी ++ 1 एम। फॉस्फोरिलस "a" + 4 ADP
सक्रिय फॉस्फोरिलस कीनेस एच 3 पीओ 4 की उपस्थिति में ग्लाइकोजन पर कार्य करता है, जो ग्लूकोज-1-फॉस्फेट के गठन की ओर जाता है। परिणामस्वरूप ग्लूकोज-1-फॉस्फेट फॉस्फोग्लुकोमुटेस की कार्रवाई के तहत ग्लूकोज-6-फॉस्फेट में बदल जाता है। ग्लूकोज -6-फॉस्फेट द्वारा मुक्त ग्लूकोज का निर्माण होता है।
ग्लुकोनियोजेनेसिस
ग्लाइकोजन संश्लेषण से किया जा सकता है गैर कार्बोहाइड्रेट सब्सट्रेट, इस प्रक्रिया को कहा जाता है ग्लुकोनियोजेनेसिस... में सब्सट्रेट ग्लुकोनियोजेनेसिस बोल सकता हूँ लैक्टेट (लैक्टिक एसिड) ग्लूकोज के अवायवीय ऑक्सीकरण के दौरान गठित
(ग्लाइकोलाइसिस)। बस ग्लाइकोलाइसिस प्रतिक्रियाओं को उलट कर, यह कई एंजाइमों द्वारा उत्प्रेरित संतुलन के उल्लंघन के कारण प्रक्रिया आगे नहीं बढ़ सकती है.

चित्र 4 ग्लाइकोलाइसिस और ग्लूकोनोजेनेसिस
इन प्रतिक्रियाओं का उलटा परिणाम निम्नलिखित प्रक्रियाओं के माध्यम से प्राप्त होता है:
परिवर्तन का मुख्य मार्ग माइटोकॉन्ड्रिया में स्थानीय ऑक्सीकरण के लिए पीवीसी... माइटोकॉन्ड्रियल झिल्ली से गुजरने के बाद
पीवीसी carboxylatedऑक्सालोसेटेट और रूप में मिटोकोंड्रिया छोड़ देता है malate (यह पथ मात्रात्मक रूप से अधिक महत्वपूर्ण है) और फिर से साइटोप्लाज्म में बदल जाता है oxaloacetate... साइटोप्लाज्म में गठित ऑक्सालोसेटेट को ग्लूकोज-6-एफ में बदल दिया जाता है। dephosphorylation यह किया जाता है ग्लूकोज-6-फॉस्फेट एंडोप्लाज्मिक रेटिकुलम में, तक शर्करा.
ग्लाइकोलाइसिस
ग्लाइकोलाइसिस - ग्लूकोज को परिवर्तित करने की एक जटिल एंजाइमेटिक प्रक्रिया, ओ 2 की अपर्याप्त खपत के साथ होती है। ग्लाइकोलाइसिस का अंतिम उत्पाद लैक्टिक एसिड है।

चित्र 4 ग्लाइकोलाइसिस और ग्लूकोनोजेनेसिस
ग्लाइकोलिसिस के लिए समग्र समीकरण निम्नानुसार दर्शाया जा सकता है:
C 6 H 12 O 6 + 2ADP + 2F H 2CH 3 CH (OH) COOH + 2ATF + 2 एच 2 ओ
ग्लाइकोलाइसिस का जैविक महत्व:
I. ग्लाइकोलाइसिस की प्रत्यावर्तीता - ग्लूकोनोजेनेसिस के कारण लैक्टिक एसिड से ग्लूकोज का गठन किया जा सकता है।
द्वितीय। फॉस्फोराइलेटेड यौगिकों का निर्माण - हेक्सोज़ और ट्रायोज़, जो शरीर में अधिक आसानी से परिवर्तित होते हैं।
तृतीय। ग्लाइकोलिसिस प्रक्रिया उच्च ऊंचाई की स्थिति में, अल्पकालिक शारीरिक गतिविधि के साथ-साथ हाइपोक्सिया के साथ होने वाली बीमारियों में बहुत महत्वपूर्ण है।
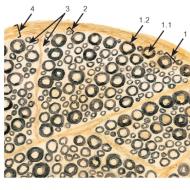
केवल मोनोसेकेराइड आंत में अवशोषित होते हैं: ग्लूकोज, गैलेक्टोज, फ्रुक्टोज। इसलिए, ऑलिगो- और पॉलीसेकेराइड जो भोजन के साथ शरीर में प्रवेश करते हैं, मोनोसेकेराइड बनाने के लिए एंजाइम सिस्टम द्वारा हाइड्रोलाइज्ड होना चाहिए। अंजीर में। 5.11 कार्बोहाइड्रेट के पाचन में शामिल एंजाइमैटिक प्रणालियों के स्थानीयकरण को दर्शाता है, जो मौखिक -एमाइलेज की कार्रवाई के साथ मौखिक गुहा में शुरू होता है और फिर अग्नाशय-ए-एमिलेज, सूक्रेज़-आइसोमाल्टेस, ग्लाइकोमाइलेज, -ग्लाइकोसाइड की मदद से आंत के विभिन्न हिस्सों में जारी रहता है। ट्रेलेज़ कॉम्प्लेक्स।
चित्र: 5.11। कार्बोहाइड्रेट के पाचन के लिए एंजाइम प्रणालियों के स्थानीयकरण की योजना
5.2.1। मौखिक और अग्नाशय के साथ कार्बोहाइड्रेट का पाचन -माइलेस -1,4-glycosidases)।भोजन के साथ प्राप्त पॉलीसेकेराइड्स, स्टार्च (जिसमें अमाइलोज़ का एक रैखिक पॉलीसेकेराइड होता है, जिसमें ग्लूकोसाइल अवशेष β-1,4-ग्लाइकोसिडिक बॉन्ड, और एमाइलोपेक्टिन, एक ब्रंचयुक्त पॉलीसेकेराइड, जहां by-1,6-ग्लाइकोसिडिक बॉन्ड भी पाए जाते हैं) से जुड़े होते हैं , लार में हाइड्रोलाइटिक एंजाइम moist-amylase (yl-1,4-ग्लाइकोसिडेज़) (K.F. 3.2.1.1) युक्त लार के साथ पहले से ही मौखिक गुहा में हाइड्रोलाइज़ करना शुरू करें, जो स्टार्च में 1,4-ग्लाइकोसिडिक बॉन्ड को क्लीयर करता है, लेकिन नहीं 1,6-ग्लाइकोसिडिक बांड पर अभिनय।


इसके अलावा, मौखिक गुहा में स्टार्च के साथ एंजाइम का संपर्क समय कम है, इसलिए स्टार्च आंशिक रूप से पच जाता है, जिससे rin डेक्सट्रिन के बड़े टुकड़े और थोड़ा माल्टोस डिसाकाराइड बनता है। डिसैकराइड्स लार वाले एमाइलेज द्वारा हाइड्रोलाइज नहीं किए जाते हैं।
जब यह अम्लीय वातावरण में पेट में प्रवेश करता है, तो लार वाले एमाइलेज को रोक दिया जाता है, पाचन प्रक्रिया केवल भोजन कोमा के अंदर हो सकती है, जहां एमिलेस गतिविधि कुछ समय तक बनी रह सकती है जब तक कि पूरे टुकड़े में पीएच अम्लीय नहीं हो जाता। गैस्ट्रिक जूस में कार्बोहाइड्रेट को तोड़ने वाले एंजाइम नहीं होते हैं, केवल ग्लाइकोसिडिक बॉन्ड की थोड़ी अम्लीय हाइड्रोलिसिस संभव है।
ऑलिगो- और पॉलीसेकेराइड्स के हाइड्रोलिसिस की मुख्य साइट छोटी आंत है, जिसके विभिन्न भागों में कुछ ग्लाइकोसिडेसिस स्रावित होते हैं।
ग्रहणी में, पेट की सामग्री अग्नाशय के स्राव से बाइकार्बोनेट्स एचसीओ 3 um से युक्त होती है और 7.5 - 8.0 का पीएच होती है। अग्न्याशय के रहस्य में, अग्नाशयी एमाइलेज पाया जाता है, जो स्टार्च और डेक्सट्रिन में हाइड्रोलाइज़ of-1,4-ग्लाइकोसिडिक बॉन्ड बनाता है जिससे माल्टोस डिसैकेराइड्स बनते हैं (इस कार्बोहाइड्रेट में, दो ग्लूकोज अवशेष एक -1,4-ग्लाइकोसिडिक बॉन्ड से जुड़े होते हैं) और आइसोमाल्टो (इस कार्बोहाइड्रेट में) स्टार्च अणु में शाखा बिंदुओं पर स्थित ग्लूकोज के शेष और 1,-1,6-ग्लाइकोसिडिक बांड द्वारा जुड़ा हुआ है)। ओलिगोसैकेराइड भी os-1,4-ग्लाइकोसिडिक और--1,6-ग्लाइकोसिडिक बॉन्ड द्वारा जुड़े 8-10 ग्लूकोज अवशेषों के साथ बनते हैं।
दोनों एमाइलेज एंडोग्लाइकोसाइड हैं। अग्नाशयी एमाइलेज स्टार्च और--1,4-ग्लाइकोसिडिक बांडों में ze-1,6-ग्लाइकोसिडिक बांडों को हाइड्रोलाइज नहीं करता है, जिसके द्वारा ग्लूकोज अवशेष सेल्यूलोज अणु में जुड़े होते हैं।

सेल्यूलोज आंतों के माध्यम से अपरिवर्तित होता है और एक गिट्टी के रूप में कार्य करता है, जिससे भोजन और पाचन को सहायता मिलती है। बड़ी आंत में, बैक्टीरियल माइक्रोफ्लोरा की कार्रवाई के तहत, सेल्यूलोज को अल्कोहल, कार्बनिक एसिड और सीओ 2 बनाने के लिए आंशिक रूप से हाइड्रोलाइज किया जा सकता है, जो आंतों की गतिशीलता के उत्तेजक के रूप में कार्य कर सकता है।
ऊपरी आंत में निर्मित, माल्टोस, आइसोमाल्टोज, और ट्राइक सैकराइड्स को विशिष्ट ग्लाइकोसिडेस द्वारा छोटी आंत में आगे हाइड्रोलाइज्ड किया जाता है। खाद्य डिसैक्राइड, सुक्रोज और लैक्टोज, भी छोटी आंत में विशिष्ट डिसैकराइड्स द्वारा हाइड्रोलाइज्ड होते हैं।
आंतों के लुमेन में, ऑलिगो- और डिसैक्रिडिड्स की गतिविधि कम होती है, लेकिन अधिकांश एंजाइम उपकला कोशिकाओं की सतह से जुड़े होते हैं, जो आंत में उंगली की तरह फैलने वाले प्रकोपों \u200b\u200bपर स्थित होते हैं and विली और खुद, बदले में, माइक्रोविली के साथ कवर किया जाता है, ये सभी कोशिकाएं एक सीमा सीमा बनाती हैं जो सतह को बढ़ाने के लिए एक ब्रश सीमा बनाती हैं। उनके सबस्ट्रेट्स के साथ।
डिसाकार्इड्स में ग्लाइकोसिडिक बॉन्ड्स को क्लीजिंग, एंजाइम (डिसैक्रैसीडेस) को एंजाइमों में वर्गीकृत किया जाता है जो एंटरोसाइट्स के साइटोप्लाज्मिक झिल्ली की बाहरी सतह पर स्थित होते हैं: सुक्रोज-आइसोमाल्टेज, ग्लाइकोमाइलेज, ऑनलाइन-ग्लाइकोसिडेज।
5.2.2। चीनी आइसोमाल्टेस कॉम्प्लेक्स। इस कॉम्प्लेक्स में दो पॉलीपेप्टाइड चेन होते हैं और पॉलीपेप्टाइड के एन-टर्मिनल छोर पर स्थित एक ट्रांसएम्ब्रेनर हाइड्रोफोबिक डोमेन के माध्यम से एंटरोसाइट की सतह से जुड़ जाते हैं। सुगर-आइसोमाल्टेज कॉम्प्लेक्स (EC 3.2.1.48 और 3.2.1.10) सुक्रोज और आइसोमाल्टोज में -1,2- और--1,6-ग्लाइकोसिडिक बॉन्ड को साफ करता है।


कॉम्प्लेक्स के दोनों एंजाइम भी माल्टोज और माल्टोट्रायोज (तीन ग्लूकोज अवशेषों वाले एक ट्राइसैकेराइड और स्टार्च के हाइड्रोलिसिस के दौरान गठित) में हाइड्रोलाइजिंग 1,-1,4-ग्लाइकोसिडिक बॉन्ड में सक्षम हैं।

हालांकि कॉम्प्लेक्स में एक उच्च मॉल्टेज़ गतिविधि होती है, ऑलिगो- और पॉलीसैकराइड्स के पाचन के दौरान गठित 80% माल्टोज़ की हाइड्रोलाइजिंग, इसकी मुख्य विशिष्टता अभी भी सुक्रोज और आइसोमाल्टोज़ की हाइड्रोलिसिस है, जो माल्टोस में बॉन्डोलिसिडिक बॉन्ड की हाइड्रोलिसिस की दर से अधिक है, जो माल्टोज़ में बॉन्डलिसिस की दर से अधिक है। इस मामले में, सुक्रोज सबयूनिट एकमात्र आंत्र एंजाइम है जो सूक्रोज को हाइड्रोलाइज करता है। जटिल मुख्य रूप से जेजुनम \u200b\u200bमें स्थानीयकृत होता है, आंत के समीपस्थ और बाहर के हिस्सों में, सुक्रेज़-आइसोमाल्टेस कॉम्प्लेक्स की सामग्री नगण्य है।
5.2.3। ग्लाइकोमाइलेज परिसर। यह कॉम्प्लेक्स (EC 3.2.1.3 और 3.2.1.20) oligosaccharides में ग्लूकोज अवशेषों के बीच α-1,4-ग्लाइकोसिडिक बॉन्ड को हाइड्रोलाइज करता है। ग्लाइकोमाइलेज़ कॉम्प्लेक्स के अमीनो एसिड अनुक्रम में 60% समरूपता है जिसमें सुक्रेज़-आइसोमाल्टेज़ कॉम्प्लेक्स का अनुक्रम होता है। दोनों कॉम्प्लेक्स 31 ग्लाइकोसिल हाइड्रॉलिसिस के परिवार से संबंधित हैं। एक्सोग्लाइकोसिडेस होने के नाते, एंजाइम कम करने वाले अंत से कार्य करता है, यह माल्टोज़ को भी तोड़ सकता है, इस प्रतिक्रिया में माल्टेज़ के रूप में कार्य करता है (जबकि ग्लाइकोमाइलेज़ कॉम्प्लेक्स हाइड्रेटिंग शेष 20% माल्टो ओलिगो- और पॉलीसेकेराइड पाचन के दौरान बनता है)। जटिल में सब्सट्रेट विशिष्टता में मामूली अंतर के साथ दो उत्प्रेरक सबयूनिट शामिल हैं। जटिल छोटी आंत के निचले हिस्सों में सबसे अधिक सक्रिय है।
5.2.4. -ग्लाइकोसिड्स कॉम्प्लेक्स (लैक्टेज)। यह एंजाइम जटिल लैक्टोज में गैलेक्टोज और ग्लूकोज के बीच β-1,4-ग्लाइकोसिडिक बॉन्ड को हाइड्रोलाइज करता है।

ग्लाइकोप्रोटीन ब्रश सीमा के साथ जुड़ा हुआ है और असमान रूप से छोटी आंत में वितरित किया जाता है। उम्र के साथ, लैक्टेज की गतिविधि कम हो जाती है: यह शिशुओं में अधिकतम है, वयस्कों में यह बच्चों में पृथक एंजाइम गतिविधि के स्तर का 10% से कम है।
5.2.5। Trehalase... यह एंजाइम (K.F. 3.2.1.28) एक ग्लाइकोसिडेज़ कॉम्प्लेक्स है जो ट्रेलेज़ में मोनोमर्स के बीच हाइड्रोलाइज़ बॉन्ड, कवक में पाया जाने वाला एक डिसाकेराइड और पहले एनोमेरिक कार्बन परमाणुओं के बीच ग्लाइकोसिडिक बॉन्ड से जुड़े दो ग्लूकोसाइल अवशेषों से बना है।

ग्लाइकोसिइल हाइड्रॉलिस की कार्रवाई के परिणामस्वरूप, मोनोसेकेराइड खाद्य कार्बोहाइड्रेट से बनते हैं: ग्लूकोज, फ्रुक्टोज, गैलेक्टोज, कुछ हद तक, मैनोज़, ज़ाइलोज़, अरबिनोज़, जो कि जेजुनम \u200b\u200bऔर इलियम के उपकला कोशिकाओं द्वारा अवशोषित होते हैं और इन कोशिकाओं के झिल्ली के माध्यम से ले जाया जाता है।
5.2.6। आंतों के उपकला कोशिका झिल्ली में मोनोसैकराइड का परिवहन।आंतों के म्यूकोसा की कोशिकाओं में मोनोसेकेराइड का स्थानांतरण सुगम प्रसार और सक्रिय परिवहन द्वारा किया जा सकता है। सक्रिय परिवहन के मामले में, ग्लूकोज झिल्ली के पार Na + आयन के साथ एक वाहक प्रोटीन द्वारा ले जाया जाता है, और ये पदार्थ इस प्रोटीन के विभिन्न भागों (छवि 5.12) के साथ बातचीत करते हैं। Na + आयन एकाग्रता ढाल के साथ कोशिका में प्रवेश करता है, और ग्लूकोज एकाग्रता ढाल (द्वितीयक-सक्रिय परिवहन) के खिलाफ होता है, इसलिए, बड़ा ढाल, अधिक ग्लूकोज एंटरोसाइट्स में स्थानांतरित हो जाता है। बाह्य तरल पदार्थ में Na + की एकाग्रता में कमी के साथ, ग्लूकोज की आपूर्ति कम हो जाती है। Na + की एकाग्रता ढाल, जो सक्रिय लक्षण को रेखांकित करती है, Na +, K + -ATPase की कार्रवाई द्वारा प्रदान की जाती है, जो K + आयन के बदले सेल से बाहर पंप + के रूप में कार्य करता है। इसी तरह, गैलेक्टोज माध्यमिक-सक्रिय परिवहन के तंत्र द्वारा एंटरोसाइट्स में प्रवेश करता है।

चित्र: 5.12। एंटरोसाइट्स में मोनोसेकेराइड का प्रवेश। SGLT1 उपकला कोशिका झिल्ली में एक सोडियम-निर्भर ग्लूकोज / गैलेक्टोज ट्रांसपोर्टर है; Na +, K + -ATPase बेसोललेटरल झिल्ली पर SGLT1 के कामकाज के लिए आवश्यक सोडियम और पोटेशियम आयनों की एकाग्रता ढाल बनाता है। GLUT5 सेल में झिल्ली के माध्यम से मुख्य रूप से फ्रुक्टोज का परिवहन करता है। बेसोल्टल मेम्ब्रेन पर GLUT2 ग्लूकोज, गैलेक्टोज और फ्रुक्टोज को सेल से स्थानांतरित करता है (तदनुसार)
सक्रिय परिवहन के कारण, एंटरोसाइट्स आंतों के लुमेन में कम एकाग्रता पर ग्लूकोज को अवशोषित कर सकते हैं। ग्लूकोज की उच्च एकाग्रता पर, यह विशेष वाहक प्रोटीन (ट्रांसपोर्टर्स) की मदद से सुगम प्रसार के माध्यम से कोशिकाओं में प्रवेश करता है। उसी तरह, फ्रक्टोज को उपकला कोशिकाओं में स्थानांतरित किया जाता है।
मोनोसैकराइड्स मुख्य रूप से सुगम प्रसार के माध्यम से एंटरोसाइट्स से रक्त वाहिकाओं में प्रवेश करते हैं। आधा ग्लूकोज को पोर्टल शिरा के माध्यम से विल्ली के केशिकाओं के माध्यम से यकृत में ले जाया जाता है, और आधा रक्त द्वारा अन्य ऊतकों की कोशिकाओं तक पहुंचाया जाता है।
5.2.7। रक्त से कोशिकाओं तक ग्लूकोज का परिवहन। कोशिकाओं में रक्त से ग्लूकोज के प्रवेश को सुविधाजनक प्रसार द्वारा किया जाता है, अर्थात ग्लूकोज परिवहन की दर झिल्ली के दोनों किनारों पर इसकी सांद्रता के ग्रेडिएंट द्वारा निर्धारित होती है। मांसपेशियों और वसा ऊतकों की कोशिकाओं में, सुविधा फैलाना अग्नाशय हार्मोन इंसुलिन द्वारा नियंत्रित किया जाता है। इंसुलिन की अनुपस्थिति में, कोशिका झिल्ली में कोई ग्लूकोज ट्रांसपोर्टर नहीं होता है। एरिथ्रोसाइट्स (GLUT1) से ग्लूकोज का प्रोटीन वाहक (ट्रांसपोर्टर), जैसा कि अंजीर में देखा गया है। 5.13, एक ट्रांसमेंब्रेन प्रोटीन है जिसमें 492 एमिनो एसिड अवशेष होते हैं और एक डोमेन संरचना होती है। ध्रुवीय अमीनो एसिड अवशेष झिल्ली के दोनों किनारों पर स्थित हैं, हाइड्रोफोबिक वाले झिल्ली में स्थानीयकृत होते हैं, इसे कई बार पार करते हैं। झिल्ली के बाहर एक ग्लूकोज बाइंडिंग साइट है। जब ग्लूकोज बांधता है, तो वाहक का विरूपण बदल जाता है, और मोनोसेकेराइड बाध्यकारी साइट कोशिका के अंदर उजागर होती है। ग्लूकोज सेल में गुजरता है, वाहक प्रोटीन से अलग होता है।
5.2.7.1। ग्लूकोज ट्रांसपोर्टर: ग्लूट 1, 2, 3, 4, 5। सभी ऊतकों में, ग्लूकोज ट्रांसपोर्टर्स पाए गए थे, जिनमें से कई किस्में हैं, उनके पता लगाने के क्रम में गिने गए। पांच प्रकार के GLUT का वर्णन किया गया है जिनके पास एक समान प्राथमिक संरचना और डोमेन संगठन है।
ग्लूट 1, मस्तिष्क में स्थानीय, प्लेसेंटा, गुर्दे, बड़ी आंत, एरिथ्रोसाइट्स, मस्तिष्क को ग्लूकोज की आपूर्ति करता है।
ग्लूट 2, ग्लूकोज को उन अंगों से ट्रांसपोर्ट करता है जो इसे रक्त में छोड़ते हैं: एंटरोसाइट्स, यकृत, इसे अग्न्याशय के लैंगरहैंस के आइलेट्स के glucose-कोशिकाओं तक पहुंचाता है।
ग्लूट 3 मस्तिष्क, अपरा, गुर्दे सहित कई ऊतकों में पाया जाता है, और तंत्रिका ऊतक की कोशिकाओं को ग्लूकोज प्रवाह प्रदान करता है।
ग्लूट 4 ग्लूकोज को मांसपेशियों की कोशिकाओं (कंकाल और कार्डियक) और वसा ऊतक में स्थानांतरित करता है, और इंसुलिन पर निर्भर है।
GLUT 5 छोटी आंत की कोशिकाओं में पाया जाता है और संभवतः फ्रुक्टोज को वहन करता है।
सभी वाहक साइटोप्लाज्मिक दोनों में स्थित हो सकते हैं

चित्र: 5.13। एरिथ्रोसाइट्स (GLUT1) से ग्लूकोज के प्रोटीन-वाहक (ट्रांसपोर्टर) की संरचना (के अनुसार)
कोशिका पुटिका और प्लाज्मा झिल्ली में। इंसुलिन की अनुपस्थिति में, GLUT 4 केवल कोशिका के अंदर स्थित होता है। इंसुलिन के प्रभाव में, पुटिकाओं को प्लाज्मा झिल्ली में स्थानांतरित किया जाता है, इसके साथ विलय होता है, और GLUT 4 को झिल्ली में शामिल किया जाता है, जिसके बाद ट्रांसपोर्टर कोशिका में ग्लूकोज के प्रसार की सुविधा प्रदान करता है। रक्त में इंसुलिन की एकाग्रता में कमी के बाद, ट्रांसपोर्टर फिर से साइटोप्लाज्म में वापस आ जाते हैं और सेल में ग्लूकोज का परिवहन बंद हो जाता है।
ग्लूकोज ट्रांसपोर्टर्स के काम में विभिन्न विकारों की पहचान की गई है। वाहक प्रोटीन में एक वंशानुगत दोष के साथ, गैर-इंसुलिन-निर्भर मधुमेह मेलेटस विकसित होता है। प्रोटीन दोषों के अलावा, अन्य विकार भी हैं: 1) इंसुलिन संकेत के संचरण में एक दोष झिल्ली के लिए ट्रांसपोर्टर के आंदोलन के बारे में, 2) ट्रांसपोर्टर के आंदोलन में एक दोष, 3) झिल्ली में प्रोटीन के समावेश में एक दोष, 4) झिल्ली से टुकड़ी का उल्लंघन।
5.2.8। इंसुलिन।यह यौगिक अग्न्याशय में लैंगरहैंस के आइलेट्स के secret- कोशिकाओं द्वारा स्रावित एक हार्मोन है। इंसुलिन एक पॉलीपेप्टाइड है जिसमें दो पॉलीपेप्टाइड श्रृंखलाएं शामिल हैं: एक में 21 एमिनो एसिड अवशेष (श्रृंखला ए), दूसरे में 30 एमिनो एसिड अवशेष (श्रृंखला बी) हैं। जंजीरों को दो डाइसल्फ़ाइड बांडों द्वारा परस्पर जोड़ा जाता है: A77B7, A20 interB19। ए-चेन के अंदर छठे और ग्यारहवें अवशेषों के बीच एक इंट्रामोलॉजिकल डाइसल्फ़ाइड बॉन्ड होता है। हार्मोन दो अनुरूपों में मौजूद हो सकता है: टी और आर (छवि। 5.14)।

चित्र: 5.14। इंसुलिन के मोनोमेरिक रूप की स्थानिक संरचना: तथा पोर्सिन इंसुलिन, टी-कॉनफॉर्मेशन, ख मानव इंसुलिन, आर-कॉनफॉर्मेशन (ए-चेन दिखाया गया है लाल रंग, बी-सर्किट पीला) (इसके अनुसार)
हार्मोन एक मोनोमर, डिमर और हेक्सामर के रूप में मौजूद हो सकता है। हेक्सामेरिक रूप में, इंसुलिन को एक जस्ता आयन द्वारा स्थिर किया जाता है, जो सभी छह सबयूनिट्स (चित्र। 5.15) की हिस 10 बी-चेन के साथ समन्वय बांड बनाता है।
स्तनधारी इंसुलिन मानव इंसुलिन के साथ अपनी प्राथमिक संरचना में एक महान समरूपता है: उदाहरण के लिए, सुअर इंसुलिन में, बी-चेन के कार्बोक्सिल अंत में थ्रेओनीन के बजाय केवल एक प्रतिस्थापन тре alanine है, गोजातीय इंसुलिन में मानव इंसुलिन की तुलना में तीन अन्य एमिनो एसिड अवशेष हैं। सबसे आम प्रतिस्थापन 8, 9 और 10 के श्रृंखला ए के पदों पर होते हैं, लेकिन वे हार्मोन की जैविक गतिविधि को महत्वपूर्ण रूप से प्रभावित नहीं करते हैं।
डाइसल्फ़ाइड बांड, ए-चेन के सी और एन-टर्मिनल क्षेत्रों में और बी-चेन के सी-टर्मिनल क्षेत्रों में हाइड्रोफोबिक अवशेषों के पदों पर अमीनो एसिड अवशेषों के पदार्थ बहुत दुर्लभ हैं, जो इंसुलिन की जैविक गतिविधि के प्रकटीकरण में इन क्षेत्रों के महत्व को इंगित करता है। हार्मोन के सक्रिय केंद्र के गठन में B- श्रृंखला के Phe24 और Phe25 अवशेष और A- श्रृंखला के C- और N- टर्मिनल अवशेष शामिल हैं।

चित्र: 5.15। इंसुलिन हेक्सामर (R 6) की स्थानिक संरचना (के अनुसार)
5.2.8.1। इंसुलिन जैवसंश्लेषण।इंसुलिन को एक अग्रदूत के रूप में संश्लेषित किया जाता है ins प्रीप्रोफुलिन रफ एंडोप्लाज्मिक रेटिकुलम में पॉलीब्रायोसोम पर 110 अमीनो एसिड अवशेषों से युक्त होता है। बायोसिंथेसिस एक सिग्नल पेप्टाइड के गठन से शुरू होता है जो एंडोप्लाज्मिक रेटिकुलम के लुमेन में प्रवेश करता है और बढ़ते पॉलीपेप्टाइड के आंदोलन को निर्देशित करता है। संश्लेषण के अंत में, 24 अमीनो एसिड अवशेषों के एक सिग्नल पेप्टाइड को प्रीप्रोन्सुलिन से प्रोएन्सुलिन बनाने के लिए क्लीव किया जाता है, जिसमें 86 अमीनो एसिड अवशेष होते हैं और इसे गोल्गी तंत्र में स्थानांतरित कर दिया जाता है, जहां आगे इंसुलिन का विकास सिस्टर्न में होता है। प्रोन्सुलिन की स्थानिक संरचना अंजीर में दिखाई गई है। 5.16।
लंबे समय तक परिपक्वता के दौरान सेरीन एंडोपेप्टिडेस पीसी 2 और पीसी 1/3 की कार्रवाई के तहत, पहले Arg64 और Lys65 के बीच पेप्टाइड बॉन्ड को क्लीव किया जाता है, फिर Arg31 और Arg32 द्वारा बनाया गया पेप्टाइड बॉन्ड हाइड्रोलाइज्ड होता है, जिसमें सी-पेप्टाइड के क्लीवेज के साथ 31 अमीनो एसिड रेजिडेंट होता है। 51 अमीनो एसिड अवशेषों वाले इंसुलिन में प्रोलिनल का रूपांतरण ए-चेन के एन-टर्मिनस में एर्गिनिन अवशेषों के हाइड्रोलिसिस के साथ समाप्त होता है और कार्बोक्जाइटिपिडेज़ बी के समान एक विशिष्टता प्रदर्शित करने वाले कार्बोक्जाइटिड ई की कार्रवाई के तहत बी-चेन के सी-टर्मिनस, अर्थात् यह हाइड्रोक्लोराइड्स है जो मुख्य अमीनो एसिड (चित्र। 5.17 और 5.18) से संबंधित है।

चित्र: 5.16। प्रोटिओलिसिस को बढ़ावा देने वाले संक्रमण में प्रिन्सुलिन की पुटीय स्थानिक संरचना। अमीनो एसिड के अवशेष (Arg64 और Lys65; Arg31 और Arg32), पेप्टाइड बांड जिनके बीच प्रोलिनल प्रसंस्करण के परिणामस्वरूप हाइड्रोलाइज्ड होता है (के अनुसार)
इक्विनोलर मात्रा में इंसुलिन और सी-पेप्टाइड स्रावी कणिकाओं में प्रवेश करते हैं, जहां इंसुलिन, जिंक आयन के साथ मिलकर डिमर्स और हेक्सामर्स बनाते हैं। स्रावी कणिकाओं, प्लाज्मा झिल्ली के साथ विलय, एक्सोसाइटोसिस के परिणामस्वरूप बाह्य तरल पदार्थ में इंसुलिन और सी-पेप्टाइड स्रावित करता है। रक्त प्लाज्मा में इंसुलिन का आधा जीवन 3 min10 मिनट है, और सी-पेप्टाइड लगभग 30 मिनट है। इंसुलिन एंजाइम इंसुलिन द्वारा विघटित हो जाता है, यह प्रक्रिया यकृत और गुर्दे में होती है।
5.2.8.2। इंसुलिन के संश्लेषण और स्राव का विनियमन। इंसुलिन स्राव का मुख्य नियामक ग्लूकोज है, जो मुख्य ऊर्जा वाहक के चयापचय में शामिल प्रोटीन के लिए इंसुलिन जीन और जीन की अभिव्यक्ति को नियंत्रित करता है। ग्लूकोज सीधे प्रतिलेखन कारकों के लिए बाध्य कर सकता है - इसका जीन अभिव्यक्ति की दर पर सीधा प्रभाव पड़ता है। इंसुलिन और ग्लूकागन के स्राव पर एक माध्यमिक प्रभाव संभव है, जब स्रावी कणिकाओं से इंसुलिन की रिहाई इंसुलिन mRNA प्रतिलेखन को सक्रिय करती है। लेकिन इंसुलिन का स्राव Ca 2+ आयनों की सांद्रता पर निर्भर करता है और ग्लूकोज की उच्च सांद्रता में भी उनकी कमी के साथ कम हो जाता है, जो इंसुलिन संश्लेषण को सक्रिय करता है। इसके अलावा, यह एड्रेनालाईन द्वारा बाधित होता है जब यह cept 2 रिसेप्टर्स से बांधता है। ग्रोथ हार्मोन, कोर्टिसोल, एस्ट्रोजेन, गैस्ट्रोइंटेस्टाइनल ट्रैक्ट के हार्मोन (सेक्रेटिन, कोलेसिस्टोकिनिन, गैस्ट्रिक इनहिबिटरी पेप्टाइड) इंसुलिन स्राव के उत्तेजक के रूप में कार्य करते हैं।

चित्र: 5.17। प्रीप्रोन्सुलिन का संश्लेषण और प्रसंस्करण (के अनुसार)
रक्त ग्लूकोज एकाग्रता में वृद्धि के जवाब में लैंगरहैंस के आइलेट्स की - कोशिकाओं द्वारा इंसुलिन स्राव इस प्रकार से लागू किया जाता है:

चित्र: 5.18। Arg64 और Lys65 के बीच पेप्टाइड बॉन्ड के हाइड्रोलिसिस द्वारा इंसुलिन में प्रोलिनिन का प्रसंस्करण, सेरीन एंडोपेप्टिडेस PC2 द्वारा उत्प्रेरित, और सेरिन एंडोपेप्टेसिड PC1 / 3 की कार्रवाई के तहत Arg31 और Arg32 के बीच पेप्टाइड बॉन्ड की दरार, क्लीवर के साथ परिवर्तन समाप्त होता है। कारबॉक्सेप्टिडेज़ ई की कार्रवाई के तहत बी-चेन (सर्कल में क्लीवबल अर्जीनी अवशेष दिखाए गए हैं)। प्रसंस्करण के परिणामस्वरूप, इंसुलिन के अलावा, सी-पेप्टाइड बनता है (के अनुसार)
1) ग्लूकोज को ग्लूअट 2 ट्रांसपोर्टर प्रोटीन के द्वारा क्षिप्रहृदय-कोशिकाओं में पहुँचाया जाता है;
2) सेल में, ग्लूकोज ग्लाइकोलाइसिस से गुजरता है और आगे एटीपी के गठन के साथ श्वसन चक्र में ऑक्सीकरण होता है; एटीपी संश्लेषण की तीव्रता रक्त में ग्लूकोज के स्तर पर निर्भर करती है;
3) एटीपी की कार्रवाई के तहत, पोटेशियम आयन चैनल बंद हो जाते हैं और झिल्ली को विध्रुवित किया जाता है;
4) झिल्ली विध्रुवण के कारण वोल्टेज पर निर्भर कैल्शियम चैनल खुलते हैं और कोशिका में कैल्शियम का प्रवेश होता है;
5) सेल में कैल्शियम के स्तर में वृद्धि फॉस्फोलिपेज़ सी को सक्रिय करती है, जो झिल्ली फॉस्फोलिपिड्स में से एक id फॉस्फेटिडाइलिनोसिटोल -4,5-डिपाहॉस्फेट osit इनोसिटोल-1,4,5-ट्राइफॉस्फेट और डायसाइल-ग्लिसरॉल में बदल देती है;
6) इनोसिटोल ट्राइफॉस्फेट, एंडोप्लाज्मिक रेटिकुलम के रिसेप्टर प्रोटीन के लिए बाध्य, बाध्य इंट्रासेल्युलर कैल्शियम की एकाग्रता में तेज वृद्धि का कारण बनता है, जो गुप्त कणिकाओं में संग्रहीत पूर्व संश्लेषित इंसुलिन की रिहाई की ओर जाता है।
5.2.8.3। कार्रवाई के इंसुलिन तंत्र। मांसपेशियों और वसा कोशिकाओं पर इंसुलिन का मुख्य प्रभाव सेल झिल्ली में ग्लूकोज के परिवहन को बढ़ाने के लिए है। इंसुलिन उत्तेजना 20-40 बार सेल में ग्लूकोज प्रवेश की दर में वृद्धि की ओर जाता है। जब इंसुलिन से प्रेरित होता है, तो प्लाज्मा झिल्ली में ग्लूकोज परिवहन प्रोटीन की सामग्री में 5-10 गुना वृद्धि होती है, जबकि इंट्रासेल्युलर पूल में उनकी सामग्री 50-60% कम हो जाती है। एटीपी के रूप में ऊर्जा की आवश्यक मात्रा मुख्य रूप से इंसुलिन रिसेप्टर के सक्रियण के लिए आवश्यक है, न कि ट्रांसपोर्टर प्रोटीन के फॉस्फोराइलेशन के लिए। ग्लूकोज परिवहन के उत्तेजना से ऊर्जा की खपत 20-30 गुना बढ़ जाती है, जबकि ग्लूकोज ट्रांसपोर्टरों को स्थानांतरित करने के लिए केवल एक छोटी राशि की आवश्यकता होती है। रिसेप्टर के साथ इंसुलिन की बातचीत के बाद, कुछ ही मिनटों में कोशिका झिल्ली में ग्लूकोज ट्रांसपोर्टर्स का अनुवाद देखा जाता है, और ट्रांसपोर्टर प्रोटीन के चक्रण की प्रक्रिया को तेज करने या बनाए रखने के लिए इंसुलिन के एक और उत्तेजक प्रभाव की आवश्यकता होती है।
इंसुलिन, अन्य हार्मोन की तरह, इसी रिसेप्टर प्रोटीन के माध्यम से कोशिकाओं पर कार्य करता है। इंसुलिन रिसेप्टर सेल झिल्ली का एक जटिल अभिन्न प्रोटीन है, जिसमें दो-सबयूनिट्स (130 केडीए) और दो)-सबयूनिट्स (95 केडीए) शामिल हैं; पूर्व पूरी तरह से कोशिका के बाहर स्थित है, इसकी सतह पर, बाद में प्लाज्मा झिल्ली में प्रवेश होता है।
इंसुलिन रिसेप्टर एक टेट्रामर है जिसमें दो बाह्य β-सबयूनिट्स होते हैं जो हार्मोन के साथ परस्पर क्रिया करते हैं और सिस्टीन 524 और ट्रिपल Cys682, Cys683, दोनों β-सबयूनिट्स के Cys685 के बीच डिस्फ़ाइड पुलों द्वारा एक दूसरे से जुड़े होते हैं (देखें Fig.5.19, देखें) तथा), और Cys647 () और Cys872 के बीच एक डाइसल्फ़ाइड पुल से जुड़ी tyrosine kinase गतिविधि का प्रदर्शन करने वाले दो ट्रांसमीटर ए-सबयूनिट्स। 135 kDa के आणविक भार के साथ -सबयूनिट की पॉलीपेप्टाइड श्रृंखला में 719 अमीनो होते हैं

चित्र: 5.19। इंसुलिन रिसेप्टर डिमर संरचना: तथा इंसुलिन रिसेप्टर की मॉड्यूलर संरचना। ऊपर - -सबयूनिट्स डिसल्फ़ाइड पुलों द्वारा लिंक किए गए Cys524, Cys683 by685 और छह डोमेन से मिलकर: दो युक्त ल्यूसीन दोहराता है L1 और L2, एक सिस्टीन-समृद्ध सीआर क्षेत्र, और तीन फ़ाइब्रोनेक्टिन प्रकार III डोमेन Fn o, Fn 1, ID (प्रविष्टि डोमेन) ... नीचे - sub-सबयूनिट को डाइसल्फ़ाइड ब्रिज Cys647Cys872 से जोड़ा गया और सात डोमेन से मिलकर बने: तीन फ़ाइब्रोनेक्टिन डोमेन ID, Fn 1 और Fn 2, TM डोमेन ट्रांसमीटर JM डोमेन की झिल्ली से सटे, tyrosine kinase डोमेन, TK, CM टर्मिनल के समीप। अनुसूचित जनजाति; ख रिसेप्टर का स्थानिक स्थान, एक डिमर रंग में दिखाया गया है, दूसरा सफेद है, हार्मोन बाइंडिंग साइट एक्स (लाल) के विपरीत ए to एक्टिवेटिंग लूप है, जो उप-सबिटिट का एक्स-टर्मिनल हिस्सा (एक्स) (काला) black एन-टर्मिनल पार्ट-सबयूनिट का हिस्सा है। , 524, 683-685, 647-872 (पदों के अनुसार) पर सिस्टीन अवशेषों के बीच पीले रंग के 1,2,3 डाइसल्फ़ाइड बांड
एसिड अवशेष और छह डोमेन होते हैं: दो डोमेन L1 और L2 युक्त ल्यूसीन दोहराता है, CR का एक सिस्टीन-समृद्ध क्षेत्र है, जहां इंसुलिन बाइंडिंग केंद्र स्थानीयकृत है, और III III ओ, एफएन 1, इन्स (प्रविष्टि डोमेन) के तीन फ़ाइब्रोनेक्टिन डोमेन (अंजीर देखें)। 5.18)। The-सबयूनिट में 620 अमीनो एसिड अवशेष शामिल हैं, जिसमें 95 kDa का आणविक भार है और इसमें सात डोमेन शामिल हैं: तीन फ़ाइब्रोनेक्टिन डोमेन आईडी, Fn 1, और Fn 2, एक टीएम ट्रांस्मैम्ब्रेन डोमेन, झिल्ली से सटे एक जेएम डोमेन, एक टीके टायरोसिन कीनेस डोमेन, और एक सी-टर्मिनल सीटी। ... रिसेप्टर पर, दो इंसुलिन बंधन स्थल पाए गए: एक उच्च आत्मीयता के साथ, दूसरा कम आत्मीयता के साथ। सेल में हार्मोन सिग्नल के संचरण के लिए, इंसुलिन को उच्च आत्मीयता के केंद्र से बांधना चाहिए। यह केंद्र L1, L2 और एक -सबयूनिट के CR डोमेन और दूसरे के फाइब्रोनेक्टिन डोमेन से इंसुलिन के बंधन पर बनता है, जबकि -सबयूनिट्स का स्थान एक दूसरे के विपरीत है, जैसा कि अंजीर में दिखाया गया है। 5.19, से।
रिसेप्टर के उच्च आत्मीयता के केंद्र के साथ इंसुलिन बातचीत की अनुपस्थिति में, субъ-सबयूनिट्स एक सबस्ट्रक्शन (कैम) द्वारा सब-यूनिटों से दूर ले जाया जाता है, जो सीआर डोमेन का हिस्सा है, जो टायरोसिन कीनेस डोमेन के सक्रिय लूप (ए-लूप) के संपर्क को एक-उप-उप-यूनिट से बचाता है। उप-इकाई (Fig.5.20) ख)। जब इंसुलिन रिसेप्टर के उच्च आत्मीयता के केंद्र में इंसुलिन बांधता है, रिसेप्टर के विरूपण में परिवर्तन होता है, तो फलाव अब субъ- और-सबयूनिट्स के अभिसरण के साथ हस्तक्षेप नहीं करता है, टीके डोमेन की सक्रियता लूप, टीके डोमेन में, विपरीत डोमेन, टॉक्सिन फॉस्फोराइलेशन की साइटों के साथ, विपरीत डोमेन, और टॉक्सिक डोमेन में ट्रांसफर करती है। , Y1162, Y1163 एक्टिवेटिंग लूप (यह एक काइनेज रेगुलेटरी डोमेन है), Y1328, Y1334 CT डोमेन, Y965, Y972 JM डोमेन (Fig.5.20) तथा), जो रिसेप्टर के टायरोसिन किनसे गतिविधि में वृद्धि की ओर जाता है। टीसी की स्थिति 1030 में, एक लाइसिन अवशेष है, जो उत्प्रेरक सक्रिय केंद्र में शामिल है - एटीपी-बाध्यकारी केंद्र। साइट-निर्देशित उत्परिवर्तजन द्वारा कई अन्य अमीनो एसिड के लिए इस लाइसिन का प्रतिस्थापन इंसुलिन रिसेप्टर के टायरोसिन किनसे गतिविधि को नष्ट कर देता है, लेकिन इंसुलिन बंधन को बाधित नहीं करता है। हालांकि, ऐसे रिसेप्टर के लिए इंसुलिन के लगाव का सेल चयापचय और प्रसार पर कोई प्रभाव नहीं पड़ता है। कुछ सेरिन-थ्रेओनीन अवशेषों के फॉस्फोराइलेशन, इसके विपरीत, इंसुलिन के लिए आत्मीयता कम हो जाती है और टाइरोसिन किनसे गतिविधि कम हो जाती है।
इंसुलिन रिसेप्टर के कई सब्सट्रेट ज्ञात हैं: आईआरएस -1 (इंसुलिन रिसेप्टर का सब्सट्रेट), आईआरएस -2, एसटीएटी परिवार का प्रोटीन (संकेत ट्रांसड्यूसर और ट्रांसक्रिप्शन के एक्टिवेटर - हमने विस्तार 4 "रक्षा प्रतिक्रियाओं की जैव रासायनिक कुर्सियां") पर विस्तार से चर्चा की।
आईआरएस -1 एक साइटोप्लाज्मिक प्रोटीन है जो इंसुलिन रिसेप्टर टीके के फॉस्फोराइलेटेड टायरोसिन को उसके एसएच 2 डोमेन से बांधता है और इंसुलिन की उत्तेजना के तुरंत बाद रिसेप्टर टायरोसिन किनोसिन द्वारा फॉस्फोराइलेट किया जाता है। इंसुलिन के लिए सेलुलर प्रतिक्रिया में वृद्धि या कमी, कोशिकाओं में परिवर्तन और हार्मोन के प्रति संवेदनशीलता सब्सट्रेट के फॉस्फोराइलेशन की डिग्री पर निर्भर करती है। आईआरएस -1 जीन को नुकसान इंसुलिन पर निर्भर मधुमेह का कारण हो सकता है। IRS-1 की पेप्टाइड श्रृंखला में लगभग 1200 अमीनो एसिड अवशेष, 20-22 संभावित टाइरोसिन फॉस्फोराइलेशन साइट और लगभग 40 सेरिन-थ्रेओनीन फॉस्फोराइलेशन साइट हैं।

चित्र: 5.20। इंसुलिन रिसेप्टर को इंसुलिन के बंधन में संरचनात्मक परिवर्तनों का एक सरल आरेख: तथा A उच्च आत्मीयता के केंद्र में हार्मोन के बंधन के परिणामस्वरूप रिसेप्टर के विरूपण में परिवर्तन से फलाव का विस्थापन, सबयूनिट्स का अभिसरण और टीके डोमेन के ट्रांसफ़ॉस्फ़ोराइज़ेशन होता है; खCept इंसुलिन रिसेप्टर पर उच्च-आत्मीयता बंधन साइट के साथ इंसुलिन बातचीत की अनुपस्थिति में, फलाव (सांचा) .- और सबयूनिट्स और टीसी डोमेन के ट्रांसफ़ॉस्फोरीलेशन को रोकता है। A- लूप TK टीके डोमेन, लूप 1 और 2 के एक सर्कल में सबऑनिट्स के बीच डाइसल्फ़ाइड बॉन्ड्स को सक्रिय करता है, टीके ine टायरोसिन किनसे डोमेन, टी का कैटेलिटिक सेंटर, 1 सेट करता है और 2-एमिनो एसिड सीक्वेंस ओईएनो-सबुनिट्स इंसुलिन के लिए उच्च आत्मीयता का एक साइट बनाता है। रिसेप्टर (के अनुसार)
कई tyrosine अवशेषों पर IRS-1 का फास्फोराइलेशन, यह SH2- डोमेन वाले प्रोटीनों को बाँधने की क्षमता देता है: tyrosine phosphatase syp, p85-subunit of PI-3-kaase (phosphatidylinositol-3-kinase), अडैप्टर प्रोटीन Grb2, प्रोटीन टायरोंसाइन , GAP (छोटे GTP- बाध्यकारी प्रोटीन के सक्रियकर्ता)। आईआरएस -1 के समान प्रोटीन के साथ बातचीत के परिणामस्वरूप, कई डाउनस्ट्रीम सिग्नल उत्पन्न होते हैं।

चित्र: 5.21। इंसुलिन की कार्रवाई के तहत साइटोप्लाज्म से प्लाज्मा झिल्ली तक मांसपेशियों और वसा कोशिकाओं में ग्लूकोज ट्रांसपोर्टर प्रोटीन GLUT 4 का अनुवाद। रिसेप्टर के साथ इंसुलिन की बातचीत इंसुलिन रिसेप्टर सब्सट्रेट (IRS) के फॉस्फोराइलेशन की ओर जाता है, जो PI-3-kinase (PI3K) को बांधता है, जो फॉस्फोलिपिड फॉस्फेटिडाइलोसिनॉल-3,4,5-ट्राइफॉस्फेट (PtdIns) (3,4,5,5) के संश्लेषण को उत्प्रेरित करता है। प्लीक्स्ट्रिन डोमेन (PH) को बांधकर, बाद का यौगिक, कोशिका झिल्ली को प्रोटीन केनेसेस PDK1, PDK2 और PKB \u200b\u200bजुटाता है। PDK1 Thr308 पर PKB \u200b\u200bको फॉस्फोराइलेट करता है, इसे सक्रिय करता है। फॉस्फोराइलेटेड PKB GLUT 4 युक्त पुटिकाओं के साथ जुड़ जाता है, जिससे प्लाज्मा झिल्ली में उनका स्थानांतरण होता है, जिससे ग्लूकोज परिवहन मांसपेशियों और वसा कोशिकाओं में बढ़ जाता है (तदनुसार)
दो माध्यमिक दूतों को बनाने के लिए कोशिका द्रव्य फास्फेटिडाइलिनोसोल -4,5-डाइफॉस्फेट के फॉस्फोलिपिड IRS-1 हाइड्रोलाइजेस द्वारा प्रेरित फॉस्फोलिपेज़ सी दो द्वितीयक संदेशवाहक बनाते हैं: inositol-3,4,5-triphosphate और diacylglycerol। इनोसिटोल-3,4,5-ट्राईफॉस्फेट, एंडोप्लाज्मिक रेटिकुलम के आयन चैनलों पर कार्य करता है, इससे कैल्शियम निकलता है। Diacylglycerol शांतोडुलिन और प्रोटीन किनेज C पर कार्य करता है, जो विभिन्न सब्सट्रेटों को फॉस्फोराइलेट करता है, जिससे सेलुलर सिस्टम की गतिविधि में बदलाव होता है।
फॉस्फोराइलेटेड IRS-1 PI-3-kinase को भी सक्रिय करता है, जो phosphatidylinositol-4-फॉस्फेट, और phosphatidylinositol-4,5-diphosphate की फॉस्फोराइलेशन को phosphatidylinositol-4,5-phinhatidylinolinolinolinoline 3xinolinoline के साथ स्थिति 3 पर बनाता है। -3,4,5-ट्राईफॉस्फेट।
PI-3-kinase विनियामक (p85) और उत्प्रेरक (p110) सबयूनिट्स युक्त एक विषमकोण है। विनियामक सबयूनिट में दो SH2 डोमेन और SH3 डोमेन होते हैं, इसलिए, FI-3 किनासे उच्च आत्मीयता के साथ IRS-1 को बांधता है। झिल्ली में गठित फॉस्फेटिडिलिनोसिटोल का व्युत्पन्न, स्थिति 3 पर फॉस्फोराइलेट, तथाकथित प्लेक्सट्रिन (PH) डोमेन वाले प्रोटीन को बांधता है (डोमेन फॉस्फेटिडिलिनॉल-3-फॉस्फेट के लिए उच्च आत्मीयता को प्रदर्शित करता है): प्रोटीन कीनेस PDK1 (फॉस्फेटिडाइलाइडाइड-की-डिपेंडेंट)
प्रोटीन किनसे बी (पीकेबी) में तीन डोमेन होते हैं: एन-टर्मिनल प्लेक्स्ट्रिन, सेंट्रल कैटेलिटिक और सी-टर्मिनल रेगुलेटरी। RKB को सक्रिय करने के लिए plextrin डोमेन की आवश्यकता है। सेल झिल्ली के पास प्लेक्स्ट्रिन डोमेन की मदद से बांधने से, PKB प्रोटीन किनेज PDK1 के पास पहुंचता है, जिसके माध्यम से
इसका plextrin डोमेन सेल झिल्ली के पास भी स्थानीयकृत है। PDK1 PKB के Thr308 किनासे डोमेन को फॉस्फोरलेट करता है, जिससे PKB का सक्रियण होता है। सक्रिय पीकेबी फॉस्फोराइलेट्स ग्लाइकोजन सिंथेज़ किनेसे 3 (सीआर 9 स्थिति में), एंजाइम की निष्क्रियता का कारण बनता है और इस तरह ग्लाइकोजन संश्लेषण की प्रक्रिया होती है। PI-3-फॉस्फेट-5-किनासे भी फॉस्फोराइलेशन से गुजरता है, जो पुटिकाओं पर कार्य करता है जिसमें GLUT 4 ट्रांसपोर्टर प्रोटीन को एडिपोसाइट्स के साइटोप्लाज्म में संग्रहित किया जाता है, जिससे ग्लूकोज ट्रांसपोर्टर्स की कोशिका झिल्ली में संचलन होता है, इसमें शामिल होता है, और मांसपेशियों और वसा कोशिकाओं में ग्लूकोज के ट्रांसमीटर ट्रांसफर होता है। (चित्र 5.21 देखें)
इंसुलिन न केवल ग्लूट 4 वाहक प्रोटीन की मदद से ग्लूकोज के प्रवाह को सेल में प्रभावित करता है। यह प्रोटीन संश्लेषण में ग्लूकोज, वसा, अमीनो एसिड, आयनों के चयापचय के नियमन में भाग लेता है, और प्रतिकृति और प्रतिलेखन की प्रक्रियाओं को प्रभावित करता है।
सेल में ग्लूकोज चयापचय पर प्रभाव इस प्रक्रिया में शामिल एंजाइमों की गतिविधि को बढ़ाकर ग्लाइकोलिसिस प्रक्रिया को उत्तेजित करके किया जाता है: ग्लूकोकाइनेज, फॉस्फोफ्रक्टोकिनेस, पाइरूवेट किनसे, हेक्सोक्सिनैस। इंसुलिन, एडिनाइलेट साइक्लेज कैस्केड के माध्यम से, फॉस्फेट को सक्रिय करता है, जो ग्लाइकोजन सिंथेज़ को dephosphorylates करता है, जो ग्लाइकोजन संश्लेषण (छवि। 5.22) की सक्रियता और उसके क्षय की प्रक्रिया को रोकता है। फॉस्फोनिओलफ्रुवेट कार्बोक्जिनेस को बाधित करके, इंसुलिन ग्लूकोनेोजेनेसिस की प्रक्रिया को रोकता है।

चित्र: 5.22। ग्लाइकोजन संश्लेषण योजना
यकृत और वसा ऊतक में, इंसुलिन एंजाइम को सक्रिय करके वसा के संश्लेषण को उत्तेजित करता है: एसिटाइलकोए कार्बोक्सिलेज, लिपोप्रोटीन लाइपेज। इस मामले में, वसा के टूटने को रोक दिया जाता है, क्योंकि इंसुलिन द्वारा सक्रिय फॉस्फेटेस, हार्मोन-संवेदनशील ट्राइकोलेग्लिसरॉल लाइपेस को डीफॉस्फोराइलेटिंग करके इस एंजाइम को रोकता है और रक्त में परिसंचारी फैटी एसिड की एकाग्रता कम हो जाती है।
यकृत, वसा ऊतक, कंकाल की मांसपेशी और हृदय में, इंसुलिन सौ से अधिक जीनों के प्रतिलेखन की दर को प्रभावित करता है।
5.2.9। ग्लूकागन।रक्त में ग्लूकोज की एकाग्रता में कमी के जवाब में, अग्न्याशय के लैंगरहैंस के आइलेट्स की cells-कोशिकाएं "भूख हार्मोन" in ग्लूकागन, जो 3,485 दा के आणविक वजन के साथ एक पॉलीपेप्टाइड है, जिसमें 29 अमीनो एसिड अवशेष शामिल हैं।
ग्लूकागन इंसुलिन के विपरीत काम करता है। इंसुलिन ग्लाइकोजेनेसिस, लिपोजेनेसिस और प्रोटीन संश्लेषण, और ग्लूकागन को उत्तेजित करके ऊर्जा भंडारण को बढ़ावा देता है, ग्लाइकोजेनोलिसिस और लिपोलिसिस को उत्तेजित करके, संभावित ऊर्जा स्रोतों के तेजी से जुटने का कारण बनता है।

चित्र: 5.23। मानव प्रोलग्यूगन और टिशू-विशिष्ट प्रसंस्करण की संरचना प्रोलग्यूगन से पेप्टाइड्स में मिलती है: अग्न्याशय, ग्लूकागन और एमपीजीएफ (महापौर प्रोग्लुकैगन टुकड़ा) प्रोलुकोगॉन से बनते हैं; आंत के न्यूरोएंडोक्राइन कोशिकाओं और केंद्रीय तंत्रिका तंत्र के कुछ हिस्सों में, ग्लाइसेन्टिन, ऑक्सिनटोमॉडुलिन, जीएलपी -1 (प्रोलग्यूगन से एक पेप्टाइड), जीएलपी -2, दो मध्यवर्ती पेप्टाइड्स (इंटरप्टिंग पेप्टाइड आईपी), जीआरपीपी lic ग्लिसेंटिन-संबंधित अग्न्याशय से संबंधित अग्न्याशय से संबंधित है। अग्न्याशय - ग्लिसरीन के व्युत्पन्न) (के अनुसार)
हार्मोन को अग्न्याशय के लैंगरहैंस के आइसलेट्स के क्लैमाओल-कोशिकाओं द्वारा संश्लेषित किया जाता है, साथ ही आंत के न्यूरोएंडोक्राइन कोशिकाओं में और केंद्रीय तंत्रिका तंत्र में एक निष्क्रिय अग्रदूत प्रोग्लुकैगन (आणविक वजन 9,000 दा) के रूप में होता है, जिसमें 180 अमीनो एसिड अवशेष होते हैं और यह रूपांतरण 2 और 2 रूपों द्वारा संसाधित होता है। ग्लूकागन और दो ग्लूकागन जैसे पेप्टाइड्स (ग्लूकागन जैसे पेप्टाइड P जीएलपी -1, जीएलपी -2, ग्लाइसेन्टिन) सहित अलग-अलग लंबाई के (चित्र। 5.23)। ग्लूकागन के 27 अमीनो एसिड अवशेषों में से 14 जठरांत्र संबंधी मार्ग, स्रावी में एक और हार्मोन के अणु में समान हैं।
यह प्रतिक्रिया करने वाले कोशिकाओं के रिसेप्टर्स को ग्लूकागन के बंधन के लिए, एन-टर्मिनस से इसके अनुक्रम 1-27 की अखंडता आवश्यक है। हार्मोन के प्रभाव की अभिव्यक्ति में एक महत्वपूर्ण भूमिका एन-टर्मिनस में स्थित हिस्टिडीन अवशेषों द्वारा निभाई जाती है, और रिसेप्टर्स के बंधन में, टुकड़ा 20-27।
रक्त प्लाज्मा में, ग्लूकागन किसी भी ट्रांसपोर्ट प्रोटीन से नहीं जुड़ता है, इसका आधा-रूपांतरण का समय 5 मिनट है, यकृत में यह प्रोटीनों द्वारा नष्ट हो जाता है, और अपघटन सेर 2 और ग्लेन 3 के बीच बंधन के दरार से शुरू होता है और एन-टर्मिनस से डिपप्टाइड को हटाता है।
ग्लूकोज के स्राव को ग्लूकोज द्वारा बाधित किया जाता है लेकिन प्रोटीन खाद्य पदार्थों द्वारा उत्तेजित किया जाता है। जीएलपी -1 ग्लूकागन स्राव को रोकता है और इंसुलिन स्राव को उत्तेजित करता है।
ग्लूकागन केवल हेपेटोसाइट्स और वसा कोशिकाओं पर कार्य करता है जो प्लाज्मा झिल्ली में इसके लिए रिसेप्टर्स होते हैं। हेपेटोसाइट्स में, प्लाज्मा झिल्ली पर रिसेप्टर्स के लिए बाध्य करके, जी-प्रोटीन के माध्यम से ग्लूकागन एडेनिलेट साइक्लेज को सक्रिय करता है, जो कि सीएमपी के गठन को उत्प्रेरित करता है, जो बदले में, फॉस्फोराइडेज़ के सक्रियण की ओर जाता है, जो ग्लाइकोजन के टूटने को तेज करता है, और ग्लाइकोजन सिंथेज़ और ग्लाइकोजन के निषेध को रोकता है। इस प्रक्रिया में शामिल एंजाइमों के संश्लेषण को प्रेरित करके ग्लूकागन ग्लूकोनोजेनेसिस को उत्तेजित करता है: ग्लूकोज -6-फॉस्फेटस, फॉस्फेनोलेफ्रुवेट कार्बोक्जिनेस, फ्रुक्टोज-1,6-डिपोस्पाटेज। ग्लूकोज के शुद्ध प्रभाव से लीवर में ग्लूकोज का उत्पादन कम हो जाता है।
वसा कोशिकाओं में, हार्मोन भी, एडिनाइलेट साइक्लेज कैस्केड का उपयोग करते हुए, हार्मोन-संवेदी triacylglycerol लाइपेस को सक्रिय करता है, लिपोलाइसिस को उत्तेजित करता है। ग्लूकागन अधिवृक्क मज्जा द्वारा कैटेकोलामाइन के स्राव को बढ़ाता है। "लड़ाई या उड़ान" जैसी प्रतिक्रियाओं की प्राप्ति में भाग लेने से, ग्लूकागन कंकाल की मांसपेशियों के लिए ऊर्जा सब्सट्रेट (ग्लूकोज, मुक्त फैटी एसिड) की उपलब्धता को बढ़ाता है और हृदय के काम को बढ़ाकर कंकाल की मांसपेशियों को रक्त की आपूर्ति को बढ़ाता है।
उनमें ग्लूकागन रिसेप्टर्स की लगभग पूर्ण अनुपस्थिति के कारण कंकाल की मांसपेशी ग्लाइकोजन पर ग्लूकागन का कोई प्रभाव नहीं होता है। हार्मोन अग्न्याशय के cells- कोशिकाओं से इंसुलिन के स्राव में वृद्धि और इंसुलिन गतिविधि के निषेध का कारण बनता है।
5.2.10। ग्लाइकोजन चयापचय का विनियमन। ग्लाइकोजन के रूप में शरीर में ग्लूकोज का संचय और इसका टूटना शरीर की ऊर्जा जरूरतों के अनुरूप है। ग्लाइकोजन चयापचय प्रक्रियाओं की दिशा हार्मोन की कार्रवाई पर निर्भर तंत्र द्वारा विनियमित होती है: इंसुलिन, ग्लूकागन और यकृत में एड्रेनालाईन, मांसपेशियों में इंसुलिन और एड्रेनालाईन। ग्लाइकोजन के संश्लेषण या टूटने की प्रक्रियाओं का स्विचिंग, अवशोषण अवधि से संक्रमण के बाद की अवधि तक या जब आराम की स्थिति को शारीरिक कार्य में बदल दिया जाता है।
5.2.10.1। ग्लाइकोजन फॉस्फोराइलेस और ग्लाइकोजन सिंथेज़ गतिविधि का विनियमन। जब रक्त में ग्लूकोज की एकाग्रता में परिवर्तन होता है, तो इंसुलिन और ग्लूकागन का संश्लेषण और स्राव होता है। ये हार्मोन ग्लाइकोजन के संश्लेषण और अपघटन की प्रक्रियाओं को नियंत्रित करते हैं, इन प्रक्रियाओं के प्रमुख एंजाइमों की गतिविधि को प्रभावित करते हैं: ग्लाइकोजन सिंथेज़ और ग्लाइकोजन फॉस्फोराइलेज उनके फॉस्फोराइलेशन-डिफॉस्फोरिएशन द्वारा।

चित्र: 5.24 ग्लाइकोजन फॉस्फोरिलस कीनेस द्वारा सेर 14 अवशेषों के फॉस्फोराइलेशन द्वारा ग्लाइकोजन फॉस्फोराइलेज की सक्रियता और सीरोस अवशेषों के डीफॉस्फोराइलेशन उत्प्रेरित करने वाले फॉस्फेटेज द्वारा निष्क्रियता (के अनुसार)
दोनों एंजाइम दो रूपों में मौजूद हैं: फॉस्फोराइलेटेड (सक्रिय ग्लाइकोजन फॉस्फोराइलेज) तथा और निष्क्रिय ग्लाइकोजेन सिंथेज़) और डीफॉस्फोराइलेटेड (निष्क्रिय फॉस्फोराइलेज) ख और सक्रिय ग्लाइकोजन सिंथेज़) (चित्र। 5.24 और 5.25)। फॉस्फोराइलेशन को किनेसे द्वारा किया जाता है, जो एटीपी से एक सेरीन अवशेषों में फॉस्फेट अवशेषों के हस्तांतरण को उत्प्रेरित करता है, जबकि फॉस्फोप्रोटीन फॉस्फेट द्वारा डीफॉस्फोराइलेशन उत्प्रेरित होता है। किनासे और फॉस्फेटस गतिविधियों को भी फॉस्फोराइलेशन-डिफॉस्फोराइलेशन द्वारा नियंत्रित किया जाता है (चित्र देखें। 5.25)।

चित्र: 5.25। ग्लाइकोजन सिंथेज़ गतिविधि का विनियमन। एंजाइम फॉस्फोप्रोटीन फॉस्फेट (पीपी 1) की क्रिया द्वारा सक्रिय होता है, जो ग्लाइकोजन सिंथेज़ में सी-टर्मिनस के पास तीन फॉस्फोसरीन अवशेषों को नष्ट कर देता है। ग्लाइकोजन सिन्थेज किनेज 3 (GSK3), जो ग्लाइकोजन सिन्थेज में तीन सेरीन अवशेषों के फॉस्फोराइलेशन को उत्प्रेरित करता है, ग्लाइकोजन संश्लेषण को रोकता है और कैसिनेज (CKII) द्वारा फॉस्फोराइलेशन द्वारा सक्रिय होता है। इंसुलिन, ग्लूकोज और ग्लूकोज-6-फॉस्फेट फॉस्फोप्रोटीन फॉस्फेट को सक्रिय करते हैं, जबकि ग्लूकागन और एड्रेनालाईन (एपिनेफ्रिन) इसे रोकते हैं। इंसुलिन ग्लाइकोजन सिंथेज़ कीनेज 3 की क्रिया को रोकता है (तदनुसार)
सीएमपी-आश्रित प्रोटीन किनेज ए (पीकेए) फॉस्फोराइलेट्स फॉस्फोरिलस कीनेस, इसे सक्रिय बनाता है, जो बदले में ग्लाइकोजन फॉस्फोरिलस फॉस्फोराइलेट्स करता है। सीएमपी का संश्लेषण एड्रेनालाईन और ग्लूकागन द्वारा उत्तेजित होता है।
इंसुलिन, रास प्रोटीन (रास सिग्नलिंग पाथवे) की भागीदारी के साथ एक झरना के माध्यम से, प्रोटीन किनसे pp90S6 को सक्रिय करता है, जो फॉस्फोरिल्ट्स और इस तरह से फॉस्फोप्रोटीन फॉस्फेट को सक्रिय करता है। सक्रिय फ़ॉस्फ़ेटेज़ डेफ़ोस्फोराइलेट्स और निष्क्रिय फॉस्फोरिलेज़ कीनेस और ग्लाइकोजन फ़ॉस्फ़ोराइसेटेज़।

ग्लाइकोजन सिंटेज़ के पीकेए द्वारा फॉस्फोराइलेशन इसकी निष्क्रियता की ओर जाता है, जबकि फॉस्फोप्रोटीन फॉस्फेटेस द्वारा डीफोस्फोराइलेशन एंजाइम को सक्रिय करता है।
5.2.10.2। यकृत में ग्लाइकोजन चयापचय का विनियमन।रक्त में ग्लूकोज की एकाग्रता में बदलाव से हार्मोन की सापेक्ष सांद्रता भी बदल जाती है: इंसुलिन और ग्लूकागन। रक्त में ग्लूकागन एकाग्रता के लिए इंसुलिन एकाग्रता का अनुपात "इंसुलिन-ग्लूकागन इंडेक्स" कहलाता है। अवशोषण के बाद की अवधि में, सूचकांक कम हो जाता है और ग्लूकागन एकाग्रता रक्त शर्करा एकाग्रता के विनियमन को प्रभावित करता है।
ग्लूकागन, जैसा कि ऊपर उल्लेख किया गया है, ग्लाइकोजन के टूटने (ग्लाइकोजन फॉस्फोराइलेज की सक्रियता और ग्लाइकोजन सिंथेज़ के निषेध) या अन्य पदार्थों ग्लूकोजोजेनेसिस के संश्लेषण के कारण रक्त में ग्लूकोज की रिहाई को सक्रिय करता है। ग्लूकोज-1-फॉस्फेट का निर्माण ग्लाइकोजन से होता है, ग्लूकोस -6-फॉस्फेट में आइसोमेरिज्ड होता है, ग्लूकोज-6-फॉस्फेट की क्रिया के तहत हाइड्रोलाइज्ड होता है, ताकि ग्लूकोज मुक्त होकर कोशिका को रक्त में छोड़ सके (चित्र 5.26)।

हेपेटोसाइट्स पर एड्रेनालाईन की कार्रवाई ors 2-रिसेप्टर्स के उपयोग के मामले में ग्लूकागन की कार्रवाई के समान होती है और यह फॉस्फोराइलेशन और ग्लाइकोजन फॉस्फोराइलेस की सक्रियता के कारण होता है। प्लाज्मा झिल्ली के cept 1 रिसेप्टर्स के साथ एड्रेनालाईन की बातचीत के मामले में, हार्मोनल सिग्नल के ट्रांसमेम्ब्रेन ट्रांसमिशन को इनोसिटोल फॉस्फेट तंत्र का उपयोग करके किया जाता है। दोनों मामलों में, ग्लाइकोजन के टूटने की प्रक्रिया सक्रिय है। इस या उस प्रकार के रिसेप्टर का उपयोग रक्त में एड्रेनालाईन की एकाग्रता पर निर्भर करता है।

चित्र: 5.26। ग्लाइकोजन फॉस्फोरोलिसिस की योजना
पाचन के दौरान, इंसुलिन-ग्लूकागन सूचकांक बढ़ जाता है और इंसुलिन का प्रभाव प्रबल हो जाता है। इंसुलिन रक्त में ग्लूकोज की सांद्रता को कम करता है, सक्रिय करता है, रास मार्ग के माध्यम से फॉस्फोराइलेटिंग, फॉस्फोडाइस्टरेज़ सीएमपी, जो एएमपी के गठन के साथ इस माध्यमिक मध्यस्थ को हाइड्रोलाइज़ करता है। इंसुलिन भी रास मार्ग के माध्यम से सक्रिय है ग्लाइकोजन कणिकाओं के फॉस्फोप्रोटीन फॉस्फेट द्वारा, डीफॉस्फोराइलेटिंग और सक्रिय ग्लाइकोजन सिंटेज़ को सक्रिय करता है और स्वयं फॉस्फोराइलेस कीनेस और ग्लाइकोजन फ़ॉस्फ़ोरीलेस को निष्क्रिय करता है। इंसुलिन ग्लूकोकाइनेज के संश्लेषण को सेल में ग्लूकोज के फॉस्फोराइलेशन और इसके ग्लाइकोजन में शामिल करने के लिए प्रेरित करता है। इस प्रकार, इंसुलिन ग्लाइकोजन के संश्लेषण को सक्रिय करता है और इसके टूटने को रोकता है।
5.2.10.3. मांसपेशियों में ग्लाइकोजन चयापचय का विनियमन। तीव्र मांसपेशियों के काम के मामले में, ग्लाइकोजन के टूटने को एड्रेनालाईन द्वारा त्वरित किया जाता है, जो and 2 रिसेप्टर्स को बांधता है और एडिनिलेट साइक्लेज सिस्टम के माध्यम से फॉस्फोराइलेशन के लिए अग्रणी होता है और फॉस्फोरिलस कीनेस और ग्लाइकोजन फॉस्फोरिलसेज़ का सक्रियण और ग्लाइकोजन सिंथेज़ का निषेध होता है (चित्र। 7) ग्लाइकोजन से बने ग्लूकोज-6-फॉस्फेट के आगे रूपांतरण के परिणामस्वरूप, एटीपी को संश्लेषित किया जाता है, जो गहन मांसपेशियों के काम के कार्यान्वयन के लिए आवश्यक है।

चित्र: 5.27। मांसपेशियों में ग्लाइकोजन फॉस्फोराइलेस गतिविधि का विनियमन (के अनुसार)
आराम से, मांसपेशी ग्लाइकोजन फॉस्फोराइलेस निष्क्रिय है, क्योंकि यह एक dephosphorylated अवस्था में है, लेकिन एटीपी हाइड्रोलिसिस के दौरान गठित एएमपी और ऑर्थोफोस्फेट द्वारा ग्लाइकोजन फॉस्फोरिलस बी के allosteric सक्रियण के कारण ग्लाइकोजन का टूटना होता है।

चित्र: 5.28। मांसपेशियों में ग्लाइकोजन सिंथेज़ गतिविधि का विनियमन (के अनुसार)
मध्यम मांसपेशियों के संकुचन के साथ, फॉस्फोरिलस काइनेज को सक्रिय रूप से सक्रिय किया जा सकता है (सीए 2+ आयनों द्वारा)। मोटर तंत्रिका संकेत के जवाब में सीए 2+ की एकाग्रता मांसपेशियों के संकुचन के साथ बढ़ जाती है। जब संकेत को देखा जाता है, तो सीए 2+ एकाग्रता में कमी के साथ-साथ किनासे गतिविधि "बंद" हो जाती है
सीए 2+ आयन न केवल मांसपेशी संकुचन में शामिल हैं, बल्कि इन संकुचन के लिए ऊर्जा प्रदान करने में भी शामिल हैं।
सीए 2+ आयन प्रोटीन शांतोदुलिन से बंधते हैं, इस मामले में कीनेस सबयूनिट्स में से एक के रूप में कार्य करते हैं। स्नायु फॉस्फोरिलस किनेज की संरचना 4 4 4। 4 है। केवल-सबयूनिट में उत्प्रेरक गुण होते हैं, and- और-सबयूनिट्स, नियामक होने के नाते, पीकेए का उपयोग कर सेरीन अवशेषों में फॉस्फोराइलेट किया जाता है, उप-सबयूनिट शांत प्रोटीन के समान है (धारा 2.3.2 में विस्तार से चर्चा की, भाग 2 "आंदोलन की जैव रसायन"), बांधता है चार सीए 2+ आयन, जो कि परिवर्तनकारी परिवर्तन की ओर जाता है, उत्प्रेरक +-सबयूनिट की सक्रियता, हालांकि किनेज एक dephosphorylated अवस्था में रहता है।
आराम से पाचन के दौरान, ग्लाइकोजन संश्लेषण भी मांसपेशियों में होता है। ग्लूकोज GLUT 4 ट्रांसपोर्टर प्रोटीन की मदद से मांसपेशियों की कोशिकाओं में प्रवेश करता है (इंसुलिन की कार्रवाई के तहत सेल झिल्ली में उनका जमाव खंड 5.2.4.3 और अंजीर। 5.21 में विस्तार से चर्चा की गई है)। मांसपेशियों में ग्लाइकोजन के संश्लेषण पर इंसुलिन का प्रभाव ग्लाइकोजन सिंटेज़ और ग्लाइकोजन फ़ॉस्फ़ोरलाइज़ के डिफॉस्फोराइलेशन के माध्यम से भी किया जाता है।
5.2.11। प्रोटीन के गैर-एंजाइमी ग्लाइकोसिलेशन। प्रोटीन के बाद के अनुवाद-संशोधन के प्रकारों में से एक ग्लाइकोसिलेट्रांसफेरस का उपयोग करके सेरीन, थ्रेओनीन, शतावरी, हाइड्रॉक्सिलीन अवशेषों का ग्लाइकोसिलेशन है। चूंकि पाचन अवधि के दौरान रक्त में कार्बोहाइड्रेट (शर्करा को कम करना) की एक उच्च एकाग्रता बनाई जाती है, प्रोटीन, लिपिड और न्यूक्लिक एसिड के गैर-एंजाइमी ग्लाइकोसिलेशन संभव है, जिसे ग्लाइकेशन कहा जाता है। प्रोटीन के साथ शर्करा के मल्टी-स्टेप इंटरैक्शन से उत्पन्न उत्पादों को एजीई c उन्नत ग्लाइकेशन एंड-उत्पाद कहा जाता है और कई मानव प्रोटीनों में पाए जाते हैं। इन उत्पादों का आधा जीवन प्रोटीन (कई महीनों से कई वर्षों तक) की तुलना में लंबा है, और उनके गठन की दर कम करने वाली चीनी के संपर्क के स्तर और अवधि पर निर्भर करती है। यह माना जाता है कि यह उनके गठन के साथ है कि मधुमेह, अल्जाइमर रोग और मोतियाबिंद में उत्पन्न होने वाली कई जटिलताएं जुड़ी हुई हैं।
ग्लाइकेशन प्रक्रिया को दो चरणों में विभाजित किया जा सकता है: प्रारंभिक और देर से। ग्लाइकेशन के पहले चरण में, लाइसिन के -अमीनो समूह द्वारा ग्लूकोज के कार्बोनिल समूह का एक न्यूक्लियोफिलिक हमला या आर्गिनिन के गनीडिनियम समूह होता है, जिसके परिणामस्वरूप एक लेबिफ शिफ बेस बनता है - एन-ग्लाइकोसिलेमिन (चित्र। 5.29)। शिफ आधार का निर्माण अपेक्षाकृत तेज और प्रतिवर्ती प्रक्रिया है।
फिर एक रीग्रुपिंग होती है एन- अमादोरी उत्पाद के गठन के साथ ग्लाइकोसिलेमिन - 1 - अमीनो - 1 - डीऑक्सीफ्रुक्टोज। इस प्रक्रिया की दर ग्लाइकोसिलेमिन गठन की दर से कम है, लेकिन शिफ आधार के हाइड्रोलिसिस की दर से काफी अधिक है,

चित्र: 5.29। प्रोटीन ग्लाइकेशन योजना। कार्बोहाइड्रेट का खुला रूप (ग्लूकोज) लाइसिन के of-एमिनो समूह के साथ प्रतिक्रिया करता है ताकि शिफ बेस बन जाए, जो एनालामाइन के मध्यवर्ती गठन के माध्यम से केटामाइन में अमादोरी पुनर्व्यवस्था को गुजरता है। Amadori पुनर्व्यवस्था को तेज किया जाता है यदि एस्पेरेट और आर्गिनिन के अवशेष लाइसिन अवशेषों के पास स्थित हों। केटामाइन आगे विभिन्न प्रकार के उत्पाद (अंत-ग्लाइकेशन उत्पाद) एजीई) का उत्पादन कर सकता है। आरेख diketoamine बनाने के लिए दूसरे कार्बोहाइड्रेट अणु के साथ प्रतिक्रिया दिखाता है (तदनुसार)
इसलिए, 1-एमिनो-1-डीऑक्सीफ्रक्टोज अवशेषों वाले प्रोटीन रक्त में जमा होते हैं। ग्लाइकेशन के प्रारंभिक चरण में प्रोटीन में लाइसिन अवशेषों का संशोधन जाहिर तौर पर प्रतिक्रियाशील अमीनो समूह के तत्काल आसपास के क्षेत्र में हिस्टिडीन, लाइसिन या आर्गिनिन अवशेषों की उपस्थिति से होता है, जो अम्लीय होता है। प्रक्रिया का मुख्य उत्प्रेरक, साथ ही साथ एस्पार्टेट के अवशेष, जो चीनी के दूसरे कार्बन परमाणु से एक प्रोटॉन को निकालता है। केटोएमिन दोहरे ग्लाइकेटेड लाइसिन के निर्माण के लिए इमिनो समूह में एक और कार्बोहाइड्रेट अवशेषों को बांध सकता है, जिसे डिकेटामाइन में परिवर्तित किया जाता है (चित्र। 5.29 देखें)।
आगे के परिवर्तनों सहित ग्लाइकेशन का देर से चरण एन-ग्लोकोसिलेमिन और अमादोरी, एक धीमे प्रक्रिया है जो स्थिर अंत-ग्लाइकेशन उत्पादों (एजीई) के गठन के लिए अग्रणी है। हाल ही में, डेटा α के डाइक में प्रत्यक्ष भागीदारी पर दिखाई दिया है - डाइकारबोनील यौगिक (ग्लाइक्सल, मिथाइलग्लॉक्सल, 3 - डीऑक्सीगलुकोसोन), का गठन में विवो दोनों ग्लूकोज की गिरावट के दौरान और ग्लूकोज के साथ प्रोटीन की संरचना में लाइसिन के संशोधन के दौरान शिफ आधार के परिवर्तनों के परिणामस्वरूप (चित्र। 5.30)। विशिष्ट reductases और sulhydryl यौगिकों (लाइपोइक एसिड, ग्लूटाथियोन) प्रतिक्रियाशील डाइकारबोनील यौगिकों को निष्क्रिय चयापचयों में बदलने में सक्षम हैं, जो अंतिम ग्लाइकेशन उत्पादों के गठन में कमी में परिलक्षित होता है।
Α-dicarbonyl यौगिकों के साथ प्रोटीन में ine- अमीनो समूहों के लाइसिन अवशेषों या प्रोटीन में आर्जिनिन अवशेषों के गुआनिडीनियम समूह प्रोटीन क्रॉस-लिंक के गठन की ओर ले जाते हैं, जो मधुमेह और अन्य बीमारियों में प्रोटीन ग्लाइकेशन के कारण होने वाली जटिलताओं के लिए जिम्मेदार होते हैं। इसके अलावा, सी 4 और सी 5 में अमादोरी उत्पाद के अनुक्रमिक निर्जलीकरण के परिणामस्वरूप, 1-एमिनो-4-डीऑक्सी-2,3-डायोन और -इंडियन का गठन होता है, जो इंटोलेस्कुलर और इंटरमॉलिक्युलर प्रोटीन क्रॉस-लिंक के गठन में भी भाग ले सकता है।
AGEs के बीच, एन ε - कार्बोक्सिमिथाइल लाइसिन (CML) और एन ε - कार्बोक्जिथाइल लाइसिन (CEL), बीआईएस (लाइसिल) इमिडाज़ोल एडिक्ट्स (गोल्ड l ग्लाइक्सल लिसील लाइसिल डिमर, मोल्ड h मेथिलग्लॉक्सल लिसील डिसीलर, डॉल्ड डीऑक्सीगलुकसोन लाइसाइल लियलर डिमर), इमिडाजोल। एमजी - एच और 3 डी जी - एच), पाइरेलिन, आर्गपाइरीमिडीन, पेंटोसिडिन, क्रॉसलिन और वेसस्पेरिलिन। 5.31 कुछ सूचीबद्ध करता है

चित्र: 5.30। डी - ग्लूकोज की उपस्थिति में प्रोटीन ग्लाइकेशन की योजना। बॉक्स ग्लाइकेशन से उत्पन्न AGE उत्पादों के मुख्य अग्रदूतों को दिखाता है (तदनुसार)
ग्लाइकेशन अंत उत्पादों। उदाहरण के लिए, पेंटोसिडाइन और कार्बोक्सिमिथाइल लाइसिन (सीएमएल) लंबे समय तक रहने वाले प्रोटीनों में पाए जाने वाले ऑक्सीकरण की स्थिति के तहत बने ग्लाइकेशन के अंतिम उत्पाद हैं: त्वचा कोलेजन और क्रिस्टलीय लेंस। Carboxymethyl lysine एक सकारात्मक रूप से चार्ज किए गए अमीनो समूह के बजाय प्रोटीन में एक नकारात्मक चार्ज किए गए कार्बोक्सिल समूह का परिचय देता है, जिससे प्रोटीन की सतह पर आवेश में परिवर्तन हो सकता है, जिससे प्रोटीन की स्थानिक संरचना में परिवर्तन हो सकता है। CML एंटीबॉडी द्वारा मान्यता प्राप्त एंटीजन है। इस उत्पाद की मात्रा उम्र के साथ रैखिक रूप से बढ़ जाती है। पेंटोसिडीन, अमादोरी उत्पाद और प्रोटीन की किसी भी स्थिति में अर्गिनिन अवशेषों के बीच एक क्रॉस-लिंक (क्रॉस-लिंकिंग उत्पाद) है, यह एस्कॉर्बेट, ग्लूकोज, फ्रुक्टोज, राइबोज से बनता है; यह अल्जाइमर रोग वाले रोगियों के मस्तिष्क के ऊतकों में पाया जाता है, जो मधुमेह वाले रोगियों की त्वचा और रक्त प्लाज्मा में है।
ग्लाइकेशन के अंतिम उत्पाद मुक्त कण ऑक्सीकरण को बढ़ावा दे सकते हैं, प्रोटीन की सतह पर एक परिवर्तन प्रभारी, प्रोटीन के विभिन्न क्षेत्रों के बीच अपरिवर्तनीय क्रॉस-लिंकिंग, जो
उनकी स्थानिक संरचना और कार्यप्रणाली को बाधित करता है, जो उन्हें एंजाइमेटिक प्रोटियोलिसिस के लिए प्रतिरोधी बनाता है। बदले में, मुक्त कट्टरपंथी ऑक्सीकरण नॉनजाइमेटिक प्रोटियोलिसिस या प्रोटीन के विखंडन, लिपिड पेरोक्सीडेशन का कारण बन सकता है।
तहखाने की झिल्ली (टाइप IV कोलेजन, लेमिनेन, हेपरान सल्फेट प्रोटियोग्लाइकन) के प्रोटीन पर ग्लाइकेशन के अंत उत्पादों के गठन से इसकी मोटाई बढ़ जाती है, केशिका लुमेन का संकुचन और उनके कार्य की हानि होती है। कोशिकीय मैट्रिक्स के ये उल्लंघन रक्त वाहिकाओं की संरचना और कार्य को बदलते हैं (संवहनी दीवार की लोच में कमी, नाइट्रिक ऑक्साइड के वासोडिलेटिंग प्रभाव की प्रतिक्रिया में परिवर्तन), एथेरोस्क्लोरोटिक प्रक्रिया के अधिक त्वरित विकास में योगदान करते हैं।
ग्लाइकेशन एंड प्रॉडक्ट्स (AGE) कुछ जीनों की अभिव्यक्ति को प्रभावित करते हैं, जो कि फाइब्रोब्लास्ट्स, टी-लिम्फोसाइट्स पर स्थानीयकृत विशिष्ट AGE रिसेप्टर्स से जुड़कर, गुर्दे (मेसैन्जियल सेल्स) में, संवहनी दीवार (एंडोथेलियम और चिकनी मांसपेशियों की कोशिकाओं), साथ ही मस्तिष्क में भी होते हैं। यकृत और प्लीहा में, जहां वे सबसे अधिक प्रचुर मात्रा में होते हैं, अर्थात्, मैक्रोफेज से समृद्ध ऊतकों में, जो मुक्त ऑक्सीजन कणों के गठन को बढ़ाकर इस संकेत के पारगमन को मध्यस्थ करते हैं। उत्तरार्द्ध, बदले में, परमाणु NF-kB कारक के प्रतिलेखन को सक्रिय करता है, जो कई जीनों की अभिव्यक्ति को नियंत्रित करता है जो विभिन्न नुकसानों का जवाब देते हैं।
प्रोटीन के गैर-एंजाइमी ग्लाइकोसिलेशन के अवांछनीय परिणामों को रोकने के प्रभावी तरीकों में से एक भोजन की कैलोरी सामग्री को कम करना है, जो रक्त में ग्लूकोज की एकाग्रता में कमी और लंबे समय से जीवित प्रोटीन, जैसे हीमोग्लोबिन के लिए ग्लूकोज के गैर-एंजाइमी लगाव में कमी से परिलक्षित होता है। ग्लूकोज एकाग्रता में कमी से प्रोटीन ग्लाइकोसिलेशन और लिपिड पेरोक्सीडेशन दोनों में कमी आती है। ग्लाइकोसिलेशन का नकारात्मक प्रभाव संरचना और कार्यों के उल्लंघन के कारण होता है जब ग्लूकोज लंबे समय तक जीवित प्रोटीन से जुड़ा होता है, और संक्रमण धातुओं के आयनों की उपस्थिति में शर्करा के ऑक्सीकरण के दौरान मुक्त कणों से उत्पन्न प्रोटीन के परिणामस्वरूप ऑक्सीडेटिव क्षति होती है। न्यूक्लियोटाइड और डीएनए भी गैर-एंजाइमी ग्लाइकोसिलेशन से गुजरते हैं, जो प्रत्यक्ष डीएनए क्षति और मरम्मत प्रणालियों की निष्क्रियता के कारण उत्परिवर्तन की ओर जाता है, जिससे गुणसूत्रों की नाजुकता बढ़ जाती है। वर्तमान में, औषधीय और आनुवंशिक प्रभावों का उपयोग करके लंबे समय तक जीवित प्रोटीन पर ग्लाइकेशन के प्रभाव को रोकने के लिए दृष्टिकोणों का अध्ययन किया जा रहा है।
ये कार्बोहाइड्रेट होते हैं जिसमें मोनोसेकेराइड के अवशेषों की संख्या दस से अधिक हो जाती है और दसियों हजार तक पहुंच सकती है। यदि एक जटिल कार्बोहाइड्रेट में एक ही मोनोसैकराइड अवशेष होते हैं, तो इसे होमोसैकेराइड कहा जाता है, यदि अलग-अलग लोगों से, इसे एक हेटेरोसेकेराइड कहा जाता है।
2.3.1। Homopolysaccharides
कठोर, मीठा नहीं। होमोपोलिसैक्राइड के मुख्य प्रतिनिधि स्टार्च और ग्लाइकोजन हैं।
स्टार्च।
एमीलोज और एमाइलोपेक्टिन से मिलकर, पौधों में एक आरक्षित पोषक तत्व है (आलू के कंद में स्टार्च अनाज, अनाज अनाज में)। स्टार्च में अमाइलोज की मात्रा 15-20% होती है, एमिलोपेक्टिन 75-85%। अमाइलोज में लगभग 100-1000 होते हैं, अमाइलोपेक्टिन में 600-6000 ग्लूकोज अवशेष होते हैं।
ग्लाइकोजन
पशु का स्टार्च.इसमें 6000 से 300000 ग्लूकोज अवशेष होते हैं। एक बैकअप ऊर्जा स्रोत के रूप में संग्रहीत किया जा सकता है। ग्लाइकोजन की सबसे बड़ी मात्रा जिगर की कोशिकाओं (7%) में, कंकाल की मांसपेशियों (1-3%) में, हृदय (0.5%) में संग्रहीत होती है। स्टार्च और ग्लाइकोजन को एंजाइम एमाइलेज द्वारा जठरांत्र संबंधी मार्ग में विभाजित किया जाता है, पशु कोशिकाओं में ग्लाइकोजन ग्लाइकोजन फास्फोरिलसेज़ द्वारा cleaved किया जाता है।
फाइबर (सेल्यूलोज)।
संयंत्र सेल की दीवार का मुख्य घटक, पानी में अघुलनशील, एक बीटा-ग्लाइकोसिडिक बंधन द्वारा जुड़े 2000-11000 ग्लूकोज अवशेष हैं। शरीर में यह आंतों की गतिशीलता को उत्तेजित करने में महत्वपूर्ण भूमिका निभाता है।
अंजीर। स्टार्च श्रृंखलाओं की संरचना के योजनाबद्ध आरेख - एमाइलोज (ए), एमाइलोपेक्टिन (बी) और ग्लाइकोजन अणु (सी) के एक भाग।
2.3.2। Heteropolysaccharides
ये जटिल कार्बोहाइड्रेट होते हैं, जिनमें दो या अधिक मोनोसेकेराइड होते हैं, जो अक्सर प्रोटीन या लिपिड से जुड़े होते हैं।
हाईऐल्युरोनिक एसिड
रैखिक बहुलक, ग्लुकुरोनिक एसिड और एसिटाइलग्लुकोसामाइन से बना है। यह सेल की दीवारों, श्लेष द्रव, विट्रोस बॉडी, आंतरिक अंगों को कवर करता है, यह एक जिलेटिनस जीवाणुनाशक स्नेहक है।
चोंड्रोइटिन सल्फेट्स।
ब्रांच्ड पॉलिमर ग्लुकुरोनिक एसिड और एन-एसिटाइलग्लुकोसमाइन से बना होता है। उपास्थि, tendons, आंख के कॉर्निया के मुख्य संरचनात्मक घटकों के रूप में सेवा करें; हड्डियों और त्वचा में भी पाया जाता है।
3. आहार में कार्बोहाइड्रेट का आदर्श
शरीर में कार्बोहाइड्रेट का भंडार शरीर के भार के 2-3% से अधिक नहीं है। उनके कारण, एक अप्रशिक्षित व्यक्ति के ऊर्जा भंडार को 12 घंटे से अधिक नहीं कवर किया जा सकता है, और यहां तक \u200b\u200bकि एथलीटों के लिए भी कम। कार्बोहाइड्रेट की सामान्य खपत के साथ, एथलीट का शरीर अधिक आर्थिक और कम थका हुआ काम करता है। इसलिए, भोजन से कार्बोहाइड्रेट का लगातार सेवन आवश्यक है। ग्लूकोज के लिए शरीर की आवश्यकता ऊर्जा खपत के स्तर पर निर्भर करती है। जैसे-जैसे तीव्रता, शारीरिक श्रम की गंभीरता बढ़ती है, कार्बोहाइड्रेट की आवश्यकता बढ़ जाती है। दैनिक आहार में कार्बोहाइड्रेट का मान 400 ग्राम है। उन लोगों के लिए जो खेल में शामिल नहीं हैं; एथलीटों के लिए 600 से 1000 जीआर तक। 64% कार्बोहाइड्रेट स्टार्च (ब्रेड, अनाज, पास्ता) के रूप में शरीर में प्रवेश करते हैं, 36% साधारण शर्करा (सुक्रोज, फ्रुक्टोज, शहद, पेक्टिन पदार्थ) के रूप में।
4. जठरांत्र संबंधी मार्ग में कार्बोहाइड्रेट का पाचन
कार्बोहाइड्रेट के पाचन की प्रक्रिया का अध्ययन करते हुए, किसी को इसमें शामिल एंजाइमों को याद रखना चाहिए, पाचन तंत्र के विभिन्न हिस्सों में उनकी कार्रवाई के लिए शर्तों का पता लगाना चाहिए, हाइड्रोलिसिस के मध्यवर्ती और अंतिम उत्पादों को जानना चाहिए।
मानव शरीर में प्रवेश करने वाले जटिल भोजन कार्बोहाइड्रेट में मानव शरीर के कार्बोहाइड्रेट की तुलना में एक अलग संरचना होती है। तो पॉलीसेकेराइड जो पौधे स्टार्च बनाते हैं - अमाइलोज और एमाइलोपेक्टिन - रैखिक या कमजोर रूप से शाखाओं वाले ग्लूकोज पॉलिमर हैं, और मानव शरीर का स्टार्च - ग्लाइकोजन - एक ही ग्लूकोज अवशेषों के आधार पर, उनसे एक अलग - अत्यधिक ब्रंचयुक्त - बहुलक संरचना बनाता है। इसलिए, भोजन ओलिगो- और पॉलीसेकेराइड्स की आत्मसात उनके हाइड्रोसेक्टिक (पानी की कार्रवाई के तहत) से मोनोसैकराइड्स के पाचन की प्रक्रिया में टूटने के साथ शुरू होता है।
पाचन के दौरान कार्बोहाइड्रेट की हाइड्रोलाइटिक दरार ग्लाइकोसिडेज एंजाइमों की कार्रवाई के तहत होती है जो जटिल कार्बोहाइड्रेट अणुओं में 1-4 और 1-6 ग्लाइकोसिडिक बंध टूटते हैं। सरल कार्बोहाइड्रेट पच नहीं रहे हैं, उनमें से केवल कुछ भाग सूक्ष्मजीवों के एंजाइमों की कार्रवाई के तहत बड़ी आंत में किण्वन कर सकते हैं।
ग्लाइकोसिडेस में लार, अग्नाशयी और आंतों का रस, लार और आंतों का रस, अंतिम डेक्सट्रिनेज़, सुक्रेज़ और आंतों के रस का लैक्टेज़ शामिल हैं। ग्लाइकोसिडेस एक कमजोर क्षारीय वातावरण में सक्रिय होते हैं और एक अम्लीय वातावरण में बाधित होते हैं, लार एमाइलेज के अपवाद के साथ, जो एक कमजोर अम्लीय वातावरण में पॉलीसेकेराइड के हाइड्रोलिसिस को उत्प्रेरित करता है और बढ़ती अम्लता के साथ गतिविधि खो देता है।
मौखिक गुहा में, स्टार्च पाचन लार वाले एमाइलेज के प्रभाव में शुरू होता है, जो एमाइलोज और एमाइलोपेक्टिन अणुओं के भीतर ग्लूकोज अवशेषों के बीच 1-4 ग्लाइकोसिडिक बांड को साफ करता है। इस मामले में, dectstrins और maltose बनते हैं। लार में थोड़ी मात्रा में माल्टेज भी होता है, जो ग्लूकोज में माल्टोज को जमा करता है। मुंह में अन्य डिसैकेराइड्स टूट नहीं रहे हैं
अधिकांश पॉलीसैकराइड अणुओं के मुंह में हाइड्रोलाइज करने का समय नहीं है। छोटे लोगों के साथ एमाइलोज और एमाइलोपेक्टिन के बड़े अणुओं का मिश्रण - डेक्सट्रिन। माल्टोस, ग्लूकोज पेट में प्रवेश करता है। गैस्ट्रिक जूस का अत्यधिक अम्लीय वातावरण लार एंजाइमों को रोकता है, इसलिए आंत में कार्बोहाइड्रेट का अधिक परिवर्तन होता है, जिसके रस में बाइकार्बोनेट होते हैं जो गैस्ट्रिक रस के हाइड्रोक्लोरिक एसिड को बेअसर करते हैं। अग्नाशयी और आंत्र रस के एमाइलेज लार वाले एमाइलेज की तुलना में अधिक सक्रिय होते हैं। आंतों के रस में अंतिम डेक्सट्रिनस भी होता है, जो एमाइलोपेक्टिन और डेक्सट्रिन अणुओं में 1-6 बॉन्ड को हाइड्रोलाइज करता है। ये एंजाइम माल्टोज के लिए पॉलीसेकेराइड के टूटने को पूरा करते हैं। आंतों के श्लेष्म में, एंजाइम भी उत्पन्न होते हैं जो डिसाकार्इड को हाइड्रोलाइज कर सकते हैं: माल्टेज, लैक्टैग, सुक्रेज। माल्टेज के प्रभाव में, माल्टोज को दो ग्लूकोज में विभाजित किया जाता है, सुक्रोज, सुक्रोज के प्रभाव में, ग्लूकोज और फ्रुक्टोज में, लैक्टेज लैक्टोज को ग्लूकोज और गैलेक्टोज में तोड़ देता है।
पाचक रसों में सेल्यूलस एंजाइम नहीं होता है, जो पौधे के भोजन से आने वाले सेल्यूलोज को हाइड्रोलाइज करता है। हालांकि, आंतों में सूक्ष्मजीव होते हैं जिनके एंजाइम सेलूलोज़ के कुछ हिस्सों को तोड़ सकते हैं। इस मामले में, सेलबोज डिसैकराइड बनता है, जो तब ग्लूकोज में विघटित हो जाता है।
अखंड सेल्युलोज आंतों की दीवार का एक यांत्रिक अड़चन है, इसकी पेरिस्टलसिस को सक्रिय करता है और भोजन द्रव्यमान की उन्नति को बढ़ावा देता है।
सूक्ष्मजीवों के एंजाइम की कार्रवाई के तहत, जटिल कार्बोहाइड्रेट के अपघटन उत्पाद किण्वन से गुजर सकते हैं, जिसके परिणामस्वरूप कार्बनिक एसिड, सीओ 2, सीएच 4 और एच 2 का निर्माण होता है। पाचन तंत्र में कार्बोहाइड्रेट के परिवर्तन का एक चित्र आरेख में दिखाया गया है।

कार्बोहाइड्रेट के हाइड्रोलिसिस के परिणामस्वरूप गठित मोनोसेकेराइड सभी जीवित जीवों की संरचना में समान हैं। पाचन उत्पादों के बीच, ग्लूकोज की प्रबलता (60%) होती है, यह रक्त में घूमने वाला मुख्य मोनोसैकराइड भी है। आंतों की दीवार में, फ्रुक्टोज और गैलेक्टोज को आंशिक रूप से ग्लूकोज में परिवर्तित किया जाता है, ताकि आंत से बहने वाले रक्त में इसकी सामग्री इसकी गुहा की तुलना में अधिक हो।
मोनोसैकराइड का अवशोषण एक सक्रिय शारीरिक प्रक्रिया है जो ऊर्जा का उपभोग करती है। यह आंतों की दीवार की कोशिकाओं में होने वाली ऑक्सीडेटिव प्रक्रियाओं द्वारा प्रदान किया जाता है। मोनोसेकेराइड्स प्रतिक्रियाओं में एक एटीपी अणु के साथ बातचीत करके ऊर्जा प्राप्त करते हैं, जिनमें से उत्पाद मोनोसेकेराइड के फॉस्फोरिक एस्टर हैं। जब आंत की दीवार से रक्त में गुजरता है, तो फास्फोरस एस्टर फॉस्फेटेस द्वारा क्लीव किया जाता है, और मुक्त मोनोसेकेराइड रक्तप्रवाह में प्रवेश करते हैं। विभिन्न अंगों की कोशिकाओं में रक्त से उनका प्रवेश भी उनके फॉस्फोरिलीकरण के साथ होता है।
हालांकि, विभिन्न उत्पादों से ग्लूकोज के रक्त में रूपांतरण और उपस्थिति की दर अलग-अलग होती है। इन जैविक प्रक्रियाओं का तंत्र "ग्लाइसेमिक इंडेक्स" (जीआई) की अवधारणा में परिलक्षित होता है, जो रक्त शर्करा में खाद्य कार्बोहाइड्रेट (स्टार्च, ग्लाइकोजन, सुक्रोज, लैक्टोज, फ्रुक्टोज, आदि) के रूपांतरण की दर को दर्शाता है।
भोजन में अधिकांश कार्बोहाइड्रेट (लगभग 60%) का प्रतिनिधित्व पौधे स्टार्च, 30% सुक्रोज, 10% लैक्टोज द्वारा किया जाता है। भोजन में थोड़ी मात्रा में ग्लूकोज और फ्रुक्टोज होते हैं, साथ ही ग्लाइकोजन भी होता है।
पॉलीसेकेराइड का पाचन बहु-चरण है (तालिका 2 देखें)। स्टार्च का पाचन, खाद्य उत्पादों का मुख्य कार्बोहाइड्रेट, लार वाले एमाइलेज के प्रभाव में पहले से ही मौखिक गुहा में शुरू होता है, जो तटस्थ या क्षारीय लार पीएच की शर्तों के तहत सक्रिय है। हालांकि, मौखिक गुहा में भोजन के रहने की छोटी अवधि और लार एमाइलेज की अपेक्षाकृत कम गतिविधि स्टार्च पाचन के इस चरण को अप्रभावी बनाती है। हालांकि यह ध्यान दिया जाना चाहिए कि लार में इस एंजाइम की सामग्री बहुत महत्वपूर्ण है।
तालिका 2
कार्बोहाइड्रेट का पाचन - मूल प्रक्रियाएं
| सब्सट्रेट और अंत उत्पादों | एंजाइम और इसके उत्पादन का स्थान | कारवाई की व्यवस्था |
| ऑलिगोसैकराइड और एमिलोपेक्टिन के लिए स्टार्च | लार ग्रंथियां अल्फा-एमाइलेज | स्टार्च ऑप्ट की संरचना में एमाइलोज के अल्फा-1,4-बॉन्ड क्लीवेज। पीएच 6.7 |
| स्टार्च से ओलिगोसैकेराइड्स | अग्न्याशय अग्नाशय amylase | यह स्टार्च ऑप्ट की संरचना में एमाइलोज के अल्फा-1,4-बॉन्ड को तोड़ता है। पीएच 7.1 |
| स्टार्च और ऑलिगोसैकराइड्स माल्टोज और ग्लूकोज के लिए | एंटरोसाइट्स एमिलेज की झिल्ली से जुड़े एंजाइम | glucoamylase |
| ग्लाइकोजन, एमिलोपेक्टिन से ऑलिगोसैकराइड्स, माल्टोज, ग्लूकोज | oligo-alpha1,6-ग्लुकोसिडेस | एमिलोपेक्टिन के अल्फा-1,6 बांड क्लीवेज |
| फ्रुक्टोज और ग्लूकोज के लिए सुक्रोज | Disaccharidase सुगर | बीटा-fructosidase |
| ग्लूकोज को माल्टोज | माल्टेज़ | अल्फा ग्लूकोसिडेज़, अल्फा 1,4 बॉन्ड्स को क्लीवेज करता है |
| ग्लूकोज को माल्टोज | Isomaltase | अल्फा-1,6-ग्लूकोसिडेस के समान कार्य करता है |
| गैलेक्टोज और ग्लूकोज के लिए लैक्टोज | लैक्टेज | बीटा galactosidase |
पेट में, एमाइलेज को पेट की अम्लीय सामग्री द्वारा निष्क्रिय किया जाता है, और कार्बोहाइड्रेट का पाचन बंद हो जाता है। और केवल ग्रहणी में स्टार्च की एक पूरी हाइड्रोलिसिस होती है, जिसमें मौखिक गुहा में गठित अल्फा-लिमिट-डेक्सट्रिन शामिल है, और मोनोसेकेराइड के लिए सभी डिसाकार्इड्स। आंत में कार्बोहाइड्रेट के हाइड्रोलिसिस अग्न्याशय (अल्फा-एमाइलेज, ऑलिगो - 1,6 - ग्लूकोसिडेज़) और आंतों (ऑलिगोसेकेराइड, डिसैकराइडेज़) के एंजाइम द्वारा किया जाता है।
एमाइलेज और ग्लूकोमाइलेज़ के प्रभाव में स्टार्च के विभाजन की दक्षता भोजन में स्टार्च के रूप और गैस्ट्रोइंटेस्टाइनल ट्रैक्ट की कार्यात्मक अवस्था दोनों से संबंधित कई कारकों पर निर्भर करती है।
हाल के वर्षों में, यह पाया गया है कि स्टार्च के तथाकथित प्रतिरोधी रूप हैं, आंत में एंजाइमेटिक टूटने के लिए प्रतिरोधी: वे बहुत धीरे-धीरे टूट जाते हैं। स्टार्च के ऐसे प्रतिरोधी रूपों का अस्तित्व दो मुख्य कारणों से है:
स्टार्च और स्टार्च ग्रैन्यूल्स के शारीरिक रूप से संरक्षित रूपों के निर्माण के साथ पौधों के तंतुओं, प्रोटीन, कोशिकाओं के अन्य घटकों और सेलुलर संरचनाओं के साथ स्टार्च की पर्याप्त रूप से मजबूत परिसरों को बनाने की क्षमता, जिसमें स्टार्च मानव पाचन तंत्र एंजाइमों द्वारा पाचन के लिए मुश्किल है।
· स्टार्च के गेल्ड रूप की अस्थिरता, जो तब होती है जब इसे पानी की उपस्थिति में गर्म किया जाता है। स्टार्च के इस रूप का निर्माण स्टार्च ग्रैन्यूल के विनाश और स्टार्च के तेजी से एंजाइमेटिक गिरावट के साथ होता है। जिलेटिनाइजेशन प्रक्रिया की यह अस्थिरता इस तथ्य की ओर ले जाती है कि जब किसी उत्पाद को ठंडा किया जाता है जो पहले हीट ट्रीटमेंट (उबलते हुए आलू, बेकिंग ब्रेड) के अधीन होता है, या कुछ प्रकार के अनाज के तकनीकी प्रसंस्करण के साथ, एक प्रक्रिया रिवर्स जेलाटिनाइज़ेशन होती है, और स्टार्च ग्रैन्यूल फिर से बनते हैं, जिसमें स्टार्च तक पहुंचना मुश्किल होता है। एक एंजाइमी हमले के लिए। यह जोर देना महत्वपूर्ण है कि अमाइलोज स्टार्च ग्रैन्यूल में पुन: पृथक्करण के लिए अधिक सक्षम है। इसलिए, ऐसे उत्पादों के ग्लाइसेमिक सूचकांकों में अंतर के सबूत के रूप में, बड़ी मात्रा में एमाइलोज़ वाले उत्पादों को एमिलेज द्वारा कम आसानी से अपमानित किया जाता है।
डिसैकराइड को संबंधित डिसैक्राइडिडेस - सूक्रेज, लैक्टेज और माल्टेस के प्रभाव के तहत मोनोसेकेराइड से पहले तोड़ा जाता है, आंत में स्रावित किया जाता है, और मुख्य रूप से मोनोसेकेराइड के रूप में अवशोषित होता है। लैक्टोज की हाइड्रोलिसिस धीमी है, और इसलिए यह वह है जो इसके अवशोषण की दर को सीमित करता है।
डिसाकार्इड्स हाइड्रोविज़्ड गुहा में नहीं, बल्कि आंतों की दीवार में होते हैं, इसलिए परिणामस्वरूप मोनोसेकेराइड को अवशोषित किया जाता है।
मोनोसेकेराइड्स गैलेक्टोज और ग्लूकोज का अवशोषण सक्रिय परिवहन का उपयोग करके दो चरणों में होता है। सबसे पहले, एंटरोसाइट्स के ब्रश बॉर्डर में स्थित सैकरीडेसिस ऑलिगोसेकेराइड को मोनोसैकेराइड्स में तोड़ देते हैं, जो सोडियम-निर्भर परिवहन प्रणाली की भागीदारी के साथ सेल में स्थानांतरित हो जाते हैं। इस मामले में, सोडियम आयनों की उपस्थिति में मोनोसेकेराइड वाहक को बांधते हैं। सोडियम और ग्लूकोज को संलग्न करके, यह वाहक झिल्ली के भीतर की तरफ सोडियम आयनों के लिए एक विद्युत रासायनिक ढाल के साथ फैलता है। यह तब सोडियम आयन और ग्लूकोज को साइटोप्लाज्म में छोड़ता है और एंटरोसाइट की बाहरी सतह पर वापस फैलता है। सेल में एक अपेक्षाकृत कम सोडियम सामग्री एक वाष्पशील सोडियम पंप की कार्रवाई के कारण बनाए रखी जाती है, जो परोक्ष रूप से झिल्ली के भीतर की तरफ सोडियम बाध्य वाहक के निरंतर प्रसार में योगदान करती है।
मन्नोज और पेंटोस सरल द्वारा कोशिका में प्रवेश करते हैं, और फ्रुक्टोज को सुगम प्रसार (निष्क्रिय परिवहन) द्वारा।
आधुनिक अवधारणाओं के अनुसार, एंटरोसाइट के पार्श्व और बेसल सतहों में मोनोसेकेराइड की रिहाई सोडियम आयनों पर निर्भर नहीं करती है।
जारी किए गए मोनोसैकराइड्स को पोर्टल शिरा की शाखाओं के साथ आंत से हटा दिया जाता है।
यकृत के अलावा, ग्लूकोज के मुख्य उपभोक्ता मस्तिष्क और कंकाल की मांसपेशियां हैं। वसा ऊतक में, ग्लूकोज का उपयोग वसा ऊतक को संश्लेषित करने के लिए किया जाता है। आमतौर पर, आंत से अवशोषित ग्लूकोज का लगभग 65% कोशिकाओं में ऑक्सीकरण के लिए सेवन किया जाता है, वसा के संश्लेषण के लिए, लगभग 30% और ग्लाइकोजन के संश्लेषण के लिए 5%। ये अनुपात शरीर की शारीरिक अवस्था, उम्र और कई अन्य कारणों के आधार पर भिन्न होते हैं।