Hipotalāma hormoni. Tropiskie hipofīzes hormoni
Hipotalāms ir svarīga smadzeņu daļa. Augstākais veģetatīvais centrs veic daudzu ķermeņa sistēmu sarežģītu kontroli un regulēšanu. Labs emocionālais stāvoklis, līdzsvars starp ierosmes un kavēšanas procesiem un savlaicīga nervu impulsu pārraide ir svarīga elementa pareizas darbības sekas.
Diencefalona struktūras bojājumi negatīvi ietekmē sirds un asinsvadu, elpošanas, endokrīnās sistēmas darbību un cilvēka vispārējo stāvokli. Ir interesanti un noderīgi zināt, kas ir hipotalāms un par ko tas ir atbildīgs. Rakstā ir daudz informācijas par svarīgu struktūru uzbūvi, funkcijām, slimībām, patoloģisku izmaiņu pazīmēm un mūsdienu ārstēšanas metodēm.
Kas tas par orgānu

Diencefalona sekcija ietekmē iekšējās vides stabilitāti, nodrošina atsevišķu sistēmu mijiedarbību un optimālu kombināciju ar organisma holistisko darbību. Svarīga struktūra ražo trīs apakšklases hormonu kompleksu.
Neirosekrēcijas un nervu vadīšanas šūnas ir svarīga diencefalona elementa pamatā. Organiskās patoloģijas kombinācijā ar funkciju bojājumiem izjauc daudzu procesu periodiskumu organismā.
Hipotalāmam ir plaši sakari ar citām smadzeņu struktūrām un nepārtraukti mijiedarbojas ar smadzeņu garozu un subkorteksu, kas nodrošina optimālu psihoemocionālo stāvokli. Dekortikācija provocē “iedomātā dusmu” sindroma attīstību.
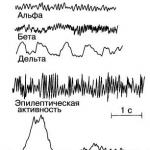
Infekcija, audzēja process, iedzimtas anomālijas, svarīgas smadzeņu daļas traumas negatīvi ietekmē neirohumorālo regulējumu, traucē impulsu pārnešanu no sirds, plaušām, gremošanas orgāniem un citiem ķermeņa elementiem. Dažādu hipotalāmu daivu iznīcināšana izjauc miegu, vielmaiņas procesus, provocē epilepsijas attīstību, aptaukošanos, pazeminātu temperatūru un emocionālus traucējumus.
Ne visi zina, kur atrodas hipotalāms. Diencefalona elements atrodas zem hipotalāma vagas, zem talāma. Struktūras šūnu grupas vienmērīgi pārveidojas par caurspīdīgu starpsienu. Mazā orgāna struktūra ir sarežģīta, tas veidojas no 32 pāriem hipotalāma kodolu, kas sastāv no nervu šūnām.
Hipotalāms sastāv no trim reģioniem, starp kuriem nav skaidras robežas. Arteriālā apļa zari nodrošina pilnīgu asins piegādi svarīgai smadzeņu daļai. Īpaša šī elementa trauku iezīme ir olbaltumvielu molekulu, pat lielu, spēja iekļūt caur sienām.
Par ko viņš ir atbildīgs?
Hipotalāma funkcijas organismā:
- kontrolē elpošanas, gremošanas, sirds, asinsvadu darbību, termoregulāciju;
- uztur optimālu endokrīno un ekskrēcijas sistēmu stāvokli;
- ietekmē dzimumdziedzeru, olnīcu, hipofīzes, virsnieru dziedzeru, aizkuņģa dziedzera darbību un;
- atbildīgs par cilvēka emocionālo uzvedību;
- piedalās nomoda un miega regulēšanas procesā, ražo hormonu melatonīnu, kura trūkuma dēļ attīstās bezmiegs un pasliktinās miega kvalitāte;
- Nodrošina optimālu ķermeņa temperatūru. Ar patoloģiskām izmaiņām hipotalāma aizmugurējā daļā, šīs zonas iznīcināšana, temperatūra pazeminās, attīstās vājums, vielmaiņas procesi norit lēnāk. Bieži vien ir pēkšņa subfertilā temperatūras paaugstināšanās;
- ietekmē nervu impulsu pārraidi;
- ražo hormonu kompleksu, bez kura pietiekama daudzuma nav iespējama pareiza organisma darbība.
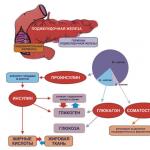
Hipotalāma hormoni

Svarīgs smadzeņu elements ražo vairākas regulatoru grupas:
- statīni: prolaktostatīns, melanotatīns, somatostatīns;
- hipofīzes aizmugurējās daivas hormoni: vazopresīns, oksitocīns;
- atbrīvojošie hormoni: folliliberīns, kortikoliberīns, prolaktoliberīns, melanoliberīns, somatoliberīns, luliberīns, tiroliberīns.
Problēmu cēloņi
Hipotalāma strukturālo elementu bojājumi ir vairāku faktoru ietekmes sekas:
- traumatiski smadzeņu bojājumi;
- bakteriālas, vīrusu infekcijas: limfogranulomatoze, sifiliss, bazālais meningīts, leikēmija, sarkoidoze;
- audzēja process;
- endokrīno dziedzeru darbības traucējumi;
- ķermeņa intoksikācija;
- dažāda veida iekaisuma procesi;
- asinsvadu patoloģijas, kas ietekmē barības vielu un skābekļa piegādes apjomu un ātrumu hipotalāma šūnām;
- fizioloģisko procesu traucējumi;
- asinsvadu sieniņu caurlaidības pārkāpums infekcijas izraisītāju iekļūšanas dēļ.
Slimības
Negatīvie procesi notiek uz svarīgas struktūras tiešas disfunkcijas fona. Audzēja process vairumā gadījumu ir labdabīgs, bet negatīvu faktoru ietekmē bieži rodas šūnu ļaundabīgi audzēji.
Piezīme! Hipotalāma bojājumu ārstēšanai nepieciešama integrēta pieeja, terapija ir saistīta ar daudziem riskiem un grūtībām. Ja tiek konstatētas onkoloģiskās patoloģijas, neiroķirurgs izņem audzēju, pēc tam pacientam tiek veiktas ķīmijterapijas un staru terapijas sesijas. Lai stabilizētu problēmu nodaļas darbību, tiek noteikts zāļu komplekss.
Galvenie hipotalāma audzēju veidi ir:
- teratomas;
- meningiomas;
- craniofaringiomas;
- gliomas;
- adenomas (aug no hipofīzes);
- pinealomas.
Simptomi

Hipotalāma darbības traucējumi izraisa negatīvu simptomu kompleksu:
- ēšanas traucējumi, nekontrolēta apetīte, pēkšņs svara zudums vai smaga aptaukošanās;
- tahikardija, asinsspiediena svārstības, sāpes krūšu kaulā, aritmija;
- samazināts libido, menstruāciju trūkums;
- agrīna pubertāte uz bīstama audzēja fona - hamartoma;
- galvassāpes, smaga agresija, nekontrolējama raudāšana vai smieklu lēkmes, krampji;
- izteikta bezcēloņa agresija, dusmu lēkmes;
- hipotalāma epilepsija ar augstu krampju biežumu visas dienas garumā;
- atraugas, caureja, sāpes epigastrālajā reģionā un vēderā;
- muskuļu vājums, pacientam ir grūtības stāvēt un staigāt;
- neiropsihiski traucējumi: halucinācijas, psihoze, trauksme, depresija, hipohondrija, garastāvokļa svārstības;
- stipras galvassāpes paaugstināta intrakraniālā spiediena dēļ;
- miega traucējumi, pamošanās vairākas reizes nakts laikā, nogurums, nespēks, galvassāpes no rīta. Iemesls ir svarīgā hormona melatonīna trūkums. Lai novērstu traucējumus, jums ir jāpielāgo nomoda un nakts miega režīms, kā arī jāveic zāļu kurss, lai atjaunotu svarīga regulatora skaļumu. Tas nodrošina labu terapeitisko efektu - jaunas paaudzes zāles ar minimālām blakusparādībām, bez atkarības sindroma;
- neskaidra redze, slikta jaunas informācijas atmiņa;
- strauja temperatūras paaugstināšanās vai indikatoru samazināšanās. Kad temperatūra paaugstinās, bieži vien ir grūti saprast, kas izraisa negatīvās izmaiņas. Par hipotalāma bojājumiem var aizdomas par pazīmju kopumu, kas norāda uz endokrīnās sistēmas bojājumiem: nekontrolēts izsalkums, slāpes, aptaukošanās, palielināta urīna izdalīšanās.
Dodieties uz adresi un izlasiet informāciju par uztura noteikumiem un 2. tipa diabēta ārstēšanu.
Diagnostika
Hipotalāma bojājuma simptomi ir tik dažādi, ka ir jāveic vairākas diagnostikas procedūras. Ļoti informatīvas metodes: ultraskaņa, EKG, MRI. Noteikti pārbaudiet virsnieru dziedzeri, vairogdziedzeri, vēdera dobuma orgānus, olnīcas, smadzenes un asinsvadus.
Ir svarīgi veikt asins un urīna analīzes, pārbaudīt glikozes, ESR, urīnvielas, leikocītu un hormonu līmeni. Pacients apmeklē endokrinologu, urologu, ginekologu, oftalmologu, endokrinologu, neirologu. Ja tiek atklāts audzējs, jums būs jākonsultējas ar neiroķirurģijas nodaļas speciālistu.
Ārstēšana
Hipotalāma bojājumu ārstēšanas shēma ietver vairākas jomas:

- ikdienas rutīnas korekcija, lai stabilizētu melatonīna ražošanu, novēršot pārmērīga uzbudinājuma, nervu spriedzes vai apātijas cēloņus;
- mainot uzturu, lai nodrošinātu optimālu vitamīnu un minerālvielu daudzumu, kas normalizē nervu sistēmas un asinsvadu stāvokli;
- medicīniskās ārstēšanas veikšana, ja tiek atklāti iekaisuma procesi ar infekciju ar smadzeņu daļu bojājumiem (antibiotikas, glikokortikosteroīdi, pretvīrusu zāles, atjaunojošie savienojumi, vitamīni, NPL);
- sedatīvu, trankvilizatoru saņemšana;
- ķirurģiska ārstēšana ļaundabīgu un labdabīgu audzēju noņemšanai. Smadzeņu onkoloģiskām patoloģijām tiek veikta apstarošana, tiek nozīmēta ķīmijterapija un imūnmodulatori;
- Labu efektu ēšanas traucējumu ārstēšanā panāk diēta, nervu darbību regulējošo vitamīnu injekcijas (B1 un B12), zāles, kas nomāc nekontrolējamu apetīti.
Ir svarīgi zināt, kāpēc hipotalāma bojājums var izraisīt strauju fizioloģisko procesu disbalansu organismā. Ja tiek konstatētas šīs smadzeņu daļas patoloģijas, jums jāveic visaptveroša pārbaude un jākonsultējas ar vairākiem ārstiem. Ar savlaicīgu terapijas sākšanu prognoze ir labvēlīga. Apstiprinot audzēja procesa attīstību, nepieciešama īpaša atbildība: noteikta veida neoplazmas sastāv no netipiskām šūnām.
Uzziniet vairāk par to, kas ir hipotalāms un par ko ir atbildīgs šis svarīgais orgāns, pēc videoklipa noskatīšanās:
Hipotalāms kalpo kā vieta tiešai mijiedarbībai starp centrālās nervu sistēmas augstākajām daļām un endokrīno sistēmu. Saikņu būtība, kas pastāv starp centrālo nervu sistēmu un endokrīno sistēmu, sāka kļūt skaidrāka pēdējās desmitgadēs, kad no hipotalāma tika izolēti pirmie humorālie faktori, kas izrādījās hormonālas vielas ar ārkārtīgi augstu bioloģisko aktivitāti. Bija vajadzīgs liels darbs un eksperimentāla prasme, lai pierādītu, ka šīs vielas veidojas hipotalāma nervu šūnās, no kurienes caur portāla kapilāru sistēmu nonāk hipofīzē un regulē hipofīzes hormonu sekrēciju, pareizāk sakot, to izdalīšanos (iespējams biosintēze). Šīs vielas vispirms sauca par neirohormoniem, bet pēc tam par atbrīvojošajiem faktoriem (no angļu valodas release — to release) jeb liberīniem. Vielas ar pretēju iedarbību, t.i. hipofīzes hormonu izdalīšanās (un, iespējams, biosintēzes) kavēšanu sāka saukt par inhibējošiem faktoriem jeb statīniem. Tādējādi hipotalāma hormoniem ir galvenā loma atsevišķu orgānu, audu un visa organisma daudzpusīgo bioloģisko funkciju hormonālās regulēšanas fizioloģiskajā sistēmā.
Līdz šim hipotalāmā ir atklāti 7 stimulanti (liberīni) un 3 inhibitori (statīni) hipofīzes hormonu sekrēcijai, proti: kortikoliberīns, tiroliberīns, luliberīns, folliliberīns, somatoliberīns, prolaktoliberīns, melanoliberīns, somatostatīns, prolaktostatīns (T un melanostatīns). 8.1) . Ir izdalīti pieci hormoni tīrā veidā, kuriem ir izveidota primārā struktūra, ko apstiprina ķīmiskā sintēze.
Lielas grūtības iegūt hipotalāma hormonus tīrā veidā ir izskaidrojamas ar to ārkārtīgi zemo saturu sākotnējos audos. Tādējādi, lai izolētu tikai 1 mg tiroliberīna, bija nepieciešams apstrādāt 7 tonnas hipotalāmu, kas iegūts no 5 miljoniem aitu.
Jāatzīmē, ka ne visi hipotalāma hormoni, šķiet, ir stingri specifiski kādam hipofīzes hormonam. Jo īpaši ir pierādīts, ka tirotropīnu atbrīvojošais hormons papildus tirotropīnam atbrīvo arī prolaktīnu, un luliberīns papildus luteinizējošajam hormonam atbrīvo arī folikulus stimulējošu hormonu.

1 Hipotalāma hormoniem nav stingri noteiktu nosaukumu. Hipofīzes hormona nosaukuma pirmajai daļai ieteicams pievienot galotni “liberīns”; piemēram, “tireotropīnu atbrīvojošais hormons” ir hipotalāma hormons, kas stimulē tirotropīna, atbilstošā hipofīzes hormona, izdalīšanos (un, iespējams, arī sintēzi). Hipotalāma faktoru nosaukumi, kas kavē hipofīzes tropisko hormonu izdalīšanos (un, iespējams, sintēzi), tiek veidoti līdzīgi - tiek pievienots galotne “statīns”. Piemēram, “somatostatīns” ir hipotalāma peptīds, kas kavē hipofīzes augšanas hormona, somatotropīna, izdalīšanos (vai sintēzi).
Konstatēts, ka visi hipotalāma hormoni pēc savas ķīmiskās struktūras ir mazmolekulārie peptīdi, tā sauktie neparastas struktūras oligopeptīdi, lai gan ne visiem ir noskaidrots precīzs aminoskābju sastāvs un primārā struktūra. Mēs piedāvājam līdz šim iegūtos datus par sešu no zināmajiem 10 hipotalāma hormoniem ķīmisko raksturu.
1. Tiroliberīns(Pyro-Glu-Gis-Pro-NH 2):

Tiroliberīnu attēlo tripeptīds, kas sastāv no piroglutamīnskābes (cikliskās) skābes, histidīna un prolinamīda, kas savienoti ar peptīdu saitēm. Atšķirībā no klasiskajiem peptīdiem, tas nesatur brīvas NH 2 - un COOH grupas pie N- un C-gala aminoskābēm.
2. GnRH ir dekapeptīds, kas sastāv no 10 aminoskābēm šādā secībā:
Pyro-Glu-Gis-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH 2
Galējā C-aminoskābe ir glicinamīds.
3. Somatostatīns ir ciklisks tetradekapeptīds (sastāv no 14 aminoskābju atlikumiem):
Šis hormons atšķiras no diviem iepriekšējiem papildus cikliskajai struktūrai ar to, ka tā N-galā nesatur piroglutamīnskābi: starp diviem cisteīna atlikumiem 3. un 14. pozīcijā veidojas disulfīda saite. Jāatzīmē, ka arī somatostatīna sintētiskais lineārais analogs ir apveltīts ar līdzīgu bioloģisko aktivitāti, kas norāda uz dabiskā hormona disulfīda tilta nenozīmīgumu. Papildus hipotalāmam somatostatīnu ražo centrālās un perifērās nervu sistēmas neironi, un tas tiek sintezēts arī aizkuņģa dziedzera saliņu (Langerhansa saliņu) S-šūnās aizkuņģa dziedzera un zarnu šūnās. Tam ir plašs bioloģisko efektu klāsts; jo īpaši ir pierādīta inhibējošā iedarbība uz augšanas hormona sintēzi adenohipofīzē, kā arī tā tiešā inhibējošā iedarbība uz insulīna un glikagona biosintēzi Langerhansa saliņu β- un α-šūnās.
4. Somatoliberīns nesen izolēts no dabiskiem avotiem. To attēlo 44 aminoskābju atlikumi ar pilnībā atklātu secību. Turklāt ķīmiski sintezētais dekapeptīds ir apveltīts ar somatoliberīna bioloģisko aktivitāti:
N-Val-Gis-Lei-Ser-Ala-Glu-Gln-Liz-Glu-Ala-ON.
Šis dekapeptīds stimulē hipofīzes augšanas hormona somatotropīna sintēzi un sekrēciju.
5. Melanoliberīns, kura ķīmiskā struktūra ir līdzīga atvērtā gredzena hormona oksitocīnam (bez tripeptīda sānu ķēdes), ir šāda struktūra:
N-Cis-Tyr-Ile-Gln-Asn-Cis-OH.
6. Melanostatīns(melanotropīnu inhibējošo faktoru) attēlo vai nu tripeptīds: Pyro-Glu-Leu-Gly-NH 2, vai pentapeptīds ar šādu secību:
Pyro-Glu-Gis-Phen-Arg-Gly-NNH 2 .
Jāatzīmē, ka melanoliberīnam ir stimulējoša iedarbība, un melanostatīnam, gluži pretēji, ir inhibējoša iedarbība uz melanotropīna sintēzi un sekrēciju hipofīzes priekšējā daļā.
Papildus uzskaitītajiem hipotalāma hormoniem intensīvi tika pētīta cita hormona ķīmiskā būtība - kortikoliberīns. Tā aktīvie preparāti tika izolēti gan no hipotalāma audiem, gan no hipofīzes aizmugurējās daivas; Pastāv viedoklis, ka pēdējais var kalpot kā vazopresīna un oksitocīna hormonu depo. Nesen no aitas hipotalāma tika izolēts kortikoliberīns, kas sastāv no 41 aminoskābes ar noskaidrotu secību.
Hipotalāma hormonu sintēzes vieta, visticamāk, ir nervu gali - hipotalāma sinaptosomas, jo tieši tur tiek atzīmēta augstākā hormonu un biogēno amīnu koncentrācija. Pēdējie kopā ar perifēro endokrīno dziedzeru hormoniem, kas darbojas pēc atgriezeniskās saites principa, tiek uzskatīti par galvenajiem hipotalāma hormonu sekrēcijas un sintēzes regulatoriem. Tiroliberīna biosintēzes mehānisms, kas, visticamāk, notiek caur neribosomu ceļu, ietver SH saturošas sintetāzes vai enzīmu kompleksa līdzdalību, kas katalizē glutamīnskābes ciklizāciju par piroglutamīnskābi, peptīdu saites veidošanos un prolīna amidēšana glutamīna klātbūtnē. Līdzīga biosintēzes mehānisma esamība ar atbilstošu sintetāžu piedalīšanos tiek pieņemta arī attiecībā uz gonadoliberīnu un somatoliberīnu.
Hipotalāma hormonu inaktivācijas ceļi nav pietiekami pētīti. Tirotropīnu atbrīvojošā hormona pussabrukšanas periods žurku asinīs ir 4 minūtes. Inaktivācija notiek gan tad, kad tiek pārrauta peptīdu saite (ekso- un endopeptidāžu ietekmē no žurku un cilvēka asins seruma), gan tad, kad tiek noņemta amīda grupa prolinamīda molekulā. Cilvēku un vairāku dzīvnieku hipotalāmā tika atklāts specifisks enzīms piroglutamilpeptidāze, kas katalizē piroglutamīnskābes molekulas šķelšanos no tiroliberīna vai gonadoliberīna.
Hipotalāma hormoni tieši ietekmē “gatavu” hormonu sekrēciju (precīzāk, izdalīšanos) un šo hormonu de novo biosintēzi. Ir pierādīts, ka cAMP ir iesaistīts hormonālo signālu pārraidē. Ir pierādīta specifisku adenohipofīzes receptoru esamība hipofīzes šūnu plazmas membrānās, ar kuriem saistās hipotalāma hormoni, pēc tam caur adenilāta ciklāzes sistēmu un membrānas kompleksiem Ca 2+ -ATP un Mg 2 izdalās Ca 2+ un cAMP joni. + -ATP; pēdējais iedarbojas gan uz atbilstošā hipofīzes hormona izdalīšanos, gan sintēzi, aktivizējot proteīnkināzi (skatīt zemāk).
Lai noskaidrotu atbrīvojošo faktoru darbības mehānismu, tostarp to mijiedarbību ar attiecīgajiem receptoriem, liela nozīme bija tiroliberīna un gonadoliberīna strukturālajiem analogiem. Dažiem no šiem analogiem ir pat augstāka hormonālā aktivitāte un ilgstoša darbība nekā dabiskajiem hipotalāma hormoniem. Tomēr vēl ir daudz darba, lai noskaidrotu jau atklāto atbrīvojošo faktoru ķīmisko struktūru un atšifrētu to darbības molekulāros mehānismus.
Atbrīvojošie hormoni ir cilvēka neirohormoni, kurus sintezē hipotalāma kodoli. Tie kavē (statīni) vai stimulē (liberīni) hipofīzes tropisko hormonu veidošanos. Tiek aktivizēts endokrīno dziedzeru darbs, un tiek regulēta to hormonu izdalīšanās. Centrālās nervu sistēmas augstākās daļas ir cieši saistītas, jo izdalās hormoni.
Hipotalāma funkcijas
Viena no svarīgākajām endokrīnās sistēmas sastāvdaļām, kas ir atbildīga par hormonu ražošanu, ir hipotalāms. Hipotalāma ražotās vielas ir hormoni, kas piedalās ķermeņa vielmaiņas procesos.
Hipotalāmā ir nervu šūnas, kas nodrošina organismam nepieciešamo vielu ražošanu normālai darbībai. Šīs šūnas sauc par neirosekrēcijas šūnām. Viņu uzdevums ir saņemt impulsus, ko pārraida dažādas nervu sistēmas daļas. Elementu izdalīšanās notiek caur aksovazālām sinapsēm.
Atbrīvojošie hormoni, ko ražo hipotalāms, vai, kā tos sauc citādi, statīni un liberīni, ir būtiski normālai hipofīzes darbībai. Pēc to ķīmiskās būtības tie ir peptīdi. Pateicoties ķīmiskajiem un nervu impulsiem, notiek to sintēze un ar asinīm tie tiek transportēti uz hipofīzi caur hipotalāma-hipofīzes sistēmu.
Hormonu klasifikācija
Apskatīsim slavenākos atbrīvojošos hormonus:
- Inhibē sekrēciju - mēs runājam par somatostatīnu, melanostatīnu, prolaktostatīnu.
- Stimulējošs - mēs runājam par melanoliberīnu, prolaktoliberīnu, folliberīnu, luliberīnu, somatoliberīnu, tiroliberīnu, gonadoliberīnu un kortikoliberīnu.
Uzskaitītās vielas vai drīzāk dažas no tām var ražot arī citi orgāni, ne tikai hipotalāms (piemēram, aizkuņģa dziedzeris).
Statīni un liberīni
No tiem tieši atkarīga hipofīzes darbība. Tie ietekmē arī perifēro endokrīno dziedzeru darbību:
- vairogdziedzeris;
- olnīcas meitenēm;
- sēklinieki vīriešiem.

Statīni un liberīni, kas ir vislabāk zināmie:
- dopamīns;
- gonadoliberīns (lyuliberīns, folliberīns);
- melonostatīns;
- somatostatīns;
- Vairogdziedzera hormons.
Luteinizējošā un folikulus stimulējošā hormona sekrēciju no hipofīzes nodrošina gonadoliberīni.
Androgēnu darbību vīriešiem ietekmē arī gonadoliberīni, kas veicina spermas aktivitātes un libido līmeņa paaugstināšanos.
Un sievietēm neirohormoni ir atbildīgi par menstruālo ciklu, un hormonu daudzums mainās atkarībā no cikla fāzes.
Nepietiekama atbrīvojošo hormonu ražošana bieži izraisa neauglību un impotenci.
Hormonu īpašības
Hormonu kortikoliberīnu, kas ir atbildīgs par trauksmi, ražo hipotalāms. Tas ir vēl viens svarīgs atbrīvojošais faktors, kas darbojas kopā ar hipofīzes hormoniem un ietekmē virsnieru dziedzeru darbību. Cilvēki ar šī hormona deficītu bieži cieš no hipertensijas un virsnieru mazspējas.
Gonadotropīnu atbrīvojošais hormons, hormons, kas uzlabo gonadotropīnu veidošanos, ir arī hipotalāma produkts. To sauc arī par gonadotropīnu atbrīvojošo hormonu.
Dzimumorgānu normāla darbība nevar pastāvēt bez GnRH. Tieši šis hormons ir atbildīgs par menstruālā cikla dabisko gaitu sievietēm. Ar tās līdzdalību notiek olšūnas nogatavināšanas un atbrīvošanās process. Šis hormons ir atbildīgs par libido (seksuālo tieksmi). Ar nepietiekamu šī hormona ražošanu hipotalāmā sievietēm bieži attīstās neauglība. Kādi citi atbrīvojošie hormoni pastāv?

Somatoliberīns
Tas visspilgtāk izpaužas bērnībā un pusaudža gados. Tās galvenā īpašība ir orgānu un ķermeņa sistēmu augšanas procesu normalizēšana. Bērna pilnīga attīstība un veidošanās ir atkarīga no tā ražošanas. Nepietiekama šī hormona ražošana hipotalāmā var izraisīt
Prolaktoliberīns
Tā ražošana visaktīvāk notiek grūsnības periodā un visā periodā, kad māte baro bērnu. Šis atbrīvojošais faktors normalizē prolaktīna ražošanu, kas veido piena dziedzeru kanālus.
Prolaktostatīns
Prolaktostatīns pieder pie statīnu apakšklases, ko ražo hipotalāms, un tas ir atbildīgs par prolaktīna inhibīciju.
Prolaktostatīni ietver:
· dopamīns;
somatostatīns;
· melanostatīns.
To galvenā darbība ir vērsta uz hipofīzes un hipotalāma tropisko hormonu nomākšanu.
Melanotropīnu atbrīvojošais hormons
Melanīna ražošanas procesu un pigmenta šūnu dalīšanos ietekmē melanoliberīns. Tas ietekmē arī hipofīzes PRD elementus.
Tas ietekmē cilvēka neirofizioloģisko uzvedību. Lieto depresijas mazināšanai un parkinsonisma ārstēšanai.
Tirotropīnu atbrīvojošais hormons (TRH)
Hipotalāma tirotropīnu atbrīvojošie hormoni ietver arī tirotropīnu atbrīvojošo hormonu. Tas veicina adenohipofīzes vairogdziedzeri stimulējošo hormonu veidošanos.
Tam ir neliela ietekme uz prolaktīna ražošanas procesu. Tiroliberīns nodrošina tiroksīna koncentrācijas paaugstināšanos asinīs.
Centrālajai nervu sistēmai ir liela ietekme uz hormonu ražošanas procesiem. Regulējošās sistēmas neirosekrēcijas šūnas ir atbildīgas par neirohormonu ražošanu.
Liberīnu galvenās funkcijas

Tie ir hipotalāmu atbrīvojošie hormoni. Gonadotropīnus atbrīvojošie hormoni normalizē sieviešu un vīriešu reproduktīvās sistēmas darbību.
Tie ir atbildīgi par folikulus stimulējošu hormonu reprodukciju un ietekmē sēklinieku un olnīcu darbību.
Komponentam, piemēram, luliberīnam, ir atdaloša iedarbība uz ovulāciju, radot iespēju ieņemt augli.
Sievietēm, kuras ir vienaldzīgas pret intīmo dzīvi, luliberīns un folliberīns tiek ražoti nepietiekamā daudzumā.
Ir arī atbrīvojošie faktori, kas saistīti ar hipotalāma vidējo daivu, taču to saikne ar hipofīzes un adenohipofīzes elementiem nav pētīta.
Hormonus atbrīvojošie agonisti: zāles
Kā jau minēts, šos hormonus ražo hipotalāms. Ja nepieciešams stimulēt olnīcas, piemēram, pirms IVF procedūras, tiek izmantoti atbrīvojošo hormonu agonisti vai analogi. Tas ir, tiem ir tāda pati ietekme uz ķermeni kā paša hormonam.
Bet pastāv liela varbūtība, ka no sievietes ķermeņa puses var attīstīties nevēlamas reakcijas. Tas notiek estrogēna līmeņa pazemināšanās dēļ. Visbiežāk sastopamās parādības ietver:
- galvassāpes;
- pārmērīga svīšana;
- plūdmaiņas;
- maksts sausums;
- garastāvokļa maiņas;
- depresīvi stāvokļi.
Tiek izmantotas šādas zāles:


Mēs pārskatījām hormonus atbrīvojošo hormonu agonistus.
Antagonisti
Tā kā estradiola līmenis ir ārkārtīgi paaugstināts, lietojot hormonus atbrīvojošā hormona agonistus, var rasties luteinizējošā hormona līmeņa paaugstināšanās. Tas noved pie priekšlaicīgas ovulācijas un olu nāves. Lai tas nenotiktu, tiek izmantoti hormonu atbrīvojošā hormona antagonisti. Viņu darbības rezultātā var atkal stimulēt hipofīzi. neizpaužas, bet tas bieži notika ilgstošas GnRH agonistu lietošanas dēļ. Ievada piecas dienas pēc folikulus stimulējošā hormona lietošanas sākuma.
Lai terapija būtu veiksmīga, visas zāļu receptes drīkst veikt tikai speciālists.
Libērieši:
- tiroliberīns;
- kortikoliberīns;
- somatoliberīns;
- prolaktoliberīns;
- melanoliberīns;
- gonadoliberīns (lyuliberīns un folliliberīns)
- somatostatīns;
- prolaktostatīns (dopamīns);
- melanostatīns;
- kortikostatīns
Neiropeptīdi:
- enkefalīni (leicīns-enkefalīns (leu-enkefalīns), metionīns-enkefapīns (met-enkefalīns));
- endorfīni (a-endorfīns, (β-endorfīns, γ-endorfīns);
- dinorfīni A un B;
- proopiomelanokortīns;
- neirotenzīns;
- viela P;
- kiotorfīns;
- vazointestinālais peptīds (VIP);
- holecistokinīns;
- neiropeptīds-Y;
- agouterīna proteīns;
- oreksīni A un B (hipokretīni 1 un 2);
- grelīns;
- delta miegu inducējošais peptīds (DSIP) utt.
Hipotalāma-aizmugurējās hipofīzes hormoni:
- vazopresīns vai antidiurētiskais hormons (ADH);
- oksitocīns
Monoamīni:
- serotonīns;
- norepinefrīns;
- adrenalīns;
- dopamīns
Hipotalāma un neirohipofīzes efektorhormoni
Hipotalāma un neirohipofīzes efektorhormoni ir vazopresīns un oksitocīns. Tie tiek sintezēti hipotalāma SON un PVN magnocelulārajos neironos, ar aksonu transportu nogādāti neirohipofīzē un izdalīti hipofīzes apakšējās artērijas kapilāru asinīs (1. att.).
Vasopresīns
Antidiurētiskais hormons(ADG vai vazopresīns) - peptīds, kas sastāv no 9 aminoskābju atlikumiem, tā saturs ir 0,5 - 5 ng/ml.
Hormona pamatsekrēcijai ir ikdienas ritms ar maksimumu agrās rīta stundās. Hormons tiek transportēts asinīs brīvā formā. Tās pusperiods ir 5-10 minūtes. ADH iedarbojas uz mērķa šūnām, stimulējot membrānas 7-TMS receptorus un otros sūtņus.
ADH funkcijas organismāADH mērķa šūnas ir nieru savākšanas kanālu epitēlija šūnas un asinsvadu sieniņu gludie miocīti. Stimulējot V 2 receptorus nieru savācējvadu epitēlija šūnās un paaugstinot cAMP līmeni tajos, ADH palielina ūdens reabsorbciju (par 10-15% jeb 15-22 l/dienā), veicina koncentrēšanos. un gala urīna tilpuma samazināšanās. Šo procesu sauc par antidiurēzi, un vazopresīnu, kas to izraisa, sauc par ADH.
Augstās koncentrācijās hormons saistās ar asinsvadu gludo miocītu V 1 receptoriem un, palielinoties IPG un Ca 2+ jonu līmenim tajos, izraisa miocītu kontrakciju, artēriju sašaurināšanos un asinsspiediena paaugstināšanos. Šo hormona ietekmi uz asinsvadiem sauc par presoru, tāpēc hormona nosaukums ir vazopresīns. ADH ir iesaistīts arī AKTH sekrēcijas stimulēšanā stresa apstākļos (caur V 3 receptoriem un intracelulāriem IPG un Ca 2+ joniem), slāpju motivācijas un dzeršanas uzvedības veidošanā, kā arī atmiņas mehānismos.
Rīsi. 1. Hipotalāma un hipofīzes hormoni (RG – atbrīvojošie hormoni (liberīni), ST – statīni). Paskaidrojumi tekstā
ADH sintēze un atbrīvošanās fizioloģiskos apstākļos stimulē osmotiskā spiediena (hiperosmolaritātes) paaugstināšanos asinīs. Hiperosmolaritāti pavada hipotalāma osmosensitīvo neironu aktivācija, kas savukārt stimulē SOY un PVN neirosekretoro šūnu ADH sekrēciju. Šīs šūnas ir saistītas arī ar vazomotora centra neironiem, kas saņem informāciju par asins plūsmu no ātriju un sinokarotīdu zonas mehāniskajiem un baroreceptoriem. Izmantojot šos savienojumus, ADH sekrēcija tiek refleksīvi stimulēta, kad samazinās cirkulējošā asins tilpums (CBV) un pazeminās asinsspiediens.
Vazopresīna galvenā iedarbība
- Aktivizējas
- Stimulē asinsvadu gludo muskuļu kontrakciju
- Aktivizē slāpju centru
- Piedalās mācīšanās mehānismos un
- Regulē termoregulācijas procesus
- Veic neiroendokrīnas funkcijas, būdams veģetatīvās nervu sistēmas starpnieks
- Piedalās organizācijā
- Ietekmē emocionālo uzvedību
Paaugstināta ADH sekrēcija tiek novērota arī ar paaugstinātu angiotenzīna II līmeni asinīs, stresu un fizisko aktivitāti.
ADH izdalīšanās samazinās, samazinoties asins osmotiskajam spiedienam, palielinoties asins tilpumam un (vai) asinsspiedienam, kā arī etilspirta iedarbībai.
ADH sekrēcijas un darbības nepietiekamība var būt hipotalāma un neirohipofīzes endokrīnās funkcijas nepietiekamības, kā arī ADH receptoru disfunkcijas (neesība, samazināta V 2 receptoru jutība nieru savācējvadu epitēlijā) sekas. ), ko pavada pārmērīga zema blīvuma urīna izvadīšana līdz 10-15 l/dienā un ķermeņa audu hipohidratācija. Šī slimība tika nosaukta cukura diabēts insipidus. Atšķirībā no diabēta, kurā pārmērīgu urīna veidošanos izraisa paaugstināts glikozes līmenis asinīs,. cukura diabēts insipidus Glikozes līmenis asinīs paliek normāls.
Pārmērīga ADH sekrēcija izpaužas kā diurēzes un ūdens aiztures samazināšanās organismā līdz pat šūnu tūskas un ūdens intoksikācijas attīstībai.
Oksitocīns
Oksitocīna funkcijas organismāOksitocīns- peptīds, kas sastāv no 9 aminoskābju atlikumiem, ko ar asinīm transportē brīvā veidā, pussabrukšanas periods - 5-10 minūtes, iedarbojas uz mērķa šūnām (dzemdes gludajiem miocītiem un piena dziedzeru kanālu mioepitsliālajām šūnām), stimulējot membrānu 7-TMS receptori un tajos IPE un Ca 2+ jonu līmeņa paaugstināšanās.
Hormonu līmeņa paaugstināšanās, kas dabiski tiek novērota grūtniecības beigās, izraisa pastiprinātu dzemdes kontrakciju dzemdību laikā un pēcdzemdību periodā. Hormons stimulē piena dziedzeru kanālu mioepitēlija šūnu kontrakciju, veicinot piena sekrēciju jaundzimušo barošanas laikā.
Galvenās oksitocīna iedarbības:
- Stimulē dzemdes kontrakcijas
- Aktivizē piena sekrēciju
- Piemīt diurētiska un nātrijurētiska iedarbība, kas piedalās ūdens un sāls uzvedībā
- Regulē dzeršanas uzvedību
- Palielina adenohipofīzes hormonu sekrēciju
- Piedalās mācīšanās un atmiņas mehānismos
- Ir hipotensīvs efekts
Paaugstināta estrogēna līmeņa ietekmē palielinās oksitocīna sintēze, un tā izdalīšanos refleksīvi pastiprina dzemdes kakla mehānisko receptoru kairinājums dzemdes kakla izstiepšanās laikā, kā arī piena dziedzeru sprauslu mehānisko receptoru stimulēšana dzemdību laikā. bērna barošana.
Nepietiekama hormona darbība izpaužas kā vājums dzemdē un traucēta piena sekrēcija.
Hipotalāmu atbrīvojošie hormoni tiek apspriesti, prezentējot perifēro endokrīno dziedzeru funkcijas.
Hipofīzes efektorhormoni
Tie ietver augšanas hormons(GR), prolaktīns(laktotropais hormons - LTG) adenohipofīzes un melanocītu stimulējošais hormons(MSG) no hipofīzes starpdaivas (sk. 1. att.).

Rīsi. 1. Hipotalāma un hipofīzes hormoni (RG – atbrīvojošie hormoni (liberīni), ST – statīni). Paskaidrojumi tekstā
Somatotropīns
Augšanas hormons (somatotropīns, somatotropais hormons GH)- polipeptīds, kas sastāv no 191 aminoskābes, ko veido adenohipofīzes sarkanās acidofīlās šūnas - somatotrofi. Pusperiods ir 20-25 minūtes. Pārvadā ar asinīm brīvā formā.
GH mērķi ir kaulu, skrimšļu, muskuļu, taukaudu un aknu šūnas. Tam ir tieša ietekme uz mērķa šūnām, stimulējot 1-TMS receptorus ar katalītisko tirozīna kināzes aktivitāti, kā arī netieši caur somatomedīniem - insulīnam līdzīgiem augšanas faktoriem (IGF-I, IGF-II), kas veidojas aknās un citi audi, reaģējot uz darbību GR.
Somatomedīnu īpašības
GH saturs ir atkarīgs no vecuma, un tam ir izteikta ikdienas periodiskums. Augstākais hormona saturs tika novērots agrā bērnībā ar pakāpenisku samazināšanos: no 5 līdz 20 gadiem - 6 ng/ml (ar maksimumu pubertātes laikā), no 20 līdz 40 gadiem - apmēram 3 ng/ml, pēc 40 gadiem - 1 ng/ml ml. Dienas laikā GH cikliski nonāk asinīs - sekrēcijas trūkums mijas ar “sekrēcijas sprādzieniem” ar maksimumu miega laikā.
Galvenās GH funkcijas organismāAugšanas hormonam ir tieša ietekme uz vielmaiņu mērķa šūnās un orgānu un audu augšanu, ko var panākt gan ar tiešu ietekmi uz mērķa šūnām, gan netieši iedarbojoties somatomedīniem C un A (insulīnam līdzīgiem augšanas faktoriem), ko izdala mērķšūnās. hepatocīti un hondrocīti, ja tie tiek pakļauti GR iedarbībai.
Augšanas hormons, tāpat kā insulīns, veicina glikozes uzsūkšanos šūnās un tās izmantošanu, stimulē glikogēna sintēzi un ir iesaistīts normāla glikozes līmeņa uzturēšanā asinīs. Tajā pašā laikā GH stimulē glikoneoģenēzi un glikogenolīzi aknās; insulīnam līdzīgais efekts tiek aizstāts ar pretsala efektu. Tā rezultātā attīstās hiperglikēmija. GH stimulē glikagona izdalīšanos, kas arī veicina hiperglikēmijas attīstību. Tajā pašā laikā palielinās insulīna veidošanās, bet samazinās šūnu jutība pret to.
Augšanas hormons aktivizē lipolīzi taukaudu šūnās, veicina brīvo taukskābju mobilizāciju asinīs un šūnu izmantošanu enerģijas iegūšanai.
Augšanas hormons stimulē proteīnu anabolismu, atvieglojot aminoskābju iekļūšanu aknu, muskuļu, skrimšļu un kaulu audu šūnās un aktivizējot olbaltumvielu un nukleīnskābju sintēzi. Tas palīdz palielināt bazālā metabolisma intensitāti, palielināt muskuļu audu masu un paātrināt cauruļveida kaulu augšanu.
GH anabolisko efektu papildina ķermeņa masas palielināšanās bez tauku uzkrāšanās. Tajā pašā laikā GH veicina slāpekļa, fosfora, kalcija, nātrija un ūdens aizturi organismā. Kā minēts, GH ir anaboliska iedarbība un stimulē augšanu, palielinot sintēzi un augšanas faktoru sekrēciju aknās un skrimšļos, kas stimulē hondrocītu diferenciāciju un kaulu pagarināšanos. Augšanas faktoru ietekmē palielinās aminoskābju piegāde miocītos un muskuļu proteīnu sintēze, ko papildina muskuļu audu masas palielināšanās.
GH sintēzi un sekrēciju regulē hipotalāma hormons somatoliberīns (SGHR – augšanas hormonu atbrīvojošais hormons), kas pastiprina GH sekrēciju, un somatostatīns (SS), kas kavē GH sintēzi un sekrēciju. Miega laikā GH līmenis pakāpeniski palielinās (maksimālais hormona saturs asinīs notiek pirmajās 2 miega stundās un pulksten 4-6 no rīta). Hipoglikēmija un brīvo taukskābju trūkums (badošanās laikā), aminoskābju pārpalikums (pēc ēšanas) asinīs palielina somatoliberīna un GH sekrēciju. Hormoni kortizols, kura līmenis palielinās līdz ar sāpju stresu, traumām, aukstuma iedarbību, emocionālu uzbudinājumu, T 4 un T 3, pastiprina somatoliberīna ietekmi uz somatotrofiem un palielina GH sekrēciju. Somatomedīni, augsts glikozes un brīvo taukskābju līmenis asinīs un eksogēnais GH kavē hipofīzes GH sekrēciju.

Rīsi. Somatotropīna sekrēcijas regulēšana

Rīsi. Somatomedīnu loma somatotropīna darbībā
Pārmērīgas vai nepietiekamas GH sekrēcijas fizioloģiskās sekas ir pētītas pacientiem ar neiroendokrīnām slimībām, kurās patoloģisko procesu pavadīja hipotalāma un (vai) hipofīzes endokrīnās funkcijas traucējumi. GH ietekmes samazināšanās ir pētīta arī gadījumos, kad mērķa šūnu reakcija uz GH darbību ir traucēta, kas saistīta ar hormonu-receptoru mijiedarbības defektiem.

Rīsi. Somatotropīna sekrēcijas ikdienas ritms
Pārmērīga GH sekrēcija bērnībā izpaužas kā straujš augšanas paātrinājums (vairāk nekā 12 cm/gadā) un gigantisma attīstība pieaugušam cilvēkam (ķermeņa augstums vīriešiem pārsniedz 2 m, bet sievietēm - 1,9 m). Tiek saglabātas ķermeņa proporcijas. Hormona pārprodukciju pieaugušajiem (piemēram, ar hipofīzes audzēju) pavada akromegālija - nesamērīgs atsevišķu ķermeņa daļu pieaugums, kas joprojām saglabā augšanas spēju. Tas izraisa izmaiņas cilvēka izskatā nesamērīgas žokļu attīstības, pārmērīgas ekstremitāšu pagarināšanas dēļ, kā arī var izraisīt cukura diabēta attīstību insulīna rezistences attīstības dēļ insulīna skaita samazināšanās dēļ. receptori šūnās un enzīma insulināzes sintēzes aktivizēšana aknās, kas iznīcina insulīnu.
Galvenā somatotropīna iedarbībaMetabolisms:
- olbaltumvielu metabolisms: stimulē olbaltumvielu sintēzi, atvieglo aminoskābju iekļūšanu šūnās;
- tauku vielmaiņa: stimulē lipolīzi, paaugstinās taukskābju līmenis asinīs un tās kļūst par galveno enerģijas avotu;
- ogļhidrātu metabolisms: stimulē insulīna un glikagona ražošanu, aktivizē aknu insulināzi. Augstās koncentrācijās tas stimulē glikogenolīzi, paaugstina glikozes līmeni asinīs un tiek kavēta tā izmantošana
Funkcionāls:
- izraisa slāpekļa, fosfora, kālija, nātrija, ūdens aizkavēšanos organismā;
- pastiprina kateholamīnu un glikokortikoīdu lipolītisko iedarbību;
- aktivizē audu izcelsmes augšanas faktorus;
- stimulē piena ražošanu;
- ir specifiska sugai.
Tabula. Somatotropīna ražošanas izmaiņu izpausmes
Nepietiekama GH sekrēcija bērnībā vai saiknes starp hormonu un receptoru traucējumi izpaužas kā augšanas ātruma kavēšana (mazāk par 4 cm/gadā), saglabājot ķermeņa proporcijas un garīgo attīstību. Šajā gadījumā pieaugušajam attīstās pundurisms (sieviešu augums nepārsniedz 120 cm, bet vīriešu - 130 cm). Pundurismu bieži pavada seksuāla nepietiekama attīstība. Otrais šīs slimības nosaukums ir hipofīzes pundurisms. Pieaugušam cilvēkam GH sekrēcijas trūkums izpaužas kā bazālās metabolisma samazināšanās, skeleta muskuļu masas samazināšanās un tauku masas palielināšanās.
Prolaktīns
Prolaktīns (laktotropais hormons)- LTG) ir polipeptīds, kas sastāv no 198 aminoskābēm, pieder tai pašai saimei kā somatotronīns un tam ir līdzīga ķīmiskā struktūra.
Izdalās asinīs ar adenohipofīzes dzeltenajiem laktotrofiem (10-25% no tās šūnām, un grūtniecības laikā - līdz 70%), transportē ar asinīm brīvā veidā, pussabrukšanas periods ir 10-25 minūtes. Prolaktīns ietekmē piena dziedzeru mērķa šūnas, stimulējot 1-TMS receptorus. Prolaktīna receptori atrodami arī olnīcu, sēklinieku, dzemdes šūnās, kā arī sirdī, plaušās, aizkrūts dziedzerī, aknās, liesā, aizkuņģa dziedzerī, nierēs, virsnieru dziedzeros, skeleta muskuļos, ādā un dažās centrālās nervu sistēmas daļās.
Galvenā prolaktīna iedarbība ir saistīta ar reproduktīvo funkciju. Būtiskākais no tiem ir laktācijas nodrošināšana, stimulējot dziedzeru audu attīstību piena dziedzerī grūtniecības laikā, bet pēc dzemdībām - jaunpiena veidošanos un tā pārtapšanu mātes pienā (laktoalbumīna, piena tauku un ogļhidrātu veidošanās). Taču tas neietekmē pašu piena sekrēciju, kas notiek refleksīvi bērna barošanas laikā.
Prolaktīns nomāc gonadotropīnu izdalīšanos no hipofīzes, stimulē dzeltenā ķermeņa attīstību, samazina progesterona veidošanos un kavē ovulāciju un grūtniecību zīdīšanas laikā. Prolaktīns veicina arī mātes vecāku instinkta veidošanos grūtniecības laikā.
Kopā ar vairogdziedzera hormoniem, augšanas hormonu un steroīdiem hormoniem prolaktīns stimulē virsmaktīvās vielas ražošanu augļa plaušās un izraisa nelielu sāpju jutības samazināšanos mātei. Bērniem prolaktīns stimulē aizkrūts dziedzera attīstību un ir iesaistīts imūnreakciju veidošanā.
Prolaktīna veidošanos un sekrēciju hipofīzē regulē hipotalāma hormoni. Prolaktostatīns ir dopamīns, kas kavē prolaktīna sekrēciju. Prolaktoliberīns, kura raksturs nav galīgi identificēts, palielina hormona sekrēciju. Prolaktīna sekrēciju stimulē dopamīna līmeņa pazemināšanās, estrogēna līmeņa paaugstināšanās grūtniecības laikā, serotonīna un melatonīna satura palielināšanās, kā arī refleksu ceļš, kad krūts sprauslas mehānoreceptori tiek kairināti. sūkšana, signāli, no kuriem nonāk hipotalāmā un stimulē prolaktoliberīna izdalīšanos.

Rīsi. Prolaktīna sekrēcijas regulēšana
Prolaktīna ražošana ievērojami palielinās trauksmes, stresa, depresijas un stipru sāpju laikā. FSH, LH un progesterons kavē prolaktīna sekrēciju.
Galvenās prolaktīna sekas:
- Uzlabo krūšu augšanu
- Uzsāk piena sintēzi grūtniecības un zīdīšanas laikā
- Aktivizē dzeltenā ķermeņa sekrēcijas aktivitāti
- Stimulē vazopresīna un aldosterona sekrēciju
- Piedalās ūdens-sāls metabolisma regulēšanā
- Stimulē iekšējo orgānu augšanu
- Piedalās mātes instinkta realizācijā
- Palielina tauku un olbaltumvielu sintēzi
- Izraisa hiperglikēmiju
- Ir autokrīna un parakrīna modulējoša iedarbība uz imūnreakciju (prolaktīna receptori uz T limfocītiem)
Hormona pārpalikums (hiperprolaktinēmija) var būt fizioloģisks un patoloģisks. Prolaktīna līmeņa paaugstināšanos veselam cilvēkam var novērot grūtniecības, zīdīšanas laikā, pēc intensīvas fiziskas slodzes un dziļa miega laikā. Prolaktīna patoloģiska hiperprodukcija ir saistīta ar hipofīzes adenomu, un to var novērot vairogdziedzera slimību, aknu cirozes un citu patoloģiju gadījumā.
Hiperprolaktinēmija var izraisīt menstruāciju traucējumus sievietēm, hipogonādismu un samazinātu dzimumdziedzeru darbību, piena dziedzeru lieluma palielināšanos, galaktoreju sievietēm, kas baro bērnu ar krūti (palielināta piena ražošana un sekrēcija); vīriešiem - impotence un neauglība.
Prolaktīna līmeņa pazemināšanos (hipoprolaktinēmiju) var novērot ar hipofīzes nepietiekamību, pēcdzemdību grūtniecību vai pēc vairāku zāļu lietošanas. Viena no izpausmēm ir nepietiekama laktācija vai tās trūkums.
Melantropīns
Melanocītu stimulējošais hormons(MSG, melanotropīns, intermedīns) ir peptīds, kas sastāv no 13 aminoskābju atlikumiem, kas veidojas hipofīzes starpzonā auglim un jaundzimušajiem. Pieaugušam cilvēkam šī zona ir samazināta, un MSH tiek ražots ierobežotā daudzumā.
MSH prekursors ir polipeptīds proopiomelanokortīns, no kura veidojas arī adrenokortikotropais hormons (AKTH) un β-lipotroīns. Ir trīs MSH veidi - a-MSH, β-MSH, y-MSH, no kuriem a-MSH ir vislielākā aktivitāte.
Galvenās MSH funkcijas organismāHormons inducē enzīma tirozināzes sintēzi un melanīna veidošanos (melanoģenēzi), stimulējot specifiskus 7-TMS receptorus, kas saistīti ar G-proteīnu mērķa šūnās, kas ir ādas, matu un tīklenes pigmenta epitēlija melanocīti. MSH izraisa melanosomu izkliedi ādas šūnās, ko pavada ādas tumšums. Šāda aptumšošanās rodas, palielinoties MSH saturam, piemēram, grūtniecības laikā vai virsnieru slimības (Adisona slimības) laikā, kad paaugstinās ne tikai MSH, bet arī AKTH un β-lipotropīna līmenis asinīs. Pēdējie, kas ir pro-opiomelanokortīna atvasinājumi, var arī uzlabot pigmentāciju, un, ja MSH līmenis pieauguša cilvēka organismā ir nepietiekams, tie var daļēji kompensēt tā funkcijas.
Melantropīni:
- Aktivizēt enzīma tirozināzes sintēzi melanosomās, ko pavada melanīna veidošanās
- Tie piedalās melanosomu izkliedēšanā ādas šūnās. Izkliedētās melanīna granulas agregējas, piedaloties ārējiem faktoriem (apgaismojums utt.), piešķirot ādai tumšu krāsu.
- Piedalīties imūnās atbildes regulēšanā
Tropiskie hipofīzes hormoni
Tie veidojas adenoginofīzē un regulē perifēro endokrīno dziedzeru mērķa šūnu, kā arī neendokrīno šūnu funkcijas. Dziedzeri, kuru funkcijas kontrolē hipotalāma-hipofīzes-endokrīno dziedzeru sistēmu hormoni, ir vairogdziedzeris, virsnieru garoza un dzimumdziedzeri.
Tireotropīns
Vairogdziedzera stimulējošais hormons(GTĪ, tirotropīns) sintezē adenohipofīzes bazofīlie tirotrofi, ir glikoproteīns, kas sastāv no a- un β-apakšvienībām, kuru sintēzi nosaka dažādi gēni.
TSH a-apakšvienības struktūra ir līdzīga placentā izveidotā lugeinizējošā hormona, folikulus stimulējošā hormona un cilvēka horiona gonadotropīna sastāvā esošajām apakšvienībām. TSH a-apakšvienība ir nespecifiska un tieši nenosaka tās bioloģisko darbību.
Tireotropīna a-subvienība asins serumā var būt aptuveni 0,5-2,0 μg/l. Augstāks tā koncentrācijas līmenis var būt viena no TSH izdaloša hipofīzes audzēja attīstības pazīmēm un novērota sievietēm pēc menopauzes.
Šī apakšvienība ir nepieciešama, lai piešķirtu specifiku TSH molekulas telpiskajai struktūrai, kurā tirotropīns iegūst spēju stimulēt vairogdziedzera tireocītu membrānas receptorus un izraisīt tā bioloģisko iedarbību. Šī TSH struktūra rodas pēc nekovalentas molekulas a- un beta-ķēžu saistīšanās. Turklāt p-apakšvienības struktūra, kas sastāv no 112 aminoskābēm, ir noteicošais faktors TSH bioloģiskās aktivitātes izpausmei. Turklāt, lai uzlabotu TSH bioloģisko aktivitāti un tā metabolisma ātrumu, ir nepieciešama TSH molekulas glikozilēšana raupjā endoplazmatiskajā retikulā un tirotrofu Golgi aparātā.
Ir zināmi gadījumi, kad bērniem ir sintēzi kodējošā gēna punktveida mutācijas (TSH β-ķēde, kā rezultātā tiek sintezēta izmainītas struktūras P-apakšvienība, kas nespēj mijiedarboties ar α-apakšvienību un veidoties bioloģiski aktīva tnrotropīns.Bērniem ar līdzīgu patoloģiju ir hipotireozes klīniskās pazīmes.
TSH koncentrācija asinīs svārstās no 0,5 līdz 5,0 μU/ml un sasniedz maksimumu no pusnakts līdz četrām stundām. Pēcpusdienā TSH sekrēcija ir minimāla. Šīs TSH līmeņa svārstības dažādos diennakts laikos būtiski neietekmē T4 un T3 koncentrāciju asinīs, jo organismā ir liels ekstratireoīdā T4 kopums. TSH pusperiods asins plazmā ir aptuveni pusstunda, un tā ražošana dienā ir 40-150 mU.
Tirotropīna sintēzi un sekrēciju regulē daudzas bioloģiski aktīvas vielas, starp kurām vadošās ir hipotalāma TRH un brīvais T4, T3, ko vairogdziedzeris izdala asinīs.
Tireotropīnu atbrīvojošais hormons ir hipotalāma neiropeptīds, ko ražo hipotalāma neirosekrēcijas šūnās un stimulē TSH sekrēciju. TRH hipotalāma šūnas izdala hipofīzes portāla asinsvadu asinīs caur aksovazālām sinapsēm, kur tas saistās ar tirotrofiem receptoriem, stimulējot TSH sintēzi. TRH sintēze tiek stimulēta ar samazinātu T4 un T3 līmeni asinīs. TRH sekrēciju kontrolē arī tirotropīna līmenis, izmantojot negatīvas atgriezeniskās saites kanālu.
TRH organismā ir vairākas sekas. Tas stimulē prolaktīna sekrēciju, un, kad TRH līmenis ir paaugstināts, sievietēm var rasties hiperprolaktinēmijas sekas. Šis stāvoklis var attīstīties, ja ir samazināta vairogdziedzera funkcija, ko papildina TRH līmeņa paaugstināšanās. TRH ir atrodams arī citās smadzeņu struktūrās, kuņģa-zarnu trakta sieniņās. Tiek uzskatīts, ka to izmanto sinapsēs kā neiromodulatoru, un tam ir antidepresīva iedarbība depresijas gadījumā.
Tabula. Galvenā tirotropīna iedarbība
TSH sekrēcija un tā līmenis plazmā ir apgriezti proporcionāls brīvā T 4, T 3 un T 2 koncentrācijai asinīs. Šie hormoni, izmantojot negatīvas atgriezeniskās saites kanālu, nomāc tirotropīna sintēzi, iedarbojoties gan tieši uz pašiem tirotrofiem, gan arī samazinot TRH sekrēciju hipotalāmā (hipotalāma neirosekretārās šūnas, kas veido TRH un hipofīzes tireotrofus T 4 un T 3 mērķa šūnas). Samazinoties vairogdziedzera hormonu koncentrācijai asinīs, piemēram, ar hipotireozi, palielinās tireotrofu populācijas procentuālais daudzums adenohipofīzes šūnās, palielinās TSH sintēze un palielinās tā līmenis asinīs. .
Šīs sekas ir hipofīzes tireotrofos ekspresēto TR 1 un TR 2 receptoru vairogdziedzera hormonu stimulācijas sekas. Eksperimenti ir parādījuši, ka TG receptora TR 2 izoformai ir galvenā nozīme TSH gēna ekspresijā. Acīmredzot vairogdziedzera hormonu receptoru ekspresijas, struktūras vai afinitātes pārkāpums var izpausties kā TSH veidošanās hipofīzē un vairogdziedzera funkcijas pārkāpums.
Somatostatīns, serotonīns, dopamīns, kā arī IL-1 un IL-6, kuru līmenis paaugstinās iekaisuma procesu laikā organismā, inhibē TSH sekrēciju no hipofīzes. Tas kavē TSH norepinefrīna un glikokortikoīdu hormonu sekrēciju, ko var novērot stresa apstākļos. TSH līmenis palielinās ar hipotireozi un var palielināties pēc daļējas tireoidektomijas un (vai) pēc radiojoda terapijas vairogdziedzera audzējiem. Šī informācija ārstiem jāņem vērā, izmeklējot pacientus ar vairogdziedzera sistēmas slimībām, lai pareizi diagnosticētu slimības cēloņus.
Tirotropīns ir galvenais tireocītu funkciju regulators, kas paātrina gandrīz katru TG sintēzes, uzglabāšanas un sekrēcijas posmu. TSH ietekmē paātrina vairogdziedzera proliferāciju, palielinās folikulu un paša vairogdziedzera izmērs, palielinās tā vaskularizācija.
Visi šie efekti ir sarežģītu bioķīmisko un fizikāli ķīmisko reakciju kopuma rezultāts, kas rodas pēc tirotropīna saistīšanās ar tā receptoriem, kas atrodas uz tireocītu bazālās membrānas, un ar G-proteīnu saistītās adenilāta ciklāzes aktivācijas, kas izraisa cAMP līmenis, cAMP atkarīgo proteīnkināžu A aktivācija, kas fosforilē galvenos enzīmus tirocītos. Tirocītos paaugstinās kalcija līmenis, palielinās jodīda uzsūkšanās, tiek paātrināta tā transportēšana un iekļaušana tiroglobulīna struktūrā, piedaloties vairogdziedzera peroksidāzes enzīmam.
TSH ietekmē tiek aktivizēti pseidopodiju veidošanās procesi, paātrinot tiroglobulīna rezorbciju no koloīda līdz tireocītiem, paātrina koloidālo pilienu veidošanos folikulās un tiroglobulīna hidrolīzi tajos lizosomu enzīmu ietekmē, tiek aktivizēts vairogdziedzera metabolisms, ko papildina glikozes, skābekļa uzsūkšanās ātruma palielināšanās un glikozes oksidēšanās ar tirocītiem, paātrina proteīnu un fosfolipīdu sintēzi, kas nepieciešami vairogdziedzera augšanai un skaita palielināšanai. un folikulu veidošanos. Augstās koncentrācijās un ar ilgstošu iedarbību tirotropīns izraisa vairogdziedzera šūnu proliferāciju, tā masas un izmēra palielināšanos (goiter), hormonu sintēzes palielināšanos un tā hiperfunkcijas attīstību (ar pietiekamu joda daudzumu). Organismā attīstās pārmērīga vairogdziedzera hormonu iedarbība (paaugstināta centrālās nervu sistēmas uzbudināmība, tahikardija, paaugstināts bazālais metabolisms un ķermeņa temperatūra, izspiedušās acis un citas izmaiņas).
TSH trūkums izraisa strauju vai pakāpenisku vairogdziedzera hipofunkcijas (hipotireoze) attīstību. Cilvēkam attīstās bazālā metabolisma samazināšanās, miegainība, letarģija, adinamija, bradikardija un citas izmaiņas.
Tirotropīns, stimulējot receptorus citos audos, palielina no selēna atkarīgās dejodināzes aktivitāti, kas pārvērš tiroksīnu aktīvākajā trijodtironīnā, kā arī to receptoru jutīgumu, tādējādi “sagatavojot” audus vairogdziedzera hormonu iedarbībai.
TSH un receptoru mijiedarbības traucējumi, piemēram, receptora struktūras izmaiņu vai tā afinitātes pret TSH dēļ, var būt vairāku vairogdziedzera slimību patoģenēzes pamatā. Jo īpaši TSH receptora struktūras izmaiņas, kas rodas mutācijas rezultātā gēnā, kas kodē tā sintēzi, izraisa vairogdziedzera jutības samazināšanos vai neesamību pret TSH darbību un iedzimtas primārās hipotireozes attīstību.
Tā kā TSH un gonadotropīna α-apakšvienību struktūra ir vienāda, gonadotropīns augstā koncentrācijā (piemēram, horionepiteliomas gadījumā) var konkurēt par saistīšanos ar TSH receptoriem un stimulēt vairogdziedzera TG veidošanos un sekrēciju.
TSH receptors spēj saistīties ne tikai ar tirotropīnu, bet arī ar autoantivielām – imūnglobulīniem, kas stimulē vai bloķē šo receptoru. Šāda saistīšanās notiek vairogdziedzera autoimūno slimību un jo īpaši autoimūna tiroidīta (Greivsa slimības) gadījumā. Šo antivielu avots parasti ir B limfocīti. Vairogdziedzera darbību stimulējošie imūnglobulīni saistās ar TSH receptoriem un iedarbojas uz dziedzera tireocītiem līdzīgi kā TSH.
Citos gadījumos organismā var parādīties autoantivielas, kas bloķē receptoru mijiedarbību ar TSH, kā rezultātā var rasties atrofisks tireoidīts, hipotireoze un miksedēma.
Gēnu mutācijas, kas ietekmē TSH receptoru sintēzi, var izraisīt TSH rezistences attīstību. Ar pilnīgu rezistenci pret TSH vairogdziedzeris ir ginoplastisks, nespēj sintezēt un izdalīt pietiekamu daudzumu vairogdziedzera hormonu.
Atkarībā no hipotalāma-hiofīzes-vairogdziedzera sistēmas saites, kuras izmaiņas izraisīja vairogdziedzera darbības traucējumu attīstību, ir ierasts atšķirt: primāro hipo- vai hipertireozi, kad traucējumi ir tieši saistīti ar vairogdziedzeris; sekundāri, ja traucējumus izraisa izmaiņas hipofīzē; terciārā - hipotalāmā.
Lutropīns
Gonadotropīnu galvenās funkcijas sievietes ķermenīGonadotropīni - folikulus stimulējošais hormons(FSH), vai folitropīns Un luteinizējošais hormons(LH), vai lutropīns, - ir glikoproteīni, kas veidojas dažādās vai vienādās adenohipofīzes bazofīlajās šūnās (gonadotrofos), regulē dzimumdziedzeru endokrīno funkciju attīstību vīriešiem un sievietēm, iedarbojas uz mērķa šūnām, stimulējot 7-TMS receptorus un paaugstinot cAMP līmeni organismā. viņiem. Grūtniecības laikā placentā var veidoties FSH un LH.
Pirmajās menstruālā cikla dienās pieaugošā FSH līmeņa ietekmē nobriest primārais folikuls un palielinās estradiola koncentrācija asinīs. Maksimālā LH līmeņa darbība cikla vidū ir tiešs cēlonis folikulu plīsumam un tā pārvēršanai dzeltenajā ķermenī. Latentais periods no maksimālās LH koncentrācijas brīža līdz ovulācijai svārstās no 24 līdz 36 stundām LH ir galvenais hormons, kas stimulē progesterona un estrogēnu veidošanos olnīcās.
Galvenās gonadotropīnu funkcijas vīrieša ķermenīFSH veicina sēklinieku augšanu, stimulē Ssrtoli šūnas un veicina to androgēnu saistošā proteīna veidošanos, kā arī stimulē inhibīna polipeptīda ražošanu šajās šūnās, kas samazina FSH un GnRH sekrēciju. LH stimulē Leidiga šūnu nobriešanu un diferenciāciju, kā arī testosterona sintēzi un sekrēciju šajās šūnās. FSH, LH un testosterona kombinētā darbība ir nepieciešama spermatoģenēzei.
Tabula. Galvenā gonadotropīnu iedarbība

FSH un LH sekrēciju regulē hipotalāma gonadotropīnu atbrīvojošais hormons (GHR), ko sauc arī par GnRH un LH, kas stimulē to izdalīšanos asinīs, galvenokārt FSH. Estrogēna satura palielināšanās sieviešu asinīs noteiktās menstruālā cikla dienās stimulē LH veidošanos hipotalāmā (pozitīva atgriezeniskā saite). Estrogēnu, progestīnu un hormona inhibīna darbība kavē GnRH, FSH un LH izdalīšanos. Prolaktīns kavē FSH un LH veidošanos.
Gonadotropīnu sekrēciju vīriešiem regulē GnrH (aktivācija), brīvais testosterons (inhibīcija) un inhibīns (inhibīcija). Vīriešiem GnRH sekrēcija notiek nepārtraukti, atšķirībā no sievietēm, kurām tā notiek cikliski.
Bērniem gonadotropīnu izdalīšanos kavē epifīzes hormons melatonīns. Tajā pašā laikā samazinātu FSH un LH līmeni bērniem pavada novēlota vai nepietiekama primāro un sekundāro seksuālo īpašību attīstība, novēlota augšanas plākšņu slēgšana kaulos (estrogēna vai testosterona trūkums) un patoloģiski augsta augšana vai gigantisms. Sievietēm FSH un LH trūkumu pavada menstruālā cikla traucējumi vai pārtraukšana. Mātēm, kas baro bērnu ar krūti, šīs cikla izmaiņas var būt diezgan izteiktas augstā prolaktīna līmeņa dēļ.
Pārmērīgu FSH un LH sekrēciju bērniem pavada agrīna pubertāte, augšanas plākšņu aizvēršanās un hipergonādu īss augums.
Kortikotropīns
Adrenokortikotropais hormons(AKTH, vai kortikotropīns) ir peptīds, kas sastāv no 39 aminoskābju atlikumiem, ko sintezē adenohipofīzes kortikotrofi, iedarbojas uz mērķa šūnām, stimulējot 7-TMS receptorus un paaugstinot cAMP līmeni, hormona pusperiods ir līdz 10 minūtēm.
Galvenās AKTH sekas sadalīta virsnieru un ārpusvirsnieru. AKTH stimulē virsnieru garozas fasciculata un reticularis augšanu un attīstību, kā arī glikokortikoīdu (kortizola un kortikosterona, ko veic zona fasciculata šūnas un mazākā mērā dzimumhormonu (galvenokārt androgēnu)) sintēzi un izdalīšanos. ar zonas reticularis šūnām.AKTH vāji stimulē mineralokortikoīda aldosterona izdalīšanos no zonas glomerulosa virsnieru garozas šūnām.
Tabula. Galvenā kortikotropīna iedarbība
AKTH ārpusvirsnieru darbība ir hormona iedarbība uz citu orgānu šūnām. AKTH piemīt lipolītiska iedarbība uz adipocītiem un palīdz paaugstināt brīvo taukskābju līmeni asinīs; stimulē aizkuņģa dziedzera beta šūnu insulīna sekrēciju un veicina hipoglikēmijas attīstību; stimulē augšanas hormona sekrēciju ar adenohipofīzes somatotrofiem; uzlabo ādas pigmentāciju, piemēram, MSH, ar kuru tai ir līdzīga struktūra.
AKTH sekrēcijas regulēšanu veic trīs galvenie mehānismi. Bāzes AKTH sekrēciju regulē endogēnais kortikoliberīna izdalīšanās ritms hipotalāmā (maksimālais līmenis no rīta 6-8 stundas, minimālais līmenis 22-2 stundas). Paaugstināta sekrēcija tiek panākta, iedarbojoties lielākam kortikoliberīna daudzumam, kas veidojas stresa ietekmes uz ķermeni laikā (emocijas, aukstums, sāpes, fiziskā aktivitāte utt.). AKTH līmeni kontrolē arī negatīvas atgriezeniskās saites mehānisms: tas samazinās, kad glikokortikoīdu hormona kortizola līmenis asinīs palielinās, un palielinās, kad kortizola līmenis asinīs samazinās. Kortizola līmeņa paaugstināšanās ir saistīta arī ar kortikosteroīdu hormonu sekrēcijas kavēšanu hipotalāmā, kas arī izraisa AKTH veidošanās samazināšanos hipofīzē.

Rīsi. Kortikotropīna sekrēcijas regulēšana
Pārmērīga AKTH sekrēcija notiek grūtniecības laikā, kā arī primārās vai sekundārās (pēc virsnieru dziedzeru noņemšanas) adenohipofīzes kortikotrofu hiperfunkcijas laikā. Tās izpausmes ir dažādas un saistītas gan ar paša AKTH iedarbību, gan ar tā stimulējošo ietekmi uz virsnieru garozas un citu hormonu hormonu sekrēciju. AKTH stimulē augšanas hormona sekrēciju, kura līmenis ir svarīgs normālai organisma augšanai un attīstībai. Paaugstināts AKTH līmenis, īpaši bērnībā, var būt saistīts ar simptomiem pārmērīgas augšanas hormona ražošanas dēļ (skatīt iepriekš). Ar pārmērīgu AKTH līmeni bērniem, jo tā stimulē virsnieru dziedzeru dzimumhormonu sekrēciju, var novērot agrīnu pubertāti, vīriešu un sieviešu dzimumhormonu nelīdzsvarotību un maskulinizācijas pazīmju attīstību sievietēm.
Augstā koncentrācijā asinīs AKTH stimulē lipolīzi, olbaltumvielu katabolismu un liekās ādas pigmentācijas veidošanos.
AKTH deficīts organismā izraisa nepietiekamu piokokortikoīdu sekrēciju virsnieru garozas šūnās, ko pavada vielmaiņas traucējumi un organisma rezistences samazināšanās pret vides faktoru nelabvēlīgo ietekmi.
AKTH veidojas no prekursora (proopiomelanokortīna), no kura tiek sintezēts arī a- un β-MSH, kā arī β- un γ-lipotropīni un endogēnie morfīnam līdzīgi peptīdi – endorfīni un enkefalīni. Lipotropīni aktivizē lipolīzi, un endorfīni un enkefalīni ir svarīgas smadzeņu antinociceptīvās (sāpju) sistēmas sastāvdaļas.