チオ硫酸ナトリウム。 一般情報 チオ硫酸ナトリウムの物性
熱的に非常に不安定:
硫酸の存在下では次のように分解します。
アルカリと反応します:
ハロゲンと反応します:
チオ硫酸
亜硫酸ナトリウムと硫黄を加えた水溶液を沸騰させ、余分な硫黄をろ別した後、放冷すると、溶液から無色透明の新しい物質の結晶が放出されます。その組成は次の式で表されます。 この物質はチオ硫酸のナトリウム塩です。
チオ硫酸は不安定です。 室温ではすでに崩壊します。 その塩であるチオ硫酸塩ははるかに安定しています。 これらのうち、最も一般的に使用されるのはチオ硫酸ナトリウムであり、誤って次亜硫酸塩としても知られています。
チオ硫酸ナトリウムの溶液に塩酸などの酸を加えると、二酸化硫黄の臭いが発生し、しばらくすると放出された硫黄により液体が白濁します。
チオ硫酸ナトリウムの特性を研究すると、その組成に含まれる硫黄原子は異なる酸化レベルを持っているという結論に達しました。そのうちの 1 つは酸化状態 +4、もう 1 つは 0 です。 。 チオ硫酸ナトリウム - 還元剤 。 塩素、臭素、その他の強力な酸化剤により酸化されて硫酸またはその塩になります。
チオスルフ?あなたは?- チオ硫酸、H2S2O3の塩およびエステル。 チオ硫酸塩は不安定であるため、自然界には存在しません。 最も広く使用されているのは、チオ硫酸ナトリウムとチオ硫酸アンモニウムです。
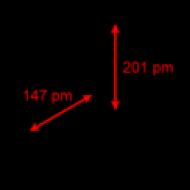
構造。チオ硫酸イオンの構造

チオ硫酸イオンは硫酸イオンと構造が似ています。 2- 四面体では、S-S 結合 (1.97A) が S-O 結合よりも長い
チオ硫酸ナトリウムかなり不安定な物質に分類される可能性があります。 チオ硫酸ナトリウムは 220°C に加熱すると分解します。チオ硫酸ナトリウムの熱分解反応では多硫化ナトリウムが得られますが、これもさらに硫化ナトリウムと元素硫黄に分解します。 酸との相互作用: チオ硫酸ナトリウムと強酸の反応ではチオ硫酸 (チオ硫酸水素) を単離することはできません。チオ硫酸は不安定ですぐに分解してしまうからです。塩酸や硝酸も同じ反応を起こします。 腐敗には不快な臭いのする分泌物が伴います。
チオ硫酸ナトリウムの酸化還元特性: 酸化状態 0 の硫黄原子が存在するため、チオ硫酸イオンは還元特性を持ちます。たとえば、弱い酸化剤 (I2、Fe3+) を使用すると、チオ硫酸イオンはテトラチオン酸イオンに酸化されます。アルカリ環境では、チオ硫酸ナトリウムはヨウ素と反応して硫酸塩になる可能性があります。
さらに強力な酸化剤により硫酸イオンに酸化されます。 :
強力な還元剤 イオンは S2- 誘導体に還元されます。条件に応じて、チオ硫酸ナトリウムは酸化特性と還元特性の両方を示すことができます。
チオ硫酸塩の錯化特性:
チオ硫酸イオンは強力な錯化剤です 、写真フィルムから未還元の臭化銀を除去するために写真で使用されます。S2O32 イオンは硫黄原子を介して金属によって配位されるため、チオ硫酸塩錯体は対応する硫化物に容易に変換されます。
チオ硫酸ナトリウムの用途
チオ硫酸ナトリウムは、日常生活と産業の両方で非常に広く使用されています。 チオ硫酸ナトリウムの主な応用分野は、医療、繊維および鉱業、写真です。
チオ硫酸ナトリウムは、繊維および製紙産業で布地や紙を漂白した後に微量の塩素を除去するために使用され、皮革製造ではクロム酸低減剤として使用されます。
鉱業では、銀濃度の低い鉱石から銀を抽出するためにチオ硫酸ナトリウムが使用されます。 銀とチオ硫酸塩の錯体化合物は非常に安定であり、少なくともフッ素、塩素、臭化物、チオシアン酸塩との錯体化合物よりも安定しています。 したがって、組成物の可溶性錯化合物の形態で銀を単離することは、工業的に有益である。 金の抽出に使用する研究が進行中です。 しかし、この場合、錯化合物の不安定定数ははるかに高く、銀錯体に比べて錯体の安定性は低くなります。
チオ硫酸ナトリウムの最初の使用は医学でした。 そして今日に至るまで、医学におけるその重要性は失われていません。 確かに、他のより効果的な薬が多くの病気の治療にすでに発見されているため、チオ硫酸ナトリウムは獣医学でより広く使用され始めています。 チオ硫酸ナトリウムは、ヒ素、水銀、その他の重金属、シアン化物(チオシアン酸塩に変換される)による中毒の解毒剤として医学で使用されます。
上で述べたように、チオ硫酸イオンは、多くの有毒な重金属を含む多くの金属と安定した錯化合物を生成します。 生成された複合化合物は毒性が低く、体外に排出されます。 チオ硫酸ナトリウムのこの特徴は、毒物学および中毒の治療におけるチオ硫酸ナトリウムの使用の基礎となっています。
チオ硫酸ナトリウムは、食中毒の場合の腸の消毒、疥癬の治療(塩酸と併用)、抗炎症剤および抗火傷剤としても使用されます。
チオ硫酸ナトリウムはヨウ素分析の試薬であるため、分析化学で広く使用されています。 ヨードメトリーは物質の濃度を定量的に測定する方法の 1 つであり、ヨウ素の濃度を測定するには、チオ硫酸ナトリウムによる酸化還元反応が使用されます。
チオ硫酸ナトリウムの最後の一般的な用途は、写真の固定剤としての使用です。 そして、通常の白黒写真はすでにカラー写真に取って代わられ、通常の写真フィルムが使用されることは非常にまれですが、多くの点でデジタル画像キャプチャよりも劣っていますが、写真乾板と写真フィルムが依然として使用されている場所がかなりあります。 例には、医療および産業用の X 線装置、科学機器、光望遠鏡などがあります。
写真画像を得るには、写真フィルム中の臭化銀の約 25% が現像されれば十分です。 そして残りは写真フィルムに残り、感光性を保ちます。 現像後に写真フィルムを光の中に取り出すと、フィルム内に残った未現像のハロゲン銀が現像液によって現像され、ネガは黒ずんでしまいます。 たとえ現像液がすべて洗い流されたとしても、ハロゲン化銀の分解によりネガは光の下で何らかの理由で暗くなります。
画像をフィルムに保存するには、未現像の銀ハロゲンをフィルムから除去する必要があります。 これを行うには、画像定着プロセスが使用され、このプロセス中にハロゲン化銀が可溶性化合物に変換され、フィルムまたは写真から洗い流されます。 画像の固定にはチオ硫酸ナトリウムが使用されます。
溶液中のチオ硫酸ナトリウムの濃度に応じて、さまざまな化合物が形成されます。 定着液に少量のチオ硫酸塩が含まれている場合、反応は次の方程式に従って進行します。
生成したチオ硫酸銀は水に不溶であるため、写真層から分離するのは困難ですが、非常に不安定であり、硫酸の放出により分解します。
硫化銀は画像を黒くし、写真層から除去できません。
溶液中に過剰なチオ硫酸ナトリウムが存在すると、錯体銀塩が形成されます。
得られる錯塩であるチオ硫酸銀酸ナトリウムは非常に安定ですが、水にはほとんど溶けません。
溶液中にチオ硫酸塩が大過剰に存在すると、水によく溶ける複雑な銀錯塩が形成されます。
チオ硫酸ナトリウムのこれらの特性は、写真の定着剤としての使用の基礎となっています。
テトラノピン酸ポリノイド酸のグループに属します。 これらは一般式の二塩基酸であり、2 ~ 6、場合によってはそれ以上の値を取ることができます。 ポリニチオン酸 不安定で、水溶液中でのみ知られています。 ポリチオ酸の塩、つまりポリチオン酸塩はより安定しています。 それらの一部は結晶の形で得られます。
ポリチオン酸 -一般式H2SnO6(n≧2)を有する硫黄化合物。 それらの塩はポリチオン酸塩と呼ばれます。

四チオン酸イオンチオ硫酸イオンをヨウ素で酸化することで得られます (反応はヨードメトリーで使用されます)。
ペンテーション酸イオンチオ硫酸イオンに対する SCl2 の作用によって、および酢酸カリウムを加えることによってヴァッケンローダー液から得られます。 まず四チオン酸カリウムの角柱状結晶が落ち、次にペンタチオン酸カリウムの板状結晶が落ち、酒石酸の作用によりペンタチオン酸水溶液が得られます。
ヘキサチオン酸カリウム K2S6O6低温で濃 HCl 中で K2S2O3 に KNO2 を作用させることによって最もよく合成されます。
重金属、ハロゲン、シアン化物の塩と無毒または低毒性の化合物を形成します。 アニリン、ベンゼン、ヨウ素、銅、水銀、青酸、昇華物、フェノールに対する解毒作用があります。 ヒ素、水銀、鉛の化合物による中毒の場合、無毒の亜硫酸塩が生成されます。 青酸とその塩による中毒の場合の解毒の主なメカニズムは、酵素ロドナーゼ - チオ硫酸シアン化物硫黄転移酵素(多くの組織に存在しますが、肝臓で最大の活性を示します)。 身体にはシアン化物を解毒する能力がありますが、ロドナーゼ系の働きは遅く、シアン化物中毒の場合、その活性は解毒するには不十分です。 この場合、ロドナーゼによって触媒される反応を加速するには、外因性硫黄供与体、通常はチオ硫酸ナトリウムを体内に導入する必要があります。
抗疥癬活性は、酸性環境で分解して硫黄と二酸化硫黄を生成する能力によるもので、これらは疥癬ダニとその卵に有害な影響を与えます。
チオ硫酸ナトリウムは静脈内投与後、細胞外液中に分布し、そのまま尿中に排泄されます。 生物学的T 1/2 - 0.65時間。
チオ硫酸ナトリウムは無毒です。 犬を対象に行われた研究では、チオ硫酸ナトリウムの慢性注入により血液量減少が認められましたが、これは浸透圧利尿効果によるものと考えられます。
アルコール性せん妄患者の解毒製品の複合体に使用されます。
物質の用途 チオ硫酸ナトリウム
ヒ素、鉛、水銀、臭素塩、ヨウ素、青酸、シアン化物による中毒。 アレルギー疾患、関節炎、神経痛; 疥癬。
禁忌
過敏症。
妊娠中および授乳中の使用
妊娠中の使用は、どうしても必要な場合にのみ可能です。 チオ硫酸ナトリウムを使用した動物の生殖研究は行われていません。 チオ硫酸ナトリウムを妊婦が摂取した場合に胎児への悪影響を引き起こす可能性があるか、あるいは生殖能力に影響を与えるかどうかは不明です。
物質チオ硫酸ナトリウムの副作用
アレルギー反応。
投与経路
IV、外部。
特別な指示
シアン化物中毒の場合、解毒剤の投与が遅れることは避けるべきです(即死の可能性があります)。 シアン化物中毒の症状が再発する可能性があるため、患者は 24 ~ 48 時間厳重に監視される必要があります。 症状が再発した場合は、半分の用量でチオ硫酸ナトリウムの投与を繰り返す必要があります。
アトリアチオ硫酸塩ナトリイ・チオスルファス
Na 2 S 2 0 3 -5H 2 0 M.m. 248.17
チオ硫酸ナトリウムは天然物ではなく、合成的に得られます。
産業では、チオ硫酸ナトリウムはガス生産廃棄物から得られます。 この方法は多段階の性質にもかかわらず、原料がガス生産廃棄物、特に石炭のコークス化中に形成される照明ガスであるため、経済的に有益である。
照明ガスには常に硫化水素の混合物が含まれており、これは水酸化カルシウムなどの吸収剤によって捕捉されます。 これにより硫化カルシウムが生成されます。
しかし、硫化カルシウムは製造過程で加水分解を受けるため、反応の進行は多少異なり、水硫化カルシウムが形成されます。
大気中の酸素によって酸化されると、水硫化カルシウムはチオ硫酸カルシウムを形成します。
得られたチオ硫酸カルシウムを硫酸ナトリウムまたは炭酸ナトリウムと融合させると、チオ硫酸ナトリウムNa 2 S 2 O 3 が得られる。
![]()
溶液を蒸発させると、薬局方の医薬品であるチオ硫酸ナトリウムが結晶化します。
チオ硫酸ナトリウム(II)は、外観上、塩味と苦味を有する無色透明の結晶です。 非常に水に溶けやすい。 50℃の温度で結晶水に溶けます。 その構造はチオ硫酸(I)の塩です。

これらの化合物の式からわかるように、分子内の硫黄原子の酸化の程度が異なります。 1 つの硫黄原子の酸化状態は +6、もう 1 つは -2 です。 さまざまな酸化状態の硫黄原子の存在によって、その特性が決まります。
このように、チオ硫酸ナトリウムは分子内にS 2- を有することで還元力を発揮する。
チオ硫酸自体と同様、その塩は強い化合物ではなく、たとえ炭酸のような弱い酸であっても、酸の影響下で容易に分解します。

酸によって分解して硫黄を放出するチオ硫酸ナトリウムのこの性質は、薬物を識別するために使用されます。 チオ硫酸ナトリウムの溶液に塩酸を加えると、硫黄の放出により溶液の濁りが観察されます。

チオ硫酸ナトリウムの非常に特徴的なのは、硝酸銀溶液との反応です。 これにより白い沈殿物 (チオ硫酸銀) が生成され、すぐに黄色に変わります。 空気中の湿気の影響下に放置すると、硫化銀の放出により沈殿物が黒くなります。
チオ硫酸ナトリウムが硝酸銀にさらされるとすぐに黒色の沈殿物が形成される場合、これは薬剤が硫化物で汚染されていることを示しており、硫化物は硝酸銀と相互作用すると直ちに硫化銀の沈殿物を放出します。

純粋な調製物は、硝酸銀溶液にさらされてもすぐに暗くなるわけではありません。
真正性反応として、チオ硫酸ナトリウムと塩化鉄(III)溶液との反応も使用できます。 この場合、紫色のチオ硫酸酸化鉄が形成されます。 この塩は還元されて無色の第一鉄塩 (FeS 2 0 3 および FeS 4 0 6) になるため、色はすぐに消えます。
チオ硫酸ナトリウムは、ヨウ素ナトリウムと相互作用すると還元剤として作用します。 S 2- から電子を受け取ると、ヨウ素は I- に還元され、チオ硫酸ナトリウムはヨウ素によって酸化されてテトラチオ酸ナトリウムになります。

塩素も同様に還元されて塩化水素になります。

塩素が過剰になると、放出された硫黄が酸化されて硫酸になります。
最初の防毒マスクで塩素を吸収するためにチオ硫酸ナトリウムが使用されたのは、この反応に基づいていました。
製剤には、ヒ素、セレン、炭酸塩、硫酸塩、硫化物、亜硫酸塩、カルシウム塩などの不純物を含めることはできません。
GF X は、標準内に塩化物および重金属塩の不純物の存在を許容します。
チオ硫酸ナトリウムの定量は、ヨウ素との相互作用の反応に基づくヨウ素分析法を使用して行われます。 GF は、製剤中のチオ硫酸ナトリウム含有量が 99% 以上、102% 以下であることを必要とします (製剤の風化の許容限界のため)。
チオ硫酸ナトリウムの使用は、硫黄を放出する能力に基づいています。 この薬は、ハロゲン、シアン、青酸による中毒の解毒剤として使用されます。

得られるチオシアン酸カリウムは、シアン化カリウムよりもはるかに毒性が低い。 したがって、青酸またはその塩による中毒の場合は、応急処置としてチオ硫酸ナトリウムを使用する必要があります。 この薬はヒ素、水銀、鉛化合物による中毒にも使用できます。 この場合、無毒の硫化物が形成されます。
チオ硫酸ナトリウムは、アレルギー疾患、関節炎、神経痛にも30%水溶液の形で静脈内投与されます。 これに関して、GF X は注射用のチオ硫酸ナトリウムの 30% 溶液を提供します (Solutio Natrii thiosulfatis 30% pro注射用)。
30% 溶液 5、10、50 ml の粉末およびアンプルで入手可能です。
チオ硫酸ナトリウムには結晶水が含まれており、蒸発しやすいため、光が分解を促進するため、しっかりと密閉した暗いガラス瓶に入れて涼しい場所に保管する必要があります。 溶液は放置すると硫黄が放出されるため白濁します。 このプロセスは二酸化炭素の存在下で加速されます。 したがって、チオ硫酸ナトリウム溶液の入ったフラスコまたはボトルには、ソーダ石灰を吸収する塩化カルシウムチューブが取り付けられています。
チオ硫酸ナトリウムは、化学では硫酸ナトリウムとして知られ、食品業界では添加剤 E539 として知られ、食品製造での使用が承認されている合成化合物です。
チオ硫酸ナトリウムは、酸性度調整剤(酸化防止剤)、固結防止剤、または防腐剤として機能します。 食品添加物としてチオ硫酸塩を使用すると、保存期間と製品の品質を延ばし、腐敗、酸味、発酵を防ぐことができます。 この物質は、純粋な形で、ヨウ素安定剤として食用ヨウ素添加塩の製造技術プロセスに関与し、固結や塊になりやすいベーキング小麦粉の加工に使用されます。
食品添加物 E539 の使用は産業分野のみに限定されており、小売りはできません。 医療目的では、チオ硫酸ナトリウムは重度の中毒に対する解毒剤および外用の抗炎症剤として使用されます。
一般情報
チオ硫酸塩 (次亜硫酸塩) は、チオ硫酸のナトリウム塩である無機化合物です。 この物質は無色無臭の粉末で、詳しく調べると透明な単斜晶系の結晶であることがわかります。
次亜硫酸塩は、自然界には存在しない不安定な化合物です。 この物質は結晶水和物を形成し、40℃以上に加熱するとそれ自身の結晶水に溶けて溶解します。 溶融したチオ硫酸ナトリウムは過冷却しやすく、約 220 °C の温度で化合物は完全に破壊されます。
チオ硫酸ナトリウム: 合成
硫酸ナトリウムは、ルブラン法を使用して実験室で初めて人工的に得られました。 この化合物はソーダ製造の副産物であり、硫化カルシウムの酸化によって形成されます。 酸素と相互作用すると、硫化カルシウムは部分的に酸化されてチオ硫酸塩となり、硫酸ナトリウムを使用するとそこから Na 2 S 2 O 3 が得られます。
 現代の化学では、硫酸ナトリウムの合成方法がいくつか提供されています。
現代の化学では、硫酸ナトリウムの合成方法がいくつか提供されています。
- 硫化ナトリウムの酸化。
- 亜硫酸ナトリウムで硫黄を沸騰させる。
- 硫化水素および酸化硫黄と水酸化ナトリウムとの相互作用。
- 硫黄を水酸化ナトリウムで沸騰させる。
上記の方法では、反応の副生成物として、または液体を蒸発させる必要がある水溶液の形態でチオ硫酸ナトリウムが生成される可能性があります。 硫酸ナトリウムのアルカリ溶液は、その硫化物を過酸化水素水に溶解することで得られます。
純粋な無水化合物チオ硫酸塩は、ホルムアミドとして知られる物質中のナトリウム塩および亜硝酸と硫黄との反応の結果として得られます。 合成反応は 80 °C の温度で起こり、約 30 分続きます。生成物はチオ硫酸塩とその酸化物です。
すべての化学反応において、次亜硫酸塩は強力な還元剤として作用します。 強い酸化剤との反応では、Na 2 S 2 O 3 は硫酸塩または硫酸に酸化され、弱い酸化剤ではテトラチオン塩に酸化されます。 チオ硫酸塩の酸化反応は、物質を測定するためのヨウ素滴定法の基礎です。
チオ硫酸ナトリウムと、強力な酸化剤であり有毒物質である遊離塩素との相互作用には、特別な注意が必要です。 次亜硫酸塩は塩素によって容易に酸化され、無害な水溶性化合物に変換されます。 したがって、この化合物は塩素の破壊的および有毒な影響を防ぎます。
工業条件では、チオ硫酸塩はガス生産廃棄物から抽出されます。 最も一般的な原料は照明ガスで、石炭のコークス化プロセス中に放出され、硫化水素不純物が含まれています。 それから硫化カルシウムが合成され、加水分解と酸化を受け、その後硫酸ナトリウムと結合してチオ硫酸塩が生成されます。 多段階のプロセスにもかかわらず、この方法は次亜硫酸塩を抽出するための最も費用対効果が高く、環境に優しい方法と考えられています。
| 系統名 | チオ硫酸ナトリウム |
|---|---|
| 伝統的な名前 | 二硫化ナトリウム、次亜硫酸ナトリウム(ナトリウム)ソーダ、抗塩素 |
| 国際マーキング | E539 |
| 化学式 | Na2S2O3 |
| グループ | 無機チオ硫酸塩(塩) |
| 集約の様子 | 無色の単斜晶系結晶(粉末) |
| 溶解性 | に可溶、不溶 |
| 融点 | 50℃ |
| 臨界温度 | 220℃ |
| プロパティ | 還元性(抗酸化性)、錯化作用 |
| 栄養補助食品カテゴリー | 酸性度調整剤、固結防止剤(固結防止剤) |
| 起源 | 合成 |
| 毒性 | 研究されていないため、その物質は条件付きで安全です |
| 使用範囲 | 食品、繊維、皮革産業、写真、医薬品、分析化学 |
チオ硫酸ナトリウム: 応用
 二硫化ナトリウムは、この化合物が栄養補助食品や医薬品に含まれるずっと前からさまざまな目的で使用されていました。 第一次世界大戦中、有毒な塩素から呼吸器系を保護するために、ガーゼ包帯やガスマスクのフィルターに反塩素剤を染み込ませるために使用されました。
二硫化ナトリウムは、この化合物が栄養補助食品や医薬品に含まれるずっと前からさまざまな目的で使用されていました。 第一次世界大戦中、有毒な塩素から呼吸器系を保護するために、ガーゼ包帯やガスマスクのフィルターに反塩素剤を染み込ませるために使用されました。
産業における次亜硫酸塩の最新の応用分野:
- 写真フィルムを処理し、印画紙に画像を記録する。
- 飲料水の脱塩素および細菌学的分析。
- 布地を漂白する際の塩素汚れの除去。
- 金鉱石の浸出。
- 銅合金と緑青の生産。
- 革のなめし。
硫酸ナトリウムは分析化学や有機化学の試薬として使用され、強酸を中和し、重金属とその有毒化合物を中和します。 チオ硫酸塩とさまざまな物質との反応は、ヨウ素分析および臭素分析の基礎です。
食品添加物 E539
チオ硫酸ナトリウムは食品添加物としては広く使用されておらず、化合物の不安定性と分解生成物の毒性のため、自由に入手することはできません。 次亜硫酸塩は、酸性度調整剤および固結防止剤として、食用ヨウ素添加塩およびベーカリー製品の製造技術プロセスに関与しています。
添加物 E539 は、野菜や魚の缶詰、デザートやアルコール飲料の製造において酸化防止剤および保存料として機能します。 この物質は、生、乾燥、冷凍の野菜や果物の表面を処理するために使用される化学物質の一部でもあります。
防腐剤および酸化防止剤 E539 は、これらの製品の品質を向上させ、保存期間を延ばすために使用されます。
- 生鮮および冷凍の野菜、果物、魚介類。
- 、ナッツ、種子。
- 野菜、キノコ、海藻、缶詰または油。
- ジャム、ゼリー、砂糖漬けのフルーツ、フルーツピューレ、詰め物。
- 生鮮、冷凍、燻製、乾燥した魚、魚介類、缶詰食品。
- 小麦粉、でんぷん、ソース、調味料、酢、
- 白とサトウキビ、甘味料(ブドウ糖と)、シュガーシロップ。
- 果物や野菜のジュース、甘い水、低アルコール飲料、ブドウ飲料。
ヨウ素添加食塩を製造する際、ヨウ素を安定化させるために食品添加物 E539 が使用されます。これにより、製品の保存期間が大幅に延長され、栄養価が維持されます。 食塩中の E539 の最大許容濃度は 1 kg あたり 250 mg です。
製パンでは、製品の品質を向上させるためにチオ硫酸ナトリウムがさまざまな添加剤の一部として積極的に使用されています。 ベーキング改良剤は酸化性または還元性のいずれかです。 固結防止剤 E539 は、特性を変更できる修復性向上剤です。
切れにくいグルテンを含む高密度の小麦粉から作られた生地は、加工が難しく、ケーキになり、必要な体積に達せず、焼成中にひび割れが発生します。 固結防止剤 E539 はジスルフィド結合を破壊し、グルテンタンパク質を構造化します。その結果、生地がよく膨らみ、クラムが緩んで弾力性があり、ベーキング中にクラストが割れません。
企業では、生地をこねる直前に、小麦粉にイースト菌とともに固結防止剤を加えます。 小麦粉中のチオ硫酸塩含有量は、ベーカリー製品の製造技術によって異なりますが、その質量の 0.001 ~ 0.002% です。 E539添加物の衛生基準は小麦粉1kgあたり50mgです。
固結防止剤 E539 は技術プロセスで厳密な用量で使用されているため、小麦粉製品を摂取してもチオ硫酸塩中毒の危険はありません。 小売用の小麦粉は販売前に加工されていません。 通常の範囲内では、サプリメントは安全であり、体に有毒な影響を及ぼしません。
医療での使用と体への影響
次亜硫酸ソーダは、最も効果的で安全な医薬品の 1 つとして、世界保健機関の必須医薬品リストに含まれています。 注射液として皮下、筋肉内、静脈内に投与されたり、外用剤として使用されます。
20世紀初頭、チオ硫酸ナトリウムが青酸中毒の解毒剤として初めて使用されました。 チオ硫酸塩は亜硝酸ナトリウムと組み合わせて、シアン化物中毒の特に重篤な場合に推奨されており、シアン化物を無毒のチオシアン酸塩に変換するために静脈内投与され、その後安全に体外に排泄されます。
硫酸ナトリウムの医療用途:
経口摂取した場合の次亜硫酸塩の人体への影響は研究されていないため、純粋な形または食品の一部としての物質の利点と害を判断することは不可能です。 E539 添加物による中毒の事例はないため、一般に無毒であると考えられています。
チオ硫酸ナトリウムと法律
チオ硫酸ナトリウムは、ロシアとウクライナの食品生産での使用が承認された食品添加物のリストに含まれています。 固結防止剤と酸度調整剤 E539 は、確立された衛生基準に従って工業用のみに使用されています。
経口投与した場合の人体に対する化学物質の影響はまだ研究されていないため、E539 添加剤は EU および米国での使用が承認されていません。
医療現場では解毒剤および脱感作剤として注射液として、または外用として殺虫剤として、獣医学では皮膚疾患の治療法として、製薬業界では医薬品の製造において。 注射用の30%チオ硫酸ナトリウム溶液の調製用。チオ硫酸ナトリウムも使われています
- 布地を漂白した後の残留塩素の除去に
- 鉱石から銀を抽出するため。
- 写真のフィクサー。
- ヨードメトリーの試薬
- 中毒の解毒剤:As、Br、Hg、その他の重金属、シアン化物(チオシアン酸塩に変換)など。
- 腸の消毒用。
- 疥癬の治療用(塩酸と併用)。
- 抗炎症剤および抗火傷剤。
- 凝固点を下げることで分子量を決定するための媒体として使用できます(冷凍定数 4.26°)。
- 食品業界では食品添加物 E539 として登録されています。
- コンクリート用添加剤。
- 組織のヨウ素を洗浄するため
説明
物理化学的特性
無色透明、無臭の結晶パッキング
バッグ40kg。 パッケージ1kg。 バッグ35kg。 袋0.5kg。 1kg袋。 5kgの袋。 バッグ10kg。
ストレージ
包装: 各 0.5 kg。 1kg; 5kg; 10kg; 35kg; 40kg; ポリエチレンフィルムまたはポリマーコーティングを施した包装紙でできた袋または袋に45kg入ります。
保管: 乾燥した場所で、しっかりと梱包された容器に入れて保管してください。 賞味期限 - 5年。
薬局方のチオ硫酸ナトリウムにちなんで名付けられた化学工場によって製造されます。 L.Ya. カルポワ
| 質量分率、% | 標準 | |
|---|---|---|
| Na 2 S 2 O 3 *5H 2 O | 99,0-102,0 | |
| カルシウム | 反応なし | |
| 硫化物 | あなたは試練に耐えます | |
| 亜硫酸塩と硫酸塩 | 最大。 | 0,01 |
| 塩化物 | 最大。 | 0,005 |
| ヘビーメタル | 最大。 | 0,001 |
| ヒ素、セレン | 反応なし | |
| 腺 | 最大。 | 0,002 |
| アルカリ性 | フェノールフタレインのピンク色がないこと | |
| 微生物学的純度 | 国家基金第 11 号第 2 号、193 ページに相当 |
- 商品コード:264-01
- 状況:在庫あり