体内のリン酸化の種類。 酸化的リン酸化による ATP 合成。 酸化的リン酸化の阻害剤
代謝経路におけるエネルギーの主導的な役割はプロセスに依存し、その本質は酸化的リン酸化です。 栄養素は酸化され、エネルギーが生成され、体はATPとして細胞のミトコンドリアに蓄えます。 地球上のあらゆる生命体にはそれぞれ好みの栄養素がありますが、ATP は普遍的な化合物であり、酸化的リン酸化によって生成されるエネルギーは代謝プロセスに使用するために蓄えられます。
細菌
35億年以上前、最初の生物が地球上に出現しました。 地球上で生命が誕生したのは、新興細菌である原核生物(核を持たない)が、呼吸と栄養の原理に従って2つのタイプに分けられたためです。 呼吸によって好気性と嫌気性に変化し、栄養によって従属栄養性と独立栄養性の原核生物に変化します。 酸化的リン酸化は基本概念なしでは説明できないため、この注意は不必要ではないでしょう。
したがって、原核生物は酸素との関係(生理学的分類)で、遊離酸素を気にしない好気性微生物と、その生命活動が遊離酸素の存在に完全に依存する好気性微生物に分けられます。 遊離酸素が飽和した環境で酸化的リン酸化を行うのは彼らです。 これは、嫌気性発酵と比較してエネルギー効率が高く、最も普及している代謝経路です。

ミトコンドリア
もう 1 つの基本概念: これはセルのエネルギー バッテリーです。 ミトコンドリアは細胞質にあり、そこには信じられないほどの数のミトコンドリアが存在します。たとえば、人の筋肉や肝臓には、細胞内に最大 15,000 個のミトコンドリアが含まれています (まさに最も激しい代謝が起こる場所です)。 そして、ミトコンドリアの手で酸化的リン酸化が起こると、ミトコンドリアはエネルギーを蓄えて分配します。
ミトコンドリアは細胞分裂にさえ依存せず、非常に機動性があり、必要なときに細胞質内を自由に移動します。 彼らは独自の DNA を持っているため、独立して生まれ、独立して死んでいきます。 それにもかかわらず、細胞の寿命は完全にミトコンドリアに依存しており、ミトコンドリアなしでは細胞は機能せず、つまり生命は本当に不可能です。 脂肪、炭水化物、タンパク質は酸化され、その結果水素原子と電子が形成され、還元等価物が呼吸鎖に沿ってさらに進みます。 これが酸化的リン酸化の仕組みであり、そのメカニズムは単純であると考えられます。

それほど簡単ではありません
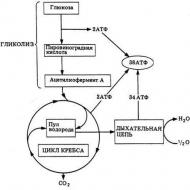
ミトコンドリアによって生成されたエネルギーは、ミトコンドリアの内膜に位置するプロトンのみの電気化学勾配のエネルギーである別のエネルギーに変換されます。 ATPの合成にはこのエネルギーが必要です。 そして、これがまさに酸化的リン酸化です。 生化学はかなり新しい科学です。ミトコンドリア顆粒が細胞内で発見されたのは 19 世紀半ばになってからであり、エネルギーを得るプロセスが説明されたのはずっと後です。 解糖によって形成されたトリオース(そして最も重要なのはピルビン酸)がどのようにミトコンドリア内でさらなる酸化を引き起こすかを監視しました。
トリオースは分裂エネルギーを使用し、そこから CO 2 が放出され、酸素が消費され、大量の ATP が合成されます (アデノシン三リン酸とそれが何であるか - ボディビルディングに熱心な人々は特によく知っています)。 上記のプロセスはすべて、酸化サイクルおよび電子を運ぶ呼吸鎖と密接に関連しています。 したがって、細胞内で酸化的リン酸化が起こり、細胞のための「燃料」である ATP 分子が合成されます。

酸化サイクルと呼吸鎖
酸化サイクルでは、トリカルボン酸が電子を放出し、電子輸送鎖に沿って移動が始まります。最初に補酵素分子に到達します。ここでは NAD が主要な分子 (ニコチンアミドアデニン ジヌクレオチド)、次に電子は ETC (電気輸送鎖) に転送され、それらは酸素分子と結合し、水分子を形成しません。 酸化的リン酸化(そのメカニズムは上で簡単に説明しました)は、別の作用部位に転移します。 これらは、ミトコンドリアの内膜に埋め込まれたタンパク質複合体です。
ここで最高潮、つまり元素の一連の酸化と還元によるエネルギーの変換が起こります。 ここで興味深いのは、酸化的リン酸化が起こる電気伝達連鎖の 3 つの主要な点です。 生化学では、このプロセスを非常に深く、注意深く調べます。 もしかしたら、いつかここから新たな老化治療法が生まれるかもしれない。 したがって、この鎖の 3 つの点で、ATP はリン酸と ADP (アデノシン二リン酸 - リボース、アデニン、および 2 つのリン酸部分から構成されます) から形成されます。 それが、プロセスにそのような名前が付けられた理由です。

細胞呼吸
細胞(別名組織)の呼吸と酸化的リン酸化は、同じプロセスの集合的な段階です。 空気は組織や器官のすべての細胞で使用され、そこで分解生成物(脂肪、炭水化物、タンパク質)が分解され、この反応により次の形で蓄えられたエネルギーが生成されます。 通常の肺呼吸は、酸素が体内に入り、炭素が取り込まれる点で組織呼吸とは異なります。二酸化物がそこから除去されます。
体は常に活動しており、そのエネルギーは運動と成長、自己生殖、過敏症、その他多くのプロセスに費やされます。 これがまさに、ミトコンドリアで酸化的リン酸化が起こる理由です。 ピルビン酸、アミノ酸、脂肪酸からの ATP の酸化的形成。 アセチル残基はトリカルボン酸によって破壊され、その後 2 分子の二酸化炭素と 4 対の水素原子が放出されます。 電子と陽子は酸素分子に伝達されます。
追加のメカニズム
細胞レベルでの呼吸により、細胞内での ADP の直接的な形成と補充が確実に行われます。 体は別の方法で自分自身を補充することができますが。 この目的のために、追加のメカニズムが存在し、必要に応じて有効化されますが、それほど効果的ではありません。
これらは、炭水化物の無酸素分解、つまりグリコーゲン分解と解糖が起こるシステムです。 これはもはや酸化的リン酸化ではなく、反応が多少異なります。 しかし、細胞呼吸を止めることはできません。その過程で、さまざまな生合成に使用される必須化合物の非常に必要な分子が形成されるからです。

エネルギーの形態
電子がミトコンドリア膜内を移動すると、そこで酸化的リン酸化が起こり、各複合体からの呼吸鎖が放出されたエネルギーを向けてプロトンを膜を通って、つまりマトリックスから膜間の空間に移動させます。 すると電位差が形成されます。 プロトンは正に帯電しており、膜間腔に存在しますが、負に帯電したプロトンはミトコンドリアマトリックスから作用します。
特定の電位差に達すると、タンパク質複合体はプロトンをマトリックスに戻し、結果として生じるエネルギーをまったく異なるエネルギーに変換します。そこでは酸化プロセスが合成プロセス、つまりADPのリン酸化と結合します。 物質が酸化され、ミトコンドリア膜を介してプロトンが送り出される全期間中、ATP 合成、つまり酸化的リン酸化は停止しません。
2種類
酸化的リン酸化と基質リン酸化は根本的に異なります。 現代の概念によれば、最も古代の生命体は基質のリン酸化反応のみを利用することができました。 この目的のために、外部環境に存在する有機化合物がエネルギー源と炭素源の 2 つの経路を通じて利用されました。 しかし、環境中のそのような化合物は徐々に枯渇し、すでに出現していた生物は適応し始め、新しいエネルギー源と新しい炭素源を探し始めました。
そこで彼らは光と二酸化炭素のエネルギーを利用することを学びました。 しかし、これが起こるまで、生物は発酵の酸化プロセスからエネルギーを放出し、それを ATP 分子に蓄えていました。 可溶性酵素による触媒作用の方法が使用される場合、これは基質リン酸化と呼ばれます。 発酵した基質は還元剤を形成し、電子を所望の内因性受容体(アセトン、アセトアルヒド、ピルビン酸塩など)に伝達するか、H2 - 水素ガスが放出されます。
比較特性
発酵と比較して、酸化的リン酸化ははるかに大きなエネルギー出力を有します。 解糖では合計 2 分子の ATP が生成され、その過程で 30 ~ 36 分子が合成されます。 電子は酸化および還元反応を通じてドナー化合物からアクセプター化合物に移動し、ATP として蓄えられるエネルギーを生成します。
真核生物は細胞のミトコンドリア膜の内側に局在するタンパク質複合体を用いてこれらの反応を実行しますが、原核生物は外側の膜間腔で機能します。 ETC (電子伝達鎖) を構成するのは、この関連タンパク質の複合体です。 真核生物にはタンパク質複合体が 5 つしかありませんが、原核生物には多くのタンパク質複合体があり、それらはすべてさまざまな電子供与体およびその受容体と作用します。

ペアリングと切断
酸化プロセスでは電気化学電位が生成され、リン酸化プロセスではこの電位が使用されます。 これは、結合が確実に行われることを意味し、そうでない場合は、リン酸化と酸化のプロセスの結合が確実に行われることを意味します。 したがって、名前は酸化的リン酸化です。 カップリングに必要な電気化学ポテンシャルは、呼吸鎖の 3 つの複合体 (カップリング ポイントと呼ばれる 1 番目、3 番目、4 番目) によって生成されます。
ミトコンドリアの内膜が損傷したり、脱共役剤の活性によりその透過性が増加したりすると、電気化学ポテンシャルの消失または低下が確実に引き起こされ、続いてリン酸化と酸化のプロセスが脱共役します。 ATP合成の停止。 電気化学的ポテンシャルが消失する現象を、リン酸化と呼吸の脱共役と呼びます。
断路器
基質の酸化は続いているが、リン酸化が起こらない(つまり、PとADPからATPが生成されない)状態をリン酸化と酸化の脱共役といいます。 これは、プロセスにディスコネクターが介入した場合に発生します。 彼らは何であり、どのような結果を目指して努力しているのでしょうか? 呼吸鎖が機能している間、ATP 合成が大幅に減少した、つまり合成される量が少なくなったとします。 エネルギーはどうなるのでしょうか? 熱として放出されます。 病気のときに体温が上昇すると、誰もがこれを感じます。
熱がありますか? これは断路器が機能したことを意味します。 たとえば、抗生物質。 これらは脂肪に溶ける弱酸です。 細胞の膜間腔に浸透し、結合したプロトンを引き込みながらマトリックス内に拡散します。 たとえば、甲状腺から分泌されるヨウ素を含むホルモン (トリヨードチロニンとチロキシン) には脱共役作用があります。 甲状腺が機能亢進している場合、患者の状態はひどいものになります。ATPエネルギーが不足し、体は酸化のために多くの基質を必要とするため、大量の食物を消費しますが、受け取ったエネルギーの大部分がエネルギーであるため、体重が減少します。熱の形で失われます。
細胞内での酸素利用のためのオキシダーゼ経路
ミトコンドリア損傷の原因と影響
ミトコンドリアの代謝機能と恒常性維持機能
ミトコンドリア酵素の局在化
1). 外膜 以下が含まれます: エロンガーゼ、飽和脂肪酸分子を伸ばす酵素。 b)。 キヌレニンヒドロキシラーゼ; Ⅴ)。 モノアミンオキシダーゼ(マーカー)など
2). 膜間腔 以下が含まれます: アデニル酸シクラーゼ。 b)。 ヌクレオシド二リン酸キナーゼ。
3). 内膜 以下が含まれます: 酸化的リン酸化鎖の酵素。シトクロムオキシダーゼがそのマーカーです。 b)。 SDH c)。 β-ヒドロキシ酪酸DG; G)。 カルニチンアシルトランスフェラーゼ。
4). マトリックス 以下が含まれます: TCAサイクル酵素; b)。 脂肪酸のβ酸化酵素。 Ⅴ)。 アミノトランスフェラーゼAST、ALT。 G)。 グルタミン酸DG d)。 ホスホエノールピルビン酸カルボキシラーゼ e)。 ピルビン酸DG。
細胞には数百から数千のミトコンドリアが含まれており、そのサイズは長さ2〜3ミクロン、幅1ミクロンです。
ミトコンドリアでは、次のことが起こります: ATP 合成と酸化的リン酸化反応における熱生成。 脂肪酸のβ酸化。 TCA サイクルの反応、糖新生、アミノ基転移、脱アミノ化、脂質生成、ヘム合成の一部の反応は TCA サイクルを通じて起こり、タンパク質、脂質、炭水化物の代謝の統合が起こります。
化学的および物理的要因によるミトコンドリア内膜の損傷は、ATP 合成プロセスの混乱、同化反応、膜間輸送およびあらゆる種類の代謝の阻害につながります。
- 酸化的リン酸化
酸素利用のオキシダーゼ経路は、相互に関連している酸化とリン酸化のプロセスで構成されています。 これには約40種類の異なるタンパク質が含まれています。 オキシダーゼ経路は O 2 の 90% を消費し、好気性細胞における ATP の主な供給源です。
酸化的リン酸化 これは、CPEに沿った電子移動のエネルギーによるADPとH 3 PO 4 からのATPの合成と呼ばれます。 酸化により 220 kJ/mol の自由エネルギーが放出されます。 3 つの ATP の合成には、30.5 * 3 = 91.5 kJ/mol が必要です。 熱として放出: 220-91.5 = 128.5 kJ/mol。 効率 = 40% NADH 2 + 1/2O 2 → NAD + + H 2 O + 220 kJ/molADP + H 3 PO 4 + 30.5 kJ/mol = ATP + H 2 O 1)。 酸化連鎖 (呼吸鎖) は、ミトコンドリアの内膜に特定の方法で組み込まれた 4 つのタンパク質複合体と、タンパク質複合体間の膜の脂質層を循環するユビキノンとシトクロム C の小さな可動分子で構成されます。 複合体 I – NADH 2 デヒドロゲナーゼ複合体– 呼吸酵素複合体の中で最大のもので、分子量は800 KDaを超え、22以上のポリペプチド鎖から構成され、補酵素としてFMNと5つの鉄硫黄(Fe 2 S 2 およびFe 4 S 4)タンパク質を含んでいます。 コンプレックス II – SDH 。 補酵素としてFADと鉄硫黄タンパク質を配合。 複合体 III – 複合体 b-c 1 (酵素 QH 2 DG) 、分子量は 500 kDa、8 本のポリペプチド鎖から構成され、おそらく二量体として存在します。 各モノマーには、シトクロム b 562、b 566、c 1 および鉄硫黄タンパク質に関連する 3 つのヘムが含まれています。 複合体 IV – シトクロムオキシダーゼ複合体 分子量は300 KDaで、8本のポリペプチド鎖からなり、二量体の形で存在します。 各モノマーには 2 つのシトクロム (a および a 3) と 2 つの銅原子が含まれています。 コエンザイムQ(ユビキノン)。 哺乳類のラジカルが 10 個のイソプレノイド単位 (Q 10) によって形成される脂質。 ユビキノンは 2H + と 2e - を転送します。 ユビキノン ↔ セミキノン ↔ ハイドロキノン シトクロムc。 質量 12.5 KDa の末梢水溶性膜タンパク質には、100 AA からなる 1 つのポリペプチド鎖と 1 つのヘム分子が含まれており、呼吸鎖の構成要素間の分子関係は組織によって異なります。 例えば、心筋では、NADH 2 デヒドロゲナーゼ複合体 1 分子に対して、b-c 1 複合体 3 分子、シトクロムオキシダーゼ複合体 7 分子、シトクロム C 9 分子、およびユビキノン 50 分子が存在します。 2)。 リン酸化 この反応は、ミトコンドリアの内膜に組み込まれたタンパク質である ATP シンテターゼ (H + -ATPase) によって行われます。 ATP シンターゼは、F0 および F1 と呼ばれる 2 つのタンパク質複合体から構成されます。 疎水性複合体 F0 は膜に浸漬されています。酸素消費のオキシダーゼ経路はミトコンドリアで発生し、90% の O 2 を消費し、酸化的リン酸化のプロセスを提供します。
酸化的リン酸化 呼吸鎖に沿った電子の移動エネルギーによる、ADP と H 3 PO 4 からの ATP の合成と呼ばれます。
酸化的リン酸化は、好気性細胞における ATP の主な供給源です。
ミッチェルの化学浸透理論
1961 年に酸化的リン酸化のメカニズムを説明するために、ミッチェルはミトコンドリア機能に関する 4 つの独立した仮説を含む化学浸透理論を提案しました。
ミトコンドリアの内膜は、すべてのイオンを透過しません。
必須代謝産物や無機イオンを輸送する多数のキャリアタンパク質が含まれています。
電子が内膜の呼吸鎖を通過すると、H+ がマトリックスから膜間空間に移動します。
プロトン勾配が十分に大きい場合、プロトンは ATP 合成を伴う ATP シンテターゼを「流れ」始めます。
酸化的リン酸化のメカニズムに関する現代的な考え方
現在、酸化的リン酸化の主要成分はすべて発見され、その構造と特性が研究されています。 酸化的リン酸化の基本原理、制御、およびいくつかの段階のメカニズムが発見されています。
酸化的リン酸化のメカニズム
酸化的リン酸化は次のプロセスで構成されます 酸化 そして リン酸化 、相互接続されています。
酸化プロセス
酸化プロセスは、電子が組織呼吸の基質から酸素まで呼吸鎖に沿って移動するときに発生します。 酸化的リン酸化の呼吸鎖は、ミトコンドリアの内膜に埋め込まれた4つのタンパク質複合体と、タンパク質複合体間の膜の脂質層を循環するユビキノンとシトクロムCの小さな可動分子で構成されています。
複雑な 私 – NADH 2 デヒドロゲナーゼ複合体 – 呼吸酵素複合体の中で最大のもので、分子量は800 KDaを超え、22以上のポリペプチド鎖から構成され、補酵素としてFMNと5つの鉄硫黄(Fe 2 S 2 およびFe 4 S 4)タンパク質を含んでいます。
複雑な Ⅱ – SDH 。 補酵素としてFADと鉄硫黄タンパク質を配合。
複雑な Ⅲ - 複雑な b - c 1 (酵素 クイーンズランド州 2 総監) 、分子量は 500 kDa、8 本のポリペプチド鎖から構成され、おそらく二量体として存在します。 各モノマーには、シトクロム b 562、b 566、c 1 および鉄硫黄タンパク質に関連する 3 つのヘムが含まれています。
複雑な Ⅳ – シトクロムオキシダーゼ複合体 分子量は300 KDaで、8本のポリペプチド鎖からなり、二量体の形で存在します。 各モノマーには 2 つのシトクロム (a および a 3) と 2 つの銅原子が含まれています。
補酵素 Q (ユビキノン)。 哺乳類のラジカルが 10 個のイソプレノイド単位 (Q 10) によって形成される脂質。 ユビキノンは 2H + と 2e - を転送します。
ユビキノン ↔ セミキノン ↔ ハイドロキノン
シトクロムc。 質量12.5 kDaの末梢水溶性膜タンパク質には、100 AAのポリペプチド鎖1本とヘム分子が含まれています。
呼吸鎖の構成要素間の分子関係は、組織によって異なります。 例えば、心筋では、NADH 2 デヒドロゲナーゼ複合体 1 分子に対して、b-c 1 複合体 3 分子、シトクロムオキシダーゼ複合体 7 分子、シトクロム C 9 分子、およびユビキノン 50 分子が存在します。
電気化学ポテンシャル。 呼吸鎖の構成要素は、酸化還元電位が増加する順序で膜内に位置します。 e - が低い酸化還元電位を持つ錯体からより高い酸化還元電位を持つ錯体に変化するとき、自由エネルギーが放出されます。 1 NADH 2 の酸化により、220 kJ/mol の自由エネルギーが放出されます。
呼吸鎖の複合体 I、III、IV は、この自由エネルギーの 65 ~ 70% を使用して H + をミトコンドリア マトリックスから膜間腔に移動し、自由エネルギーの 30 ~ 35% が熱として放散されます。
 運動の段階 e
-
呼吸鎖に沿って
運動の段階 e
-
呼吸鎖に沿って
2e - NADH 2 から複合体 I (FMN→SFe タンパク質) を通過して CoQ に至ります。この場合に放出されるエネルギーにより、H + のポンピングが確実になります (H + 移動のメカニズムは不明です)。
2 を持つ CoQ - マトリックスから水から 2H+ を取り出し、CoQH 2 に変わります (CoQ の還元は複合体 II の参加によっても起こります)。
CoQH 2 は、2e - を複合体 III に移動し、2H + を膜間空間に移動します。
シトクロム C は複合体 III の e - c を複合体 IV に転移します。
錯体 IV は e - を O 2 上にダンプし、この場合に放出されるエネルギーは H + のポンピングを確実にします (H + 移動のメカニズムは不明です)。
H + がマトリックスから膜間腔に移動すると、 プロトン浸透圧勾配 ∆рН = 60 mV (∆рН = 1 の場合) (マトリックスの pH はサイトゾルよりも高い)。 各 H+ は正の電荷を帯びているため、内膜にも現れます。 電位差 ΔV=160mV、膜の内側はマイナスに帯電し、外側はプラスに帯電します。
合計すると、プロトンの浸透圧勾配と電位差が形成されます。 電気化学ポテンシャル これは、典型的なセルでは約 60+160=220 mV です。
膜を通過する H+ 移動のメカニズムは完全には理解されていません。 呼吸鎖の異なる構成要素は、e - の輸送と H + の移動を結び付けるための異なるメカニズムを持っている可能性があります。
ミトコンドリア内膜上に形成される電気化学ポテンシャルは、次の目的で使用されます。
- 異化反応で形成される NADH と FADH 2 は、水素原子 (つまり、水素陽子と電子) を呼吸鎖の酵素に渡します。
- 電子は呼吸鎖の酵素を通って移動し、エネルギーを失います。
- このエネルギーは、H+ プロトンをマトリックスから膜間空間にポンプで送り込むために使用されます。
- 呼吸鎖の最後で、電子が酸素と衝突し、酸素を水に還元します。
- H+ プロトンはマトリックスに急いで戻り、ATP シンターゼを通過します。
- 同時に、ATP合成に使用されるエネルギーも失います。
ADPからATPへのリン酸化。
ミトコンドリア膜を通過する物質の輸送。
エネルギーの形成に主導的な役割を果たします。 炭水化物、脂肪、タンパク質の酸化の結果、還元等価物(電子と水素原子)が形成され、呼吸鎖に沿って移動します。 この場合に放出されるエネルギーは、ミトコンドリア内膜上のプロトンの電気化学勾配のエネルギーに変換され、ATP の合成に使用されます。 このプロセスは酸化的リン酸化と呼ばれます。
解糖の結果として形成されるトリオース、主にピルビン酸は、ミトコンドリアで起こるさらなる酸化に関与します。
これはすべての化学結合の切断エネルギーを使用し、CO2 の放出、酸素の消費、および大量の ATP の合成につながります。 これらのプロセスは、トリカルボン酸の酸化サイクルと呼吸電子伝達鎖に関連しており、そこで ADP のリン酸化と細胞の「燃料」である ATP 分子の合成が起こります。 トリカルボン酸回路では、酸化中に放出された電子は補酵素 (NAD - ニコチンアミドアデニン ジヌクレオチド) のアクセプター分子に転送され、さらに電子伝達系 (ETC - 電子伝達系) に関与します。 ミトコンドリア内のこれらのイベントは、ミトコンドリアのマトリックスで発生します。 さらなる電子伝達およびATP合成に関連する残りの反応は、ミトコンドリア内膜、およびミトコンドリアクリステに関連しています。 トリカルボン酸回路の酸化プロセス中に放出された電子は、補酵素に受け入れられ、呼吸鎖 (電子伝達鎖) に転送され、そこで酸素分子と結合して水分子を形成します。 呼吸鎖はミトコンドリア内膜に埋め込まれた一連のタンパク質複合体であり、ミトコンドリアの主要なエネルギー変換システムです。 ここでは、呼吸鎖の要素の酸化と還元が連続して起こり、その結果、少量ずつエネルギーが放出されます。 このエネルギーにより、ATP は ADP とリン酸から鎖の 3 点で形成されます。 したがって、酸化(電子伝達)はリン酸化(ADP + Phn = ATP)と関連しており、酸化的リン酸化のプロセスが発生すると言われています。
ミトコンドリア膜内での電子の移動中、呼吸鎖の各複合体は酸化の自由エネルギーを、膜を通ってマトリックスから膜間空間へのプロトン(正電荷)の移動に向けます。これにより、ミトコンドリア膜が形成されます。膜を横切る電位差: 正電荷は膜間空間で優勢であり、負電荷はミトコンドリア マトリックスの膜間空間で優勢です。 特定の電位差 (220 mV) に達すると、ATP シンテターゼタンパク質複合体はプロトンをマトリックスに戻し始め、同時にエネルギーの 1 つの形態を別の形態に変換します。つまり、ADP と無機リン酸から ATP を形成します。 これは、酸化プロセスが合成プロセス、つまり ADP のリン酸化と結合する方法です。 基質の酸化が発生し、プロトンがミトコンドリア内膜を通って送り込まれる間に、関連する ATP 合成、つまり酸化的リン酸化が発生します (
炭水化物、脂肪酸、アルコール、アミノ酸の酸化反応で形成された NADH および FADH 2 分子は、ミトコンドリアに入り、そこで酵素が働きます。 呼吸鎖プロセスが実行されています 酸化的リン酸化.
酸化的リン酸化
酸化的リン酸化は、実行中に発生する複数のステップのプロセスです。 ミトコンドリアの内膜これは、呼吸鎖の酵素による還元型等価物(NADH および FADH 2)の酸化からなり、ATP の合成を伴います。
酸化的リン酸化のメカニズムは、Peter Mitchell によって最初に提案されました。 この仮説によれば 電子移動ミトコンドリア内膜で発生し、原因となります。 H+イオンを汲み出すミトコンドリアマトリックスから膜間腔へ。 これにより、 H+イオン濃度勾配サイトゾルとミトコンドリア内の閉鎖空間の間。 水素イオンは通常、ATPを形成する特殊な酵素を介するという一方向でのみミトコンドリアマトリックスに戻ることができます。 ATP合成酵素.
現代の概念によれば、ミトコンドリア内膜には、多くの酵素を含む多数の多酵素複合体が含まれています。 これらの酵素はと呼ばれます 呼吸酵素、膜内でのそれらの位置の順序は次のとおりです。 呼吸鎖または 電子伝達系(英語) 電子伝達系).
一般に、呼吸鎖の働きは次のとおりです。