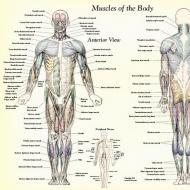
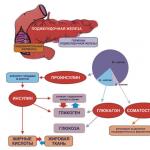
視床下部のホルモン。 下垂体の熱帯ホルモン
視床下部は脳の重要な部分です。 高次の栄養中枢は、多くの身体システムの複雑な制御と調節を実行します。 良好な感情状態、興奮と抑制のプロセス間のバランス、および神経インパルスのタイムリーな伝達は、重要な要素が正しく機能する結果です。
間脳の構造への損傷は、心臓血管系、呼吸器系、内分泌系の機能、および人の全身状態に悪影響を及ぼします。 視床下部とは何なのか、またその役割は何なのかを知ることは興味深く、役に立ちます。 この記事には、重要な構造の構造、機能、病気、病理学的変化の兆候、および現代の治療法に関する多くの情報が含まれています。
これは何の臓器ですか

間脳セクションは内部環境の安定性に影響を与え、個々のシステムと身体の全体的な機能との相互作用と最適な組み合わせを保証します。 重要な構造は、3 つのサブクラスのホルモンの複合体を生成します。
神経分泌細胞と神経伝導細胞は、間脳の重要な要素の基礎です。 器質的病状と機能への損傷が組み合わさると、体内の多くのプロセスの周期性が混乱します。
視床下部は他の脳構造と広範な接続を持っており、大脳皮質および皮質下と継続的に相互作用することで、最適な精神感情状態が保証されます。 皮質除去は「想像上の怒り」症候群の発症を引き起こします。
感染症、腫瘍の進行、先天異常、脳の重要な部分の損傷は、神経液性調節に悪影響を及ぼし、心臓、肺、消化器官、その他の体の要素からのインパルスの伝達を妨げます。 視床下部のさまざまな葉の破壊は、睡眠、代謝プロセスを混乱させ、てんかん、肥満、体温低下、感情障害の発症を引き起こします。
視床下部がどこにあるのか誰もが知っているわけではありません。 間脳要素は、視床の下、視床下部溝の下に位置します。 構造の細胞群は滑らかに透明な隔壁に変化します。 この小さな器官の構造は複雑で、神経細胞からなる 32 対の視床下部核から形成されています。
視床下部は 3 つの領域で構成されており、それらの間に明確な境界はありません。 動脈環の枝は、脳の重要な部分への血液の完全な供給を保証します。 この要素の血管の特有の特徴は、タンパク質分子が、たとえ大きな分子であっても壁を通過できることです。
彼の責任は何ですか?
体内の視床下部の機能:
- 呼吸器、消化器、心臓、血管、体温調節の機能を制御します。
- 内分泌系と排泄系の最適な状態を維持します。
- 生殖腺、卵巣、下垂体、副腎、膵臓などの機能に影響を与えます。
- 人間の感情的な行動に責任があります。
- 覚醒と睡眠を調節するプロセスに関与し、メラトニンというホルモンを生成します。メラトニンの欠乏により不眠症が発症し、睡眠の質が低下します。
- 最適な体温を提供します。 視床下部の後部の病理学的変化、このゾーンの破壊により、体温が低下し、衰弱が発症し、代謝プロセスの進行がより遅くなります。 多くの場合、不適温が突然上昇します。
- 神経インパルスの伝達に影響を与えます。
- ホルモンの複合体が生成されますが、十分な量がないと体の適切な機能が不可能になります。
視床下部ホルモン

脳の重要な要素は、いくつかの制御因子グループを生成します。
- スタチン:プロラクトスタチン、メラノタチン、ソマトスタチン。
- 下垂体後葉のホルモン:バソプレシン、オキシトシン。
- 放出ホルモン:フォリリベリン、コルチコリベリン、プロラクトリベリン、メラノリベリン、ソマトリベリン、ルリベリン、チロリベリン。
問題の原因
視床下部の構造要素への損傷は、いくつかの要因の影響の結果です。
- 外傷性脳損傷;
- 細菌、ウイルス感染症:リンパ肉芽腫症、梅毒、基底性髄膜炎、白血病、サルコイドーシス。
- 腫瘍のプロセス。
- 内分泌腺の機能の混乱。
- 体の中毒;
- さまざまな種類の炎症過程。
- 視床下部の細胞への栄養素と酸素の供給量と供給速度に影響を与える血管の病状。
- 生理学的プロセスの破壊。
- 感染性物質の浸透による血管壁の透過性の侵害。
病気
負のプロセスは、重要な構造の直接的な機能不全を背景に発生します。 ほとんどの場合、腫瘍のプロセスは良性ですが、負の要因の影響下で細胞の悪性腫瘍が発生することがよくあります。
注記!視床下部病変の治療には統合的なアプローチが必要であり、治療には多くのリスクと困難が伴います。 腫瘍学的病理が検出された場合、神経外科医は腫瘍を切除し、その後患者は化学療法と放射線療法を受けます。 問題のある部門の機能を安定させるために、複合薬が処方されます。
視床下部腫瘍の主な種類は次のとおりです。
- 奇形腫;
- 髄膜腫;
- 頭蓋咽頭腫;
- 神経膠腫;
- 腺腫(下垂体から成長する)。
- 松果腫。
症状

視床下部の機能障害は、次のような陰性症状の複合体を引き起こします。
- 摂食障害、制御不能な食欲、突然の体重減少または重度の肥満。
- 頻脈、血圧の変動、胸骨の痛み、不整脈。
- 性欲の低下、月経の欠如。
- 危険な腫瘍 - 過誤腫を背景とした思春期初期。
- 頭痛、激しい攻撃性、制御不能な泣き声や発作的な笑い、発作。
- 顕著な理由のない攻撃性、激怒の発作。
- 1日を通して高頻度の発作を伴う視床下部てんかん。
- げっぷ、下痢、上腹部および腹部の痛み。
- 筋力低下により、患者は立ったり歩いたりすることが困難になります。
- 神経精神障害:幻覚、精神病、不安、うつ病、心気症、気分変動。
- 頭蓋内圧の上昇による激しい頭痛。
- 睡眠障害、夜中に何度も目が覚める、疲労感、脱力感、朝の頭痛。 その理由は、重要なホルモンであるメラトニンの欠乏です。 この障害を解消するには、起床と夜間の睡眠パターンを調整し、重要な調節機能の量を回復するために一連の薬を服用する必要があります。 優れた治療効果をもたらし、副作用が最小限に抑えられ、中毒症候群のない新世代の薬です。
- かすみ目、新しい情報の記憶力の低下。
- 温度の急激な上昇または指標の低下。 気温が上昇すると、何がマイナスの変化を引き起こしているのかを理解するのが難しいことがよくあります。 視床下部への損傷は、制御されていない空腹、喉の渇き、肥満、尿量の増加など、内分泌系への損傷を示す一連の兆候によって疑われることがあります。
このアドレスにアクセスして、食事のルールと 2 型糖尿病の治療に関する情報を読んでください。
診断
視床下部の損傷の症状は非常に多様であるため、いくつかの診断手順を実行する必要があります。 非常に有益な方法: 超音波、ECG、MRI。 副腎、甲状腺、腹部臓器、卵巣、脳、血管系を必ず検査してください。
血液検査と尿検査を受け、グルコース、ESR、尿素、白血球、ホルモンのレベルをチェックすることが重要です。 患者は内分泌科医、泌尿器科医、婦人科医、眼科医、内分泌科医、神経科医を受診します。 腫瘍が検出された場合は、脳神経外科の専門医に相談する必要があります。
処理
視床下部病変の治療計画には、いくつかの領域が含まれます。

- メラトニンの生成を安定させるために日常生活を修正し、過度の興奮、神経質な緊張、または無関心の原因を排除します。
- 神経系と血管の状態を正常化する最適量のビタミンとミネラルを供給するために食事を変える。
- 脳の一部への損傷を伴う感染を伴う炎症過程が検出された場合に薬物治療を実施する(抗生物質、グルココルチコステロイド、抗ウイルス薬、修復化合物、ビタミン、NSAID)。
- 鎮静剤、精神安定剤の投与。
- 悪性腫瘍と良性腫瘍を除去する外科的治療。 脳の腫瘍学的病状の場合は、放射線照射が行われ、化学療法と免疫調節剤が処方されます。
- 摂食障害の治療には、食事療法、神経活動を調節するビタミン(ビタミンB1とビタミンB12)の注射、制御不能な食欲を抑える薬によって効果が得られます。
視床下部の損傷が体内の生理学的プロセスの急速な不均衡につながる理由を知ることが重要です。 脳のこの部分の病状が特定された場合は、総合的な検査を受け、複数の医師に相談する必要があります。 適時に治療を開始すれば、予後は良好です。 腫瘍プロセスの進行を確認するときは特別な責任が必要です。特定の種類の新生物は異型細胞で構成されています。
視床下部とは何なのか、またこの重要な器官がどのような役割を担っているのかについては、次のビデオをご覧ください。
視床下部は、中枢神経系の高次部分と内分泌系の間の直接相互作用の場所として機能します。 中枢神経系と内分泌系の間に存在するつながりの性質は、最初の体液性因子が視床下部から単離されたここ数十年で明らかになり始めましたが、これは非常に高い生物活性を持つホルモン物質であることが判明しました。 これらの物質が視床下部の神経細胞で形成され、そこから門脈毛細血管系を通って下垂体に到達し、下垂体ホルモンの分泌、あるいはむしろその放出を調節していることを証明するには、多大な労力と実験技術が必要でした。生合成)。 これらの物質は最初は神経ホルモンと呼ばれ、次に放出因子(英語の release - 解放することから)またはリベリンと呼ばれました。 逆の効果を持つ物質、つまり 下垂体ホルモンの放出(そしておそらくは生合成)を阻害することは、阻害因子またはスタチンと呼ばれるようになりました。 したがって、視床下部のホルモンは、個々の器官、組織、および生物全体の多面的な生物学的機能のホルモン調節の生理学的システムにおいて重要な役割を果たしています。
現在までに、下垂体ホルモン分泌の 7 種類の刺激剤 (リベリン) と 3 種類の阻害剤 (スタチン) が視床下部で発見されています。すなわち、コルチコリベリン、チロリベリン、ルリベリン、フォリリベリン、ソマトリベリン、プロラクトリベリン、メラノリベリン、ソマトスタチン、プロラクトスタチンおよびメラノスタチンです (表) 8.1) 。 5 つのホルモンが純粋な形で単離されており、その一次構造が確立されており、化学合成によって確認されています。
視床下部ホルモンを純粋な形で入手するのが非常に難しいのは、元の組織に含まれるホルモンの含有量が極めて低いことによって説明されます。 したがって、たった 1 mg のチロリベリンを単離するには、500 万頭の羊から得た 7 トンの視床下部を処理する必要がありました。
すべての視床下部ホルモンが 1 つの下垂体ホルモンに厳密に特異的であるわけではないことに注意してください。 特に、甲状腺刺激ホルモン放出ホルモンは、甲状腺刺激ホルモンに加えてプロラクチンも放出することが示されており、ルリベリンの場合、黄体形成ホルモンに加えて卵胞刺激ホルモンも放出します。

1 視床下部ホルモンには、しっかりと確立された名前がありません。 下垂体ホルモン名の最初の部分に語尾「リベリン」を追加することをお勧めします。 例えば、「甲状腺刺激ホルモン放出ホルモン」は、下垂体の対応するホルモンである甲状腺刺激ピンの放出(および場合によっては合成)を刺激する視床下部ホルモンを意味する。 下垂体向性ホルモンの放出(そしておそらくは合成)を阻害する視床下部因子の名前も同様の方法で形成され、末尾に「スタチン」が追加されます。 例えば、「ソマトスタチン」は、下垂体成長ホルモンであるソマトトロピンの放出(または合成)を阻害する視床下部ペプチドを意味する。
化学構造によれば、視床下部ホルモンはすべて低分子ペプチド、いわゆる異常な構造のオリゴペプチドであることが確認されていますが、すべての正確なアミノ酸組成と一次構造は明らかにされていません。 我々は、視床下部の既知の 10 種類のホルモンのうち 6 種類の化学的性質に関してこれまでに得られたデータを提示します。
1. チロリベリン(Pyro-Glu-Gis-Pro-NH 2):

チロリベリンは、ペプチド結合によって結合されたピログルタミン酸 (環状) 酸、ヒスチジン、プロリンアミドからなるトリペプチドで表されます。 古典的なペプチドとは異なり、N および C 末端アミノ酸に遊離の NH 2 - および COOH 基が含まれていません。
2. GnRHは、次の配列の 10 個のアミノ酸からなるデカペプチドです。
ピロ-Glu-Gis-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH 2
末端 C アミノ酸はグリシンアミドです。
3. ソマトスタチン環状テトラデカペプチド (14 アミノ酸残基からなる):
このホルモンは、環状構造に加えて、N 末端にピログルタミン酸を含まないという点で、前の 2 つのホルモンとは異なります。3 位と 14 位の 2 つのシステイン残基の間にジスルフィド結合が形成されます。 ソマトスタチンの合成線状類似体にも同様の生物学的活性が備わっていることに留意すべきであり、これは天然ホルモンのジスルフィド架橋が重要ではないことを示している。 ソマトスタチンは、視床下部に加えて、中枢神経系および末梢神経系のニューロンによって産生され、膵臓および腸細胞の膵島(ランゲルハンス島)のS細胞でも合成されます。 広範囲にわたる生物学的影響があります。 特に、下垂体腺における成長ホルモンの合成に対する阻害効果、ならびにランゲルハンス島のβ細胞およびα細胞におけるインスリンおよびグルカゴンの生合成に対する直接的な阻害効果が示されている。
4. ソマトリベリン最近天然源から分離されました。 それは、完全に明らかにされた配列を持つ 44 アミノ酸残基で表されます。 さらに、化学合成されたデカペプチドには、ソマトリベリンの生物学的活性が付与されています。
N-Val-Gis-Lei-Ser-Ala-Glu-Gln-Liz-Glu-Ala-ON。
このデカペプチドは、下垂体成長ホルモンのソマトトロピンの合成と分泌を刺激します。
5. メラノリベリン、その化学構造は開環ホルモンのオキシトシン(トリペプチド側鎖なし)の化学構造に似ており、次の構造を持っています。
N-Cis-Tyr-Ile-Gln-Asn-Cis-OH。
6. メラノスタチン(メラノトロピン阻害因子) は、トリペプチド: Pyro-Glu-Leu-Gly-NH 2、または次の配列のペンタペプチドのいずれかで表されます。
ピロ-グル-ギス-フェン-アルグ-グリ-NNH 2 。
メラノリベリンには刺激作用があり、逆にメラノスタチンには下垂体前葉におけるメラノトロピンの合成および分泌に対する阻害作用があることに留意すべきである。
列挙された視床下部ホルモンに加えて、別のホルモンの化学的性質が集中的に研究されました。 コルチコリベリン。 その活性製剤は、視床下部の組織と下垂体後葉の両方から単離されました。 後者はバソプレシンとオキシトシンのホルモン貯蔵庫として機能する可能性があるという意見があります。 最近、配列が解明された41個のアミノ酸からなるコルチコリベリンがヒツジの視床下部から単離された。
視床下部ホルモンの合成場所は、視床下部の神経終末である可能性が最も高く、ホルモンと生体アミンの濃度が最も高くなるのはそこであるためです。 後者は、末梢内分泌腺のホルモンとともに、フィードバック原理に基づいて作用し、視床下部ホルモンの分泌と合成の主な調節因子であると考えられています。 チロリベリンの生合成機構は、非リボソーム経路によって行われる可能性が最も高く、グルタミン酸からピログルタミン酸への環化、ペプチド結合の形成、およびグルタミンの存在下でのプロリンのアミド化。 ゴナドリベリンおよびソマトリベリンに関しても、対応する合成酵素の関与による同様の生合成機構の存在が想定されている。
視床下部ホルモンの不活化経路は十分に研究されていません。 ラットの血液中の甲状腺刺激ホルモン放出ホルモンの半減期は 4 分です。 不活化は、ペプチド結合が切断されるとき(ラットおよびヒトの血清からのエキソペプチダーゼおよびエンドペプチダーゼの影響下)、およびプロリンアミド分子のアミド基が除去されるときの両方で発生します。 人間および多くの動物の視床下部で、チロリベリンまたはゴナドリベリンからのピログルタミン酸分子の切断を触媒する特定の酵素、ピログルタミルペプチダーゼが発見されました。
視床下部ホルモンは、「準備完了」ホルモンの分泌 (より正確には、放出) とこれらのホルモンの新規生合成に直接影響します。 cAMP がホルモンシグナル伝達に関与していることが証明されています。 下垂体細胞の原形質膜には特定の下垂体腺下垂体受容体の存在が示されており、これに視床下部ホルモンが結合し、その後アデニル酸シクラーゼの系と膜複合体Ca 2+ -ATPおよびMg 2 を介してCa 2+ およびcAMPイオンが放出されます。 + -ATP; 後者は、プロテインキナーゼを活性化することにより、対応する下垂体ホルモンの放出と合成の両方に作用します(以下を参照)。
対応する受容体との相互作用を含む放出因子の作用機序を解明するには、チロリベリンとゴナドリベリンの構造類似体が重要な役割を果たしました。 これらの類似体の中には、視床下部の天然ホルモンよりもさらに高いホルモン活性と持続的な作用を有するものもあります。 しかし、すでに発見されている放出因子の化学構造を解明し、それらの作用の分子機構を解読するには、多くの研究が残されています。
放出ホルモンは、視床下部の核によって合成されるヒト神経ホルモンです。 それらは、下垂体向性ホルモンの産生を阻害(スタチン)または刺激(リベリン)します。 内分泌腺の働きが活性化され、内分泌腺によるホルモンの放出が調節されます。 中枢神経系の高次の部分は、ホルモンの放出により密接に連携しています。
視床下部の機能
ホルモンの生成を担う内分泌系の重要な構成要素の 1 つが視床下部です。 視床下部によって生成される物質は、体の代謝プロセスに関与するホルモンです。
視床下部には、身体が正常に機能するために必要な必須物質を生成する神経細胞が含まれています。 これらの細胞は神経分泌細胞と呼ばれます。 彼らの仕事は、神経系のさまざまな部分から伝達されるインパルスを受信することです。 要素の放出は軸索洞シナプスを通じて起こります。
視床下部によって生成されるホルモン、または別名スタチンおよびリベリンの放出は、下垂体の正常な機能に不可欠です。 化学的性質により、それらはペプチドです。 化学的および神経インパルスのおかげで、それらの合成が起こり、血液によって視床下部-下垂体系を通って下垂体に輸送されます。
ホルモンの分類
最も有名な放出ホルモンを見てみましょう。
- 分泌の阻害 - 私たちはソマトスタチン、メラノスタチン、プロラクトスタチンについて話しています。
- 刺激性 - 私たちはメラノリベリン、プロラクトリベリン、フォリベリン、ルリベリン、ソマトリベリン、チロリベリン、ゴナドリベリン、コルチコリベリンについて話しています。
列挙された物質、またはその一部は、視床下部 (膵臓など) だけでなく、他の臓器でも生成されます。
スタチンとリベリン
下垂体の機能はそれらに直接依存します。 それらは末梢内分泌腺の機能にも影響を与えます。
- 甲状腺;
- 女の子の卵巣。
- 男性の睾丸。

最もよく知られているスタチンとリベリン:
- ドーパミン;
- ゴナドリベリン(リュリベリン、フォリベリン);
- メロノスタチン;
- ソマトスタチン;
- 甲状腺ホルモン。
下垂体による黄体形成ホルモンおよび卵胞刺激ホルモンの分泌は、ゴナドリベリンによって確保されます。
男性のアンドロゲンの活性は、精子の活性と性欲レベルの増加に寄与するゴナドリベリンの影響も受けます。
また、女性では神経ホルモンが月経周期に関与しており、ホルモンの量は周期の段階に応じて変化します。
放出ホルモンの生成が不十分であると、不妊症やインポテンスが引き起こされることがよくあります。
ホルモンの特徴
不安の原因となるコルチコリベリンというホルモンは、視床下部によって生成されます。 これは、下垂体ホルモンと連携して作用し、副腎の機能に影響を与えるもう 1 つの重要な放出因子です。 このホルモンが欠乏している人は、高血圧や副腎不全に悩まされることがよくあります。
ゴナドトロピン放出ホルモンは、ゴナドトロピンの産生を促進するホルモンであり、視床下部の産物です。 ゴナドトロピン放出ホルモンとも呼ばれます。
生殖器官の正常な機能は、GnRH なしでは存在できません。 女性の月経周期の自然な経過に関与しているのはこのホルモンです。 その参加により、卵の成熟と放出のプロセスが行われます。 このホルモンはリビドー(性欲)の原因となります。 視床下部によるこのホルモンの産生が不十分なため、女性は不妊症を発症することがよくあります。 他にどのような放出ホルモンがありますか?

ソマトリベリン
それは小児期と青年期に最も顕著です。 その主な特性は、臓器や身体システムの成長プロセスの正常化です。 子どもの完全な発達と形成は、その生産にかかっています。 視床下部によるこのホルモンの産生が不十分だと、次のような症状が起こる可能性があります。
プロラクトリベリン
その生成は、妊娠期間中および母親が子供に栄養を与える全期間を通じて最も活発に起こります。 この放出因子は、乳腺の管を形成するプロラクチンの生成を正常化します。
プロラクトスタチン
プロラクトスタチンは、視床下部によって産生されるスタチンのサブクラスに属し、プロラクチンの阻害に関与します。
プロラクトスタチンには次のものが含まれます。
・ドーパミン。
ソマトスタチン;
・メラノスタチン。
それらの主な作用は、下垂体および視床下部の向性ホルモンを抑制することを目的としています。
メラノトロピン放出ホルモン
メラニンの生成と色素細胞の分裂のプロセスはメラノリベリンの影響を受けます。 また、下垂体の PRD の要素にも影響を与えます。
それは人間の神経生理学的行動に影響を与えます。 うつ病の緩和やパーキンソニズムの治療に使用されます。
甲状腺刺激ホルモン放出ホルモン (TRH)
視床下部の甲状腺刺激ホルモン放出ホルモンには、甲状腺刺激ホルモン放出ホルモンも含まれます。 下垂体腺の甲状腺刺激ホルモンの産生を促進します。
プロラクチン生成のプロセスにわずかな影響を与えます。 チロリベリンは、血液中のチロキシン濃度を確実に増加させます。
中枢神経系はホルモン生成のプロセスに大きな影響を与えます。 調節システムの神経分泌細胞は、神経ホルモンの産生を担っています。
リベリンの主な機能

これらは視床下部のホルモンを放出しています。 ゴナドトロピン放出ホルモンは、女性と男性の生殖器系の機能を正常化します。
これらは卵胞刺激ホルモンの再生に関与し、睾丸と卵巣の機能に影響を与えます。
ルリベリンなどの成分は排卵を分離する作用があり、胎児を妊娠する可能性を生み出します。
親密な生活に無関心な女性では、ルリベリンとフォリベリンの生成量が不十分です。
視床下部の中葉に関連する放出因子もありますが、下垂体および下垂体腺の要素との関連は研究されていません。
ホルモン放出アゴニスト: 薬物
すでに述べたように、これらのホルモンは視床下部によって生成されます。 たとえば体外受精の前など、卵巣を刺激する必要がある場合には、放出ホルモンのアゴニストまたは類似体が使用されます。 つまり、それらは体自身のホルモンと同じ影響を及ぼします。
しかし、女性の身体に副作用が発生する可能性が高くなります。 これはエストロゲンレベルの低下によって起こります。 最も一般的な現象は次のとおりです。
- 頭痛;
- 過度の発汗;
- 潮汐。
- 膣の乾燥;
- 気分のむら;
- 抑うつ状態。
以下の薬剤が使用されます。


ホルモン放出ホルモンアゴニストをレビューしました。
アンタゴニスト
ホルモン放出ホルモン作動薬を服用するとエストラジオールが極端に上昇するため、黄体形成ホルモンの急増が起こる可能性があります。 これは早期排卵と卵子の死を引き起こします。 これを防ぐために、ホルモン放出ホルモン拮抗薬が使用されます。 それらの作用の結果として、下垂体が再び刺激される可能性があります。 症状自体は現れませんが、これは GnRH アゴニストの長期使用が原因で起こることがよくあります。 卵胞刺激ホルモンの使用開始から5日後に投与。
治療を成功させるためには、すべての薬の処方は専門家のみが行う必要があります。
リベリア人:
- チロリベリン;
- コルチコリベリン;
- ソマトリベリン;
- プロラクトリベリン;
- メラノリベリン;
- ゴナドリベリン(リュリベリンおよびフォリリベリン)
- ソマトスタチン;
- プロラクトスタチン(ドーパミン);
- メラノスタチン;
- コルチコスタチン
神経ペプチド:
- エンケファリン(ロイシン-エンケファリン(leu-エンケファリン)、メチオニン-エンケファピン(met-エンケファリン));
- エンドルフィン (α-エンドルフィン、(β-エンドルフィン、γ-エンドルフィン);
- ダイノルフィンAおよびB。
- プロオピオメラノコルチン;
- ニューロテンシン;
- 物質P。
- キョートルフィン。
- 血管腸ペプチド (VIP);
- コレシストキニン;
- 神経ペプチド-Y;
- アゴ子宮タンパク質。
- オレキシン A および B (ヒポクレチン 1 および 2)。
- グレリン;
- デルタ睡眠誘導ペプチド(DSIP)など
視床下部-下垂体後葉ホルモン:
- バソプレシンまたは抗利尿ホルモン (ADH);
- オキシトシン
モノアミン:
- セロトニン;
- ノルアドレナリン;
- アドレナリン;
- ドーパミン
視床下部および下垂体神経のエフェクターホルモン
視床下部および下垂体神経のエフェクターホルモンバソプレシンとオキシトシンです。 それらは視床下部のSONおよびPVNの大細胞ニューロンで合成され、軸索輸送によって下垂体神経に送達され、下垂体動脈の毛細血管の血液中に放出されます(図1)。
バソプレシン
抗利尿ホルモン(ADG、または バソプレシン) - 9アミノ酸残基からなるペプチドで、その含有量は0.5~5ng/mlです。
ホルモンの基礎分泌には一日のリズムがあり、早朝に最大分泌されます。 ホルモンは遊離の形で血液中に輸送されます。 半減期は5~10分です。 ADH は、膜 7-TMS 受容体とセカンド メッセンジャーの刺激を通じて標的細胞に作用します。
体内におけるADHの機能ADH の標的細胞は、腎集合管の上皮細胞および血管壁の平滑筋細胞です。 ADH は、腎臓の集合管の上皮細胞内の V2 受容体の刺激とその中の cAMP レベルの増加を通じて、水の再吸収を増加させ (10 ~ 15%、または 15 ~ 22 l/日)、集中力を促進します。そして最終的な尿の量が減少します。 このプロセスは抗利尿と呼ばれ、それを引き起こすバソプレシンはADHと呼ばれます。
高濃度では、このホルモンは血管平滑筋細胞の V 1 受容体に結合し、その中の IPG および Ca 2+ イオンのレベルの増加を通じて、筋細胞の収縮、動脈の狭窄、および血圧の上昇を引き起こします。 血管に対するホルモンのこの効果は昇圧と呼ばれ、そのためホルモンの名前はバソプレシンです。 ADH はまた、ストレス下での ACTH 分泌の刺激 (V 3 受容体、細胞内 IPG および Ca 2+ イオンを介して)、喉の渇きの動機と飲酒行動の形成、および記憶メカニズムにも関与しています。
米。 1. 視床下部および下垂体ホルモン (RG - 放出ホルモン (リベリン)、ST - スタチン)。 本文中の説明
生理学的条件下での ADH の合成と放出は、血液の浸透圧 (高浸透圧) の上昇を刺激します。 高浸透圧は視床下部の浸透圧感受性ニューロンの活性化を伴い、これによりSOYおよびPVNの神経分泌細胞によるADHの分泌が刺激されます。 これらの細胞は、心房および洞頸動脈帯の機械受容器および圧受容器から血流に関する情報を受け取る血管運動中枢のニューロンとも関連しています。 これらのつながりを通じて、循環血液量 (CBV) が減少し、血圧が低下すると、ADH の分泌が反射的に刺激されます。
バソプレシンの主な作用
- 活性化する
- 血管平滑筋の収縮を刺激します
- 喉の渇き中枢を活性化します
- 学習メカニズムに参加し、
- 体温調節プロセスを調節します
- 自律神経系のメディエーターとして神経内分泌機能を実行します。
- 組織に参加しています
- 感情的な行動に影響を与える
ADH 分泌の増加は、血中アンジオテンシン II レベルの増加、ストレス、身体活動によっても観察されます。
ADH の放出は、血液浸透圧の低下、血液量および (または) 血圧の増加、およびエチルアルコールの影響により減少します。
ADHの分泌と作用の不全は、視床下部および下垂体神経の内分泌機能の不全、ならびにADH受容体の機能不全(腎臓の集合管の上皮におけるV 2 受容体の欠如、感受性の低下)の結果である可能性があります。 )、1日あたり最大10〜15リットルの低濃度尿の過剰な排泄と体組織の水分不足を伴います。 この病名は 尿崩症。血液中のグルコースレベルの上昇によって過剰な尿が生成される糖尿病とは異なり、 尿崩症血糖値は正常なままです。
ADH の過剰分泌は、利尿作用の低下と体内の水分保持によって現れ、細胞浮腫や水中毒が発生します。
オキシトシン
体内でのオキシトシンの働きオキシトシン- 遊離型で血液によって輸送される9個のアミノ酸残基からなるペプチド、半減期 - 5〜10分、膜の刺激を通じて標的細胞(子宮の平滑筋細胞および乳腺管の筋上皮細胞)に作用します。 7-TMS 受容体とその受容体における IPE および Ca 2+ イオンのレベルの増加。
妊娠の終わりに向かって自然に観察されるホルモンレベルの上昇は、出産中および産後の期間における子宮の収縮の増加を引き起こします。 このホルモンは乳腺管の筋上皮細胞の収縮を刺激し、新生児に授乳する際の乳汁の分泌を促進します。
オキシトシンの主な効果:
- 子宮の収縮を刺激する
- 乳汁の分泌を活性化します
- 利尿作用とナトリウム利尿作用があり、水と塩の作用に関与します。
- 飲酒行動を規制する
- 下垂体腺腺ホルモンの分泌を増加させます
- 学習と記憶のメカニズムに参加します
- 降圧効果があります
オキシトシンの合成はエストロゲンレベルの上昇の影響下で増加し、出産時の子宮頸部の機械受容体が伸展中に刺激されたときや、乳腺の乳首の機械受容体が刺激されたとき、反射経路によってオキシトシンの放出が促進されます。子供の授乳中に刺激されます。
ホルモンの機能不全は、子宮の陣痛の弱さや乳汁の分泌障害として現れます。
視床下部放出ホルモンは、末梢内分泌腺の機能を説明するときに議論されます。
下垂体のエフェクターホルモン
これらには以下が含まれます 成長ホルモン(GR)、 プロラクチン下垂体腺腺の(乳腺刺激ホルモン - LTG)と メラノサイト刺激ホルモン下垂体中葉の (MSG) (図 1 を参照)。

米。 1. 視床下部および下垂体ホルモン (RG - 放出ホルモン (リベリン)、ST - スタチン)。 本文中の説明
成長ホルモン
成長ホルモン(成長ホルモン、成長ホルモンGH)- 191個のアミノ酸からなるポリペプチドで、下垂体腺の下垂体 - 成長ホルモンの赤色好酸性細胞によって形成されます。 半減期は20~25分です。 遊離形態で血液によって輸送される。
GH の標的は、骨、軟骨、筋肉、脂肪組織、肝臓の細胞です。 触媒チロシンキナーゼ活性による 1-TMS 受容体の刺激を介して標的細胞に直接的な影響を与えるだけでなく、肝臓や肝臓で形成されるインスリン様成長因子 (IGF-I、IGF-II) であるソマトメジンを介した間接的な影響もあります。 GR アクションに反応する他の組織。
ソマトメジンの特徴
GH の含有量は年齢によって異なり、毎日の周期性が顕著です。 ホルモンの最高含有量は幼児期に観察され、徐々に減少します:5〜20歳 - 6 ng/ml(思春期にピーク)、20〜40歳 - 約3 ng/ml、40年後 - 1ng/ml ml。 日中、GHは周期的に血液に入ります。分泌の欠如と「分泌の爆発」が交互に起こり、睡眠中に最大になります。
体内でのGHの主な働き成長ホルモンは、標的細胞の代謝と臓器や組織の成長に直接的な影響を及ぼします。これは、標的細胞に対する直接的な効果と、細胞から放出されるソマトメジン C および A (インスリン様成長因子) の間接的な効果の両方によって達成されます。肝細胞および軟骨細胞を GR に曝露した場合。
成長ホルモンは、インスリンと同様、細胞によるグルコースの吸収とその利用を促進し、グリコーゲン合成を刺激し、正常な血糖値の維持に関与します。 同時に、GH は肝臓での糖新生とグリコーゲン分解を刺激します。 インスリン様効果は、対インシュリン効果に置き換えられます。 この結果、高血糖が発症します。 GH はグルカゴンの放出を刺激しますが、これも高血糖の発症に寄与します。 同時に、インスリンの生成は増加しますが、それに対する細胞の感受性は低下します。
成長ホルモンは脂肪組織細胞の脂肪分解を活性化し、遊離脂肪酸の血中への動員と細胞によるエネルギーとしての利用を促進します。
成長ホルモンはタンパク質の同化作用を刺激し、肝臓、筋肉、軟骨、骨組織の細胞へのアミノ酸の侵入を促進し、タンパク質と核酸の合成を活性化します。 これは、基礎代謝の強度を高め、筋肉組織の量を増やし、管状骨の成長を促進するのに役立ちます。
GH の同化効果には、脂肪の蓄積を伴わない体重の増加が伴います。 同時に、GH は体内の窒素、リン、カルシウム、ナトリウム、水の保持を促進します。 前述したように、GH には同化作用があり、肝臓と軟骨における軟骨細胞の分化と骨の伸長を刺激する成長因子の合成と分泌の増加を通じて成長を刺激します。 成長因子の影響下で、筋細胞へのアミノ酸の供給と筋タンパク質の合成が増加し、それに伴い筋組織の質量が増加します。
GHの合成と分泌は、GHの分泌を促進する視床下部ホルモンのソマトリベリン(SGHR - 成長ホルモン放出ホルモン)と、GHの合成と分泌を阻害するソマトスタチン(SS)によって調節されています。 GH のレベルは睡眠中に徐々に増加します(血液中のホルモンの最大含有量は睡眠の最初の 2 時間と午前 4 ~ 6 時に発生します)。 血中の低血糖と遊離脂肪酸の欠乏(絶食中)、過剰なアミノ酸(食後)は、ソマトリベリンとGHの分泌を増加させます。 ホルモンのコルチゾールは、痛み、ストレス、怪我、寒さへの曝露、感情的興奮、T 4 および T 3 によってレベルが上昇し、成長ホルモンに対するソマトリベリンの効果を高め、GH の分泌を増加させます。 ソマトメジン、血液中の高レベルのグルコースおよび遊離脂肪酸、および外因性 GH は、下垂体 GH の分泌を阻害します。

米。 ソマトトロピン分泌の調節

米。 ソマトトロピンの作用におけるソマトメジンの役割
GH の過剰または不十分な分泌の生理学的影響は、視床下部および (または) 下垂体の内分泌機能の破壊を伴う病理学的過程を伴う神経内分泌疾患の患者を対象に研究されています。 ホルモン受容体相互作用の欠陥に関連して、GH の作用に対する標的細胞の反応が障害された場合の GH の効果の低下も研究されています。

米。 成長ホルモン分泌の一日のリズム
小児期のGHの過剰分泌は、成長の急激な加速(年間12cm以上)と成人の巨人症の発症(男性の身長は2mを超え、女性は1.9mを超えます)として現れます。 体のプロポーションは保たれます。 成人におけるホルモンの過剰産生(下垂体腫瘍など)は先端巨大症を伴います。これは、成長能力をまだ保持している体の各部分が不均衡に増加することです。 これは、顎の不均衡な発達や手足の過度の伸長による外見の変化につながり、また、インスリンの数の減少によるインスリン抵抗性の発症による糖尿病の発症を伴うこともあります。細胞内の受容体と、インスリンを破壊する肝臓内の酵素インシュリナーゼの合成の活性化。
ソマトトロピンの主な効果代謝:
- タンパク質代謝:タンパク質合成を刺激し、アミノ酸の細胞への侵入を促進します。
- 脂肪代謝:脂肪分解を刺激し、血中の脂肪酸レベルが増加し、脂肪酸が主なエネルギー源になります。
- 炭水化物代謝: インスリンとグルカゴンの生成を刺激し、肝臓インシュリナーゼを活性化します。 高濃度ではグリコーゲン分解を刺激し、血糖値が上昇し、その利用が阻害されます。
機能:
- 窒素、リン、カリウム、ナトリウム、水の体内での遅れを引き起こします。
- カテコールアミンとグルココルチコイドの脂肪分解効果を強化します。
- 組織由来の成長因子を活性化します。
- 乳の生産を刺激します。
- 種特有のものです。
テーブル。 成長ホルモン産生の変化の現れ
小児期のGHの分泌不足、またはホルモンと受容体の間の接続の破壊は、体のプロポーションと精神発達を維持しながらの成長速度の阻害(年間4cm未満)として現れます。 この場合、成人は小人症を発症します(女性の身長は120cmを超えず、男性の身長は130cmを超えません)。 小人症は性的発達不全を伴うことがよくあります。 この病気の2番目の名前は、下垂体性小人症です。 成人では、GH分泌の欠如は、基礎代謝、骨格筋量の減少、脂肪量の増加として現れます。
プロラクチン
プロラクチン(乳酸刺激ホルモン)-LTG) は 198 個のアミノ酸からなるポリペプチドで、ソマトトロニンと同じファミリーに属し、同様の化学構造を持っています。
下垂体腺腺の黄色乳腺栄養細胞(その細胞の10~25%、妊娠中は最大70%)によって血液中に分泌され、遊離形態で血液によって輸送され、半減期は10~25分です。 プロラクチンは、1-TMS 受容体の刺激を通じて乳腺の標的細胞に影響を与えます。 プロラクチン受容体は、卵巣、精巣、子宮の細胞のほか、心臓、肺、胸腺、肝臓、脾臓、膵臓、腎臓、副腎、骨格筋、皮膚、および中枢神経系の一部にも存在します。
プロラクチンの主な効果は生殖機能に関連しています。 それらの中で最も重要なのは、妊娠中と出産後の乳腺の腺組織の発達、つまり初乳の形成と母乳への変換(ラクトアルブミン、乳脂肪、炭水化物の形成)を刺激することによって授乳を確実にすることです。 ただし、赤ちゃんの授乳中に反射的に起こる母乳の分泌自体には影響しません。
プロラクチンは、下垂体による性腺刺激ホルモンの放出を抑制し、黄体の発達を刺激し、プロゲステロンの生成を減少させ、授乳中の排卵と妊娠を阻害します。 プロラクチンは、妊娠中の母親の親としての本能の形成にも寄与します。
プロラクチンは、甲状腺ホルモン、成長ホルモン、ステロイドホルモンとともに、胎児の肺による界面活性剤の生成を刺激し、母親の痛みに対する感受性をわずかに低下させます。 小児では、プロラクチンは胸腺の発達を刺激し、免疫反応の形成に関与します。
下垂体によるプロラクチンの形成と分泌は、視床下部のホルモンによって調節されます。 プロラクトスタチンは、プロラクチンの分泌を抑制するドーパミンです。 プロラクトリベリンは、その性質は明確には特定されていませんが、ホルモンの分泌を増加させます。 プロラクチンの分泌は、ドーパミンレベルの低下、妊娠中のエストロゲンレベルの増加、セロトニンとメラトニンの含有量の増加、さらに妊娠中に乳腺の機械受容体が刺激されたときの反射経路によって刺激されます。吸う行為、そこからの信号が視床下部に入り、プロラクトリベリンの放出を刺激します。

米。 プロラクチン分泌の調節
プロラクチンの産生は、不安、ストレス、うつ病、重度の痛みの際に大幅に増加します。 FSH、LH、プロゲステロンはプロラクチンの分泌を阻害します。
プロラクチンの主な効果:
- 胸の成長を促進します
- 妊娠中および授乳中に乳の合成を開始します。
- 黄体の分泌活動を活性化します。
- バソプレシンとアルドステロンの分泌を刺激します。
- 水と塩の代謝の調節に関与する
- 内臓の成長を刺激する
- 母性本能の実現に参加します
- 脂肪とタンパク質の合成を増加させます
- 高血糖を引き起こす
- 免疫反応(T リンパ球上のプロラクチン受容体)に対する自己分泌およびパラクリン調節効果があります。
ホルモンの過剰(高プロラクチン血症)は、生理学的にも病理学的にも起こります。 健康な人のプロラクチンレベルの上昇は、妊娠中、授乳中、激しい身体活動後、深い睡眠中に観察されます。 プロラクチンの病理学的過剰産生は下垂体腺腫に関連しており、甲状腺疾患、肝硬変、その他の病状で観察されることがあります。
高プロラクチン血症は、女性の月経不順、性腺機能低下症と生殖腺の機能低下、乳腺のサイズの増加、授乳中の女性の乳汁漏出(乳の生産と分泌の増加)を引き起こす可能性があります。 男性ではインポテンスと不妊症。
プロラクチンレベルの低下(低プロラクチン血症)は、下垂体の機能不全、過期妊娠、または多数の薬剤の服用後に観察されることがあります。 症状の 1 つは、不十分な授乳または授乳の欠如です。
メラントロピン
メラノサイト刺激ホルモン(MSG、 メラノトロピン、インターメジン)は、胎児および新生児の下垂体の中間領域で形成される、13 アミノ酸残基からなるペプチドです。 成人では、このゾーンは減少し、MSHの生産量は限られています。
MSH の前駆体はポリペプチド プロオピオメラノコルチンであり、副腎皮質刺激ホルモン (ACTH) や β-リポトロインもプロオピオメラノコルチンから形成されます。 MSHにはα-MSH、β-MSH、γ-MSHの3種類があり、そのうちα-MSHが最も活性が高い。
体内におけるMSHの主な働きこのホルモンは、皮膚、毛髪、網膜色素上皮のメラノサイトである標的細胞内の G タンパク質に関連する特定の 7-TMS 受容体の刺激を通じて、酵素チロシナーゼの合成とメラニンの形成 (メラニン生成) を誘導します。 MSH は皮膚細胞内のメラノソームの分散を引き起こし、皮膚の黒ずみを伴います。 このような黒ずみは、妊娠中や副腎疾患(アジソン病)など、MSH 含有量が増加すると、血中の MSH レベルだけでなく ACTH および β-リポトロピンも増加します。 後者はプロオピオメラノコルチンの誘導体であり、色素沈着を促進する可能性があり、成人の体内のMSHレベルが不十分な場合、その機能を部分的に補うことができます。
メラントロピン:
- メラニンの形成を伴うメラノソーム内の酵素チロシナーゼの合成を活性化します。
- それらは皮膚細胞内のメラノソームの分散に関与します。 分散したメラニン顆粒が外部要因(照明など)の影響を受けて凝集し、皮膚の色が暗くなります。
- 免疫反応の制御に参加する
下垂体の熱帯ホルモン
それらは腺腺垂体で形成され、末梢内分泌腺の標的細胞および非内分泌細胞の機能を調節します。 視床下部-下垂体-内分泌腺系のホルモンによって機能が制御される腺は、甲状腺、副腎皮質、および生殖腺です。
甲状腺刺激ホルモン
甲状腺刺激ホルモン(TSG、 甲状腺刺激ホルモン)下垂体腺の好塩基性甲状腺刺激細胞によって合成されるαサブユニットとβサブユニットからなる糖タンパク質であり、その合成はさまざまな遺伝子によって決定されます。
TSH α サブユニットの構造は、黄体形成ホルモン、卵胞刺激ホルモン、および胎盤で形成されるヒト絨毛性性腺刺激ホルモンの組成におけるサブユニットと類似しています。 TSH のαサブユニットは非特異的であり、その生物学的作用を直接決定しません。
甲状腺刺激ホルモンのαサブユニットは、血清中に約0.5~2.0μg/lの量で含まれ得る。 その濃度の高レベルは、TSH 分泌下垂体腫瘍の発症の兆候の 1 つである可能性があり、閉経後の女性に観察されます。
このサブユニットは、TSH 分子の空間構造に特異性を与えるために必要であり、ここで甲状腺刺激ピンは甲状腺甲状腺細胞の膜受容体を刺激し、その生物学的効果を引き起こす能力を獲得します。 TSH のこの構造は、分子のα鎖とβ鎖が非共有結合した後に生じます。 さらに、112 個のアミノ酸からなるβサブユニットの構造は、TSH の生物学的活性の発現の決定要因です。 さらに、TSHの生物学的活性とその代謝速度を高めるためには、甲状腺刺激ホルモンの粗面小胞体およびゴルジ装置におけるTSH分子のグリコシル化が必要です。
合成をコードする遺伝子(TSHのβ鎖)に点突然変異を有する小児のケースが知られており、その結果、構造が変化したPサブユニットが合成され、αサブユニットと相互作用して生物学的に活性なサブユニットを形成できなくなります。 tnrotropin. 同様の病状を持つ子供には、甲状腺機能低下症の臨床徴候が見られます。
血液中のTSH濃度は0.5~5.0μU/mlの範囲であり、真夜中から4時間の間に最大値に達します。 TSHの分泌は午後には最小限になります。 身体には甲状腺外 T4 が大量にプールされているため、1 日のさまざまな時間における TSH レベルの変動は、血中の T4 および T3 濃度に大きな影響を与えません。 血漿中の TSH の半減期は約 30 分で、1 日あたりの TSH 生産量は 40 ~ 150 mU です。
甲状腺刺激ホルモンの合成と分泌は多くの生理活性物質によって調節されており、その中で主要なものは視床下部の TRH と甲状腺から血中に分泌される遊離 T4、T3 です。
甲状腺刺激ホルモン放出ホルモンは、視床下部の神経分泌細胞で産生される視床下部神経ペプチドであり、TSH の分泌を刺激します。 TRHは視床下部の細胞から軸索帆腔シナプスを通って下垂体の門脈血管の血液中に分泌され、そこで甲状腺刺激ホルモン受容体に結合してTSHの合成を刺激します。 TRH 合成は、血中の T4 および T3 レベルの低下により刺激されます。 TRH 分泌も、甲状腺刺激ホルモンのレベルによる負のフィードバック チャネルを通じて制御されます。
TRH は体内でさまざまな効果を発揮します。 プロラクチンの分泌を刺激し、TRH レベルが上昇すると、女性は高プロラクチン血症の影響を経験する可能性があります。 この状態は、TRH レベルの増加を伴う甲状腺機能の低下によって発症する可能性があります。 TRH は、脳の他の構造や胃腸管の壁にも存在します。 神経調節物質としてシナプスで使用され、うつ病では抗うつ効果があると考えられています。
テーブル。 甲状腺刺激ホルモンの主な効果
TSH の分泌と血漿中の TSH レベルは、血液中の遊離 T4、T3、および T2 の濃度に反比例します。 これらのホルモンは、負のフィードバックチャネルを介して甲状腺刺激ホルモンの合成を抑制し、甲状腺刺激ホルモン自体に直接作用するとともに、視床下部による TRH 分泌の減少を通じて作用します(TRH と下垂体甲状腺刺激ホルモンを形成する視床下部の神経分泌細胞は、 T 4 および T 3 のターゲット セル)。 甲状腺機能低下症などで血液中の甲状腺ホルモンの濃度が低下すると、下垂体腺の細胞中の甲状腺刺激細胞集団の割合が増加し、TSHの合成が増加し、血液中のTSHレベルが増加します。 。
これらの効果は、下垂体の甲状腺刺激ホルモンで発現される TR 1 および TR 2 受容体の甲状腺ホルモンによる刺激の結果です。 実験により、TG 受容体の TR 2 アイソフォームが TSH 遺伝子の発現にとって重要であることが示されました。 明らかに、甲状腺ホルモン受容体の発現、構造または親和性の変化は、下垂体における TSH の形成および甲状腺機能の違反として現れる可能性があります。
ソマトスタチン、セロトニン、ドーパミン、ならびに体内の炎症過程でレベルが上昇するIL-1およびIL-6は、下垂体によるTSHの分泌を阻害する効果があります。 ストレス条件下で観察されるTSHノルエピネフリンおよび糖質コルチコイドホルモンの分泌を阻害します。 TSH レベルは甲状腺機能低下症とともに増加し、甲状腺部分切除術後および (または) 甲状腺腫瘍に対する放射性ヨウ素療法後に増加する可能性があります。 医師は甲状腺系の疾患を持つ患者を診察する際、疾患の原因を正しく診断するためにこの情報を考慮する必要があります。
甲状腺刺激ホルモンは甲状腺細胞の機能の主な調節因子であり、TG の合成、貯蔵、分泌のほぼすべての段階を加速します。 TSHの影響下で、甲状腺細胞の増殖が加速し、卵胞と甲状腺自体のサイズが増加し、その血管新生が増加します。
これらすべての効果は、甲状腺刺激ホルモンが甲状腺細胞の基底膜にある受容体に結合し、G タンパク質共役アデニル酸シクラーゼが活性化された後に起こる一連の複雑な生化学的および物理化学的反応の結果です。 cAMP のレベル、甲状腺細胞の主要な酵素をリン酸化する cAMP 依存性プロテインキナーゼ A の活性化。 甲状腺細胞では、カルシウムのレベルが増加し、ヨウ化物の吸収が増加し、酵素甲状腺ペルオキシダーゼの関与により、ヨウ化物の輸送とサイログロブリンの構造への取り込みが加速されます。
TSHの影響下で、仮足の形成プロセスが活性化され、コロイドから甲状腺細胞へのサイログロブリンの再吸収が加速され、毛包におけるコロイド状液滴の形成と、リソソーム酵素の影響下でのそれらにおけるサイログロブリンの加水分解が加速されます。甲状腺細胞の代謝が活性化され、グルコース、酸素の吸収速度の増加、および甲状腺細胞によるグルコースの酸化が促進され、甲状腺細胞の成長と数の増加に必要なタンパク質とリン脂質の合成が促進されます。そして卵胞の形成。 高濃度で長期間暴露すると、甲状腺刺激ホルモンは、甲状腺細胞の増殖、その質量とサイズの増加(甲状腺腫)、ホルモン合成の増加、およびその機能亢進の発現(十分なヨウ素を伴う)を引き起こします。 体は過剰な甲状腺ホルモンの影響(中枢神経系の興奮性の増加、頻脈、基礎代謝と体温の上昇、目の突出、その他の変化)を発症します。
TSHが不足すると、甲状腺の機能低下(甲状腺機能低下症)が急速または徐々に発症します。 基礎代謝の低下、眠気、嗜眠、無力症、徐脈、その他の変化が生じます。
他の組織の受容体を刺激する甲状腺刺激ピンは、チロキシンをより活性の高いトリヨードチロニンに変換するセレン依存性脱ヨウ素酵素の活性を高め、その受容体の感受性を高め、それによって甲状腺ホルモンの影響に対して組織を「準備」します。
たとえば、受容体の構造やTSHに対する親和性の変化による、TSHと受容体の相互作用の破壊が、多くの甲状腺疾患の病因の根底にある可能性があります。 特に、その合成をコードする遺伝子の変異の結果として生じるTSH受容体の構造の変化は、TSHの作用に対する甲状腺細胞の感受性の低下または欠如、および先天性原発性甲状腺機能低下症の発症につながります。
TSH とゴナドトロピンの α サブユニットの構造は同じであるため、高濃度のゴナドトロピン (絨毛膜上皮腫など) では、TSH 受容体への結合を巡って競合し、甲状腺による TG の形成と分泌を刺激します。
TSH 受容体は、甲状腺刺激ホルモンだけでなく、この受容体を刺激または遮断する免疫グロブリンである自己抗体にも結合することができます。 このような結合は、甲状腺の自己免疫疾患、特に自己免疫性甲状腺炎 (バセドウ病) で発生します。 これらの抗体の供給源は通常 B リンパ球です。 甲状腺を刺激する免疫グロブリンは TSH 受容体に結合し、TSH が作用するのと同じように甲状腺の甲状腺細胞に作用します。
他の場合には、自己抗体が体内に現れ、受容体とTSHの相互作用をブロックし、萎縮性甲状腺炎、甲状腺機能低下症、粘液水腫を引き起こす可能性があります。
TSH 受容体の合成に影響を与える遺伝子の変異は、TSH 耐性の発症につながる可能性があります。 TSH に対する完全な耐性により、甲状腺は女性形成性となり、十分な量の甲状腺ホルモンを合成および分泌できなくなります。
視床下部-下垂体-甲状腺系の関係、つまり甲状腺の機能障害の発症につながる変化に応じて、次のように区別するのが通例である:障害が直接関連する場合、原発性甲状腺機能低下症または甲状腺機能亢進症。甲状腺。 二次性、下垂体の変化によって障害が引き起こされる場合。 三次 - 視床下部にあります。
ルトロピン
女性の体内におけるゴナドトロピンの主な機能ゴナドトロピン - 卵胞刺激ホルモン(FSH)、または フォリトロピンそして 黄体形成ホルモン(LH)、または ルトロピン、 -下垂体腺の異なるまたは同じ好塩基性細胞(性腺刺激ホルモン)で形成される糖タンパク質で、男性と女性の生殖腺の内分泌機能の発達を調節し、7-TMS受容体の刺激を通じて標的細胞に作用し、体内のcAMPレベルを増加させます。彼ら。 妊娠中、胎盤で FSH と LH が生成されることがあります。
月経周期の最初の数日間のFSHレベルの上昇の影響で、一次卵胞が成熟し、血中のエストラジオール濃度が増加します。 周期の途中でのピーク LH レベルの作用は、卵胞の破裂とその黄体への変化の直接の原因です。 LH 濃度のピークから排卵までの潜伏期間は 24 ~ 36 時間で、LH は卵巣におけるプロゲステロンとエストロゲンの生成を刺激する重要なホルモンです。
男性の体内におけるゴナドトロピンの主な機能FSH は精巣の成長を促進し、Ssrtoli 細胞を刺激してアンドロゲン結合タンパク質の形成を促進します。また、これらの細胞によるインヒビン ポリペプチドの産生も刺激して、FSH と GnRH の分泌を減少させます。 LH は、ライディッヒ細胞の成熟と分化、およびこれらの細胞によるテストステロンの合成と分泌を刺激します。 精子形成には、FSH、LH、テストステロンの複合作用が必要です。
テーブル。 ゴナドトロピンの主な作用

FSH と LH の分泌は、GnRH および LH とも呼ばれる視床下部性腺刺激ホルモン放出ホルモン (GHR) によって調節され、主に FSH の血液中への放出を刺激します。 月経周期の特定の日に女性の血液中のエストロゲン含有量が増加すると、視床下部での LH の形成が刺激されます (正のフィードバック)。 エストロゲン、プロゲスチン、ホルモンのインヒビンの作用により、GnRH、FSH、LH の放出が抑制されます。 プロラクチンは、FSH と LH の形成を阻害します。
男性のゴナドトロピンの分泌は、GnrH (活性化)、遊離テストステロン (抑制)、およびインヒビン (抑制) によって調節されます。 男性では、GnRH 分泌が継続的に起こりますが、女性では周期的に分泌されます。
小児では、性腺刺激ホルモンの放出が松果体ホルモンのメラトニンによって抑制されます。 同時に、小児におけるFSHおよびLHレベルの低下は、第一次および第二次性徴の発達の遅れまたは不十分さ、骨の成長板の閉鎖の遅れ(エストロゲンまたはテストステロンの欠如)、および病的な高成長または巨人症を伴います。 女性では、FSH と LH の欠乏により、月経周期の中断または停止が起こります。 授乳中の母親では、プロラクチンレベルが高いために、これらの周期の変化が非常に顕著になることがあります。
小児におけるFSHおよびLHの過剰分泌は、思春期早期、成長板の閉鎖、および性腺機能亢進による低身長を伴います。
コルチコトロピン
副腎皮質刺激ホルモン(ACT、 またはコルチコトロピン)は、下垂体腺皮質栄養細胞によって合成される 39 アミノ酸残基からなるペプチドで、標的細胞に作用して 7-TMS 受容体を刺激し、cAMP レベルを増加させます。このホルモンの半減期は最大 10 分です。
ACTHの主な効果副腎と副腎外に分けられます。 ACTHは、副腎皮質の束状帯と網状層の成長と発達、ならびに糖質コルチコイド(束状帯の細胞によるコルチゾールとコルチコステロン、および程度は低いですが性ホルモン(主にアンドロゲン))の合成と放出を刺激します。 ACTH は、糸球体帯副腎皮質の細胞によるミネラルコルチコイド アルドステロンの放出を弱く刺激します。
テーブル。 コルチコトロピンの主な効果
ACTH の副腎外作用は、他の臓器の細胞に対するホルモンの作用です。 ACTH は脂肪細胞において脂肪分解作用を有し、血中の遊離脂肪酸のレベルを増加させるのに役立ちます。 膵臓のベータ細胞によるインスリンの分泌を刺激し、低血糖の発症を促進します。 下垂体腺の成長ホルモンによる成長ホルモンの分泌を刺激します。 同様の構造を持つMSHと同様に、皮膚の色素沈着を強化します。
ACTH 分泌の調節は 3 つの主要なメカニズムによって実行されます。 ACTHの基礎分泌は、視床下部によるコルチコリベリン放出の内因性リズムによって調節されます(朝の最大レベルは6~8時間、最小レベルは22~2時間)。 分泌の増加は、体へのストレスの影響(感情、寒さ、痛み、身体活動など)の間に形成される、より大量のコルチコリベリンの作用によって達成されます。 ACTH のレベルも負のフィードバック機構によって制御されます。つまり、血液中の糖質コルチコイド ホルモンであるコルチゾールのレベルが増加すると ACTH は減少し、血液中のコルチゾールのレベルが減少すると増加します。 コルチゾールレベルの増加は、視床下部によるコルチコステロイドホルモンの分泌の阻害も伴い、これは下垂体による ACTH の形成の減少にもつながります。

米。 コルチコトロピン分泌の調節
ACTH の過剰分泌は、妊娠中だけでなく、下垂体腺の下垂体副腎皮質刺激ホルモンの一次性または二次性 (副腎摘出後) の機能亢進中にも発生します。 その症状は多様で、ACTH 自体の効果と、副腎皮質や他のホルモンによるホルモンの分泌に対する ACTH の刺激効果の両方に関連しています。 ACTH は成長ホルモンの分泌を刺激します。成長ホルモンのレベルは体の正常な成長と発達にとって重要です。 特に小児期の ACTH レベルの上昇は、過剰な成長ホルモン産生による症状を伴うことがあります (上記を参照)。 小児でACTHのレベルが過剰になると、副腎による性ホルモンの分泌が刺激されるため、思春期の初期、男性ホルモンと女性ホルモンのバランスが崩れ、女性に男性化の兆候が現れることがあります。
血中で高濃度の ACTH は、脂肪分解、タンパク質の異化、および過剰な皮膚の色素沈着の発生を刺激します。
体内の ACTH 欠乏は、副腎皮質細胞によるピオココルチコイドの分泌不足につながり、代謝障害や環境要因の悪影響に対する体の抵抗力の低下を伴います。
ACTHは前駆体(プロオピオメラノコルチン)から形成され、α-およびβ-MSH、β-およびγ-リポトロピン、内因性モルヒネ様ペプチド(エンドルフィンやエンケファリン)もそこから合成されます。 リポトロピンは脂肪分解を活性化し、エンドルフィンとエンケファリンは脳の抗侵害受容(痛み)システムの重要な成分です。