Ecetsavat kapunk. Ecetsav
Kétségtelen, hogy az alifás mono-nulla savakkal kapcsolatos ismert oldószerek közül az ismert ecetsav. Más névvel is rendelkezik: ecetsav lényege vagy stencil sav. Olcsóság és hozzáférhetőség a különböző koncentrációkban (3-100%) ennek az anyagnak, stabilitása és egyszerűsége a tisztításhoz, arra a tényre vezetett, hogy ma a legjobb és legismertebb eszköz a szerves anyagok többségének feloldására Eredet, amelyek nagy igényűek különböző területeken emberi tevékenység.
Ecetsav És ennek megfelelően az egyes iparágakban történő felhasználásának lehetősége a koncentráció mértéke szerint változhat. Ez az élelmiszer, azaz az ecet (3-15%), valamint a technikai - ecetsav (70-80%) és a jég (100%).
Mind a háztartási szinten, mind általában az élelmiszeriparban alacsony kereslet alacsony koncentrált oldat, az ecetsav százalékos aránya, amelyben körülbelül 3-15%. A szezonkészített ételeket számos termék ízesítésére használják, elengedhetetlen a konzerv, a maráinosítás, valamint a húsok és a halak sója, stb.
Műszaki ecetsav 70, Vásárlás Mely, az ételtől eltérően nem használható a szokásos élelmiszerboltban, aktívan alkalmazzák a vegyiparban, kiváló oldószerként és kémiai reagensként, más anyagokat, például acetont szintetizálnak.
A technikai esélymagot gyakran orvosi (például aszpirin), pép és papír (festés és tipográfia), festék és lakk, textil parfüm, bőr és egyéb ipari területek használják. Az illatos anyagok összekapcsolására szolgál, herbicidek előállítására, acetát (szintetikus) szálak létrehozására.
Az ecetsav jelentősége orvosi és gyógyszeripar Szintén nagyszerű. Ez az anyag számos gyógyszer integrált eleme, és gyógyszerekmint például az ólom- és alumínium-sók ecetsavak, acetilszalicilsav. A komplexumban számos kezelésben használják gyulladásos folyamatok és különböző betegségek, főként a pediculózis, alkohol mérgezés, lichen, radikulitis, poliartritis stb.
Ecetic essence, valamint oldószer 646, Ár Ami szintén kicsi, szinte bárkinek vásárolhat, anélkül, hogy kizárná a háztartási cikkeket. Elég ahhoz, hogy megrendelje és megvegye az interneten keresztül. A költségek olcsóbbak lesznek. Ez különösen előnyös azoknak, akik az iparban dolgoznak, ahol jelentős mennyiségekre van szükség, és ahol ecetsav, mint mások kémiai oldószerekSok alompalackban és hordóban valósul meg. Ezért legjobb, ha vesz már a szállítók, akik sikerült bizonyítani maguknak is, és az árut a piacon.
Megtekintések: 11,857 alkalommal
Tanfolyam
"Ecetsav"
Elvégzett: _____________
______________________
Ellenőrzött: _____________
______________________
Volgograd 2004.
Bevezetés ................................................. ......... 3
1. Az ecetsav nyílása ........................... 5
2. Az ecetsav tulajdonságai .........................13
3. Ecetsav előállítása ........................ 19
4. Az ecetsav alkalmazása ....................... 22
Következtetés ................................................. ..... 26
A használt hivatkozások listája .................. .. ... 27
Bevezetés
Ecetsav, CH3COOH, színtelen éghető folyadék éles illatú, jól oldódik vízben. Van egy jellegzetes savanyú íze, az elektromos áramvezetők.
Az ecetsav az egyetlen, aki tudta az ókori görögöket. Innen és annak neve: "Oksos" - savanyú, savanyú íz. Ecetsav van egyszerűbb nézet Szerves savak, amelyek szerves részét képezik a növényi és állati zsírok. Kis koncentrációban, jelen van az élelmiszer-termékek és italok, valamint részt vesz a metabolikus folyamatok az érési gyümölcsök. Az ecetsav gyakran megtalálható a növényekben, állati kisülésben. Sókat és ecetsav-észtereket acetátoknak nevezik.
Az ecetsav gyenge (disszociálódik) vizesoldat Csak részben). Mivel azonban a savas tápközeg elnyomja a mikroorganizmusok élettartamát, az ecetsavat a megőrzés során használják Élelmiszer termékekPéldául a marinádok részeként.
Az ecetsavat acetaldehid és egyéb eljárások oxidációjával állítjuk elő, az etanol ecetsav-ecetsav-fermentációja. Használt megszerezni gyógyászati \u200b\u200bés illatos anyagok, mint például egy oldószerben (például, a termelés cellulóz-acetát), a táblázat formájában ecetet gyártásához fűszerek, pácok, konzerveket. Az ecetsav számos metabolikus folyamatban részt vesz az élő szervezetekben. Ez az egyik illékony sav, amely szinte minden élelmiszerben, savanyú ízben és az ecet fő összetevőjében jelen van.
Ennek a munkának a célja: az ecetsav tulajdonságainak, termelésének és felhasználásának feltárása.
Feladatok ez a tanulmány:
1. Elmondani az ecetsav megnyitásának történetét
2. Az ecetsav tulajdonságainak tanulmányozása
3. Ismertesse az ecetsav előállítására szolgáló módszereket
4. feltárja az ecetsav használatának jellemzőit
1. Az ecetsav kinyitása
Az ecetsav szerkezete érdekli a kémikusok a triklór-ecetsav nyílása óta, mivel ez a felfedezés Berzelius elektrokémiai elméletének karbantartását okozta. Az utóbbi, elosztó elemek elektropozitív és elektrongatív, nem ismeri fel a szerves anyagok helyettesítésének lehetőségét, mély változás nélkül kémiai tulajdonságok , hidrogén (elektropozitív) klór (elektropozitív) klór (elektropozitív elem), és időközben a Dumas ("Comptes rendelés" a párizsi akadémia, 1839-ben) kiderült, hogy "a klór bevezetése a hidrogénhelyen nem változik A molekula teljesen külső tulajdonságai ... "Miért Duma és csodák", hogy az elektrokémiai nézetek és ötletek az egyszerű testek molekuláihoz (atomok) által tulajdonított polaritásról (atomok) az ilyen egyértelmű tényekre támaszkodnak, hogy figyelembe vegyék a feltétel nélküli hit témáit; ha Hipotéziseknek kell tekinteni, majd ezek a hipotézisek alkalmasak-e a tényekre? ... fel kell ismernie, hogy más. Szervetlen kémiai kémia, izomorfizmus, tényeken alapuló elmélet, valamint az elektrokémiai elméletekkel rendelkező, kevéssé konzonáns jól ismert. A szerves kémiaban ugyanazt a szerepet játssza le a csereelmélet. .. és talán a jövő azt mutatja, hogy mindkét nézet szorosabban kapcsolódik egymás között, hogy ugyanazon okokból következik, és összefoglalhatók egy és ugyanaz a név. Időközben az U. sav átalakítása kloro-ecetikus és aldehid formájában kloro-ecetikus és aldehidben klóroldehidben (klór), és abból a tényből, hogy ezekben az esetekben az összes hidrogén helyettesíthető egy klórral, anélkül, hogy megváltoztatná a fő kémiai természetét az anyag, lehet levonni, hogy a szerves kémiában vannak típusok, amelyek megőrzésre, majd amikor bemutatjuk azonos térfogatú klór-, bróm és jód, hogy a hidrogén helyett. Ez azt jelenti, hogy a helyettesítés elmélete a tényeken nyugszik, és a legrosszabb a szerves kémia. ". A svéd akadémia éves jelentésében (" Jahresbericht stb. ", Vol. 19, 1840, 370. o. ). BurtSellius közleményei: "Duma elkészített egy olyan vegyületet, amelyhez a Racionális képletet adja a C4CL6O3 + H2O-t (modern atomsúlyok, triklór-ecetsavat, vízzel anhidridvegyületnek tekintjük); Ez a megfigyelés számolva a Les Plus Eclatants de La Chimie Organique kitalra; Ez a helyettesítőelmélet alapja. amely az ő véleménye, a billentés elektrokémiai elméletek ..., és közben kiderül, hogy ez csak a képletet írási némileg eltérő, hogy egy vegyület oxalous sav. A megfelelő kloriddal, a C2CI6 + C2O4H2-vel, amely az oxálsavhoz és savhoz és sókhoz kapcsolódik. Ezért a vegyület ilyen anyanyelvével foglalkozunk, amelyek közül sok példa van; Sok ... egyszerű és összetett csoportok rendelkeznek, hogy az ingatlan az oxigént tartalmazó részét köthet kapcsolatban bázisok és elveszíteni őket, anélkül, hogy elveszítené a kapcsolatot a klórtartalmú része. Ezt a megjelenést nem adják meg a dumákban, és nem voltak kitéve tapasztalt ellenőrzésnek, és közben, ha igaz, akkor az új tanítás, a dumákban, a dumasban, a legtöbb elméleti elképzeléssel, a talaj lábai alatt menekülnek Meg kell esnie. A Berzalius-Cro2Cl2-t (a krómsav-anhidrid-kloridot) a Berzelius - Cro2Cl2 között (a króm-sav-anhidrid-kloridot is felszámolják) króm-anhidriddel: 3CRO2CI2 \u003d CRCL6 + 2CRO3), a Britzelius folytatódik: "A duma-klór-ecetsav nyilvánvalóan ehhez a vegyületekhez tartozik; Benne a széngyűrű oxigénnel és klórral van összekötve. Ez tehát oxálsav, amelyben a fele oxigént klórral vagy 1 atom (molekulák) oxálsavval helyettesítjük, 1 atom (molekula) félhűtő szén - C2CI6. Az első feltételezés nem fogadható el, mivel lehetővé teszi a klór 11/2, oxigénatomok helyettesítésének lehetőségét (a bátor oxálsav szerint C2O3.). A Dumasban a harmadik nézetet is tartja, amely teljesen összeegyeztethetetlen a kettővel, amelyen a klór nem helyettesíti oxigénnel, és az elektropozitív hidrogénatom, amely egy C4Cl6 szénhidrogénet képez, amely ugyanolyan tulajdonságokkal rendelkezik, amelynek tulajdonságai vannak egy komplex radikális, valamint a C4H6 vagy az acetil és egy képes, állítólag 3 oxigénatommal, hogy a W. W. tulajdonságok szerint savas savat kapjunk, de amint az összehasonlításból (fizikai tulajdonságaik), nagyon kitűnő tőle. "Amennyire Burtselius mélyen meggyőződött róla Az ecetsav és a triklór-ecetsav különböző alkotmánya, az õ és az évben tett megjegyzésből ("Jahresb", 19, 1840, 558) a Gerar (Journ. F. pr. ch. " XIV, 17): "Gerard, azt mondja, új pillantást vetett az alkohol, az éter és azok származékai összetételére; Ez a következő: Az ismert króm, az oxigén és a klór-vegyület \u003d Cro2Cl2, klóratom helyettesíti oxigénatom benne (értünk Berzelius 1 oxigénatomot króm-anhidrid - CrO 3). W. A sav C4H6 + 3O magában foglalja az oxálsav 2 atomot (molekulákat), amelyek közül az összes oxigénben hidrogénatommal helyettesített \u003d C2O3 + C2H6. És egy ilyen játék a képletekben töltött 37 oldalt. De a következő évben a dumák, a típusok elképzelésének fejlesztése jelezte, hogy az ingatlanok tulajdonságainak címeiről és a triklór-ecetsav tulajdonságairól beszélve kémiai tulajdonságaik identitása, vizuálisan kifejezve, például az analógiában lúgja: C2H3O2K + KOH \u003d CH4 + K2CO8 és C2CL3O2K + KOH \u003d CHCI3 + K2CO8, mivel a CH4 és a CHCI3 ugyanolyan mechanikai típusú képviselők. Másrészt, a Lubih és a Gremis nyilvánosan beszélt a helyettesítési elmélet talaján elért nagyobb egyszerűség javára, a klór-termelő hétköznapi éter és a formáló és az U. sav étere alapján Malagetti és Britzelius az új tények nyomását eredményezi az 5. ED-ben. A "LEHRBUCH DER CHEMIE" (az előszót 1842. novemberi jelöléssel), elfelejtve a Gerardról szóló éles felülvizsgálatát, feltéve, hogy a következőket írja le: "Ha visszahívjuk az ecetsav átalakulását (a szöveges bomlást) a klór hatása alatt klór-szemű savban (klór-klóroxalái-britzelius) trichlór-ecetsavat hív. ("Lehrbuch", 5 Ed., P. 629).), Úgy tűnik, lehetséges, hogy egy másik pillantást az ecetsav összetételére (ecetsavnak hívják Berzelius acetilsaure. ), nevezetesen - ez kombinálható oxálsavat, amelynél a kombinált csoportban (Paarling) jelentése C2H6, ahogy egy kombinált csoport chloroable sav C2Cl6, és akkor a hatása klórrá ecetsav csak akkor lenne a konvertáló C2H6 a C2Cl6 . Nyilvánvaló, hogy lehetetlen eldönteni, hogy az ilyen képviselet pontosabban helyes-e.
Így Berzeliusnak meg kellett ismernie a hidrogén-helyettesítés lehetőségét klórral anélkül, hogy megváltoztatná az eredeti test kémiai funkcióját, amelyben a csere következik be. Anélkül, hogy más vegyületekre néző nézeteinek függelékét megállnám, az ecetsavhoz, majd más határértékű mono-abnormális savakhoz fordulok, akkor számos tényt találtak, amelyek harmonizáltak a Bercelius (Gerard) nézeteihez. A Kolbe műveinek kezdeti pontja kristályos anyagként, a CCL4SO2 készítménye, amelyet Berzelius és Marsa korábban a Royal Vodka CS2-en végzett, és a CS2-es kollégiumban alakult ki a CS2-ben. Kolbe átalakítása közelében (lásd Kolbe, "Beitrage Znr Kenntniss der Gepaarten Verbindungen" ("Ann. Ch. U. u. pp", 54, 1845, 145).) Azt mutatta, hogy ez a test képviseli, modern nyelv, klór anhidrid triklór-metil-szulfonnal Sav, CCL4SO2 \u003d CCL3.SO2CI (KOHLENSUPERCHLOROD SCHWEFLIGHIGSAURE KOLBE), alkalis-specifikus savas sav, CCL3.SO2 (OH) [Colba, de + C2Cl3S2O5 - ChlorkohlenunurschweSelsaure] (Atom súlyok: H \u003d 2, Cl \u003d 71, C \u003d 12 és o \u003d 16; és ezért a modern atomtömegekkel, a C4SL6S2O6H2.), Ami a cink hatása alatt először egy atom hidrogénatommal helyettesíti, a CHCl2.SO2 (OH) savat képezi [Colbet - Wasserhaltige klorformylunterschwefelsaure ( Britzelius ("Jahresb" 25, 1846, 91) megjegyzi, hogy az S2O5 ditionsav kloroformálással történő kombinációjával helyes, miért CCL3SO2 (OH) KohleSuperClorurur (C2CI6) - ditionsaure (S2O5). Hidratál, A szokásos módon a Burtselliusot nem veszik figyelembe..), És állítsa be EM és a másik, a CH2CI 2 (OH) savat képezve [OH) [Colbe - kloralaylunterschwefelelsaure], és végül az áram vagy kálium-amalgám helyreállításakor (a reakció röviddel az olvadékot, mielőtt az olvadékot az ecet-re csökkentjük .) A hidrogén és mindhárom atom helyettesítése, metil-szulfonsav kialakítása. CH3.SO2 (OH) [Colbet - Methylterschwefelsaure]. Ezeknek a vegyületeknek a analógiája klór-ecetsavval szokatlanul feltűnő volt; Valóban, az akkori képletek, két párhuzamos sorban kapunk, ahogy a következő lemez: H2O + C2Cl6.S2O5 H2O + C2Cl6.C2O3 H2O + C2H2CL4.S2O5 H2O + C2H2CL4.C2O3 H2H2CL4.C2O3 H2O + C2H4CL2.S2O5 H2O + C2H4CL2.C2O3 H2O + C2H6. S2O5 H2O + C2H6.C2O3 Ez nem csúszott el a Colba-tól, amely észrevegyük (I. P. 181): "a fent leírt kombinált kénsavakhoz és közvetlenül klór-szén felett - H2O + C2CL6. S2O5) a klórmentes savat, amely klór-ecetsavat ismert. Folyékony klór-szén - CCl (CL \u003d 71, C \u003d 12; Most írjuk a C2Cl4-et klór-etilén.), Mint tudod, a klór - hexakhloroetán (az akkori nómenklatúra - KohleSuperChlorur) szerint fénybe fordulunk, és Azt várhatja, hogy ha egyidejűleg vízzel van ellátva vízzel, akkor, mint egy bizmut klorid, klór-antimon stb. Az oktatás pillanatában cserélje ki a klór-oxigént. A tapasztalat megerősítette a feltételezést. "A C2CL4-en lévő fény és klór hatására, amely víz alatt volt, a kollége hexaklór-etánnal és triklór-ecetsavval kapott, és az átalakulást ilyen egyenletsel expresszálta: (mivel a CCL4-t a CCL4-ből kaphatjuk Antawed csően keresztül továbbítva, és a CCl4-t cselekvés közben alakítjuk ki, CL2 CS2-re, a Kolbe-reakció az első időben az ecetsav szintézisével az elemekből származik.) "Nehéz egyidejűleg eldönteni, és ez Nehéz megoldani azt, mivel a klór azonnal oxidálja az ecetsavban "... a klór-ecetsavra való bercélium nézete" csodálatos módon (AUF Eine TierraSchende Weise) megerősíti a kombinált kénesek tulajdonságainak létezése és párhuzamosságát savak, és úgy tűnik számomra (mondja Kolbe I. 186. o.), jön ki a hipotézisek régiójából, és magas fokú valószínűséget szerez. Ha a klóroh-anoxalátot (Chlorkohlenoxalsure, a kollektoros klónt, a klór-ecetsavat) a klór-ecetsavat tartalmazza.) A klorogénsav készítményéhez hasonló összetétele, akkor az ecetsavat is figyelembe kell venni, amely megfelel a metil-szolgáltatásokat, a kombinált savaként : C2h6.c2o3 (ez egy pillantás, korábban Gerard kifejezve). Nem hihetetlen, hogy a jövőben arra kényszerülünk, hogy a kombinált savak esetében jelentős számú szerves savakat vegyenek fel, amelyben jelenleg a korlátozott információk alapján - elfogadjuk a hipotetikus radikákat ... "Ami a Ezekben a kombinált savak szubsztitúciójának jelenségeinek, egyszerű magyarázatot kapnak abban a tényben, hogy a különböző, valószínűleg izomorf vegyületek képesek egymásra cserélni egymást a kombinált csoportok (ALS RARLINGE, L. PP 187), anélkül, hogy megváltoztatnák az esszenciális sav tulajdonságokat A testet velük kombinálta! "További kísérleti megerősítés Ez a megjelenés Frankland és Kolbe cikkben találjuk meg:" Ueber Die Chemische alkotmány Der Sauren der Reihe (CH2) 2NO4 und Der Unter Den Namen "Nitril" Bekannten Verbindungen "(" Ann. Chem . n. Pharm. ", 65, 1848, 288). A prezentáció alapján, hogy a sorozat (CH2) 2NO4-es savja, mint a metil-keletű sav (most írjuk a CNH2NO2-t, és hívjuk a metylchy savas sav - ecet.), Ha a H2O + H2 .C2O3 képlet a hangyasav racionális összetételének valódi expresszióját jelenti, azaz az oxálsavra tekintve, egy ekvivalens hidrogénnel kombinálva (a kifejezés nem igaz; N. Frankland helyett Kolbe keresztezett betűt használ, amely megfelel 2 N.), majd könnyen megmagyarázza az átalakítást, amikor magas hőmérséklet Ammónium-oxigénsav vizes sinilsavba, mert ismert, és a DoBereer azt is megállapítja, hogy az ammóniumi kazettát vízbe és ciánné melegítjük. A gyógyfémsavval kombinált hidrogén csak akkor vehető igénybe a hidrogén a reakcióban csak azzal a ténnyel kapcsolatban, hogy összekapcsolja a ciánkék sinil-savat képez: a lúgosok kék hatásának hátrameneti képződése semmit sem jelent, mint a Cyana ismert átalakításának ismétlése az oxálsavban és ammóniában oldott vízben, csak a különbséggel; Ez a képződés idején az oxálsavat kék sav hidrogénnel kombináljuk. "Az a tény, hogy a benzol-cianid (C6H5CN), például a felingben, nincs savas tulajdonságai, és nem formálja Berlin Lazari-t a Kolbol szerint és Frankland, tegye párhuzamosan képtelen a klór-kloridot kloriddal való reakció AgNO3, és helyességét a lerakódásának Kolbol és Frankland bizonyítani szerinti szintézis nitril módszerrel (nitrilek szerezték desztillációjával kénsavak, KCN (módszerével Dumas és malagett Lebed): R. ".SO3 (OH) + KCN \u003d R. CN + KHSO4) ecetsav, propionic (az akkori, met-aceton,) és kőkrónsav, majd a következő évben, a kollégium electrolycial sói mono-axiális limit savak és, egyetértésben a rendszert, megfigyelhető volt az elektrolízis ecetsav, Oktatási etán, coalic-ecetsavval és hidrogén: H2O + C2H6.C2O3 \u003d H2 +, és a macskagyökér elektrolízis - oktán, Szalonsav és hidrogén: H2O + C8H18.C2O3 \u003d H2 +. Nem lehet azonban észrevenni, hogy a kolbe az ecetsav-metil (CH3) "-ból várt, hidrogénnel, azaz a mocsárgázzal és a valerián-butil-C4H9-ből, azaz a hidrogénnel, azaz C4H10-hez (Hívja a C4H9-et), De ebben a várakozásban meg kell tekinteni az állampolgárság jelentős jogait a Gerar képletei általi jelentős jogokhoz való hozzárendeléséhez, aki elhagyta az ecetsavat, és nem a C4H8O4-nek tekintette, hogy a kriotoszkópos adatok alapján ítéli meg, És valójában, és a C2H4O2 esetében, az összes modern kémiai tankönyvben.
Név:
Az ecetsav (sininsav) egy alifás sorozat monosuláris karbonsav.
Kémiai formula:
Nyitva tartás:
Az ecetsav az ősi idők óta ismert, mivel a borok (borecet) kialakulásakor alakul ki.
De a szerkezet ecetsav és az oka a előfordulása, a tudósok érdeklődését csak a szenzációs közzétételét empirikus szabály szubsztitúciós szerves vegyületek hidrogén klórt. Ezt megelőzően az elmélet domináns volt a kémia, amelyet Jacob Berzelius jelölt. Elosztotta az elemeket elektropozitív és elektrongatív, és teljesen kimutatta a hidrogén és a klór szubsztitúcióját, illetve az anyagok kémiai szerkezetének megváltoztatása nélkül.
Munkájában 1839-ben a Svéd Akadémia Duma bemutatta egy jelentést, amelyben a szerves anyagok empirikus szabályai által megfogalmazott kezdeti elveket különösítettük, különösen az ecetsav esetében: "Szervetlen kémia, izomorfizmus, A tények, kézi menetként szolgálnak, mivel jól ismert, kevés konszonáns elektrokémiai elméletekkel. A szerves kémiában ugyanazt a szerepet játssza le a csereelmélet ... és talán a jövő azt mutatja, hogy mindkét nézet szorosabban kapcsolódik egymás között, hogy ugyanazon okokból következik, és ugyanazon a név alatt foglalhatók össze. "
Az ilyen következtetéshez több éves volt. A DUMA első kísérleteit az ecetsav vizsgálatából kezdte, és kloroacetikusan forgatta. A hidrogén ebben a reakcióban teljesen klórral helyettesítjük, 1: 1 arányban, és ami a legfontosabb, anélkül, hogy elveszítené a fő kémiai tulajdonságait és az anyag arányát az osztályhoz. A hidrogén-jód és a brómot szubsztitúciós további kísérletek végül meggyőzték a tudósot ebben.
Forradalmár volt a szervetlen és szerves vegyületek kialakulásának alapvető különbségével kapcsolatos következtetés.
Azonban Burtsellius, az elmélet védelme, az oxálsav példáját és a kapott sót, amikor kloriddal összekeverjük, ami a savas tulajdonságok elvesztését jelenti. Azt állítja, hogy példa a szerves és szervetlen vegyületekre, hogy oxigéntartalmú részüket a bázisokkal reagáltathatjuk, és elveszíthetik őket anélkül, hogy elveszítenék a klór-tartalmú részeket. Ez a szempont szerint a vegyész, a Dumas fő mulasztása a kísérleteiben, mert Nem engedte meg, és megerősítette ezt a jól ismert tényt.
Valahogy megmagyarázni, az eredmények által kapott eredményeket, a BurtsSellius továbbra is feltételezhető: "Duma-klór-ecetsav,
nyilvánvalóan ez a vegyületek e csoportjához tartozik; Az IT-szén radikális csatlakozik
És oxigénnel és klórral. Ez tehát oxálsav,
amely fél oxigént szubsztituálva van klórral vagy 1 atom vegyületekkel
(molekulák) oxálsav 1 atom (molekula) félhűtő szén
C2CL6. Az első feltételezés nem fogadható el, mert lehetővé teszi
a klór 11/2, oxigénatomok cseréje (Berzelius Oxal szerint)
a sav C2O3.).). A Dumas teljesen a harmadik bemutatót is tartja
nem kompatibilis a fenti kettővel, amely szerint klórat nem helyettesíti oxigén, hanem
elektromos pozitív hidrogén, amely egy C4CL6 szénhidrogént képez, amely ugyanaz
egy komplex radikális tulajdonságai, mint például a C4H6 vagy az acetil, és állítólag 3
oxigénatomok sav, az egyik a tulajdonságok tulajdonságai W., de ahogy látható
az összehasonlításból (fizikai tulajdonságaik), elég kitűnő "
De a vetőmagok, a Dumasban, így lőttek. Most sok tudós elfordul a Bercelius elméletétől folytatta az innovációkat. Tehát Charles Frederick Gerard először a radikális elmélet ellenére (amely alkotó és elkötelezettség Bercelius volt) megállapította, hogy a radikálisok nem léteznek önállóan, de atomcsoportok - "maradékok", amelynek kombinációja molekulát képez . Az ő esszét „A bázicitása savak” 1851-ben, ő kidolgozott elmélet típusok, amely szerint az összes kémiai vegyületek sorolhatók származékai négy típusú hidrogén, klorid, víz és ammónia. Különösen gondolta a triklór-ecetsav és ecetsav alkotmányának hasonlóságát. Védjében, Bercelius Parries: "Gerard új pillantást vetett az alkohol, az éter és azok összetételére
származékok; A következő: a jól ismert króm, oxigén és klór
formula \u003d cro2cl2, klór helyettesíti az oxigénatomot (jelentette
Berzelius 1 oxigénatomja króm-anhidrid - CRO3). W. C4H6 + 3O
2 atomot (molekulát) tartalmaz oxálsav, amelyből egy
az oxigént hidrogénatommal helyettesítjük \u003d C2O3 + C2H6. " De egy ilyen játék nem tartotta meg az elmélet hatóságait, és egy évvel később, a Duma egy zúzó csapást biztosít, a típusai elméletét, a triklór-ecetsav hasonló tulajdonságait és ecetsavat vizsgálva az lúgos hatással.
Másrészt, Lubi és Grem nyilvánosan beszélt
nagyobb egyszerűség a helyettesítési elmélet talaján, figyelembe véve
klór-termelő hétköznapi éter és éter éter és u. sav, kapott
Malagetti.
Britzelius, alacsonyabb az új tények nyomására, az 5. ED-ben. Övé
"Lehrbuch der Chemie" (Előszó: November 1842), 709. oldal,
elfelejti a Gerardról szóló éles felülvizsgálatát, feltéve, hogy a következőket írja le: "Ha mi
emlékezzünk vissza az átalakításra (a szöveges bomlásban) u. sav a klór hatása alatt
klórossavas (kloroschalevaleva - klóroxalsaure - burstsellius hívás
triklór-ecetsav , úgy tűnik
egy másik más álláspont az U. sav összetételére, nevezetesen kombinált oxálsav lehet, amelyben a kombinált csoport (pazarling) C2H6, ugyanakkor a klór-estasav kombinált csoportja a C2CI6, majd a klór hatására W. Sav Ez csak a C2H6 C2CI6-ban történő konvertálása lenne. Nyilvánvaló, hogy lehetetlen eldönteni, hogy az ilyen képviselet pontosabb-e ... azonban hasznos figyelmet fordítani rá. "
De az ezredben a támogatók a típusai, mind megérkezett. A Kolbe műveinek kezdeti pontja kristályos anyagként, a CCL4SO2 készítménye, amelyet Berzelius és Marsa korábban a Royal Vodka CS2-en végzett, és a CS2-es kollégiumban alakult ki a CS2-ben. A Collee átalakítása közelében megmutatta, hogy ez
a test képviseli, kifejező modern nyelv, klóranhidrid
trichlór-metil-szulfonsav, CCL4SO2 \u003d CCL3.SO2CI, amely befolyásolhatja az alkalitákat, hogy a megfelelő sav - CCL3.SO2 (OH) sóit kapjuk, amely a cink hatása alatt egy atom hidrogénatommal helyettesíti, a CHCl2.SO2 (OH) hidrátvizet képezi. , mint a szokásos, Bezelius nem elfogadható
figyelembe kell venni.), majd a másik, a savas CH2CI.SO2 (OH) [OH) [a kollégán -
Klororelialunterschwefelelsaure], és végül az aktuális vagy kálium helyreállításakor
amalgama (a reakció röviddel a gépet, mielőtt a gépet alkalmazzák az olvadékra
a triklór-ecetsav ecet-ben történő helyreállítása.) Helyesített hidrogén és mindhárom
atom, metil-szulfonsav kialakítása. CH3.SO2 (OH) [Colba -
Metilunterschwefelelsaure].
Ezeknek a vegyületeknek a klór-ecetsavval való analógiája
akaratlanul rohant a szemébe; Valóban, az akkori képletekkel, kettővel
párhuzamos sorok, amint az a következő lemezről látható: H2O + C2CL6.S2O5
H2O + C2CL6.C2O3 H2O + C2H2CL4.S2O5 H2O + C2H2CL4.C2O3 H2O + C2H4CL2.S2O5
H2O + C2H4CL2.C2O3 H2O + C2H6.S2O5 H2O + C2H6.C2O3 Ez nem lépett ki a Colba-ból,
mely jegyzetek (I. p. 181. o.): "A fent leírt kombinált kénhez
savak és közvetlenül klorogénidszervikális savakban (fent
H2O + C2CL6.S2O5) A klór-tér savat adja, amelyet a név neveznek
klór-ecetsav. Folyékony klorogén - CCl (SL \u003d 71, c \u003d 12; most írunk
A C2Cl4 klór-etilén.), Mint tudod, a hatás alatt fénygé válik
klór B-hexakhloroethane, és várható, hogy ha egyidejűleg vízzel vízzel, akkor, mint egy bizmut-klorid, klór-antimon stb. Az oktatás pillanatában cserélje ki a klór oxigént. A tapasztalat megerősítette a feltételezést. "A fény és a
klór a C2CL4-en, aki víz alatt volt, Kolbe egy sorba került hexakhloretánnal
és triklór-ecetsavat és expresszálta az átalakítást egy ilyen egyenletgel: (mint C2CL4
a CCL4-ből kapható, ha egy anthered) csővel és CCL4-et továbbít
a cselekvés alatt alakult, a CL2 CS2-en, majd a kollégium reakciója volt
az U. sav első szintézise az elemektől.) "Egyidejűleg alakul ki
és a szabad sorval savak, nehéz megoldani, mert a klór azonnal
oxidálja azt u. sav "...
A britizerus felülvizsgálata kloroecetsavra
"Egy csodálatos módon (AUF EINE TIBERRASCHENDE WEISE) megerősítik
a kombinált kénsavak tulajdonságainak létezése és párhuzamosa, és mint én
Úgy tűnik (mondja Kolbe I. p. 186. o.), A hipotézisek régióból származik
nagyfokú valószínűséget szerez.
A szerves savak további felfedezéseinek előrejelzését a cikk megerősíti, amelyben a kísérletekre támaszkodik: "Nem
hihetetlen, hogy a jövőben kénytelenek leszünk a kombinált savakra
jelentős számú ilyen szerves savak, amelyek jelenleg
információink korlátai - elfogadjuk a hipotetikus radikákat ... ".
Ő is különös a radikális elméletéhez, megerősítve a korábban kifejezett kifejezést is. "Ami a kombinált savak helyettesítésének jelenségeit illeti, egyszerű magyarázatot kapnak abban, hogy különböző, valószínűleg izomorf vegyületek képesek egymásra cserélni egymást A kombinált csoportok szerepében, amelyek nem változtatnak lényegesen savas tulajdonságokkal együtt velük! "
Ennek a pillantásnak a további kísérleti megerősítése Frankland és Kolbe cikkben találjuk meg: "A bemutató alapján, hogy a sor összes savja
(CH2) 2NO4, épített, mint a metilcsinsav (most írunk cnh2no2 és
hívjuk a metilcsiszkát - ecetsavat. Kombinált B.
hangyasav-hidrogén csak az a tény, hogy csatlakozik
cianom, sinilsavat képez: a hangyasav ellentétes kialakulása
sinyl, az alkáli hatása alatt, semmi más, mint ismétlés
ismert konverzió a vízben az oxálsavban és ammóniában oldódik,
csak a különbséggel; hogy a képződés idején az oxálsavat kombinálják
kék sav hidrogénje. "
Az a tény, hogy a benzol-cianid (C6H5CN), például a Feling, nem savas tulajdonságokkal rendelkezik és nem képez Berlin lazuries lehet szerint Kolbe és Fanchanda, tegye párhuzamosan a képtelenség a klór-kloridot etil-a reakció AgNO3 , és az útmutatásuk helyessége Kolbe I.
Frankland a nitrilek módszerével továbbít eredményezi (nitrilek)
a kénsavak desztillációja KCN-vel (Duma és Malagetti módszer Lebedel):
R ".SO3 (OH) + KCN \u003d R.CN + KHSO4) U., Propionova (az akkori, met-aceton,) és
kőkronsav.
Ezután a következő évben a kolbe tette az alkálikus elektrolízist
a monoszuláris határok sói, és a rendszerüknek megfelelően
ez az ecetsav elektrolízisével, etán, szövetsav és
hidrogén:
H2o + c2h6.c2o3 \u003d H2 +,
És a valerian-oktán, a szenet és a hidrogén elektrolízisével: H2O + C8H18.C2O3 \u003d H2 +.
Az ecetsav kollégiumának munkája, ugyanakkor
más szerves savakat végül tisztáztuk a későbbi vegyészek szerepével.
csak a divízióhoz vezet - az elméleti megfontolások és a Gerard Hatóságának köszönhetően,
colza képletek felében, és lefordítani őket a strukturális nézetek nyelvére,
amelynek következtében a C2H6.C2O4H2 képlet CH3.CO (OH) lett.
A megszerzés módszerei:
Az ecetsav előállítására szolgáló fő technikai módszer a levegő oxigén acetaldehid oxidációja mangán katalizátorok jelenlétében.
acetaldehid ecetsav
Kémiai tulajdonságok:
Kölcsönhatás:
Fémek
Ecet-magnézium-acetát
Alkalmazás:
Az ecetsavat széles körben használják az iparban:
- Hús- és haltermékek
- Szintetikus (acetát) szál gyártása,
- Herbicidek termelése,
- Illatos anyagok és oldószerek szintézise,
- Bőr, textil és egyéb iparágakban,
- Széles körben használt ecetsav sók - acetátok.
Tanfolyam
a témán:
"Ecetsav"
Elvégzett: _____________
______________________
Ellenőrzött: _____________
______________________
Volgograd 2004.
Bevezetés ................................................. ......... 3
1. Az ecetsav nyílása ........................... 5
2. Az ecetsav tulajdonságai .........................13
3. Ecetsav előállítása ........................ 19
4. Az ecetsav alkalmazása ....................... 22
Következtetés ................................................. ..... 26
A használt hivatkozások listája .................. .. ... 27
Bevezetés
Ecetsav, CH3COOH, színtelen éghető folyadék éles illatú, jól oldódik vízben. Van egy jellegzetes savanyú íze, az elektromos áramvezetők.
Az ecetsav az egyetlen, aki tudta az ókori görögöket. Innen és annak neve: "Oksos" - savanyú, savanyú íz. Az ecetsav a szerves savak legegyszerűbb formája, amelyek a növényi és állati zsírok szerves részét képezik. Kis koncentrációkban van jelen az élelmiszer- és italtermékekben, és részt vesz a metabolikus folyamatokban a gyümölcsök érlelésben. Az ecetsav gyakran megtalálható a növényekben, állati kisülésben. Sókat és ecetsav-észtereket acetátoknak nevezik.
Az ecetsav gyenge (csak részben oldja vizes oldatban). Mivel azonban a savas tápközeg elnyomja a mikroorganizmusok élettartamát, az ecetsavat az élelmiszerek megőrzésében használják, például a marinádok részeként.
Az ecetsavat acetaldehid és egyéb eljárások oxidációjával állítjuk elő, az etanol ecetsav-ecetsav-fermentációja. Használt megszerezni gyógyászati \u200b\u200bés illatos anyagok, mint például egy oldószerben (például, a termelés cellulóz-acetát), a táblázat formájában ecetet gyártásához fűszerek, pácok, konzerveket. Az ecetsav számos metabolikus folyamatban részt vesz az élő szervezetekben. Ez az egyik illékony sav, amely szinte minden élelmiszerben, savanyú ízben és az ecet fő összetevőjében jelen van.
Ennek a munkának a célja: az ecetsav tulajdonságainak, termelésének és felhasználásának feltárása.
A tanulmány feladata:
1. Elmondani az ecetsav megnyitásának történetét
2. Az ecetsav tulajdonságainak tanulmányozása
3. Ismertesse az ecetsav előállítására szolgáló módszereket
4. feltárja az ecetsav használatának jellemzőit
1. Az ecetsav kinyitása
Az ecetsav szerkezete érdekli a kémikusok a triklór-ecetsav nyílása óta, mivel ez a felfedezés Berzelius elektrokémiai elméletének karbantartását okozta. Az utóbbi, forgalmazó elemek elektropozitív és elektronegatív, nem ismeri fel a helyettesítési lehetőségek a szerves anyagok, anélkül, hogy egy mély változás a kémiai tulajdonságok, hidrogén (elektropozitív elem) klórral (elemmel elektronegatív), és közben a megfigyelések, melyek Dumas (” Comptes rendös "a párizsi akadémia, 1839) kiderült, hogy" a klór bevezetése a hidrogén helyén nem változtatja meg a molekula teljesen külső tulajdonságait ... "Miért Duma és csodák", hogy az elektrokémiai nézetek és ötletek a polaritásról Az egyszerű testületek molekuláira (atomok), az ilyen egyértelmű tényekre, hogy a feltétel nélküli hit tárgyát képezik; ha hipotéziseknek kell tekinteni, ezek a hipotézisek a tények számára megfelelőnek kell lenniük, fel kell ismerni, folytatja hogy más. Szervetlen kémia, izomorfizmus, elmélet, a tényekről, jól ismert, kevéssé konzonáns elektrokémiai elméletekkel. A szerves vegyianyagban És ugyanazt a szerepet játssza az elmélet csere ... és talán a jövő fogja megmutatni, hogy mindkét nézetek szorosabb kapcsolatban vannak egymással, hogy követik az azonos okokból lehet összefoglalni ugyanazon a néven. Időközben az U. sav átalakítása kloro-ecetikus és aldehid formájában kloro-ecetikus és aldehidben klóroldehidben (klór), és abból a tényből, hogy ezekben az esetekben az összes hidrogén helyettesíthető egy klórral, anélkül, hogy megváltoztatná a fő kémiai természetét az anyag, lehet levonni, hogy a szerves kémiában vannak típusok, amelyek megőrzésre, majd amikor bemutatjuk azonos térfogatú klór-, bróm és jód, hogy a hidrogén helyett. Ez azt jelenti, hogy a helyettesítés elmélete a tényeken nyugszik, és a legrosszabb a szerves kémia. ". A svéd akadémia éves jelentésében (" Jahresbericht stb. ", Vol. 19, 1840, 370. o. ). BurtSellius közleményei: "Duma elkészített egy olyan vegyületet, amelyhez a Racionális képletet adja a C4CL6O3 + H2O-t (modern atomsúlyok, triklór-ecetsavat, vízzel anhidridvegyületnek tekintjük); Ez a megfigyelés számolva a Les Plus Eclatants de La Chimie Organique kitalra; Ez a helyettesítőelmélet alapja. amely az ő véleménye, a billentés elektrokémiai elméletek ..., és közben kiderül, hogy ez csak a képletet írási némileg eltérő, hogy egy vegyület oxalous sav. A megfelelő kloriddal, a C2CI6 + C2O4H2-vel, amely az oxálsavhoz és savhoz és sókhoz kapcsolódik. Ezért a vegyület ilyen anyanyelvével foglalkozunk, amelyek közül sok példa van; Sok ... egyszerű és összetett csoportok rendelkeznek, hogy az ingatlan az oxigént tartalmazó részét köthet kapcsolatban bázisok és elveszíteni őket, anélkül, hogy elveszítené a kapcsolatot a klórtartalmú része. Ezt a megjelenést nem adják meg a dumákban, és nem voltak kitéve tapasztalt ellenőrzésnek, és közben, ha igaz, akkor az új tanítás, a dumákban, a dumasban, a legtöbb elméleti elképzeléssel, a talaj lábai alatt menekülnek Meg kell esnie. A Berzalius-Cro2Cl2-t (a krómsav-anhidrid-kloridot) a Berzelius - Cro2Cl2 között (a króm-sav-anhidrid-kloridot is felszámolják) króm-anhidriddel: 3CRO2CI2 \u003d CRCL6 + 2CRO3), a Britzelius folytatódik: "A duma-klór-ecetsav nyilvánvalóan ehhez a vegyületekhez tartozik; Benne a széngyűrű oxigénnel és klórral van összekötve. Ez tehát oxálsav, amelyben a fele oxigént klórral vagy 1 atom (molekulák) oxálsavval helyettesítjük, 1 atom (molekula) félhűtő szén - C2CI6. Az első feltételezés nem fogadható el, mivel lehetővé teszi a klór 11/2, oxigénatomok helyettesítésének lehetőségét (a bátor oxálsav szerint C2O3.). A Dumasban a harmadik nézetet is tartja, amely teljesen összeegyeztethetetlen a kettővel, amelyen a klór nem helyettesíti oxigénnel, és az elektropozitív hidrogénatom, amely egy C4Cl6 szénhidrogénet képez, amely ugyanolyan tulajdonságokkal rendelkezik, amelynek tulajdonságai vannak egy komplex radikális, valamint a C4H6 vagy az acetil és egy képes, állítólag 3 oxigénatommal, hogy a W. W. tulajdonságok szerint savas savat kapjunk, de amint az összehasonlításból (fizikai tulajdonságaik), nagyon kitűnő tőle. "Amennyire Burtselius mélyen meggyőződött róla Az ecetsav és a triklór-ecetsav különböző alkotmánya, az õ és az évben tett megjegyzésből ("Jahresb", 19, 1840, 558) a Gerar (Journ. F. pr. ch. " XIV, 17): "Gerard, azt mondja, új pillantást vetett az alkohol, az éter és azok származékai összetételére; Ez a következő: Az ismert króm, az oxigén és a klór-vegyület \u003d Cro2Cl2, klóratom helyettesíti oxigénatom benne (értünk Berzelius 1 oxigénatomot króm-anhidrid - CrO 3). W. A sav C4H6 + 3O magában foglalja az oxálsav 2 atomot (molekulákat), amelyek közül az összes oxigénben hidrogénatommal helyettesített \u003d C2O3 + C2H6. És egy ilyen játék a képletekben töltött 37 oldalt. De a következő évben a dumák, a típusok elképzelésének fejlesztése jelezte, hogy az ingatlanok tulajdonságainak címeiről és a triklór-ecetsav tulajdonságairól beszélve kémiai tulajdonságaik identitása, vizuálisan kifejezve, például az analógiában lúgja: C2H3O2K + KOH \u003d CH4 + K2CO8 és C2CL3O2K + KOH \u003d CHCI3 + K2CO8, mivel a CH4 és a CHCI3 ugyanolyan mechanikai típusú képviselők. Másrészt, a Lubih és a Gremis nyilvánosan beszélt a helyettesítési elmélet talaján elért nagyobb egyszerűség javára, a klór-termelő hétköznapi éter és a formáló és az U. sav étere alapján Malagetti és Britzelius az új tények nyomását eredményezi az 5. ED-ben. A "LEHRBUCH DER CHEMIE" (az előszót 1842. novemberi jelöléssel), elfelejtve a Gerardról szóló éles felülvizsgálatát, feltéve, hogy a következőket írja le: "Ha visszahívjuk az ecetsav átalakulását (a szöveges bomlást) a klór hatása alatt klór-szemű savban (klór-klóroxalái-britzelius) trichlór-ecetsavat hív. ("Lehrbuch", 5 Ed., P. 629).), Úgy tűnik, lehetséges, hogy egy másik pillantást az ecetsav összetételére (ecetsavnak hívják Berzelius acetilsaure. ), Nevezetesen - kombinált oxálsav, amelyben a kombinált csoport (pazarling) C2H6, ugyanúgy, mint egy klórós sav kombinált csoportja C2CI6, majd az ecetsavra való klórt hatását csak a C2H6-ban a C2H6-ban lehet átalakítani . Nyilvánvaló, hogy lehetetlen eldönteni, hogy az ilyen reprezentáció helyesbb-e. .. azonban hasznos figyelmet fordítani rá. "
Így Berzeliusnak meg kellett ismernie a hidrogén-helyettesítés lehetőségét klórral anélkül, hogy megváltoztatná az eredeti test kémiai funkcióját, amelyben a csere következik be. Anélkül, hogy más vegyületekre néző nézeteinek függelékét megállnám, az ecetsavhoz, majd más határértékű mono-abnormális savakhoz fordulok, akkor számos tényt találtak, amelyek harmonizáltak a Bercelius (Gerard) nézeteihez. A Kolbe műveinek kezdeti pontja kristályos anyagként, a CCL4SO2 készítménye, amelyet Berzelius és Marsa korábban a Royal Vodka CS2-en végzett, és a CS2-es kollégiumban alakult ki a CS2-ben. Kolbe átalakítása közelében (lásd Kolbe, "Beitrage Znr Kenntniss der Gepaarten Verbindungen" ("Ann. Ch. U. u. pp", 54, 1845, 145).) Azt mutatta, hogy ez a test képviseli, modern nyelv, klór anhidrid triklór-metil-szulfonnal Sav, CCL4SO2 \u003d CCL3.SO2CI (KOHLENSUPERCHLOROD SCHWEFLIGHIGSAURE KOLBE), alkalis-specifikus savas sav, CCL3.SO2 (OH) [Colba, de + C2Cl3S2O5 - ChlorkohlenunurschweSelsaure] (Atom súlyok: H \u003d 2, Cl \u003d 71, C \u003d 12 és o \u003d 16; és ezért a modern atomtömegekkel, a C4SL6S2O6H2.), Ami a cink hatása alatt először egy atom hidrogénatommal helyettesíti, a CHCl2.SO2 (OH) savat képezi [Colbet - Wasserhaltige klorformylunterschwefelsaure ( Britzelius ("Jahresb" 25, 1846, 91) megjegyzi, hogy az S2O5 ditionsav kloroformálással történő kombinációjával helyes, miért CCL3SO2 (OH) KohleSuperClorurur (C2CI6) - ditionsaure (S2O5). Hidratál, A szokásos módon a Burtselliusot nem veszik figyelembe..), És állítsa be EM és a másik, a CH2CI 2 (OH) savat képezve [OH) [Colbe - kloralaylunterschwefelelsaure], és végül az áram vagy kálium-amalgám helyreállításakor (a reakció röviddel az olvadékot, mielőtt az olvadékot az ecet-re csökkentjük .) A hidrogén és mindhárom atom helyettesítése, metil-szulfonsav kialakítása. CH3.SO2 (OH) [Colbet - Methylterschwefelsaure]. Ezeknek a vegyületeknek a analógiája klór-ecetsavval szokatlanul feltűnő volt; Valójában az akkori formuláknál két párhuzamos sorot kaptunk, amint az a következő lemezen látható: H2O + C2CIL6.S2O5H2O + C2CIL6.C2O3H2O + C2H2CI3H2O5H2O + C2H2CIL4.C2O3H2H2CIL4CICICO3H2O + C2H4CIL2O3H2O + C2H4CIL2.S2O5 H20 C2H4CL2.C2O3 H2O + C2H6. S2O5 H2O + C2H6.C2O3 Ez nem csúszott el a Colba-tól, amely észrevegyük (I. P. 181): "a fent leírt kombinált kénsavakhoz és közvetlenül klór-szén felett - H2O + C2CL6. S2O5) a klórmentes savat, amely klór-ecetsavat ismert. Folyékony klór-szén - CCl (CL \u003d 71, C \u003d 12; Most írjuk a C2Cl4-et klór-etilén.), Mint tudod, a klór - hexakhloroetán (az akkori nómenklatúra - KohleSuperChlorur) szerint fénybe fordulunk, és Azt várhatja, hogy ha egyidejűleg vízzel van ellátva vízzel, akkor, mint egy bizmut klorid, klór-antimon stb. Az oktatás pillanatában cserélje ki a klór-oxigént. A tapasztalat megerősítette a feltételezést. "A C2CL4-en lévő fény és klór hatására, amely víz alatt volt, a kollége hexaklór-etánnal és triklór-ecetsavval kapott, és az átalakulást ilyen egyenletsel expresszálta: (mivel a CCL4-t a CCL4-ből kaphatjuk Antawed csően keresztül továbbítva, és a CCl4-t cselekvés közben alakítjuk ki, CL2 CS2-re, a Kolbe-reakció az első időben az ecetsav szintézisével az elemekből származik.) "Nehéz egyidejűleg eldönteni, és ez Nehéz megoldani azt, mivel a klór azonnal oxidálja az ecetsavban "... a klór-ecetsavra való bercélium nézete" csodálatos módon (AUF Eine TierraSchende Weise) megerősíti a kombinált kénes savak, és úgy tűnik számomra (mondja Kolbe I. 186. o.), jön ki a hipotézisek régiójából, és magas fokú valószínűséget szerez. Ha a klóroh-anoxalátot (Chlorkohlenoxalsure, a kollektoros klónt, a klór-ecetsavat) a klór-ecetsavat tartalmazza. : C2h6.c2o3 (ez egy pillantás, korábban Gerard kifejezve). Nem hihetetlen, hogy a jövőben arra kényszerülünk, hogy a kombinált savak esetében jelentős számú szerves savakat vegyenek fel, amelyben jelenleg a korlátozott információk alapján - elfogadjuk a hipotetikus radikákat ... "Ami a Ezekben a kombinált savak szubsztitúciójának jelenségeinek, egyszerű magyarázatot kapnak abban a tényben, hogy a különböző, valószínűleg izomorf vegyületek képesek egymásra cserélni egymást a kombinált csoportok (ALS RARLINGE, L. PP 187), anélkül, hogy megváltoztatnák az esszenciális sav tulajdonságokat A testet velük kombinálta! "További kísérleti megerősítés Ez a megjelenés Frankland és Kolbe cikkben találjuk meg:" Ueber Die Chemische alkotmány Der Sauren der Reihe (CH2) 2NO4 und Der Unter Den Namen "Nitril" Bekannten Verbindungen "(" Ann. Chem . n. Pharm. ", 65, 1848, 288). A prezentáció alapján, hogy a sorozat (CH2) 2NO4-es savja, mint a metil-keletű sav (most írjuk a CNH2NO2-t, és hívjuk a metylchy savas sav - ecet.), Ha a képlet H2O + H2 .C2O3 képviseli az igazi expresszióját a racionális készítmény hangyasav, azaz, ha úgy ítélik meg a oxálsav, kombinálva egy ekvivalens hidrogén (a kifejezés nem igaz; N helyett Frankland és Kolbe használ egy keresztezett betűt, amely megfelel 2 N.), akkor az ammónium antioxid sav magas hőmérsékletű transzformációjával könnyen magyarázható vizes sinilsavvá, mert ismert, és a DOBERER-ot megtalálják hogy az ammónium vastagságát vízbe és ciánné melegítjük. A gyógyfémsavval kombinált hidrogén csak akkor vehető igénybe a hidrogén a reakcióban csak azzal a ténnyel kapcsolatban, hogy összekapcsolja a ciánkék sinil-savat képez: a lúgosok kék hatásának hátrameneti képződése semmit sem jelent, mint a Cyana ismert átalakításának ismétlése az oxálsavban és ammóniában oldott vízben, csak a különbséggel; Ez a képződés idején az oxálsavat kék sav hidrogénnel kombináljuk. "Az a tény, hogy a benzol-cianid (C6H5CN), például a felingben, nincs savas tulajdonságai, és nem formálja Berlin Lazari-t a Kolbol szerint és Frankland, tegye párhuzamosan képtelen a klór-kloridot kloriddal való reakció AgNO3, és helyességét a lerakódásának Kolbol és Frankland bizonyítani szerinti szintézis nitril módszerrel (nitrilek szerezték desztillációjával kénsavak, KCN (módszerével Dumas és malagett Lebed): R. ".SO3 (OH) + KCN \u003d R. CN + KHSO4) ecetsav, propionic (az akkori, met-aceton,) és kőkrónsav, majd a következő évben, a kollégium electrolycial sói mono-axiális limit savak és, egyetértésben a rendszert, megfigyelhető volt az elektrolízis ecetsav, Oktatási etán, coalic-ecetsavval és hidrogén: H2O + C2H6.C2O3 \u003d H2 +, és a macskagyökér elektrolízis - oktán, Szalonsav és hidrogén: H2O + C8H18.C2O3 \u003d H2 +. Nem lehet azonban észrevenni, hogy a kolbe az ecetsav-metil (CH3) "-ból várt, hidrogénnel, azaz a mocsárgázzal és a valerián-butil-C4H9-ből, azaz a hidrogénnel, azaz C4H10-hez (Hívja a C4H9-et), De ebben a várakozásban meg kell tekinteni az állampolgárság jelentős jogait a Gerar képletei általi jelentős jogokhoz való hozzárendeléséhez, aki elhagyta az ecetsavat, és nem a C4H8O4-nek tekintette, hogy a kriotoszkópos adatok alapján ítéli meg, És valójában, és a C2H4O2 esetében, az összes modern kémiai tankönyvben.
A COLLÉE működik ecetsav, és ugyanabban az időben, és minden más szerves savak végül tisztázódott, és a szerepe a későbbi vegyészek csökkent csak a Division - elvi okok miatt, és a hatóság Gerard, a Repce képletek a felére, és hogy lefordítsa őket a szerkezeti nézetek nyelvére, hogy a C2H6.C2O4H2 képlet CH3.CO (OH) lett.
2. Az ecetsav tulajdonságai
A karbonsavak olyan szerves vegyületek, amelyek egy vagy több karboxilcsoportot tartalmaznak, amely szénhidrogéncsoporthoz kapcsolódik.
A karbonsavak savas tulajdonságai az elektronsűrűségnek a karbonil-oxigénhez való elmozdulásának köszönhetők, és az O-N kommunikáció polarizációjának további (az alkoholokhoz képest) okozták.
Vizes oldatban a karbonsavak disszociálják Ions:
A vízben lévő savak molekulatömegű oldhatóságának növekedésével csökken.
A karboxilcsoportok száma szerint a savakat monokuláris (monokarbonikus) és több tengelyre osztjuk (dikarboxil-, tricarboxyle stb.).
A szénhidrogéngyök jellege szerint a savakat megkülönböztetett, telítetlen és aromás.
A szisztematikus savas neveket a megfelelő szénhidrogén neve adja meg, az utótag hozzáadásával -com És szavak sav . Triviális neveket is használnak.
Némi korlátos monoise savak
A karbonsavak magas reaktivitást mutatnak. Különböző anyagokkal reagálnak, és számos vegyületet alkotnak, köztük nagy jelentőségűek funkcionális származékok . A karboxilcsoport reakciói következtében kapott vegyületek.
2.1 Só képződése
a) A fémekkel való kölcsönhatáskor:
2RCOOH + MG ® (RCOO) 2 mg + h 2
b) metal-hidroxidokkal való reakciókban:
2RCOOH + NaOH ® RCOCA + H 2 O
A karbonsavak helyett halogén chidridjaikat gyakran használják:
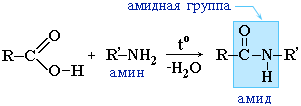 |
Amidokat, szintén képződik a kölcsönhatás a karbonsavak (ezek halogenantrides vagy anhidridek) szerves ammóniával származékok (aminok):
Az amidok fontos szerepet játszanak a természetben. A természetes peptidek és fehérjék molekulái a-aminosavakból állnak az amidcsoportok - peptidkötegek részvételével.
Ecetsav (maratósav).
Formula: CH3 - SOAM; átlátszó színtelen folyadék éles illatú; Az olvadáspont alatt (MP. 16,6 ° C) hasonló a jégtömeghez (ezért a koncentrált ecetsav is jeges ecetsavnak is nevezik). Vízben, etanolban oldódik.
1. táblázat: Az ecetsav fizikai tulajdonságai
A szintetikus élelmiszer-ecetsav színtelen, átlátszó, gyúlékony folyadék, amely éles illatú ecet. A szintetikus élelmiszer-ecetsavat metanolból és szén-monoxidból állítjuk elő a ródium katalizátorban. A szintetikus élelmiszer-ecetsavat a kémiai, gyógyszerészeti és könnyűiparban, valamint az élelmiszeriparban tartósítószerként használják. Formula CH 3 Coxy.
A szintetikus élelmiszer-ecetsavat bepároljuk (99,7%) és vizes oldat (80%) formájában.
A fizikai és kémiai mutatókban a szintetikus élelmiszer-ecetsavnak meg kell felelnie a következő szabványoknak:
2. táblázat: Alapvető műszaki követelmények
| A mutató neve | Norma |
| 1. Megjelenés | Színtelen, átlátszó folyadék mechanikus szennyeződés nélkül |
| 2. Vízoldékonyság | Teljes, megoldás átlátszó |
| 3. Az ecetsav tömegrésze,%, nem kevesebb | 99,5 |
| 4. Az ecetsav-aldehid tömegrésze,%, többé | 0,004 |
| 5. A hangyasav tömegrésze,%, többé | 0,05 |
| 6. A szulfátok tömegrésze (SO 4),%, többé | 0,0003 |
| 7. A kloridok tömegrésze (CL),%, többé | 0,0004 |
| 8. A hidrogén-szulfid (PB) által kicsapott nehézfémek tömegrésze,%, többé | 0,0004 |
| 9. A vas tömegrésze (FE),%, többé | 0,0004 |
| 10. A nem illékony maradványok tömegrésze,%, többé | 0,004 |
| 11. A mangán-szilárd kálium-oldat színének stabilitása, min, nem kevesebb | 60 |
| 12. tömegtörtje anyagok oxidált két tengely kálium, cm3 nátrium-tioszulfát-oldattal, C koncentrációt (Na 2SO 3 * 5H 2O) \u003d 0,1 mol / dm 3 (0,1 H), nem több, | 5,0 |
Szintetikus élelmiszer ecetsav - tűzveszélyes folyadék, mértéke szerint a hatása a test utal, hogy a anyagokat a 3. veszélyességi osztály. Ecetsavval való munkavégzés esetén alkalmazni kell egyéni eszközök védelem (gázmaszkok szűrése). Első segítségnyújtás az égési sérülésekben - bőséges öntözés vízzel.
Szintetikus élelmiszer ecetsavat öntjük tiszta vasúti tartálykocsik, tartály teherautók egy belső felülete rozsdamentes acélból, a konténerek, konténerek és rozsdamentes acélból készült hordó egy kapacitása akár 275 dm3, valamint üvegek és polietilén hordó kapacitású legfeljebb 50 dm3. A polimer tartály alkalmas az öbölre és ecetsav tárolására egy hónapra. A szintetikus élelmiszer-ecetsav lezárt rozsdamentes acéltartályokban tárolódik. A tartályokat, a tartályokat, hordókat, palackokat és műanyag lombikokat tároló helyiségekben vagy lombkorona alatt tárolják. Az erős oxidizátorokkal (salétromsav, kénsav, kálium-permanganát stb.) Tárolás nem megengedett.
A 12x18h10t vagy 10x17h13m2t rozsdamentes acélból készült vasúti tartályokban szállítják, a felső szilva.
3. Ecetsav előállítása
Az ecetsav a legfontosabb vegyi termék, amelyet széles körben használnak az iparban az észterek, monomerek (vinil-acetát), az élelmiszeripar stb. A világ termelése évente 5 millió tonna. Az ecetsav előállítása a közelmúltig petrolkémiai nyersanyagokon alapult. A Walker-folyamatban az enyhe körülmények között az etilént levegő oxigénnel oxigént oxidáljuk acetaldehidnek a PDCL2 és CUCl2 katalitikus rendszer jelenlétében. Ezután az acetaldehidet ecetsavra oxidáljuk:
CH2 \u003d CH2 + 1/2 O2 CH3CHO CH3COOH
A másik módszer, ecetsavat oxidálása útján kapott, H-bután hőmérsékleten 200 ° C és nyomása 50 atm jelenlétében egy kobalt katalizátor.
Az elegáns Walker folyamat a petrolkémia fejlesztésének egyik szimbóluma - fokozatosan helyettesíti az új módszereket a szénre szabott anyagok használatán alapulva. A metanolból származó ecetsav előállítására szolgáló módszereket fejlesztettek ki:
CH3OH + CO CH3COOH
Ez a reakció, amelynek nagy ipari értéke kiváló példa a sikerre. homogén katalízis. Mivel a reakció - CH3OH és CO mindkét komponense a szénből származhat, a karbonilezési eljárásnak gazdaságosabbá kell válnia, mint az olajárak emelkedése. Két ipari metanol-karbonilezési eljárás van. A BASF-ben kifejlesztett régebbi módszerben kobalt katalizátort alkalmaztunk, a reakciókörülmények merevek voltak: 250 ° C hőmérséklet és nyomás 500-700 atm. Egy másik eljárásban egy másik eljárásban ródiumkatalizátort alkalmaztunk, a reakcióelegyet alacsonyabb hőmérsékleten (150-200 ° C) és nyomáson (1-40 atm) végeztük. Érdekes a folyamat megnyitásának története. A tudósok cégek vizsgálták a hidraulációt riforifoszfin katalizátorok segítségével. A petrolkémiai részleg technikai igazgatója azt javasolta, hogy ugyanazt a katalizátort alkalmazzuk a metanol karbonilálására. A kísérletek eredményei negatívak voltak, és ezek kapcsolódtak a fém-szén-dioxid-csatlakozás kialakításának nehézségéhez. Mindazonáltal emlékezünk arra, hogy a vállalat tanácsadójának előadása a jód-metil-fémkomplexek számára a legegyszerűbb oxidatív csatlakozásáról, a kutatók úgy döntöttek, hogy egy jód promótert adnak a reakcióelegyhez, és ragyogó eredményt kaptak, amelyet először nem hittek. Az ilyen felfedezést a "Union Carbide" versenytárs vállalatából álló tudósok is tették, mindössze néhány hónap múlva. Egy csapat metanolt karbonilezési technológia mindössze 5 hónapos intenzív munka létrehozott ipari folyamat a Monsanto, amellyel 150 ezer tonna ecetsavat kapunk 1970. Ez a folyamat a tudomány területének kikötője volt, amelyet C1 kémia neveznek.
A karbonilezési mechanizmust gondosan vizsgáltuk. A reakció megvalósításához szükséges jód-metil-t egyenletesen kapjuk
CH3OH + HI CH3I + H2O
A katalitikus ciklus bemutatható:
A lapos nagyságú komplex - (i) opsisibly csatlakozik a metil-, a kialakulása egy hat-koordinációs komplex II, majd eredményeként a bevezetése Metil-Rhodes, acetylrody komplex (III) van kialakítva. Az ecetsav odanhidrid redukálása regenerálja a katalizátort, és a jódid hidrolízisét ecetsavat termel.
Ipari ecetsav szintézis:
a) A bután katalitikus oxidációja
2CH3-CH2-CH2-CH3 + 5O2 T 4CH3COOH + 2H2O
b) A szén-oxid (II) és a metanol keverékét nyomás katalizátoron melegítjük
CH3OH + CO CH3COOH
Ecetsav-fermentáció (ecetsav-fermentáció) előállítása.
Nyersanyagok: Etanol-változó folyadékok (bor, született gyümölcslevek), oxigén.
Kiegészítő anyagok: ecetsavbaktériumok enzimei.
Kémiai reakció: Az etanolt biokatinálisan oxidáljuk ecetsavra.
CH 2 - CH - HE + O 2 CH 2 - SOAM + H 2 O
Fő termék: ecetsav.
4. Az ecetsav alkalmazása
Az ecetsavat gyógyászati \u200b\u200bés illatos anyagok előállítására használják oldószerként (például cellulóz-acetát előállításához), asztali ecet formájában, fűszerek, marinádok, konzervek gyártása során.
Az ecetsav vizes oldatát íz- és tartósítóeszközként alkalmazzuk (étkezés, marináló gomba, zöldségek).
Az ecet összetétele olyan savakat tartalmaz, mint az alma, tejtermék, aszkorbiás, ecet.
Apple ecet (4% ecetsav)
Az Apple Ecet 20 legfontosabb ásványi anyagot és mikroelemeket, valamint ecet-, propionic, tejet és leminsavSzámos enzim és aminosav, értékes ballasztanyag, például potash, pektin. Az Apple ecetet széles körben használják különböző ételek és megőrzés előkészítésében. Teljesen kombinálva mindenféle salátával, mind a friss zöldség, mind a hús és a hal. A tengeri hús, az uborka, a káposzta, a kapribogyók, a portulák, valamint a szarvasgomba. Nyugaton azonban az Apple ecet ismerte orvosi tulajdonságok. Az emelkedett vérnyomás, a migrén, az asztma, a fejfájás, az alkoholizmus, a szédülés, arthritis, a vesék, a magas hőmérséklet, az égések, az alkupozás stb.
Az egészséges emberek minden nap ajánlottak, hogy hasznos és frissítő italt használjanak: egy pohár vízben keveredünk egy kanál mézet és add 1 kanálot apple ecet. Ha fogyni akar, javasoljuk minden alkalommal, amikor az étkezés közben egy pohár szennyvizet ivott, két kanál almás ecettel.
Az ecetet széles körben használják az otthoni konzervdobozokban a különböző erődök marinádjainak előkészítéséhez. BAN BEN népi gyógymód Az ecetet nem specifikus lázcsillapítólagként használják (a bőr és az ecetet 3: 1 arányú oldatával, valamint a folyó módszerével. Az ecet használata gyakori a rovarcsípéssel tömörítéssel.
Ismeretes, hogy alkoholtartalmú ecetet használ a kozmetikában. Nevezetesen, hogy a kémiai hajlítás és az állandó szín után lágyság és fényes haj. Ehhez, a haj ajánlott öblítse meleg vízzel alkohol hozzáadásával ecet (per 1 liter víz - 3-4 kanál ecetet).
Ecetes szőlő (4% -os ecetsav)
A szőlőecetet széles körben használják a vezető szakácsok nemcsak Szlovénia, hanem a világ minden táján. Szlovéniában hagyományosan különböző növényi és szezonális saláták előkészítéséhez használják (2-3 evőkanál kanál saláta tálban), mert Ő adja az étel egyedülálló és kifinomult ízét. A szőlőecetet is tökéletesen kombinálják a tengeri termékek különböző halsalátaival és ételekkel. Amikor különböző húsfajtákból származó kebabokat főzünk, de különösen a sertéshúsból, a szőlőecet egyszerűen elengedhetetlen.
Az ecetsavat gyógyszerek előállítására is használják.
A tabletták az aszpirin (ok) tartalmaznak egy hatóanyag-acetilszalicilsavat, amely ecet-éter szalicil sav.
Acetilszalicilsav A szalicilsavat vízmentes ecetsavval melegítjük kis mennyiségű kénsav jelenlétében (katalizátorként).
Nátrium-hidroxiddal (NaOH) vizes oldatban melegítjük, az acetilszalicilsavat nátrium-szalicilát és nátrium-acetát hidrolizáljuk. Amikor a tápközeget megsavanyítjuk, a szalicilsav-vízesés kicsapódik, és olvadásponttal (156-1600 ° C) azonosítható. A hidrolízis során kialakított szalicilsav azonosításának másik módja, hogy az oldatot sötét lila színre festjük, ha vas-kloridot (FECL3) adunk hozzá. A szűrletben jelen lévő ecetsav etanollal és kénsavval etoxi-etanollal történő fűtésgé alakul, amelyet könnyen fel lehet ismerni a jellemző szaga. Ezenkívül az acetilszalicilsavat különböző kromatográfiás módszerekkel lehet azonosítani.
Az acetilszalicilsav kristályosodik színtelen monoklinos polihedra vagy tűk, egy kis savanyú ízléssel. Száraz levegőben stabilak, de nedves tápközegben fokozatosan szalicilsavra és ecetsavra (Leeson és Mattocks, 1958, Stempel, 1961). A tiszta anyag egy fehér kristályos por, amely szinte nem rendelkezik a szaggal. Az ecetsav szaga azt jelzi, hogy az anyag hidrolizén. Az acetilszalicilsav lúgos hidroxidok, lúgos bikarbonátok, valamint forró vízben történő észterezésnek van kitéve.
Az acetilszalicilsav gyulladásgátló, lázcsillapító, valamint fájdalmas hatású, és széles körben használják a lázas állapotok, a fejfájás, a neuralgia stb.
Az ecetsavat alkalmazzuk és a vegyiparban (acetil-cellulóz előállítása, amelyből az acetátszálakat kapjuk, szerves üveg, film, színezékek, gyógyszerek és észterek szintéziséhez), nem éghető filmek, illatanyagtermékek előállítása során , oldószerek, a színezékek szintézisében, gyógyszerekpéldául az aszpirin. Az ecetsavókat a növények kártevők elleni küzdelemre használják.
Következtetés
Tehát ecetsav (CH3COOH), színtelen éghető folyadék éles szaga, jól oldódik vízben. Van egy jellegzetes savanyú íze, az elektromos áramvezetők. Az ecetsav használata az iparágban nagyon nagy.
Az Oroszországban előállított ecetsav a legjobb világszínvonal szintjén áll, magas kereslet a világpiacon, és a világ számos országába exportálja.
Az ecetsav előállítására számos egyedi követelményeknek, ezért a szakemberek szükségesek, amelyeknek nagy tapasztalattal nem csak az automatizálás területén és folyamatmenedzsment és eljárások, hanem tisztán a különleges követelmények ebben az iparágban.
A használt irodalom listája
1. Artemenko, Alexander Ivanovich. Hivatkozási útmutató a kémia / A.I. Artyomenko, i.v. Tikunova, V.A. Férfi. - 2. Ed., Pererab. és add hozzá. - M.: Felső iskola, 2002. - 367
2. Akhmetov, Nail Sibgatovich. Általános és szervetlen kémia: tankönyv a csapra. Him.-Tehnol. szakember. Egyetemek / Akhmetov N.-4. ED. / Egyetem - M.: Felső Iskola, 2002.-743 p.
3. Berezin, Boris Dmitrievich. A modern szerves kémia útja: Tanulmányok. Tanulmányi kézikönyv egyetemek, szabadidő. Him.-Tehnol. Spec. / Berezin B.D., Berezin D. B.-M.: Felső iskola, 2001.-768 p.
4. I. G. Bolsheov, G. S. Zaitseva. Karbonsavak és származékaik (szintézis, reakciókészség, szerves szintézis alkalmazás). Módszertani anyagok a szerves kémia általános folyamán. 5. kiadás: Moszkva 1997
5. Zommer K. Az akkumulátor kémia ismerete. Per. Vele., 2. ed. - M.: Mir, 1985. - 294 p.
6. Karakhanov e.a. Szintézisgáz az olaj alternatívájaként. I. Fischer-Tropsch folyamat és oxo-szintézis // szíriai oktatási magazin. 1997. No. 3. P. 69-74.
7. Karavaev M.., Leonov E.V., Popov, I.G., SHEPELEV E.T. Szintetikus metanol technológiája. M., 1984. 239 p.
8. Catalízis C1 kémiai / ed. V. Kima. M., 1983. 296 p.
9. Reutov, Oleg Aleksandrovich. Szerves kémia: tutorial for stud. egyetemek, szabadidő. például és különleges. "Kémia" / Reutov O.a., Kurtz A.l. Butin K.p.-M.: Moszkvai Állami Egyetem Kiadója.-21 Lásd CH. 1.-1999.-560 p.
10. szovjet enciklopédikus szótár, ch. Ed. A.M. Prokhorov - Moszkva, szovjet enciklopédia, 1989
11. Kémia: Referencia útmutató, ch. Ed. N.r. Lieberman - St. Petersburg, Publishing House "Chemistry", 1975
12. Kémia: Szerves kémia: Edző kiadás 10 cl. környezetek SHK. - Moszkva, megvilágosodás, 1993
Sommer K. Tudás akkumulátor a kémiaban. Per. Vele., 2. ed. - M.: Mir, 1985. P. 199.
I. G. Bolsheov, G. S. Zaitseva. Karbonsavak és származékaik (szintézis, reakciókészség, szerves szintézis alkalmazás). Módszertani anyagok a szerves kémia általános folyamán. Kiadás 5. Moszkva 1997 P. 23
Sommer K. Tudás akkumulátor a kémiaban. Per. Vele., 2. ed. - M.: Mir, 1985. P. 201
Karakhanov e.a. Szintézisgáz az olaj alternatívájaként. I. Fischer-Tropsch folyamat és oxo-szintézis // szíriai oktatási magazin. 1997. No. 3. P. 69
Sommer K. Tudás akkumulátor a kémiaban. Per. Vele., 2. ed. - M.: Mir, 1985. P. 258.
Sommer K. Tudás akkumulátor a kémiaban. Per. Vele., 2. ed. - M.: Mir, 1985. P. 264