A foszforiláció típusai a szervezetben. ATP szintézis oxidatív foszforilációval. Az oxidatív foszforiláció gátlói
Az energia vezető szerepe a metabolikus úton a folyamattól függ, melynek lényege az oxidatív foszforiláció. A tápanyagok oxidálódnak, energiát termelnek, amelyet a szervezet ATP-ként a sejtek mitokondriumaiban tárol. A földi élet minden formájának megvannak a maga kedvenc tápanyagai, de az ATP univerzális vegyület, és az oxidatív foszforiláció által termelt energiát elraktározzák az anyagcsere folyamatokhoz.
Baktériumok
Több mint három és fél milliárd éve jelentek meg bolygónkon az első élő szervezetek. Az élet a Földön annak köszönhető, hogy a feltörekvő baktériumokat - prokarióta szervezeteket (mag nélkül) két típusra osztották a légzés és a táplálkozás elve szerint. Légzés útján - aerob és anaerob, valamint táplálkozás útján - heterotróf és autotróf prokariótákba. Ez az emlékeztető valószínűleg nem lesz felesleges, mert az oxidatív foszforiláció nem magyarázható meg alapfogalmak nélkül.
Tehát az oxigénnel kapcsolatban (fiziológiai besorolás) a prokarióták aerob mikroorganizmusokra oszthatók, amelyek nem törődnek a szabad oxigénnel, és aerob mikroorganizmusokra, amelyek létfontosságú tevékenysége teljes mértékben függ a jelenlététől. Ők végzik az oxidatív foszforilációt, szabad oxigénnel telített környezetben. Ez a legelterjedtebb metabolikus út, amely az anaerob fermentációhoz képest nagy energiahatékonysággal rendelkezik.

Mitokondriumok
Egy másik alapkoncepció: Ez a cella energia akkumulátora. A mitokondriumok a citoplazmában találhatók, és hihetetlenül sok van belőlük - például az ember izmaiban vagy a májában a sejtek akár másfél ezer mitokondriumot tartalmaznak (pontosan ott, ahol a legintenzívebb anyagcsere zajlik). És amikor oxidatív foszforiláció történik a mitokondriumok kezében, akkor az energiát is tárolják és elosztják.
A mitokondriumok nem is függnek a sejtosztódástól, nagyon mozgékonyak, szabadon mozognak a citoplazmában, amikor szükségük van rá. Saját DNS-ük van, ezért függetlenül születnek és halnak meg. Ennek ellenére a sejt élete teljes mértékben rajtuk múlik, mitokondriumok nélkül nem működik, vagyis az élet valóban lehetetlen. A zsírok, szénhidrátok és fehérjék oxidálódnak, ennek eredményeként hidrogénatomok és elektronok képződnek - redukáló ekvivalensek, amelyek továbbhaladnak a légzési lánc mentén. Így megy végbe az oxidatív foszforiláció, melynek mechanizmusa látszólag egyszerű.

Nem olyan könnyű
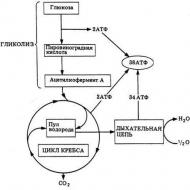
A mitokondriumok által termelt energia egy másikká alakul át, ami az elektrokémiai gradiens energiája, amely tisztán a mitokondriumok belső membránján található protonokra vonatkozik. Ez az energia szükséges az ATP szintéziséhez. És pontosan ez az oxidatív foszforiláció. A biokémia meglehetősen fiatal tudomány, csak a tizenkilencedik század közepén fedezték fel a sejtekben a mitokondriális granulátumokat, és az energiaszerzés folyamatát jóval később írták le. Megfigyelték, hogy a glikolízis során képződő triózok (és legfőképpen a piroszőlősav) hogyan hoznak létre további oxidációt a mitokondriumokban.
A triózok a hasadás energiáját használják fel, amiből CO 2 szabadul fel, oxigént fogyasztanak, és hatalmas mennyiségű ATP szintetizálódik (adenozin-trifoszforsav, és mi az - a testépítés iránt érdeklődők különösen jól tudják). A fenti folyamatok mindegyike szorosan összefügg az oxidációs ciklusokkal, valamint az elektronokat szállító légzési lánccal. Így a sejtekben oxidatív foszforiláció történik, „üzemanyagot” szintetizálva számukra - ATP-molekulákat.

Oxidációs ciklusok és légzési lánc
Az oxidatív ciklusban a trikarbonsavak elektronokat szabadítanak fel, amelyek az elektrontranszport lánc mentén kezdik meg útjukat: először a koenzim molekulákhoz, itt a NAD a fő (nikotinamid-adenin-dinukleotid), majd az elektronok átkerülnek az ETC-be (elektrotranszport lánc), amíg molekuláris oxigénnel egyesülnek, és nem alkotnak vízmolekulát. Az oxidatív foszforiláció, amelynek mechanizmusát fent röviden ismertettük, egy másik hatáshelyre kerül át. Ezek a mitokondriumok belső membránjába ágyazott fehérjekomplexek.
Itt következik be a csúcspont – az energia átalakítása az elemek oxidációja és redukciója során. Érdekes itt az elektromos szállítási lánc három fő pontja, ahol az oxidatív foszforiláció megtörténik. A biokémia ezt a folyamatot nagyon mélyen és körültekintően vizsgálja. Talán egyszer innen születik új gyógymód az öregedés ellen. Tehát ennek a láncnak a három pontján az ATP foszfátból és ADP-ből (adenozin-difoszfátból - amely ribózból, adeninből és két rész foszforsavból áll) képződik. Ezért kapott a folyamat ilyen nevet.

Sejtlégzés
A sejtes (más néven szöveti) légzés és az oxidatív foszforiláció ugyanannak a folyamatnak a közös szakaszai. A levegőt a szövetek és szervek minden sejtje felhasználja, ahol a bomlástermékek (zsírok, szénhidrátok, fehérjék) lebomlanak, és ez a reakció energia formájában raktározódik. eltávolítják belőle a dioxidot .
A test mindig aktív, energiáját mozgásra és növekedésre, önreprodukcióra, ingerlékenységre és sok más folyamatra fordítja. Pontosan ezért megy végbe a mitokondriumokban az oxidatív foszforiláció. három szintre osztható: ATP oxidatív képződése piroszőlősavból, valamint aminosavakból és zsírsavakból; az acetilmaradékokat a trikarbonsavak elpusztítják, majd két szén-dioxid molekula és négy pár hidrogénatom szabadul fel; az elektronok és a protonok átkerülnek a molekuláris oxigénbe.
További mechanizmusok
A sejtszintű légzés biztosítja az ADP képződését és utánpótlását közvetlenül a sejtekben. Bár a szervezet más módon is feltöltheti magát. Erre a célra további mechanizmusok léteznek, és szükség esetén aktiválódnak, bár nem olyan hatékonyak.
Ezek olyan rendszerek, amelyekben a szénhidrátok oxigénmentes lebontása történik - glikogenolízis és glikolízis. Ez már nem oxidatív foszforiláció, a reakciók némileg eltérőek. A sejtlégzés azonban nem állhat meg, mivel folyamata során az esszenciális vegyületek nagyon szükséges molekulái képződnek, amelyeket különféle bioszintézisekhez használnak fel.

Az energia formái
Amikor az elektronokat a mitokondriális membránban áthelyezik, ahol oxidatív foszforiláció megy végbe, az egyes komplexeiből származó légzőláncok a felszabaduló energiát a protonok membránon keresztül történő mozgatására irányítják, vagyis a mátrixból a membránok közötti térbe. Ekkor potenciálkülönbség keletkezik. A protonok pozitív töltésűek és a membránközi térben helyezkednek el, míg a negatív töltésűek a mitokondriális mátrixból hatnak.
Egy bizonyos potenciálkülönbség elérésekor a fehérjekomplex visszaadja a protonokat a mátrixba, a kapott energiát teljesen más energiává alakítva, ahol az oxidatív folyamatok szintetikus folyamatokkal – az ADP foszforilációjával – párosulnak. Az anyagok oxidációjának és a protonoknak a mitokondriális membránon keresztül történő pumpálásának teljes időtartama alatt az ATP szintézise nem áll le, vagyis az oxidatív foszforiláció.
Két fajta
Az oxidatív és a szubsztrát foszforiláció alapvetően különbözik egymástól. A modern elképzelések szerint a legősibb életformák csak szubsztrát foszforilációs reakciókat tudtak alkalmazni. Erre a célra a külső környezetben létező szerves vegyületeket két csatornán keresztül - energiaforrásként és szénforrásként - használták fel. Az ilyen vegyületek azonban a környezetben fokozatosan kiszáradtak, és a már megjelent szervezetek elkezdtek alkalmazkodni, új energiaforrásokat és új szénforrásokat keresni.
Így megtanulták használni a fény és a szén-dioxid energiáját. De amíg ez meg nem történt, az élőlények energiát szabadítottak fel a fermentáció oxidatív folyamataiból, és azt ATP-molekulákban is tárolták. Ezt nevezik szubsztrát foszforilációnak, amikor az oldható enzimek általi katalizálás módszerét alkalmazzák. A fermentált szubsztrát redukálószert képez, amely elektronokat ad át a kívánt endogén akceptornak - acetonnak, acetalhidnek, piruvátnak és hasonlóknak, vagy H2 - hidrogéngáz szabadul fel.
Összehasonlító jellemzők
A fermentációhoz képest az oxidatív foszforiláció sokkal nagyobb energiakibocsátással rendelkezik. A glikolízis összesen két molekulából álló ATP-t ad, és a folyamat során harminc-harminchat molekula szintetizálódik. Az elektronok oxidációs és redukciós reakciókon keresztül a donor vegyületekből akceptorvegyületekké vándorolnak, ATP-ként tárolt energiát termelve.
Az eukarióták a sejt mitokondriális membránján belül lokalizált fehérjekomplexekkel hajtják végre ezeket a reakciókat, míg a prokarióták kívül - a membránok közötti térben - dolgoznak. Ez a rokon fehérjék komplexe alkotja az ETC-t (elektrontranszport lánc). Az eukariótáknak csak öt fehérjekomplexük van, míg a prokariótáknak sok, és mindegyik különféle elektrondonorral és azok akceptorával dolgozik.

Párosítások és szétkapcsolások
Az oxidációs folyamat elektrokémiai potenciált hoz létre, és a foszforilációs folyamat ezt a potenciált használja ki. Ez azt jelenti, hogy a konjugáció biztosított, ellenkező esetben a foszforilációs és oxidációs folyamatok kötődése biztosított. Innen a név - oxidatív foszforiláció. A csatoláshoz szükséges elektrokémiai potenciált a légzési lánc három komplexuma hozza létre - az első, a harmadik és a negyedik, amelyeket kapcsolódási pontoknak nevezünk.
Ha a mitokondriumok belső membránja sérül, vagy az áteresztőképessége megnőtt a szétkapcsolók aktivitása miatt, az minden bizonnyal az elektrokémiai potenciál megszűnését vagy csökkenését fogja okozni, majd ezt követi a foszforilációs és oxidációs folyamatok szétválása, azaz az ATP szintézis leállása. A foszforiláció és a légzés szétválásának nevezik azt a jelenséget, amikor az elektrokémiai potenciál megszűnik.
Szakaszolók
Az az állapot, amikor a szubsztrátok oxidációja folytatódik, de foszforiláció nem következik be (azaz ATP nem képződik P-ből és ADP-ből), a foszforiláció és az oxidáció szétválása. Ez akkor történik, amikor a szakaszolók beavatkoznak a folyamatba. Mik ezek, és milyen eredményekre törekednek? Tegyük fel, hogy az ATP szintézise nagymértékben lecsökken, vagyis kevesebb mennyiségben szintetizálódik, miközben a légzési lánc működik. Mi történik az energiával? Hőként szabadul fel. Ezt mindenki érzi megemelkedett testhőmérsékletű betegség során.
lázad van? Ez azt jelenti, hogy a szakaszolók működtek. Például az antibiotikumok. Ezek gyenge savak, amelyek zsírokban oldódnak. A sejt membránközi terébe behatolva bediffundálnak a mátrixba, és magukkal húzzák a megkötött protonokat. Például a pajzsmirigy által kiválasztott, jódot tartalmazó hormonok (trijódtironin és tiroxin) szétkapcsoló hatásúak. Ha a pajzsmirigy túlműködik, a betegek állapota borzasztó: hiányzik az ATP-energia, sok ételt fogyasztanak, mivel a szervezetnek sok szubsztrátra van szüksége az oxidációhoz, de fogynak, mivel a kapott energia nagy része hő formájában elveszett.
Oxidáz út az oxigén felhasználásához a sejtekben
A mitokondriális károsodás okai és következményei
A mitokondriumok metabolikus és homeosztatikus funkciói
A mitokondriális enzimek lokalizációja
1). Külső membrán tartalmazza: a). elongázok, enzimek, amelyek meghosszabbítják a telített zsírsavmolekulákat; b). kinurenin-hidroxiláz; V). monoamin-oxidáz (marker) stb.
2). Membránközi tér tartalmazza: a). adenilát-cikláz; b). nukleozid-difoszfát kináz.
3). Belső membrán tartalmazza: a). az oxidatív foszforilációs lánc enzimei, amelyeknek a citokróm-oxidáz a markere; b). SDH c). β-hidroxi-butirát DG; G). karnitin-aciltranszferáz.
4). Mátrix tartalmazza: a). TCA ciklus enzimek; b). zsírsavak β-oxidációs enzimei; V). aminotranszferázok AST, ALT; G). glutamát DG d). foszfoenolpiruvát-karboxiláz e). piruvát DG.
A sejt száztól több ezerig terjedő mitokondriumot tartalmaz, méretük 2-3 mikron hosszú és 1 mikron széles.
A mitokondriumokban a következők fordulnak elő: ATP szintézis és hőtermelés az oxidatív foszforiláció reakciójában; zsírsavak β-oxidációja; A TCA ciklus reakciói, a glükoneogenezis, a transzamináció, a dezamináció, a lipogenezis és a hem szintézis egyes reakciói a TCA cikluson keresztül mennek végbe, a fehérje-, lipid- és szénhidrát-anyagcsere integrációja megtörténik.
A belső mitokondriális membrán kémiai és fizikai tényezők által okozott károsodása az ATP szintézis folyamatának megzavarásához, az anabolikus reakciók gátlásához, a membránok közötti transzporthoz és az anyagcsere minden típusához vezet.
- oxidatív foszforiláció
Az oxigénhasznosítás oxidáz útja az oxidáció és a foszforiláció folyamataiból áll, amelyek egymással összefüggenek. Körülbelül 40 különböző fehérjét tartalmaz. Az oxidáz útvonal az O 2 90%-át fogyasztja, és az aerob sejtekben az ATP fő forrása.
Oxidatív foszforiláció ATP szintézisének nevezik ADP-ből és H 3 PO 4-ből a CPE mentén történő elektrontranszfer energiája miatt. Az oxidáció során 220 kJ/mol szabad energia szabadul fel. A 3 ATP szintéziséhez: 30,5 * 3 = 91,5 kJ/mol. Hőként felszabaduló: 220-91,5 = 128,5 kJ/mol. Hatékonyság = 40%, NADH 2 + ½O 2 → NAD + + H 2 O + 220 kJ/molADP + H 3 PO 4 + 30,5 kJ/mol = ATP + H 2 O 1). Oxidációs lánc (légzési lánc) 4 fehérjekomplexből áll, amelyek meghatározott módon beépülnek a mitokondriumok belső membránjába, valamint kis mobil ubikinon és citokróm C molekulákból, amelyek a membrán lipidrétegében keringenek a fehérjekomplexek között. I. komplex – NADH 2 dehidrogenáz komplex– a légzőszervi enzimkomplexek közül a legnagyobb - 800 KDa feletti molekulatömegű, több mint 22 polipeptid láncból áll, FMN és 5 vas-kén (Fe 2 S 2 és Fe 4 S 4) fehérjét tartalmaz koenzimként. II. komplexum – SDH . FAD-ot és vas-kén fehérjét tartalmaz koenzimként. Komplex III – Komplex b-c 1 (enzim QH 2 DG) 500 kDa molekulatömege, 8 polipeptid láncból áll, és valószínűleg dimerként létezik. Mindegyik monomer 3 hemet tartalmaz, amelyek a b 562, b 566, c 1 citokrómokhoz és egy vas-kén fehérjéhez kapcsolódnak. IV. komplex – Citokróm-oxidáz komplex molekulatömege 300 kDa, 8 polipeptid láncból áll, dimer formájában létezik. Mindegyik monomer 2 citokrómot (a és egy 3) és 2 rézatomot tartalmaz. Koenzim Q (ubikinon). Lipid, amelynek gyökjét emlősökben 10 izoprenoid egység alkotja (Q 10). Az ubikinon átviszi a 2H + és 2e - jeleket. ubikinon ↔ szemikinon ↔ hidrokinon Citokróm c. Egy 12,5 KDa tömegű perifériás vízoldható membránfehérje 1 db 100 AA-s polipeptidláncot és egy hemmolekulát tartalmaz.A légzőlánc komponensei közötti molekuláris kapcsolatok a különböző szövetekben eltérőek. Például a szívizomban 1 molekula NADH 2 dehidrogenáz komplexhez 3 molekula b-c 1 komplex, 7 molekula citokróm oxidáz komplex, 9 citokróm C molekula és 50 ubikinon molekula található. 2). Foszforilezés ATP-szintetáz (H + -ATPáz) végzi - a mitokondriumok belső membránjának szerves fehérje. Az ATP-szintáz 2 fehérjekomplexből áll, amelyeket F0-nak és F1-nek neveznek. Az F0 hidrofób komplex a membránba merül.Az oxigénfogyasztás oxidáz útja a mitokondriumokban történik, 90% O 2 -t fogyaszt, és biztosítja az oxidatív foszforiláció folyamatát.
Oxidatív foszforiláció ATP szintézisének nevezik ADP-ből és H 3 PO 4-ből az elektronok légzési lánc mentén történő mozgásának energiája miatt.
Az oxidatív foszforiláció az ATP fő forrása az aerob sejtekben.
Mitchell kemiozmotikus elmélete
Az oxidatív foszforiláció mechanizmusának magyarázatára 1961-ben Mitchell egy kemioszmotikus elméletet javasolt, amely négy független posztulátumot tartalmazott a mitokondriális működésre vonatkozóan:
A mitokondriumok belső membránja minden ion számára áthatolhatatlan.
Számos hordozó fehérjét tartalmaz, amelyek lényeges metabolitokat és szervetlen ionokat szállítanak.
Ahogy az elektronok áthaladnak a belső membrán légzőláncán, a H+ a mátrixból a membránközi térbe kerül.
Amikor a proton gradiens elég nagy, a protonok elkezdenek „folyni” az ATP-szintetázon keresztül, amit ATP-szintézis kísér.
Modern elképzelések az oxidatív foszforiláció mechanizmusáról
Jelenleg az oxidatív foszforiláció összes fő összetevőjét felfedezték, szerkezetüket és tulajdonságait tanulmányozták. Feltárták az oxidatív foszforiláció alapelveit, szabályozását és egyes szakaszok mechanizmusait.
Az oxidatív foszforiláció mechanizmusa
Az oxidatív foszforiláció folyamatokból áll oxidáció És foszforiláció , amelyek egymáshoz kapcsolódnak.
Oxidációs folyamat
Az oxidációs folyamat akkor következik be, amikor az elektronok a légzési lánc mentén mozognak a szöveti légzés szubsztrátjaitól az oxigénig. Az oxidatív foszforiláció légzési lánca a mitokondriumok belső membránjába ágyazott 4 fehérjekomplexből, valamint kis mobil ubikinon és citokróm C molekulákból áll, amelyek a membrán lipidrétegében keringenek a fehérjekomplexek között.
Összetett én – NADH 2 dehidrogenáz komplex – a légzőszervi enzimkomplexek közül a legnagyobb - 800 KDa feletti molekulatömegű, több mint 22 polipeptid láncból áll, FMN és 5 vas-kén (Fe 2 S 2 és Fe 4 S 4) fehérjét tartalmaz koenzimként.
Összetett II – SDH . FAD-ot és vas-kén fehérjét tartalmaz koenzimként.
Összetett III – Összetett b - c 1 (enzim QH 2 DG) 500 kDa molekulatömege, 8 polipeptid láncból áll, és valószínűleg dimerként létezik. Mindegyik monomer 3 hemet tartalmaz, amelyek a b 562, b 566, c 1 citokrómokhoz és egy vas-kén fehérjéhez kapcsolódnak.
Összetett IV – Citokróm-oxidáz komplex molekulatömege 300 kDa, 8 polipeptid láncból áll, dimer formájában létezik. Mindegyik monomer 2 citokrómot (a és egy 3) és 2 rézatomot tartalmaz.
Koenzim K (ubikinon). Lipid, amelynek gyökjét emlősökben 10 izoprenoid egység alkotja (Q 10). Az ubikinon átviszi a 2H + és 2e - jeleket.
ubikinon ↔ szemikinon ↔ hidrokinon
Citokróm c. Egy 12,5 kDa tömegű perifériás vízoldható membránfehérje 1 100 AA-s polipeptidláncot és egy hem molekulát tartalmaz.
A légzési lánc komponensei közötti molekuláris kapcsolatok a különböző szövetekben eltérőek. Például a szívizomban 1 molekula NADH 2 dehidrogenáz komplexhez 3 molekula b-c 1 komplex, 7 molekula citokróm oxidáz komplex, 9 citokróm C molekula és 50 ubikinon molekula található.
Elektrokémiai potenciál. A légzési lánc összetevői a membránban helyezkednek el, annak érdekében, hogy növeljék redox potenciáljukat. Amikor e - egy alacsony redoxpotenciálú komplexből egy nagyobb redoxpotenciállal rendelkező komplexbe, szabad energia szabadul fel. 1 NADH 2 oxidációja során 220 kJ/mol szabad energia szabadul fel.
A légzési lánc I., III. és IV. komplexei ennek a szabad energiának a 65-70%-át használják fel a H + átvitelére a mitokondriális mátrixból a membránok közötti térbe, a szabad energia 30-35%-a hőként disszipálódik.
 A mozgás szakaszai e
-
a légzési lánc mentén
A mozgás szakaszai e
-
a légzési lánc mentén
2e - a NADH 2-ből az I komplexen (FMN→SFe fehérje) áthaladva a CoQ-ba, az ilyenkor felszabaduló energia biztosítja a H + pumpálását (a H + transzfer mechanizmusa nem ismert).
CoQ 2е-val - 2H+-t vesz fel a vízből a mátrixból és CoQH 2-vé alakul (a CoQ redukciója szintén a II komplex részvételével megy végbe).
A CoQH 2 a 2e-t a III-as komplexbe, a 2H+-t pedig a membránközi térbe viszi át.
A citokróm C a III-as komplex e-c-jét átviszi a IV-es komplexbe.
A Complex IV e-t ürít O 2 -re, a felszabaduló energia ebben az esetben biztosítja a H + szivattyúzását (a H + transzfer mechanizmusa nem ismert).
Ha a H + a mátrixból az intermembrán térbe kerül, a protonozmotikus gradiens ∆рН = 60 mV (∆рН = 1-nél) (a mátrixban a pH magasabb, mint a citoszolban). Mivel minden H+ pozitív töltést hordoz, a belső membránon is megjelenik lehetséges különbség ∆V=160mV, a membrán belső oldala negatívan, a külső oldala pozitívan töltődik.
Összességében a protonok ozmotikus gradiense és a potenciálkülönbség alakul ki elektrokémiai potenciál , ami egy tipikus cellában kb. 60+160=220 mV.
A H+ membránon keresztüli átvitelének mechanizmusa nem teljesen ismert. Valószínű, hogy a légzési lánc különböző komponensei eltérő mechanizmussal kapcsolják össze az e - transzportját a H + mozgásával.
A belső mitokondriális membránon kialakuló elektrokémiai potenciált a következőkre használják:
- A katabolizmus során keletkező NADH és FADH 2 hidrogénatomokat (azaz hidrogén protonokat és elektronokat) ad át a légzőlánc enzimjeihez.
- Az elektronok áthaladnak a légzési lánc enzimein, és energiát veszítenek.
- Ezt az energiát arra használják, hogy a mátrixból H+ protonokat pumpáljanak a membránközi térbe.
- A légzési lánc végén az elektronok oxigénnel ütköznek, és vízzé redukálják.
- A H+ protonok visszarohannak a mátrixba, és áthaladnak az ATP-szintázon.
- Ugyanakkor energiát veszítenek, amelyet az ATP szintézisére használnak fel.
az ADP foszforilációja ATP-vé;
anyagok szállítása a mitokondriális membránon keresztül;
Vezető szerepet játszik az energiaképzésben. A szénhidrátok, zsírok és fehérjék oxidációja következtében redukáló ekvivalensek (elektronok és hidrogénatomok) keletkeznek, amelyek a légzési lánc mentén kerülnek átadásra. Az ebben az esetben felszabaduló energia a belső mitokondriális membránon lévő protonok elektrokémiai gradiensének energiájává alakul át, amelyet viszont az ATP szintézisére használnak fel. Ezt a folyamatot oxidatív foszforilációnak nevezik.
A glikolízis eredményeként képződő triózok, és elsősorban a piroszőlősav, részt vesznek a mitokondriumokban végbemenő további oxidációban.
Ez az összes kémiai kötés felhasadásának energiáját használja fel, ami CO2 felszabadulásához, oxigénfogyasztáshoz és nagy mennyiségű ATP szintéziséhez vezet. Ezek a folyamatok a trikarbonsavak oxidatív ciklusával és a légzési elektrontranszport lánccal kapcsolatosak, ahol az ADP foszforilációja és a celluláris „üzemanyag” - ATP molekulák - szintézise megy végbe. A trikarbonsav körfolyamatban az oxidáció során felszabaduló elektronok a koenzimek akceptor molekuláiba (NAD – nikotinamidadenin-dinukleotid) kerülnek át, amelyek tovább vonják őket az elektrontranszport láncba (ETC – elektrontranszport lánc). Ezek a mitokondriumokon belüli események a mátrixukban történnek. A további elektrontranszferrel és ATP-szintézissel kapcsolatos további reakciók a belső mitokondriális membránhoz, a mitokondriális cristae-hoz kapcsolódnak. A trikarbonsav körfolyamatban az oxidációs folyamat során felszabaduló, koenzimeken felvett elektronok ezután a légzési láncba (elektrontranszport lánc) kerülnek, ahol a molekuláris oxigénnel egyesülve vízmolekulákat képeznek. A légzési lánc a belső mitokondriális membránba ágyazott fehérjekomplexek sorozata, és a mitokondriumok fő energiaátalakító rendszere. Itt a légzési lánc elemeinek szekvenciális oxidációja és redukciója megy végbe, ami kis részletekben energia felszabadulását eredményezi. Ennek az energiának köszönhetően az ATP a lánc három pontján képződik ADP-ből és foszfátból. Ezért azt mondják, hogy az oxidáció (elektrontranszfer) a foszforilációhoz kapcsolódik (ADP + Phn = ATP), azaz megtörténik az oxidatív foszforiláció folyamata.
A mitokondriális membránban történő elektrontranszfer során a légzési lánc minden egyes komplexe az oxidáció szabad energiáját a protonok (pozitív töltések) membránon keresztüli mozgására irányítja, a mátrixból a membránközi térbe, ami a membránközi térbe vezet. potenciálkülönbség a membránon keresztül: a pozitív töltések az intermembrán térben, a negatív töltések az intermembrán térben. Egy bizonyos potenciálkülönbség (220 mV) elérésekor az ATP-szintetáz fehérjekomplex elkezdi visszaszállítani a protonokat a mátrixba, miközben az egyik energiaformát egy másikká alakítja át: ADP-ből és szervetlen foszfátból ATP-t képez. Így párosulnak az oxidatív folyamatok a szintetikus folyamatokkal - az ADP foszforilációjával. Miközben a szubsztrátok oxidációja megtörténik, miközben a protonok a belső mitokondriális membránon keresztül pumpálódnak, megtörténik a kapcsolódó ATP-szintézis, azaz oxidatív foszforiláció.
A szénhidrátok, zsírsavak, alkoholok és aminosavak oxidációs reakciói során keletkező NADH és FADH 2 molekulák a mitokondriumokba jutnak, ahol az enzimek légzőlánc folyamatban van a folyamat oxidatív foszforiláció.
Oxidatív foszforiláció
Oxidatív foszforiláció alatt zajló többlépcsős folyamat a mitokondriumok belső membránjaés redukált ekvivalensek (NADH és FADH 2) oxidációjából áll a légzési lánc enzimei által, amihez ATP szintézis társul.
Az oxidatív foszforiláció mechanizmusát először Peter Mitchell javasolta. E hipotézis szerint elektrontranszfer, a belső mitokondriális membránban előforduló, okozza H+ ionok kiszivattyúzása a mitokondriális mátrixból az intermembrán térbe. Ez létrehozza H+ ion koncentráció gradiens a citoszol és a zárt intramitokondriális tér között. A hidrogénionok normál esetben csak egyetlen módon - egy speciális, ATP-t képző enzimen keresztül - képesek visszatérni a mitokondriális mátrixba. ATP szintáz.
A modern elképzelések szerint a belső mitokondriális membrán számos multienzim komplexet tartalmaz, köztük számos enzimet. Ezeket az enzimeket ún légzőszervi enzimek, és a membránban való elhelyezkedésük sorrendje az légzőlánc vagy elektronszállító lánc(Angol) elektronszállító lánc).
Általában a légzőlánc munkája a következő: