Nātrija tiosulfāts. Vispārīga informācija Nātrija tiosulfāta fizikālās īpašības
Termiski ļoti nestabils:
Sērskābes klātbūtnē tas sadalās:
Reaģē ar sārmiem:
Reaģē ar halogēniem:
Tiosulfurskābe
Ja uzvāra nātrija sulfīta ūdens šķīdumu ar sēru un pēc liekā sēra izfiltrēšanas ļauj atdzist, tad no šķīduma izdalās bezkrāsaini caurspīdīgi jaunas vielas kristāli, kuru sastāvu izsaka ar formulu. Šī viela ir tiosulfurskābes nātrija sāls.
Tiosulfurskābe ir nestabila. Jau istabas temperatūrā tas sadalās. Tās sāļi, tiosulfāti, ir daudz stabilāki. No tiem visbiežāk izmantotais ir nātrija tiosulfāts, ko nepareizi dēvē arī par hiposulfītu.
Kad nātrija tiosulfāta šķīdumam pievieno kādu skābi, piemēram, sālsskābi, parādās sēra dioksīda smaka un pēc kāda laika šķidrums no izdalītā sēra kļūst duļķains.
Nātrija tiosulfāta īpašību izpēte ļauj secināt, ka tā sastāvā esošajiem sēra atomiem ir dažādi oksidācijas līmeņi: vienam no tiem oksidācijas pakāpe ir +4, otram ir 0 . Nātrija tiosulfāts - reducētājs . Hlors, broms un citi spēcīgi oksidētāji to oksidē līdz sērskābei vai tās sālim.
Tiosulf?- tiosulfurskābes sāļi un esteri, H2S2O3. Tiosulfāti ir nestabili un tāpēc dabā nav sastopami. Visplašāk izmantotais ir nātrija tiosulfāts un amonija tiosulfāts.
Struktūra. Tiosulfāta jonu struktūra

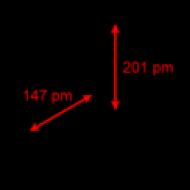
Tiosulfāta jons pēc struktūras ir tuvu sulfāta jonam. 2-tetraedrā S-S saite (1,97A) ir garāka nekā S-O saite
Nātrija tiosulfāts var klasificēt kā diezgan nestabilas vielas. Nātrija tiosulfāts sadalās, karsējot līdz 220°C: Nātrija tiosulfāta termiskās sadalīšanās reakcijā mēs iegūstam nātrija polisulfīdu, kas arī tālāk sadalās nātrija sulfīdā un elementārajā sērā. Mijiedarbība ar skābēm: tiosulfātu (ūdeņraža tiosulfātu) nav iespējams izolēt, nātrija tiosulfātu reaģējot ar spēcīgu skābi, jo tā ir nestabila un nekavējoties sadalās: Sālsskābe un slāpekļskābe arī tiks pakļauta tādai pašai reakcijai. Sadalīšanās notiek kopā ar izdalījumiem, kam ir nepatīkama smaka.
Nātrija tiosulfāta redoksīpašības: Sēra atomu klātbūtnes dēļ ar oksidācijas pakāpi 0, tiosulfāta jonam ir reducējošas īpašības, piemēram, ar vājiem oksidētājiem (I2, Fe3+) tiosulfāts tiek oksidēts par tetrationāta jonu: Sārmainā vidē notiek oksidēšanās. nātrija tiosulfāts ar jodu var pāriet uz sulfātu.
Un spēcīgāki oksidētāji to oksidē līdz sulfāta joniem :
Spēcīgi reducējoši līdzekļi jons tiek reducēts līdz S2-atvasinājumiem: atkarībā no apstākļiem nātrija tiosulfātam var būt gan oksidējošas, gan reducējošas īpašības.
Tiosulfātu kompleksās īpašības:
Tiosulfāta jons ir spēcīgs kompleksveidotājs , ko izmanto fotogrāfijā, lai no fotofilmas noņemtu nereducētu sudraba bromīdu: S2O32 jonu koordinē metāli caur sēra atomu, tāpēc tiosulfātu kompleksi viegli pārvēršas attiecīgajos sulfīdos.
Nātrija tiosulfāta pielietojums
Nātrija tiosulfātu diezgan plaši izmanto gan ikdienas dzīvē, gan rūpniecībā. Galvenās nātrija tiosulfāta pielietošanas jomas būs medicīna, tekstilrūpniecība un ieguves rūpniecība, fotogrāfija.
Nātrija tiosulfātu izmanto tekstilrūpniecībā un papīra rūpniecībā, lai pēc audumu un papīra balināšanas noņemtu hlora pēdas, bet ādas ražošanā to izmanto kā hromskābes reducētāju.
Kalnrūpniecībā nātrija tiosulfātu izmanto, lai iegūtu sudrabu no rūdām ar zemu sudraba koncentrāciju. Sudraba kompleksie savienojumi ar tiosulfātiem ir diezgan stabili, vismaz stabilāki nekā kompleksie savienojumi ar fluoru, hloru, bromīdiem un tiocianātiem. Tāpēc sudraba izdalīšana kompozīcijas šķīstoša kompleksa savienojuma veidā vai ir rūpnieciski izdevīga. Notiek darbs pie tā izmantošanas zelta ieguvē. Bet šajā gadījumā kompleksā savienojuma nestabilitātes konstante ir daudz augstāka un kompleksi ir mazāk stabili, salīdzinot ar sudraba.
Pirmo reizi nātrija tiosulfāts tika izmantots medicīnā. Un līdz šai dienai tas nav zaudējis savu nozīmi medicīnā. Tiesa, daudzu slimību ārstēšanai jau ir atrasti arī citi, efektīvāki medikamenti, tāpēc nātrija tiosulfātu sācis plašāk izmantot veterinārmedicīnā. Nātrija tiosulfātu izmanto medicīnā kā pretlīdzekli saindēšanās gadījumā ar arsēnu, dzīvsudrabu un citiem smagajiem metāliem, cianīdiem (pārvērš tos tiocianātos):
Kā minēts iepriekš, tiosulfāta jons rada stabilus kompleksus savienojumus ar daudziem metāliem, tostarp daudziem toksiskiem smagajiem metāliem. Izveidotie kompleksie savienojumi ir maz toksiski un izdalās no organisma. Šī nātrija tiosulfāta īpašība ir pamats tā izmantošanai toksikoloģijā un saindēšanās ārstēšanā.
Nātrija tiosulfātu lieto arī zarnu dezinfekcijai pārtikas saindēšanās gadījumā, kašķa ārstēšanai (kopā ar sālsskābi), kā pretiekaisuma un pretapdegumu līdzekli.
Nātrija tiosulfātu plaši izmanto analītiskajā ķīmijā, jo tas ir reaģents jodometrijā. Jodometrija ir viena no metodēm vielu koncentrāciju kvantitatīvai noteikšanai un joda koncentrācijas noteikšanai, tiek izmantota redoksreakcija ar nātrija tiosulfātu:
Pēdējais diezgan izplatītais nātrija tiosulfāta lietojums ir tā izmantošana kā fiksācijas līdzeklis fotogrāfijā. Un, lai gan parastā melnbaltā fotogrāfija jau ir piekāpusies krāsainajai un parastā fotofilma tiek izmantota diezgan reti, daudzējādā ziņā zemāka par digitālo attēlu tveršanu, ir diezgan daudz vietu, kur joprojām tiek izmantotas fotoplates un fotofilmas. Piemēri ir rentgena iekārtas, gan medicīnas, gan rūpnieciskās, zinātniskās iekārtas un fototeleskopi.
Lai mēs iegūtu fotogrāfisku attēlu, pietiek ar to, lai attīstītos aptuveni 25% no fotofilmā esošā sudraba bromīda. Un pārējais paliek fotofilmā un saglabā savu fotosensitivitāti. Ja fotofilmu pēc attīstīšanas izņem gaismā, tad tajā palikušo neattīstīto halogēna sudrabu attīstīs attīstītājs un negatīvs kļūs tumšāks. Pat ja viss attīstītājs ir izskalots, sudraba halogenīda sadalīšanās dēļ negatīvs kaut kādā veidā kļūs tumšāks gaismā.
Lai saglabātu attēlu uz plēves, no tās ir jānoņem neattīstītais sudraba halogēns. Lai to izdarītu, tiek izmantots attēla fiksācijas process, kura laikā sudraba halogenīdus pārvērš šķīstošos savienojumos un izskalo no filmas vai fotogrāfijas. Attēla fiksēšanai tiek izmantots nātrija tiosulfāts.
Atkarībā no nātrija tiosulfāta koncentrācijas šķīdumā veidojas dažādi savienojumi. Ja fiksatora šķīdums satur nelielu daudzumu tiosulfāta, tad reakcija notiek saskaņā ar vienādojumu:
Iegūtais sudraba tiosulfāts nešķīst ūdenī, tāpēc to ir grūti izolēt no foto slāņa, tas ir diezgan nestabils un sadalās, izdaloties sērskābei:
Sudraba sulfīds padara attēlu melnu, un to nevar noņemt no foto slāņa.
Ja šķīdumā ir pārāk daudz nātrija tiosulfāta, veidojas sarežģīti sudraba sāļi:
Iegūtais kompleksais sāls, nātrija tiosulfāta argentāts, ir diezgan stabils, bet slikti šķīst ūdenī.
Ja šķīdumā ir liels tiosulfātu pārpalikums, veidojas kompleksie sudraba kompleksie sāļi, kas labi šķīst ūdenī:
Šīs nātrija tiosulfāta īpašības ir pamats tā izmantošanai kā fiksators fotogrāfijā.
Tetratnopīnskābe pieder pie polinoīdu skābju grupas. Tās ir divvērtīgās skābes ar vispārīgu formulu, kur to vērtības var būt no 2 līdz 6 un, iespējams, vairāk. Polnitionskābes nestabils un zināms tikai ūdens šķīdumos. Politioskābju sāļi — politionāti — ir stabilāki; daži no tiem ir iegūti kristālu veidā.
Politionskābes - sēra savienojumi ar vispārīgo formulu H2SnO6, kur n>=2. To sāļus sauc par politionātiem.

Tetrationāta jons var iegūt, oksidējot tiosulfāta jonu ar jodu (reakciju izmanto jodometrijā):
Pentācijas jons ko iegūst, SCl2 iedarbojoties uz tiosulfāta jonu un no Vakenrodera šķidruma, pievienojot tam kālija acetātu. Vispirms izkrīt prizmatiski kālija tetrationāta kristāli, tad plāksnveidīgi kālija pentationāta kristāli, no kuriem vīnskābes iedarbībā iegūst pentationskābes ūdens šķīdumu.
Kālija heksationāts K2S6O6 vislabāk sintezēts, iedarbojoties KNO2 uz K2S2O3 koncentrētā HCl zemā temperatūrā.
Veido netoksiskus vai maztoksiskus savienojumus ar smago metālu sāļiem, halogēniem, cianīdiem. Tam ir pretlīdzekļu īpašības pret anilīnu, benzolu, jodu, varu, dzīvsudrabu, ciānūdeņražskābi, sublimātu un fenoliem. Saindēšanās gadījumā ar arsēna, dzīvsudraba un svina savienojumiem veidojas netoksiski sulfīti. Galvenais detoksikācijas mehānisms saindēšanās gadījumā ar ciānūdeņražskābi un tās sāļiem ir cianīda pārvēršana tiocianāta jonā, kas ir salīdzinoši netoksisks, piedaloties fermentam rodonāzei - tiosulfātcianīda sēra transferāzei (atrodams daudzos audos, bet uzrāda maksimālu aktivitāti aknās). Organismam ir spēja detoksikēt cianīdu, bet rodonāzes sistēma darbojas lēni, un saindēšanās ar cianīdu gadījumā tās aktivitāte ir nepietiekama detoksikācijai. Šajā gadījumā, lai paātrinātu rodonāzes katalizēto reakciju, organismā jāievada eksogēni sēra donori, parasti nātrija tiosulfāts.
Pretkašķa aktivitāte ir saistīta ar spēju sadalīties skābā vidē, veidojoties sēram un sēra dioksīdam, kas kaitīgi iedarbojas uz kašķa ērci un tās olām.
Pēc intravenozas ievadīšanas nātrija tiosulfāts izkliedējas ekstracelulārajā šķidrumā un izdalās nemainītā veidā ar urīnu. Bioloģiskā T 1/2 - 0,65 stundas.
Nātrija tiosulfāts nav toksisks. Pētījumos ar suņiem ar hronisku nātrija tiosulfāta infūziju tika novērota hipovolēmija, kas, iespējams, ir saistīta ar tā osmotisko diurētisko efektu.
Lieto detoksikācijas līdzekļu kompleksā pacientiem ar alkoholisko delīriju.
Vielas pielietojums Nātrija tiosulfāts
Saindēšanās ar arsēnu, svinu, dzīvsudrabu, broma sāļiem, jodu, ciānūdeņražskābi un cianīdiem; alerģiskas slimības, artrīts, neiralģija; kašķis.
Kontrindikācijas
Paaugstināta jutība.
Lietojiet grūtniecības un zīdīšanas laikā
Lietošana grūtniecības laikā ir iespējama tikai tad, ja tas ir absolūti nepieciešams. Reproduktīvie pētījumi ar dzīvniekiem ar nātrija tiosulfātu nav veikti. Nav zināms, vai nātrija tiosulfāts var izraisīt nelabvēlīgu ietekmi uz augli, ja to lieto grūtnieces, vai ietekmēt reproduktīvo spēju.
Vielas blakusparādības Nātrija tiosulfāts
Alerģiskas reakcijas.
Ievadīšanas ceļi
IV, ārēji.
Speciālas instrukcijas
Cianīda intoksikācijas gadījumā jāizvairās no aizkavēšanās ar antidota ievadīšanu (iespējama ātra nāve). Pacients rūpīgi jānovēro 24-48 stundas, jo var atkārtoties saindēšanās ar cianīdu simptomi. Ja simptomi atjaunojas, nātrija tiosulfāta ievadīšana jāatkārto, lietojot pusi no devas.
ātriju tiosulfāts Natrii tiosulfas
Na 2S 2 0 3 -5H 2 0 M. m 248,17
Nātrija tiosulfāts nav dabisks produkts, to iegūst sintētiski.
Rūpniecībā nātrija tiosulfātu iegūst no gāzes ražošanas atkritumiem. Šī metode, neskatoties uz tās daudzpakāpju raksturu, ir ekonomiski izdevīga, jo izejvielas ir gāzes ražošanas atkritumi un jo īpaši ogļu koksēšanas laikā radusies apgaismojošā gāze.
Apgaismojošā gāze vienmēr satur sērūdeņraža piejaukumu, ko uztver absorbētāji, piemēram, kalcija hidroksīds. Tas rada kalcija sulfīdu.
Bet kalcija sulfīds ražošanas procesā tiek hidrolizēts, tāpēc reakcija notiek nedaudz savādāk - veidojas kalcija hidrosulfīds.
Oksidējot ar atmosfēras skābekli, kalcija hidrosulfīds veido kalcija tiosulfātu.
Kad iegūtais kalcija tiosulfāts tiek sakausēts ar nātrija sulfātu vai nātrija karbonātu, tiek iegūts nātrija tiosulfāts Na 2 S 2 0 3.
![]()
Pēc šķīduma iztvaicēšanas kristalizējas nātrija tiosulfāts, kas ir farmakopejas zāles.
Pēc izskata nātrija tiosulfāts (II) ir bezkrāsaini caurspīdīgi kristāli ar sāļi rūgtu garšu. Ļoti viegli šķīst ūdenī. 50 °C temperatūrā tas izkūst savā kristalizācijas ūdenī. Tās struktūra ir tiosulfurskābes (I) sāls.

Kā redzams no šo savienojumu formulas, sēra atomu oksidācijas pakāpe to molekulās ir atšķirīga. Vienam sēra atomam oksidācijas pakāpe ir +6, otram -2. Sēra atomu klātbūtne dažādos oksidācijas stāvokļos nosaka to īpašības.
Tādējādi, ja molekulā ir S2-, nātrija tiosulfātam ir reducēšanas spēja.
Tāpat kā pati tiosulfurskābe, arī tās sāļi nav stipri savienojumi un viegli sadalās skābju, pat tādu vāju kā ogļskābe, ietekmē.

Šo nātrija tiosulfāta īpašību sadalīties ar skābēm, lai atbrīvotu sēru, izmanto, lai identificētu zāles. Pievienojot sālsskābi nātrija tiosulfāta šķīdumam, sēra izdalīšanās dēļ tiek novērota šķīduma duļķainība.

Nātrija tiosulfātam ļoti raksturīga ir tā reakcija ar sudraba nitrāta šķīdumu. Tādējādi veidojas baltas nogulsnes (sudraba tiosulfāts), kas ātri kļūst dzeltenas. Stāvot gaisa mitruma ietekmē, nogulsnes kļūst melnas, jo izdalās sudraba sulfīds.
Ja, nātrija tiosulfātu pakļaujot sudraba nitrātam, nekavējoties veidojas melnas nogulsnes, tas norāda uz zāļu piesārņojumu ar sulfīdiem, kas, mijiedarbojoties ar sudraba nitrātu, nekavējoties izdala sudraba sulfīda nogulsnes.

Tīrs preparāts, pakļaujoties sudraba nitrāta šķīdumam, uzreiz nekļūst tumšāks.
Kā autentiskuma reakciju var izmantot arī nātrija tiosulfāta reakciju ar dzelzs (III) hlorīda šķīdumu. Šajā gadījumā veidojas dzelzs oksīda tiosulfāts, kas ir violets. Krāsa ātri pazūd, jo šis sāls pārvēršas par bezkrāsainiem dzelzs dzelzs sāļiem (FeS 2 0 3 un FeS 4 0 6).
Mijiedarbojoties ar nātrija jodu, nātrija tiosulfāts darbojas kā reducētājs. Paņemot elektronus no S 2-, jods tiek reducēts līdz I-, un nātrija tiosulfāts ar jodu tiek oksidēts par nātrija tetratioātu.

Hloru līdzīgi reducē par hlorūdeņradi.

Ja ir hlora pārpalikums, atbrīvotais sērs tiek oksidēts par sērskābi.
Nātrija tiosulfāta izmantošana hlora absorbēšanai pirmajās gāzmaskās tika balstīta uz šo reakciju.
Preparāts nedrīkst saturēt arsēna, selēna, karbonātu, sulfātu, sulfīdu, sulfītu, kalcija sāļu piemaisījumus.
GF X pieļauj hlorīdu un smago metālu sāļu piemaisījumu klātbūtni standarta ietvaros.
Nātrija tiosulfāta kvantitatīvo noteikšanu veic, izmantojot jodometrisko metodi, kuras pamatā ir tā mijiedarbības reakcija ar jodu. GF pieprasa, lai nātrija tiosulfāta saturs preparātā būtu ne mazāks par 99% un ne vairāk kā 102% (sakarā ar pieļaujamo preparāta laikapstākļu robežu).
Nātrija tiosulfāta izmantošanas pamatā ir tā spēja atbrīvot sēru. Zāles lieto kā pretlīdzekli saindēšanās gadījumā ar halogēniem, cianogēniem un ciānūdeņražskābi.

Iegūtais kālija tiocianāts ir daudz mazāk toksisks nekā kālija cianīds. Tāpēc saindēšanās gadījumā ar ciānūdeņražskābi vai tās sāļiem kā pirmā palīdzība jāizmanto nātrija tiosulfāts. Zāles var lietot arī saindēšanās gadījumā ar arsēna, dzīvsudraba un svina savienojumiem; šajā gadījumā veidojas netoksiski sulfīdi.
Nātrija tiosulfātu lieto arī alerģiskām slimībām, artrītu, neiralģiju - intravenozi 30% ūdens šķīduma veidā. Šajā sakarā GF X nodrošina 30% nātrija tiosulfāta šķīdumu injekcijām (Solutio Natrii thiosulfatis 30% pro injekcijas).
Pieejams pulveros un ampulās pa 5, 10, 50 ml 30% šķīduma.
Nātrija tiosulfāts satur kristalizācijas ūdeni, kas viegli iztvaiko, tāpēc tas jāuzglabā vēsā vietā, labi noslēgtās tumša stikla pudelēs, jo gaisma veicina tā sadalīšanos. Šķīdumi, stāvot, kļūst duļķains izdalītā sēra dēļ. Šis process tiek paātrināts oglekļa dioksīda klātbūtnē. Tāpēc kolbas vai pudeles ar nātrija tiosulfāta šķīdumiem ir aprīkotas ar kalcija hlorīda caurulīti, kas piepildīta ar nātrija kaļķi, kas to absorbē.
Nātrija tiosulfāts ir sintētisks savienojums, kas ķīmijā pazīstams kā nātrija sulfāts un pārtikas rūpniecībā kā piedeva E539, apstiprināts izmantošanai pārtikas ražošanā.
Nātrija tiosulfāts darbojas kā skābuma regulētājs (antioksidants), pretsalipes līdzeklis vai konservants. Tiosulfāta kā pārtikas piedevas izmantošana ļauj palielināt glabāšanas laiku un produkta kvalitāti, kā arī novērst puves, skābumu un fermentāciju. Tīrā veidā šī viela ir iesaistīta pārtikas jodētā sāls ražošanas tehnoloģiskajos procesos kā joda stabilizators un tiek izmantota cepamo miltu apstrādei, kas ir pakļauti salipšanai un salipšanai.
Pārtikas piedevas E539 lietošana ir ierobežota tikai rūpniecības jomā; viela nav pieejama mazumtirdzniecībai. Medicīniskiem nolūkiem nātrija tiosulfātu izmanto kā pretlīdzekli smagas saindēšanās gadījumos un pretiekaisuma līdzekli ārējai lietošanai.
Galvenā informācija
Tiosulfāts (hiposulfīts) ir neorganisks savienojums, kas ir tiosulfurskābes nātrija sāls. Viela ir bezkrāsains, bez smaržas pulveris, kas pēc rūpīgākas pārbaudes izrādās caurspīdīgi monoklīniski kristāli.
Hiposulfīts ir nestabils savienojums, kas dabā nav sastopams. Viela veido kristālisku hidrātu, kas, karsējot virs 40 °C, izkūst savā kristāliskajā ūdenī un izšķīst. Izkausēts nātrija tiosulfāts ir pakļauts pārdzesēšanai, un aptuveni 220 ° C temperatūrā savienojums tiek pilnībā iznīcināts.
Nātrija tiosulfāts: sintēze
Nātrija sulfāts vispirms tika iegūts mākslīgi laboratorijā, izmantojot Leblanc metodi. Šis savienojums ir sodas ražošanas blakusprodukts, kas veidojas, oksidējoties kalcija sulfīdam. Mijiedarbojoties ar skābekli, kalcija sulfīds daļēji oksidējas līdz tiosulfātam, no kura, izmantojot nātrija sulfātu, iegūst Na 2 S 2 O 3.
 Mūsdienu ķīmija piedāvā vairākas nātrija sulfāta sintēzes metodes:
Mūsdienu ķīmija piedāvā vairākas nātrija sulfāta sintēzes metodes:
- nātrija sulfīdu oksidēšana;
- verdošs sērs ar nātrija sulfītu;
- sērūdeņraža un sēra oksīda mijiedarbība ar nātrija hidroksīdu;
- verdošs sērs ar nātrija hidroksīdu.
Iepriekš minētās metodes var iegūt nātrija tiosulfātu kā reakcijas blakusproduktu vai ūdens šķīduma formā, no kura šķidrums ir jāiztvaicē. Nātrija sulfāta sārmainu šķīdumu var iegūt, izšķīdinot tā sulfīdu ūdenī ar skābekli.
Tīrs bezūdens savienojums tiosulfāts ir nātrija sāls un slāpekļskābes reakcijas rezultāts ar sēru vielā, kas pazīstama kā formamīds. Sintēzes reakcija notiek 80 °C temperatūrā un ilgst aptuveni pusstundu, tās produkti ir tiosulfāts un tā oksīds.
Visās ķīmiskajās reakcijās hiposulfīts darbojas kā spēcīgs reducētājs. Reakcijās ar spēcīgiem oksidētājiem Na 2 S 2 O 3 tiek oksidēts par sulfātu vai sērskābi, bet ar vājiem - par tetrationa sāli. Tiosulfāta oksidācijas reakcija ir vielu noteikšanas jodometriskās metodes pamatā.
Īpaša uzmanība ir jāpievērš nātrija tiosulfāta mijiedarbībai ar brīvo hloru, kas ir spēcīgs oksidētājs un toksiska viela. Hiposulfītu viegli oksidē hlors un pārvērš to nekaitīgos ūdenī šķīstošos savienojumos. Tādējādi šis savienojums novērš hlora postošo un toksisko iedarbību.
Rūpnieciskos apstākļos tiosulfātu iegūst no gāzes ražošanas atkritumiem. Visizplatītākā izejviela ir apgaismojošā gāze, kas izdalās ogļu koksēšanas procesā un satur sērūdeņraža piemaisījumus. No tā tiek sintezēts kalcija sulfīds, kas tiek pakļauts hidrolīzei un oksidēšanai, pēc tam to apvieno ar nātrija sulfātu, lai iegūtu tiosulfātu. Neskatoties uz daudzpakāpju procesu, šī metode tiek uzskatīta par visrentablāko un videi draudzīgāko metodi hiposulfīta iegūšanai.
| Sistemātisks nosaukums | Nātrija tiosulfāts |
|---|---|
| Tradicionālie nosaukumi | Nātrija disulfīds, nātrija hiposulfīts (nātrija) soda, antihlors |
| Starptautiskais marķējums | E539 |
| Ķīmiskā formula | Na2S2O3 |
| Grupa | Neorganiskie tiosulfāti (sāļi) |
| Apkopošanas stāvoklis | Bezkrāsaini monoklīniski kristāli (pulveris) |
| Šķīdība | Šķīst, nešķīst |
| Kušanas temperatūra | 50 °C |
| Kritiskā temperatūra | 220 °C |
| Īpašības | Reducējošs (antioksidants), kompleksu veidojošs |
| Uztura bagātinātāju kategorija | Skābuma regulētāji, pretsalipes līdzekļi (pretsalipes līdzekļi) |
| Izcelsme | Sintētisks |
| Toksicitāte | Nav pētīta, viela ir nosacīti droša |
| Lietošanas jomas | Pārtika, tekstilrūpniecība, ādas rūpniecība, fotogrāfija, farmācija, analītiskā ķīmija |
Nātrija tiosulfāts: pielietojums
 Nātrija disulfīds tika izmantots dažādiem mērķiem ilgi pirms savienojuma iekļaušanas uztura bagātinātājos un medikamentos. Antihloru izmantoja marles saišu un gāzmasku filtru impregnēšanai, lai aizsargātu elpošanas sistēmu no toksiskā hlora Pirmā pasaules kara laikā.
Nātrija disulfīds tika izmantots dažādiem mērķiem ilgi pirms savienojuma iekļaušanas uztura bagātinātājos un medikamentos. Antihloru izmantoja marles saišu un gāzmasku filtru impregnēšanai, lai aizsargātu elpošanas sistēmu no toksiskā hlora Pirmā pasaules kara laikā.
Mūsdienu hiposulfīta pielietošanas jomas rūpniecībā:
- fotofilmu apstrāde un attēlu ierakstīšana uz fotopapīra;
- dzeramā ūdens dehlorēšana un bakterioloģiskā analīze;
- hlora traipu noņemšana audumu balināšanas laikā;
- zelta rūdas izskalošana;
- vara sakausējumu un patīnas ražošana;
- ādas miecēšana.
Nātrija sulfātu izmanto kā reaģentu analītiskajā un organiskajā ķīmijā, tas neitralizē stiprās skābes un neitralizē smagos metālus un to toksiskos savienojumus. Tiosulfāta reakcijas ar dažādām vielām ir jodometrijas un bromometrijas pamatā.
Pārtikas piedeva E539
Nātrija tiosulfāts nav plaši izmantota pārtikas piedeva, un tas nav brīvi pieejams savienojuma nestabilitātes un tā sadalīšanās produktu toksicitātes dēļ. Hiposulfīts ir iesaistīts pārtikas jodētā sāls un maizes izstrādājumu ražošanas tehnoloģiskajos procesos kā skābuma regulētājs un pretsalipes līdzeklis.
Piedeva E539 darbojas kā antioksidants un konservants dārzeņu un zivju konservu, desertu un alkoholisko dzērienu ražošanā. Šī viela ir arī daļa no ķīmiskajām vielām, ko izmanto svaigu, žāvētu un saldētu dārzeņu un augļu virsmas apstrādei.
Konservantu un antioksidantu E539 izmanto, lai uzlabotu šādu produktu kvalitāti un pagarinātu glabāšanas laiku:
- svaigi un saldēti dārzeņi, augļi, jūras veltes;
- , rieksti, sēklas;
- dārzeņi, sēnes un jūraszāles, konservētas vai eļļā;
- ievārījumi, želejas, sukādes, augļu biezeņi un pildījumi;
- svaigas, saldētas, kūpinātas un kaltētas zivis, jūras veltes, konservi;
- milti, ciete, mērces, garšvielas, etiķis, ;
- baltie un niedres, saldinātāji (dekstroze un), cukura sīrupi;
- augļu un dārzeņu sulas, saldais ūdens, dzērieni ar zemu alkohola saturu, vīnogu dzērieni.
Ražojot galda jodēto sāli, joda stabilizēšanai tiek izmantota pārtikas piedeva E539, kas var ievērojami pagarināt produkta glabāšanas laiku un saglabāt tā uzturvērtību. Maksimālā pieļaujamā E539 koncentrācija galda sālī ir 250 mg uz 1 kg.
Cepšanā nātrija tiosulfātu aktīvi izmanto kā daļu no dažādām piedevām, lai uzlabotu produktu kvalitāti. Cepšanas uzlabotāji ir oksidējoši vai reducējoši. Pretsalipes līdzeklis E539 ir atjaunojošs uzlabotājs, kas ļauj mainīt īpašības.
Mīklu, kas izgatavota no blīviem miltiem ar īsi plīstošu lipekli, ir grūti apstrādāt, kūkas, nesasniedz nepieciešamo tilpumu un cepšanas laikā plaisā. Pretsalipes līdzeklis E539 iznīcina disulfīda saites un strukturē lipekļa proteīnus, kā rezultātā mīkla labi ceļas, drupačas kļūst irdenas un elastīgas, un cepšanas laikā neplaisā garoza.
Uzņēmumos tieši pirms mīklas mīcīšanas miltiem kopā ar raugu pievieno pretsalipes līdzekli. Tiosulfātu saturs miltos ir 0,001-0,002% no to masas atkarībā no maizes izstrādājuma ražošanas tehnoloģijas. Sanitārie standarti E539 piedevai ir 50 mg uz 1 kg kviešu miltu.
Pretsalipes līdzeklis E539 tehnoloģiskajos procesos tiek izmantots stingrās devās, tāpēc, lietojot miltu izstrādājumus, nepastāv risks saindēties ar tiosulfātu. Mazumtirdzniecībai paredzētie milti pirms pārdošanas netiek apstrādāti. Normālās robežās uztura bagātinātājs ir drošs un tam nav toksiskas ietekmes uz organismu.
Lietošana medicīnā un tās ietekme uz organismu
Soda hiposulfīts ir iekļauts Pasaules Veselības organizācijas svarīgāko zāļu sarakstā kā vienas no efektīvākajām un drošākajām zālēm. To ievada subkutāni, intramuskulāri un intravenozi injekciju šķīduma veidā vai izmanto kā ārēju līdzekli.
Divdesmitā gadsimta sākumā nātrija tiosulfātu pirmo reizi izmantoja kā pretlīdzekli saindēšanās ar ciānūdeņražskābi gadījumā. Kombinācijā ar nātrija nitrītu tiosulfātu ieteicams lietot īpaši smagos saindēšanās gadījumos ar cianīdu, un to ievada intravenozi, lai cianīds pārvērstos netoksiskos tiocianātos, kurus pēc tam var droši izvadīt no organisma.
Nātrija sulfāta izmantošana medicīnā:
Hiposulfīta ietekme uz cilvēka ķermeni, lietojot iekšķīgi, nav pētīta, tāpēc nav iespējams spriest par vielas ieguvumiem un kaitējumu tīrā veidā vai kā pārtikas produktu sastāvdaļa. Nav bijuši saindēšanās gadījumi ar E539 piedevu, tāpēc to parasti uzskata par netoksisku.
Nātrija tiosulfāts un likumdošana
Nātrija tiosulfāts ir iekļauts to pārtikas piedevu sarakstā, kuras ir apstiprinātas lietošanai pārtikas ražošanā Krievijā un Ukrainā. Pretsalipes līdzeklis un skābuma regulators E539 tiek izmantoti saskaņā ar noteiktajiem sanitārajiem un higiēnas standartiem tikai rūpnieciskiem nolūkiem.
Tā kā ķīmiskās vielas ietekme uz cilvēka organismu, lietojot iekšķīgi, vēl nav pētīta, E539 piedeva nav apstiprināta lietošanai ES un ASV.
Medicīnas praksē injekciju šķīduma veidā kā detoksikācijas un desensibilizācijas līdzeklis vai ārēji kā insekticīds līdzeklis, veterinārmedicīnā kā līdzeklis pret ādas slimībām, farmācijas rūpniecībā zāļu ražošanā; 30% nātrija tiosulfāta šķīdumu pagatavošanai injekcijām.Tiek izmantots arī nātrija tiosulfāts
- hlora pēdu noņemšanai pēc audumu balināšanas
- sudraba ieguvei no rūdām;
- fiksators fotogrāfijā;
- reaģents jodometrijā
- pretinde saindēšanās gadījumā: As, Br, Hg un citi smagie metāli, cianīdi (pārvērš tos tiocianātos) utt.
- zarnu dezinfekcijai;
- kašķa ārstēšanai (kopā ar sālsskābi);
- pretiekaisuma un pretapdeguma līdzeklis;
- var izmantot kā līdzekli molekulmasu noteikšanai, pazeminot sasalšanas punktu (krioskopiskā konstante 4,26°)
- pārtikas rūpniecībā reģistrēta kā pārtikas piedeva E539.
- piedevas betonam.
- audu attīrīšanai no joda
Apraksts
Fizikāli ķīmiskās īpašības
Bezkrāsaini, caurspīdīgi, bez smaržas kristāliIepakošana
Soma 40 kg. Iepakojumā 1 kg. Soma 35 kg. Soma 0,5 kg. 1 kg maiss. 5 kg maiss. Soma 10 kg.
Uzglabāšana
Iepakojums: 0,5 kg katrs; 1 kg; 5 kg; 10 kg; 35 kg; 40 kg; 45 kg maisos vai maisos, kas izgatavoti no polietilēna plēves vai iepakojuma papīra ar polimēra pārklājumu.
Uzglabāšana: Sausā vietā, labi iesaiņotos traukos. Derīguma termiņš - 5 gadi.
Farmakopejas nātrija tiosulfāts, ko ražo nosauktā ķīmiskā rūpnīca. L.Ya. Karpova
| Masas daļa, % | Norm | |
|---|---|---|
| Na2S2O3*5H2O | 99,0-102,0 | |
| kalcijs | nekādas reakcijas | |
| sulfīdi | tu izturi pārbaudi | |
| sulfīti un sulfāti | Maks. | 0,01 |
| hlorīdi | Maks. | 0,005 |
| smagie metāli | Maks. | 0,001 |
| arsēns, selēns | nekādas reakcijas | |
| dziedzeris | Maks. | 0,002 |
| sārmainība | fenolftaleīna rozā krāsas trūkums | |
| Mikrobioloģiskā tīrība | atbilst Valsts fonda XI 2. laidiena 193. lpp |
- Preces kods: 264-01
- Pieejamība: Noliktavā