Diabetes insipidus sievietēm, vīriešiem un bērniem. Cukura diabēts bērniem Idiopātisks cukura diabēts
7.1. DIABĒTA KLASIFIKĀCIJA
Diabēts(DM) ir vielmaiņas slimību grupa, kam raksturīga hiperglikēmija, ko izraisa traucēta sekrēcija un/vai insulīna darbības efektivitāte. Hronisku hiperglikēmiju, kas attīstās ar cukura diabētu, pavada komplikāciju attīstība no daudziem orgāniem un sistēmām, galvenokārt no sirds, asinsvadiem, acīm, nierēm un nerviem. Kopumā ar cukura diabētu slimo 5-6% iedzīvotāju. Ekonomiski attīstītajās pasaules valstīs ik pēc 10-15 gadiem cukura diabēta pacientu skaits dubultojas. Dzīves ilgums ar cukura diabētu samazinās par 10-15%.
Cukura diabēta cēloņi ir ļoti dažādi. Lielākajā daļā gadījumu diabēts attīstās vai nu absolūta insulīna deficīta dēļ (1. tipa cukura diabēts - DM-1), vai perifēro audu samazinātas jutības dēļ pret insulīnu kombinācijā ar aizkuņģa dziedzera β-šūnu sekrēcijas disfunkciju. (2. tipa cukura diabēts - SD-2). Dažos gadījumos pacientu klasificēt kā DM-1 vai DM-2 ir sarežģīti, taču praksē svarīgāka ir DM kompensācija, nevis precīza tā veida noteikšana. Etioloģiskā klasifikācija nosaka četras galvenās diabēta klīniskās klases (7.1. tabula).
Visbiežāk sastopamās DM-1 (7.5. punkts), DM-2 (7.6. punkts) un gestācijas DM (7.9. punkts) ir apskatītas atsevišķās nodaļās. Ieslēgts citi specifiski veidi veido tikai aptuveni 1% diabēta gadījumu. Šķiet, ka šo diabēta veidu etioloģija un patoģenēze ir vairāk pētīta salīdzinājumā ar 1. un jo īpaši 2. diabētu. Vairākus DM variantus izraisa monogēni iedzimti ģenētiski funkcionālie defektiβ - šūnas. Tas ietver dažādus autosomāli dominējošā pārmantotā MODY sindroma variantus. brieduma sākuma diabēts jauniešiem- pieaugušo tipa cukura diabēts jauniešiem), kam raksturīgs pārkāpums, bet ne insulīna sekrēcijas trūkums ar normālu perifēro audu jutību pret to.
Tabula 7.1. Cukura diabēta klasifikācija
Kazuistiski reti ģenētiski defekti insulīna darbībā, saistīta ar insulīna receptoru mutāciju (leprechaunism, Rabson-Mandehall sindroms). DM dabiski attīstās ar eksokrīnas aizkuņģa dziedzera slimības, kas izraisa β-šūnu iznīcināšanu (pankreatīts, pankreatektomija, cistiskā fibroze, hemohromatoze), kā arī vairākās endokrīnās slimībās, kurās notiek pārmērīga pretinsulāro hormonu ražošana (akromegālija, Kušinga sindroms). Zāles un ķīmiskās vielas(vakors, pentamidīns, nikotīnskābe, diazoksīds utt.) reti izraisa diabētu, bet var veicināt slimības izpausmi un dekompensāciju indivīdiem ar insulīna rezistenci. Rinda infekcijas slimības(masaliņu, citomegālijas, koksakivīrusu un adenovīrusu infekcijas) var pavadīt β-šūnu iznīcināšana, savukārt vairumam pacientu tiek konstatēti DM-1 imunoģenētiskie marķieri. UZ retas imūnmediēta diabēta formas ietver diabētu, kas attīstās pacientiem ar “stīva-rnana” sindromu (autoimūnu neiroloģisku slimību), kā arī diabētu, ko izraisa insulīna receptoru autoantivielu iedarbība. Ir sastopami dažādi diabēta varianti ar paaugstinātu biežumu
daudzi ģenētiski sindromi, jo īpaši Dauna sindroms, Klinefeltera sindroms, Tērnera sindroms, Volframa sindroms, Pradera-Villi sindroms un daudzi citi.
7.2. OGĻHIDRĀTU METABOLISMA FIZIOLOĢIJAS KLĪNISKIE ASPEKTI
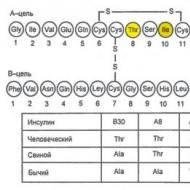
Insulīns sintezē un izdala aizkuņģa dziedzera Langerhansa saliņu (PLI) β-šūnas. Turklāt Langerhansa saliņas izdala glikagonu (α šūnas), somatostatīnu (δ šūnas) un aizkuņģa dziedzera polipeptīdu (PP šūnas). Saliņu šūnu hormoni mijiedarbojas viens ar otru: glikagons parasti stimulē insulīna sekrēciju, un somatostatīns nomāc insulīna un glikagona sekrēciju. Insulīna molekula sastāv no divām polipeptīdu ķēdēm (A ķēde - 21 aminoskābe; B ķēde - 30 aminoskābes) (7.1. att.). Insulīna sintēze sākas ar preproinsulīna veidošanos, ko proteāze šķeļ, veidojot proinsulīns. Golgi aparāta sekrēcijas granulās proinsulīns tiek sadalīts insulīnā un C-peptīds, kas izdalās asinīs eksocitozes procesā (7.2. att.).
Galvenais insulīna sekrēcijas stimulators ir glikoze. Insulīns tiek atbrīvots, reaģējot uz paaugstinātu glikozes līmeni asinīs divfāzu(7.3. att.). Pirmā jeb akūta fāze ilgst vairākas minūtes un ir saistīta ar uzkrāto izdalīšanos
 Rīsi. 7.1. Insulīna molekulas primārās struktūras diagramma
Rīsi. 7.1. Insulīna molekulas primārās struktūras diagramma
 Rīsi. 7.2. Insulīna biosintēzes shēma
Rīsi. 7.2. Insulīna biosintēzes shēma
insulīnu, kas atrodas β-šūnā laikā starp ēdienreizēm. Otrā fāze turpinās, līdz glikēmiskais līmenis sasniedz normālu tukšā dūšā (3,3-5,5 mmol/l). Sulfonilurīnvielas atvasinājumiem ir līdzīga ietekme uz β-šūnu.
Caur portāla sistēmu insulīns sasniedz aknas- tā galvenais mērķa orgāns. Aknu receptori saista pusi no izdalītā hormona. Otra puse, nonākot sistēmiskajā cirkulācijā, sasniedz muskuļus un taukaudus. Lielākā daļa insulīna (80%) proteolītiski sadalās aknās, pārējais - nierēs, un tikai neliels daudzums tiek tieši metabolizēts muskuļu un tauku šūnās. Dzīves ilgums ir normāls
 Rīsi. 7.3. Divfāzu insulīna izdalīšanās glikozes ietekmē
Rīsi. 7.3. Divfāzu insulīna izdalīšanās glikozes ietekmē
pieaugušais cilvēks izdala 35-50 vienības insulīna dienā, kas ir 0,6-1,2 vienības uz 1 kg ķermeņa svara. Šis noslēpums ir sadalīts uztura un bazālajā. Pārtikas sekrēcija insulīns atbilst glikozes līmeņa paaugstināšanās pēc ēšanas, t.i. tās dēļ tiek neitralizēta pārtikas hiperglikēmiskā iedarbība. Uztura insulīna daudzums aptuveni atbilst uzņemto ogļhidrātu daudzumam - apmēram 1-2,5 vienības
uz 10-12 g ogļhidrātu (1 maizes vienība - XE). Bāzes insulīna sekrēcija nodrošina optimālu glikēmijas un anabolisma līmeni intervālos starp ēdienreizēm un miega laikā. Bāzes insulīns tiek izdalīts ar ātrumu aptuveni 1 U/h, ar ilgstošu fizisko aktivitāti vai ilgstošu badošanos tas ievērojami samazinās. Uztura insulīns veido vismaz 50-70% no ikdienas insulīna ražošanas (7.4. att.).
Insulīna sekrēciju ietekmē ne tikai pārtika, bet arī katru dienu
 Rīsi. 7 .4.
Normāls ikdienas insulīna ražošanas modelis
Rīsi. 7 .4.
Normāls ikdienas insulīna ražošanas modelis
ny svārstības: Vajadzība pēc insulīna palielinās agrās rīta stundās un pēc tam pakāpeniski samazinās visas dienas garumā. Tātad brokastīm uz 1 XE izdalās 2,0-2,5 vienības insulīna, pusdienās - 1,0-1,5 vienības un vakariņās - 1,0 vienības. Viens no šo insulīna jutības izmaiņu iemesliem ir augstais vairāku pretsalu hormonu (galvenokārt kortizola) līmenis no rīta, kas nakts sākumā pakāpeniski samazinās līdz minimumam.
Galvenā insulīna fizioloģiskā iedarbība ir glikozes pārneses stimulēšana caur no insulīna atkarīgo audu šūnu membrānām. Galvenie insulīna mērķa orgāni ir aknas, taukaudi un muskuļi. No insulīna neatkarīgie audi, kuru piegāde ar glikozi nav atkarīga no insulīna iedarbības, galvenokārt ietver centrālo un perifēro nervu sistēmu, asinsvadu endotēliju, asins šūnas utt. Insulīns stimulē glikogēna sintēzi aknās un muskuļos, tauku sintēze aknās un taukaudos, proteīnu sintēze aknās, muskuļos un citos orgānos. Visas šīs izmaiņas ir vērstas uz glikozes izmantošanu, kas izraisa tās līmeņa pazemināšanos asinīs. Insulīna fizioloģiskais antagonists ir glikagons, kas stimulē glikogēna un tauku mobilizāciju no depo; Parasti glikagona līmenis mainās atkarībā no insulīna ražošanas.
Insulīna bioloģiskā iedarbība ir saistīta ar tā receptoriem kas atrodas uz mērķa šūnām. Insulīna receptors ir glikoproteīns, kas sastāv no četrām apakšvienībām. Ar augstu insulīna līmeni asinīs tā receptoru skaits samazinās saskaņā ar pazeminātas regulēšanas principu, ko papildina šūnu jutības pret insulīnu samazināšanās. Pēc tam, kad insulīns saistās ar šūnu receptoru, iegūtais komplekss nonāk šūnā. Tālāk muskuļu un tauku šūnās insulīns izraisa intracelulāro pūslīšu mobilizāciju, kas satur glikozes transportētājs GLUT-4. Rezultātā pūslīši pārvietojas uz šūnas virsmu, kur GLUT-4 darbojas kā glikozes ieejas punkts. Fiziskām aktivitātēm ir līdzīga ietekme uz GLUT-4.
7.3. DIABĒTA LABORATORIJAS DIAGNOSTIKA UN KOMPENSĀCIJAS KRITĒRIJI
Diabēta laboratoriskā diagnostika balstās uz glikozes līmeņa noteikšanu asinīs, un diagnostikas kritēriji visiem ir vienādi
SD veidi un varianti (7.2. tabula). Citu laboratorijas testu (glikozūrijas līmenis, glikozētā hemoglobīna līmeņa noteikšana) datus nevajadzētu izmantot, lai pārbaudītu diabēta diagnozi. Diabēta diagnozi var noteikt, pamatojoties uz divkāršu atklāšanu vienam no trīs kritēriji:
1. Ar acīmredzamiem cukura diabēta simptomiem (poliūrija, polidipsija) un glikozes līmenis kapilārajās asinīs ir lielāks par 11,1 mmol/l neatkarīgi no diennakts laika un iepriekšējās ēdienreizes.
2. Ja glikozes līmenis tukšā dūšā kapilārajās asinīs pārsniedz 6,1 mmol/l.
3. Kad glikozes līmenis kapilārajās asinīs 2 stundas pēc 75 gramu glikozes lietošanas (perorālais glikozes tolerances tests) ir lielāks par 11,1 mmol/l.
Tabula 7.2. Cukura diabēta diagnosticēšanas kritēriji
 Svarīgākais un nozīmīgākais tests diabēta diagnostikā ir glikēmijas līmeņa noteikšana tukšā dūšā (ne mazāk kā 8 stundas tukšā dūšā). Krievijas Federācijā glikēmijas līmeni parasti novērtē pilnās asinīs. Glikozes noteikšana tiek plaši izmantota daudzās valstīs
Svarīgākais un nozīmīgākais tests diabēta diagnostikā ir glikēmijas līmeņa noteikšana tukšā dūšā (ne mazāk kā 8 stundas tukšā dūšā). Krievijas Federācijā glikēmijas līmeni parasti novērtē pilnās asinīs. Glikozes noteikšana tiek plaši izmantota daudzās valstīs
asins plazmā. Mutes glikozes tolerances tests(OGTT; glikozes līmeņa noteikšana 2 stundas pēc 75 gramu ūdenī izšķīdinātas glikozes uzņemšanas) šajā ziņā tiek piešķirta mazāka nozīme. Tomēr, pamatojoties uz OGTT, tas tiek diagnosticēts traucēta glikozes tolerance(NTG). IGT tiek diagnosticēts, ja glikozes līmenis tukšā dūšā kapilārajās asinīs nepārsniedz 6,1 mmol/l, un 2 stundas pēc glikozes slodzes tas ir virs 7,8 mmol/l, bet zem 11,1 mmol/l. Vēl viens ogļhidrātu metabolisma traucējumu variants ir traucēta glikozes līmenis tukšā dūšā(NGNT). Pēdējais tiek noteikts, ja glikēmijas līmenis pilnās kapilārās asinīs tukšā dūšā ir robežās no 5,6-6,0 mmol/l un 2 stundas pēc glikozes slodzes ir mazāka par 7,8 mmol/l). NTG un NGNT pašlaik ir apvienoti saskaņā ar terminu prediabēts, jo abām pacientu kategorijām ir augsts cukura diabēta un diabētiskās makroangiopātijas attīstības risks.
Lai diagnosticētu diabētu, glikēmijas līmenis jānosaka ar standarta laboratorijas metodēm. Interpretējot glikēmiskās vērtības, jāpatur prātā, ka glikozes līmenis tukšā dūšā veselās venozās asinīs atbilst tā līmenim pilnajās kapilārajās asinīs. Pēc ēdienreizes jeb OGTT tā līmenis venozajās asinīs ir aptuveni par 1,1 mmol/l zemāks nekā kapilārajās asinīs. Glikozes saturs plazmā ir par aptuveni 0,84 mmol/l augstāks nekā pilnās asinīs. Lai novērtētu kompensāciju un diabēta terapijas atbilstību, glikēmijas līmeni kapilārajās asinīs nosaka, izmantojot portatīvo ierīci. glikometri paši pacienti, viņu radinieki vai medicīnas personāls.
Ar jebkura veida diabētu, kā arī ar ievērojamu glikozes slodzi tas var attīstīties glikozūrija, kas ir glikozes reabsorbcijas no primārā urīna sliekšņa pārsniegšanas sekas. Glikozes reabsorbcijas slieksnis individuāli ievērojami atšķiras (≈ 9-10 mmol/l). Glikozūriju nedrīkst izmantot kā atsevišķu indikatoru diabēta diagnosticēšanai. Parasti glikozūrija nenotiek, izņemot gadījumus, kad uzturā ir ievērojama rafinētu ogļhidrātu slodze.
Produkti ketonu ķermeņi(acetons, acetoacetāts, β-hidroksibutirāts) ievērojami pastiprinās ar absolūtu insulīna deficītu. Ar DM-1 dekompensāciju, izteikta ketonūrija(pārbaudīts, izmantojot testa strēmeles, kas iemērc urīnā). Vieglu (nelielu) ketonūriju var konstatēt veseliem cilvēkiem badošanās un zema ogļhidrātu diētas laikā.
Svarīgs laboratoriskais rādītājs, ko izmanto diabēta veidu diferenciāldiagnozei, kā arī insulīna deficīta veidošanās noteikšanai pacientiem ar cukura diabētu-2, ir līmenis. C-peptīds. C-peptīda līmenis asinīs var netieši spriest par aizkuņģa dziedzera β-šūnu insulīna sekrēcijas spēju. Pēdējie ražo proinsulīnu, no kura pirms sekrēcijas tiek atdalīts C-peptīds, kas vienādos daudzumos ar insulīnu nonāk asinīs. Par 50% insulīna saistās aknās, un tā eliminācijas pusperiods perifērajās asinīs ir aptuveni 4 minūtes. C-peptīds netiek izvadīts no asinsrites ar aknām, un tā pussabrukšanas periods asinīs ir aptuveni 30 minūtes. Turklāt tas nesaistās ar šūnu receptoriem perifērijā. Tāpēc C-peptīda līmeņa noteikšana ir ticamāks tests, lai novērtētu salu aparāta darbību. Visinformatīvāk ir pētīt C-peptīda līmeni uz stimulācijas testu fona (pēc ēšanas vai glikagona ievadīšanas). Pārbaude nav informatīva, ja to veic uz smagas diabēta dekompensācijas fona, jo smagai hiperglikēmijai ir toksiska ietekme uz β-šūnām (glikotoksicitāte). Insulīna terapija pēdējo dienu laikā neietekmēs testa rezultātus.
Pamata ārstēšanas mērķis Jebkura veida cukura diabēts ir tā novēloto komplikāciju novēršana, ko var panākt, ņemot vērā tā stabilu kompensāciju par vairākiem parametriem (7.3. tabula). Galvenais ogļhidrātu metabolisma kompensācijas kvalitātes kritērijs cukura diabēta gadījumā ir līmenis glikēts (glikozilēts) hemoglobīns (HbA1c). Pēdējais ir hemoglobīns, kas nav kovalenti saistīts ar glikozi. Glikoze eritrocītos nonāk neatkarīgi no insulīna, un hemoglobīna glikozilācija ir neatgriezenisks process, un tās pakāpe ir tieši proporcionāla glikozes koncentrācijai, ar kuru tā bija saskarē 120 pastāvēšanas dienu laikā. Neliela hemoglobīna daļa ir glikozilēta un ir normāla; cukura diabēta gadījumā to var ievērojami palielināt. HbA1c līmenis atšķirībā no glikozes līmeņa, kas pastāvīgi mainās, neatņemami atspoguļo glikēmiju pēdējo 3-4 mēnešu laikā. Tieši šajā intervālā ir ieteicams noteikt HbA1c līmeni, lai novērtētu diabēta kompensāciju.
Hroniska hiperglikēmija nebūt nav vienīgais riska faktors diabēta vēlīnu komplikāciju attīstībai un progresēšanai. Sakarā ar šo DM kompensācijas novērtējums pamatojoties uz kompleksu
laboratorisko un instrumentālo pētījumu metodes (7.3. tabula). Papildus indikatoriem, kas raksturo ogļhidrātu vielmaiņas stāvokli, vissvarīgākie ir asinsspiediena līmenis un asins lipīdu spektrs.
Tabula 7.3. Cukura diabēta kompensācijas kritēriji
 Papildus iepriekš minētajiem kompensācijas kritērijiem, plānojot diabēta ārstēšanas mērķus, ir nepieciešama individuāla pieeja. Diabēta vēlīnu komplikāciju (īpaši mikroangiopātijas) attīstības un progresēšanas iespējamība palielinās, palielinoties slimības ilgumam. Tādējādi, ja bērniem un jauniem pacientiem, kuriem diabēta vēsture pēc tam var sasniegt vairākus gadu desmitus, ir nepieciešams sasniegt optimālus glikēmijas rādītājus, tad pacientiem, kuriem cukura diabēts izpaudās vecumdienās, tiek noteikta stingra eiglikēmiskā kompensācija, kas būtiski palielina risku saslimt ar cukura diabētu. hipoglikēmija, ne vienmēr ir ieteicama.
Papildus iepriekš minētajiem kompensācijas kritērijiem, plānojot diabēta ārstēšanas mērķus, ir nepieciešama individuāla pieeja. Diabēta vēlīnu komplikāciju (īpaši mikroangiopātijas) attīstības un progresēšanas iespējamība palielinās, palielinoties slimības ilgumam. Tādējādi, ja bērniem un jauniem pacientiem, kuriem diabēta vēsture pēc tam var sasniegt vairākus gadu desmitus, ir nepieciešams sasniegt optimālus glikēmijas rādītājus, tad pacientiem, kuriem cukura diabēts izpaudās vecumdienās, tiek noteikta stingra eiglikēmiskā kompensācija, kas būtiski palielina risku saslimt ar cukura diabētu. hipoglikēmija, ne vienmēr ir ieteicama.
7.4. INULĪNA PREPARĀTI UN INULĪNA TERAPIJA
Insulīna preparāti ir vitāli svarīgi pacientiem ar 1. tipa cukura diabētu; turklāt līdz 40% pacientu ar T2DM tos saņem. Uz vispārīgo indikācijas insulīna terapijas izrakstīšanai diabēta gadījumā, daudzi no tiem faktiski pārklājas viens ar otru, tostarp:
1. 1 tipa cukura diabēts
2. Pankreatektomija
3. Ketoacidotiska un hiperosmolāra koma
4. 2. tipa cukura diabēta gadījumā:
Skaidras insulīna deficīta pazīmes, piemēram, progresējošs svara zudums un ketoze, smaga hiperglikēmija;
Lielas ķirurģiskas iejaukšanās;
Akūtas makrovaskulāras komplikācijas (insults, miokarda infarkts, gangrēna utt.) un smagas infekcijas slimības, ko pavada ogļhidrātu metabolisma dekompensācija;
Glikozes līmenis tukšā dūšā ir lielāks par 15-18 mmol/l;
Stabilas kompensācijas trūkums, neskatoties uz dažādu tablešu hipoglikēmisko zāļu maksimālo dienas devu izrakstīšanu;
Vēlīnās diabēta komplikāciju stadijas (smaga polineiropātija un retinopātija, hroniska nieru mazspēja).
5. Nespēja panākt gestācijas diabēta kompensāciju ar diētas terapiju.
Pēc izcelsmes Insulīna preparātus var iedalīt trīs grupās:
Dzīvnieku insulīni (cūkgaļa);
Cilvēka insulīni (daļēji sintētiski, ģenētiski modificēti);
Insulīna analogi (lispro, asparts, glargīns, detemirs).
Cilvēka insulīna ražošanas tehnoloģiju attīstība ir ļāvusi izmantot cūkgaļas insulīns(atšķiras no cilvēka viena aminoskābe) pēdējā laikā ir ievērojami samazinājies. Cūku insulīnu var izmantot cilvēka insulīna ražošanai daļēji sintētiskā metode, kas ietver vienas dažādas aminoskābes aizstāšanu savā molekulā. Augstākā kvalitāte gēnu inženierija cilvēka insulīni. Lai tos iegūtu, cilvēka genoma reģions, kas ir atbildīgs par insulīna sintēzi, ir saistīts ar genomu E.coli vai rauga kultūra, kā rezultātā pēdējie sāk ražot cilvēka insulīnu. Radīšana insulīna analogi izmantojot dažādu aminoskābju pārkārtojumus, mērķis bija iegūt zāles ar vēlamo un vislabvēlīgāko farmakokinētiku. Tādējādi lispro insulīns (Humalog) ir analogs
īpaši īsas darbības insulīns, kura hipoglikēmiskā iedarbība attīstās 15 minūšu laikā pēc injekcijas. Insulīna analogam glargīnam (Lantus), gluži pretēji, ir raksturīga ilgstoša iedarbība, kas ilgst visu dienu, savukārt zāļu kinētikas iezīme ir izteiktu plazmas koncentrācijas maksimumu trūkums. Lielākā daļa pašlaik lietoto insulīna preparātu un to analogu tiek ražoti koncentrācijas 100 V/ml. Autors darbības ilgums insulīnus iedala 4 galvenajās grupās (7.4. tabula):
Tabula 7.4. Zāļu un insulīna analogu farmakokinētika
 1.
Īpaši īslaicīgas darbības (lispro, asparts).
1.
Īpaši īslaicīgas darbības (lispro, asparts).
2. Īsas darbības (vienkāršs cilvēka insulīns).
3. Vidējas darbības (neitrālie protamīna Hagedorna insulīni).
4. Ilgstošas darbības (glargīns, detemirs).
5. Dažāda darbības ilguma insulīnu maisījumi (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Narkotikas īpaši īsa darbība[lispro (Humalog), aspart (Novorapid)] ir insulīna analogi. To priekšrocības ir ātra hipoglikēmiskā efekta attīstība pēc injekcijas (pēc 15 minūtēm), kas ļauj injicēt tieši pirms ēšanas vai pat tūlīt pēc ēšanas, kā arī īss darbības ilgums (mazāk nekā 3 stundas), kas samazina risku hipoglikēmija. Narkotikas īsa darbība(vienkāršais insulīns, parastais insulīns) ir šķīdums, kas satur insulīnu koncentrācijā 100 U/ml. Vienkārša insulīna injekcija tiek veikta 30 minūtes pirms ēšanas; Darbības ilgums ir aptuveni 4-6 stundas. Īpaši īsas un īslaicīgas darbības zāles var ievadīt subkutāni, intramuskulāri un intravenozi.
Starp narkotikām vidējais darbības ilgums Visbiežāk lietotās zāles ir neitrāls protamīns Hagedorn (NPH). NPH ir proteīns, kas nekovalenti adsorbē insulīnu, palēninot tā uzsūkšanos no zemādas depo. NPH insulīnu efektīvais darbības ilgums parasti ir aptuveni 12 stundas; tos ievada tikai subkutāni. NPH insulīns ir suspensija, un tāpēc atšķirībā no vienkārša insulīna tas flakonā ir duļķains, un, ilgstoši stāvot, veidojas suspensija, kas pirms injekcijas ir rūpīgi jāsamaisa. NPH insulīnus, atšķirībā no citām ilgstošas darbības zālēm, var sajaukt jebkurā proporcijā ar īslaicīgas darbības insulīnu (vienkāršo insulīnu), un maisījuma sastāvdaļu farmakokinētika nemainīsies, jo NPH nesaistīs papildu daudzumu vienkāršā insulīna ( 7.5. att.). Turklāt protamīnu izmanto, lai sagatavotu standarta insulīna analogu maisījumus (Novomix-30, Humalog-Mix-25).
Starp ilgstošas darbības zālēm pašlaik aktīvi izmanto insulīna analogus. glargīns(Lantus) un detemirs(Levemirs). Šo zāļu farmakokinētikas labvēlīga iezīme ir tā, ka atšķirībā no NPH insulīniem tie nodrošina vienmērīgāku un ilgstošāku zāļu piegādi no zemādas depo. Šajā sakarā glargīnu var izrakstīt tikai vienu reizi dienā, praktiski neatkarīgi no diennakts laika.
 Rīsi. 7.5. Dažādu insulīna preparātu farmakokinētika:
Rīsi. 7.5. Dažādu insulīna preparātu farmakokinētika:
a) vienkomponentu; b) standarta insulīna maisījumi
Papildus monokomponentu insulīna preparātiem tos plaši izmanto klīniskajā praksē. standarta maisījumi. Parasti mēs runājam par īslaicīgas vai īpaši īslaicīgas darbības insulīna maisījumiem ar vidējas darbības insulīnu. Piemēram, zāles "Humulin-MZ" satur 30% vienkārša insulīna un 70% NPH insulīna vienā pudelē; zāles "Novomix-30" satur 30% asparta insulīna un 70% asparta insulīna kristāliskā protamīna suspensijas; zāles "Humalog-Mix-25" satur 25% lispro insulīna un 75% lispro insulīna protamīna suspensijas. Priekšrocība
standarta insulīna maisījumi ir divu injekciju aizstāšana ar vienu un nedaudz lielāka maisījuma sastāvdaļu dozēšanas precizitāte; Trūkums ir atsevišķu maisījuma sastāvdaļu individuālas dozēšanas neiespējamība. Tas nosaka priekšroku standarta insulīna maisījumu lietošanai T2DM vai t.s tradicionālā insulīna terapija( izrakstot noteiktas insulīna devas), savukārt par intensīva insulīna terapija(elastīga devas izvēle atkarībā no glikēmiskajiem rādītājiem un ogļhidrātu daudzuma pārtikā) priekšroka dodama vienkomponentu zāļu lietošanai.
Veiksmīgas insulīnterapijas atslēga ir stingra ievērošana injekcijas metodes. Ir vairāki veidi, kā ievadīt insulīnu. Vienkāršākā un uzticamākā metode ir injekcija, izmantojot insulīnu. šļirce.Ērtāks veids, kā ievadīt insulīnu, ir injekcijas šļirču pildspalvas, kas ir kombinēta ierīce, kurā ir insulīna rezervuārs (kārtridžs), dozēšanas sistēma un adata ar inžektoru.
Uzturošajai terapijai (ja nerunājam par smagu cukura diabēta dekompensāciju vai kritiskiem stāvokļiem) insulīnu ievada subkutāni. Īsas darbības insulīna injekcijas ieteicams veikt vēdera zemādas taukaudos, ilgstošas darbības insulīnu - augšstilba vai pleca audos (7.6. att. a). Injekcijas veic dziļi zemādas audos caur plaši saspiestu ādu 45° leņķī (7.6. att. b). Pacientam jāiesaka katru dienu mainīt insulīna injekcijas vietu tajā pašā vietā, lai novērstu lipodistrofiju attīstību.
UZ faktori, kas ietekmē insulīna uzsūkšanās ātrumu no subkutānās depo, jāņem vērā insulīna deva (devas palielināšana palielina uzsūkšanās ilgumu), injekcijas vieta (absorbcija no vēdera audiem notiek ātrāk) un apkārtējās vides temperatūra (sasilšana un injekcijas vietas masēšana paātrina uzsūkšanos ).
Sarežģītāka ievadīšanas metode, kas daudziem pacientiem tomēr ļauj sasniegt labus ārstēšanas rezultātus, ir lietošana insulīna dozators, vai sistēmas nepārtrauktai subkutānai insulīna ievadīšanai. Dozators ir pārnēsājama ierīce, kas sastāv no datora, kas iestata insulīna padeves režīmu, kā arī insulīna padeves sistēmas, kas caur katetru un miniatūru adatu tiek ievadīta zemādas dobumā.
 Rīsi. 7.6. Insulīna injekcijas: a) tipiskas injekcijas vietas; b) insulīna šļirces adatas novietojums injekcijas laikā
Rīsi. 7.6. Insulīna injekcijas: a) tipiskas injekcijas vietas; b) insulīna šļirces adatas novietojums injekcijas laikā
taukaudi. Izmantojot dozatoru, tiek veikta nepārtraukta īslaicīgas vai īpaši īslaicīgas darbības insulīna bazālā injekcija (ar ātrumu aptuveni 0,5-1 U/stundā), un pirms ēšanas atkarībā no ogļhidrātu satura un glikēmijas līmeņa pacients ievada nepieciešamo tā paša īslaicīgas darbības insulīna bolus devu. Insulīna terapijas priekšrocība, izmantojot dozatoru, ir tikai īslaicīgas darbības (vai pat īpaši īsas) insulīna ievadīšana, kas pats par sevi ir nedaudz fizioloģiskāks, jo ilgstošas darbības insulīna preparātu uzsūkšanās ir pakļauta lielām svārstībām; šajā ziņā ilgstoša īslaicīgas darbības insulīna ievadīšana šķiet vieglāk vadāms process. Insulīna terapijas trūkums, izmantojot dozatoru, ir nepieciešamība pastāvīgi valkāt ierīci, kā arī ilgstoša injekcijas adatas klātbūtne zemādas audos, kas prasa periodisku insulīna piegādes procesa uzraudzību. Insulīna terapija, izmantojot dozatoru, galvenokārt ir indicēta pacientiem ar 1. tipa cukura diabētu, kuri ir gatavi apgūt tās vadības tehniku. Īpaši šajā sakarā uzmanība jāpievērš pacientēm ar izteiktu rītausmas parādību, kā arī grūtniecēm un grūtniecību plānojošām pacientēm ar T1DM un pacientēm
cilvēkiem ar nesakārtotu dzīvesveidu (elastīgāka uztura iespēja).
7.5. 1. TIPA DIABĒTS
CD-1 - orgānu specifisks autoimūna slimība, kas izraisa insulīnu ražojošo β-šūnu iznīcināšanu aizkuņģa dziedzera saliņās, kas izpaužas kā absolūts insulīna deficīts. Dažos gadījumos pacientiem ar atklātu T1DM trūkst β-šūnu autoimūno bojājumu marķieru (idiopātisks DM-1).
Etioloģija
DM-1 ir slimība ar iedzimtu predispozīciju, bet tās ieguldījums slimības attīstībā ir neliels (nosaka tās attīstību aptuveni par 1/3). T1DM atbilstības līmenis identiskiem dvīņiem ir tikai 36%. T1D attīstības iespējamība bērnam ar slimu māti ir 1-2%, tēvam - 3-6%, brālim vai māsai - 6%. Viens vai vairāki humorālie autoimūnu β-šūnu bojājumu marķieri, kas ietver antivielas pret aizkuņģa dziedzera saliņām, antivielas pret glutamāta dekarboksilāzi (GAD65) un antivielas pret tirozīna fosfatāzi (IA-2 un ΙΑ-2β), tiek konstatēti 85-90% pacientu. . Tomēr galvenā loma β-šūnu iznīcināšanā ir šūnu imunitātes faktoriem. T1DM ir saistīts ar tādiem HLA haplotipiem kā DQA Un DQB kamēr tikai alēles HLA-DR/DQ var būt nosliece uz slimības attīstību, bet citi ir aizsargājoši. Ar paaugstinātu biežumu DM-1 tiek kombinēts ar citām autoimūnām endokrīnām (autoimūns tiroidīts, Adisona slimība) un neendokrīnām slimībām, piemēram, alopēcija, vitiligo, Krona slimība, reimatiskas slimības (7.5. tabula).
Patoģenēze
DM-1 izpaužas, kad 80-90% β-šūnu tiek iznīcināti autoimūna procesa rezultātā. Šī procesa ātrums un intensitāte var ievērojami atšķirties. Visbiežāk, kad tipisks kurss bērnu un jauniešu slimības, šis process norit diezgan ātri, kam seko strauja slimības izpausme, kurā var paiet tikai dažas nedēļas no pirmo klīnisko simptomu parādīšanās līdz ketoacidozes attīstībai (līdz ketoacidozes komai).
Tabula 7.5. 1 tipa cukura diabēts
 Tabulas turpinājums. 7.5
Tabulas turpinājums. 7.5
 Citos, daudz retākos gadījumos, parasti pieaugušajiem, kas vecāki par 40 gadiem, slimība var būt latenta. (latents autoimūns diabēts pieaugušajiem - LADA), Tajā pašā laikā slimības sākumā šādiem pacientiem bieži tiek diagnosticēts cukura diabēts-2, un vairākus gadus cukura diabēta kompensāciju var panākt, izrakstot sulfonilurīnvielas preparātus. Bet vēlāk, parasti pēc 3 gadiem, parādās absolūta insulīna deficīta pazīmes (svara zudums, ketonūrija, smaga hiperglikēmija, neskatoties uz tablešu hipoglikēmisko zāļu lietošanu).
Citos, daudz retākos gadījumos, parasti pieaugušajiem, kas vecāki par 40 gadiem, slimība var būt latenta. (latents autoimūns diabēts pieaugušajiem - LADA), Tajā pašā laikā slimības sākumā šādiem pacientiem bieži tiek diagnosticēts cukura diabēts-2, un vairākus gadus cukura diabēta kompensāciju var panākt, izrakstot sulfonilurīnvielas preparātus. Bet vēlāk, parasti pēc 3 gadiem, parādās absolūta insulīna deficīta pazīmes (svara zudums, ketonūrija, smaga hiperglikēmija, neskatoties uz tablešu hipoglikēmisko zāļu lietošanu).
T1DM patoģenēze, kā norādīts, balstās uz absolūtu insulīna deficītu. Glikozes nespēja iekļūt no insulīna atkarīgos audos (taukos un muskuļos) izraisa enerģijas deficītu, kā rezultātā pastiprinās lipolīze un proteolīze, kas ir saistītas ar svara zudumu. Glikēmijas līmeņa paaugstināšanās izraisa hiperosmolaritāti, ko pavada osmotiskā diurēze un smaga dehidratācija. Insulīna deficīta un enerģijas deficīta apstākļos tiek pārtraukta kontrainsulāro hormonu (glikagona, kortizola, augšanas hormona) ražošana, kas, neskatoties uz glikēmijas palielināšanos, izraisa glikoneoģenēzes stimulāciju. Paaugstināta lipolīze taukaudos izraisa ievērojamu brīvo taukskābju koncentrācijas palielināšanos. Ar insulīna deficītu aknu liposintētiskā spēja ir nomākta un brīva
taukskābes sāk iekļauties ketoģenēzē. Ketonu ķermeņu uzkrāšanās izraisa diabētiskās ketozes attīstību un pēc tam ketoacidozi. Progresīvi palielinoties dehidratācijai un acidozei, attīstās koma (skatīt apakšpunktu 7.7.1), kas, ja netiek veikta insulīnterapija un rehidratācija, neizbēgami beidzas ar nāvi.
Epidemioloģija
T1DM veido aptuveni 1,5–2% no visiem diabēta gadījumiem, un šis relatīvais skaitlis vēl vairāk samazināsies, jo strauji palielinās T2DM sastopamība. Mūža risks saslimt ar T1DM kaukāziešiem ir aptuveni 0,4%. Saslimstība ar 1. tipa cukura diabētu pieaug par 3% gadā: par 1,5% sakarā ar jauniem gadījumiem un vēl par 1,5% saistībā ar pacientu dzīves ilguma palielināšanos. T1DM izplatība mainās atkarībā no iedzīvotāju etniskā sastāva. 2000. gadā tas bija 0,02% Āfrikā, 0,1% Dienvidāzijā un Dienvidamerikā un Centrālamerikā un 0,2% Eiropā un Ziemeļamerikā. Visaugstākā saslimstība ar DM-1 ir Somijā un Zviedrijā (30-35 gadījumi uz 100 tūkstošiem iedzīvotāju gadā), bet vismazākā Japānā, Ķīnā un Korejā (attiecīgi 0,5-2,0 gadījumi). Maksimālais vecums T1DM izpausmei atbilst aptuveni 10-13 gadiem. Lielākajā daļā gadījumu T1DM izpaužas pirms 40 gadu vecuma.
Klīniskās izpausmes
IN tipiski gadījumi,Īpaši bērniem un jauniešiem T1DM debitē ar spilgtu klīnisko ainu, kas attīstās vairāku mēnešu vai pat nedēļu laikā. T1DM izpausmi var izraisīt infekcijas un citas vienlaicīgas slimības. Raksturīgs simptomi, kas raksturīgi visiem diabēta veidiem, saistīta ar hiperglikēmiju: polidipsija, poliūrija, ādas nieze, bet ar 1. tipa cukura diabētu tie ir ļoti izteikti. Tātad visas dienas garumā pacienti var izdzert un izdalīt līdz 5-10 litriem šķidruma. Konkrēts 1. tipa cukura diabēta gadījumā simptoms, ko izraisa absolūts insulīna deficīts, ir svara zudums, sasniedzot 10-15 kg 1-2 mēnešu laikā. Raksturīgs ar smagu vispārēju un muskuļu vājumu, samazinātu veiktspēju un miegainību. Slimības sākumā dažiem pacientiem var palielināties apetīte, kas, attīstoties ketoacidozei, dod vietu anoreksijai. Pēdējo raksturo acetona smaržas (vai augļu smaržas) parādīšanās no mutes, slikta dūša
piezīmes, vemšana, bieži sāpes vēderā (pseidoperitonīts), smaga dehidratācija un beidzas ar komas attīstību (skatīt apakšpunktu 7.7.1). Dažos gadījumos pirmā T1DM izpausme bērniem ir progresējoši apziņas traucējumi līdz pat komai, ko izraisa vienlaicīgas slimības, parasti infekcijas vai akūta ķirurģiska patoloģija.
Salīdzinoši retos T1DM attīstības gadījumos cilvēkiem, kas vecāki par 35-40 gadiem (latents autoimūns diabēts pieaugušajiem) slimība var neizpausties tik skaidri (mērena polidipsija un poliūrija, bez ķermeņa masas samazināšanās) un var tikt atklāta pat nejauši, regulāri nosakot glikēmisko līmeni. Šādos gadījumos pacientam nereti sākotnēji tiek diagnosticēts cukura diabēts-2 un tiek nozīmētas tabletes hipoglikemizējošās zāles (TGD), kas kādu laiku nodrošina pieņemamu cukura diabēta kompensāciju. Tomēr vairāku gadu laikā (bieži vien gada laikā) pacientam attīstās simptomi, ko izraisa pieaugošs absolūtais insulīna deficīts: svara zudums, nespēja uzturēt normālu glikēmiju uz TSP fona, ketoze, ketoacidoze.
Diagnostika
Ņemot vērā, ka DM-1 ir skaidra klīniskā aina un arī salīdzinoši reta slimība, skrīninga glikēmijas līmeņa noteikšana DM-1 diagnosticēšanai nav indicēta. Slimības attīstības iespējamība pacientu tuvākajos radiniekos ir zema, kas kopā ar efektīvu T1DM primārās profilakses metožu trūkumu nosaka slimības imunoģenētisko marķieru izpētes nepiemērotību viņiem. T1DM diagnoze vairumā gadījumu balstās uz nozīmīgas hiperglikēmijas noteikšanu pacientiem ar smagām absolūtā insulīna deficīta klīniskām izpausmēm. OGTT, lai diagnosticētu T1DM, ir jāveic ļoti reti.
Diferenciāldiagnoze
Apšaubāmos gadījumos (mērenas hiperglikēmijas noteikšana, ja nav acīmredzamu klīnisku izpausmju, izpausme salīdzinoši vecā vecumā), kā arī diferenciāldiagnozes nolūkos ar citiem cukura diabēta veidiem, tiek izmantota līmeņa noteikšana. C-peptīds(pamata un 2 stundas pēc ēšanas). Netiešā diagnostiskā vērtība apšaubāmos gadījumos definīcijai var būt imunoloģiskie marķieri CD-1 - antivielas pret saliņām
PZH, uz glutamāta dekarboksilāzi (GAD65) un tirozīna fosfatāzi (IA-2 un IA-2β). DM-1 un DM-2 diferenciāldiagnoze ir parādīta tabulā. 7.6.
Tabula 7.6. Diferenciāldiagnoze un atšķirības starp DM-1 un DM-2
 Ārstēšana
Ārstēšana
Jebkura veida cukura diabēta ārstēšana balstās uz trim galvenajiem principiem: glikozes līmeni pazeminošu terapiju (diabēta-1 gadījumā – insulīna terapiju), diētu un pacientu izglītošanu. Insulīna terapija ar DM-1 nodilumu aizstājējs raksturs un tā mērķis ir maksimāli imitēt hormona fizioloģisko ražošanu, lai sasniegtu pieņemtos kompensācijas kritērijus (7.3. tabula). Vistuvāk fizioloģiskajai insulīna sekrēcijai intensīva insulīna terapija. Nepieciešamība pēc insulīna, kas atbilst tās bazālā sekrēcija To nodrošina divas vidējas darbības insulīna injekcijas (no rīta un vakarā) vai viena ilgstošas darbības insulīna (glargīna) injekcija. Kopējā bazālā insulīna deva
Daudzums nedrīkst pārsniegt pusi no kopējās dienas vajadzības pēc zāles. Pārtikas vai bolus insulīna sekrēcija tiek aizstāts ar īslaicīgas vai īpaši īslaicīgas darbības insulīna injekcijām pirms katras ēdienreizes, un tā devu aprēķina, pamatojoties uz gaidāmās ēdienreizes laikā uzņemamo ogļhidrātu daudzumu un esošo glikēmijas līmeni, ko nosaka pacients, izmantojot glikometru pirms katras insulīna injekcijas (7.7. att.).
Aptuvens intensīva insulīna terapijas shēma, kas mainīsies gandrīz katru dienu, var attēlot šādi. Tiek pieņemts, ka ikdienas nepieciešamība pēc insulīna ir aptuveni 0,5-0,7 vienības uz 1 kg ķermeņa svara (pacientam, kas sver 70 kg, apmēram 35-50 vienības). Apmēram 1/3 - 1/2 no šīs devas būs ilgstošas darbības insulīns (20-25 V), 1/2 - 2/3 īsas vai īpaši īslaicīgas darbības insulīna. NPH insulīna devu sadala 2 injekcijās: no rīta 2/3 no tās devas (12 vienības), vakarā - 1/3 (8-10 vienības).
Mērķis pirmais posms Insulīna terapijas izvēle ir glikozes līmeņa normalizēšana tukšā dūšā. NPH insulīna vakara devu parasti ievada 22–23 stundās, rīta devu kopā ar īslaicīgas darbības insulīna injekciju pirms brokastīm. Izvēloties NPH insulīna vakara devu, jāpatur prātā iespēja attīstīt vairākus
 Rīsi. 7.7. Intensīva insulīna terapijas shēma
Rīsi. 7.7. Intensīva insulīna terapijas shēma
diezgan tipiskas parādības. Rīta hiperglikēmijas cēlonis var būt nepietiekama ilgstošas darbības insulīna deva, jo no rīta nepieciešamība pēc insulīna ievērojami palielinās. (“ausmas” fenomens). Papildus nepietiekamai devai rīta hiperglikēmiju var izraisīt tās pārpalikums - Somogyi fenomens(Somogyi), pēchipoglikēmijas hiperglikēmija. Šī parādība ir izskaidrojama ar to, ka audu maksimālā jutība pret insulīnu tiek novērota no pulksten 2 līdz 4 naktī. Tieši šajā laikā galveno kontrainsulāro hormonu (kortizola, augšanas hormona utt.) līmenis parasti ir viszemākais. Ja ilgstošas darbības insulīna vakara deva ir pārmērīga, tad šajā laikā hipoglikēmija. Klīniski tas var izpausties kā slikts miegs ar murgiem, neapzināta rīcība miegā, rīta galvassāpes un nogurums. Hipoglikēmijas attīstība šajā laikā izraisa ievērojamu glikagona un citu kontrainsulāro hormonu kompensācijas izdalīšanos, kam seko hiperglikēmija no rīta. Ja šādā situācijā vakarā ievadītā ilgstošas darbības insulīna deva netiek samazināta, bet gan palielināta, nakts hipoglikēmija un rīta hiperglikēmija pastiprināsies, kas galu galā var izraisīt hronisku insulīna pārdozēšanas sindromu (Somogyi sindromu), kas ir aptaukošanās kombinācija. ar hronisku cukura diabēta dekompensāciju, biežu hipoglikēmiju un progresējošām vēlīnām komplikācijām. Lai diagnosticētu Somogyi fenomenu, ir nepieciešams izpētīt glikēmisko līmeni aptuveni pulksten 3:00, kas ir insulīna terapijas izvēles neatņemama sastāvdaļa. Ja NPH vakara devas samazināšanos līdz drošai nakts hipoglikēmijai pavada hiperglikēmija no rīta (rīta rīta parādība), pacientam jāiesaka celties agrāk (6-7 no rīta), kamēr naktī ievadītais insulīns turpina uzturēt normālu. glikēmiskais līmenis.
Otro NPH insulīna injekciju parasti ievada pirms brokastīm kopā ar īsas darbības (īpaši īslaicīgas darbības) insulīna rīta injekciju. Šajā gadījumā devu izvēlas galvenokārt, pamatojoties uz glikēmisko līmeni pirms galvenajām ikdienas ēdienreizēm (pusdienām, vakariņām); turklāt to var ierobežot hipoglikēmijas attīstība starp ēdienreizēm, piemēram, pusdienlaikā, starp brokastīm un pusdienām.
Visa insulīna deva ilgstošas darbības(glargīns) tiek ievadīts vienu reizi dienā, un nav svarīgi, kurā laikā. Kinētika
glargīna insulīns un detemira insulīns ir labvēlīgāki hipoglikēmijas, tostarp nakts, attīstības riska ziņā.
Īsas vai īpaši īsas darbības insulīna deva pat pirmajā insulīna izrakstīšanas dienā pacientam būs atkarīga no patērēto ogļhidrātu daudzuma (maizes vienībām) un glikēmijas līmeņa pirms injekcijas. Parasti, pamatojoties uz parasto ikdienas insulīna sekrēcijas ritmu, vakariņām tiek atvēlēta apmēram 1/4 no īslaicīgas darbības insulīna devas (6-8 vienības), atlikušo devu sadala aptuveni vienādi brokastīs un pusdienās (10-12). vienības). Jo augstāks ir sākotnējais glikēmijas līmenis, jo mazāk tas samazināsies uz vienu ievadītā insulīna vienību. Īsas darbības insulīna injekciju veic 30 minūtes pirms ēšanas, īpaši īslaicīgas darbības insulīna injekciju tieši pirms ēšanas vai pat tūlīt pēc ēšanas. Īsas darbības insulīna devas atbilstību novērtē pēc glikēmijas rādītājiem 2 stundas pēc ēšanas un pirms nākamās ēdienreizes.
Lai aprēķinātu insulīna devu intensīvas insulīnterapijas laikā, ir pietiekami aprēķināt XE skaitu, pamatojoties tikai uz ogļhidrātu komponentu. Šajā gadījumā netiek ņemti vērā visi ogļhidrātus saturošie produkti, bet tikai tā sauktie saskaitāmie. Pie pēdējiem pieder kartupeļi, graudu produkti, augļi, šķidrie piena produkti un saldie produkti. Produkti, kas satur nesagremojamus ogļhidrātus (lielākā daļa dārzeņu), netiek ņemti vērā. Ir izstrādātas īpašas maiņas tabulas, ar kuru palīdzību, izsakot ogļhidrātu daudzumu XE, var aprēķināt nepieciešamo insulīna devu. Viens XE atbilst 10-12 g ogļhidrātu (10.7. tabula).
Pēc 1 XE saturošas ēdienreizes ēšanas glikēmiskais līmenis paaugstinās par 1,6-2,2 mmol/l, t.i. aptuveni tik daudz, cik glikozes līmenis samazinās, ievadot 1 insulīna vienību. Citiem vārdiem sakot, katram XE, kas atrodas pārtikā, kuru plānojat ēst, jums iepriekš jāievada aptuveni 1 insulīna vienība (atkarībā no diennakts laika). Turklāt ir jāņem vērā glikēmiskā līmeņa paškontroles rezultāti, kas tiek veikta pirms katras injekcijas, un diennakts laiks (apmēram 2 U insulīna uz 1 XE no rīta un pusdienās, 1 V par 1 XE vakariņās). Tātad, ja tiek konstatēta hiperglikēmija, insulīna deva, kas aprēķināta atbilstoši gaidāmajai ēdienreizei (pamatojoties uz XE skaitu), ir jāpalielina, un otrādi, ja tiek konstatēta hipoglikēmija, tiek ievadīts mazāk insulīna.
Tabula 7.7. Līdzvērtīga to izstrādājumu nomaiņa, kas veido 1 XE
 Piemēram, ja pacientam 30 minūtes pirms plānotajām vakariņām, kas satur 5 XE, glikēmijas līmenis ir 7 mmol/l, viņam jāievada 1 vienība insulīna, lai glikēmija samazinātos līdz normālam līmenim: no 7 mmol/l līdz aptuveni. 5 mmol/l. Turklāt, lai segtu 5 XE, jāievada 5 vienības insulīna. Tādējādi šajā gadījumā pacients injicēs 6 vienības īslaicīgas vai īpaši īsas darbības insulīna.
Piemēram, ja pacientam 30 minūtes pirms plānotajām vakariņām, kas satur 5 XE, glikēmijas līmenis ir 7 mmol/l, viņam jāievada 1 vienība insulīna, lai glikēmija samazinātos līdz normālam līmenim: no 7 mmol/l līdz aptuveni. 5 mmol/l. Turklāt, lai segtu 5 XE, jāievada 5 vienības insulīna. Tādējādi šajā gadījumā pacients injicēs 6 vienības īslaicīgas vai īpaši īsas darbības insulīna.
Pēc T1DM izpausmes un insulīna terapijas uzsākšanas pietiekami ilgu laiku nepieciešamība pēc insulīna var būt neliela un mazāka par 0,3-0,4 U/kg. Šo periodu sauc par remisijas fāzi vai "Medusmēnesis". Pēc hiperglikēmijas un ketoacidozes perioda, kas nomāc insulīna sekrēciju par 10-15% atlikušo β-šūnu, hormonālo vielmaiņas traucējumu kompensēšana ar insulīna ievadīšanu atjauno šo šūnu darbību, kuras pēc tam pārņem organisma nodrošināšanu ar insulīnu. minimālā līmenī. Šis periods var ilgt no vairākām nedēļām līdz vairākiem gadiem, bet galu galā atlikušo β-šūnu autoimūnās iznīcināšanas dēļ “medusmēnesis” beidzas.
Diēta T1DM apmācītiem pacientiem, kuriem ir paškontroles un insulīna devas izvēles prasmes, to var liberalizēt, t.i. tuvojas brīvs. Ja pacientam nav liekais svars vai nepietiekams svars, diētai jābūt
izokalorisks. Galvenā T1DM uztura sastāvdaļa ir ogļhidrāti, kuriem vajadzētu būt aptuveni 65% no ikdienas kalorijām. Priekšroka jādod produktiem, kas satur kompleksus, lēni uzsūcas ogļhidrātus, kā arī produktiem, kas bagāti ar šķiedrvielām. Jāizvairās no produktiem, kas satur viegli sagremojamus ogļhidrātus (milti, saldumi). Olbaltumvielu īpatsvars jāsamazina līdz 10-35%, kas palīdz samazināt mikroangiopātijas attīstības risku, bet tauku īpatsvars jāsamazina līdz 25-35%, savukārt ierobežojošajiem taukiem vajadzētu būt līdz 7% no kalorijām, kas. samazina aterosklerozes attīstības risku. Turklāt ir jāizvairās no alkoholisko dzērienu, īpaši stipro, dzeršanas.
Neatņemama sastāvdaļa darbā ar pacientu ar T1DM un efektīvas kompensācijas atslēga ir pacientu izglītošana. Visas dzīves laikā pacientam neatkarīgi no daudziem faktoriem katru dienu jāmaina insulīna deva. Acīmredzot, tas prasa apgūt noteiktas prasmes, kas jāiemāca pacientam. “Pacientu skola ar DM-1” tiek organizēta endokrinoloģijas slimnīcās vai ambulatori un sastāv no 5-7 strukturētām nodarbībām, kurās ārsts vai speciāli apmācīta medmāsa interaktīvi, izmantojot dažādus uzskates līdzekļus, māca pacientiem principus. paškontrole.
Prognoze
Insulīna terapijas trūkuma gadījumā 1. tipa cukura diabēta pacients neizbēgami mirst no ketoacidozes komas. Pie neadekvātas insulīnterapijas, uz kuras fona netiek sasniegti cukura diabēta kompensācijas kritēriji un pacients atrodas hroniskas hiperglikēmijas stāvoklī (7.3. tabula), sāk attīstīties un progresēt vēlīnās komplikācijas (7.8. punkts). T1DM gadījumā vislielākā klīniskā nozīme šajā sakarā ir diabētiskās mikroangiopātijas (nefropātijas un retinopātijas) un neiropātijas (diabētiskās pēdas sindroma) izpausmēm. Makroangiopātija 1. tipa cukura diabēta gadījumā priekšplānā izvirzās salīdzinoši reti.
7.6. 2. TIPA DIABĒTS
2 tipa cukura diabēts- hroniska slimība, kas izpaužas kā traucēta ogļhidrātu vielmaiņa ar hiperglikēmijas attīstību insulīna rezistences un β-šūnu sekrēcijas disfunkcijas dēļ;
kā arī lipīdu metabolismu ar aterosklerozes attīstību. Tā kā galvenais pacientu nāves un invaliditātes cēlonis ir sistēmiskas aterosklerozes komplikācijas, T2DM dažreiz sauc par sirds un asinsvadu slimībām.
Tabula 7.8. 2 tipa cukura diabēts
 Etioloģija
Etioloģija
T2DM ir daudzfaktoru slimība ar iedzimtu predispozīciju. T2DM atbilstība identiskiem dvīņiem sasniedz 80% vai vairāk. Lielākā daļa pacientu ar T2DM norāda uz T2DM klātbūtni viņu tuvākajā ģimenē; Ja vienam no vecākiem ir T2DM, tā attīstības iespējamība pēcnācējam dzīves laikā ir 40%. Nav atrasts neviens gēns, kura polimorfisms nosaka noslieci uz T2DM. Vides faktoriem, galvenokārt dzīvesveida iezīmēm, ir liela nozīme iedzimtas noslieces uz T2DM realizācijā. T2DM attīstības riska faktori ir:
Aptaukošanās, īpaši viscerāla (sk. 11.2. punktu);
Etniskā piederība (īpaši, mainot tradicionālo dzīvesveidu pret Rietumu);
Mazkustīgs dzīvesveids;
Uztura īpatnības (liels rafinētu ogļhidrātu patēriņš un zems šķiedrvielu saturs);
Arteriālā hipertensija.
Patoģenēze
Patoģenētiski T2DM ir neviendabīga vielmaiņas traucējumu grupa, kas nosaka tās nozīmīgo klīnisko neviendabīgumu. Tās patoģenēzes pamatā ir insulīna rezistence (ar insulīnu saistīta glikozes izmantošanas samazināšanās audos), kas rodas β-šūnu sekrēcijas disfunkcijas fona apstākļos. Tādējādi ir nelīdzsvarotība insulīna jutībā un insulīna sekrēcijā. Sekretāra disfunkcijaβ - šūnas sastāv no insulīna “agrīnas” sekrēcijas izdalīšanās palēnināšanas, reaģējot uz glikozes līmeņa paaugstināšanos asinīs. Šajā gadījumā 1. (ātrā) sekrēcijas fāze, kas sastāv no vezikulu iztukšošanas ar uzkrāto insulīnu, praktiski nav; 2. (lēnā) sekrēcijas fāze notiek, reaģējot uz stabilizējošu hiperglikēmiju pastāvīgi, tonizējošā režīmā, un, neskatoties uz pārmērīgu insulīna sekrēciju, glikēmijas līmenis uz insulīna rezistences fona nenormalizē (7.8. att.).
Hiperinsulinēmijas sekas ir insulīna receptoru jutības un skaita samazināšanās, kā arī nomākums.
postreceptoru mehānismi, kas mediē insulīna iedarbību (insulīna rezistence). Galvenā glikozes transportētāja saturs muskuļu un tauku šūnās (GLUT-4) ir samazināts par 40% indivīdiem ar viscerālu aptaukošanos un par 80% indivīdiem ar 2. tipa cukura diabētu. Sakarā ar hepatocītu rezistenci pret insulīnu rodas portāla hiperinsulinēmija glikozes pārprodukcija aknās, un attīstās hiperglikēmija tukšā dūšā, kas tiek konstatēta lielākajai daļai pacientu ar T2DM, tostarp slimības sākuma stadijā.
Pati hiperglikēmija nelabvēlīgi ietekmē β-šūnu sekrēcijas aktivitātes raksturu un līmeni (glikotoksicitāte). Ilgtermiņa, daudzu gadu un gadu desmitu laikā esošā hiperglikēmija galu galā noved pie β-šūnu insulīna ražošanas samazināšanās, un pacientam var rasties daži simptomi. insulīna deficīts- svara zudums, ketoze ar vienlaicīgām infekcijas slimībām. Tomēr atlikušā insulīna ražošana, kas ir pietiekama, lai novērstu ketoacidozi, gandrīz vienmēr tiek saglabāta T2DM.
Epidemioloģija
T2DM nosaka diabēta epidemioloģiju kopumā, jo tas veido aptuveni 98% šīs slimības gadījumu. T2DM izplatība dažādās valstīs un etniskajās grupās ir atšķirīga. Eiropas valodā
 Rīsi. 7.8.β-šūnu sekrēcijas disfunkcija 2. tipa cukura diabēta gadījumā (1. ātrās insulīna sekrēcijas fāzes zudums)
Rīsi. 7.8.β-šūnu sekrēcijas disfunkcija 2. tipa cukura diabēta gadījumā (1. ātrās insulīna sekrēcijas fāzes zudums)
valstīs, ASV un Krievijas Federācijā, tas veido aptuveni 5-6% no iedzīvotāju skaita. Saslimstība ar T2DM pieaug līdz ar vecumu: pieaugušajiem T2DM izplatība ir 10%, bet cilvēkiem, kas vecāki par 65 gadiem, tā sasniedz 20%. T2DM sastopamība ir 2,5 reizes lielāka Amerikas pamatiedzīvotāju un havajiešu vidū; starp Pima indiāņiem (Arizona) tas sasniedz 50%. Indijas, Ķīnas, Čīles un Āfrikas valstu lauku iedzīvotājiem, kuri piekopj tradicionālu dzīvesveidu, T2DM izplatība ir ļoti zema (mazāk nekā 1%). Savukārt Rietumu industriālo valstu imigrantu vidū tas sasniedz ievērojamu līmeni. Tādējādi starp imigrantiem no Indijas un Ķīnas, kas dzīvo ASV un Lielbritānijā, T2DM izplatība sasniedz 12-15%.
PVO prognozē diabēta slimnieku skaita pieaugumu pasaulē par 122% nākamo 20 gadu laikā (no 135 līdz 300 miljoniem). Tas ir saistīts gan ar progresējošu iedzīvotāju novecošanos, gan ar urbanizēta dzīvesveida izplatību un pasliktināšanos. Pēdējos gados ir notikusi ievērojama T2DM “atjaunošanās” un tā sastopamības palielināšanās bērnu vidū.
Klīniskās izpausmes
Vairumā gadījumu, nav izteiktu klīnisku izpausmju, un diagnoze tiek noteikta, regulāri nosakot glikēmisko līmeni. Slimība parasti izpaužas vecumā virs 40 gadiem, savukārt lielākajai daļai pacientu ir aptaukošanās un citas metaboliskā sindroma sastāvdaļas (skatīt 11.2. apakšpunktu). Pacienti nesūdzas par samazinātu veiktspēju, ja tam nav citu iemeslu. Sūdzības par slāpēm un poliūriju reti sasniedz ievērojamu smagumu. Diezgan bieži pacientus nomoka ādas un maksts nieze, tāpēc viņi vēršas pie dermatologiem un ginekologiem. Tā kā no faktiskās T2DM izpausmes līdz diagnozei bieži paiet daudzi gadi (vidēji aptuveni 7 gadi), daudziem pacientiem klīniskajā attēlā dominē diabēta vēlīnu komplikāciju simptomi un izpausmes. Turklāt T2DM pacienta pirmā vizīte medicīniskajā aprūpē ļoti bieži notiek novēlotu komplikāciju dēļ. Tādējādi pacienti var tikt hospitalizēti ķirurģiskās slimnīcās ar čūlainiem kāju bojājumiem (diabētiskās pēdas sindroms), sazinieties ar oftalmologu progresējoša redzes zuduma dēļ (diabētiskā retinopātija), tikt hospitalizētam ar sirdslēkmi, insultu
tami, iznīcinot kāju asinsvadu bojājumus iestādēs, kur pirmo reizi tiek konstatēta hiperglikēmija.
Diagnostika
Diagnostikas kritēriji, kas ir kopīgi visiem diabēta veidiem, ir parādīti 7.3. punktā. DM-2 diagnoze vairumā gadījumu ir balstīta uz hiperglikēmijas noteikšanu personām ar tipiskām DM-2 klīniskajām pazīmēm (aptaukošanās, vecums virs 40-45 gadiem, pozitīva DM-2 ģimenes anamnēze, citi komponenti). metaboliskais sindroms), ja nav klīnisku un laboratorisku pazīmju, absolūts insulīna deficīts (izteikts svara zudums, ketoze). T2DM augstās izplatības kombinācija, tai raksturīgā ilgstoša asimptomātiskā gaita un iespēja novērst smagas komplikācijas ar agrīnu diagnostiku, nosaka nepieciešamību skrīnings, tie. izmeklējuma veikšana, lai izslēgtu T2DM starp personām bez slimības simptomiem. Galvenais tests, kā norādīts, ir noteikšana glikozes līmenis asinīs tukšā dūšā. Tas ir norādīts šādos gadījumos:
1. Visiem cilvēkiem, kas vecāki par 45 gadiem, īpaši ar lieko ķermeņa masu (ĶMI vairāk nekā 25 kg/m2) ar intervālu ik pēc 3 gadiem.
2. Jaunākā vecumā, ja ir liekais ķermeņa svars (ĶMI virs 25 kg/m2) un papildu riska faktori, kas ietver:
Mazkustīgs dzīvesveids;
CD-2 tuviem radiniekiem;
Piederība tautībām, kurām ir augsts T2DM attīstības risks (afroamerikāņi, spāņi, indiāņi utt.);
Sievietes, kuras dzemdējušas bērnu, kas sver vairāk par 4 kg un/vai kurām anamnēzē ir bijis gestācijas diabēts;
Arteriālā hipertensija (≥ 140/90 mm Hg);
ABL līmenis > 0,9 mmol/l un/vai triglicerīdi > 2,8 mmol/l;
policistisko olnīcu sindroms;
NTG un NGNT;
Sirds un asinsvadu slimības.
Ievērojams T2DM sastopamības pieaugums bērnu vidū nosaka nepieciešamību veikt skrīninga glikēmijas līmeņa noteikšanu. bērnu un pusaudžu vidū(sākot no 10 gadiem ar 2 gadu intervālu vai ar sākumu
pubertāte, ja tā iestājusies agrākā vecumā), kas pieder pie augsta riska grupām, kuru skaitā ir bērni ar lieko ķermeņa svaru(ĶMI un/vai svars > 85. procentile vecumam vai svaram, kas pārsniedz 120% no ideālā svara) kombinācijā ar jebkuriem diviem no šiem papildu riska faktoriem:
CD-2 pirmās vai otrās pakāpes radinieku vidū;
Piederība augsta riska tautībām;
Klīniskās izpausmes, kas saistītas ar rezistenci pret insulīnu (acanthosis nigricans, arteriālā hipertensija, dislipidēmija);
Cukura diabēts, tostarp gestācijas diabēts, mātei.
Diferenciāldiagnoze
Vislielākā klīniskā nozīme ir DM-2 un DM-1 diferenciāldiagnozei, kuras principi ir aprakstīti 7.5. punktā (7.6. tabula). Kā norādīts, vairumā gadījumu tas ir balstīts uz klīniskiem datiem. Gadījumos, kad ir apgrūtināta diabēta veida noteikšana vai ir aizdomas par kādu retu diabēta variantu, tai skaitā iedzimtu sindromu ietvaros, svarīgākais praktiskais jautājums, uz kuru jāatbild, ir, vai pacientam nepieciešama insulīnterapija.
Ārstēšana
Galvenās DM2 ārstēšanas sastāvdaļas ir: diētas terapija, palielināta fiziskā aktivitāte, hipoglikēmiskā terapija, DM vēlīnu komplikāciju profilakse un ārstēšana. Tā kā lielākā daļa pacientu ar T2DM ir aptaukojušies, diētai jābūt vērstai uz svara zudumu (hipokalorisku) un vēlīnu komplikāciju, galvenokārt makroangiopātijas (aterosklerozes) novēršanu. Hipokaloriskā diēta nepieciešama visiem pacientiem ar lieko ķermeņa masu (ĶMI 25-29 kg/m2) vai aptaukošanos (ĶMI > 30 kg/m2). Vairumā gadījumu būtu ieteicams samazināt ikdienas kaloriju patēriņu līdz 1000-1200 kcal sievietēm un līdz 1200-1600 kcal vīriešiem. Ieteicamā galveno pārtikas sastāvdaļu attiecība DM-2 ir līdzīga kā DM-1 (ogļhidrāti - 65%, olbaltumvielas 10-35%, tauki līdz 25-35%). Izmantot alkohols jāierobežo, jo tas ir nozīmīgs papildu kaloriju avots; turklāt alkohola lietošana terapijas laikā
Sulfonilurīnvielas atvasinājumu un insulīna uzņemšana var izraisīt hipoglikēmijas attīstību (skatīt apakšpunktu 7.7.3).
Ieteikumi priekš fiziskās aktivitātes palielināšana jābūt individualizētam. Sākumā ieteicami mērenas intensitātes aerobikas vingrinājumi (pastaigas, peldēšana) 30-45 minūtes 3-5 reizes dienā (apmēram 150 minūtes nedēļā). Nākotnē ir nepieciešama pakāpeniska fiziskās aktivitātes palielināšana, kas būtiski veicina ķermeņa masas samazināšanos un normalizēšanos. Turklāt fiziskās aktivitātes palīdz samazināt insulīna rezistenci un tai ir hipoglikēmiska iedarbība. Diētas terapijas un palielinātas fiziskās aktivitātes kombinācija bez glikozes līmeni pazeminošu zāļu parakstīšanas ļauj uzturēt diabēta kompensāciju atbilstoši izvirzītajiem mērķiem (7.3. tabula) aptuveni 5% pacientu ar T2DM.
Zāles priekš hipoglikēmiskā terapija ar T2DM var iedalīt četrās galvenajās grupās.
I. Zāles, kas palīdz samazināt insulīna rezistenci (sensibilizatori).Šajā grupā ietilpst metformīns un tiazolidīndioni. Metformīns ir vienīgā narkotika no grupas, ko pašlaik lieto biguanīdi. Tās darbības mehānisma galvenās sastāvdaļas ir:
1. Glikoneoģenēzes nomākšana aknās (glikozes ražošanas samazināšanās aknās), kas izraisa glikozes līmeņa pazemināšanos tukšā dūšā.
2. Samazināta insulīna rezistence (palielināta glikozes izmantošana perifērajos audos, galvenokārt muskuļos).
3. Anaerobās glikolīzes aktivizēšana un glikozes uzsūkšanās samazināšana tievajās zarnās.
Metformīns ir pirmās izvēles zāles glikozes līmeni pazeminošai terapijai pacientiem ar 2. tipa cukura diabētu, aptaukošanos un hiperglikēmiju tukšā dūšā. Sākumdeva ir 500 mg naktī vai vakariņu laikā. Pēc tam devu pakāpeniski palielina līdz 2-3 gramiem 2-3 devās. Starp blakusparādībām salīdzinoši bieži sastopama dispepsija (caureja), kas parasti ir pārejoša un izzūd pati pēc 1-2 nedēļām pēc zāļu lietošanas. Tā kā metformīnam nav stimulējošas ietekmes uz insulīna ražošanu, šīs zāles monoterapijas laikā hipoglikēmija nenotiek.
attīstīties (tā darbība tiks apzīmēta kā antihiperglikēmiska, nevis hipoglikēmiska). Kontrindikācijas metformīna lietošanai ir grūtniecība, smaga sirds, aknu, nieru un citu orgānu mazspēja, kā arī citas izcelsmes hipoksiskie stāvokļi. Ļoti reta komplikācija, kas rodas, ja metformīns tiek parakstīts, neņemot vērā iepriekš minētās kontrindikācijas, ir laktacidoze, kas ir anaerobās glikolīzes hiperaktivācijas sekas.
Tiazolidīndioni(pioglitazons, rosiglitazons) ir peroksisomu proliferatoru aktivētu receptoru γ (PPAR-γ) agonisti. Tiazolidīndioni aktivizē glikozes un lipīdu metabolismu muskuļos un taukaudos, kas izraisa endogēnā insulīna aktivitātes palielināšanos, t.i. Lai novērstu insulīna rezistenci (insulīna sensibilizatorus). Pioglitazona dienas deva ir 15-30 mg/dienā, rosiglitazona - 4-8 mg (1-2 devām). Tiazolidīndionu kombinācija ar metformīnu ir ļoti efektīva. Kontrindikācija tiazolidīndionu lietošanai ir aknu transamināžu līmeņa paaugstināšanās (2,5 reizes vai vairāk). Papildus hepatotoksicitātei tiazolidīndionu blakusparādības ietver šķidruma aizturi un tūsku, kas biežāk attīstās, ja zāles tiek kombinētas ar insulīnu.
II. Narkotikas, kas ietekmēβ -šūnu un veicina palielinātu insulīna sekrēciju.Šajā grupā ietilpst sulfonilurīnvielas atvasinājumi un glinīdi (ēdienreizes glikēmijas regulatori), ko galvenokārt izmanto, lai normalizētu glikēmisko līmeni pēc ēšanas. Galvenais mērķis sulfonilurīnvielas atvasinājumi(PSM) ir aizkuņģa dziedzera saliņu β-šūnas. PSM saistās ar specifiskiem receptoriem uz β-šūnu membrānas. Tas noved pie ATP atkarīgo kālija kanālu slēgšanas un šūnu membrānas depolarizācijas, kas savukārt veicina kalcija kanālu atvēršanos. Kalcija iekļūšana β-šūnās izraisa to degranulāciju un insulīna izdalīšanos asinīs. Klīniskajā praksē izmanto diezgan daudz PSM, kas atšķiras pēc glikozes līmeni pazeminošās iedarbības ilguma un smaguma pakāpes (7.9. tabula).
Tabula 7.9. Sulfonilurīnvielas atvasinājumi
 Galvenā un diezgan izplatītā PSM blakusparādība ir hipoglikēmija (skatīt 7.7.3. apakšpunktu). Tas var rasties ar zāļu pārdozēšanu, tā uzkrāšanos (nieru mazspēja),
Galvenā un diezgan izplatītā PSM blakusparādība ir hipoglikēmija (skatīt 7.7.3. apakšpunktu). Tas var rasties ar zāļu pārdozēšanu, tā uzkrāšanos (nieru mazspēja),
diētas neievērošana (ēdienreižu izlaišana, alkohola lietošana) vai režīma neievērošana (būtiskas fiziskās aktivitātes, pirms kurām netika samazināta PSM deva vai netika uzņemti ogļhidrāti).
Uz grupu glinīdi(ēdienu glikēmijas regulatori) ietver repaglinīds(benzoskābes atvasinājums; dienas deva 0,5-16 mg/dienā) un nateglinīds(D-fenilalanīna atvasinājums; dienas deva 180-540 mg/dienā). Pēc ievadīšanas zāles ātri un atgriezeniski mijiedarbojas ar β-šūnu sulfonilurīnvielas receptoriem, kā rezultātā īslaicīgi palielinās insulīna līmenis, kas atdarina normālas insulīna sekrēcijas pirmo fāzi. Zāles lieto 10-20 minūtes pirms galvenajām ēdienreizēm, parasti 3 reizes dienā.
III. Zāles, kas samazina glikozes uzsūkšanos zarnās.
Šajā grupā ietilpst akarboze un guāra sveķi. Akarbozes darbības mehānisms ir atgriezeniska α-glikozidāžu blokāde tievajās zarnās, kā rezultātā palēninās secīgās fermentācijas un ogļhidrātu uzsūkšanās procesi, samazinās rezorbcijas ātrums un glikozes iekļūšana aknās. , un pēc ēšanas glikēmijas līmenis samazinās. Akarbozes sākotnējā deva ir 50 mg 3 reizes dienā, pēc tam devu var palielināt līdz 100 mg 3 reizes dienā; zāles lieto tieši pirms ēšanas vai ēšanas laikā. Akarbozes galvenā blakusparādība ir zarnu dispepsija (caureja, meteorisms), kas saistīta ar neuzsūktu ogļhidrātu iekļūšanu resnajā zarnā. Akarbozes glikozes līmeni pazeminošā iedarbība ir ļoti mērena (7.10. tabula).
Klīniskajā praksē tabletes hipoglikēmiskās zāles tiek efektīvi kombinētas savā starpā un ar insulīna zālēm, jo lielākajai daļai pacientu vienlaikus tiek konstatēta hiperglikēmija tukšā dūšā un pēc ēšanas. Ir daudz fiksētas kombinācijas zāles vienā tabletē. Visbiežāk metformīns tiek kombinēts ar dažādiem PSM vienā tabletē, kā arī metformīns ar tiazolidīndioniem.
Tabula 7.10. Tablešu hipoglikēmisko zāļu darbības mehānisms un iespējamā efektivitāte
 IV. Insulīni un insulīna analogi
IV. Insulīni un insulīna analogi
Noteiktā stadijā līdz 30-40% pacientu ar T2DM sāk saņemt insulīna preparātus. Indikācijas insulīna terapijai 2. tipa cukura diabēta gadījumā ir norādītas 7.4. apakšpunkta sākumā. Visizplatītākā iespēja pacientus ar T2DM pārcelt uz insulīnterapiju, ir ilgstošas darbības insulīna (NPH insulīna, glargīna vai detemira) parakstīšana kombinācijā ar glikozes līmeni pazeminošu zāļu tabletēm. Situācijā, kad glikozes līmeni asinīs tukšā dūšā nevar kontrolēt, izrakstot metformīnu vai pēdējais ir kontrindicēts, pacientam tiek nozīmēta vakara (nakts) insulīna injekcija. Ja ar tabletēm nav iespējams kontrolēt gan tukšā dūšā, gan pēc ēšanas glikēmiju, pacients tiek pārcelts uz monoinsulīna terapiju. Parasti T2DM gadījumā insulīna terapiju veic saskaņā ar tā saukto "tradicionālā" shēma kas ietver fiksētas ilgstošas un īslaicīgas darbības insulīna devu izrakstīšanu. Šajā plānā
Ērti ir standarta insulīna maisījumi, kas satur īsu (īpaši īsu) un ilgstošas darbības insulīnu vienā pudelē. Tradicionālās insulīnterapijas izvēli nosaka tas, ka T2DM gadījumā tā bieži tiek nozīmēta gados vecākiem pacientiem, kuriem ir grūti iemācīt patstāvīgi mainīt insulīna devu. Turklāt intensīva insulīnterapija, kuras mērķis ir uzturēt ogļhidrātu metabolisma kompensāciju līmenī, kas tuvojas normoglikēmijai, rada paaugstinātu hipoglikēmijas risku. Lai gan viegla hipoglikēmija nerada nopietnu risku jaunākiem pacientiem, tai var būt ļoti nelabvēlīgas kardiovaskulāras sekas gados vecākiem pacientiem ar zemāku hipoglikēmijas slieksni. Jauniem pacientiem ar T2DM, kā arī pacientiem ar daudzsološām efektīvas mācīšanās iespējām var nozīmēt intensīvu insulīnterapijas versiju.
Prognoze
Galvenais invaliditātes un nāves cēlonis pacientiem ar T2DM ir vēlīnās komplikācijas (skatīt 7.8. apakšpunktu), visbiežāk diabētiskā makroangiopātija. Atsevišķu vēlīnu komplikāciju rašanās risku nosaka faktoru komplekss, kas aplūkots attiecīgajās nodaļās. Universāls riska faktors to attīstībai ir hroniska hiperglikēmija. Tādējādi HbA1c līmeņa pazemināšanās pacientiem ar 2. tipa cukura diabētu par 1% noved pie kopējās mirstības samazināšanās attiecīgi par aptuveni 20%, par 2% un 3% - par aptuveni 40%.
7.7. DIABĒTA AKŪTAS KOMPlikācijas
7.7.1. Diabētiskā ketoacidoze
Diabētiskā ketoacidoze (DKA)- DM-1 dekompensācija, ko izraisa absolūts insulīna deficīts, kas, ja nav savlaicīgas ārstēšanas, beidzas ar ketoacidotisko komu (KC) un nāvi.
Etioloģija
DKA izraisa absolūts insulīna deficīts. T1DM izpausmes laikā lielākajai daļai pacientu tiek noteikta dažāda smaguma DKA (10-20% no visiem DKA gadījumiem).
Pacientam ar diagnosticētu T1DM diagnozi DKA var attīstīties, pārtraucot insulīna ievadīšanu, bieži vien pats pacients (13% DKA gadījumu), ņemot vērā pavadošās slimības, galvenokārt infekcijas, ja nepalielinās insulīna devu
Tabula 7.11. Diabētiskā ketoacidoze
 Līdz 20% gadījumu DKA attīstība jauniem pacientiem ar T1DM ir saistīta ar psiholoģiskām problēmām un/vai ēšanas traucējumiem (bailes no svara pieauguma, bailēm no hipoglikēmijas, pusaudžu problēmām). Diezgan izplatīts DKA cēlonis vairākās valstīs ir
Līdz 20% gadījumu DKA attīstība jauniem pacientiem ar T1DM ir saistīta ar psiholoģiskām problēmām un/vai ēšanas traucējumiem (bailes no svara pieauguma, bailēm no hipoglikēmijas, pusaudžu problēmām). Diezgan izplatīts DKA cēlonis vairākās valstīs ir
insulīna izņemšana, ko veicis pats pacients, jo dažiem iedzīvotāju slāņiem zāļu izmaksas ir augstas (7.11. tabula).
Patoģenēze
DKA patoģenēze balstās uz absolūtu insulīna deficītu apvienojumā ar pretsola hormonu, piemēram, glikagona, kateholamīnu un kortizola, ražošanas pieaugumu. Tā rezultātā ievērojami palielinās glikozes ražošana aknās un tiek traucēta tās izmantošana perifērajos audos, palielinās hiperglikēmija un tiek pārkāpta ārpusšūnu telpas osmolaritāte. Insulīna deficīts kombinācijā ar relatīvu kontrainsulāro hormonu pārpalikumu DKA izraisa brīvo taukskābju izdalīšanos cirkulācijā (lipolīze) un to nekontrolētu oksidēšanos aknās par ketonu ķermeņiem (β-hidroksibutirāts, acetoacetāts, acetons), kā rezultātā rodas hiperketonēmijas attīstība un pēc tam metaboliskā acidoze. Smagas glikozūrijas rezultātā attīstās osmotiskā diurēze, dehidratācija, nātrija, kālija un citu elektrolītu zudums (7.9. att.).
Epidemioloģija
Jaunu DKA gadījumu biežums ir 5-8 uz 1000 pacientiem ar 1. tipa cukura diabētu gadā un tieši atkarīgs no diabēta pacientu medicīniskās aprūpes organizēšanas līmeņa. Amerikas Savienotajās Valstīs katru gadu notiek aptuveni 100 000 hospitalizāciju DKA dēļ, un, ja pacienta izmaksas ir USD 13 000 par vienu hospitalizāciju, vairāk nekā 1 miljards USD gadā tiek tērēts DKA stacionārajai aprūpei. Krievijas Federācijā 2005. gadā DKA tika reģistrēta 4,31% bērnu, 4,75% pusaudžu un 0,33% pieaugušo pacientu ar T1DM.
Klīniskās izpausmes
DKA attīstība atkarībā no cēloņa, kas to izraisīja, var ilgt no vairākām nedēļām līdz dienai. Vairumā gadījumu pirms DKA parādās dekompensēta diabēta simptomi, bet dažreiz tiem var nebūt laika attīstīties. DKA klīniskie simptomi ir poliūrija, polidipsija, svara zudums, izkliedētas sāpes vēderā (“diabētiskais pseidoperitonīts”), dehidratācija, smags vājums, acetona smaka no elpas (vai augļu smarža) un pakāpeniska apziņas apduļķošanās. Patiesa koma ar DKA pēdējā laikā ir attīstījusies salīdzinoši reti agrīnas diagnostikas dēļ. Fiziskā apskate atklāj dehidratācijas pazīmes: pazemināta
 Rīsi. 7.9. Ketoacidotiskās komas patoģenēze
Rīsi. 7.9. Ketoacidotiskās komas patoģenēze
ādas turgors un acs ābola blīvums, tahikardija, hipotensija. Izvērstos gadījumos attīstās Kussmaul elpošana. Vairāk nekā 25% pacientu ar DKA attīstās vemšana, kas pēc krāsas var atgādināt kafijas biezumus.
Diagnostika
Pamatojoties uz klīniskās ainas datiem, norādēm, ka pacientam ir 1. tipa cukura diabēts, kā arī laboratorisko izmeklējumu datiem. DKA raksturo hiperglikēmija (dažos gadījumos neliela), ketonūrija, metaboliskā acidoze, hiperosmolaritāte (7.12. tabula).
Tabula 7.12. Cukura diabēta akūtu komplikāciju laboratoriskā diagnostika
 Pārbaudot pacientus ar akūtu cukura diabēta dekompensāciju, nepieciešams noteikt glikēmijas, kreatinīna un urīnvielas un elektrolītu līmeni, pamatojoties uz kuriem tiek aprēķināta efektīvā osmolaritāte. Turklāt ir nepieciešams novērtēt skābju-bāzes stāvokli. Efektīva osmolaritāte(EO) aprēķina, izmantojot šādu formulu: 2 *. Parasti EO ir 285–295 mOsm/l.
Pārbaudot pacientus ar akūtu cukura diabēta dekompensāciju, nepieciešams noteikt glikēmijas, kreatinīna un urīnvielas un elektrolītu līmeni, pamatojoties uz kuriem tiek aprēķināta efektīvā osmolaritāte. Turklāt ir nepieciešams novērtēt skābju-bāzes stāvokli. Efektīva osmolaritāte(EO) aprēķina, izmantojot šādu formulu: 2 *. Parasti EO ir 285–295 mOsm/l.
Lielākajai daļai pacientu ar DKA, leikocitoze, kuru smagums ir proporcionāls ketonvielu līmenim asinīs. Līmenis nātrijs, kā likums, tas tiek samazināts sakarā ar šķidruma osmotisko aizplūšanu no intracelulārajām telpām uz ārpusšūnu telpām, reaģējot uz hiperglikēmiju. Retāk nātrija līmenis var būt nepatiesi samazināts smagas hipertensijas rezultātā.
trigliceridēmija. Līmenis kālijs seruma līmenis sākotnēji var palielināties, jo tas pārvietojas no ārpusšūnu telpām.
Diferenciāldiagnoze
Citi samaņas zuduma cēloņi pacientiem ar cukura diabētu. Diferenciāldiagnoze ar hiperosmolāru komu, kā likums, nesagādā grūtības (attīstās gados vecākiem pacientiem ar T2DM) un tai nav lielas klīniskas nozīmes, jo Ārstēšanas principi abiem stāvokļiem ir līdzīgi. Ja pacientam ar cukura diabētu nav iespējams operatīvi noteikt samaņas zuduma cēloni, viņam ieteicams ievadīt glikozi, jo hipoglikēmiskie stāvokļi ir daudz biežāk sastopami, un strauja pozitīva dinamika uz glikozes ievadīšanas fona pati par sevi ļauj noskaidrot samaņas zuduma cēloni.
Ārstēšana
DKA ārstēšana ietver rehidratāciju, hiperglikēmijas korekciju, elektrolītu traucējumus, kā arī tādu slimību ārstēšanu, kas izraisījušas cukura diabēta dekompensāciju. Ārstēšana visoptimālāk tiek veikta specializētās medicīnas iestādes intensīvās terapijas nodaļā. Pieaugušiem pacientiem bez smagām vienlaicīgām sirds patoloģijām, pat pirmshospitalijas stadijā kā pirmā prioritāte rehidratācija Izotonisku šķīdumu (0,9% NaCl) ieteicams ievadīt ar ātrumu aptuveni viens litrs stundā (apmēram 15-20 ml uz kilogramu ķermeņa svara stundā). Pilnīga šķidruma deficīta kompensācija, kas DKA ir 100-200 ml uz kg svara, jāsasniedz pirmajā ārstēšanas dienā. Vienlaicīgas sirds vai nieru mazspējas gadījumā šis periods jāpagarina. Bērniem ieteicamais izotoniskā šķīduma tilpums rehidratācijas terapijai ir 10-20 ml uz kg ķermeņa svara stundā, savukārt pirmajās 4 stundās tas nedrīkst pārsniegt 50 ml uz kg ķermeņa svara. Pilnīgu rehidratāciju ieteicams panākt aptuveni pēc 48 stundām. Pēc glikēmijas līmeņa pazemināšanās līdz aptuveni 14 mmol/l uz paralēlās insulīnterapijas fona viņi pāriet uz 10% glikozes šķīduma pārliešanu, kas turpina rehidratāciju.
Jēdziens “mazas devas” pašlaik ir pieņemts insulīnu DKA ārstēšanā. Tiek izmantots tikai īslaicīgas darbības insulīns. Optimālākā intravenoza insulīna izmantošana ir
Līna. Insulīna intramuskulāra ievadīšana, kas ir mazāk efektīva, ir iespējama tikai ar mērenu DKA smagumu, ar stabilu hemodinamiku un ja nav iespējama intravenoza terapija. Pēdējā gadījumā injekcijas veic taisnajā vēdera muskulī, savukārt uz insulīna šļirces ievieto intramuskulāras injekcijas adatu (uzticamai intramuskulārai injekcijai), un insulīns tiek ievilkts no flakona šļircē, izmantojot šo adatu.
Ir vairākas iespējas insulīna ievadīšanai intravenozi. Pirmkārt, insulīnu var injicēt infūzijas sistēmas “gumijas joslā”, bet nepieciešamo insulīna daudzumu ievelk insulīna šļircē, pēc tam pievienojot tai 1 ml izotoniskā šķīduma. Kamēr glikēmiskais līmenis sasniedz 14 mmol/l, pacientam katru stundu tiek ievadītas 6-10 vienības īslaicīgas darbības insulīna; tālāk (paralēli rehidratācijas šķīduma maiņai no izotoniskā uz 10% glikozi) atkarībā no stundā noteiktajiem glikēmijas rādītājiem insulīna devu samazina līdz 4-8 vienībām stundā. Ieteicamais glikēmijas līmeņa samazināšanas ātrums nedrīkst pārsniegt 5 mmol/l stundā. Vēl viena intravenozas insulīna terapijas iespēja ietver perfuzora izmantošanu. Lai pagatavotu šķīdumu perfuzoram, rīkojieties pēc šādas attiecības: 50 V īslaicīgas darbības insulīna pievieno 2 ml 20% cilvēka albumīna šķīduma, pēc tam pievieno 50 mg 0,9% izotoniskā šķīduma. Ja tiek izvēlēts intramuskulārais insulīna ievadīšanas veids, sākotnēji ievada 20 vienības īslaicīgas darbības insulīna, pēc tam 6 vienības stundā, un pēc glikēmijas līmeņa sasniegšanas 14 mmol/l devu samazina līdz 4 vienībām stundā. Pēc pilnīgas hemodinamikas stabilizācijas un skābju-bāzes traucējumu kompensācijas pacients tiek pārnests uz subkutānām insulīna injekcijām.
Kā norādīts, neskatoties uz ievērojamo kālija deficīts organismā (kopējais zudums 3-6 mmol/kg), ar DKA tā līmenis pirms insulīnterapijas sākuma var nedaudz paaugstināties. Tomēr ir ieteicams sākt kālija hlorīda šķīduma pārliešanu vienlaikus ar insulīna terapiju, ja kālija līmenis plazmā ir mazāks par 5,5 mmol/L. Veiksmīga kālija deficīta korekcija notiek tikai uz pH normalizēšanās fona. Pie zema pH kālija plūsma šūnā ir ievērojami samazināta, tādēļ, ja iespējams, pārlietā kālija hlorīda devu vēlams pielāgot noteiktai pH vērtībai (7.13. tabula).
Tabula 7.13. Kālija deficīta korekcijas shēma
 * Aprēķinos tiek izmantoti šādi dati:
* Aprēķinos tiek izmantoti šādi dati:
1 g KCl = 13,4 mmol; 1 mmol KCl = 0,075 g.4% KS1 šķīdumā: 100 ml - 4 g KS1, 25 ml - 1 g KS1, 10 ml 0,4 g KS1.
Diabēta dekompensāciju bieži izraisa infekcijas slimības(pielonefrīts, inficēta čūla diabētiskās pēdas sindroma gadījumā, pneimonija, sinusīts utt.). Pastāv noteikums, saskaņā ar kuru DKA gadījumā antibiotiku terapija tiek nozīmēta gandrīz visiem pacientiem ar zemu drudzi vai drudzi, pat ja nav redzama infekcijas avota, jo ķermeņa temperatūras paaugstināšanās nav raksturīga DKA.
Prognoze
Mirstība no DKA ir 0,5–5%, un vairumā gadījumu tas ir saistīts ar novēlotu un nekvalificētu medicīnisko aprūpi. Mirstība ir visaugstākā (līdz 50%) gados vecākiem pacientiem.
7.7.2. Hiperosmolāra koma
Hiperosmolāra koma(GOC) ir reta akūta T2DM komplikācija, kas attīstās smagas dehidratācijas un hiperglikēmijas rezultātā, ja nav absolūta insulīna deficīta, kopā ar augstu mirstību (7.14. tabula).
Etioloģija
GOC parasti attīstās gados vecākiem pacientiem ar T2DM. Šādi pacienti visbiežāk ir vieni, dzīvo bez aprūpes, atstāj novārtā savu stāvokli un paškontroli, uzņem nepietiekami daudz šķidruma. Bieži dekompensāciju izraisa infekcijas (diabētiskās pēdas sindroms, pneimonija, akūts pielonefrīts), smadzeņu darbības traucējumi
asinsrites un citi stāvokļi, kuru rezultātā pacienti slikti pārvietojas, nelieto glikozes līmeni pazeminošos medikamentus un šķidrumus.
Tabula 7.14. Hiperosmolāra koma (HOC)
 Patoģenēze
Patoģenēze
Paaugstināta hiperglikēmija un osmotiskā diurēze izraisa smagu dehidratāciju, kas iepriekš minēto iemeslu dēļ netiek papildināta no ārpuses. Hiperglikēmijas un dehidratācijas rezultāts ir plazmas hiperosmolaritāte. Neatņemama GOC patoģenēzes sastāvdaļa ir relatīvs insulīna deficīts un kontrainsulāro hormonu pārpalikums, tomēr atlikušā insulīna sekrēcija, kas saglabājas T2DM gadījumā, ir pietiekama, lai nomāktu lipolīzi un ketoģenēzi, kā rezultātā ketoacidozes attīstība nenotiek. rodas.
Dažos gadījumos hiperlaktātēmijas rezultātā uz audu hipoperfūzijas fona var konstatēt mērenu acidozi. Smagas hiperglikēmijas gadījumā, lai saglabātu osmotisko līdzsvaru cerebrospinālajā šķidrumā, palielinās nātrija saturs, kas nāk no smadzeņu šūnām, kur kālijs nonāk apmaiņā. Nervu šūnu transmembrānas potenciāls ir traucēts. Progresējoša apdullināšana attīstās kombinācijā ar konvulsīvo sindromu (7.10. att.).
Epidemioloģija
GOC veido 10–30% akūtu hiperglikēmisku stāvokļu pieaugušajiem un gados vecākiem pacientiem ar T2DM. Apmēram 2/3 gadījumu GOC attīstās personām ar iepriekš nediagnosticētu diabētu.
Klīniskās izpausmes
Hiperosmolārās komas klīniskā attēla pazīmes ir:
Dehidratācijas un hipoperfūzijas pazīmju un komplikāciju kopums: slāpes, sausas gļotādas, tahikardija, arteriāla hipotensija, slikta dūša, vājums, šoks;
Fokālas un ģeneralizētas lēkmes;
Drudzis, slikta dūša un vemšana (40-65% gadījumu);
Vienlaicīgas slimības un komplikācijas bieži ir dziļo vēnu tromboze, pneimonija, cerebrovaskulāri traucējumi un gastroparēze.
Diagnostika
Pamatojoties uz klīnisko ainu, pacienta vecumu un 2. tipa cukura diabētu anamnēzē, smagu hiperglikēmiju bez ketonūrijas un ketoacidozi. Tipiskās GOC laboratorijas pazīmes ir parādītas tabulā. 7.12.
 Rīsi. 7 .10.
Hiperosmolārās komas patoģenēze
Rīsi. 7 .10.
Hiperosmolārās komas patoģenēze
Diferenciāldiagnoze
Citi akūti stāvokļi, kas attīstās pacientiem ar cukura diabētu, visbiežāk ar vienlaicīgu patoloģiju, kas izraisa smagu cukura diabēta dekompensāciju.
Ārstēšana
GOK ārstēšana un uzraudzība, izņemot dažas pazīmes, neatšķiras no tām, kas aprakstītas ketoacidotiskās diabētiskās komas gadījumā (7.7.1. sadaļa):
Lielāks sākotnējās rehidratācijas apjoms 1,5-2 litri 1 stundā; 1 l - 2. un 3. stundā, pēc tam 500 ml/stundā izotoniskā nātrija hlorīda šķīduma;
Kāliju saturošu šķīdumu ievadīšanas nepieciešamība parasti ir lielāka nekā ketoacidozes komas gadījumā;
Insulīna terapija ir līdzīga CC, taču insulīna nepieciešamība ir mazāka un glikēmiskais līmenis jāsamazina ne ātrāk kā par 5 mmol/l stundā, lai izvairītos no smadzeņu tūskas veidošanās;
Vislabāk ir izvairīties no hipotoniska šķīduma (NaCl 0,45%) ievadīšanas (tikai ar smagu hipernatriēmiju: > 155 mmol/l un/vai efektīvo osmolaritāti > 320 mOsm/l);
Nav nepieciešams ievadīt bikarbonātu (tikai specializētās intensīvās terapijas nodaļās acidozes gadījumā ar pH līmeni< 7,1).
Prognoze
Mirstība ar GOC ir augsta un svārstās no 15 līdz 60%. Sliktākā prognoze ir gados vecākiem pacientiem ar smagu vienlaicīgu patoloģiju, kas bieži ir diabēta dekompensācijas un GOK attīstības cēlonis.
7.7.3. Hipoglikēmija
Hipoglikēmija- glikozes līmeņa pazemināšanās serumā (<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etioloģija
Insulīna un tā analogu, kā arī sulfonilurīnvielas atvasinājumu pārdozēšana;
Nepietiekama uztura uzņemšana nemainīgas glikozes līmeni pazeminošas terapijas fona apstākļos;
Alkoholisko dzērienu dzeršana;
Fiziskā aktivitāte pastāvīgas glikozes līmeni pazeminošas terapijas fona apstākļos un/vai bez papildu ogļhidrātu uzņemšanas;
Cukura diabēta vēlīnās komplikācijas (autonomā neiropātija ar gastroparēzi, nieru mazspēja) un vairāku citu slimību (virsnieru mazspēja, hipotireoze, aknu mazspēja, ļaundabīgi audzēji) attīstība ar nemainīgu glikozes līmeni pazeminošu terapiju (turpināšana un TSP uzkrāšanās uz fona nieru mazspējas gadījumā, saglabājot tādu pašu insulīna devu);
Insulīna ievadīšanas tehnikas pārkāpums (intramuskulāra injekcija, nevis subkutāna);
Mākslīgā hipoglikēmija (pacienta apzināta glikozes līmeni pazeminošu zāļu pārdozēšana);
Organisks hiperinsulinisms - insulinoma (skat. 10.3. punktu).
Patoģenēze
Hipoglikēmijas patoģenēze ir nelīdzsvarotība starp glikozes iekļūšanu asinīs, tās izmantošanu, insulīna un pretsala hormonu līmeni. Parasti, ja glikēmiskais līmenis ir robežās no 4,2-4,7 mmol/l, insulīna ražošana un izdalīšanās no β-šūnām tiek nomākta. Glikēmiskā līmeņa pazemināšanos zem 3,9 mmol/l pavada pretsola hormonu (glikagona, kortizola, augšanas hormona, adrenalīna) ražošanas stimulēšana. Neiroglikopēnijas simptomi attīstās, ja glikēmiskais līmenis samazinās līdz mazāk nekā 2,5-2,8 mmol/l. Pārdozēšanas gadījumā insulīnu un/vai narkotikas sulfonilurīnvielas atvasinājumi hipoglikēmija attīstās eksogēna vai endogēna hormona tiešās hipoglikēmiskās iedarbības dēļ. Sulfonilurīnvielas atvasinājumu pārdozēšanas gadījumā hipoglikēmijas simptomi var atkārtoties vairākas reizes pēc lēkmes pārtraukšanas, jo dažu zāļu darbības ilgums var sasniegt vienu dienu vai ilgāk. TSP, kuriem nav stimulējošas ietekmes uz insulīna ražošanu (metformīns, tiazolidīndioni), paši par sevi nevar izraisīt hipoglikēmiju, bet, pievienojot tos sulfonilurīnvielas atvasinājumiem vai insulīnam, pēdējo vienā devā lietošana var izraisīt hipoglikēmiju hipoglikēmiskā līdzekļa uzkrāšanās dēļ. kombinētās terapijas efekts (7.15. tabula).
Tabula 7.15. Hipoglikēmija
 Tabulas beigas. 7.15
Tabulas beigas. 7.15
 Pēc uzņemšanas alkohols tiek nomākta glikoneoģenēze aknās, kas ir vissvarīgākais faktors, kas novērš hipoglikēmiju. Fiziskie vingrinājumi veicina no insulīna neatkarīgu glikozes izmantošanu, kā rezultātā uz nemainīgas glikozes līmeni pazeminošas terapijas fona un/vai bez papildu ogļhidrātu uzņemšanas tie var izraisīt hipoglikēmiju.
Pēc uzņemšanas alkohols tiek nomākta glikoneoģenēze aknās, kas ir vissvarīgākais faktors, kas novērš hipoglikēmiju. Fiziskie vingrinājumi veicina no insulīna neatkarīgu glikozes izmantošanu, kā rezultātā uz nemainīgas glikozes līmeni pazeminošas terapijas fona un/vai bez papildu ogļhidrātu uzņemšanas tie var izraisīt hipoglikēmiju.
Epidemioloģija
Viegla, ātri atgriezeniska hipoglikēmija pacientiem ar 1. tipa cukura diabētu, kas saņem intensīvu insulīnterapiju, var rasties vairākas reizes nedēļā un ir salīdzinoši nekaitīga. Katram pacientam, kurš saņem intensīvu insulīnterapiju, ir 1 smagas hipoglikēmijas gadījums gadā. Vairumā gadījumu hipoglikēmija attīstās naktī. 2. tipa cukura diabēta gadījumā 20% pacientu, kas saņem insulīnu, un 6% pacientu, kuri saņem sulfonilurīnvielas atvasinājumus, 10 gadu laikā attīstās vismaz viena smagas hipoglikēmijas epizode.
Klīniskās izpausmes
Ir divas galvenās simptomu grupas: adrenerģiski, kas saistīti ar simpātiskās nervu sistēmas aktivāciju un adrenalīna izdalīšanos no virsnieru dziedzeriem, un neiroglikopēniski, kas saistīti ar centrālās nervu sistēmas disfunkciju tās galvenā enerģijas substrāta deficīta fona. . UZ adrenerģisks simptomi ir: tahikardija, midriāze; trauksme, agresivitāte; trīce, auksti sviedri, parestēzija; slikta dūša, smags izsalkums, pastiprināta siekalošanās; caureja, pārmērīga urinēšana. UZ neiroglikopēns simptomi ir astēnija,
samazināta koncentrēšanās spēja, galvassāpes, bailes, apjukums, dezorientācija, halucinācijas; runas, redzes, uzvedības traucējumi, amnēzija, apziņas traucējumi, krampji, pārejoša paralīze, koma. Var nebūt skaidras attiecības starp simptomu smagumu un secību, jo hipoglikēmija kļūst smagāka. Var rasties tikai adrenerģiski vai tikai neiroglikopēniski simptomi. Dažos gadījumos, neskatoties uz normoglikēmijas atjaunošanos un notiekošo terapiju, pacienti var palikt stuporā vai pat komā vairākas stundas vai pat dienas. Ilgstoša hipoglikēmija vai biežas tās epizodes var izraisīt neatgriezeniskas izmaiņas centrālajā nervu sistēmā (galvenokārt smadzeņu garozā), kuru izpausmes ievērojami atšķiras no maldu un halucinācijas-paranojas epizodēm līdz tipiskām epilepsijas lēkmēm, kuru neizbēgams iznākums ir pastāvīga demence. .
Pacienti subjektīvi panes hiperglikēmiju vieglāk nekā pat vieglas hipoglikēmijas epizodes. Tāpēc daudzi pacienti, baidoties no hipoglikēmijas, uzskata par nepieciešamu uzturēt glikēmiju salīdzinoši augstā līmenī, kas faktiski atbilst slimības dekompensācijai. Šī stereotipa pārvarēšana dažkārt prasa ievērojamas pūles no ārstiem un apmācāmā personāla.
Diagnostika
Hipoglikēmijas klīniskā aina pacientam ar cukura diabētu kombinācijā ar laboratorisku (parasti izmantojot glikometru) zema glikozes līmeņa noteikšanu asinīs.
Diferenciāldiagnoze
Citi iemesli, kas izraisa samaņas zudumu. Ja cukura diabēta pacienta samaņas zuduma cēlonis nav zināms un nav iespējams veikt ātru glikēmijas līmeņa analīzi, ir indicēta glikozes ievadīšana. Bieži vien ir nepieciešams noteikt biežas hipoglikēmijas attīstības cēloni pacientiem ar cukura diabētu. Visbiežāk tās ir neadekvātas glikozes līmeni pazeminošas terapijas un pacienta zemo zināšanu par savu slimību rezultāts. Jāatceras, ka vairākas slimības (virsnieru mazspēja, hipotireoze, nieru un aknu mazspēja), tostarp ļaundabīgi audzēji, var samazināt vajadzību pēc glikozes līmeni pazeminošas terapijas līdz tās pilnīgai atcelšanai (“pazudis diabēts”). .
Ārstēšana
Lai ārstētu vieglu hipoglikēmiju, kurā pacients ir pie samaņas un var sev palīdzēt, parasti pietiek ar ogļhidrātus saturošu pārtiku vai šķidrumu 1-2 maizes vienību (10-20 g glikozes) daudzumā. Šo daudzumu satur, piemēram, 200 ml saldas augļu sulas. Dzērieni efektīvāk mazina hipoglikēmiju, jo šķidrā veidā glikoze uzsūcas daudz ātrāk. Ja simptomi turpina pasliktināties, neskatoties uz nepārtrauktu ogļhidrātu uzņemšanu, nepieciešama intravenoza glikozes vai intramuskulāra glikagona ievadīšana. Smagu hipoglikēmiju, kas rodas ar samaņas zudumu, ārstē līdzīgi. Šajā gadījumā pacientam tiek ievadīti apmēram 50 ml 40% glikozes šķīdums intravenozi. Glikozes ievadīšana jāturpina, līdz lēkme tiek pārtraukta un glikēmija normalizējas, lai gan lielāka deva - līdz 100 ml vai vairāk, kā likums, nav nepieciešama. Glikagons tiek ievadīts (parasti ar rūpnīcā sagatavotu pildītu šļirci) intramuskulāri vai subkutāni. Pēc dažām minūtēm glikēmijas līmenis atgriežas normālā stāvoklī, jo glikagons izraisa glikogenolīzi. Tomēr tas ne vienmēr notiek: ja insulīna līmenis asinīs ir augsts, glikagons ir neefektīvs. Glikagona pussabrukšanas periods ir īsāks nekā insulīna. Alkoholisma un aknu slimību gadījumā glikogēna sintēze ir traucēta, un glikagona ievadīšana var būt neefektīva. Glikagona ievadīšanas blakusparādība var būt vemšana, radot aspirācijas risku. Pacienta radiniekiem vēlams apgūt glikagona injekcijas tehniku.
Prognoze
Viegla hipoglikēmija apmācītiem pacientiem uz labas slimības kompensācijas fona ir droša. Bieža hipoglikēmija ir sliktas diabēta kompensācijas pazīme; vairumā gadījumu šādiem pacientiem ir vairāk vai mazāk smaga hiperglikēmija un augsts glikozētā hemoglobīna līmenis pārējā dienas daļā. Gados vecākiem pacientiem ar vēlīnām diabēta komplikācijām hipoglikēmija var izraisīt asinsvadu komplikācijas, piemēram, miokarda infarktu, insultu un tīklenes asiņošanu. Hipoglikēmiska koma, kas ilgst līdz 30 minūtēm ar adekvātu ārstēšanu un ātru samaņas atgriešanos, parasti nerada nekādas komplikācijas vai sekas.
7.8. DIABĒTA VĒLĀS KOMPlikācijas
Vēlīnas komplikācijas attīstās abos diabēta veidos. Klīniski ir piecas galvenās vēlīnās diabēta komplikācijas: makroangiopātija, nefropātija, retinopātija, neiropātija un diabētiskās pēdas sindroms. Novēloto komplikāciju nespecifiskumu dažiem diabēta veidiem nosaka fakts, ka to galvenā patoģenētiskā saikne ir hroniska hiperglikēmija. Šajā sakarā T1DM izpausmes laikā pacientiem gandrīz nekad nenotiek novēlotas komplikācijas, kas attīstās gadiem un gadu desmitiem atkarībā no terapijas efektivitātes. Parasti vislielākā klīniskā nozīme T1DM ir diabētiskā mikroangiopātija(nefropātija, retinopātija) un neiropātija (diabētiskās pēdas sindroms). Ar T2DM, gluži pretēji, novēlotas komplikācijas bieži tiek atklātas jau diagnozes laikā. Pirmkārt, tas ir saistīts ar faktu, ka T2DM izpaužas ilgi pirms diagnozes noteikšanas. Otrkārt, aterosklerozei, ko klīniski izpaužas makroangiopātija, ir daudzas kopīgas patoģenēzes saiknes ar diabētu. T2DM gadījumā vislielāko klīnisko nozīmi parasti iegūst diabētiķis makroangiopātija, kas tiek atklāts lielākajai daļai pacientu diagnozes laikā. Katrā konkrētā gadījumā atsevišķu vēlīnu komplikāciju kopums un smagums atšķiras no to paradoksālas pilnīgas neesamības, neskatoties uz ievērojamo slimības ilgumu, līdz visu iespējamo variantu kombinācijai smagā formā.
Ir vēlīnās komplikācijas galvenais nāves cēlonis pacientiem ar cukura diabētu, un, ņemot vērā tā izplatību, tā ir vissvarīgākā medicīniskā un sociālā veselības problēma lielākajā daļā valstu. Sakarā ar šo galvenais ārstēšanas mērķis un pacientu ar cukura diabētu novērošana ir tā novēloto komplikāciju profilakse (primārā, sekundārā, terciārā).
7.8.1. Diabētiskā makroangiopātija
Diabētiskā makroangiopātija- kolektīvs jēdziens, kas apvieno lielo artēriju aterosklerozes bojājumus diabēta gadījumā,
klīniski izpaužas koronārā sirds slimība (KSS), obliterējoša smadzeņu asinsvadu, apakšējo ekstremitāšu, iekšējo orgānu ateroskleroze un arteriālā hipertensija (7.16. tabula).
Tabula 7.16. Diabētiskā makroangiopātija
 Etioloģija un patoģenēze
Etioloģija un patoģenēze
Iespējams, tas ir līdzīgs aterosklerozes etioloģijai un patoģenēzei indivīdiem bez cukura diabēta. Aterosklerozes plāksnes neatšķiras pēc mikroskopiskās struktūras indivīdiem ar un bez cukura diabēta. Tomēr diabēta gadījumā papildu riska faktori var izvirzīties priekšplānā vai arī diabēts var saasināt zināmos nespecifiskos faktorus. Diabēta gadījumā tie ietver:
1. Hiperglikēmija. Tas ir aterosklerozes attīstības riska faktors. HbA1c līmeņa paaugstināšanās par 1% pacientiem ar T2DM palielinās
Pastāv 15% risks saslimt ar miokarda infarktu. Hiperglikēmijas aterogēnās iedarbības mehānisms nav pilnībā skaidrs, iespējams, tas ir saistīts ar ZBL metabolisma galaproduktu un asinsvadu sieniņu kolagēna glikozilāciju.
2. Arteriālā hipertensija(AG). Patoģenēzē liela nozīme tiek piešķirta nieru komponentam (diabētiskā nefropātija). Hipertensija 2. tipa cukura diabēta gadījumā ir ne mazāk nozīmīgs sirdslēkmes un insulta riska faktors kā hiperglikēmija.
3. Dislipidēmija. Hiperinsulinēmija, kas ir neatņemama insulīna rezistences sastāvdaļa 2. tipa cukura diabēta gadījumā, izraisa ABL līmeņa pazemināšanos, triglicerīdu līmeņa paaugstināšanos un blīvuma samazināšanos, t.i. paaugstināta ZBL aterogenitāte.
4. aptaukošanās, ar ko slimo lielākā daļa pacientu ar T2DM, ir neatkarīgs aterosklerozes, miokarda infarkta un insulta riska faktors (skatīt apakšpunktu 11.2).
5. Insulīna rezistence. Hiperinsulinēmija un augsts insulīnam proinsulīnam līdzīgu molekulu līmenis palielina aterosklerozes attīstības risku, kas var būt saistīta ar endotēlija disfunkciju.
6. Asins koagulācijas traucējumi. Cukura diabēta gadījumā tiek noteikts fibrinogēna, trombocītu inhibitoru aktivatora un fon Vilebranda faktora līmeņa paaugstināšanās, kā rezultātā veidojas asins koagulācijas sistēmas protrombotiskais stāvoklis.
7. Endotēlija disfunkcija, ko raksturo palielināta plazminogēna inhibitora aktivatora un šūnu adhēzijas molekulu ekspresija.
8. Oksidatīvais stress, izraisot oksidēto ZBL un F2-izoprostānu koncentrācijas palielināšanos.
9. Sistēmisks iekaisums kurā palielinās fibrinogēna un C reaktīvā proteīna ekspresija.
Nozīmīgākie riska faktori koronāro artēriju slimības attīstībai 2. tipa cukura diabēta gadījumā ir paaugstināts ZBL līmenis, pazemināts ABL līmenis, arteriālā hipertensija, hiperglikēmija un smēķēšana. Viena no atšķirībām starp aterosklerozes procesu cukura diabēta gadījumā ir tā plašākā izplatība un okluzālā bojājuma distālais raksturs, tie. Procesā bieži tiek iesaistītas salīdzinoši mazākas artērijas, kas sarežģī ķirurģisku ārstēšanu un pasliktina prognozi.
Epidemioloģija
Koronārās sirds slimības attīstības risks cilvēkiem ar 2. tipa cukura diabētu ir 6 reizes lielāks nekā cilvēkiem bez diabēta, savukārt vīriešiem un sievietēm tas ir vienāds. Arteriālā hipertensija tiek konstatēta 20% pacientu ar 1. tipa cukura diabētu un 75% pacientu ar 2. tipa cukura diabētu. Kopumā pacientiem ar cukura diabētu tas notiek 2 reizes biežāk nekā cilvēkiem bez tā. Perifēro asinsvadu obliterējošā ateroskleroze attīstās 10% pacientu ar cukura diabētu. Smadzeņu asinsvadu trombembolija attīstās 8% pacientu ar cukura diabētu (2-4 reizes biežāk nekā cilvēkiem bez cukura diabēta).
Klīniskās izpausmes
Būtībā tie neatšķiras no cilvēkiem bez cukura diabēta. T2DM klīniskajā attēlā bieži tiek izvirzītas makrovaskulāras komplikācijas (miokarda infarkts, insults, kāju asinsvadu okluzīvi bojājumi), un tieši ar to attīstību pacientam bieži tiek konstatēta hiperglikēmija. Iespējams, vienlaicīgas autonomās neiropātijas dēļ līdz 30% miokarda infarktu cilvēkiem ar cukura diabētu notiek bez tipiskas stenokardijas lēkmes (nesāpīgs infarkts).
Diagnostika
Aterosklerozes komplikāciju (koronāro sirds slimību, cerebrovaskulāru traucējumu, kāju artēriju okluzīvu bojājumu) diagnostikas principi neatšķiras no tiem, kas paredzēti personām bez cukura diabēta. Mērīšana asinsspiediens(BP) jāveic katrā cukura diabēta pacienta vizītē pie ārsta un rādītāju noteikšana. lipīdu spektrs Asins analīzes (kopējais holesterīns, triglicerīdi, ZBL, ABL) diabēta noteikšanai jāveic vismaz reizi gadā.
Diferenciāldiagnoze
Citas sirds un asinsvadu slimības, simptomātiska arteriāla hipertensija, sekundāra dislipidēmija.
Ārstēšana
♦ Asinsspiediena kontrole. Pareizais sistoliskā asinsspiediena līmenis diabēta gadījumā ir mazāks par 130 mmHg, bet diastoliskais asinsspiediens ir 80 mmHg (7.3. tabula). Lielākajai daļai pacientu ir nepieciešami vairāki antihipertensīvie medikamenti, lai sasniegtu šo mērķi. Cukura diabēta antihipertensīvās terapijas izvēles zāles ir AKE inhibitori un angiotenzīna receptoru blokatori, kurus nepieciešamības gadījumā papildina ar tiazīdu grupas diurētiskiem līdzekļiem. Izvēles zāles pacientiem ar cukura diabētu, kas pārcietuši miokarda infarktu, ir β-blokatori.
♦ Dislipidēmijas korekcija. Lipīdu spektra indikatoru mērķa līmeņi ir parādīti tabulā. 7.3. Izvēles zāles lipīdu līmeni pazeminošai terapijai ir 3-hidroksi-3-metilglutaril-CoA reduktāzes inhibitori (statīni).
♦ Antitrombocītu terapija. Aspirīna terapija (75-100 mg/dienā) indicēta pacientiem ar cukura diabētu vecākiem par 40 gadiem ar paaugstinātu kardiovaskulāro patoloģiju attīstības risku (sarežģīta ģimenes anamnēze, arteriālā hipertensija, smēķēšana, dislipidēmija, mikroalbuminūrija), kā arī visiem pacientiem ar. aterosklerozes klīniskās izpausmes kā sekundāra profilakse.
♦ Koronāro artēriju slimības skrīnings un ārstēšana. Stresa testi, lai izslēgtu koronāro artēriju slimību, ir indicēti pacientiem ar sirds un asinsvadu slimību simptomiem, kā arī gadījumos, kad EKG atklāj patoloģiju.
Prognoze
75% pacientu ar T2DM un 35% pacientu ar T1DM mirst no sirds un asinsvadu slimībām. Apmēram 50% pacientu ar T2DM mirst no koronāro artēriju slimības komplikācijām, 15% no smadzeņu trombembolijas. Mirstība no miokarda infarkta cilvēkiem ar cukura diabētu pārsniedz 50%.
7.8.2. Diabētiskā retinopātija
Diabētiskā retinopātija(DR) - tīklenes asinsvadu mikroangiopātija, ko raksturo mikroaneirismu attīstība, asinsizplūdumi, eksudatīvās izmaiņas un jaunizveidoto asinsvadu proliferācija, kas izraisa daļēju vai pilnīgu redzes zudumu (7.17. tabula).
Etioloģija
Galvenais etioloģiskais faktors DR attīstībā ir hroniska hiperglikēmija. Citi faktori (arteriālā hipertensija, dislipidēmija, smēķēšana, grūtniecība utt.) ir mazāk nozīmīgi.
Patoģenēze
Galvenās saites DR patoģenēzē ir:
Tīklenes asinsvadu mikroangiopātija, kas izraisa asinsvadu lūmena sašaurināšanos, attīstoties hipoperfūzijai;
Asinsvadu deģenerācija ar mikroaneirismu veidošanos;
Progresējoša hipoksija, kas stimulē asinsvadu proliferāciju un izraisa tauku deģenerāciju un kalcija sāļu nogulsnēšanos tīklenē;
Tabula 7.17. Diabētiskā retinopātija
 mikroinfarkti ar eksudāciju, kas izraisa mīkstu "vates plankumu" veidošanos;
mikroinfarkti ar eksudāciju, kas izraisa mīkstu "vates plankumu" veidošanos;
Lipīdu nogulsnēšanās ar blīvu eksudātu veidošanos;
Proliferējošu asinsvadu proliferācija tīklenē, veidojot šuntus un aneirismas, kas izraisa vēnu paplašināšanos un tīklenes hipoperfūzijas pasliktināšanos;
Zagšanas parādība ar turpmāku išēmijas progresēšanu, kas izraisa infiltrātu un rētu veidošanos;
Tīklenes atslāņošanās tās išēmiskās sadalīšanās un vitreoretinālās vilkšanas veidošanās rezultātā;
Stiklveida asiņošana, ko izraisa hemorāģisks infarkts, masveida asinsvadu invāzija un aneirismu plīsums;
Varavīksnenes asinsvadu proliferācija (diabētiskā rubeoze), kas izraisa sekundāras glaukomas attīstību;
Makulopātija ar tīklenes tūsku.
Epidemioloģija
DR ir visizplatītākais akluma cēlonis attīstīto valstu strādājošo iedzīvotāju vidū, un akluma risks pacientiem ar DM ir 10-20 reizes lielāks nekā vispārējā populācijā. T1DM diagnosticēšanas brīdī DR nav konstatēts gandrīz nevienam no pacientiem, pēc 5 gadiem slimība tiek atklāta 8% pacientu, bet ar trīsdesmit gadu diabēta stāžu - 98% pacientu. T2DM diagnozes laikā DR tiek konstatēts 20-40% pacientu, bet pacientiem ar piecpadsmit gadu T2DM stāžu - 85%. DM-1 gadījumā salīdzinoši biežāk sastopama proliferatīvā retinopātija, bet DM-2 - makulopātija (75% makulopātijas gadījumu).
Klīniskās izpausmes
Saskaņā ar vispārpieņemto klasifikāciju ir 3 DR posmi
(7.18. tabula).
Diagnostika
Pilnīga oftalmoloģiskā izmeklēšana, ieskaitot tiešu oftalmoskopiju ar tīklenes fotografēšanu, ir indicēta pacientiem ar T1DM 3-5 gadus pēc slimības sākuma, bet pacientiem ar T2DM uzreiz pēc tās diagnozes noteikšanas. Turpmāk šādi pētījumi ir jāatkārto katru gadu.
Tabula 7.18. Diabētiskās retinopātijas klasifikācija
 Diferenciāldiagnoze
Diferenciāldiagnoze
Citas acu slimības pacientiem ar cukura diabētu.
Ārstēšana
Diabētiskās retinopātijas, kā arī citu novēloto komplikāciju ārstēšanas pamatprincips ir optimāla diabēta kompensācija. Visefektīvākā metode diabētiskās retinopātijas ārstēšanai un akluma profilaksei ir lāzera fotokoagulācija. Mērķis
 Rīsi. 7.11. Diabētiskā retinopātija:
Rīsi. 7.11. Diabētiskā retinopātija:
a) neizplatīšanas; b) preproliferatīvs; c) proliferatīvs
lāzera fotokoagulācija ir jaunizveidoto asinsvadu darbības pārtraukšana, kas rada galvenos draudus tādu smagu komplikāciju attīstībai kā hemoftalms, vilces tīklenes atslāņošanās, varavīksnenes rubeoze un sekundāra glaukoma.
Prognoze
Aklums tiek reģistrēts 2% pacientu ar cukura diabētu (3-4% pacientu ar 1. tipa cukura diabētu un 1,5-2% pacientu ar 2. tipa cukura diabētu). Aprēķinātais jaunu ar DR saistītu akluma gadījumu biežums ir 3,3 gadījumi uz 100 000 iedzīvotāju gadā. 1. tipa cukura diabēta gadījumā HbA1c samazināšana līdz 7,0% samazina DR attīstības risku par 75% un DR progresēšanas risku par 60%. 2. tipa cukura diabēta gadījumā HbA1c samazinājums par 1% samazina DR attīstības risku par 20%.
7.8.3. Diabētiskā nefropātija
Diabētiskā nefropātija(DNF) tiek definēta kā albuminūrija (vairāk nekā 300 mg albumīna dienā vai proteīnūrija vairāk nekā 0,5 g proteīna dienā) un/vai pavājināta nieru filtrācijas funkcija personām ar cukura diabētu, ja nav urīnceļu infekciju, sirds mazspējas vai citu slimību. nieru slimības. Mikroalbuminūrija tiek definēta kā albumīna izdalīšanās 30-300 mg/dienā vai 20-200 mcg/min.
Etioloģija un patoģenēze
Galvenie DNF riska faktori ir diabēta ilgums, hroniska hiperglikēmija, arteriālā hipertensija, dislipidēmija un nieru slimība vecākiem. DNF vispirms tiek ietekmēta glomerulārais aparāts nieres
1. Viens no iespējamiem mehānismiem, ar kuru palīdzību hiperglikēmija veicina glomerulu bojājumu attīstību, ir sorbīta uzkrāšanās glikozes metabolisma poliola ceļa aktivizēšanas dēļ, kā arī vairāki uzlaboti glikācijas galaprodukti.
2. Hemodinamiskie traucējumi, proti intraglomerulāra hipertensija(paaugstināts asinsspiediens nieru glomerulos) ir būtiska patoģenēzes sastāvdaļa
Intraglomerulārās hipertensijas cēlonis ir arteriolu tonusa pārkāpums: aferenta paplašināšanās un eferenta sašaurināšanās.
Tabula 7.19. Diabētiskā nefropātija
 Tas, savukārt, notiek vairāku humorālu faktoru, piemēram, angiotenzīna-2 un endotelīna, ietekmē, kā arī glomerulārās bazālās membrānas elektrolītu īpašību pārkāpuma dēļ. Turklāt intraglomerulāro hipertensiju veicina sistēmiskā hipertensija, kas tiek konstatēta lielākajai daļai pacientu ar DNF. Intraglomerulārās hipertensijas dēļ rodas bazālo membrānu un filtrācijas poru bojājumi,
Tas, savukārt, notiek vairāku humorālu faktoru, piemēram, angiotenzīna-2 un endotelīna, ietekmē, kā arī glomerulārās bazālās membrānas elektrolītu īpašību pārkāpuma dēļ. Turklāt intraglomerulāro hipertensiju veicina sistēmiskā hipertensija, kas tiek konstatēta lielākajai daļai pacientu ar DNF. Intraglomerulārās hipertensijas dēļ rodas bazālo membrānu un filtrācijas poru bojājumi,
caur kurām sāk iekļūt pēdas (mikroalbuminūrija), un pēc tam ievērojamu daudzumu albumīna (proteinūrija). Pamata membrānu sabiezēšana izraisa to elektrolītu īpašību izmaiņas, kas pats par sevi noved pie tā, ka ultrafiltrātā nonāk vairāk albumīna pat tad, ja filtrācijas poru izmērs nemainās.
3. Ģenētiskā predispozīcija. Arteriālā hipertensija biežāk sastopama pacientu ar DNF radiniekiem. Ir pierādījumi par saistību starp DNF un ACE gēna polimorfismu. Mikroskopiski ar DNF tiek atklāta glomerulu bazālo membrānu sabiezēšana, mezangija paplašināšanās, kā arī šķiedru izmaiņas aferentajos un eferentajos arteriolos. Pēdējā stadijā, kas klīniski atbilst hroniskai nieru mazspējai (CRF), tiek noteikta fokālā (Kimmelstiel-Wilson) un pēc tam difūzā glomeruloskleroze.
Epidemioloģija
Mikroalbuminūrija tiek atklāta 6-60% pacientu ar T1DM 5-15 gadus pēc tās izpausmes. DNF tiek atklāts 35% cilvēku ar T1DM, biežāk vīriešiem un cilvēkiem, kuriem T1DM attīstījās pirms 15 gadu vecuma. T2DM gadījumā DNF attīstās 25% kaukāziešu un 50% aziātu. Kopējā DNF izplatība T2DM ir 4-30%.
Klīniskās izpausmes
Salīdzinoši agrīna klīniskā izpausme, kas ir netieši saistīta ar DNF, ir arteriālā hipertensija. Citas klīniski acīmredzamas izpausmes ir novēlotas. Tie ietver nefrotiskā sindroma un hroniskas nieru mazspējas izpausmes.
Diagnostika
DNF skrīnings cilvēkiem ar cukura diabētu ietver ikgadēju testēšanu mikroalbuminūrija DM-1 gadījumā 5 gadus pēc slimības izpausmes un DM-2 tūlīt pēc tās atklāšanas. Turklāt, lai aprēķinātu, ir nepieciešams vismaz gada kreatinīna līmenis glomerulārās filtrācijas ātrums (GFR). GFR var aprēķināt, izmantojot dažādas formulas, piemēram, Kokkrofta-Go formulu:
Vīriešiem: a = 1,23 (normāls GFĀ 100 - 150 ml/min) Sievietēm: a = 1,05 (normāls GFR 85 - 130 ml/min)
Sākotnējās DNF stadijās var konstatēt GFR palielināšanos, kas pakāpeniski samazinās, attīstoties hroniskai nieru mazspējai. Mikroalbuminūriju sāk konstatēt 5-15 gadus pēc DM-1 izpausmes; ar T2DM 8-10% gadījumu tas tiek atklāts uzreiz pēc tā atklāšanas, iespējams, sakarā ar ilgu asimptomātisku slimības gaitu pirms diagnozes noteikšanas. Acīmredzamas proteīnūrijas vai albumīnūrijas maksimums T1DM gadījumā notiek 15–20 gadus pēc sākuma. Proteīnūrija norāda neatgriezeniskums DNF, kas agrāk vai vēlāk novedīs pie hroniskas nieru mazspējas. Urēmija attīstās vidēji 7-10 gadus pēc atklātas proteīnūrijas sākuma. Jāatzīmē, ka GFR nekorelē ar proteīnūriju.
Diferenciāldiagnoze
Citi proteīnūrijas un nieru mazspējas cēloņi cilvēkiem ar cukura diabētu. Vairumā gadījumu DNF tiek kombinēts ar arteriālo hipertensiju, diabētisko retinopātiju vai neiropātiju, kuru neesamības gadījumā diferenciāldiagnozei jābūt īpaši uzmanīgai. 10% gadījumu ar DM-1 un 30% gadījumu ar DM-2 proteīnūrija nav saistīta ar DNF.
Ārstēšana
♦ Primārās un sekundārās pamatnosacījumi profilakse
DNF ir diabēta kompensācija un normāla sistēmiskā asinsspiediena uzturēšana. Turklāt primārā DNF profilakse ietver olbaltumvielu pārtikas patēriņa samazināšanu - mazāk nekā 35% no ikdienas kalorijām.
♦ Pa posmiem mikroalbuminūrija Un proteīnūrija pacientiem tiek nozīmēti AKE inhibitori vai angiotenzīna receptoru blokatori. Ar vienlaicīgu arteriālo hipertensiju tās tiek parakstītas antihipertensīvās devās, ja nepieciešams, kombinācijā ar citiem antihipertensīviem līdzekļiem. Ar normālu asinsspiedienu šīs zāles tiek parakstītas devās, kas neizraisa hipotensijas attīstību. Gan AKE inhibitori (DM-1 un DM-2), gan angiotenzīna receptoru blokatori (DM-2) palīdz novērst mikroalbuminūrijas pāreju uz proteīnūriju. Dažos gadījumos uz šīs terapijas fona kombinācijā ar cukura diabēta kompensāciju ar citiem parametriem mikroalbuminūrija tiek novērsta. Turklāt, sākot no mikroalbuminūrijas stadijas, ir nepieciešams
samazinot olbaltumvielu uzņemšanu līdz mazāk nekā 10% no ikdienas kaloriju daudzuma (vai mazāk nekā 0,8 gramiem uz kilogramu svara) un sāls uzņemšanu līdz mazāk nekā 3 gramiem dienā.
♦ Uz skatuves hroniska nieru mazspēja, parasti ir nepieciešama glikozes līmeni pazeminošas terapijas pielāgošana. Lielākajai daļai pacientu ar T2DM ir jāpāriet uz insulīnterapiju, jo TSP uzkrāšanās rada smagas hipoglikēmijas attīstības risku. Lielākajai daļai pacientu ar T1DM samazinās nepieciešamība pēc insulīna, jo nieres ir viena no galvenajām insulīna metabolisma vietām. Ja kreatinīna līmenis serumā paaugstinās līdz 500 μmol/L vai vairāk, ir nepieciešams izvirzīt jautājumu par pacienta sagatavošanu ekstrakorporālai (hemodialīze, peritoneālā dialīze) vai ķirurģiskai (nieru transplantācija) ārstēšanas metodei. Nieru transplantācija ir indicēta, ja kreatinīna līmenis sasniedz 600-700 µmol/l un glomerulārās filtrācijas ātrums samazinās līdz mazāk nekā 25 ml/min, hemodialīze - attiecīgi 1000-1200 µmol/l un mazāk par 10 ml/min.
Prognoze
50% pacientu ar 1. tipa cukura diabētu un 10% pacientu ar 2. tipa cukura diabētu, kuriem ir proteīnūrija, nākamo 10 gadu laikā attīstās hroniska nieru mazspēja. 15% no visiem nāves gadījumiem pacientiem ar 1. tipa cukura diabētu, kas jaunāki par 50 gadiem, ir saistīti ar hronisku nieru mazspēju, ko izraisa DNF.
7.8.4. Diabētiskā neiropātija
Diabētiskā neiropātija(DNE) ir nervu sistēmas bojājumu sindromu kombinācija, ko var klasificēt atkarībā no tā dažādo daļu dominējošās iesaistīšanās procesā (sensomotorā, autonomā), kā arī bojājuma izplatības un smaguma pakāpes (7.20. tabula). ).
es Sensomotorā neiropātija:
Simetrisks;
Fokāla (mononeiropātija) vai polifokāla (galvaskausa, proksimālā motora, ekstremitāšu un stumbra mononeuropatija).
II. Autonomā (autonomā) neiropātija:
Sirds un asinsvadu sistēmas (ortostatiskā hipotensija, sirds denervācijas sindroms);
Kuņģa-zarnu trakta (kuņģa atonija, žultsceļu diskinēzija, diabētiskā enteropātija);
Uroģenitālā (ar urīnpūšļa un seksuālās funkcijas disfunkciju);
Pacienta spēja atpazīt hipoglikēmiju ir traucēta;
traucēta skolēna funkcija;
Sviedru dziedzeru darbības traucējumi (distālā anhidroze, hiperhidroze ēšanas laikā).
Tabula 7.20. Diabētiskā neiropātija
 Etioloģija un patoģenēze
Etioloģija un patoģenēze
Galvenais DNE cēlonis ir hiperglikēmija. Tiek ierosināti vairāki tā patoģenēzes mehānismi:
Glikozes metabolisma poliola ceļa aktivizēšana, kā rezultātā uzkrājas sorbīts, fruktoze un samazinās mioinozīta un glutationa saturs nervu šūnās. Tas savukārt izraisa brīvo radikāļu procesu aktivizēšanos un slāpekļa oksīda līmeņa pazemināšanos;
Nervu šūnu membrānas un citoplazmas proteīnu neenzimātiska glikozilēšana;
Mikroangiopātija vasa nervs kas izraisa kapilārās asinsrites palēnināšanos un nervu hipoksiju.
Epidemioloģija
DNE izplatība abos diabēta veidos ir aptuveni 30%. Ar T1DM pēc 5 gadiem no slimības sākuma to sāk atklāt 10% pacientu. Jaunu DNE gadījumu biežums T2DM ir aptuveni 6% pacientu gadā. Visizplatītākais variants ir distālais simetrisks sensoromotors DNE.
Klīniskās izpausmes
Sensomotoru DIENA izpaužas kā motoru un sensoro traucējumu komplekss. Biežs DNE distālās formas simptoms ir parestēzija, kas izpaužas kā “rāpojošas zosādas” sajūta, nejutīgums. Pacienti bieži sūdzas par vēsām pēdām, lai gan tās paliek siltas, pieskaroties, kas ir pazīme, kas atšķir polineuropatiju no išēmiskām izmaiņām, kad pēdas ir aukstas. Sensorās neiropātijas agrīna izpausme ir vibrācijas jutīguma pārkāpums. Raksturīgs ir "nemierīgo kāju" sindroms, kas ir nakts parestēzijas un paaugstinātas jutības kombinācija. Kāju sāpes visbiežāk traucē naktī, un dažreiz pacients nevar izturēt segas pieskārienu. Tipiskā gadījumā sāpes, atšķirībā no okluzīvām artēriju slimībām, var mazināties ejot. Gadu gaitā sāpes var spontāni apstāties, jo mirst mazās nervu šķiedras, kas ir atbildīgas par sāpju jutīgumu. Hipestēzija izpaužas ar jutīguma zudumu “zeķu” un “cimdu” veidā. Dziļas, proprioceptīvās jutības pārkāpums izraisa koordinācijas traucējumus un pārvietošanās grūtības (sensoro ataksiju). Pacients sūdzas par “svešajām kājām”, sajūtu, ka “stāv uz vates”. Trofiskās inervācijas pārkāpums izraisa deģeneratīvas izmaiņas ādā, kaulos un cīpslās. Pavājināta sāpju jutība izraisa biežas, pacienta nepamanītas pēdu mikrotraumas, kuras viegli inficējas. Koordinācijas un staigāšanas traucējumi noved pie pēdas locītavu slodzes nefizioloģiskas pārdales. Rezultātā tiek izjauktas anatomiskās attiecības kājas muskuļu un skeleta sistēmā.
Pēdas velve ir deformēta, pietūkums, lūzumi, veidojas hroniski strutojoši procesi (skatīt 7.8.5. apakšpunktu).
Pastāv vairākas autonomas dienasgaismas formas. Cēlonis sirds un asinsvadu forma- sirds un plaušu kompleksa un lielo asinsvadu inervācijas traucējumi. Vagusa nervs ir garākais nervs, un tāpēc tas tiek ietekmēts agrāk nekā citi. Simpātisku ietekmju dominēšanas rezultātā, tahikardija miera stāvoklī. Parādās neadekvāta reakcija uz ortostāzi ortostatiskā hipotensija un ģībonis. Plaušu-sirds kompleksa autonomā denervācija noved pie sirdsdarbības ātruma mainīguma trūkuma. Autonomā neiropātija ir saistīta ar palielinātu klusa miokarda infarkta izplatību pacientiem ar cukura diabētu.
Simptomi kuņģa-zarnu trakta forma DNE ir gastroparēze ar lēnu vai, gluži pretēji, ātru kuņģa iztukšošanos, kas var radīt grūtības insulīna terapijas izvēlē, jo ogļhidrātu uzsūkšanās laiks un apjoms mainās bezgalīgi; barības vada atonija, refluksa ezofagīts, disfāgija; ūdeņaina caureja. Priekš uroģenitālā forma DNE raksturo urīnvadu un urīnpūšļa atonija, kas izraisa noslieci uz urīnceļu infekcijām; erektilā disfunkcija (apmēram 50% pacientu ar cukura diabētu); retrogrāda ejakulācija.
Citas iespējamās veģetatīvās DNE izpausmes ir traucēta spēja atpazīt hipoglikēmiju, traucēta skolēna funkcija, traucēta sviedru dziedzeru darbība (anhidroze) un diabētiskā amiotrofija.
Diagnostika
Katru gadu jāveic neiroloģiskā izmeklēšana pacientiem ar cukura diabētu. Tas ietver vismaz testu veikšanu, lai identificētu distālo sensoromotoro neiropātiju. To veic, novērtējot vibrācijas jutību, izmantojot graduētu kamertoni, taustes jutību, izmantojot monopavedienu, kā arī temperatūras un sāpju jutību. Pēc indikācijām tiek pētīts veģetatīvās nervu sistēmas stāvoklis: lai diagnosticētu sirds parasimpātiskās inervācijas nepietiekamību, tiek izmantoti vairāki funkcionālie testi, piemēram, sirdsdarbības mērīšana dziļas elpošanas laikā ar mainīguma novērtēšanu.
sirdsdarbība un Valsalva manevrs; Lai diagnosticētu sirds simpātiskās inervācijas nepietiekamību, tiek izmantots ortostatiskais tests.
Diferenciāldiagnoze
Citas izcelsmes neiropātijas (alkoholiskas, urēmiskas, ar B 12 deficīta anēmiju utt.). Konkrēta orgāna disfunkcijas diagnoze autonomās neiropātijas rezultātā tiek noteikta tikai pēc orgānu patoloģijas izslēgšanas.
Ārstēšana
1. Glikozes līmeni pazeminošas terapijas optimizācija.
2. Pēdu kopšana (skat. 7.8.5. punktu).
3. Neirotropo zāļu (α-lipoīnskābes) efektivitāte nav apstiprināta visos pētījumos.
4. Simptomātiska terapija (sāpju mazināšana, sildenafils erektilās disfunkcijas gadījumā, fludrokortizons ortostatiskas hipotensijas ārstēšanai utt.).
Prognoze
Sākotnējās stadijās DNE var būt atgriezeniska uz pastāvīgas diabēta kompensācijas fona. DNE tiek atklāts 80% pacientu ar čūlainiem bojājumiem un ir galvenais kājas amputācijas riska faktors
7.8.5. Diabētiskās pēdas sindroms
Diabētiskās pēdas sindroms(SDS) ir pēdas patoloģisks stāvoklis cukura diabēta gadījumā, kas rodas uz perifēro nervu, ādas un mīksto audu, kaulu un locītavu bojājumu fona un izpaužas ar akūtām un hroniskām čūlām, osteoartikulāriem bojājumiem un strutojoši-nekrotiskiem procesiem (7.21. tabula). .
Etioloģija un patoģenēze
DFS patoģenēze ir daudzkomponentu, un to raksturo neiropātisku un perfūzijas traucējumu kombinācija ar izteiktu infekcijas tendenci. Pamatojoties uz viena vai otra uzskaitītā faktora pārsvaru patoģenēzē, izšķir 3 galvenās formas
Tabula 7.21. Diabētiskās pēdas sindroms
 I. Neiropātiskā forma(60-70 %):
I. Neiropātiskā forma(60-70 %):
Bez osteoartropātijas;
Ar diabētisku osteoartropātiju.
II. Neiroišēmiska (jaukta) forma(15-20 %).
III. Išēmiska forma(3-7 %).
SDS neiropātiskā forma. Diabētiskās neiropātijas gadījumā galvenokārt tiek ietekmētas garāko nervu distālās daļas. Ilgstošs trofisko impulsu trūkums izraisa ādas, kaulu, saišu, cīpslu un muskuļu hipotrofiju. Savienojošo struktūru hipotrofijas rezultāts ir pēdas deformācija ar nefizioloģisku atbalsta slodzes pārdali un pārmērīgu tās palielināšanos noteiktos apgabalos. Šajās vietās, piemēram, pleznas kaulu galvu projekcijas zonā, tiek novērota ādas sabiezēšana un hiperkeratožu veidošanās. Pastāvīgs spiediens uz šīm zonām izraisa pamatā esošo mīksto audu iekaisuma autolīzi, kas rada priekšnoteikumus čūlaina defekta veidošanai. Atrofijas un traucētas svīšanas rezultātā āda kļūst sausa un viegli plaisā. Sāpju jutības samazināšanās dēļ pacients bieži nepievērš uzmanību notiekošajām izmaiņām. Viņš nevar laicīgi noteikt apavu neērtības, kas izraisa nobrāzumu un nobrāzumu veidošanos, kā arī nepamana svešķermeņu vai mazu brūču iekļūšanu plaisāšanas vietās. Situāciju pasliktina dziļas jutības pārkāpums, kas izpaužas kā gaitas traucējumi un nepareiza kāju pozīcija. Visbiežāk čūlainais defekts ir inficēts ar stafilokokiem, streptokokiem un zarnu baktērijām; anaerobā flora bieži pievienojas. Neiropātiskā osteoartropātija ir izteiktu distrofisku izmaiņu rezultāts pēdas osteoartikulārajā aparātā (osteoporoze, osteolīze, hiperostoze).
SDS išēmiskā forma ir apakšējo ekstremitāšu artēriju aterosklerozes sekas, kas izraisa galvenās asinsrites traucējumus, t.i. ir viens no diabētiskās makroangiopātijas variantiem.
Epidemioloģija
DDS novēro 10-25%, un saskaņā ar dažiem datiem vienā vai otrā formā 30-80% pacientu ar cukura diabētu. Amerikas Savienotajās Valstīs ikgadējās izmaksas par pacientu ar cukura diabētu ārstēšanu ar DDS ir 1 miljards ASV dolāru.
Klīniskās izpausmes
Plkst neiropātiskā forma SDS izšķir divus visbiežāk sastopamos bojājumu veidus: neiropātisku čūlu un osteoartropātijas (ar attīstību
 Rīsi. 7.12. Neiropātiskā čūla diabētiskās pēdas sindroma gadījumā
Rīsi. 7.12. Neiropātiskā čūla diabētiskās pēdas sindroma gadījumā
 Rīsi. 7.13. Charcot locītava diabētiskās pēdas sindroma gadījumā
Rīsi. 7.13. Charcot locītava diabētiskās pēdas sindroma gadījumā
Šarko locītava). Neiropātiskās čūlas, Parasti tie ir lokalizēti zoles un starppirkstu telpu zonā, t.i. uz pēdas zonām, kurās ir vislielākais spiediens (7.12. att.).
Destruktīvās izmaiņas pēdas saišu sistēmā var progresēt daudzu mēnešu laikā un izraisīt smagu kaulu deformāciju - diabētiskā osteoartropātija un veidošanās Šarko locītava,šajā gadījumā pēda tēlaini tiek salīdzināta ar “kaulu maisu”
Plkst SDS išēmiskā forma
pēdu āda ir auksta, bāla vai ciāniska; retāk tam ir sārti sarkans nokrāsa, ko izraisa virspusējo kapilāru paplašināšanās, reaģējot uz išēmiju. Čūlainie defekti rodas kā akrālā nekroze – uz pirkstu galiem, papēžu malējās virsmas (7.14. att.).
Pulss pēdas, popliteālās un augšstilba kaula artērijās ir novājināts vai nav taustāms.
Tipiskos gadījumos pacienti sūdzas par “intermitējošu klucīšanos”. Išēmisku ekstremitāšu bojājumu smagumu nosaka trīs galvenie faktori: stenozes smagums, blakus asinsrites attīstība un asins koagulācijas sistēmas stāvoklis.
Diagnostika
Cukura diabēta pacientam kāju pārbaude jāveic katru reizi vizītes laikā pie ārsta, ne retāk kā reizi pusgadā. SDS diagnoze ietver:
 Rīsi. 7.14. Akrālā nekroze diabētiskās pēdas sindroma išēmiskā formā
Rīsi. 7.14. Akrālā nekroze diabētiskās pēdas sindroma išēmiskā formā
Pēdu pārbaude;
Neiroloģiskā stāvokļa novērtējums - dažāda veida jutīgums, cīpslu refleksi, elektromiogrāfija;
Arteriālās asinsrites stāvokļa novērtēšana - angiogrāfija, Doplera ultraskaņa, Doplera sonogrāfija;
Pēdu un potīšu locītavu rentgenogrāfija;
Brūču izdalījumu bakterioloģiskā izmeklēšana.
Diferenciāldiagnoze
To veic ar dažādas izcelsmes pēdu brūču procesiem, kā arī citām apakšējo ekstremitāšu asinsvadu okluzīvām slimībām un pēdas locītavu patoloģijām. Turklāt ir nepieciešams diferencēt DFS klīniskās formas (7.22. tabula).
Ārstēšana
Ārstēšana neiropātiski inficēts VTS veidlapa ietver šādu darbību kopumu:
Diabēta kompensācijas optimizācija parasti ietver insulīna devas palielināšanu, bet diabēta-2 gadījumā – pāreju uz to;
Sistēmiskā antibiotiku terapija;
Pilnīga pēdas atslogošana (tas var izraisīt gadiem ilgi pastāvējušu čūlu sadzīšanu dažu nedēļu laikā);
Vietēja brūces ārstēšana ar hiperkeratozes zonu noņemšanu;
Pēdu kopšana, pareiza speciālo apavu izvēle un valkāšana. Savlaicīga konservatīvā terapija ļauj
izvairīties no operācijas 95% gadījumu.
Tabula 7.22. DFS klīnisko formu diferenciāldiagnoze
 Ārstēšana išēmisks VTS veidlapas ietver:
Ārstēšana išēmisks VTS veidlapas ietver:
Diabēta kompensācijas optimizācija parasti ietver insulīna devas palielināšanu, bet diabēta-2 gadījumā – pāreju uz to;
Ja nav čūlaini-nekrotisku bojājumu, ergoterapija (1-2 stundas pastaigas dienā, veicinot kolaterālas asinsrites attīstību);
Revaskularizācijas operācijas skartajos traukos;
Konservatīvā terapija: antikoagulanti, aspirīns (līdz 100 mg/dienā), ja nepieciešams, fibrinolītiskie līdzekļi, prostaglandīns E1 un prostaciklīna preparāti.
Attīstoties plašiem strutaini-nekrotiskiem bojājumiem visu veidu DFS, tiek izvirzīts jautājums par amputāciju.
Prognoze
No 50 līdz 70% no kopējā veikto kāju amputāciju skaita ir cukura diabēta pacienti. Kāju amputācijas pacientiem ar cukura diabētu notiek 20-40 reizes biežāk nekā cilvēkiem bez cukura diabēta.
7.9. DIABĒTS UN GRŪTNIECĪBA
Gestācijas cukura diabēts(GDM) ir glikozes tolerances traucējumi, kas pirmo reizi konstatēti grūtniecības laikā (7.23. tabula). Šī definīcija neizslēdz iespēju, ka ogļhidrātu metabolisma patoloģija varētu būt pirms grūtniecības. GDM jānošķir no situācijām, kad sievietei ar iepriekš diagnosticētu cukura diabētu (vecuma dēļ biežāk T1DM) iestājas grūtniecība.
Etioloģija un patoģenēze
GDM tie ir līdzīgi tiem, kas ir T2DM. Augsts olnīcu un placentas steroīdu līmenis, kā arī kortizola ražošanas palielināšanās virsnieru garozā izraisa fizioloģiskās insulīna rezistences attīstību grūtniecības laikā. GDM attīstība ir saistīta ar to, ka insulīna rezistence, kas dabiski veidojas grūtniecības laikā, un līdz ar to paaugstināta nepieciešamība pēc insulīna predisponētām personām pārsniedz aizkuņģa dziedzera β-šūnu funkcionālās spējas. Pēc dzemdībām, līdz ar hormonālo un vielmaiņas attiecību atgriešanos sākotnējā līmenī, tas parasti pāriet.
Tabula 7.23. Gestācijas cukura diabēts
 GDM parasti attīstās 2. trimestra vidū, no 4 līdz 8 grūtniecības mēnešiem. Lielākajai daļai pacientu ir liekais svars, un viņiem anamnēzē ir cukura diabēts-2. GDM attīstības riska faktori, kā arī sieviešu grupas ar zemu GDM attīstības risku ir norādītas tabulā. 7.24.
GDM parasti attīstās 2. trimestra vidū, no 4 līdz 8 grūtniecības mēnešiem. Lielākajai daļai pacientu ir liekais svars, un viņiem anamnēzē ir cukura diabēts-2. GDM attīstības riska faktori, kā arī sieviešu grupas ar zemu GDM attīstības risku ir norādītas tabulā. 7.24.
Tabula 7.24. Riska faktori gestācijas cukura diabēta attīstībai
 Mātes hiperglikēmija izraisa hiperglikēmiju bērna asinsrites sistēmā. Glikoze viegli iekļūst placentā un nepārtraukti no mātes asinīm nonāk auglim. Notiek arī aktīva aminoskābju transportēšana un ketonvielu pārnešana uz augli. Turpretim insulīns, glikagons un mātes brīvās taukskābes nenonāk augļa asinīs. Pirmajās 9-12 grūtniecības nedēļās augļa aizkuņģa dziedzeris vēl neražo savu insulīnu. Šis laiks atbilst augļa organoģenēzes fāzei, kad ar pastāvīgu hiperglikēmiju mātei var veidoties dažādi attīstības defekti (sirds, mugurkaula, muguras smadzenes, kuņģa-zarnu trakts). No 12. grūtniecības nedēļas augļa aizkuņģa dziedzeris sāk sintezēt insulīnu, un, reaģējot uz hiperglikēmiju, attīstās augļa aizkuņģa dziedzera β-šūnu reaktīvā hipertrofija un hiperplāzija. Hiperinsulinēmijas dēļ attīstās augļa makrosomija, kā arī lecitīna sintēzes inhibīcija, kas izskaidro lielo respiratorā distresa sindroma sastopamību jaundzimušajiem. β-šūnu hiperplāzijas un hiperinsulinēmijas rezultātā ir tendence uz smagu un ilgstošu hipoglikēmiju.
Mātes hiperglikēmija izraisa hiperglikēmiju bērna asinsrites sistēmā. Glikoze viegli iekļūst placentā un nepārtraukti no mātes asinīm nonāk auglim. Notiek arī aktīva aminoskābju transportēšana un ketonvielu pārnešana uz augli. Turpretim insulīns, glikagons un mātes brīvās taukskābes nenonāk augļa asinīs. Pirmajās 9-12 grūtniecības nedēļās augļa aizkuņģa dziedzeris vēl neražo savu insulīnu. Šis laiks atbilst augļa organoģenēzes fāzei, kad ar pastāvīgu hiperglikēmiju mātei var veidoties dažādi attīstības defekti (sirds, mugurkaula, muguras smadzenes, kuņģa-zarnu trakts). No 12. grūtniecības nedēļas augļa aizkuņģa dziedzeris sāk sintezēt insulīnu, un, reaģējot uz hiperglikēmiju, attīstās augļa aizkuņģa dziedzera β-šūnu reaktīvā hipertrofija un hiperplāzija. Hiperinsulinēmijas dēļ attīstās augļa makrosomija, kā arī lecitīna sintēzes inhibīcija, kas izskaidro lielo respiratorā distresa sindroma sastopamību jaundzimušajiem. β-šūnu hiperplāzijas un hiperinsulinēmijas rezultātā ir tendence uz smagu un ilgstošu hipoglikēmiju.
Epidemioloģija
Ar cukura diabētu slimo 0,3% no visām reproduktīvā vecuma sievietēm, 0,2-0,3% grūtnieču jau sākotnēji slimo ar diabētu, un 1-14% grūtniecību GDM attīstās vai izpaužas īsts diabēts. GDM izplatība dažādās populācijās ir atšķirīga, piemēram, ASV to konstatē aptuveni 4% grūtnieču (135 tūkstoši gadījumu gadā).
Klīniskās izpausmes
GDM nav. Var būt nespecifiski dekompensēta diabēta simptomi.
Diagnostika
Glikozes līmeņa noteikšana tukšā dūšā ir indicēta visām grūtniecēm kā daļa no bioķīmiskās asins analīzes. Sievietēm, kurām ir risks (7.24. tabula), ieteicams perorālais glikozes tolerances tests(OGTT). Ir aprakstītas daudzas iespējas tās ieviešanai grūtniecēm. Vienkāršākais no tiem ietver šādus noteikumus:
3 dienas pirms pārbaudes sieviete ēd normālu uzturu un uztur ierasto fizisko aktivitāti;
Pārbaudi veic no rīta tukšā dūšā, pēc nakts badošanās vismaz 8 stundas;
Pēc asins parauga ņemšanas tukšā dūšā sieviete 5 minūšu laikā izdzer šķīdumu, kas sastāv no 75 gramiem sausas glikozes, kas izšķīdināta 250-300 ml ūdens; Glikozes līmenis asinīs tiek atkārtoti noteikts pēc 2 stundām.
GDM diagnozi nosaka šādi kritēriji:
Glikozes līmenis asinīs tukšā dūšā (venozās, kapilārās) > 6,1 mmol/l vai
Glikozes līmenis venozajā asins plazmā ≥ 7 mmol/l vai
Visa kapilārā asins glikoze vai venozās asins plazma 2 stundas pēc 75 g glikozes slodzes ≥ 7,8 mmol/l.
Ja sievietei, kurai ir risks, testa rezultāti ir normāli, testu atkārto 24-28 grūtniecības nedēļā.
Diferenciāldiagnoze
GDM un patiess diabēts; glikozūrija grūtniecēm.
Ārstēšana
Risks mātei un auglim, kā arī pieejas diabēta ārstēšanai un tā kontroles iezīmes GDM un patiesā diabēta gadījumā ir vienādas. Vēlīnās diabēta komplikācijas grūtniecības laikā var ievērojami progresēt, taču ar kvalitatīvu cukura diabēta kompensāciju nav indikāciju grūtniecības pārtraukšanai. Sievietei, kas slimo ar cukura diabētu (parasti 1. tipa cukura diabētu), grūtniecība jāplāno jaunībā, kad komplikāciju risks ir viszemākais. Ja grūtniecība tiek plānota, ieteicams to atcelt
saņemšana vairākus mēnešus pēc optimālas kompensācijas sasniegšanas. Kontrindikācijas grūtniecības plānošanai ir smaga nefropātija ar progresējošu nieru mazspēju, smaga išēmiska sirds slimība, smaga proliferatīva retinopātija, ko nevar koriģēt, ketoacidoze grūtniecības sākumā (ketonķermeņi ir teratogēni faktori).
Ārstēšanas mērķis GDM un patiesais diabēts grūtniecības laikā ir šādu laboratorijas parametru sasniegšana:
Glikēmija tukšā dūšā< 5-5,8 ммоль/л;
Glikēmija 1 stundu pēc ēšanas< 7,8 ммоль/л;
Glikēmija 2 stundas pēc ēšanas< 6,7 ммоль/л;
Vidējais dienas glikēmijas profils< 5,5 ммоль/л;
HbA1c līmenis ar ikmēneša monitoringu ir tāds pats kā veseliem cilvēkiem (4-6%).
Ar 1. tipa cukura diabētu, kā arī ārpus grūtniecības sievietei jāsaņem intensīva insulīnterapija, tomēr glikēmijas līmeni grūtniecības laikā ieteicams novērtēt 7-8 reizes dienā. Ja ar parastām injekcijām nav iespējams sasniegt normoglikēmisko kompensāciju, jāapsver pacienta pārnešana uz insulīnterapiju, izmantojot insulīna dozatoru.
Pirmajā posmā GDM ārstēšana Tiek nozīmēta diētas terapija, kas sastāv no ikdienas kaloriju daudzuma ierobežošanas līdz aptuveni 25 kcal/kg no faktiskā svara, galvenokārt pateicoties viegli sagremojamiem dzīvnieku izcelsmes ogļhidrātiem un taukiem, kā arī paplašinot fizisko aktivitāti. Ja diētas terapija nespēj sasniegt ārstēšanas mērķus, pacientam jānosaka intensīva insulīnterapija. Jebkuras tabletes glikozes līmeni pazeminošas zāles (TDL) grūtniecības laikā kontrindicēta. Izrādās, ka apmēram 15% sieviešu ir jāpāriet uz insulīnterapiju.
Prognoze
Ar neapmierinošu GDM un diabēta kompensāciju grūtniecības laikā dažādu patoloģiju attīstības iespējamība auglim ir 30% (risks ir 12 reizes lielāks nekā vispārējā populācijā). Vairāk nekā 50% sieviešu, kurām grūtniecības laikā tika diagnosticēts GDM, nākamo 15 gadu laikā attīstīsies T2DM.
Termins “diabēts” cēlies no grieķu vārda “I leak”; senos laikos tika uzskatīts, ka šīs slimības laikā organismā nonākušais šķidrums iziet cauri organismam, neuzsūcos. Diabetes insipidus ir reta hroniska patoloģija, kas pilnībā atbilst senajai definīcijai. Tās cēlonis ir hormona trūkums, kas regulē ūdens izdalīšanos caur nierēm. Rezultātā urīna izdalīšanās daudzkārt palielinās, praktiski liedzot cilvēkam normālu dzīvi.
Pacients pastāvīgi jūt slāpes un ir spiests dzert litrus šķidruma, lai novērstu dehidratāciju. Atšķirībā no cukura diabēta, cukura diabēts neizraisa glikozes līmeņa paaugstināšanos asinīs, nav saistīts ar aizkuņģa dziedzera darbību un neizraisa tipiskas diabēta komplikācijas. Šīm divām slimībām ir tikai viens kopīgs simptoms - izteikta poliūrija.
Diabetes insipidus - kas tas ir?
Ne viss šķidrums, kas nonāk mūsu nierēs, kļūst par urīnu. Gandrīz viss primārā urīna tilpums pēc filtrēšanas caur nieru kanāliņiem uzsūcas atpakaļ asinīs, un šo procesu sauc par reabsorbciju. No 150 litriem, ko nieres iziet cauri, tikai 1% izdalās koncentrēta sekundārā urīna veidā. Reabsorbcija ir iespējama, pateicoties akvaporīniem - proteīna vielām, kas veido poras šūnu membrānās. Viena veida akvaporīns, kas atrodas nierēs, veic savas funkcijas tikai vazopresīna klātbūtnē.
Vasopresīns ir hormons, kas tiek sintezēts hipotalāmā (smadzeņu daļā) un tiek uzglabāts hipofīzē (īpašā dziedzerī, kas atrodas smadzeņu apakšā). Tās galvenā funkcija ir regulēt ūdens metabolismu. Ja palielinās asins blīvums vai organismā nav pietiekami daudz šķidruma, palielinās vazopresīna izdalīšanās.
Ja kāda iemesla dēļ hormona sintēze samazinās vai nieru šūnas vairs neuztver vazopresīnu, attīstās cukura diabēts. Tās pirmā pazīme ir poliūrija, pārmērīgs urīns. Nieres var izdalīt līdz 20 litriem šķidruma dienā. Pacients pastāvīgi dzer ūdeni un urinē. Šāds dzīves ritms nogurdina cilvēku un būtiski pasliktina viņa dzīves kvalitāti. Vēl viens slimības nosaukums ir cukura diabēts. Cukura diabēta slimnieki saņem 3. invaliditātes grupu, iespēju ārstēties bez maksas un izrakstītos medikamentus.
Slimība ir reta, skar 2-3 cilvēkus no 1 miljona. Visbiežāk slimība sākas pieaugušā vecumā, vecumā no 25 līdz 40 gadiem - 6 cilvēki uz 1 miljonu iedzīvotāju. Bērniem diabēts insipidus attīstās daudz retāk.
Kādas ir dažādas ND formas un veidi?
Atkarībā no poliūrijas cēloņa bezcukura diabētu iedala šādās formās:
- Centrālais diabēts insipidus- sākas, kad smadzenes ir bojātas un vazopresīna izdalīšanās asinsritē apstājas. Šī forma var attīstīties pēc neiroķirurģijas, traumām, audzējiem, meningīta un citiem smadzeņu iekaisumiem. Bērniem centrālā forma bieži ir akūtas vai hroniskas infekcijas vai ģenētisku traucējumu rezultāts. Smagi simptomi pacientiem parādās, kad beidz funkcionēt aptuveni 80% hipotalāma kodolu, pirms tam hormonu sintēzi pārņem nebojātas vietas.
- Nefrogēns diabēts insipidus- attīstās, kad nieru kanāliņu receptori pārstāj reaģēt uz vazopresīnu. Ar šo diabēta formu urīns parasti veidojas mazāk nekā ar centrālo diabētu. Šādus traucējumus nierēs var izraisīt urīna stagnācija, cistiski veidojumi un audzēji, kā arī ilgstošs iekaisuma process. Pastāv arī iedzimta nieru bezcukura diabēta forma, ko izraisa augļa nieru anomālijas.
- Idiopātisks cukura diabēts- Diagnoze bieži tiek noteikta, ja ir nepietiekams vazopresīna daudzums, bet tā trūkuma cēloni šobrīd nevar noteikt. Parasti tas ir mazs audzējs. Pieaugot, veidojums tiek lokalizēts, izmantojot mūsdienu vizuālās metodes: MRI vai CT. Idiopātisku cukura diabētu var diagnosticēt arī tad, ja hormona līmenis ir augsts, bet izmaiņas nierēs nevar konstatēt. To parasti izskaidro gēnu mutācija. Simptomi tiek novēroti tikai vīriešiem. Sievietes ir bojāta gēna nēsātājas, viņām slimības pazīmes var noteikt tikai ar laboratorijas metodēm, nav izteiktas poliūrijas.
- Insipidus gestācijas diabēts- iespējama tikai grūtniecēm, jo tās cēlonis ir placentas sintezētais hormons vazopresināze, kas iznīcina vazopresīnu. Šī slimības forma pazūd uzreiz pēc dzemdībām - mūsu raksts par.
Papildus vazopresīna klātbūtnei asinīs bezcukura diabētu klasificē pēc citiem kritērijiem:
| Klasifikācijas kritēriji | Cukura diabēta veidi | Raksturīgs |
| Sākuma laiks | iedzimts | Reti novērots, parasti nefrogēns. |
| iegūta | Radās dzīves laikā citu slimību vai traumu dēļ. | |
| Cukura diabēta smagums diagnozes laikā | viegli | Poliūrija līdz 8 litriem dienā. |
| vidēji | 8-14 l | |
| smags | > 14 l | |
| Pacienta stāvoklis pēc ārstēšanas sākuma | kompensāciju | Poliūrijas nav. |
| apakškompensācija | Urīna izdalīšanās un slāpes palielinās vairākas reizes dienā. | |
| dekompensācija | Poliūrijas noturība pēc terapijas ievadīšanas. |
ZD attīstības iemesli
Cukura diabēta centrālā forma var attīstīties šādās situācijās:
- hipotalāma un hipofīzes traumas - šo zonu bojājumi, pietūkums tuvējā zonā, saspiešana ar citiem audiem;
- audzēji un metastāzes smadzenēs;
- ķirurģiskas vai staru terapijas iejaukšanās rezultātā smadzeņu struktūrās, kas atrodas tuvu hipotalāmam un hipofīzei. Šādas operācijas glābj pacienta dzīvību, bet retos gadījumos (20% no kopējā cukura diabēta sastopamības biežuma) ietekmē hormona veidošanos. Ir gadījumi, kad diabēts ir pašatveseļojies, kas sākas uzreiz pēc operācijas un pāriet dažu dienu laikā;
- staru terapija smadzeņu audzēju ārstēšanai;
- asinsrites traucējumi galvas traukos trombozes, aneirismas vai insulta rezultātā;
- neiroinfekcijas slimības - encefalīts, meningīts;
- akūtas infekcijas - garais klepus, gripa, vējbakas. Bērniem infekcijas slimības izraisa cukura diabētu biežāk nekā pieaugušajiem. Tas ir saistīts ar smadzeņu anatomijas īpatnībām bērnībā: strauju jaunu asinsvadu augšanu, esošo caurlaidību un nepilnīgi izveidoto hematoencefālisko barjeru;
- plaušu granulomatoze, tuberkuloze;
- klonidīna lietošana;
- iedzimti defekti - mikrocefālija, smadzeņu daļu nepietiekama attīstība;
- hipotalāma bojājumi intrauterīnās infekcijas dēļ. Diabēta simptomi šajā gadījumā var parādīties gadus vēlāk, stresa, traumu vai hormonālo izmaiņu dēļ.
- gēnu defekts, kas padara neiespējamu vazopresīna sintēzi;
- Volframa sindroms ir sarežģīts iedzimts traucējums, kas ietver cukura diabētu un bezcukura diabētu, sliktu redzi un dzirdi.

Iespējamie nefrogēna diabēta cēloņi:
- nieru mazspējas attīstība hroniskas nieru slimības, policistiskās slimības, urolitiāzes dēļ;
- olbaltumvielu metabolisma traucējumi ar amiloīda nogulsnēšanos nieru audos;
- nieru mieloma vai sarkoma;
- vazopresīna receptoru ģenētiskā mazspēja nierēs;
- noteiktu zāļu toksiskā ietekme uz nierēm:
Insipidus diabēta simptomi
Pirmā jebkuras formas diabēta insipidus pazīme ir krasi palielināta urinēšana (no 4 litriem), kas neapstājas naktī. Pacientam tiek liegts normāls miegs, un pakāpeniski attīstās nervu izsīkums. Bērniem sākas nakts un pēc tam dienas enurēze. Urīns ir dzidrs, gandrīz bez sāļiem, tā porcijas ir lielas, no puslitra. Bez ārstēšanas šāda urīna daudzuma dēļ nieru iegurnis un urīnpūslis pakāpeniski paplašinās.
Reaģējot uz šķidruma izvadīšanu no organisma, sākas stipras slāpes, pacienti dzer litrus ūdens. Priekšroka parasti tiek dota ļoti aukstiem dzērieniem, jo siltie dzērieni sliktāk remdē slāpes. Gremošana pasliktinās, kuņģis stiepjas un grimst, un zarnās rodas kairinājums.
Sākumā ar patērēto ūdeni pietiek, lai apmierinātu tā trūkumu organismā, tad pamazām sākas dehidratācija. Tās simptomi ir nogurums, galvassāpes un reibonis, zems asinsspiediens, aritmijas. Pacientam ar cukura diabētu samazinās siekalu daudzums, āda izžūst, neizdalās asaru šķidrums.
Simptomi vīriešiem - menstruāciju trūkums sievietēm, aizkavēta fiziskā un intelektuālā attīstība bērniem.
Diagnostika un pārbaude
Visiem pacientiem ar poliūriju jāpārbauda bezcukura diabēts. Diagnostikas procedūra:
- Anamnēzes apkopošana - pacienta iztaujāšana par slimības ilgumu, izdalītā urīna daudzumu, citiem simptomiem, bezcukura diabēta gadījumiem tuviem radiniekiem, iepriekšējām operācijām vai smadzeņu traumām. Slāpju rakstura noteikšana: ja tās nav naktī vai kad pacients ir aizņemts ar kādu interesantu darbību, poliūrijas cēlonis var būt nevis cukura diabēts, bet gan psihogēna polidipsija.
- Glikozes līmeņa noteikšana asinīs, lai izslēgtu cukura diabētu - un kā to izdarīt pareizi.
- Urīna analīze ar tā blīvuma un osmolaritātes aprēķinu. Blīvums, kas mazāks par 1005, un osmolaritāte, kas mazāka par 300, runā par labu diabēta insipidusam.
- Ūdens atņemšanas tests - pacientam uz 8 stundām tiek liegts jebkāds dzēriens un šķidra pārtika. Visu šo laiku viņš atrodas ārstu uzraudzībā. Ja rodas bīstama dehidratācija, testu pārtrauc agri. Cukura diabēts tiek uzskatīts par apstiprinātu, ja pacienta svars šajā laikā ir samazinājies par 5% vai vairāk un urīna osmolaritāte un blīvums nav palielinājies.
- Vasopresīna daudzuma analīze asinīs tūlīt pēc testa, lai noteiktu slimības formu. Centrālā diabēta gadījumā tā līmenis saglabājas zems, nefrogēnajā formā tas ievērojami palielinās.
- MRI, ja ir aizdomas par centrālo diabētu, lai atklātu audzēju smadzenēs.
- Nieru ultraskaņa ar lielu nefrogēnas formas iespējamību.
- Ģenētiskā skrīnings aizdomām par iedzimtu diabētu.
Insipidus diabēta ārstēšana
Pēc slimības cēloņa noteikšanas visi ārstu centieni ir vērsti uz tā novēršanu: audzēju izņemšanu, iekaisuma mazināšanu nierēs. Ja tiek identificēta centrālā forma un diabēts neapstājas pēc iespējamā cēloņa ārstēšanas, tiek nozīmēta aizstājterapija. Tas sastāv no pacientam trūkstošā hormona sintētiskā analoga - despopresīna (tabletes Minirin, Nourem, Nativa) ievadīšanas asinīs. Deva tiek izvēlēta individuāli atkarībā no sava vazopresīna sintēzes klātbūtnes un nepieciešamības pēc tā. Deva tiek uzskatīta par adekvātu, ja diabēta insipidus simptomi izzūd.

Ja jūsu hormons tiek ražots, bet nepietiekams, var ordinēt klofibrātu, karbamazepīnu vai hlorpropamīdu. Dažiem pacientiem tie var izraisīt pastiprinātu vazopresīna sintēzi. Bērniem no šīm zālēm ir atļauts tikai hlorpropamīds, taču, to lietojot, ir nepieciešams kontrolēt glikozes līmeni asinīs, jo tam ir hipoglikēmiska iedarbība.
Nav pierādīta efektīva nefrogēna diabēta ārstēšanas metode. Diurētiskie līdzekļi no tiazīdu grupas var samazināt šķidruma zudumu par 25-50%. Insipidus diabēta gadījumā tie nestimulē urīna izdalīšanos, kā veseliem cilvēkiem, bet, gluži pretēji, uzlabo tā reabsorbciju.
Papildus medikamentiem pacientiem tiek nozīmēta diēta ar ierobežotu olbaltumvielu daudzumu, lai nepārslogotu nieres. Lai novērstu dehidratāciju, jādzer pietiekami daudz šķidruma, vēlams sulas vai kompotus, lai atjaunotu izskalotos vitamīnus un mikroelementus.
Ja ārstēšana ir palīdzējusi sasniegt diabēta insipidus kompensācijas stadiju, pacients var dzīvot normālu dzīvi, saglabājot darba spējas. Pilnīga atveseļošanās ir iespējama, ja ir novērsts slimības cēlonis. Visbiežāk diabēts izzūd, ja to izraisījis traumas, audzēji un operācija. Citos gadījumos pacientiem nepieciešama mūža ārstēšana.
Viens no galvenajiem simptomiem, ko var izmantot, lai aizdomas par cukura diabētu, ir pastāvīgas slāpes un pārmērīga urinēšana, kas var sasniegt 5 un 10 litrus dienā.
Tie paši simptomi tiek novēroti ar cukura diabētu vai cukura diabētu. Šī diezgan retā slimība ir saistīta ar antidiurētiskā hormona vazopresīna deficītu.
Vasopresīnu var sintezēt samazinātos daudzumos, vai arī nieru receptori var vairs nereaģēt uz to. Tāpat bezcukura diabēts var attīstīties bērniem līdz viena gada vecumam, otrajā vai pēdējā grūtniecības trimestrī, lietojot medikamentus. Pēdējām formām, atšķirībā no centrālajām un nieru formām, ir labvēlīga prognoze un viegla gaita.
Diabēta insipidus attīstība: cēloņi un mehānisms
Lai šķidrums no primārā urīna atgrieztos atpakaļ asinīs, ir nepieciešams vazopresīns. Tas ir vienīgais hormons cilvēka organismā, kas spēj veikt šādu funkciju. Ja tas nedarbojas, attīstīsies smagi vielmaiņas traucējumi – cukura diabēts.
Vazopresīns tiek ražots hipotalāma neironos - supraoptiskajā kodolā. Tad tas pa neironu procesiem nonāk hipofīzē, kur uzkrājas un izdalās asinīs. Signāls tā izdalīšanai ir plazmas osmolaritātes (koncentrācijas) palielināšanās un cirkulējošā asins tilpuma samazināšanās.
Osmolaritāte atspoguļo visu izšķīdušo sāļu koncentrāciju. Parasti tas svārstās no 280 līdz 300 mOsm/l. Šajā gadījumā ķermenis darbojas fizioloģiskos apstākļos. Ja tas palielinās, tad receptori hipotalāmā, aknās un smadzeņu 3. kambara sieniņā pārraida signālus par nepieciešamību saglabāt šķidrumu, ņemot to no urīna.
Hipofīze saņem tādus pašus signālus no tilpuma receptoriem ātrijos un vēnās, kas atrodas krūškurvja iekšpusē, ja cirkulējošo asiņu tilpums ir zem normas. Uzturot normālu tilpumu, audi tiek apgādāti ar barības vielām un skābekli. Samazinoties asins tilpumam, spiediens traukos samazinās un mikrocirkulācija tiek kavēta.
Lai novērstu šķidruma deficīta un liekā sāls sekas, tiek atbrīvots vazopresīns. Antidiurētiskā hormona līmeņa paaugstināšanās rodas šādu iemeslu dēļ: sāpju šoks traumas laikā, asins zudums, dehidratācija, psihoze.
Vazopresīna darbība notiek šādos virzienos:
- Samazinās urīna izdalīšanās.
- Ūdens no urīna nonāk asinīs, palielinot tā tilpumu.
- Samazinās plazmas osmolaritāte, tostarp nātrija un hlora līmenis.
- Paaugstinās gludo muskuļu tonuss, īpaši gremošanas sistēmā un asinsvados.
- Spiediens artērijās palielinās, un tās kļūst jutīgākas pret adrenalīnu un norepinefrīnu.
- Asiņošana apstājas.
Turklāt vazopresīns ietekmē cilvēka uzvedību, daļēji nosakot sociālo uzvedību, agresīvas reakcijas un veidojot tēvos mīlestību pret bērniem.
Ja hormons pārstāj iekļūt asinīs vai zūd jutība pret to, attīstās cukura diabēts.
Insipidus diabēta formas
Cukura līmenis
 Centrālā tipa cukura diabēts attīstās ar traumām un smadzeņu audzējiem, kā arī ar traucētu asins piegādi hipotalāmam vai hipofīzei. Bieži slimības rašanās ir saistīta ar neiroinfekciju.
Centrālā tipa cukura diabēts attīstās ar traumām un smadzeņu audzējiem, kā arī ar traucētu asins piegādi hipotalāmam vai hipofīzei. Bieži slimības rašanās ir saistīta ar neiroinfekciju.
Hipofīzes adenomas ķirurģiska ārstēšana vai starojums ārstēšanas laikā var izraisīt bezcukura diabēta simptomu attīstību. Ģenētisko Volframa sindromu papildina nepietiekama vazopresīna ražošana, kas stimulē šīs patoloģijas rašanos.
Ja ir grūti noteikt cēloni, ko novēro ievērojamai daļai pacientu ar centrālo cukura diabēta formu, šo slimības variantu sauc par idiopātisku.
Nieru formā vazopresīna receptori nereaģē uz tā klātbūtni asinīs. Tas var būt šādu iemeslu dēļ:
- Iedzimti receptoru struktūras traucējumi.
- Nieru mazspēja.
- Traucējumi plazmas jonu sastāvā.
- Litija medikamentu lietošana.
- Diabētiskā nefropātija vēlīnās stadijās.
Cukura diabēts grūtniecēm tiek klasificēts kā pārejošs (pārejošs), tas ir saistīts ar faktu, ka placentas ražotie fermenti iznīcina vazopresīnu. Pēc dzemdībām gestācijas diabēts insipidus izzūd.
Tāpat bērni pirmajā dzīves gadā cieš no pārejoša cukura diabēta, kas saistīts ar hipofīzes un hipotalāma veidošanos.
Slimības smagums un ūdens-elektrolītu metabolisma traucējumu līmenis ir atkarīgs no ķermeņa dehidratācijas pakāpes. Pastāv šādas insipidus diabēta formas:
- Smags - urinēšana 14 litri dienā.
- Vidēji – diurēze no 8 līdz 14 litriem dienā.
- viegls - pacienti izdala līdz 8 litriem dienā.
- Ja jūs zaudējat mazāk par 4 litriem dienā - daļējs (daļējs) cukura diabēts.
Pārejošs diabēts bērniem un grūtniecēm bieži notiek vieglā formā. Lietojot medikamentus (jatrogēnus) – vidēji smagas. Centrālajā un nieru formā tiek novērota vissmagākā cukura diabēta gaita.
Cukura diabēts insipidus tiek uzskatīts par diezgan retu patoloģiju. Bet nesen tika reģistrēts pastāvīgs centrālo formu pieaugums, jo ir palielinājies traumatisku smadzeņu ievainojumu skaits un smadzeņu slimību ķirurģiska iejaukšanās.
Visbiežāk bezcukura diabēts un tā simptomi tiek konstatēti vīriešiem vecumā no 10 līdz 30 gadiem.
Insipidus diabēta diagnostika
Insipidus diabēta simptomi ir saistīti ar lielu urīna daudzumu un dehidratācijas attīstību. Turklāt attīstās elektrolītu līdzsvara traucējumi asinīs un asinsspiediena pazemināšanās.
Smaguma pakāpi nosaka slimības smagums un tās rašanās cēlonis. Galvenās pacientu sūdzības, tāpat kā diabēta gadījumā, ir stipras slāpes, pastāvīga sausa mute, sausa, dehidrēta āda un gļotādas, kā arī bieža un bagātīga urinēšana.
Pacienti var izdzert vairāk nekā 6 litrus šķidruma dienā, un izdalītā urīna daudzums palielinās līdz 10-20 litriem. Nakts diurēze ievērojami palielinās.
Tipiski diabēta insipidus simptomi ir:
- Smags nogurums, bezspēcība.
- Bezmiegs vai pastiprināta miegainība.
- Samazināta siekalu ražošana.
- Pastāvīgs aizcietējums.
- Smaguma sajūta vēderā pēc ēšanas, atraugas.
- Slikta dūša un vemšana.
- Paaugstināta ķermeņa temperatūra.
No sirds un asinsvadu sistēmas veidojas traucētas asinsvadu regulācijas simptomu komplekss - asinsspiediena pazemināšanās, ātrs pulss, sirdsdarbības pārtraukumi. Ķermeņa svars samazinās, bērniem pēc 4 gadu vecuma attīstās urīna nesaturēšana, un pacientus nomoka pastāvīgs ādas nieze.
Neiroloģiskie simptomi attīstās kā sekas elektrolītu zudumam urīnā - galvassāpes, krampji vai muskuļu un citu ķermeņa daļu raustīšanās. Vīriešu diabēta insipidusam ir tāda tipiska izpausme kā samazināts libido un erektilās disfunkcijas attīstība.
Bezcukura diabēta diagnozes apstiprināšanai tiek veikta laboratoriskā diagnostika un speciālie izmeklējumi, lai noskaidrotu bezcukura diabēta izcelsmi. Tiek veikta slimības nieru un centrālās formas diferenciāldiagnoze, izslēgts arī cukura diabēts.
Pirmajā posmā tiek pārbaudīts urīna tilpums, tā blīvums un osmolalitāte. Cukura diabētu insipidus raksturo šādas vērtības:
- Uz katru ķermeņa svara kilogramu dienā izdalās vairāk nekā 40 ml urīna.
- Urīna relatīvā blīvuma samazināšanās zem 1005 g/l
- Urīna osmolalitāte mazāka par 300 mOsm/kg
Cukura diabēta nieru formā parādās šādas pazīmes: hiperkalciēmija, hiperkaliēmija, paaugstināts kreatinīna līmenis asinīs, nieru mazspējas pazīmes vai infekciozs process urīnceļos. Diabētiskās nefropātijas gadījumā diagnostikas indikators ir cukura līmeņa paaugstināšanās asinīs.
Veicot sausās ēšanas testu, pacienti ātri piedzīvo dehidratācijas simptomus un svara zudumu. Pārbaudot ar desmopresīnu, cukura diabēta centrālā forma ātri tiek novērsta.
Ja diagnoze ir neskaidra, ir nepieciešams veikt smadzeņu tomogrāfiju, kā arī ģenētisko pētījumu.
Insipidus diabēta ārstēšana
Taktikas izvēle diabēta insipidus ārstēšanā ir atkarīga no slimības formas. Lai ārstētu centrālo formu hipotalāma vai hipofīzes bojājumu dēļ, tiek izmantots sintētiski ražots vazopresīna analogs.
Zāles, kuru pamatā ir desmopresīns, ir pieejamas tablešu vai deguna aerosola veidā. Tirdzniecības nosaukumi: Vazomirin, Minirin, Presaynex un Nativa. Tas veicina ūdens reabsorbciju nierēs. Tāpēc, to lietojot, jādzer tikai tad, kad ir slāpes, lai neizraisītu ūdens reibumu.
Ja esat pārdozējis desmopresīnu vai patērējat lielu daudzumu šķidruma tā lietošanas laikā, var rasties:
- Paaugstināts asinsspiediens.
- Audu tūskas attīstība.
- Samazināta nātrija koncentrācija asinīs.
- Apziņas traucējumi.
Devu izvēlas individuāli no 10 līdz 40 mcg dienā. To var lietot vienu reizi vai sadalīt divās devās. Parasti zāles ir labi panesamas, taču ir iespējamas blakusparādības kā galvassāpes un reibonis, sāpes zarnās, slikta dūša un mērens asinsspiediena paaugstinājums.
Lietojot desmopresīna aerosolu vai pilienus, jāatceras, ka tad, kad gļotādas pietūkuma dēļ ir iesnas, zāļu uzsūkšanās palēninās, tāpēc šādos gadījumos tās var pilināt zem mēles.
Cukura diabēta centrālajā formā vazopresīna ražošanas stimulēšanai izmanto arī zāles, kuru pamatā ir karbamazepīns (Finlepsin, Zeptol) un hlorpropamīds.
Nefrogēns cukura diabēts ir saistīts ar nieru nespēju reaģēt uz vazopresīnu, kas var būt pietiekamā daudzumā asinīs. Tomēr, pārbaudot ar desmopresīnu, reakcija neparādās.
Lai ārstētu šo formu, tiek izmantoti tiazīdu grupas diurētiskie līdzekļi un nesteroīdie pretiekaisuma līdzekļi - Indometacīns, Nimesulīds, Voltarens. Sāls daudzums uzturā ir ierobežots.
Gestācijas diabētu insipidus ārstē ar desmopresīna zālēm, ārstēšanu veic tikai grūtniecības laikā, pēc dzemdībām šāda terapija nav nepieciešama.
Viegla vai daļēja cukura diabēta insipidus gadījumā var izmantot nemedikamentozu terapiju, izmantojot atbilstošu dzeršanas režīmu, lai novērstu dehidratāciju.
Lai samazinātu slodzi uz nierēm, tiek noteikts diētisks uzturs. Tās galvenie principi:
- Olbaltumvielu, īpaši gaļas, ierobežošana.
- Pietiekams tauku un ogļhidrātu daudzums.
- Biežas nelielas maltītes.
- Svaigu dārzeņu un augļu iekļaušana.
- Lai remdētu slāpes, izmantojiet augļu dzērienus, sulas vai kompotus.
Ārstēšanas efektivitāti novērtē pēc pacientu pašsajūtas un izdalītā urīna daudzuma samazināšanās.
Cukura diabēts ir diezgan reta slimība, kas saistīta ar traucētu šķidruma uzsūkšanos nierēs. Šo slimību sauc arī par diabētu, jo tās attīstība noved pie tā, ka urīns pārstāj koncentrēties un lielos daudzumos atšķaidīts atstāj ķermeni.Līdzīga slimība rodas dzīvniekiem, visbiežāk suņiem un cilvēkiem, un jebkurā vecumā. Protams, šāds nopietns nieru darbības traucējums negatīvi ietekmē visa ķermeņa funkcionalitāti. Kā slimība izpaužas un kā to izārstēt?
Kas tas ir?
Cukura diabēts ir reta slimība (apmēram 3 no 100 000), kas saistīta ar hipotalāma vai hipofīzes disfunkciju, kam raksturīga poliūrija (6–15 litru urīna izdalīšanās dienā) un polidipsija (slāpes).
Tas notiek abiem dzimumiem, gan pieaugušajiem, gan bērniem. Visbiežāk slimo jaunieši – no 18 līdz 25 gadiem. Ir zināmi slimības gadījumi bērniem pirmajā dzīves gadā (A.D. Arbuzovs, 1959, Šarapovs V.S. 1992).
Cukura diabēta cēloņi
Cukura diabēts ir patoloģija, ko izraisa vazopresīna deficīts, tā absolūtais vai relatīvais deficīts. Vasopresīns (antidiurētiskais hormons) tiek izdalīts hipotalāmā un, cita starpā, ir atbildīgs par urinēšanas procesa normalizēšanu. Pēc izcelsmes cēloņiem ir ierasts izšķirt trīs šīs slimības veidus: ģenētisko, iegūto, idiopātisku.
Lielākajai daļai pacientu ar šo reto slimību cēlonis joprojām nav zināms. Šo diabēta veidu sauc par idiopātisku, un tas skar līdz 70 procentiem pacientu. Ģenētiskais ir iedzimts faktors. Šajā gadījumā diabēts insipidus dažreiz skar vairākus ģimenes locekļus un vairākas paaudzes pēc kārtas.
Medicīna to skaidro ar nopietnām genotipa izmaiņām, kas veicina antidiurētiskā hormona darbības traucējumus. Šīs slimības iedzimtība ir izskaidrojama ar iedzimtu defektu diencefalona un vidussmadzeņu struktūrā.
Apsverot diabēta insipidus cēloņus, jāņem vērā tā attīstības mehānismi:
1) Centrālais cukura diabēts - rodas, ja hipotalāmā ir nepietiekama vazopresīna sekrēcija vai ir traucēta tā izdalīšanās asinīs no hipofīzes, domājams, ka tā cēloņi ir:
- Hipotalāma patoloģija, jo tā ir atbildīga par urīna izdalīšanās regulēšanu un antidiurētiskā hormona sintēzi, tās darbības traucējumi izraisa šo slimību. Hipotalāma disfunkcijas cēloņi un provocējošie faktori var būt akūtas vai hroniskas infekcijas slimības: iekaisis kakls, gripa, seksuāli transmisīvās slimības, tuberkuloze.
- Ķirurģiskas iejaukšanās smadzenēs un smadzeņu iekaisuma patoloģijas.
- Smadzeņu satricinājums, traumatisks smadzeņu bojājums.
- Autoimūnas slimības.
- Cistiski, deģeneratīvi, iekaisīgi nieru bojājumi, kas pasliktina vazopresīna uztveri.
- Hipotalāma un hipofīzes audzēju procesi.
- Arī hipertensijas klātbūtne ir viens no pastiprinošiem faktoriem bezcukura diabēta laikā.
- Hipotalāma-hipofīzes sistēmas asinsvadu bojājumi, kas izraisa smadzeņu asinsrites problēmas traukos, kas apgādā hipotalāmu un hipofīzi.
2) Nieru bezcukura diabēts - šajā gadījumā vazopresīns tiek ražots normālā daudzumā, bet nieru audi uz to nereaģē pareizi. Iemesli var būt šādi:
- nefrona vai nieru medulla urīnvadu bojājumi;
- iedzimts faktors - iedzimta patoloģija;
- sirpjveida šūnu anēmija;
- paaugstināts kālija vai samazināts kalcija līmenis asinīs;
- hroniska nieru mazspēja;
- amiloidoze (amiloīda nogulsnēšanās audos) vai policistiska slimība (vairāku cistu veidošanās) nierēs;
- tādu zāļu lietošana, kurām var būt toksiska ietekme uz nieru audiem (demeklocilīns, amfotericīns B, litijs);
- dažreiz patoloģija rodas vecumā vai uz citu patoloģiju vājināšanas fona.
Dažreiz stresa dēļ var rasties pastiprinātas slāpes (psihogēna polidipsija). Vai arī cukura diabēts grūtniecības laikā, kas attīstās 3. trimestrī, jo placentas ražotie enzīmi iznīcina vazopresīnu. Abu veidu pārkāpumi tiek novērsti paši pēc galvenā cēloņa novēršanas.
Klasifikācija
Ir ierasts izšķirt 2 šīs slimības klīniskās formas:
- Nefrogēns diabēts insipidus (perifērs). Šī slimības forma ir distālo nieru kanāliņu jutības samazināšanās vai pilnīgas neesamības sekas pret vazopresīna bioloģisko iedarbību. Parasti to novēro hroniskas nieru patoloģijas (ar pielonefrītu vai policistisku nieru slimību fona), ilgstošas kālija satura samazināšanās asinīs un kalcija līmeņa paaugstināšanās gadījumā ar nepietiekamu olbaltumvielu uzņemšanu. no pārtikas - olbaltumvielu badošanās, Šegrena sindroms un daži iedzimti defekti. Dažos gadījumos slimība ir ģimenes raksturs.
- Neirogēns cukura diabēts (centrālais). Attīstās nervu sistēmas patoloģisku izmaiņu rezultātā, īpaši hipotalāmā vai hipofīzes aizmugurē. Parasti slimības cēlonis šajā gadījumā ir operācija, lai pilnībā vai daļēji noņemtu hipofīzi, šīs zonas infiltratīvā patoloģija (hemohromatoze, sarkoidoze), traumas vai iekaisuma rakstura izmaiņas. Dažos gadījumos neirogēns bezcukura diabēts ir idiopātisks, vienlaikus sastopams vairākiem vienas ģimenes locekļiem.

Insipidus diabēta simptomi
Pirmās diabēta insipidus pazīmes ir stipras, sāpīgas slāpes (polidipsija) un bieža pārmērīga urinēšana (poliūrija), kas nomoka pacientus pat naktī. Dienā var izdalīties no 3 līdz 15 litriem urīna, un dažreiz tā daudzums sasniedz pat 20 litrus dienā. Tāpēc pacientu mocīja stipras slāpes.
- Insipidus diabēta simptomi vīriešiem ir samazināts libido un potence.
- Cukura diabēta simptomi sievietēm: menstruālā cikla traucējumi līdz amenorejai, ar to saistīta neauglība un, ja iestājas grūtniecība, palielināts spontāna aborta risks.
- Cukura diabēta simptomi bērniem ir izteikti. Jaundzimušajiem un maziem bērniem šīs slimības stāvoklis parasti ir smags. Paaugstinās ķermeņa temperatūra, rodas neizskaidrojama vemšana, attīstās nervu sistēmas traucējumi. Vecākiem bērniem līdz pusaudža vecumam diabēta insipidus simptoms ir slapināšana gultā jeb enurēze.
Vēlāk, progresējot, parādās šādi simptomi:
- Pateicoties liela daudzuma šķidruma patēriņam, kuņģis stiepjas un dažreiz pat nokrīt;
- Parādās dehidratācijas pazīmes (ūdens trūkums organismā): sausa āda un gļotādas (sausa mute), samazināts ķermeņa svars;
- Sakarā ar urīna izdalīšanos lielos daudzumos, urīnpūslis ir izstiepts;
- Ūdens trūkuma dēļ organismā tiek traucēta gremošanas enzīmu ražošana kuņģī un zarnās. Tāpēc pacientam samazinās apetīte, attīstās gastrīts vai kolīts, un ir tendence uz aizcietējumiem;
- Asinsspiediens bieži pazeminās un sirdsdarbība palielinās;
- Tā kā organismā nav pietiekami daudz ūdens, samazinās svīšana;
- Pacients ātri nogurst;
- Dažreiz ir neizskaidrojama slikta dūša un vemšana;
- Ķermeņa temperatūra var paaugstināties.
- Dažreiz rodas slapināšana gultā (enurēze).
Tā kā slāpes un pārmērīga urinēšana turpinās naktī, pacientam attīstās garīgi un emocionāli traucējumi:
- emocionālā labilitāte (dažreiz pat attīstās psihoze) un aizkaitināmība;
- bezmiegs un galvassāpes;
- samazināta garīgā aktivitāte.
Tipiskos gadījumos šīs ir bezcukura diabēta pazīmes. Tomēr vīriešiem un sievietēm, kā arī bērniem slimības izpausmes var nedaudz atšķirties.
Diagnostika
Tipiskos gadījumos bezcukura diabēta diagnoze nav grūta un balstās uz:
- izteiktas slāpes
- ikdienas urīna daudzums ir vairāk nekā 3 litri dienā
- plazmas hiperosmolalitāte (vairāk nekā 290 mOsm/kg, atkarībā no šķidruma uzņemšanas)
- augsts nātrija saturs
- urīna hipoosmolalitāte (100-200 mOsm/kg)
- zems relatīvais urīna blīvums (<1010)
Lai noteiktu slimības cēloni, tiek rūpīgi analizēti rentgena, oftalmoloģisko un neiropsihiatrisko izmeklējumu rezultāti. Nepieciešama smadzeņu magnētiskās rezonanses attēlveidošana.

Kā ārstēt cukura diabētu?
Šīs patoloģijas terapijas veiksmīgais iznākums ir precīzi noteikt un novērst galveno cēloni, kas izraisa vazopresīna ražošanas traucējumus, piemēram, audzēju vai metastāzes smadzenēs bezcukura diabēta centrālajā formā.
Zāles pret cukura diabētu izvēlas ārstējošais ārsts, tās visas ir sintētisks antidiurētiskā hormona analogs. Atkarībā no zāļu darbības ilguma zāles jālieto vairākas reizes dienā vai reizi pāris dienās (ilgstošas darbības zāles).
Centrālās formas diabēta insipidus gadījumā visbiežāk tiek lietotas zāles karbamazepīns vai hlorpropamīds - šīs zāles stimulē vazopresīna veidošanos un izdalīšanos. Lai novērstu ķermeņa dehidratāciju uz bagātīgas un biežas urinēšanas fona, pacientam tiek ievadīti intravenozi fizioloģisko šķīdumu pilieni.
Bezcukura diabēta ārstēšana sievietēm sastāv no papildu konsultācijas ar ginekologu un menstruālā cikla korekciju.
Uztura noteikumi
Ikviens zina, ka pacientiem ar cukura diabētu ir “īpašas” attiecības ar cukuriem. Bet ko var teikt par uzturu, ja slimība ir cukura insipidus? Šajā gadījumā ierobežojums attieksies uz citu produktu – sāli. Ja pacients neslimo ar nieru mazspēju, tad sāli iespējams aizstāt ar uztura bagātinātāju, piemēram, Sanasol.
Šīs slimības diēta ietver olbaltumvielu pārtikas patēriņa ierobežošanu (ne vairāk kā 70 g dienā). Pacientam ieteicama uztura tabula Nr.7.
Diēta ietver šādus ēdienus un dzērienus:
- Ogas un augļi ar saldskābo garšu.
- Svaigi dārzeņi.
- Svaigi spiestas sulas, kvass, tējas - zāļu un zaļumu.
- Ūdens ar citronu sulu.
- Raudzētie piena produkti un dzērieni.
- Liesās gaļas veidi.
- Zema tauku satura zivis un jūras veltes.
Prognoze
Idiopātisks cukura diabēts, pakļauts adekvātai aizstājterapijai, nerada draudus pacienta dzīvībai, tomēr atveseļošanās no šīs formas nav iespējama.
Cukura diabēts, kas rodas uz kādas citas slimības fona, dažos gadījumos izzūd spontāni pēc tam, kad tiek novērsts cēlonis, kas to izraisījis.
1. tipa cukura diabēts ir orgānu specifiska autoimūna slimība, kas izraisa insulīnu ražojošo beta šūnu iznīcināšanu aizkuņģa dziedzera saliņās, kas izpaužas kā absolūts insulīna deficīts. Dažos gadījumos pacientiem ar atklātu 1. tipa cukura diabētu trūkst autoimūnu beta šūnu bojājumu marķieru (idiopātisks 1. tipa cukura diabēts).
Etioloģija
1. tipa cukura diabēts ir slimība ar iedzimtu predispozīciju, bet tās ieguldījums slimības attīstībā ir neliels (nosaka tā attīstību aptuveni par 1/3). 1. tipa cukura diabēta attīstības iespējamība bērnam ar slimu māti ir 1-2%, tēvam - 3-6%, brālim vai māsai - 6%. Viens vai vairāki humorālie autoimūno beta šūnu bojājumu marķieri, kas ietver antivielas pret aizkuņģa dziedzera saliņām, anti-glutamāta dekarboksilāzes antivielas (GAD 65) un anti-tirozīna fosfatāzes antivielas (IA-2 un IA-2beta), ir atrodami 85-90. % pacientu. Tomēr galvenā nozīme beta šūnu iznīcināšanā ir šūnu imunitātes faktoriem. 1. tipa cukura diabēts ir saistīts ar HLA haplotipiem DQA un DQB. Ar paaugstinātu biežumu 1. tipa cukura diabēts tiek kombinēts ar citām autoimūnām endokrīnām (autoimūns tiroidīts, Adisona slimība) un neendokrīnām slimībām, piemēram, alopēcija, vitiligo, Krona slimība, reimatiskas slimības.
Patoģenēze
1. tipa cukura diabēts izpaužas, kad autoimūna procesa rezultātā tiek iznīcināti 80-90% beta šūnu. Šī procesa ātrums un intensitāte var ievērojami atšķirties. Visbiežāk, kad tipisks kurss bērnu un jauniešu slimības, šis process norit diezgan ātri, kam seko strauja slimības izpausme, kurā var paiet tikai dažas nedēļas no pirmo klīnisko simptomu parādīšanās līdz ketoacidozes attīstībai (līdz ketoacidozes komai).
Citos, daudz retākos gadījumos, parasti pieaugušajiem, kas vecāki par 40 gadiem, slimība var būt latenta. (latents autoimūns diabēts pieaugušajiem - LADA), Turklāt slimības sākumā šādiem pacientiem bieži tiek diagnosticēts 2. tipa cukura diabēts, un vairākus gadus cukura diabēta kompensāciju var panākt, izrakstot sulfonilurīnvielas preparātus. Bet vēlāk, parasti pēc 3 gadiem, parādās absolūta insulīna deficīta pazīmes (svara zudums, ketonūrija, smaga hiperglikēmija, neskatoties uz tablešu hipoglikēmisko zāļu lietošanu).
1. tipa cukura diabēta patoģenēzes pamatā ir absolūts insulīna deficīts. Glikozes nespēja iekļūt no insulīna atkarīgos audos (taukos un muskuļos) izraisa enerģijas deficītu, kā rezultātā pastiprinās lipolīze un proteolīze, kas ir saistītas ar svara zudumu. Glikēmijas līmeņa paaugstināšanās izraisa hiperosmolaritāti, ko pavada osmotiskā diurēze un smaga dehidratācija. Insulīna deficīta un enerģijas deficīta apstākļos tiek pārtraukta kontrainsulāro hormonu (glikagona, kortizola, augšanas hormona) ražošana, kas, neskatoties uz glikēmijas palielināšanos, izraisa glikoneoģenēzes stimulāciju. Paaugstināta lipolīze taukaudos izraisa ievērojamu brīvo taukskābju koncentrācijas palielināšanos. Ar insulīna deficītu tiek nomākta aknu liposintētiskā spēja, un ketoģenēzē sāk iekļauties brīvās taukskābes. Ketonu ķermeņu uzkrāšanās izraisa diabētiskās ketozes attīstību un pēc tam ketoacidozi. Pakāpeniski palielinoties dehidratācijai un acidozei, attīstās koma, kas insulīna terapijas un rehidratācijas trūkuma gadījumā neizbēgami beidzas ar nāvi.
Epidemioloģija
1. tipa cukura diabēts veido 1,5-2% no visiem diabēta gadījumiem. Mūža risks saslimt ar 1. tipa cukura diabētu kaukāziešiem ir aptuveni 0,4%. Maksimālais 1. tipa cukura diabēta izpausmes vecums ir aptuveni 10-13 gadi. Lielākajā daļā gadījumu 1. tipa cukura diabēts izpaužas pirms 40 gadu vecuma.
Klīniskās izpausmes
Tipiskos gadījumos,Īpaši bērniem un jauniešiem 1. tipa cukura diabēts debitē ar skaidru klīnisku ainu, kas attīstās vairāku mēnešu vai pat nedēļu laikā. 1. tipa cukura diabēta izpausmi var izraisīt infekcijas un citas vienlaicīgas slimības. Raksturīgs simptomi, kas raksturīgi visiem diabēta veidiem, saistīta ar hiperglikēmiju: polidipsija, poliūrija, nieze, bet 1. tipa cukura diabēta gadījumā tie ir ļoti izteikti. Tātad visas dienas garumā pacienti var izdzert un izdalīt līdz 5-10 litriem šķidruma. Konkrēts 1. tipa cukura diabēta gadījumā simptoms, ko izraisa absolūts insulīna deficīts, ir svara zudums, kas 1-2 mēnešu laikā sasniedz 10-15 kg. Raksturīgs ar smagu vispārēju un muskuļu vājumu, samazinātu veiktspēju un miegainību. Slimības sākumā dažiem pacientiem var palielināties ēstgriba, kas, attīstoties ketoacidozei, dod vietu anoreksijai. Pēdējo raksturo acetona smaržas (vai augļu smaržas) parādīšanās no mutes, slikta dūša, vemšana, bieži sāpes vēderā (pseidoperitonīts), smaga dehidratācija un beidzas ar komas attīstību. Dažos gadījumos pirmā 1. tipa cukura diabēta izpausme bērniem ir progresējoši apziņas traucējumi līdz pat komai, ko izraisa vienlaicīgas slimības, parasti infekcijas vai akūta ķirurģiska patoloģija.
Retos gadījumos 1. tipa cukura diabēta attīstība cilvēkiem, kas vecāki par 35-40 gadiem (latents autoimūns diabēts pieaugušajiem) slimība var neizpausties tik skaidri (mērena polidipsija un poliūrija, bez ķermeņa masas samazināšanās) un var tikt atklāta pat nejauši, regulāri nosakot glikēmisko līmeni. Šādos gadījumos pacientam nereti vispirms tiek diagnosticēts 2. tipa cukura diabēts un tiek nozīmētas tabletes hipoglikemizējošās zāles, kas kādu laiku nodrošina pieņemamu cukura diabēta kompensāciju. Tomēr vairāku gadu laikā (bieži vien gada laikā) pacientam attīstās simptomi, ko izraisa pieaugošs absolūtais insulīna deficīts: svara zudums, nespēja uzturēt normālu glikēmiju uz tablešu glikozes līmeni pazeminošo zāļu fona, ketoze, ketoacidoze.
Diagnostika
Ņemot vērā, ka 1. tipa cukura diabētam ir skaidra klīniskā aina un tā ir arī salīdzinoši reta slimība, skrīninga glikēmijas līmeņa noteikšana 1. tipa cukura diabēta diagnosticēšanai nav indicēta. Slimības attīstības iespējamība pacientu tuviem radiniekiem ir zema, kas kopā ar efektīvu 1. tipa diabēta primārās profilakses metožu trūkumu nosaka slimības imunoģenētisko marķieru izpētes nepiemērotību tiem. 1. tipa cukura diabēta diagnoze vairumā gadījumu balstās uz nozīmīgas hiperglikēmijas noteikšanu pacientiem ar smagām absolūtā insulīna deficīta klīniskām izpausmēm. Mutes glikozes tolerances tests lai diagnosticētu 1. tipa cukura diabētu, ir nepieciešams veikt ļoti reti.
Diferenciāldiagnoze
Apšaubāmos gadījumos (mērenas hiperglikēmijas noteikšana, ja nav acīmredzamu klīnisku izpausmju, izpausme salīdzinoši vecā vecumā), kā arī diferenciāldiagnozes nolūkos ar citiem cukura diabēta veidiem, tiek izmantota līmeņa noteikšana. C-peptīds(pamata un 2 stundas pēc ēšanas). Netiešā diagnostiskā vērtība apšaubāmos gadījumos definīcijai var būt imunoloģiskie marķieri 1. tipa cukura diabēts – antivielas pret aizkuņģa dziedzera saliņām, glutamāta dekarboksilāzi (GAD65) un tirozīna fosfatāzi (IA-2 un IA-2P).
Ārstēšana jebkura veida cukura diabēts ir balstīts uz trim galvenajiem principiem: hipoglikēmiskā terapija (1. tipa cukura diabēta gadījumā - insulīnterapija), diēta un pacientu izglītošana. Insulīna terapija 1. tipa cukura diabēta gadījumā ir aizstājējs raksturs un tā mērķis ir pēc iespējas vairāk atdarināt fizioloģisko hormonu veidošanos, lai sasniegtu pieņemtos kompensācijas kritērijus. Intensīvā insulīna terapija ir vistuvākā fizioloģiskajai insulīna sekrēcijai. Nepieciešamība pēc insulīna, kas atbilst tās bazālā sekrēcija To nodrošina divas vidējas darbības insulīna injekcijas (no rīta un vakarā) vai viena ilgstošas darbības insulīna (glargīna) injekcija. Kopējā bazālā insulīna deva nedrīkst pārsniegt pusi no kopējās dienas nepieciešamības pēc zālēm.
Pārtikas vai bolus insulīna sekrēcija tiek aizstāts ar īslaicīgas vai īpaši īsas darbības insulīna injekcijām pirms katras ēdienreizes, un tā devu aprēķina, pamatojoties uz gaidāmās ēdienreizes laikā uzņemamo ogļhidrātu daudzumu un esošo glikēmijas līmeni, ko pacients nosaka, izmantojot glikometrs pirms katras insulīna injekcijas.
Pēc 1. tipa cukura diabēta izpausmes un insulīna terapijas uzsākšanas diezgan ilgu laiku nepieciešamība pēc insulīna var būt neliela un mazāka par 0,3-0,4 V/kg. Šo periodu sauc par remisijas fāzi vai "Medusmēnesis". Pēc hiperglikēmijas un ketoacidozes perioda, kas nomāc insulīna sekrēciju ar 10-15% atlikušajām beta šūnām, hormonālo vielmaiņas traucējumu kompensācija, ievadot insulīnu, atjauno šo šūnu darbību, kuras pēc tam pārņem organisma nodrošināšanu ar insulīnu minimālā daudzumā. līmenī. Šis periods var ilgt no vairākām nedēļām līdz vairākiem gadiem, bet galu galā atlikušo beta šūnu autoimūnās iznīcināšanas dēļ medusmēnesis beidzas.