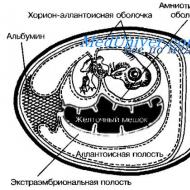
Olbaltumvielu metabolisma otrā posma pārkāpums - endogēno olbaltumvielu sintēzes un sadalīšanās procesi. Olbaltumvielu metabolisma traucējumi cilvēka organismā vai vegāna risks Proteīna sintēzes traucējumi mikrobiem
Olbaltumvielu metabolisma nozīmi organismam, pirmkārt, nosaka tas, ka visu tā audu elementu pamatu veido olbaltumvielas, kuras nepārtraukti tiek atjaunotas to galveno daļu asimilācijas un disimilācijas procesu dēļ. - aminoskābes un to kompleksi. Tāpēc olbaltumvielu metabolisma traucējumi dažādos variantos ir visu patoloģisko procesu patoģenēzes sastāvdaļas bez izņēmuma.
Olbaltumvielu loma cilvēka organismā:
· visu audu struktūra
augšana un atjaunošana (atveseļošanās) šūnās
· fermenti, gēni, antivielas un hormoni ir olbaltumvielu produkti
ietekme uz ūdens bilanci, izmantojot onkotisko spiedienu
· dalība skābju-bāzes līdzsvara regulēšanā
Vispārīgu priekšstatu par olbaltumvielu metabolisma traucējumiem var iegūt, pētot organisma un vides slāpekļa līdzsvaru.
1. Pozitīvs slāpekļa līdzsvars ir stāvoklis, kad no organisma izdalās mazāk slāpekļa nekā tiek uzņemts ar pārtiku. To novēro ķermeņa augšanas laikā, grūtniecības laikā, pēc badošanās, ar pārmērīgu anabolisko hormonu (GH, androgēnu) sekrēciju.
2. Negatīvs slāpekļa līdzsvars ir stāvoklis, kad no organisma izdalās vairāk slāpekļa nekā tiek uzņemts ar pārtiku. Attīstās ar badošanos, proteīnūriju, asiņošanu, pārmērīgu katabolisko hormonu (tiroksīna, glikokortikoīdu) sekrēciju.
Tipiski olbaltumvielu metabolisma traucējumi
1. Olbaltumvielu daudzuma un kvalitātes pārkāpumi, kas nonāk organismā
2. Proteīnu uzsūkšanās un sintēzes traucējumi
3. Intersticiālas aminoskābju metabolisma pārkāpums
4. Asins olbaltumvielu sastāva pārkāpums
5. Olbaltumvielu metabolisma beigu posmu pārkāpums
1. Olbaltumvielu daudzuma un kvalitātes pārkāpumi, kas nonāk organismā
A) Viens no biežākajiem olbaltumvielu metabolisma traucējumu cēloņiem ir kvantitatīvi vai augstas kvalitātes olbaltumvielu deficīts. Tas ir saistīts ar ierobežoto eksogēno olbaltumvielu piegādi badošanās laikā, zemo pārtikas olbaltumvielu bioloģisko vērtību un neaizvietojamo aminoskābju trūkumu.
Olbaltumvielu deficīta izpausmes:
negatīvs slāpekļa bilance
ķermeņa augšanas un attīstības palēnināšanās
audu reģenerācijas procesu nepietiekamība
svara zudums
Samazināta apetīte un olbaltumvielu uzsūkšanās
Olbaltumvielu deficīta galējās izpausmes ir kwashiorkor un uztura marasms.
Uztura marasms ir patoloģisks stāvoklis, kas rodas ilgstošas pilnīgas badošanās rezultātā un kam raksturīgs vispārējs izsīkums, vielmaiņas traucējumi, muskuļu atrofija un vairuma orgānu un sistēmu disfunkcija.
Kwashiorkor ir slimība, kas skar mazus bērnus, un to izraisa kvalitatīvs un kvantitatīvs proteīna deficīts vispārēja kaloriju pārpalikuma klātbūtnē.
b)Pārmērīga olbaltumvielu uzņemšana izraisa šādas izmaiņas organismā:
pozitīvs slāpekļa līdzsvars
dispepsija
· disbakterioze
zarnu autoinfekcija, autointoksikācija
nepatika pret olbaltumvielu pārtiku
2. Proteīnu uzsūkšanās un sintēzes traucējumi
· proteīnu sadalīšanās traucējumi kuņģī (gastrīts ar samazinātu sekrēcijas aktivitāti un zemu skābumu, kuņģa rezekcijas, kuņģa audzēji). Olbaltumvielas ir svešas antigēnas informācijas nesēji, un tie ir jāsadala gremošanas procesā, zaudējot savu antigenitāti, pretējā gadījumā to nepilnīga sadalīšanās izraisīs pārtikas alerģiju.
· malabsorbcija zarnās (akūts un hronisks pankreatīts, aizkuņģa dziedzera audzēji, duodenīts, enterīts, tievās zarnas rezekcija)
regulējošo un strukturālo gēnu patoloģiskas mutācijas
Olbaltumvielu sintēzes disregulācija (anabolisko un katabolisko hormonu attiecības maiņa)
3. Intersticiālas aminoskābju metabolisma pārkāpums
1. Traucēta transaminācija (aminoskābju veidošanās)
· piridoksīna deficīts (vitamīns B6)
· badošanās
aknu slimības
2. Traucēta deaminācija (aminoskābju iznīcināšana) izraisa hiperaminoacidēmija ® aminoaciduria ® izmaiņas atsevišķu aminoskābju attiecībās asinīs ® traucēta proteīnu sintēze.
piridoksīna, riboflavīna (B 2), nikotīnskābes trūkums
hipoksija
· badošanās
3. Pavājināta dekarboksilēšana (notiek ar CO 2 un biogēno amīnu veidošanos) izraisa liela daudzuma biogēno amīnu parādīšanos audos un lokālās asinsrites traucējumus, asinsvadu caurlaidības palielināšanos un nervu sistēmas bojājumus.
hipoksija
išēmija un audu iznīcināšana
4. Asins olbaltumvielu sastāva pārkāpums
Hiperproteinēmija - plazmas proteīna palielināšanās > 80 g/l
Hiperproteinēmijas sekas: paaugstināta asins viskozitāte, to reoloģisko īpašību izmaiņas un traucēta mikrocirkulācija.
Hipoproteinēmija- olbaltumvielu līmeņa pazemināšanās asins plazmā< 60 г/л
· badošanās
Traucēta gremošana un olbaltumvielu uzsūkšanās
Proteīna sintēzes traucējumi (aknu bojājumi)
olbaltumvielu zudums (asins zudums, nieru bojājumi, apdegumi, iekaisums)
pastiprināta olbaltumvielu sadalīšanās (drudzis, audzēji, kataboliskie hormoni)
Hipoproteinēmijas sekas:
· ¯ organisma pretestība un reaktivitāte
· visu organisma sistēmu funkciju traucējumi, jo tiek traucēta fermentu, hormonu u.c. sintēze.
5. Olbaltumvielu metabolisma beigu posmu pārkāpums. Olbaltumvielu metabolisma beigu posmu patofizioloģija ietver slāpekļa produktu veidošanās un izvadīšanas no organisma procesu patoloģiju. Atlikušais asins slāpeklis ir neolbaltumvielu slāpeklis, kas paliek pēc olbaltumvielu nogulsnēšanās.
Parasti 20-30 mg% sastāvs:
· urīnviela 50%
aminoskābes 25%
· citi slāpekli saturoši produkti 25%
Hiperazotēmija - atlikuma slāpekļa līmeņa paaugstināšanās asinīs
![]()
Atlikušā slāpekļa uzkrāšanās asinīs izraisa visa ķermeņa, galvenokārt centrālās nervu sistēmas, intoksikāciju un komas attīstību.
Olbaltumvielu sintēzē uz mikroorganismu ribosomām, kas sastāv no 30S un 50S apakšvienībām (cilvēkiem - 60S un 40S apakšvienības; sedimentācijas vienības), izšķir šādus posmus:
1) iniciācija– aminoskābju pievienošana mRNS, izmantojot tRNS (tRNS antikodona triplets mijiedarbojas ar mRNS kodonu);
2) pagarinājums– tRNS pievienošana ar jaunu aminoskābi mRNS kodonam ribosomas A (acil) vietā;
3) transpeptidācija– jau izveidotā peptīda piesaiste no vietas P (peptidil) jaunai aminoskābei ribosomas vietā A;
4) pārvietošana– pateicoties ribosomas kustībai pa mRNS, iegūtais peptīds pārvietojas no vietas A uz vietu P; tRNS ir atdalīta (83. att.).
Rīsi. 83. Proteīnu sintēzes galvenie posmi uz ribosomām.
Antibiotikas, kas traucē olbaltumvielu sintēzi, ir aminoglikozīdi, tetraciklīni, hloramfenikols, makrolīdi un linkozamīdi.
Aminoglikozīdi traucēt pareizu jaunas aminoskābes pievienošanu.
Tetraciklīni neļautu tRNS antikodonam pievienoties mRNS kodonam.
Hloramfenikols traucē transpeptidāciju.
Makrolīdi Un linkozamīdi ietekmē translokācijas procesus un var konkurēt savā starpā (tajā pašā laikā tiek vājināta to antibakteriālā iedarbība).
Aminoglikozīdi
Aminoglikozīdi ir plaša spektra antibiotikas. Tie iedarbojas uz gramnegatīvām un dažām grampozitīvām baktērijām. Neiedarbiniet pret meticilīnu rezistentiem stafilokokiem.
Aminoglikozīdi slikti iekļūst caur baktēriju šūnu sienas porīniem. Antibiotikas (jo īpaši penicilīni), kas izjauc šūnu sienas integritāti, atvieglo aminoglikozīdu iekļūšanu baktēriju šūnā.
Aminoglikozīdi iekļūst baktēriju citoplazmas membrānā ar skābekļa atkarīgu aktīvo transportu (tāpēc tie ir neefektīvi pret anaerobām baktērijām).
Iekļūstot baktēriju šūnas citoplazmā, aminoglikozīdi iedarbojas uz 30. ribosomu apakšvienību. Tie izjauc proteīnu sintēzes sākotnējos posmus baktēriju ribosomās. Aminoglikozīdi traucē pareizu mRNS nolasīšanu. Rezultātā vietā A tiek pievienotas citas aminoskābes (83. att.) un veidojas “nepareizi” (nefunkcionāli) proteīni, kas kaitīgi iedarbojas uz citoplazmas membrānu.
Lielākas devās aminoglikozīdi traucē polisomu veidošanos. Aminoglikozīdu ietekmē polisomas tiek sadalītas atsevišķās ribosomās (monosomās), kuras nespēj pārvietoties pa mRNS.
Tādējādi aminoglikozīdu darbība traucē:
1) citoplazmas membrānas caurlaidība;
2) baktēriju proteīnu sintēze.
Aminoglikozīdu darbība ir baktericīda.
Aminoglikozīdi ir ļoti polāri savienojumi (polikationi). Tie praktiski neuzsūcas no kuņģa-zarnu trakta, tāpēc tos ievada intramuskulāri vai intravenozi. Neiekļūt asins-smadzeņu barjerā. Iekļūst acs stiklveida ķermenī. Iekļūst caur placentu. Augstās koncentrācijās tie tiek noteikti dziedzeru sekrēcijās, pleiras šķidrumā un locītavās.
Aminoglikozīdi organismā tiek slikti metabolizēti; 50–60% izdalās nemainītā veidā caur nierēm. Tas veicina aminoglikozīdu efektivitāti nieru un urīnceļu infekcijas slimību gadījumā. Tajā pašā laikā ar nieru mazspēju palielinās aminoglikozīdu toksiskā iedarbība (ototoksicitāte, nefrotoksicitāte).
Aminoglikozīdus galvenokārt lieto smagu infekciju gadījumā, ko izraisa pret aminoglikozīdiem jutīgi mikroorganismi (sepse, peritonīts, urīnceļu infekcijas, pneimonija, brūču un apdegumu infekcijas).
Izšķir šādas aminoglikozīdu paaudzes:
I paaudze- streptomicīns, kanamicīns, neomicīns;
II paaudze– gentamicīns, tobramicīns;
III paaudze- amikacīns, netilmicīns.
Streptomicīns(Streptomicīns) ir pirmā no atklātajām antibiotikām, kas ir efektīvas pret Mycobacterium tuberculosis. Par streptomicīna atklāšanu S. A. Vaksmans (ASV) 1952. gadā saņēma Nobela prēmiju. Viņš arī radīja terminu "antibiotika".
Streptomicīns arī izrādījās ļoti efektīvs līdzeklis mēra, tularēmijas un brucelozes ārstēšanai. Efektīva pret kokiem (pneimokoki ir salīdzinoši izturīgi), Haemophilus influenzae, Klebsiella, Shigella, Salmonella. Anaerobi, spirohetas, riketsijas un Pseudomonas aeruginosa ir rezistenti pret streptomicīnu. Streptomicīnu lieto tuberkulozes, tularēmijas, mēra (kopā ar doksiciklīnu), brucelozes, kā arī pneimonijas un hronisku komplicētu urīnceļu infekciju gadījumā. Ievadīts intramuskulāri vai intravenozi.
Kanamicīns(Kanamicīnu) lieto, ja Mycobacterium tuberculosis ir rezistenta pret streptomicīnu.
Neomicīns(Neomicīns) augstākas toksicitātes dēļ tiek lietots tikai lokāli. Zāles neuzsūcas, ja tās tiek ievadītas enterāli, un tās var lietot perorāli enterīta gadījumā, kā arī zarnu mikrobu floras nomākšanai pirms operācijas.
No II paaudzes aminoglikozīdi visbiežāk lietotais ir gentamicīns.
Gentamicīns(Gentamicīns) ir efektīvs pret stafilokokiem, enterokokiem, Escherichia coli, Shigella, Salmonella, Klebsiella, Proteus, tularemia bacilli, Brucella. Atšķirībā no pirmās paaudzes zālēm gentamicīns un citas otrās paaudzes zāles iedarbojas uz Pseudomonas aeruginosa. Anaerobās baktērijas, meningokoki, Treponema pallidum, mikoplazmas, hlamīdijas, legionellas ir izturīgas pret gentamicīnu. Gentamicīns ir neefektīvs pret tuberkulozi. Gentamicīnu ievada intramuskulāri vai intravenozi (lēni vai pilienu veidā; t 1/2 gentamicīna – 2-3 stundas); 50–60% neizmainītā gentamicīna izdalās caur nierēm.
Gentamicīnu lieto pneimonijai, plaušu abscesam, sepsi, peritonītu, enterokoku izraisītu endokardītu (kopā ar benzilpenicilīnu), akūtu holecistītu un holangītu, akūtu un hronisku pielonefrītu, cistītu, prostatītu, strutojošu ādas infekciju, mīksto audu, kaulu audu (mīksto audu) infekciju. , locītavu, brūču un apdegumu infekcijām, ko izraisa pret gentamicīnu jutīgi mikroorganismi.
Gentamicīnu ārīgi lieto piodermijai, inficētām brūcēm, kā arī oftalmoloģiskajā praksē pie blefarīta, konjunktivīta acu pilienu veidā (1 piliens 4-6 reizes dienā).
Gentamicīna blakusparādības:
- dzirdes zaudēšana;
- vestibulārie traucējumi;
- slikta dūša, vemšana;
- aknu darbības traucējumi;
- proteīnūrija, muskuļu vājums;
- leikopēnija;
- ādas izsitumi.
Gentamicīns ir kontrindicēts myasthenia gravis gadījumā.
Tobramicīns(Tobramicīns) pēc īpašībām un lietošanas veida ir līdzīgs gentamicīnam. Efektīvāks pret Pseudomonas aeruginosa. Zāļu veidā Tobrex lieto kā acu pilienus blefarīta, konjunktivīta, keratokonjunktivīta un iridociklīta ārstēšanai.
Trešās paaudzes aminoglikozīdi– amikacīns, netilmicīns – darbības spektrā līdzīgs gentamicīnam un tobramicīnam. Efektīva pret pirmās un otrās paaudzes baktērijām, kas ir rezistentas pret aminoglikozīdiem.
Amikacīns(Amikacin) – aminoglikozīds ar visplašāko darbības spektru; lieto, ja gentamicīns ir neefektīvs. Efektīva pret Mycobacterium tuberculosis.
Tas uzkrājas starpšūnu šķidrumā un izdalās caur nierēm ar augstu koncentrāciju urīnā. Amikacīnu lieto pneimonijas, plaušu abscesa, endokardīta, nieru un urīnceļu infekciju, osteomielīta, apdegumu infekciju un tuberkulozes kompleksajā ārstēšanā. Ievadīts intramuskulāri vai intravenozi.
Netilmicīns(Netilmicīns) pēc īpašībām ir līdzīgs amikacīnam.
Citi medicīnas praksē izmantotie aminoglikozīdi ir sizomicīns, paromomicīns un framicetīns.
Sizomicīns(Sizomicīnu) ievada intramuskulāri vai intravenozi žults un urīnceļu infekcijām, pneimoniju, meningītu, peritonītu, sepsi, infekciozo artrītu, osteomielītu.
Paromomicīns(Paromomicīns) slikti uzsūcas no kuņģa-zarnu trakta. Izrakstīts iekšķīgi pie gastroenterīta, enterokolīta, salmonelozes, šigelozes, amēbiozes, giardiozes, kā arī gatavojoties zarnu operācijām.
Framicetīns(Framicetīns) ir zāles vietējai lietošanai. Deguna aerosola veidā to lieto rinīta, nazofaringīta un sinusīta gadījumā.
Aminoglikozīdu blakusparādības:
1) nefrotoksiska iedarbība(nieru kanāliņu bojājums) ar ilgstošu lietošanu (gentamicīns > tobramicīns > amikacīns = streptomicīns, netilmicīns);
2) ototoksiska iedarbība(neatgriezenisks gliemežnīcas un vestibulārā aparāta jutīgo šūnu bojājums):
- dzirdes traucējumi visbiežāk izraisa amikacīns, netilmicīns, tobramicīns;
- vestibulārie traucējumi(reibonis, ataksija, līdzsvara traucējumi) visbiežāk izraisa amikacīns, streptomicīns, gentamicīns; aminoglikozīdu ototoksiskā iedarbība ievērojami pastiprinās, ja tos kombinē ar cilpas diurētiskiem līdzekļiem (furosemīdu utt.), kuriem piemīt arī ototoksiskas īpašības;
- neiromuskulārās transmisijas traucējumi(novērst Ca 2+ jonu iekļūšanu motoro nervu šķiedru galos presinaptiskās membrānas depolarizācijas laikā); var pastiprināt kūrei līdzīgu zāļu iedarbību;
- alerģiskas reakcijas.
Aminoglikozīdi ir kontrindicēti myasthenia gravis gadījumā.
Aminociklīti
Spektinomicīns(Spectinomicīns; trobicīns) ir plaša spektra antibiotika. Pēc ķīmiskās struktūras tas ir līdzīgs aminoglikozīdiem, taču atšķiras no tiem darbības mehānismā. Tas izjauc proteīnu sintēzi translokācijas stadijā, neietekmējot (atšķirībā no aminoglikozīdiem) pareizu mRNS kodona nolasīšanu. Darbojas bakteriostatiski. Īpaši efektīvs (baktericīds) pret Neisseria gonorrhoeae. Gandrīz pilnībā (90%) nemainītā veidā izdalās caur nierēm.
Spektinomicīnu lieto tikai uroģenitālās gonorejas ārstēšanai vīriešiem un sievietēm. Nekomplicētu gonoreju (akūtu uretrītu, proktītu, cervicītu) var izārstēt ar vienu intramuskulāru spektinomicīna injekciju.
Streptogramīns
Kvinupristīns(Kvinupristīns) un dalfopristīns(Dalfopristīns) traucē proteīnu sintēzi, iedarbojoties uz 50S ribosomu apakšvienību un inhibējot peptidiltransferāzi. Atsevišķi šīs zāles ir neefektīvas, taču, lietojot kopā, tās ir baktericīdas pret grampozitīvām baktērijām, jo īpaši pret meticilīnu rezistentiem stafilokokiem, pret vankomicīnu rezistentiem enterokokiem, streptokokiem un stafilokokiem. Dalfopristīns maina ribosomu struktūru, palielinot hinupristīna saistīšanos ar ribosomām.
Šo savienojumu kombinēto preparātu ievada intravenozi pret vankomicīnu rezistentu enterokoku un stafilokoku izraisītām infekcijām. Zāles ir efektīvas pret infekcijām, ko izraisa Haemophilus influenzae, Moraxella, Mycoplasma, Legionella un Chlamydia. Neietekmē Pseudomonas aeruginosa.
Blakus efekti:
- flebīts;
- artralģija;
- mialģija.
Tetraciklīni
Tetraciklīni (satur 4 kondensētus gredzenus ķīmiskajā struktūrā) ir plaša spektra antibiotikas. Tie traucē olbaltumvielu sintēzi baktēriju ribosomās. Iedarbojas uz 30S ribosomu apakšvienību; novērstu pārneses RNS (tRNS) savienošanos vietā A ar nākamo aminoskābi, tādējādi izjaucot pagarināšanas procesu. Tetraciklīnu darbība ir bakteriostatiska.
Tetraciklīni labi iekļūst šūnās un iedarbojas uz intracelulāriem mikroorganismiem - hlamīdijām, legionellām, mikoplazmām, riketsiju.
Tetraciklīni (visbiežāk doksiciklīns) ir izvēles zāles riketsiozei (tīfs u.c.), brucelozei (kopā ar gentamicīnu vai rifampicīnu), holērai, mēri, plaušu un uroģenitālās sistēmas hlamīdijām, mikoplazmas vai ureaplazmas izraisītām infekcijām, Laima slimību. slimība (ērču borelioze).
Tetraciklīni ir rezerves zāles sifilisa, gonorejas, Sibīrijas mēra, jersiniozes, šigelozes un amebiāzes ārstēšanai.
Efektīva pret koku, Haemophilus influenzae, Klebsiella, Legionella, Escherichia coli, H. pylori, Salmonella, tularēmijas patogēniem un Plasmodium malāriju.
Tie neiedarbojas uz Pseudomonas aeruginosa, Bacteroides, Proteus, pret meticilīnu rezistentiem stafilokokiem.
Tetraciklīni uzsūcas, ja tos lieto iekšķīgi (tetraciklīns 60%, doksiciklīns gandrīz pilnībā). Piens, antacīdi un dzelzs piedevas var aizkavēt tetraciklīnu uzsūkšanos, jo tetraciklīni veido helātus ar Ca 2+, Mg 2+, Al 3+, Fe 2+ joniem.
Tā kā veidojas helātu savienojumi ar Ca 2+ joniem, tetraciklīni nogulsnējas kaulaudos, kā arī zobu audos un var traucēt to attīstību. Tetraciklīnus nedrīkst parakstīt bērniem līdz 8 gadu vecumam, grūtniecēm un sievietēm zīdīšanas periodā.
Doksiciklīns(Doksiciklīns; vibramicīns) tiek parakstīts iekšķīgi riketsiozei (vēdertīfs u.c.), hlamīdiju izraisītām infekcijām (trahoma, psitakoze, uroģenitālā hlamīdija), bruceloze, mēris, holēra, ērču borelioze (Laima slimība), elpceļu infekcijas ( pneimonija, paasinājums hronisks bronhīts), kuņģa-zarnu trakta, uroģenitālās sistēmas, kā arī pret Sibīrijas mēri, malāriju kā rezerves zāles pret sifilisu.
Gandrīz pilnībā uzsūcas zarnās (apmēram 90%). Darbības ilgums – 12 stundas (izrakstīts 2 reizes dienā). Izdalās caur nierēm neaktīvu metabolītu veidā. Zāles tiek ievadītas arī intravenozi.
Doksiciklīna blakusparādības:
- dispepsijas traucējumi;
- galvassāpes;
– redzes traucējumi;
- hepatotoksiska iedarbība;
- ādas fotosensitivitāte;
- zarnu kandidoze;
- iespējams pseidomembranozais kolīts.
Tetraciklīns(Tetraciklīns) tiek nozīmēts iekšķīgi tādām pašām indikācijām kā citi tetraciklīni. Darbības ilgums – 6 stundas (paredzēts 4 reizes dienā). Lokāli konjunktivīta un blefarīta gadījumā lieto tetraciklīna acu ziedi (liek aiz plakstiņa 2-3 reizes dienā).
Oksitetraciklīns(Oksitetraciklīns) tiek nozīmēts iekšķīgi vai intramuskulāri pneimonijas, bronhīta, tonsilīta, holecistīta, pielonefrīta, zarnu infekciju, endometrīta, prostatīta, kā arī riketsiozes, sifilisa, gonorejas, brucelozes gadījumā. Oksitetraciklīnu lokāli lieto ziedes veidā konjunktivīta, blefarīta un trahomas ārstēšanai.
Tetraciklīnu blakusparādības:
Slikta dūša, vemšana, glosīts;
Mutes dobuma, zarnu, maksts kandidoze (saistīta ar normālas mikrofloras nomākšanu);
Aknu disfunkcija;
Izsitumi uz ādas, fotosensitivitāte, alerģiskas reakcijas;
Iespējami tīklenes un kaulu smadzeņu darbības traucējumi (anēmija, neitropēnija).
Tetraciklīni nogulsnējas kaulaudos, tāpēc agrīnā vecumā iespējami kaulu audu un zobu attīstības traucējumi; Tetraciklīnus nav ieteicams lietot bērniem līdz 8 gadu vecumam, grūtniecēm un sievietēm zīdīšanas laikā. Ilgstoši lietojot tetraciklīnus, ir iespējama makrofāgu aktivitātes kavēšana un imunitātes samazināšanās.
Tetraciklīni, izjaucot baktēriju proteīnu sintēzi, palēnina to augšanu un tāpēc var vājināt penicilīnu iedarbību, kam ir baktericīda iedarbība uz augošajām baktērijām.
Hloramfenikols
Hloramfenikols(hloramfenikols; hloramfenikols) ir plaša spektra antibiotika. Traucē olbaltumvielu sintēzi baktēriju ribosomās. Iedarbojas uz 50S ribosomu apakšvienību; inhibē peptidiltransferāzi un tādējādi novērš transpeptidāciju – peptīdu ķēdes pārnešanu no vietas P uz vietu A, lai pievienotos jaunai aminoskābei (83. att.). Tam ir bakteriostatiska iedarbība uz jutīgākajiem mikroorganismiem.
Ļoti efektīvs (baktericīds) pret meningokokiem, Haemophilus influenzae (arī pret citām antibiotikām rezistentus). Efektīva pret šigelām, salmonellām, riketsijām, brucellām, klostrīdijām, hlamīdijām, mikoplazmām, streptokokiem, stafilokokiem, kas neražo penicilināzi. Darbojas uz V. fragilis, Proteus.
Pseudomonas aeruginosa, Mycobacterium tuberculosis un stafilokoki, kas ražo penicilināzi, ir rezistenti pret hloramfenikolu.
Hloramfenikols tiek parakstīts iekšķīgi (zāles gandrīz pilnībā uzsūcas zarnās); maksimālais efekts pēc 2 stundām; t 1/2-2 tējk.
Smagos gadījumos hloramfenikolu ievada intravenozi. hloramfenikols iekļūst asins-smadzeņu barjerā; zāļu koncentrācija cerebrospinālajā šķidrumā ir aptuveni 60% no koncentrācijas asins plazmā. Aknās hloramfenikols glikuroniltransferāzes ietekmē glikuronizējas. Apmēram 10% nemainītā hloramfenikola tiek izvadīti ar urīnu.
Hloramfenikolu lieto meningīta gadījumā, ja nav iespējams lietot penicilīnus, Haemophilus influenzae izraisītām infekcijām (ja nevar lietot trešās paaudzes cefalosporīnus). Pirms fluorhinolonu parādīšanās hloramfenikols bija izvēles zāles vēdertīfa ārstēšanai. Pašlaik hloramfenikols ir rezerves zāles pret vēdertīfu un paratīfu, bacilāru dizentēriju, tīfu un citām riketsiozēm, holēru, mēri, brucelozi, tularēmiju un hlamīdijām.
Acu pilienu veidā levomicetīna šķīdumu lieto konjunktivīta, blefarīta gadījumā (1 piliens 4-6 reizes dienā).
Hloramfenikola lietošanu ierobežo tā inhibējošā iedarbība uz asinsradi kaulu smadzenēs (iespējama leikopēnija, agranulocitoze, aplastiskā anēmija). Citas blakusparādības:
Superinfekcijas (orofaringeālā kandidoze, stafilokoku enterokolīts);
Stomatīts, glossīts;
Optiskais neirīts, encefalopātija.
Hloramfenikols ir kontrindicēts jaundzimušajiem, jo šajā vecumā hloramfenikola glikuronizācijas sistēma ir nepietiekama; var izraisīt tajos "pelēko sindromu" - cianozi, neregulāru elpošanu, asinsvadu kolapsu, vemšanu, caureju (irdeni zaļi izkārnījumi), vēdera uzpūšanos, hipotermiju, pelni pelēku ādas krāsu; mirstība – 40%.
Hloramfenikols inhibē mikrosomālo aknu enzīmu sintēzi un tādējādi var pastiprināt un paildzināt šo enzīmu inaktivēto zāļu iedarbību. Tādējādi hloramfenikols palielina varfarīna un fenitoīna pusperiodu.
Hloramfenikols, izjaucot baktēriju proteīnu sintēzi, palēnina to augšanu un tāpēc var vājināt penicilīnu iedarbību, kam ir baktericīda iedarbība uz augošajām baktērijām.
Makrolīdi
Makrolīdi ir makrocikliski savienojumi. 14 locekļu makrolīdi ietver eritromicīnu un klaritromicīnu, 15 locekļu makrolīdi ietver azitromicīnu (klasificēti kā azalīdus), un 16 locekļu makrolīdi ietver josamicīnu un spiramicīnu.
Makrolīdi iedarbojas uz ribosomu 50S apakšvienību un izjauc translokāciju – proteīnu sintēzes beigu stadiju uz baktēriju ribosomām (veidotā peptīda pārvietošanās no vietas A uz vietu P sakarā ar ribosomas kustību pa mRNS – 83. att.). Var konkurēt ar linkozamīdiem par saistīšanos ar ribosomām; šajā gadījumā antibiotiku iedarbība ir savstarpēji vājināta. Tādēļ makrolīdu lietošana kombinācijā ar linkozamīdiem nav ieteicama.
Makrolīdi iedarbojas bakteriostatiski uz jutīgākajiem mikroorganismiem un baktericīdi uz dažiem. Tie labi iekļūst ķermeņa šūnās, kas inficētas ar baktērijām. Makrolīdu koncentrācija šūnās ievērojami pārsniedz to koncentrāciju asins plazmā.
Makrolīdi ir efektīvi pret vairākiem intracelulāriem patogēniem (hlamīdijām, mikoplazmām, ureaplazmām, legionellām). Tie iedarbojas uz koku, Haemophilus influenzae, difterijas un Sibīrijas mēra nūjiņām, Borrelia, Treponema pallidum, H. pylori.
Makrolīdi neiekļūst asins-smadzeņu barjerā sinoviālajā šķidrumā.
Pret makrolīdiem rezistenti ir Escherichia coli, Shigella, Salmonella, Pseudomonas aeruginosa, Klebsiella, mēra, tularēmijas, B. fragilis un meticilīna rezistenti stafilokoki.
Makrolīdus lieto LOR orgānu infekcijām, hlamīdiju, mikoplazmas, legionellu izraisītām pneimonijām, urīnceļu, ādas un mīksto audu infekcijām.
Roksitromicīnu un klaritromicīnu izraksta kuņģa un divpadsmitpirkstu zarnas čūlas gadījumā, lai izskaustu H. pylori.
Azitromicīns ir ļoti efektīvs pret urīnizvadkanāla hlamīdijām.
Eritromicīns(eritromicīnam) ir baktericīda iedarbība pret streptokokiem, pneimokokiem, bakteriostatiska pret stafilokokiem, gonokokiem, meningokokiem, Haemophilus influenzae, hlamīdijām, mikoplazmām, legionellām, treponēmu pallidum. Escherichia coli, Shigella, Salmonella un Pseudomonas aeruginosa ir izturīgas pret eritromicīnu.
Iekšķīgi lietojot, zāles uzsūcas, bet zāļu biopieejamība ir zema (35%). Izkliedēts audos (izņemot centrālo nervu sistēmu); iekļūst prostatas dziedzerī un caur placentu. Tāpat kā citi makrolīdi, eritromicīns labi iekļūst audu šūnās; Zāļu koncentrācija šūnās ir aptuveni 13 reizes lielāka nekā tā koncentrācija asins plazmā. Koncentrējas aknās, izdalās galvenokārt ar žulti. Puses eliminācijas periods ( t 1/2) – 90 min. Darbības ilgums – 6 stundas.
Eritromicīns ir izvēles zāles elpceļu infekcijām, ko izraisa intracelulāri patogēni (hlamīdijas, mikoplazmas, legionellas), pneimokoki, streptokoki un uroģenitālās trakta infekcijas (prostatīts, epididimīts, cervicīts, uretrīts), ko izraisa hlamīdijas, ureaplazma. Eritromicīnu lieto pret pneimoniju, LOR infekcijām, leģionāru slimību, trahomu, garo klepu, difteriju; kā rezerves zāles - pret skarlatīnu, brucelozi, gonoreju, sifilisu.
Eritromicīnu ordinē iekšķīgi 4 reizes dienā. Lieto kā acu ziedi pie konjunktivīta un blefarīta (liek aiz plakstiņa 2 reizes dienā). Ir iespējama eritromicīna intramuskulāra ievadīšana.
Eritromicīna blakusparādības:
- epigastriskais distress;
- slikta dūša, vemšana, caureja;
- pārejošs dzirdes zudums;
- holestātiska dzelte;
- oportūnistiskas zarnu infekcijas.
Klaritromicīns(Klaritromicīns; Klacid) – 6-metoksieritromicīns. Salīdzinot ar eritromicīnu, tas ir efektīvāks pret Haemophilus influenzae. Rada augstāku intracelulāro koncentrāciju un ir efektīvāka pret hlamīdijām, legionellu, moraksellu, mikoplazmu, kā arī pret Laima slimības izraisītāju (Borrelia burgdorferi). Iedarbojas uz pneimokokiem, streptokokiem, gonokokiem, Haemophilus influenzae, Moraxella, H. pylori. Labi iekļūst makrofāgos un neitrofilos. Izdalās ar urīnu (40%) metabolītu veidā.
Izrakstīt klaritromicīnu iekšķīgi vai intravenozi 2 reizes dienā ( t 1/2 – 4–5 stundas) augšējo un apakšējo elpceļu infekcijām, kā arī ādas un mīksto audu infekcijām.
Klaritromicīna blakusparādības:
- slikta dūša;
- caureja;
– no devas atkarīgs kurlums.
Roksitromicīns(Roksitromicīns; Rulid) tiek izrakstīts iekšķīgi 1-2 reizes dienā tonsilīta, faringīta, sinusīta, vidusauss iekaisuma, mutes dobuma infekciju, bronhīta, pneimonijas, hlamīdiju izraisītu uroģenitālās sistēmas infekciju, ureaplazmas, ādas infekciju (erysipelas, furunkuls, piodermija) gadījumos, kā arī pret difteriju, garo klepu. Uroģenitālās hlamīdijas 100% gadījumu tiek izārstētas ar roksitromicīnu. Roksitromicīna koncentrācija neitrofilos un makrofāgos ir attiecīgi 34 un 16 reizes augstāka nekā plazmā.
Azitromicīns(Azitromicīns; sumamed) – azalīds (nitro- (azo-) grupas iekļaušana makrolīdu ciklā). Salīdzinot ar eritromicīnu, tas ir mazāk efektīvs pret stafilokokiem, bet tam ir plašāks pretmikrobu iedarbības spektrs. Efektīvāks pret Haemophilus influenzae un Legionella. Ļoti efektīvs pret toksoplazmu. Efektīva pret pneimokokiem, gonokokiem, Moraxella, hlamīdijām, mikoplazmām, ureaplazmām, Treponema pallidum, H. pylori, garā klepus patogēniem (Bordetella pertussis), gāzes gangrēnu, Laima slimību (Borrelia burgdoferi). Azitromicīna koncentrācija fagocītos ir 40 reizes lielāka nekā tā koncentrācija asinīs. Azitromicīns aktīvā formā izdalās ar žulti.
Azitromicīnu ordinē iekšķīgi vienu reizi dienā ( t 1/2 – 48 stundas) augšējo elpceļu infekcijām un LOR infekcijām (tonsilīts, tonsilīts, sinusīts, vidusauss iekaisums), apakšējo elpceļu infekcijām (bronhīts, pneimonija), ko izraisa pneimokoki, Haemophilus influenzae, hlamīdijas, mikoplazmas, skarlatīns, Laima slimība, hlamīdiju izraisīts uretrīts, mikoplazma, ureaplazma, cervicīts, gonoreja, ādas un mīksto audu infekcijas, H. pylori izskaušanai.
Azitromicīna blakusparādības:
- slikta dūša;
- caureja;
– no devas atkarīgs kurlums.
Azitromicīns ir kontrindicēts grūtniecības, laktācijas laikā, bērniem līdz 12 gadu vecumam un smagiem aknu un nieru darbības traucējumiem.
Midekamicīns(Midekamicīns; macropen) tiek izrakstīts iekšķīgi pret elpceļu un uroģenitālās trakta infekcijām, ko izraisa intracelulāri patogēni (hlamīdijas, moraksellas, mikoplazmas, ureaplazmas, legionellas), kā arī streptokoku, stafilokoku izraisītām infekcijām, difterijas un garā klepus ārstēšanai un profilaksei. kuņģa-zarnu trakta infekcijām, ko izraisa Campylobacter spp. Zāles ir efektīvas pret H. pylori.
Spiramicīns(Spiramicīns; rovamicīns) atgriezeniski saistās ar 50S ribosomu apakšvienību un izjauc proteīnu sintēzi. Ir bakteriostatiska iedarbība. Spiramicīns tiek ordinēts iekšķīgi vai intravenozi pneimonijai, ko izraisa hlamīdijas, legionellas, mikoplazma, hroniska bronhīta paasinājumi, LOR orgānu slimības (tonsilīts, sinusīts, otitis), uroģenitālās sistēmas infekcijas (tostarp hlamīdijas), infekciozais artrīts, osteomielīts, āda infekcijas un mīkstie audi. Josamicīns (vilprafēns) tiek parakstīts iekšķīgi. Efektīva pret Chlamidia trachomatis, Chlamidia pneumoniae, Mycoplasma pneumoniae, Ureaplasma urealyticum, Legionella pneumophila, Treponema pallidum, kā arī pret streptokokiem, pneimokokiem, stafilokokiem, gonokokiem, meningokokiem, gāzveida cabacillus difterijas izraisītājiem. Īpaši lielā koncentrācijā tas tiek noteikts plaušu audos.
Josamicīnu lieto elpceļu un LOR orgānu infekcijām (faringīts, tonsilīts, laringīts, sinusīts, vidusauss iekaisums), difterijai (papildus ārstēšanai ar difterijas toksoīdu), uroģenitālās sistēmas hlamīdiju, ureaplazmas infekcijām, kā arī par sifilisu gadījumos, kad nav iespējams lietot zāles benzilpenicilīnam.
Linkozamīdi
Linkozamīdi pēc darbības mehānisma ir līdzīgi makrolīdiem. Tie iedarbojas uz hromosomu 50S apakšvienību un izjauc translokācijas procesu. Tie galvenokārt iedarbojas uz grampozitīviem mikroorganismiem, galvenokārt bakteriostatiski. Efektīva pret aerobām grampozitīvām baktērijām - stafilokokiem (arī tiem, kas ražo penicilināzi), streptokokiem, pneimokokiem, kā arī pret klostrīdijām, mikoplazmām. Efektīva pret anaerobiem patogēniem (īpaši Bacteroides fragilis). Baktērijas lēnām attīsta rezistenci pret linkozamīdiem. Linkozamīdi labi iekļūst kaulu audos. Neiekļūt asins-smadzeņu barjerā.
Pret meticilīnu rezistenti stafilokoki, lielākā daļa gramnegatīvo baktēriju, sēnīšu, vīrusu un vienšūņu ir rezistenti pret linkozamīdiem.
Linkomicīns(Linkomicīns) ir efektīvs pret grampozitīviem koku, tostarp penicilināzes producējošiem stafilokokiem. Ļoti efektīvs pret bakterioīdiem. Neaktīvs pret meningokokiem un gonokokiem. Linkomicīns neietekmē Escherichia coli, Shigella, Salmonella, Klebsiella, Legionella, Pseudomonas aeruginosa un Chlamydia. Trichomonas un Candida sēnes ir izturīgas pret linkomicīnu.
Kuņģa-zarnu traktā linkomicīns nav pilnībā uzsūcas - 25–40%. Augstā koncentrācijā nogulsnējas kaulu audos. Izdalās ar žulti un urīnu. Linkomicīnu ordinē iekšķīgi, intramuskulāri, intravenozi un lokāli ziedes veidā.
Linkomicīna lietošanas indikācijas ir sepse, osteomielīts, žokļu infekcijas slimības, septisks endokardīts, pneimonija, plaušu abscess, erysipelas, otitis.
Linkomicīna blakusparādības:
- slikta dūša, vemšana;
- glosīts, stomatīts;
- caureja;
- aknu darbības traucējumi;
- ādas izsitumi;
- neitropēnija, trombocitopēnija.
Lietojot perorāli linkomicīnu, ir iespējama zarnu kandidoze un pseidomembranozais kolīts (ko izraisa Clostridium difficile), kas saistīts ar normālas zarnu mikrofloras nomākšanu (caurejas gadījumā zāles jāpārtrauc). Metronidazolu un vankomicīnu lieto pseidomembranozā kolīta ārstēšanai.
Smago blakusparādību dēļ linkomicīnu arvien vairāk aizstāj ar mazāk toksisku klindamicīnu.
Klindamicīns(klindamicīns; dalacīns C) – linkomicīna atvasinājums; 2-10 reizes aktīvāks. Tam ir baktericīda iedarbība uz grampozitīviem kokiem un bakteriostatiska iedarbība uz bakteroīdiem. Lietojot iekšķīgi, uzsūcas 90% zāļu. Klindamicīna darbības ilgums ir 6 stundas.Tas izdalās ar nierēm un žulti (10% nemainītā veidā). Salīdzinot ar linkomicīnu, tas mazāk kairina kuņģa-zarnu traktu un mazāk var izraisīt pseidomembranozo kolītu un citas blakusparādības.
Klindamicīnu ordinē iekšķīgi 4 reizes dienā septiska endokardīta, ENT orgānu, kaulu audu, locītavu, žokļa flegmonu, jutīgu mikroorganismu izraisītu vēdera orgānu infekcijas slimībām. Septicēmijas, pneimonijas, plaušu abscesa, peritonīta gadījumā zāles ievada intramuskulāri vai intravenozi. Stafilokoku konjunktivītam klindamicīns tiek nozīmēts kā acu pilieni. Strutojošu-iekaisīgu ādas slimību gadījumā ārīgi lieto želeju ar klindamicīnu; maksts infekcijām - maksts krēms.
Orgānu un audu olbaltumvielām nepieciešama pastāvīga atjaunošana. Katabolisma un anabolisma dinamiskā līdzsvara traucējumi var izraisīt patoloģisku procesu attīstību.
Olbaltumvielu sintēze notiek šūnu citoplazmā uz ribosomām. Sākotnējā olbaltumvielu sintēzes stadija ir aminoskābju aktivācija enzīmu un ATP ietekmē ar aminoaciladenilātu veidošanos. Aktivētā aminoskābe mijiedarbojas ar pārneses RNS, un šis komplekss tiek vilkts uz ribosomu. Savukārt ribosomas nonāk saskarē ar ziņneša RNS un, virzoties pa ziņneša RNS lineāro struktūru, iekļauj aminoskābes noteiktā secībā. Pēc sintēzes pabeigšanas polipeptīdu ķēde tiek izņemta no ribosomas vidē, beidzot iegūstot šim specifiskajam proteīnam raksturīgu telpisko konfigurāciju. Proteīnu sintēzes regulēšanā piedalās operatora gēns un regulējošais gēns. Regulējošais gēns ir atbildīgs par represora sintēzi, kas ir enzīms un kavē strukturālo gēnu darbību. Represors mijiedarbojas ar operatora gēnu, kas ir neatņemama sastāvdaļa ar strukturālajiem gēniem. Represors var būt aktīvā vai neaktīvā stāvoklī. Aktīvs represors nomāc operatora gēnu, un proteīnu sintēze uz strukturālajiem gēniem apstājas. Represora aktivators var būt noteikta proteīna koncentrācija šūnā. Ar olbaltumvielu trūkumu represors tiek inhibēts un palielinās proteīnu sintēze strukturālajos gēnos. Anaboliskie hormoni un kancerogēnas vielas kavē represoru.
Olbaltumvielu sintēzes traucējumu cēloņi šūnā:
1. skābekļa samazināšanās atmosfēras gaisā un asinīs;
2. ATP ražošanas trūkums.
3. nepietiekams olbaltumvielu un neaizvietojamo aminoskābju saturs pārtikā (piemēram, ar triptofāna trūkumu - attīstās hipoproteinēmija, arginīns - samazinās spermatoģenēze, attīstās metionīns - tauku infiltrācija aknās, valīns - muskuļu vājums, augšanas aizkavēšanās, svara zudums un rodas keratozes);
4. anabolisko hormonu trūkums.
5. strukturālo gēnu darbības traucējumi (mutācijas) (piemēram, ja hemoglobīna molekulā glutamīnskābes vietā iekļauj valīnu, attīstās sirpjveida šūnu anēmija);
6. atsevišķu olbaltumvielu biosintēzes posmu pārkāpumi: replikācija, transkripcija un translācija.
7. kad ir saistīts represors (piemēram, kad to bloķē kancerogēnas vielas, notiek nepārtraukta olbaltumvielu sintēze);
8. ja tiek traucēta neiroendokrīnā regulācija (piemēram, kad tiek pārgriezti nervi un trūkst anabolisko hormonu, samazinās olbaltumvielu ražošana un mainās tā kvalitāte).
Hormoni, kas regulē olbaltumvielu metabolismu, ir sadalīti anaboliska un kataboliska. Anaboliskie hormoni ietver hipofīzes priekšējās daļas somatotropos un gonadotropos hormonus, dzimumdziedzeru hormonus un insulīnu. Vairogdziedzera hormoni fizioloģiskās devās augošā organismā stimulē proteīnu sintēzi, audu morfoloģisko un funkcionālo diferenciāciju. Normālas devas pieauguša cilvēka organismā ar pietiekamu un pastiprinātu olbaltumvielu uzturu uzrāda katabolisku efektu, kas neizraisa slāpekļa līdzsvara traucējumus un veicina liekā proteīna izvadīšanu. Vairogdziedzera hormonu un glikokortikoīdu pārprodukcijai ir kataboliska iedarbība.
Papildus iegūtajiem ir iedzimti proteīnu biosintēzes defekti (traucēta asinsreces faktoru, hemoglobīna, strukturālo olbaltumvielu veidošanās organismā).
Paaugstinātas olbaltumvielu sadalīšanās iemesli:
1. pārmērīga katabolisko homonu uzņemšana, kas aktivizē intracelulārās proteināzes, kas lokalizētas lizosomās;
2. Lizosomu caurlaidības palielināšana baktēriju toksīnu, audu sabrukšanas produktu, acidozes, hipoksijas un citu faktoru ietekmē, kas veicina katepsīnu izdalīšanos un pastiprinātus kataboliskos procesus.
Starp iemesliem, kas izraisa olbaltumvielu sintēzes traucējumus, nozīmīgu vietu ieņem dažāda veida uztura trūkums (pilnīga, nepilnīga badošanās, neaizvietojamo aminoskābju trūkums pārtikā, noteiktas kvantitatīvās attiecības pārkāpums starp neaizvietojamajām aminoskābēm, kas nonāk organismā).
Ja, piemēram, triptofāns, lizīns un valīns audu proteīnos ir vienādās proporcijās (1:1:1), un šīs aminoskābes tiek piegādātas ar pārtikas olbaltumvielām attiecībā 1:1:0,5, tad audu proteīnu sintēze. tiks nodrošināta vienmērīgi puse. Vismaz vienas (no 20) neaizvietojamās aminoskābes trūkums šūnās aptur proteīnu sintēzi kopumā.
Olbaltumvielu sintēzes ātruma traucējumu cēlonis var būt attiecīgo ģenētisko struktūru darbības traucējumi. Ģenētiskā aparāta bojājumi var būt gan iedzimti, gan iegūti, kas rodas dažādu mutagēno faktoru (jonizējošā starojuma, ultravioleto staru uc) ietekmē. Dažas antibiotikas izraisa olbaltumvielu sintēzes traucējumus. Tādējādi streptomicīna, neomicīna un citu antibiotiku ietekmē var rasties “kļūdas” ģenētiskā koda nolasīšanā. Tetraciklīni kavē jaunu aminoskābju pievienošanos augošai polipeptīdu ķēdei (spēcīgu kovalento saišu veidošanos starp tās ķēdēm), novēršot DNS virkņu sadalīšanos.
Viens no svarīgākajiem iemesliem, kas izraisa proteīnu sintēzes traucējumus, var būt šī procesa disregulācija. Olbaltumvielu metabolisma intensitātes un virziena regulēšanu kontrolē nervu un endokrīnās sistēmas, kuru iedarbība tiek realizēta, ietekmējot dažādas enzīmu sistēmas. Dzīvnieku decebrācija izraisa samazināšanos
proteīnu sintēze. Augšanas hormons, dzimumhormoni un insulīns noteiktos apstākļos stimulē proteīnu sintēzi. Visbeidzot, tās patoloģijas cēlonis var būt olbaltumvielu sintēzē iesaistīto šūnu enzīmu sistēmu aktivitātes izmaiņas.
Šo faktoru rezultāts ir atsevišķu olbaltumvielu sintēzes ātruma samazināšanās.
Kvantitatīvās olbaltumvielu sintēzes izmaiņas var izraisīt atsevišķu olbaltumvielu frakciju attiecības izmaiņas asins serumā - disproteinēmiju. Pastāv divas disproteinēmijas formas: hiperproteinēmija (palielināts visu vai atsevišķu olbaltumvielu veidu saturs) un hipoproteinēmija (samazināts visu vai atsevišķu olbaltumvielu saturs). Tādējādi dažas aknu (ciroze, hepatīts), nieru slimības (nefrīts, nefroze) pavada albumīna sintēzes samazināšanās un tā satura samazināšanās serumā. Vairākas infekcijas slimības, ko pavada plaši iekaisuma procesi, izraisa sintēzes palielināšanos un sekojošu gamma globulīnu satura palielināšanos serumā. Disproteinēmijas attīstību parasti pavada homeostāzes izmaiņas (onkotiskā spiediena traucējumi, ūdens bilance). Ievērojams olbaltumvielu, īpaši albumīnu un gamma globulīnu, sintēzes samazināšanās izraisa strauju organisma rezistences pret infekcijām samazināšanos.
Ar aknu un nieru bojājumiem, atsevišķiem akūtiem un hroniskiem iekaisuma procesiem (reimatisms, infekciozais miokardīts, pneimonija), proteīnu sintēzē notiek kvalitatīvas izmaiņas, tiek sintezēti īpaši proteīni ar mainītām īpašībām, piemēram, C-reaktīvais proteīns. Slimību piemēri, ko izraisa patoloģisku proteīnu klātbūtne, ir slimības, kas saistītas ar patoloģiskā hemoglobīna (hemoglobinozes) klātbūtni, asinsreces traucējumi ar patoloģisku fibrinogēnu parādīšanos. Neparastās asins olbaltumvielas ietver krioglobulīnus, kas var izgulsnēties temperatūrā, kas zemāka par 37 ° C (sistēmiskas slimības, aknu ciroze).
Preferanskaja Ņina Germanovna
vārdā nosauktās Pirmās Maskavas Valsts medicīnas universitātes Farmācijas fakultātes Farmakoloģijas katedras asociētais profesors. VIŅI. Sečenovs
Antibiotikām ir galvenokārt bakteriostatiska iedarbība, izņemot aminoglikozīdus, kuriem ir baktericīda iedarbība, un zāles, ko lieto lielās devās. Šīm zālēm ir plašs pretmikrobu iedarbības spektrs, un tās bieži izmanto klīniskajā praksē; tās ir īpaši nepieciešamas tādu retu infekciju specifiskā ārstēšanā kā bartoneloze, bruceloze, kriptosporidioze, cistiskā fibroze, toksoplazmoze, tularēmija, tuberkuloze, Sibīrijas mēris, holēra, mēris. utt.
I daļa. Makrolīdi
Makrolīdi ir antibiotiku klase, kuras molekulā ir makrociklisks laktona gredzens, kas saistīts ar aminocukuru ogļhidrātu atliekām. Atkarībā no oglekļa atomu skaita, kas veido gredzenu, izšķir 14 locekļu, 15 locekļu un 16 locekļu makrolīdus. No visām esošajām antibiotikām makrolīdi ir pierādījuši sevi kā ļoti efektīvus un drošākos ķīmijterapijas līdzekļus. Makrolīdi ir sadalīti divās grupās: dabīgie un daļēji sintētiskie .
Makrolīdu pretmikrobu iedarbība ir saistīta ar olbaltumvielu sintēzes traucējumiem mikrobu šūnas ribosomās. Makrolīdi atgriezeniski saistās ar dažādiem ribosomu 50S apakšvienības katalītiskā peptil-transferāzes centra domēniem un kavē peptīdu translokācijas un transpeptidācijas procesus, kas noved pie olbaltumvielu molekulu montāžas pārtraukšanas un palēnina mikroorganismu spēju dalīties un vairoties. Atkarībā no mikroorganisma veida un zāļu koncentrācijas tiem ir no devas atkarīga iedarbība, kas uzrāda bakteriostatisku efektu, bet lielās devās un dažiem mikroorganismu celmiem - baktericīda iedarbība. Pretmikrobu iedarbības spektrs ir ļoti tuvs dabisko penicilīnu grupai.
Makrolīdiem piemīt lipofīlas īpašības, tie ātri uzsūcas kuņģa-zarnu traktā, rada augstu audu un intracelulāro koncentrāciju, izplatās daudzos audos un sekrēcijās, slikti saglabājas ekstracelulārajos šķidrumos un neiekļūst BBB. To iedarbība izpaužas galvenokārt reprodukcijas stadijā. Tie ir augsti efektīvi tikai pret aktīvi dalošiem mikroorganismiem, tāpēc ir sevi pierādījuši slimības akūtā perioda ārstēšanā un maz vai nemaz neietekmē gausos procesus.
Tiem ir paaugstināta aktivitāte pret grama “+” koku un intracelulāriem patogēniem (hlamīdijām, mikoplazmām, legionellām), nomāc gramnegatīvo koku, difterijas baciļu, brucelozes patogēnu, amēbās dizentērijas attīstību. Uz gramiem “-” mikroorganismiem no Enterobacteriaceae P. aeruginosa un gramu “-” anaerobi ir izturīgi. Pseudomonas un Acinetobacter ir dabiski rezistenti pret visiem makrolīdiem. Mikroorganismu rezistence pret šo zāļu grupu ir saistīta ar izmaiņām ribosomu 50S apakšvienību receptoru struktūrā, kas izraisa antibiotikas saistīšanās ar ribosomām traucējumus. Makrolīdos, linkozamīdos un fenikolos saistīšanās ar 50S ribosomu apakšvienību notiek dažādās vietās, kā rezultātā nav krusteniskās rezistences. Makrolīdu pretmikrobu iedarbības iezīme ir to bakteriostatiskā iedarbība pret tām baktēriju formām, kuras ir rezistentas pret tādām plaši lietotām grupām kā penicilīni, streptomicīni un tetraciklīni.
Makrolīdus lieto apakšējo elpceļu infekcijām, tostarp netipiskām formām, hroniska bronhīta saasināšanās un sabiedrībā iegūtas pneimonijas gadījumā. Tos izraksta augšējo elpceļu infekcijām (sinusīts, otitis, faringīts, tonsilīts), mutes dobuma, mīksto audu, ādas infekcijām, inficētām pūtītēm un uroģenitālām infekcijām. Indikācijas to lietošanai ir mikobakteriozes profilakse un ārstēšana, reimatiskā drudža, endokardīta profilakse ar mērķi izskaust H. pylori ( klaritromicīns). Makrolīdu imūnmodulējošās īpašības tiek izmantotas panbronhonhiolīta gadījumā. klaritromicīns, roksitromicīns) un cistiskā fibroze ( azitromicīns).
Galvenās blakusparādības, lietojot makrolīdus, ir kuņģa-zarnu trakta traucējumi, kuru risks nepārsniedz 5-8%. Retos gadījumos 2-3% attīstās alerģiskas reakcijas (izsitumi uz ādas, sejas, kakla, pēdu pietūkums, anafilaktiskais šoks), retāk holestātisks hepatīts un pseidomembranozais kolīts. Mazākais makrolīdu ievadīšanas biežums, uzlaboti farmakokinētiskie parametri neprasa devas pielāgošanu nieru mazspējas gadījumā, un pacienti tos labi panes. Lielākā daļa makrolīdu (īpaši eritromicīns un klaritromicīns) ir spēcīgi citohroma P-450 (CYP 3A 4, CYP3A5, CYP3A7, CYP 1A 2) inhibitori, tāpēc to lietošana izjauc biotransformāciju un palielina vienlaikus lietoto zāļu maksimālo koncentrāciju asinīs. Tas ir īpaši svarīgi ņemt vērā, lietojot Varfarīns, ciklosporīns, teofilīns, digoksīns, karbamazepīns utt., kas tiek metabolizēti aknās. To kombinēta lietošana var izraisīt visbīstamākās komplikācijas (sirds ritma traucējumus, Q-T intervāla pagarināšanos, ekstremitāšu išēmijas un gangrēnas attīstību). Spiramicīns un azitromicīns nav pakļauti citohroma P-450 oksidācijai. Organismā makrolīdi iziet enterohepātisku recirkulāciju, izdalās galvenokārt ar žulti, un tikai 5-10% zāļu izdalās caur nierēm.
Eritromicīns (eritromicīns) ražo augsnes aktinomicīti (starojošās sēnes), no kuru kultūras šķidruma tas tika izolēts 1952. gadā. Tas labi uzsūcas no kuņģa-zarnu trakta. Kuņģa skābā vidē tas tiek daļēji iznīcināts, tāpēc eritromicīns jāievada tabletēs, kas pārklātas ar skābi izturīgu apvalku, kas šķīst tikai zarnās. Zāles viegli iekļūst dažādos audos, t.sk. šķērso placentas barjeru. Normālos apstākļos tas neietilpst smadzeņu audos. Pēc vienreizējas perorālas devas maksimālā koncentrācija asinīs tiek sasniegta pēc 2 stundām. Eritromicīna biopieejamība ir 2-3 stundas, tāpēc, lai uzturētu terapeitisko līmeni asinīs, tas jāievada 4 reizes dienā. Lielākas devas iekšķīgi: vienreizēja - 0,5 g, dienā - 2 g Izdalās ar izkārnījumiem un daļēji ar urīnu. Eritromicīna tabletes visplašāk lieto pneimonijas, dažādas etioloģijas bronhīta, skarlatīna, tonsilīta, strutojošu vidusauss iekaisumu, difterijas, brūču infekciju ārstēšanai. Zāles lieto smagām infekcijas slimībām, garā klepus, difterijas ārstēšanai. Konjunktivīta gadījumā jaundzimušajiem to ievada intravenozi, vienu devu atšķaida 250 ml izotoniskā nātrija hlorīda šķīduma, ievadot lēnām stundas laikā. Gastroparēzes gadījumā eritromicīns atkarībā no devas stimulē kuņģa kustīgumu, palielina pīlora kontrakciju amplitūdu un uzlabo antrālo un divpadsmitpirkstu zarnas koordināciju. Lokāli lieto ziedes un šķīduma veidā ārējai lietošanai strutojošu-iekaisīgu ādas slimību, inficētu brūču, trofisko čūlu, izgulējumu un II-III pakāpes apdegumu ārstēšanai. Ātri attīstās mikroorganismu rezistence pret eritromicīnu, zāles ir maz toksiskas un reti izraisa blakusparādības. Dažreiz rodas dispepsijas traucējumi (slikta dūša, vemšana) un alerģiskas reakcijas. Lietojot eritromicīnu ēšanas laikā vai pēc tās, biopieejamība ievērojami samazinās, jo pārtika samazina šīs antibiotikas koncentrāciju asinīs vairāk nekā 2 reizes. Pieejams cauruļveida, pārklāts. obol. 100 un 250 mg; acu ziede 10 g (1 g 10 000 vienības); ziede ārējai un vietējai lietošanai 15 mg - 10 tūkstoši vienību/g. Svecītes bērniem 0,05 g un 0,1 g Pulveris injekcijām 0,05, 0,1 un 0,2 g un granulas suspensijas pagatavošanai 0,125 g un 0,2 g 5 ml pudelēs.