女性、男性、子供の尿崩症。 小児の糖尿病 特発性糖尿病
7.1. 糖尿病の分類
糖尿病(DM) は、インスリン作用の分泌および/または効率の低下による高血糖を特徴とする代謝性疾患のグループです。 糖尿病とともに発症する慢性高血糖は、主に心臓、血管、目、腎臓、神経など、多くの臓器や系の合併症の発症を伴います。 合計すると、人口の 5 ~ 6% が糖尿病に苦しんでいます。 世界の経済的に発展した国々では、糖尿病患者の数は 10 ~ 15 年ごとに 2 倍になります。 糖尿病になると平均余命は10~15%短縮されます。
糖尿病の原因は多岐にわたります。 ほとんどの場合、糖尿病はインスリンの絶対的欠乏によって発症します。 (1型糖尿病 - DM-1)、または膵臓β細胞の分泌機能不全と組み合わせたインスリンに対する末梢組織の感受性の低下によるもの (2型糖尿病 - SD-2)。 場合によっては、患者を DM-1 または DM-2 に分類することが難しい場合がありますが、実際には、DM のタイプを正確に識別することよりも、DM に対する補償の方が重要です。 病因分類により、糖尿病の 4 つの主要な臨床クラスが特定されます (表 7.1)。
最も一般的な DM-1 (第 7.5 条)、DM-2 (第 7.6 条)、および妊娠 DM (第 7.9 条) については、別の章で説明します。 の上 他の特定のタイプ糖尿病症例のわずか約1%を占めます。 これらのタイプの糖尿病の病因と病因は、1 型糖尿病、特に 2 型糖尿病に比べてより研究されているようです。 多くの DM バリアントは一遺伝子遺伝によって引き起こされます 機能における遺伝的欠陥β -細胞。これには、常染色体優性遺伝の MODY 症候群のさまざまな変異型が含まれます。 若者の成人発症型糖尿病- 若者の成人型糖尿病)、これは違反を特徴としますが、末梢組織の正常な感受性を備えたインスリン分泌の欠如ではありません。
テーブル 7.1.糖尿病の分類
カジュアルめに珍しい インスリン作用の遺伝的欠陥、インスリン受容体の変異に関連するもの(らい病、ラブソン・マンデホール症候群)。 DM は自然に発展します 外分泌膵臓の病気、β細胞の破壊(膵炎、膵臓切除術、嚢胞性線維症、ヘモクロマトーシス)や、対島ホルモンの過剰産生が起こる多くの内分泌疾患(先端巨大症、クッシング症候群)を引き起こします。 医薬品および化学薬品(バコール、ペンタミジン、ニコチン酸、ジアゾキシドなど) が糖尿病を引き起こすことはめったにありませんが、インスリン抵抗性のある個人では疾患の発現と代償不全に寄与する可能性があります。 行 感染症(風疹、細胞腫大症、コクサッキーウイルス、アデノウイルス感染症)はβ細胞の破壊を伴う場合がありますが、ほとんどの患者でDM-1の免疫遺伝子マーカーが検出されます。 に まれな形態の免疫介在性糖尿病これには、「stiff-rnan」症候群(自己免疫性神経疾患)の患者で発症する糖尿病や、インスリン受容体に対する自己抗体への曝露による糖尿病が含まれます。 糖尿病のさまざまな変異型が発生する頻度が増加しています。
多くの遺伝性症候群、特にダウン症候群、クラインフェルター症候群、ターナー症候群、ウォルフラム症候群、プラダーウィリ症候群、その他多数。
7.2. 炭水化物代謝の生理学の臨床的側面
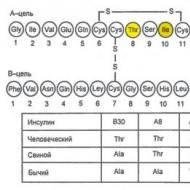
インスリン膵臓のランゲルハンス島 (PLI) のβ細胞によって合成および分泌されます。 さらに、ランゲルハンス島はグルカゴン (α 細胞)、ソマトスタチン (δ 細胞)、膵臓ポリペプチド (PP 細胞) を分泌します。 膵島細胞ホルモンは相互作用します。通常、グルカゴンはインスリン分泌を刺激し、ソマトスタチンはインスリンとグルカゴンの分泌を抑制します。 インスリン分子は 2 つのポリペプチド鎖 (A 鎖 - 21 アミノ酸、B 鎖 - 30 アミノ酸) で構成されています (図 7.1)。 インスリン合成はプレプロインスリンの形成から始まり、プロテアーゼによって切断されてプレプロインスリンが形成されます。 プロインスリン。ゴルジ体の分泌顆粒では、プロインスリンがインスリンに分解され、 C-ペプチド、これらはエキソサイトーシスの過程で血中に放出されます (図 7.2)。
インスリン分泌の主な刺激物質はブドウ糖です。 血糖値の上昇に反応してインスリンが放出される 二相(図7.3)。 最初の段階、つまり急性期は数分間続き、蓄積された物質の放出に関連します。
 米。 7.1.インスリン分子の一次構造の図
米。 7.1.インスリン分子の一次構造の図
 米。 7.2.インスリン生合成スキーム
米。 7.2.インスリン生合成スキーム
食事の間の期間中にβ細胞内に存在するインスリン。 第 2 段階は、血糖値が通常の空腹時レベル (3.3 ~ 5.5 mmol/l) に達するまで続きます。 スルホニル尿素はβ細胞に対して同様の影響を及ぼします。
ポータルシステムを介して、インスリンは到達します 肝臓- その主な標的臓器。 肝臓の受容体は、分泌されたホルモンの半分に結合します。 残りの半分は体循環に入り、筋肉や脂肪組織に到達します。 ほとんどのインスリン (80%) は肝臓でタンパク質分解を受け、残りは腎臓で分解され、筋肉や脂肪細胞によって直接代謝されるのは少量だけです。 寿命は普通です
 米。 7.3.グルコースの影響下でのインスリンの二相性放出
米。 7.3.グルコースの影響下でのインスリンの二相性放出
成人は 1 日あたり 35 ~ 50 単位のインスリンを分泌します。これは、体重 1 kg あたり 0.6 ~ 1.2 単位に相当します。 この分泌物は栄養分泌物と基礎分泌物に分けられます。 食物分泌インスリンは食後のグルコースレベルの上昇に対応します。 そのおかげで、食物による高血糖の影響は中和されます。 食事によるインスリンの量は、摂取した炭水化物の量にほぼ対応します(約 1 ~ 2.5 単位)。
炭水化物10〜12 g(パン1単位 - XE)に相当します。 基礎インスリン分泌食事の間および睡眠中に最適なレベルの血糖と同化作用を提供します。 基礎インスリンは約 1 U/h の速度で分泌されますが、長時間の身体活動や長期間の絶食により、基礎インスリンは大幅に減少します。 食事によるインスリンは、1 日のインスリン生成量の少なくとも 50 ~ 70% を占めます (図 7.4)。
インスリン分泌は食事だけでなく、 毎日
 米。 7 .4.
通常の毎日のインスリン生成パターン
米。 7 .4.
通常の毎日のインスリン生成パターン
NYの変動:インスリンの必要性は早朝に増加し、その後は一日を通して徐々に減少します。 したがって、朝食では1 XEあたり2.0〜2.5単位のインスリンが分泌され、昼食では1.0〜1.5単位、夕食では1.0単位が分泌されます。 インスリン感受性のこの変化の理由の 1 つは、朝に多くの抗インシュリンホルモン (主にコルチゾール) のレベルが高く、夜の初めには徐々に最低値まで低下することです。
主要 インスリンの生理学的影響インスリン依存性組織の細胞膜を通過するグルコース輸送を刺激します。 インスリンの主な標的臓器は肝臓、脂肪組織、筋肉です。 インスリン非依存性組織(インスリンの効果に依存しないグルコースの供給)には、主に中枢神経系および末梢神経系、血管内皮、血球などが含まれます。インスリンは肝臓と筋肉でのグリコーゲンの合成を刺激します。肝臓および脂肪組織における脂肪の合成、肝臓、筋肉および他の器官におけるタンパク質の合成。 これらすべての変化はブドウ糖の利用を目的としており、血液中のブドウ糖濃度の低下につながります。 インスリンの生理学的拮抗薬は、 グルカゴン、デポからのグリコーゲンと脂肪の動員を刺激します。 通常、グルカゴンレベルはインスリン産生と相互に変化します。
インスリンの生物学的効果は、 受容体ターゲットセル上にあります。 インスリン受容体は、4 つのサブユニットからなる糖タンパク質です。 血中のインスリン濃度が高くなると、ダウンレギュレーションの原理に従ってその受容体の数が減少し、これに伴いインスリンに対する細胞の感受性が低下します。 インスリンが細胞受容体に結合すると、生成した複合体が細胞に入ります。 筋肉細胞や脂肪細胞のさらに内側では、インスリンが細胞内小胞の動員を引き起こします。 グルコーストランスポーター GLUT-4。 その結果、小胞は細胞表面に移動し、そこで GLUT-4 がグルコースの入口点として機能します。 身体活動も GLUT-4 に同様の影響を与えます。
7.3. 糖尿病の検査診断と補償基準
糖尿病の検査診断は血糖値の測定に基づいており、診断基準は誰にとっても同じです。
SD のタイプとバリアント (表 7.2)。 他の臨床検査のデータ (血糖値、糖化ヘモグロビン値の測定) は、糖尿病の診断を確認するために使用すべきではありません。 糖尿病の診断は、次のいずれかの二重検出に基づいて確立できます。 3 つの基準:
1. 明らかな糖尿病の症状(多尿、多飲)があり、時間帯や前の食事に関係なく、全毛細管血中のグルコース濃度が 11.1 mmol/l 以上である。
2. 空腹時の全毛細血管血中のグルコースレベルが 6.1 mmol/l 以上の場合。
3. 75グラムのグルコースを摂取した2時間後の全毛細管血中のグルコースレベル(経口ブドウ糖負荷試験)が11.1 mmol/lを超える場合。
テーブル 7.2.糖尿病の診断基準
 糖尿病の診断において最も重要かつ重要な検査は、空腹時血糖(最低 8 時間の絶食)のレベルを測定することです。 ロシア連邦では、通常、血糖値は全血で評価されます。 グルコース検査は多くの国で広く使用されています
糖尿病の診断において最も重要かつ重要な検査は、空腹時血糖(最低 8 時間の絶食)のレベルを測定することです。 ロシア連邦では、通常、血糖値は全血で評価されます。 グルコース検査は多くの国で広く使用されています
血漿中。 経口ブドウ糖負荷試験(OGTT;水に溶解した75グラムのグルコースを摂取してから2時間後のグルコースレベルの測定)は、この点ではそれほど重要ではありません。 ただし、OGTT に基づいて診断されます。 耐糖能異常(NTG)。 IGT は、空腹時の全毛細管血のグルコース レベルが 6.1 mmol/l を超えず、グルコース負荷の 2 時間後に 7.8 mmol/l を超え、11.1 mmol/l 未満である場合に診断されます。 炭水化物代謝障害の別の変種は次のとおりです。 空腹時血糖値の低下(NGNT)。 後者は、空腹時の全毛細管血の血糖レベルが 5.6 ~ 6.0 mmol/l の範囲にあり、グルコース負荷の 2 時間後に 7.8 mmol/l 未満である場合に確立されます。 NTG と NGNT は現在、次の用語で統合されています。 前糖尿病、どちらのカテゴリーの患者も、糖尿病を発症し、糖尿病性大血管症を発症するリスクが高いためです。
糖尿病を診断するには、標準的な検査法によって血糖値を測定する必要があります。 血糖値を解釈するときは、全静脈血中の空腹時血糖値が全毛細管血中の血糖値に対応していることに留意する必要があります。 食事または OGTT 後、静脈血中の濃度は毛細管血よりも約 1.1 mmol/l 低くなります。 血漿中のグルコース含有量は、全血よりも約 0.84 mmol/l 高くなります。 糖尿病治療の代償と適切性を評価するために、携帯用機器を使用して毛細管血中の血糖レベルを評価します。 血糖計患者自身、その親族、医療スタッフによるものです。
どのような種類の糖尿病であっても、グルコース負荷が高い場合には、糖尿病が発症する可能性があります。 血糖、これは、原尿からのグルコース再吸収の閾値を超えた結果です。 グルコース再吸収の閾値は個別に大きく異なります (約 9 ~ 10 mmol/l)。 血糖は、糖尿病を診断するための別個の指標として使用されるべきではありません。 通常、精製炭水化物を大量に摂取した場合を除いて、血糖は起こりません。
製品 ケトン体(アセトン、アセト酢酸、β-ヒドロキシ酪酸) は、インスリンの絶対的欠乏により著しく強化されます。 DM-1の代償不全により、顕著な ケトン尿症(尿に浸したテストストリップを使用してテストされます)。 軽度(微量)ケトン尿症は、健康な人でも絶食中や低炭水化物ダイエット中に検出されることがあります。
糖尿病の種類の鑑別診断や、2 型糖尿病患者におけるインスリン欠乏症の形成を特定するために使用される重要な検査指標は、レベルです。 C-ペプチド。血中の C ペプチドのレベルは、膵臓の β 細胞のインスリン分泌能力を間接的に判断できます。 後者はプロインスリンを生成し、分泌前にプロインスリンから C ペプチドが切断され、インスリンと同量が血液に入ります。 インスリンは肝臓で 50% 結合し、末梢血中での半減期は約 4 分です。 C ペプチドは肝臓によって血流から除去されず、血中での半減期は約 30 分です。 さらに、末梢の細胞受容体には結合しません。 したがって、C ペプチドのレベルを測定することは、島装置の機能を評価するためのより信頼性の高い検査です。 刺激試験(グルカゴンの食後または投与後)のバックグラウンドに対して C ペプチドのレベルを研究することが最も有益です。 重度の高血糖はβ細胞に有毒な影響(糖毒性)を及ぼすため、糖尿病の重度の代償不全を背景に検査を行った場合、この検査は有益ではありません。 過去数日間のインスリン療法は検査結果に影響しません。
基本 治療の目的あらゆる種類の糖尿病の最大の特徴は、晩期合併症の予防であり、これは多くのパラメーターに対する安定した補償を背景に達成できます(表 7.3)。 糖尿病における炭水化物代謝の代償の質に関する主な基準は、次のレベルです。 糖化(グリコシル化)ヘモグロビン(HbA1c)。後者は、グルコースに非共有結合したヘモグロビンです。 グルコースはインスリンとは無関係に赤血球に入り、ヘモグロビンのグリコシル化は不可逆的なプロセスであり、その程度はヘモグロビンが存在する120日間に接触したグルコースの濃度に直接比例します。 ヘモグロビンのごく一部はグリコシル化されていますが、これは正常です。 糖尿病では大幅に増加する可能性があります。 HbA1c レベルは、常に変化する血糖値とは異なり、過去 3 ~ 4 か月の血糖を総合的に反映します。 糖尿病の代償を評価するために、この間隔で HbA1c レベルを測定することが推奨されます。
慢性高血糖は、糖尿病の晩期合併症の発症と進行の唯一の危険因子ではありません。 これによると DM補償評価コンプレックスに基づいて
実験室および機器による研究方法 (表 7.3)。 炭水化物代謝の状態を特徴付ける指標に加えて、最も重要なのは血圧のレベルと血液の脂質スペクトルです。
テーブル 7.3.糖尿病の補償基準
 糖尿病治療の目標を計画する際には、上記の報酬基準に加えて、個別のアプローチが必要です。 糖尿病の晩期合併症(特に微小血管症)の発症および進行の可能性は、病気の期間が長くなるにつれて増加します。 したがって、糖尿病の病歴がその後数十年に達する可能性がある子供や若い患者では、最適な血糖指標を達成する必要がある場合、高齢になって糖尿病が現れた患者では厳格な正常血糖補償が必要であり、これにより糖尿病のリスクが大幅に増加します。低血糖、必ずしも推奨されるわけではありません。
糖尿病治療の目標を計画する際には、上記の報酬基準に加えて、個別のアプローチが必要です。 糖尿病の晩期合併症(特に微小血管症)の発症および進行の可能性は、病気の期間が長くなるにつれて増加します。 したがって、糖尿病の病歴がその後数十年に達する可能性がある子供や若い患者では、最適な血糖指標を達成する必要がある場合、高齢になって糖尿病が現れた患者では厳格な正常血糖補償が必要であり、これにより糖尿病のリスクが大幅に増加します。低血糖、必ずしも推奨されるわけではありません。
7.4. インスリン製剤とインスリン療法
インスリン製剤は 1 型糖尿病患者にとって不可欠です。 さらに、T2DM 患者の最大 40% がこれらの治療を受けています。 一般の方へ 糖尿病に対するインスリン療法の処方の適応、実際に互いに重なり合うものの多くは次のとおりです。
1. 1型糖尿病
2. 膵臓切除術
3. ケトアシドーシスおよび高浸透圧性昏睡
4. 2 型糖尿病の場合:
進行性の体重減少やケトーシス、重度の高血糖など、インスリン欠乏症の明らかな兆候。
大規模な外科的介入。
炭水化物代謝の代償不全を伴う急性大血管合併症(脳卒中、心筋梗塞、壊疽など)および重度の感染症。
空腹時血糖値が 15 ~ 18 mmol/l 以上。
さまざまな錠剤型血糖降下薬の1日最大用量が処方されているにもかかわらず、安定した補償が欠如している。
糖尿病の晩期合併症の後期(重度の多発性神経障害および網膜症、慢性腎不全)。
5. 食事療法では妊娠糖尿病を補うことができない。
出身地別インスリン製剤は次の 3 つのグループに分類できます。
動物インスリン (豚肉);
ヒトインスリン(半合成、遺伝子組み換え)
インスリン類似体(リスプロ、アスパルト、グラルギン、デテミル)。
ヒトインスリン生産技術の進歩により、 豚インスリン(人間のアミノ酸1つとは異なります)は最近大幅に減少しました。 ブタのインスリンはヒトのインスリンの製造に使用される可能性がある 半合成法、これには、分子内の 1 つの異なるアミノ酸を置換することが含まれます。 最高品質 遺伝子工学人間のインスリン。 それらを得るために、インスリン合成を担うヒトゲノムの領域がゲノムに関連付けられます。 大腸菌または酵母培養の結果、後者はヒトインスリンを生成し始めます。 創造 インスリン類似体さまざまなアミノ酸の再構成を使用して、望ましい薬物動態を備えた薬物を得ることが目標でした。 したがって、インスリンリスプロ (Humalog) は類似体です。
注射後15分以内に血糖降下効果が発現する超短時間作用型インスリン。 対照的に、インスリン類似体であるグラルギン(ランタス)は、一日中持続する長期的な効果を特徴とし、薬物の動態の特徴は血漿濃度に顕著なピークがないことです。 現在使用されているほとんどのインスリン製剤とその類似体は、 濃度 100U/ml。 による 作用時間インスリンは 4 つの主要なグループに分類されます (表 7.4)。
テーブル 7.4.薬物およびインスリン類似体の薬物動態
 1.
超短時間作用型(リスプロ、アスパルト)。
1.
超短時間作用型(リスプロ、アスパルト)。
2. 短時間作用型(単純ヒトインスリン)。
3. 中作用型 (中性プロタミン ハーゲドン インスリン)。
4. 長時間作用型(グラルギン、デテミル)。
5. 作用持続時間が異なるインスリンの混合物 (Novomix-30、Humulin-MZ、Humalog-Mix-25)。
薬物 超ショートアクション[リスプロ(ヒューマログ)、アスパルト(ノボラピッド)]はインスリン類似体です。 それらの利点は、注射後(15 分後)血糖降下効果が急速に発現するため、食事の直前または食事の直後でも注射が可能であること、および作用持続時間が短い(3 時間未満)ため、血糖降下リスクが軽減されることです。低血糖症。 薬物 短時間作用型(単純インスリン、通常のインスリン) は、100 U/ml の濃度でインスリンを含む溶液です。 単純なインスリン注射は食事の30分前に行われます。 作用持続時間は約4~6時間です。 超短時間作用型の薬剤は、皮下、筋肉内、静脈内に投与できます。
薬の中には 平均アクション持続時間最も一般的に使用される薬剤は中性プロタミン ハーゲドン (NPH) です。 NPH は、インスリンを非共有結合的に吸着し、皮下デポからの吸収を遅らせるタンパク質です。 NPH インスリンの有効作用時間は通常約 12 時間です。 それらは皮下にのみ投与されます。 NPH インスリンは懸濁液であるため、単純なインスリンと異なりバイアル内で濁り、長時間放置すると懸濁液が形成されるため、注射前に十分に混合する必要があります。 NPH インスリンは、他の長時間作用型薬剤とは異なり、短時間作用型インスリン (単純インスリン) と任意の比率で混合することができ、NPH は追加量の単純インスリンに結合しないため、混合物の成分の薬物動態は変化しません (図7.5)。 さらに、プロタミンは、インスリン類似体の標準混合物 (Novomix-30、Humalog-Mix-25) の調製にも使用されます。
長時間作用型薬の中で、現在はインスリンアナログが積極的に使用されています。 グラルギン(ランタス)と デテミル(レヴミル)。 これらの薬剤の薬物動態の好ましい特徴は、NPH インスリンとは異なり、皮下デポから薬剤がより均一かつ長期間供給されることです。 この点において、グラルギンは、実質的に時刻に関係なく、1 日 1 回だけ処方することができます。
 米。 7.5。さまざまなインスリン製剤の薬物動態:
米。 7.5。さまざまなインスリン製剤の薬物動態:
a) 単一成分; b) 標準インスリン混合物
単成分インスリン製剤に加えて、これらは臨床現場で広く使用されています。 標準的な混合物。原則として、短時間作用型または超短時間作用型インスリンと中間作用型インスリンの混合物について話します。 たとえば、薬剤「Humulin-MZ」には、1 つのボトルに 30% の単純インスリンと 70% の NPH インスリンが含まれています。 薬剤「Novomix-30」には、30%のインスリンアスパルトと70%のインスリンアスパルトの結晶性プロタミン懸濁液が含まれています。 薬剤「Humalog-Mix-25」には、25%のインスリンリスプロと75%のインスリンリスプロのプロタミン懸濁液が含まれています。 アドバンテージ
標準インスリン混合物は、2 回の注射を 1 回で行うもので、混合物の成分の投与量が若干正確になります。 欠点は、混合物の個々の成分を個別に投与することができないことです。 これにより、T2DM またはいわゆるインスリン混合物の治療に標準的なインスリン混合物を使用するかどうかが決まります。 従来のインスリン療法(固定用量のインスリンを処方する)一方、 集中インスリン療法(血糖指標および食物中の炭水化物の量に応じて柔軟な用量選択)単成分薬剤の使用が好ましい。
インスリン療法を成功させる鍵は、次の事項を厳守することです。 注射技術。インスリンを投与するにはいくつかの方法があります。 最も簡単で信頼性の高い方法は、インスリンを使用した注射です。 注射器。インスリンを投与するより便利な方法は、 注射器ペン、これは、インスリン リザーバー (カートリッジ)、投与システム、および注射器付きの針を含む複合デバイスです。
維持療法(糖尿病の重度の代償不全や重篤な状態以外の場合)では、インスリンが皮下投与されます。 短時間作用型インスリンの注射は腹部の皮下脂肪組織に、長時間作用型インスリンの注射は大腿部または肩の組織に行うことが推奨されます(図7.6a)。 注射は、45°の角度で広く圧縮された皮膚を通して皮下組織の奥深くに行われます(図7.6 b)。 脂肪ジストロフィーの発症を防ぐために、同じ領域内でインスリン注射部位を毎日変更するように患者にアドバイスする必要があります。
に インスリン吸収速度に影響を与える要因皮下デポからのインスリンの投与量(投与量を増やすと吸収時間が長くなります)、注射部位(腹部組織からの吸収がより速くなります)、および周囲温度(注射部位を温めたりマッサージすると吸収が促進されます)を考慮する必要があります。 )。
より複雑な投与方法であるにもかかわらず、多くの患者で良好な治療結果を達成できるのは、 インスリン ディスペンサー,または持続皮下インスリン投与のためのシステム。 ディスペンサーは、インスリン供給モードを設定するコンピュータと、カテーテルおよび皮下への小型針を介して実行されるインスリン供給システムで構成されるポータブルデバイスです。
 米。 7.6.インスリン注射: a) 典型的な注射部位。 b) 注射中のインスリン注射針の位置
米。 7.6.インスリン注射: a) 典型的な注射部位。 b) 注射中のインスリン注射針の位置
脂肪組織。 ディスペンサーを使用して、短時間作用型または超短時間作用型インスリンの連続基礎注射を実行し(約0.5~1U/時間の速度で)、炭水化物含有量と血糖値に応じて、食事の前に、患者は同じ短時間作用型インスリンを必要なボーラス用量で投与します。 ディスペンサーを使用するインスリン療法の利点は、短時間作用型(または超短時間型)インスリンを単独で投与できることです。これは、長時間作用型インスリン製剤の吸収は大きく変動するため、それ自体、いくぶん生理的です。 この点において、短時間作用型インスリンの継続投与は、より管理しやすいプロセスであると考えられます。 ディスペンサーを使用するインスリン療法の欠点は、常に装置を装着する必要があることと、皮下組織に注射針が長期間存在するため、インスリン供給プロセスを定期的に監視する必要があることです。 ディスペンサーを使用したインスリン療法は、主に、その管理技術を習得する準備ができている 1 型糖尿病患者に適応されます。 特にこの点において、顕著な「夜明け」現象を示す患者、ならびに妊娠中および妊娠を計画しているT1DM患者およびその患者には注意を払う必要がある。
不規則なライフスタイルを持つ患者(より柔軟な食事の可能性)。
7.5。 1型糖尿病
CD-1 - 臓器特異的 自己免疫インスリンの絶対的な欠乏によって現れる、膵臓の島のインスリン産生β細胞の破壊を引き起こす疾患。 場合によっては、顕性 T1DM 患者には、β 細胞に対する自己免疫損傷のマーカーが欠如している (特発性DM-1)。
病因
DM-1 は遺伝性の素因を持つ病気ですが、病気の発症への寄与は小さいです (病気の発症は約 1/3 で決まります)。 一卵性双生児における T1DM の一致率はわずか 36% です。 病気の母親を持つ子供がT1Dを発症する確率は1~2%、父親の場合は3~6%、兄弟または姉妹の場合は6%です。 膵島に対する抗体、グルタミン酸デカルボキシラーゼに対する抗体(GAD65)、チロシンホスファターゼに対する抗体(IA-2およびΙA-2β)などの自己免疫β細胞損傷の1つまたは複数の体液性マーカーが、患者の85~90%で検出されます。 。 それにもかかわらず、β細胞の破壊における主な役割は細胞性免疫因子に与えられています。 T1DM は、次のような HLA ハプロタイプと関連しています。 DQAそして DQB一方、対立遺伝子のみ HLA-DR/DQ病気の発症の素因になる可能性がある一方で、防御的なものもあります。 DM-1は、他の自己免疫内分泌疾患(自己免疫性甲状腺炎、アジソン病)や脱毛症、白斑、クローン病、リウマチ性疾患などの非内分泌疾患と組み合わされる頻度が高くなります(表7.5)。
病因
DM-1 は、β 細胞の 80 ~ 90% が自己免疫プロセスによって破壊されたときに現れます。 このプロセスの速度と強度は大幅に異なる場合があります。 最も頻繁に起こるのは、 典型的なコース子供や若者の病気では、このプロセスは非常に急速に進行し、その後、病気が急速に発現します。最初の臨床症状の出現からケトアシドーシス(ケトアシドーシス昏睡まで)の発症まで、わずか数週間しかかかりません。
テーブル 7.5。 1型糖尿病
 表の続き。 7.5
表の続き。 7.5
 他の非常にまれなケースでは、通常は 40 歳以上の成人で、この病気が潜在している可能性があります。 (成人の潜在性自己免疫性糖尿病 - LADA)、同時に、このような患者は病気の発症時に 2 型糖尿病と診断されることが多く、数年間はスルホニル尿素薬を処方することで糖尿病を補うことができます。 しかし、その後、通常は 3 年後に、絶対的なインスリン欠乏の兆候が現れます(錠剤の血糖降下薬を服用しているにもかかわらず、体重減少、ケトン尿、重度の高血糖)。
他の非常にまれなケースでは、通常は 40 歳以上の成人で、この病気が潜在している可能性があります。 (成人の潜在性自己免疫性糖尿病 - LADA)、同時に、このような患者は病気の発症時に 2 型糖尿病と診断されることが多く、数年間はスルホニル尿素薬を処方することで糖尿病を補うことができます。 しかし、その後、通常は 3 年後に、絶対的なインスリン欠乏の兆候が現れます(錠剤の血糖降下薬を服用しているにもかかわらず、体重減少、ケトン尿、重度の高血糖)。
示されているように、T1DM の病因は絶対的なインスリン欠乏に基づいています。 グルコースがインスリン依存性組織(脂肪および筋肉)に入ることができないとエネルギー不足が生じ、その結果、脂肪分解およびタンパク質分解が強化され、体重減少につながります。 血糖値の上昇は高浸透圧を引き起こし、浸透圧利尿と重度の脱水を伴います。 インスリン欠乏およびエネルギー欠乏の条件下では、抑制ホルモン(グルカゴン、コルチゾール、成長ホルモン)の産生が阻害され、血糖の増加にも関わらず糖新生の刺激が引き起こされます。 脂肪組織における脂肪分解の増加は、遊離脂肪酸の濃度の大幅な増加につながります。 インスリンが欠乏すると肝臓の脂肪合成能力が低下し、肝臓の脂肪合成能力が低下します。
脂肪酸はケト生成に含まれ始めます。 ケトン体の蓄積は、糖尿病性ケトーシスの発症につながり、その後ケトアシドーシスを引き起こします。 脱水症とアシドーシスが進行すると昏睡状態に陥り(セクション 7.7.1 を参照)、インスリン療法や水分補給がなければ必然的に死に至ります。
疫学
T1DM は糖尿病の全症例の約 1.5 ~ 2% を占めますが、T2DM の発生率が急速に増加しているため、この相対的な数値はさらに減少すると考えられます。 白人が生涯にわたって T1DM を発症するリスクは約 0.4% です。 1 型糖尿病の発生率は年間 3% 増加しています。新規症例により 1.5% 増加し、患者の平均余命の延長によりさらに 1.5% 増加しています。 T1DM の有病率は、人口の民族構成によって異なります。 2000年の時点で、アフリカでは0.02%、南アジアと中南米では0.1%、ヨーロッパと北米では0.2%でした。 DM-1の発生率はフィンランドとスウェーデンで最も高く(人口10万人当たり年間30~35件)、日本、中国、韓国で最も低い(それぞれ0.5~2.0件)。 T1DM の発現のピーク年齢は、約 10 ~ 13 歳に相当します。 ほとんどの場合、T1DM は 40 歳になる前に発症します。
臨床症状
で 典型的なケース、特に子供や若者では、T1DM は鮮明な臨床像を伴って発症し、数か月から場合によっては数週間にわたって発症します。 T1DM の発現は、感染症やその他の付随疾患によって引き起こされる場合があります。 特性 あらゆる種類の糖尿病に共通する症状、高血糖に関連する症状としては、多飲、多尿、皮膚のかゆみなどが挙げられますが、1型糖尿病の場合、これらは非常に顕著です。 そのため、患者は 1 日を通して最大 5 ~ 10 リットルの水分を摂取し、排泄することができます。 特定の 1 型糖尿病の場合、インスリンの絶対的な欠乏によって引き起こされる症状は、1 ~ 2 か月で 10 ~ 15 kg に達する体重減少です。 全身性および筋力の重度の衰弱、パフォーマンスの低下、および眠気を特徴とします。 病気の発症時に食欲の増加を経験する患者もいますが、ケトアシドーシスが進行するにつれて食欲不振に変わります。 後者は、口からのアセトン臭(またはフルーティーな匂い)の出現、吐き気を特徴とします。
症状、嘔吐、しばしば腹痛(偽腹膜炎)、重度の脱水症状が起こり、最終的には昏睡状態に陥ります(セクション7.7.1を参照)。 場合によっては、小児における T1DM の最初の症状は、併発疾患 (通常は感染症または急性外科的病理) による昏睡に至る進行性の意識障害です。
35~40歳以上の人々でT1DMが発症する比較的まれなケース (成人の潜在的な自己免疫性糖尿病)この病気はそれほど明確に現れないこともあり(中等度の多飲と多尿、体重減少なし)、日常的な血糖値の測定中に偶然検出されることもあります。 このような場合、患者は多くの場合、最初に 2 型糖尿病と診断され、錠剤の血糖降下薬 (TGD) が処方されます。これにより、しばらくの間は許容できる糖尿病の補償が得られます。 しかし、数年にわたって(多くの場合1年以内に)、患者はインスリンの絶対的欠乏の増加によって引き起こされる症状、つまり体重減少、TSPを背景とした正常な血糖の維持不能、ケトーシス、ケトアシドーシスを発症します。
診断
DM-1 には明確な臨床像があり、比較的まれな疾患でもあることを考慮すると、DM-1 の診断を目的とした血糖値のスクリーニング測定は必要ありません。 患者の近親者がこの疾患を発症する可能性は低く、T1DM の一次予防に効果的な方法が存在しないことと合わせて、彼らの疾患の免疫遺伝マーカーを研究することが不適切であることが決定されています。 ほとんどの場合、T1DM の診断は、絶対的インスリン欠乏の重篤な臨床症状を示す患者における重大な高血糖の検出に基づいています。 T1DM を診断する目的で OGTT を実行する必要があるのは非常にまれです。
鑑別診断
疑わしい場合(明らかな臨床症状がないにもかかわらず中等度の高血糖が検出された場合、比較的高齢での症状が現れた場合)、および他の種類の糖尿病との鑑別診断の目的で、レベル判定が使用されます。 C-ペプチド(基礎と食後2時間)。 疑わしい場合の間接的な診断価値では、定義には次のようなものがある可能性があります。 免疫学的マーカー CD-1 - 膵島に対する抗体
PZH、グルタミン酸デカルボキシラーゼ (GAD65) およびチロシンホスファターゼ (IA-2 および IA-2β)。 DM-1 と DM-2 の鑑別診断を表に示します。 7.6.
テーブル 7.6.鑑別診断とDM-1とDM-2の違い
 処理
処理
あらゆるタイプの糖尿病の治療は、血糖降下療法(糖尿病-1 - インスリン療法)、食事療法、患者教育という 3 つの主な原則に基づいています。 インスリン療法 DM-1ウェアと合わせて 代替性そしてその目標は、受け入れられた補償基準を達成するためにホルモンの生理学的生成を最大限に模倣することです(表7.3)。 生理的なインスリン分泌に最も近い 集中的なインスリン療法。それに応じたインスリンの必要性 基礎分泌中間型インスリンの2回注射(朝と夕方)または持効型インスリン(グラルギン)の1回の注射によって提供されます。 基礎インスリンの総投与量
その量は、薬の1日の総必要量の半分を超えてはなりません。 食事またはボーラスインスリン分泌の代わりに、各食事の前に短時間作用型または超短時間作用型インスリンを注射します。その用量は、次の食事中に摂取されると予想される炭水化物の量と、使用している患者によって決定される既存の血糖レベルに基づいて計算されます。各インスリン注射の前に血糖計を測定します (図 7.7)。
近似 集中インスリン療法レジメン、ほぼ毎日変化するので、次のように表すことができます。 インスリンの 1 日の必要量は、体重 1 kg あたり約 0.5 ~ 0.7 単位であると想定されています (体重 70 kg の患者の場合、約 35 ~ 50 単位)。 この用量の約 1/3 ~ 1/2 は長時間作用型インスリン (20 ~ 25 U)、1/2 ~ 2/3 は短時間作用型または超短時間作用型インスリンになります。 NPH インスリンの投与量は 2 回の注射に分割されます。朝は投与量の 2/3 (12 単位)、夕方は投与量の 1/3 (8-10 単位)です。
目的 最初の段階インスリン療法の選択は、空腹時血糖値を正常化することです。 NPH インスリンの夕方の用量は通常 22 ~ 23 時間後に投与され、朝の用量は朝食前の短時間作用型インスリンの注射とともに投与されます。 NPH インスリンの夕方用量を選択するときは、多数の疾患を発症する可能性を念頭に置く必要があります。
 米。 7.7.集中インスリン療法レジメン
米。 7.7.集中インスリン療法レジメン
極めて典型的な現象。 朝までにインスリンの必要性が大幅に増加するため、朝の高血糖の原因は持続型インスリンの用量が不十分である可能性があります。 (「夜明け」現象)。不十分な用量に加えて、過剰な摂取によって朝の高血糖が引き起こされる可能性があります。 ソモギ現象(ソモギ)、低血糖後の高血糖。 この現象は、インスリンに対する組織の最大感受性が午前 2 時から 4 時の間に観察されるという事実によって説明されます。 通常、主要な抑制ホルモン(コルチゾール、成長ホルモンなど)のレベルが最も低くなるのはこの時期です。 夕方の持効型インスリンの用量が多すぎる場合は、この時点で 低血糖症。臨床的には、悪夢を伴う睡眠不足、睡眠中の無意識の行動、朝の頭痛、倦怠感として現れることがあります。 この時点での低血糖の発症により、グルカゴンおよび他の抑制ホルモンの大幅な代償放出が引き起こされ、その後、 朝の高血糖。この状況で、夕方に投与される持効型インスリンの用量が減らずに増量されると、夜間の低血糖と朝の高血糖が悪化して、最終的には肥満が組み合わさった慢性インスリン過剰摂取症候群(ソモギー症候群)につながる可能性があります。糖尿病の慢性代償不全、頻繁な低血糖症、進行性の晩期合併症を伴います。 ソモジー現象を診断するには、午前 3 時頃の血糖値を調べる必要があります。これは、インスリン療法の選択に不可欠な要素です。 安全な夜間低血糖まで夕方のNPHの用量を減らすと、朝の高血糖(明け方現象)が伴う場合は、夜間に投与されるインスリンが正常を維持し続ける間、患者には早めに起床(午前6〜7時)するようアドバイスする必要があります。血糖値。
NPH インスリンの 2 回目の注射は、通常、朝の短時間作用型 (超短時間作用型) インスリンの注射とともに朝食前に行われます。 この場合、用量は主に毎日の主な食事(昼食、夕食)前の血糖値に基づいて選択されます。 さらに、食事の間、例えば正午、朝食と昼食の間の低血糖の発症によって制限される可能性があります。
インスリンの全投与量 長時間作用型(グラルギン)は1日1回投与され、時間は関係ありません。 動力学
インスリングラルギンとデテミルは、夜間を含む低血糖症を発症するリスクの点でより有利です。
短時間作用型または超速効型インスリンの用量は、患者へのインスリン処方初日であっても、摂取した炭水化物の量(パン単位)と注射前の血糖レベルによって異なります。 従来は、正常なインスリン分泌の1日のリズムに基づいて、速効型インスリンの投与量の約1/4(6~8単位)を夕食に割り当て、残りの投与量を朝食と昼食(10~12単位)にほぼ均等に分けて投与していました。単位)。 初期血糖値が高いほど、投与されるインスリン単位当たりの血糖値の低下は少なくなります。 速効型インスリン注射は食事の30分前、超速効型インスリン注射は食事の直前、さらには食直後に投与されます。 短時間作用型インスリンの用量の適切性は、食後 2 時間と次の食事前の血糖指標によって評価されます。
強力なインスリン療法中のインスリンの投与量を計算するには、炭水化物成分のみに基づいて XE の数を計算するだけで十分です。 この場合、すべての炭水化物を含む製品が考慮されるわけではなく、いわゆる可算製品のみが考慮されます。 後者には、ジャガイモ、穀物製品、果物、液体乳製品、甘い製品が含まれます。 難消化性炭水化物を含む製品(ほとんどの野菜)は考慮されません。 特別な交換表が開発されており、これを利用して炭水化物の量を XE で表すことにより、必要なインスリンの投与量を計算できます。 1 XE は 10 ~ 12 g の炭水化物に相当します (表 10.7)。
1 XE を含む食事を摂取した後、血糖値は 1.6 ~ 2.2 mmol/l 増加します。 1単位のインスリンが投与されたときに血糖値が低下するのとほぼ同じ量です。 つまり、食べる予定の食品に含まれる XE ごとに、(時間帯に応じて)約 1 単位のインスリンを事前に投与する必要があります。 さらに、毎回の注射前に行われる血糖値の自己モニタリングの結果と時間帯(朝と昼の1XEあたり約2Uのインスリン、1Uのインスリン)を考慮する必要があります。ディナー時は1XEあたり)。 したがって、高血糖が検出された場合は、次の食事に従って(XEの数に基づいて)計算されたインスリンの用量を増やす必要があり、逆も同様で、低血糖が検出された場合は、投与されるインスリンの量が少なくなります。
テーブル 7.7. 1 XEを構成する製品の同等代替
 たとえば、5 XE を含む予定の夕食の 30 分前に患者の血糖値が 7 mmol/l である場合、血糖値が正常レベル、つまり 7 mmol/l からおよそ5ミリモル/リットル。 さらに、5 XE をカバーするには 5 単位のインスリンを投与する必要があります。 したがって、この場合、患者は 6 単位の短時間作用型または超短時間作用型インスリンを注射することになります。
たとえば、5 XE を含む予定の夕食の 30 分前に患者の血糖値が 7 mmol/l である場合、血糖値が正常レベル、つまり 7 mmol/l からおよそ5ミリモル/リットル。 さらに、5 XE をカバーするには 5 単位のインスリンを投与する必要があります。 したがって、この場合、患者は 6 単位の短時間作用型または超短時間作用型インスリンを注射することになります。
T1DM が発現し、十分に長い期間インスリン療法を開始した後では、インスリンの必要性は少なくなり、0.3 ~ 0.4 U/kg 未満になることがあります。 この期間は寛解期と呼ばれます。 "ハネムーン"。残りの β 細胞の 10 ~ 15% によるインスリン分泌が抑制される高血糖とケトアシドーシスが一定期間続いた後、インスリンの投与によってホルモン代謝障害が補償され、これらの細胞の機能が回復し、その後、体へのインスリンの供給を引き継ぎます。最低限のレベルでは。 この期間は数週間から数年続くこともありますが、最終的には残っているβ細胞の自己免疫破壊により「ハネムーン」は終わります。
ダイエットインスリン投与量の自己管理と選択のスキルを備えた訓練を受けた患者のT1DMについては、自由化することができます。 無料に近づいています。 患者が過体重でも過体重でもない場合、食事は次のとおりである必要があります。
等カロリー。 T1DM の食事の主成分は炭水化物であり、1 日のカロリーの約 65% を占めるはずです。 食物繊維が豊富な製品だけでなく、複雑でゆっくりと吸収される炭水化物を含む製品を優先する必要があります。 消化しやすい炭水化物(小麦粉、お菓子)を含む製品は避けてください。 タンパク質の割合は 10 ~ 35% に減らす必要があり、これは微小血管症の発症リスクを軽減するのに役立ちます。脂肪の割合は 25 ~ 35% に減らす必要があります。一方、脂肪を制限することでカロリーの最大 7% を占める必要があります。アテローム性動脈硬化症を発症するリスクを軽減します。 また、アルコール飲料、特に強いアルコール飲料の摂取も避ける必要があります。
T1DM 患者の治療に不可欠な要素であり、効果的な補償の鍵となるのは、 患者教育。患者は生涯を通じて、さまざまな要因に応じてインスリンの投与量を毎日独自に変更する必要があります。 明らかに、これには患者に教える必要がある特定のスキルを習得する必要があります。 「DM-1 を使用した患者学校」は、内分泌科の病院または外来で開催され、医師または特別な訓練を受けた看護師がさまざまな視覚補助を使用して対話的に患者に原則を教える 5 ~ 7 つの構造化されたセッションで構成されています。 自制心。
予報
インスリン療法がなければ、1 型糖尿病患者はケトアシドーシス性昏睡で必然的に死亡します。 糖尿病の補償基準が達成されず、患者が慢性高血糖状態にあることを背景に、不適切なインスリン療法が行われると(表 7.3)、晩期合併症が発症および進行し始めます(第 7.8 項)。 T1DM では、糖尿病性微小血管障害 (腎症および網膜症) および神経障害 (糖尿病性足症候群) の症状がこの点で臨床的に最も重要です。 1 型糖尿病における大血管症が表面化することは比較的まれです。
7.6. 2型糖尿病
2型糖尿病- インスリン抵抗性およびβ細胞の分泌機能不全による高血糖の発症を伴う炭水化物代謝障害によって現れる慢性疾患、
アテローム性動脈硬化の進行に伴う脂質代謝も同様です。 患者の死亡および障害の主な原因は全身性アテローム性動脈硬化症の合併症であるため、T2DM は心血管疾患と呼ばれることもあります。
テーブル 7.8. 2型糖尿病
 病因
病因
T2DM は、遺伝的素因を持つ多因子疾患です。 一卵性双生児における T2DM の一致率は 80% 以上に達します。 T2DM 患者のほとんどは、近親者に T2DM が存在することを示しています。 両親のどちらかが T2DM を患っている場合、子孫が生涯を通じて T2DM を発症する確率は 40% です。 多型性が T2DM の素因を決定する単一の遺伝子は見つかっていません。 環境要因、主にライフスタイルの特徴は、T2DM の遺伝的素因の実現に大きな役割を果たします。 T2DM を発症するリスク要因は次のとおりです。
肥満、特に内臓系の肥満(11.2項を参照)。
民族性(特に伝統的なライフスタイルを西洋的なライフスタイルに変える場合)。
体を動かさない生活;
食事の特徴(精製炭水化物の摂取量が多く、繊維含有量が低い)。
動脈性高血圧。
病因
病因学的に、T2DM は代謝障害の異質なグループであり、これがその重大な臨床的異質性を決定するものです。 その病因は、β細胞の分泌機能不全を背景に起こるインスリン抵抗性(組織によるインスリン媒介グルコース利用の減少)に基づいています。 したがって、インスリン感受性とインスリン分泌の不均衡が生じます。 分泌機能不全β -細胞血糖値の上昇に応じてインスリンの「初期」分泌放出を遅らせることから成ります。 この場合、蓄積したインスリンで小胞を空にすることからなる分泌の第 1 (高速) 段階は事実上存在しません。 分泌の第 2 (遅い) 段階は、高血糖を持続的に安定化させることに応答して、強壮モードで発生します。過剰なインスリン分泌にもかかわらず、インスリン抵抗性を背景とした血糖レベルは正常化されません (図 7.8)。
高インスリン血症の結果は、インスリン受容体の感受性と数の低下、および抑制です。
インスリンの効果を媒介する受容体後機構 (インスリン抵抗性)。筋肉および脂肪細胞の主要なグルコース輸送体(GLUT-4)の含有量は、内臓肥満の人では 40% 減少し、2 型糖尿病の人では 80% 減少します。 肝細胞のインスリン抵抗性により門脈高インスリン血症が発生します。 肝臓によるブドウ糖の過剰生産、空腹時高血糖が発生しますが、これは疾患の初期段階を含め、ほとんどの T2DM 患者で検出されます。
高血糖そのものは、β細胞の分泌活性の性質とレベルに悪影響を及ぼします(糖毒性)。 何年、何十年にもわたる長期にわたると、既存の高血糖は最終的にβ細胞のインスリン産生の枯渇につながり、患者はいくつかの症状を経験することがあります。 インスリン欠乏症- 感染症を伴う体重減少、ケトーシス。 しかし、ケトアシドーシスを予防するのに十分な残存インスリン産生は、T2DM でもほとんどの場合維持されます。
疫学
T2DM は糖尿病の症例の約 98% を占めるため、糖尿病全体の疫学を決定します。 T2DM の有病率は国や民族によって異なります。 ヨーロッパでは
 米。 7.8. 2 型糖尿病におけるβ細胞の分泌機能不全 (インスリン分泌の第 1 速期の喪失)
米。 7.8. 2 型糖尿病におけるβ細胞の分泌機能不全 (インスリン分泌の第 1 速期の喪失)
米国やロシア連邦などの国では、人口の約5〜6%を占めています。 T2DM の発生率は年齢とともに増加します。成人では T2DM の有病率は 10%、65 歳以上では 20% に達します。 T2DM の発生率は、アメリカ先住民とハワイ人の間で 2.5 倍高くなります。 ピマ・インディアン(アリゾナ州)ではその割合は50%に達します。 伝統的なライフスタイルを送るインド、中国、チリ、アフリカ諸国の農村部の人々の間では、T2DM の有病率は非常に低い (1% 未満)。 一方、西側先進国への移民では、この割合はかなりの水準に達している。 したがって、米国と英国に住むインドと中国からの移民の間では、T2DM の有病率は 12 ~ 15% に達します。
WHO は、世界の糖尿病患者の数が今後 20 年間で 122% (1 億 3,500 万人から 3 億人に) 増加すると予測しています。 これは、人口の高齢化が進行していることと、都市化されたライフスタイルの広がりと悪化の両方によるものです。 近年、T2DM の大幅な「若返り」が見られ、小児における T2DM の発生率が増加しています。
臨床症状
ほとんどの場合、 顕著な臨床症状はありませんが、診断は日常的な血糖値の測定によって確立されます。 この病気は通常 40 歳以上で発症しますが、大多数の患者は肥満やその他のメタボリックシンドロームの要素を持っています (セクション 11.2 を参照)。 他に理由がない限り、患者はパフォーマンスの低下について不平を言いません。 口の渇きや多尿の訴えが重大な重症度に達することはほとんどありません。 多くの場合、患者は皮膚や膣のかゆみに悩まされ、皮膚科医や婦人科医に相談します。 T2DM の実際の症状が現れてから診断までに長い年月 (平均約 7 年) かかることが多いため、多くの患者の臨床像は次のようなものに支配されています。 糖尿病の晩期合併症の症状と発現。さらに、T2DM 患者の最初の受診は、晩期合併症が原因で発生することが非常に多いです。 したがって、患者は下肢の潰瘍性病変を患う外科病院に入院することができます。 (糖尿病性足症候群)、進行性の視力喪失のため眼科医に連絡してください (糖尿病性網膜症)、心臓発作、脳卒中で入院する
tami、高血糖が最初に検出された施設で脚の血管の病変を消滅させる。
診断
すべてのタイプの糖尿病に共通する診断基準は、パラグラフ 7.3 に示されています。 ほとんどの症例における DM-2 の診断は、DM-2 の典型的な臨床症状 (肥満、40 ~ 45 歳以上の年齢、DM-2 の陽性家族歴、その他の症状) を有する個人における高血糖の特定に基づいています。メタボリックシンドローム)、臨床的および臨床検査の兆候がない場合、絶対的なインスリン欠乏(顕著な体重減少、ケトーシス)。 T2DM の有病率の高さ、その特徴的な長期無症候性経過、および早期診断による重篤な合併症の予防の可能性の組み合わせにより、T2DM の必要性が事前に決定されます。 ふるい分け、それらの。 病気の症状がない人に対してT2DMを除外するための検査を実施する。 示されているように、主なテストは決定です。 空腹時血糖値。次のような場合に表示されます。
1. 45 歳以上のすべての人、特に過剰体重 (BMI 25 kg/m2 以上) のある人を 3 年ごとに対象とします。
2. 若い年齢で、過剰な体重(BMI 25 kg/m2 以上)および次のような追加の危険因子が存在する場合。
体を動かさない生活;
近親者ではCD-2。
T2DMを発症するリスクが高い国籍(アフリカ系アメリカ人、ヒスパニック系、ネイティブアメリカンなど)に属している。
体重が4kgを超える子供を出産した女性、および/または妊娠糖尿病の病歴のある女性。
動脈性高血圧症(≧140/90mmHg);
HDL レベル > 0.9 mmol/l および/またはトリグリセリド > 2.8 mmol/l;
多嚢胞性卵巣症候群;
NTG と NGNT。
心血管疾患。
小児におけるT2DMの発生率が大幅に増加しているため、血糖値のスクリーニング判定が必要となっている 子供や青少年の間で(10年から2年間隔、または最初から)
思春期、それがより早い年齢で起こった場合)、子供を含む高リスクグループに属する 余分な体重がある(BMI および/または体重 > 85 パーセンタイルの年齢または体重が理想体重の 120% を超える) 以下の追加の危険因子のいずれか 2 つとの組み合わせ:
一親等または二親等の血縁者におけるCD-2。
高リスクの国籍に属している。
インスリン抵抗性に関連する臨床症状 (黒色表皮症、動脈性高血圧、脂質異常症);
母親の糖尿病(妊娠糖尿病を含む)。
鑑別診断
DM-2 と DM-1 の鑑別診断は臨床的に最も重要であり、その原則は 7.5 項で説明されています (表 7.6)。 示されているように、ほとんどの場合、それは臨床データに基づいています。 糖尿病の種類の特定が難しい場合、または遺伝性症候群の枠組み内を含め、糖尿病のまれな変異型の疑いがある場合、答えるべき最も重要な実際的な問題は、患者がインスリン療法を必要とするかどうかです。
処理
DM2 の治療の主な要素は、食事療法、身体活動の増加、血糖降下療法、DM の晩期合併症の予防と治療です。 ほとんどの T2DM 患者は肥満であるため、食事は減量 (低カロリー) と晩期合併症、主に大血管症 (アテローム性動脈硬化) の予防を目的とすべきです。 低カロリーダイエット過剰体重(BMI 25 ~ 29 kg/m2)または肥満(BMI > 30 kg/m2)のすべての患者に必要です。 ほとんどの場合、1日のカロリー摂取量を女性の場合は1000〜1200kcal、男性の場合は1200〜1600kcalに減らすことが推奨されます。 DM-2 の主な食品成分の推奨比率は DM-1 と同様です (炭水化物 - 65%、タンパク質 10 ~ 35%、脂肪 25 ~ 35%)。 使用 アルコール追加カロリーの重要な供給源となるため、制限する必要があり、また、治療中のアルコール摂取も制限する必要があります。
スルホニル尿素およびインスリンの摂取は、低血糖症の発症を引き起こす可能性があります (セクション 7.7.3 を参照)。
の推奨事項 身体活動を増やす個別化する必要があります。 最初は、30~45分間の中強度の有酸素運動(ウォーキング、水泳)を1日3~5回(週に約150分)行うことをお勧めします。 将来的には、体重の減少と正常化に大きく貢献する身体活動の段階的な増加が必要です。 さらに、身体活動はインスリン抵抗性を軽減し、血糖降下効果をもたらします。 血糖降下薬を処方せずに食事療法と身体活動の増加を組み合わせることで、T2DM 患者の約 5% で確立された目標 (表 7.3) に従って糖尿病代償を維持することが可能になります。
のための薬 低血糖療法 T2DM は 4 つの主なグループに分類できます。
I. インスリン抵抗性の軽減を助ける薬剤 (感作物質)。このグループには、メトホルミンおよびチアゾリジンジオンが含まれます。 メトホルミン現在使用されているグループの唯一の薬剤です ビグアニド。その作用メカニズムの主な構成要素は次のとおりです。
1. 肝臓での糖新生の抑制(肝臓によるグルコース産生の減少)。これにより、空腹時血糖値が低下します。
2. インスリン抵抗性の低下(末梢組織、主に筋肉によるグルコース利用の増加)。
3. 嫌気性解糖系の活性化と小腸でのグルコース吸収の減少。
メトホルミンは、2 型糖尿病、肥満、空腹時高血糖患者の血糖降下療法の第一選択薬です。 開始用量は夜間または夕食時に500mgです。 その後、用量を2〜3回に分けて2〜3グラムまで徐々に増やします。 副作用の中で消化不良 (下痢) は比較的よく見られますが、これは通常一過性であり、薬を服用してから 1 ~ 2 週間後に自然に消えます。 メトホルミンにはインスリン産生を刺激する効果がないため、この薬剤の単独療法中に低血糖は起こりません。
(その作用は低血糖ではなく抗高血糖として指定されます)。 メトホルミンの使用に対する禁忌は、妊娠、重度の心臓、肝臓、腎臓、その他の臓器不全、および他の原因による低酸素状態です。 上記の禁忌を考慮せずにメトホルミンが処方された場合に発生する非常にまれな合併症は、嫌気性解糖系の過剰活性化の結果である乳酸アシドーシスです。
チアゾリジンジオン(ピオグリタゾン、ロシグリタゾン) は、ペルオキシソーム増殖因子活性化受容体 γ (PPAR-γ) アゴニストです。 チアゾリジンジオンは、筋肉および脂肪組織におけるグルコースと脂質の代謝を活性化し、内因性インスリンの活性の増加につながります。 インスリン抵抗性(インスリン感作物質)を排除するため。 ピオグリタゾンの1日量は15〜30 mg /日、ロシグリタゾンは4〜8 mg(1〜2回用量)です。 チアゾリジンジオンとメトホルミンの組み合わせは非常に効果的です。 チアゾリジンジオンの使用に対する禁忌は、肝臓のトランスアミナーゼレベルの上昇(2.5倍以上)です。 肝毒性に加えて、チアゾリジンジオンの副作用には体液貯留や浮腫が含まれますが、これらは薬物をインスリンと組み合わせるとより頻繁に発生します。
II. 影響を与える薬物β -細胞を活性化し、インスリン分泌の増加を促進します。このグループには、主に食後の血糖値を正常化するために使用されるスルホニル尿素およびグリニド(食事時血糖調節剤)が含まれます。 メインターゲット スルホニル尿素(PSM) は膵島のβ細胞です。 PSM は、β 細胞膜上の特定の受容体に結合します。 これにより、ATP 依存性カリウム チャネルの閉鎖と細胞膜の脱分極が起こり、さらにカルシウム チャネルの開口が促進されます。 β細胞へのカルシウムの侵入は、β細胞の脱顆粒と血中へのインスリンの放出を引き起こします。 臨床現場では、血糖降下効果の持続時間と重症度が異なる非常に多くの PSM が使用されます (表 7.9)。
テーブル 7.9.スルホニル尿素
 PSM の主な、そしてかなり一般的な副作用は低血糖です (セクション 7.7.3 を参照)。 薬物の過剰摂取、その蓄積(腎不全)、
PSM の主な、そしてかなり一般的な副作用は低血糖です (セクション 7.7.3 を参照)。 薬物の過剰摂取、その蓄積(腎不全)、
食事療法(食事を抜く、飲酒)または養生法(PSMの用量を減らす前に、または炭水化物を摂取しなかった前の重大な身体活動)の不遵守。
グループへ グリニド(食時血糖調節剤)には次のものがあります。 レパグリニド(安息香酸誘導体; 1 日量 0.5 ~ 16 mg/日) および ナテグリニド(D-フェニルアラニン誘導体; 1日量180-540 mg/日)。 投与されると、薬物はβ細胞上のスルホニル尿素受容体と迅速かつ可逆的に相互作用し、その結果、正常なインスリン分泌の第一段階を模倣するインスリンレベルの短期間の上昇が引き起こされます。 薬は主食の10〜20分前に通常1日3回服用されます。
Ⅲ. 腸内でのブドウ糖の吸収を抑える薬。
このグループには、アカルボースとグアーガムが含まれます。 アカルボースの作用機序は、小腸におけるα-グリコシダーゼの可逆的遮断であり、その結果、炭水化物の一連の発酵と吸収のプロセスが遅くなり、肝臓へのグルコースの吸収と流入の速度が低下します。となり、食後の血糖値が下がります。 アカルボースの初期用量は 50 mg を 1 日 3 回、その後は用量を 100 mg を 1 日 3 回に増やすことができます。 薬は食事の直前または食事中に服用します。 アカルボースの主な副作用は腸の消化不良(下痢、鼓腸)であり、これは吸収されなかった炭水化物の結腸への侵入に関連しています。 アカルボースの血糖降下効果は非常に中程度です (表 7.10)。
臨床現場では、ほとんどの患者で空腹時高血糖と食後高血糖の両方が同時に検出されるため、錠剤型血糖降下薬は相互に、またインスリン薬と効果的に組み合わせられます。 たくさんあります 固定の組み合わせ 1錠に薬が入っています。 ほとんどの場合、メトホルミンは、チアゾリジンジオンと同様に、さまざまな PSM と 1 つの錠剤に組み合わされます。
テーブル 7.10。錠剤型血糖降下薬の作用機序と潜在的な有効性
 IV. インスリンおよびインスリン類似体
IV. インスリンおよびインスリン類似体
ある段階になると、T2DM 患者の最大 30 ~ 40% がインスリン製剤の投与を開始します。 2 型糖尿病に対するインスリン療法の適応については、セクション 7.4 の冒頭に記載されています。 T2DM 患者をインスリン療法に移行するための最も一般的な選択肢は、長時間作用型インスリン (NPH インスリン、グラルギン、またはデテミル) と血糖降下薬の錠剤を組み合わせて処方することです。 メトホルミンの処方によって空腹時血糖値を制御できない場合、または後者が禁忌である場合、患者は夕方(夜)のインスリン注射を処方されます。 錠剤を使用して空腹時血糖と食後血糖の両方を制御することが不可能な場合、患者はモノインスリン療法に移行します。 通常、T2DM の場合、インスリン療法はいわゆる次の手順に従って実行されます。 「伝統的な」スキームこれには、固定用量の長時間作用型インスリンと短時間作用型インスリンを処方することが含まれます。 このプランでは
1 つのボトルに短時間作用型 (超短時間作用型) と長時間作用型インスリンが入った標準インスリン混合物が便利です。 従来のインスリン療法の選択は、T2DM の場合、インスリン投与量を独自に変更する方法を教えるのが難しい高齢の患者に処方されることが多いという事実によって決まります。 さらに、炭水化物代謝の代償を正常血糖に近いレベルに維持することが目的である集中インスリン療法は、低血糖のリスクを高めます。 軽度の低血糖は、若い患者では深刻なリスクを引き起こしませんが、低血糖を経験する閾値が低い高齢の患者では心血管に非常に悪影響を与える可能性があります。 若い T2DM 患者や、効果的な学習の有望な機会を持つ患者には、集中型のインスリン療法が処方される場合があります。
予報
T2DM 患者の障害と死亡の主な原因は晩期合併症 (セクション 7.8 を参照) であり、最も多くの場合は糖尿病性大血管障害です。 特定の晩期合併症を発症するリスクは、関連する章で説明されている複合的な要因によって決まります。 それらの発症の普遍的な危険因子は慢性高血糖です。 したがって、2 型糖尿病患者の HbA1c レベルが 1% 低下すると、全体の死亡率がそれぞれ約 20%、2%、3%、約 40% 減少します。
7.7. 糖尿病の急性合併症
7.7.1. 糖尿病性ケトアシドーシス
糖尿病性ケトアシドーシス (DKA)- インスリンの絶対的欠乏によって引き起こされるDM-1の代償不全。タイムリーな治療がなければ、ケトアシドーシス性昏睡(KC)および死に至る。
病因
DKAはインスリンの絶対的欠乏によって引き起こされます。 さまざまな重症度の DKA は、ほとんどの患者で T1DM の発現時に決定されます (DKA の全症例の 10 ~ 20%)。
T1DM の診断が確立されている患者では、主に感染症などの付随疾患を背景に、インスリン投与が患者自身によって中止されることが多く (DKA 症例の 13%)、T1DM の増加がない場合に DKA が発症することがあります。インスリン投与量
テーブル 7.11。糖尿病性ケトアシドーシス
 若い T1DM 患者における DKA 発症の最大 20% は、心理的問題および/または摂食障害 (体重増加に対する恐怖、低血糖に対する恐怖、10 代の問題) に関連しています。 多くの国で DKA のかなり一般的な原因は次のとおりです。
若い T1DM 患者における DKA 発症の最大 20% は、心理的問題および/または摂食障害 (体重増加に対する恐怖、低血糖に対する恐怖、10 代の問題) に関連しています。 多くの国で DKA のかなり一般的な原因は次のとおりです。
一部の層では薬剤費が高額であるため、患者自身がインスリンを中止することもある(表7.11)。
病因
DKA の病因は、グルカゴン、カテコールアミン、コルチゾールなどの対島ホルモンの産生の増加と組み合わされたインスリンの絶対的な欠乏に基づいています。 その結果、肝臓によるグルコースの産生が大幅に増加し、末梢組織によるグルコースの利用が阻害され、高血糖が増加し、細胞外空間の浸透圧が侵害されます。 インスリン欠乏症と DKA の相対的に過剰な禁制ホルモンの組み合わせにより、遊離脂肪酸が循環中に放出され (脂肪分解)、肝臓でそれらが制御されずにケトン体 (β-ヒドロキシ酪酸、アセト酢酸、アセトン) に酸化され、その結果、高ケトン血症の発症、その後の代謝性アシドーシス。 重度の糖尿の結果として、浸透圧利尿、脱水、ナトリウム、カリウム、その他の電解質の喪失が発生します(図7.9)。
疫学
DKA の新規症例の発生率は、1 型糖尿病患者 1,000 人あたり年間 5 ~ 8 人であり、糖尿病患者に対する医療組織のレベルに直接依存します。 米国では毎年約 100,000 人が DKA で入院しており、入院 1 人あたりの費用は 13,000 ドルで、DKA の入院治療には年間 10 億ドル以上が費やされています。 2005 年のロシア連邦では、DKA は小児の 4.31%、青少年の 4.75%、成人の T1DM 患者の 0.33% で記録されました。
臨床症状
DKA の発症には、原因に応じて数週間から 1 日かかる場合があります。 ほとんどの場合、DKA には非代償性糖尿病の症状が先行しますが、発症する時間がない場合もあります。 DKA の臨床症状には、多尿、多飲、体重減少、びまん性腹痛 (「糖尿病性偽腹膜炎」)、脱水、重度の脱力感、呼気からのアセトン臭 (またはフルーティーな臭い)、および徐々に意識が混濁するなどがあります。 最近では、早期診断により、DKA による真性昏睡が発症することは比較的まれです。 身体検査で脱水症状の兆候が判明: 減少
 米。 7.9. ケトアシドーシス性昏睡の病因
米。 7.9. ケトアシドーシス性昏睡の病因
皮膚の膨満と眼球の密度、頻脈、低血圧。 進行した場合には、クスマウル呼吸が発生します。 DKA 患者の 25% 以上が嘔吐を発症し、その色はコーヒーかすに似ている場合があります。
診断
臨床画像データ、患者が 1 型糖尿病であることの兆候、および臨床検査データに基づいています。 DKA は、高血糖 (場合によっては軽度)、ケトン尿症、代謝性アシドーシス、高浸透圧を特徴とします (表 7.12)。
テーブル 7.12。糖尿病の急性合併症の臨床検査診断
 糖尿病の急性代償不全患者を検査する場合、有効浸透圧モル濃度の計算に基づいて、血糖、クレアチニン、尿素、電解質のレベルを測定する必要があります。 さらに、酸塩基状態の評価も必要です。 有効浸透圧濃度(EO) は次の式を使用して計算されます: 2 *。 通常、EO は 285 ~ 295 mOsm/l です。
糖尿病の急性代償不全患者を検査する場合、有効浸透圧モル濃度の計算に基づいて、血糖、クレアチニン、尿素、電解質のレベルを測定する必要があります。 さらに、酸塩基状態の評価も必要です。 有効浸透圧濃度(EO) は次の式を使用して計算されます: 2 *。 通常、EO は 285 ~ 295 mOsm/l です。
DKA 患者のほとんどは、 白血球増加症、その重症度は血液中のケトン体のレベルに比例します。 レベル ナトリウム、一般に、高血糖に応じて細胞内空間から細胞外空間への体液の浸透圧流出によって減少します。 あまり一般的ではありませんが、重度の高血圧症の結果としてナトリウム濃度が誤って低下することがあります。
中性脂肪血症。 レベル カリウム血清レベルは、最初は細胞外空間からの移動により増加する可能性があります。
鑑別診断
糖尿病患者における意識喪失のその他の原因。 高浸透圧性昏睡との鑑別診断は、原則として困難を引き起こすことはなく(T2DM の高齢患者に発症する)、臨床的にあまり重要ではありません。 どちらの症状の治療原則も同様です。 糖尿病患者の意識喪失の原因を迅速に特定することができない場合は、ブドウ糖を投与することが推奨されます。 低血糖状態ははるかに一般的であり、グルコース投与自体を背景とした急速なポジティブなダイナミクスにより、意識喪失の原因を見つけることが可能になります。
処理
DKA の治療には、水分補給、高血糖の是正、電解質障害、さらには糖尿病の代償不全を引き起こした疾患の治療が含まれます。 治療は専門の医療機関の集中治療室で最適に行われます。 重篤な心臓病変を併発していない成人患者の場合、たとえ入院前の段階であっても、最優先の対策として 水分補給等張液(0.9% NaCl)を 1 時間あたり約 1 リットル(体重 1 キログラムあたり 1 時間あたり約 15 ~ 20 ml)の速度で投与することが推奨されます。 体液不足の完全な補填(DKA では体重 1 kg あたり 100 ~ 200 ml)は、治療初日以内に達成される必要があります。 心不全または腎不全を伴う場合は、この期間を延長する必要があります。 小児の場合、水分補給療法に推奨される等張液の量は、1 時間あたり体重 1 kg あたり 10 ~ 20 ml ですが、最初の 4 時間は体重 1 kg あたり 50 ml を超えてはなりません。 約 48 時間後に完全に水分補給することをお勧めします。 並行したインスリン療法を背景に血糖値が約 14 mmol/l に低下した後、10% ブドウ糖溶液の輸血に切り替え、水分補給を続けます。
「少量」という概念が現在受け入れられている インスリン DKAの治療中。 短時間作用型インスリンのみが使用されます。 静脈内インスリンの最も最適な使用法は次のとおりです。
リナ。 インスリンの筋肉内投与は効果が低いが、DKA が中程度の重症度で、血行動態が安定しており、静脈内治療が不可能な場合にのみ可能である。 後者の場合、腹直筋に注射を行いますが、インスリン注射器に筋肉注射針を取り付け(確実に筋肉内注射するため)、この針を使用してバイアルから注射器にインスリンを引き込みます。
インスリンの静脈内投与にはいくつかの選択肢があります。 まず、インスリンを点滴システムの「ゴムバンド」に注入し、必要な量のインスリンをインスリン注射器に引き込み、その後、1 mlの等張液をそれに加えます。 血糖値が 14 mmol/l に達するまで、患者には 1 時間ごとに 6 ~ 10 単位の短時間作用型インスリンが投与されます。 さらに遠く (再水和溶液を等張から10%グルコースに変更するのと並行して)時間ごとに決定される血糖指標に応じて、インスリン投与量は 1 時間あたり 4 ~ 8 単位に減らされます。 推奨される血糖値の低下速度は、1 時間あたり 5 mmol/l を超えてはなりません。 静脈内インスリン療法の別の選択肢には、灌流器の使用が含まれます。 灌流器用の溶液を調製するには、以下の比率で進めてください: 20% ヒトアルブミン溶液 2 ml を 50 U の短時間作用型インスリンに添加し、その後 50 mg の 0.9% 等張液を添加します。 インスリンの筋肉内投与が選択された場合、最初に20単位の短時間作用型インスリンが投与され、その後1時間ごとに6単位が投与され、血糖値が14 mmol/lに達した後、用量は1時間あたり4単位に減らされます。 血行動態が完全に安定化し、酸塩基障害が補償された後、患者は皮下インスリン注射に移行します。
示されているように、重要な点にもかかわらず、 カリウム欠乏症体内では(総損失 3 ~ 6 mmol/kg)、DKA を使用すると、インスリン療法の開始前のレベルがわずかに増加する可能性があります。 ただし、血漿カリウム濃度が 5.5 mmol/L 未満の場合は、インスリン療法の開始と同時に塩化カリウム溶液の輸血を開始することが推奨されます。 カリウム欠乏症の正常な矯正は、pHの正常化を背景にしてのみ起こります。 低い pH では、細胞へのカリウムの流れが大幅に減少するため、可能であれば、輸血される塩化カリウムの用量を特定の pH 値に適合させることが推奨されます (表 7.13)。
テーブル 7.13。カリウム欠乏症の是正スキーム
 ※計算には以下のデータを使用します。
※計算には以下のデータを使用します。
1 g KCl = 13.4 ミリモル; 1 mmol KCl = 0.075 g KS1 の 4% 溶液中: 100 ml 中に 4 g の KS1、25 ml 中に 1 g の KS1、10 ml 中に 0.4 g の KS1。
糖尿病の代償不全は、多くの場合、次のような原因で引き起こされます。 感染症(腎盂腎炎、糖尿病性足症候群における感染性潰瘍、肺炎、副鼻腔炎など)。 DKA の場合、目に見える感染源がない場合でも、体温の上昇は典型的なものではないため、微熱または発熱のあるほぼすべての患者に抗生物質療法が処方されるという規則があります。 DKA。
予報
DKA の死亡率は 0.5 ~ 5% で、ほとんどの症例は遅れた不適格な医療によるものです。 死亡率は高齢患者で最も高い(最大50%)。
7.7.2. 高浸透圧性昏睡
高浸透圧性昏睡(GOC) は、T2DM のまれな急性合併症であり、絶対的なインスリン欠乏がない状態で重度の脱水症と高血糖の結果として発症し、高い死亡率を伴います (表 7.14)。
病因
GOC は通常、T2DM の高齢患者で発症します。 このような患者は、ほとんどの場合、孤独で、何のケアも受けずに生活し、自分の状態や自制心を無視し、水分摂取も不十分です。 多くの場合、代償不全は感染症(糖尿病性足症候群、肺炎、急性腎盂腎炎)、脳疾患によって引き起こされます。
血液循環やその他の状態により、患者は動きが悪くなり、血糖降下薬や水分を摂取しません。
テーブル 7.14。高浸透圧性昏睡(HOC)
 病因
病因
高血糖と浸透圧利尿の増加は重度の脱水を引き起こしますが、上記の理由により脱水は外部から補給されません。 高血糖と脱水の結果、血漿高浸透圧が起こります。 GOC の病因の不可欠な要素は、インスリンの相対的欠乏と禁制ホルモンの過剰であるが、T2DM で持続する残留インスリン分泌は脂肪分解とケト生成を抑制するのに十分であり、その結果ケトアシドーシスの発症は起こらない。起こる。
場合によっては、組織の低灌流を背景とした高乳酸血症の結果として中程度のアシドーシスが検出されることがあります。 重度の高血糖では、脳脊髄液の浸透圧バランスを維持するために、脳細胞からのナトリウム含有量が増加し、代わりにカリウムが入ります。 神経細胞の膜貫通電位が破壊されます。 進行性の昏迷は、けいれん症候群と組み合わせて発生します(図7.10)。
疫学
GOC は、成人および高齢の T2DM 患者における急性高血糖状態の 10 ~ 30% を占めます。 症例の約 2/3 で、これまで診断されていなかった糖尿病患者に GOC が発症します。
臨床症状
高浸透圧性昏睡の臨床像の特徴は次のとおりです。
脱水と低灌流の一連の兆候と合併症:喉の渇き、粘膜の乾燥、頻脈、動脈性低血圧、吐き気、脱力感、ショック。
局所発作および全般発作。
発熱、吐き気、嘔吐 (症例の 40 ~ 65%);
付随する病気や合併症には、深部静脈血栓症、肺炎、脳血管障害、胃不全麻痺などが含まれることがよくあります。
診断
臨床像、患者の年齢、2 型糖尿病の病歴、ケトン尿症およびケトアシドーシスを伴わない重度の高血糖に基づいています。 GOC の典型的な臨床検査所見を表に示します。 7.12。
 米。 7 .10.
高浸透圧性昏睡の病因
米。 7 .10.
高浸透圧性昏睡の病因
鑑別診断
糖尿病患者で発症するその他の急性症状は、ほとんどの場合病理を併発し、糖尿病の重度の代償不全につながります。
処理
GOC の治療とモニタリングは、いくつかの特徴を除いて、ケトアシドーシス性糖尿病性昏睡について説明されているものと変わりません (セクション 7.7.1)。
初期水分補給量が多くなり、最初の 1 時間あたり 1.5 ~ 2 リットル。 2時間目と3時間目に1リットル、その後500ml/時間の等張塩化ナトリウム溶液。
カリウム含有溶液の投与の必要性は、通常、ケト酸性昏睡よりも高くなります。
インスリン療法はCCの場合と似ていますが、インスリンの必要性は少なく、脳浮腫の発症を避けるために血糖値は1時間あたり5 mmol/l以下に下げる必要があります。
低張液 (NaCl 0.45%) の投与は避けるのが最善です (重度の高ナトリウム血症: > 155 mmol/l および/または実効浸透圧 > 320 mOsm/l の場合のみ)。
重炭酸塩を投与する必要はありません(pH のあるアシドーシスの専門集中治療室でのみ)< 7,1).
予報
GOC による死亡率は高く、15 ~ 60% の範囲です。 予後が最も悪いのは、糖尿病の代償不全やGOCの発症の原因となることが多い、重篤な病状を併発している高齢患者です。
7.7.3. 低血糖症
低血糖症- 血清グルコースレベルの低下(<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
病因
インスリンとその類似体、スルホニル尿素の過剰摂取。
血糖降下療法が変化していないことを背景とした不十分な食物摂取。
アルコール飲料を飲む。
継続的な血糖降下療法を背景とした身体活動、および/または炭水化物の追加摂取を伴わない身体活動。
血糖降下療法を変えずに(TSPの摂取継続と蓄積を背景に)、糖尿病の遅発性合併症(胃不全麻痺を伴う自律神経障害、腎不全)および他の多くの疾患(副腎不全、甲状腺機能低下症、肝不全、悪性腫瘍)の発症腎不全の場合、同じ用量のインスリンを維持する)。
インスリン投与技術の違反(皮下注射ではなく筋肉注射)。
人為的低血糖症(患者自身による血糖降下薬の意図的な過剰摂取)。
器質性高インスリン症 - インスリノーマ (10.3 項を参照)。
病因
低血糖の病因は、血液中へのグルコースの流入、その利用、インスリンおよび抗島ホルモンのレベルの間の不均衡である。 通常、血糖値が 4.2 ~ 4.7 mmol/l の範囲では、β 細胞からのインスリンの産生と放出が抑制されます。 血糖値が 3.9 mmol/l 未満に低下すると、対島ホルモン (グルカゴン、コルチゾール、成長ホルモン、アドレナリン) の産生が刺激されます。 神経糖減少症の症状は、血糖値が 2.5 ~ 2.8 mmol/l 未満に低下すると発症します。 過剰摂取の場合 インスリンおよび/または薬物 スルホニル尿素低血糖症は、外因性または内因性ホルモンの直接的な血糖降下作用により発症します。 スルホニル尿素薬を過剰摂取した場合、一部の薬の作用時間は 1 日以上に達するため、発作を止めた後に低血糖症状が何度も再発することがあります。 インスリン産生を刺激する作用を持たないTSP(メトホルミン、チアゾリジンジオン)は、それ自体で低血糖を引き起こすことはありませんが、スルホニル尿素またはインスリンに添加される場合、後者を同じ用量で摂取すると、低血糖物質の蓄積により低血糖を引き起こす可能性があります。併用療法の効果 (表 7.15)。
テーブル 7.15。低血糖症
 テーブルの終わり。 7.15
テーブルの終わり。 7.15
 入学時 アルコール低血糖を防ぐ最も重要な因子である肝臓での糖新生が抑制されます。 体操インスリン非依存性のグルコース利用を促進します。そのため、変化のない血糖降下療法を背景に、および/または追加の炭水化物摂取がない場合、低血糖を引き起こす可能性があります。
入学時 アルコール低血糖を防ぐ最も重要な因子である肝臓での糖新生が抑制されます。 体操インスリン非依存性のグルコース利用を促進します。そのため、変化のない血糖降下療法を背景に、および/または追加の炭水化物摂取がない場合、低血糖を引き起こす可能性があります。
疫学
集中インスリン療法を受けている 1 型糖尿病患者における軽度ですぐに回復する低血糖は、週に数回発生することがありますが、比較的無害です。 集中インスリン療法を受けている患者ごとに、重度の低血糖症が年に 1 件発生します。 ほとんどの場合、低血糖は夜間に発症します。 2 型糖尿病では、インスリンを投与されている患者の 20%、スルホニルウレア剤を投与されている患者の 6% が、10 年間に少なくとも 1 回重度の低血糖を発症します。
臨床症状
症状には主に 2 つのグループがあります。1 つは交感神経系の活性化と副腎によるアドレナリンの放出に関連するアドレナリン作動性症状、もう 1 つは主要なエネルギー基質の欠乏を背景とした中枢神経系の機能不全に関連する神経糖減少症です。 。 に アドレナリン作動性症状には以下が含まれます:頻脈、散瞳。 不安、攻撃性。 震え、冷や汗、感覚異常。 吐き気、ひどい空腹感、唾液分泌過多。 下痢、多尿。 に 神経糖減少症症状には無力症が含まれます。
集中力の低下、頭痛、恐怖、混乱、見当識障害、幻覚。 言語障害、視覚障害、行動障害、健忘症、意識障害、けいれん、一過性麻痺、昏睡。 低血糖がより重篤になるにつれて、症状の重症度と一連の症状の間には明確な関係がない可能性があります。 アドレナリン作動性症状のみ、または神経糖減少症のみが発生する場合もあります。 場合によっては、正常血糖の回復と治療の継続にもかかわらず、患者は数時間または場合によっては数日間、昏睡状態または昏睡状態に陥ることもあります。 長期にわたる低血糖またはその頻繁な発症は、中枢神経系(主に大脳皮質)に不可逆的な変化を引き起こす可能性があり、その症状はせん妄や幻覚妄想エピソードから典型的なてんかん発作まで大きく異なり、その必然的な結果は持続性認知症です。 。
高血糖は、軽度の低血糖のエピソードよりも患者の主観的には容易に許容されます。 したがって、多くの患者は、低血糖を恐れて、血糖を比較的高いレベルに維持する必要があると考えるが、これは実際には疾患の代償不全に相当する。 この固定観念を克服するには、医師や研修スタッフの多大な努力が必要になる場合があります。
診断
低血糖値の検査(通常は血糖計を使用)による検査と組み合わせた、糖尿病患者の低血糖の臨床像。
鑑別診断
意識喪失につながるその他の原因。 糖尿病患者の意識喪失の原因が不明であり、血糖値の迅速な分析を行うことができない場合には、ブドウ糖投与が必要となります。 糖尿病患者において頻繁に起こる低血糖症の原因を突き止める必要があることがよくあります。 ほとんどの場合、それらは不適切な血糖降下療法と患者の病気に関する知識レベルの低さが原因です。 悪性腫瘍を含む多くの病気(副腎不全、甲状腺機能低下症、腎不全および肝不全)は、完全な廃止(「糖尿病の消滅」)に至るまで、血糖降下療法の必要性の減少につながる可能性があることを覚えておく必要があります。 。
処理
患者に意識があり自力で回復できる軽度の低血糖を治療するには、通常、パン 1 ~ 2 単位(ブドウ糖 10 ~ 20 g)の量の炭水化物を含む食品または液体を摂取するだけで十分です。 この量は、例えば甘い果汁 200 ml に含まれます。 液体の状態ではブドウ糖がより早く吸収されるため、飲み物は低血糖をより効果的に緩和します。 炭水化物の摂取を続けても症状の悪化が続く場合は、ブドウ糖の静脈内投与またはグルカゴンの筋肉注射が必要です。 意識喪失を伴って発生する重度の低血糖も同様の方法で治療されます。 この場合、患者には約50mlが投与されます。 40% ブドウ糖溶液を静脈内投与します。ブドウ糖の投与は、発作が止まり血糖が正常化するまで続けなければなりませんが、原則として100ml以上の大量投与は必要ありません。 グルカゴン筋肉内または皮下に(通常は工場で準備された充填済みの注射器を使用して)投与されます。 数分後、グルカゴンによるグリコーゲン分解の誘導により、血糖レベルは正常に戻ります。 しかし、これは常に起こるわけではありません。血中のインスリン濃度が高いと、グルカゴンは効果がありません。 グルカゴンの半減期はインスリンの半減期よりも短いです。 アルコール依存症や肝疾患ではグリコーゲン合成が障害されており、グルカゴン投与が効果がない場合があります。 グルカゴン投与の副作用として嘔吐があり、誤嚥の危険が生じます。 患者の親族がグルカゴン注射の技術を習得することをお勧めします。
予報
訓練を受けた患者の軽度の低血糖は、病気が十分に補償されているため安全です。 頻繁な低血糖は、糖尿病の代償が不十分であることの兆候です。 ほとんどの場合、そのような患者は多かれ少なかれ重度の高血糖を起こし、残りの日は糖化ヘモグロビンレベルが高くなります。 糖尿病の遅発性合併症を患う高齢患者では、低血糖が心筋梗塞、脳卒中、網膜出血などの血管合併症を引き起こす可能性があります。 低血糖性昏睡は、適切な治療と迅速な意識の回復があれば、最長 30 分間持続し、原則として合併症や影響はありません。
7.8. 糖尿病の晩期合併症
どちらのタイプの糖尿病でも晩期合併症が発生します。 臨床的には、糖尿病には主に 5 つの晩期合併症があります: 大血管症、腎症、網膜症、神経障害、および糖尿病性足症候群です。 特定の種類の糖尿病における晩期合併症の非特異性は、その主な病因関係が慢性高血糖であるという事実によって決まります。 この点に関して、T1DM の発現時には、患者に晩期合併症がほとんど発生せず、治療の有効性に応じて、数年、数十年かけて発症します。 一般に、T1DM の最大の臨床的意義は次のとおりです。 糖尿病性細血管症(腎症、網膜症)および神経障害(糖尿病性足症候群)。 逆に、T2DM では晩期合併症が診断時にすでに検出されていることがよくあります。 第一に、これは、T2DM が診断が下されるずっと前に現れるという事実によるものです。 第二に、大血管症として臨床的に現れるアテローム性動脈硬化症には、糖尿病と多くの共通の病因関係があります。 T2DM では、原則として、最大の臨床的意義は糖尿病患者によって獲得されます。 大血管症、これは診断時に大多数の患者で検出されます。 それぞれの具体的なケースにおいて、遅発性合併症の種類と重症度は、病気の罹患期間が長いにもかかわらず、矛盾した完全な欠如から、考えられるすべての選択肢を組み合わせた重篤な状態までさまざまです。
晩期合併症は、 主な死因糖尿病患者であり、その有病率を考慮すると、糖尿病はほとんどの国で最も重要な医学的および社会的健康問題です。 これによると 治療の主な目標糖尿病患者の観察は、晩期合併症の(一次、二次、三次)予防につながります。
7.8.1. 糖尿病性大血管症
糖尿病性大血管症- 糖尿病における大動脈のアテローム性動脈硬化病変を統合する集合的な概念。
臨床的には、冠状動脈性心疾患(CHD)、脳血管の閉塞性アテローム性動脈硬化症、下肢、内臓、および動脈性高血圧によって現れます(表7.16)。
テーブル 7.16。糖尿病性大血管症
 病因と病因
病因と病因
おそらく、糖尿病ではない人のアテローム性動脈硬化の病因と病因に似ています。 アテローム性動脈硬化プラークは、糖尿病のある人とない人の顕微鏡構造に違いはありません。 ただし、糖尿病では、追加の危険因子が浮上したり、既知の非特異的因子が悪化したりする可能性があります。 糖尿病には次のようなものがあります。
1. 高血糖。これはアテローム性動脈硬化症の発症の危険因子です。 T2DM患者のHbA1cレベルが1%増加すると、
心筋梗塞を発症するリスクは15%あります。 高血糖のアテローム生成効果のメカニズムは完全には明らかではありませんが、おそらく、LDL 代謝の最終生成物および血管壁のコラーゲンのグリコシル化に関連していると考えられます。
2. 動脈性高血圧症(AG)。 病因では、腎臓の成分が非常に重要視されます (糖尿病性腎症)。 2 型糖尿病における高血圧は、高血糖と同様に心臓発作や脳卒中の重大な危険因子です。
3. 脂質異常症。高インスリン血症は、2 型糖尿病におけるインスリン抵抗性の不可欠な要素であり、HDL レベルの低下、トリグリセリド レベルの増加、密度の低下を引き起こします。 LDLのアテローム生成性の増加。
4. 肥満、ほとんどの T2DM 患者が苦しんでいますが、これはアテローム性動脈硬化症、心筋梗塞、脳卒中の独立した危険因子です (セクション 11.2 を参照)。
5. インスリン抵抗性。高インスリン血症および高レベルのインスリンプロインスリン様分子は、内皮機能不全に関連している可能性があるアテローム性動脈硬化症を発症するリスクを高めます。
6. 血液凝固障害。糖尿病では、フィブリノーゲン、血小板阻害剤活性化因子、およびフォン・ヴィレブランド因子のレベルの増加が測定され、その結果、血液凝固系の血栓促進状態が形成されます。
7. 内皮機能不全、プラスミノーゲン阻害剤活性化因子および細胞接着分子の発現の増加を特徴とします。
8. 酸化ストレス、酸化LDLおよびF2イソプロスタンの濃度の増加につながります。
9. 全身性炎症フィブリノーゲンと C 反応性タンパク質の発現が増加します。
2 型糖尿病における冠動脈疾患の発症の最も重大な危険因子は、LDL レベルの上昇、HDL レベルの低下、動脈性高血圧、高血糖、喫煙です。 糖尿病におけるアテローム性動脈硬化プロセスの違いの 1 つは、その進行がより広範囲に及ぶことです。 咬合性病変の遠位側の性質、それらの。 このプロセスには比較的細い動脈が関与することが多く、これが外科的治療を複雑にし、予後を悪化させます。
疫学
2 型糖尿病の人が冠状動脈性心疾患を発症するリスクは、糖尿病でない人に比べて 6 倍高くなりますが、男性と女性では同じです。 動脈性高血圧は、1 型糖尿病患者の 20%、2 型糖尿病患者の 75% で検出されます。 一般に、糖尿病患者では、糖尿病でない人に比べて2倍の頻度で糖尿病が発生します。 末梢血管の閉塞性アテローム性動脈硬化症は、糖尿病患者の 10% で発生します。 脳血管の血栓塞栓症は、糖尿病患者の 8% で発生します (糖尿病でない人の 2 ~ 4 倍の頻度)。
臨床症状
基本的には糖尿病でない人と変わりません。 T2DM の臨床像では、大血管合併症 (心筋梗塞、脳卒中、脚の血管の閉塞性病変) がしばしば前面に出てきます。また、それらの合併症の発症により、患者の高血糖が最初に検出されることがよくあります。 おそらく付随する自律神経障害のため、糖尿病患者の心筋梗塞の最大 30% が、典型的な狭心症発作(無痛性梗塞)を伴わずに発生します。
診断
アテローム性動脈硬化症の合併症(冠状動脈性心疾患、脳血管障害、脚の動脈の閉塞病変)を診断するための原則は、糖尿病でない人の診断原則と変わりません。 測定 血圧(血圧) は、糖尿病患者が医師を訪れるたびに実施され、指標が決定される必要があります。 脂質スペクトル糖尿病の血液検査(総コレステロール、中性脂肪、LDL、HDL)は、少なくとも年に1回実施する必要があります。
鑑別診断
他の心血管疾患、症候性動脈性高血圧症、二次性脂質異常症。
処理
♦ 血圧制御。糖尿病における適切な収縮期血圧は 130 mmHg 未満、拡張期血圧は 80 mmHg です (表 7.3)。 ほとんどの患者は、この目標を達成するために複数の降圧薬を必要とします。 糖尿病の降圧療法に選択される薬剤は ACE 阻害薬とアンジオテンシン受容体拮抗薬で、必要に応じてサイアザイド系利尿薬が補充されます。 心筋梗塞を起こした糖尿病患者に選択される薬剤はβ遮断薬です。
♦ 脂質異常症の矯正。脂質スペクトル指標の目標レベルを表に示します。 7.3. 脂質低下療法に選択される薬剤は、3-ヒドロキシ-3-メチルグルタリル-CoA レダクターゼ阻害剤 (スタチン) です。
♦ 抗血小板療法。アスピリン療法(75~100mg/日)は、心血管病理(複雑な家族歴、動脈性高血圧、喫煙、脂質異常症、微量アルブミン尿)を発症するリスクが高い40歳以上の糖尿病患者、および以下のすべての患者に適応されます。二次予防としてのアテローム性動脈硬化症の臨床症状。
♦ 冠動脈疾患のスクリーニングと治療。冠動脈疾患を除外するための負荷試験は、心血管疾患の症状がある患者や、心電図によって病理が検出された場合に適用されます。
予報
T2DM患者の75%、T1DM患者の35%が心血管疾患で死亡しています。 T2DM患者の約50%は冠動脈疾患の合併症で死亡し、15%は脳血栓塞栓症で死亡します。 糖尿病患者の心筋梗塞による死亡率は50%を超えています。
7.8.2. 糖尿病性網膜症
糖尿病性網膜症(DR) - 網膜血管の微小血管症。微小動脈瘤、出血、滲出性変化、新たに形成された血管の増殖を特徴とし、部分的または完全な視力喪失につながります (表 7.17)。
病因
DR 発症の主な病因は慢性高血糖です。 他の要因(動脈性高血圧、脂質異常症、喫煙、妊娠など)はそれほど重要ではありません。
病因
DR の発症における主な関連性は次のとおりです。
網膜血管の微小血管症。低灌流の発症に伴い血管内腔が狭くなります。
微小動脈瘤の形成を伴う血管変性。
進行性の低酸素症、血管の増殖を刺激し、網膜の脂肪変性とカルシウム塩の沈着を引き起こします。
テーブル 7.17。糖尿病性網膜症
 滲出液を伴う微小梗塞。柔らかい「綿ウールの斑点」の形成につながります。
滲出液を伴う微小梗塞。柔らかい「綿ウールの斑点」の形成につながります。
高密度の滲出液の形成を伴う脂質の沈着。
網膜内でシャントや動脈瘤の形成を伴う増殖性血管の増殖が起こり、静脈の拡張と網膜低灌流の悪化を引き起こします。
虚血がさらに進行すると、浸潤物や瘢痕が形成される盗み現象。
虚血性崩壊および硝子体網膜牽引の形成の結果としての網膜剥離。
出血性梗塞、大規模な血管浸潤、および動脈瘤の破裂に起因する硝子体出血。
虹彩の血管の増殖(糖尿病性ルベオーシス)、続発性緑内障の発症につながります。
網膜浮腫を伴う黄斑症。
疫学
DR は先進国の労働人口の間で失明の最も一般的な原因であり、DM 患者が失明するリスクは一般集団の 10 ~ 20 倍です。 T1DM の診断時には、ほとんどの患者で DR は検出されませんが、5 年後には 8% の患者で DR が検出され、30 年の糖尿病経験があると 98% の患者で DR が検出されます。 T2DM の診断時に、患者の 20 ~ 40% で DR が検出され、T2DM 歴 15 年の患者では 85% で DR が検出されます。 DM-1では増殖性網膜症が比較的一般的であり、DM-2では黄斑症(黄斑症症例の75%)がより一般的です。
臨床症状
一般に受け入れられている分類によれば、DR には 3 つの段階があります。
(表7.18)。
診断
網膜写真撮影を伴う直接眼底検査を含む完全な眼科検査は、T1DM 患者には病気の発症後 3 ~ 5 年が必要であり、T2DM 患者には診断直後に必要となります。 将来的には、このような研究を毎年繰り返す必要があります。
テーブル 7.18。糖尿病網膜症の分類
 鑑別診断
鑑別診断
糖尿病患者におけるその他の眼疾患。
処理
糖尿病性網膜症およびその他の晩期合併症の治療の基本原則は、糖尿病を最適に補償することです。 糖尿病網膜症を治療し、失明を予防する最も効果的な方法は次のとおりです。 レーザー光凝固。目的
 米。 7.11。糖尿病性網膜症:
米。 7.11。糖尿病性網膜症:
a) 非増殖性。 b) 前増殖性。 c) 増殖性
レーザー光凝固は、新たに形成された血管の機能の停止であり、血眼症、牽引性網膜剥離、虹彩ルベオーシス、続発性緑内障などの重篤な合併症の発症の主な脅威となります。
予報
糖尿病患者の2%(1型糖尿病患者の3~4%、2型糖尿病患者の1.5~2%)で失明が記録されています。 DR に関連する新たな失明症例の推定発生率は、人口 100,000 人あたり年間 3.3 例です。 1 型糖尿病では、HbA1c を 7.0% に下げると、DR を発症するリスクが 75% 減少し、DR が進行するリスクが 60% 減少します。 2 型糖尿病では、HbA1c が 1% 低下すると、DR を発症するリスクが 20% 低下します。
7.8.3. 糖尿病性腎症
糖尿病性腎症(DNF) は、尿路感染症、心不全などが存在しない糖尿病患者におけるアルブミン尿 (1 日あたり 300 mg を超えるアルブミン尿、または 1 日あたり 0.5 g を超えるタンパク質尿) および/または腎濾過機能の低下として定義されます。腎臓病。 微量アルブミン尿は、30 ~ 300 mg/日または 20 ~ 200 mcg/分のアルブミン排泄として定義されます。
病因と病因
DNF の主な危険因子は、両親の糖尿病の持続期間、慢性高血糖、動脈性高血圧、脂質異常症、腎臓病です。 DNF では、最初に影響を受けるのは次のとおりです。 糸球体装置腎臓
1. 考えられるメカニズムの 1 つは、 高血糖糸球体損傷の進行を促進し、グルコース代謝のポリオール経路の活性化によるソルビトール、および多くの高度な糖化最終生成物の蓄積です。
2. 血行力学的障害、すなわち、 糸球体内高血圧症(腎臓の糸球体内の血圧上昇)は病因の必須要素です
糸球体内高血圧症の原因は、細動脈の緊張の違反、つまり求心性動脈の拡張と遠心性動脈の狭窄です。
テーブル 7.19。糖尿病性腎症
 これは、アンジオテンシン-2 やエンドセリンなどの多くの体液性因子の影響下で、また糸球体基底膜の電解質特性の違反によって発生します。 さらに、糸球体内高血圧は全身性高血圧によって促進され、DNF 患者の大多数で検出されます。 糸球体内高血圧症により、基底膜や濾過孔の損傷が起こり、
これは、アンジオテンシン-2 やエンドセリンなどの多くの体液性因子の影響下で、また糸球体基底膜の電解質特性の違反によって発生します。 さらに、糸球体内高血圧は全身性高血圧によって促進され、DNF 患者の大多数で検出されます。 糸球体内高血圧症により、基底膜や濾過孔の損傷が起こり、
そこを通って痕跡が浸透し始める (微量アルブミン尿)、そして大量のアルブミン (タンパク尿)。基底膜の肥厚は電解質特性の変化を引き起こし、それ自体、濾過細孔のサイズに変化がない場合でも、限外濾過液に入るアルブミンの量が増加します。
3. 遺伝的素因。動脈性高血圧症は、DNF 患者の血縁者で発生する頻度が高くなります。 DNF と ACE 遺伝子多型の間に関連性があるという証拠があります。 DNF を使用すると、糸球体基底膜の肥厚、メサンギウムの拡張、および輸入細動脈と輸出細動脈の線維性変化が顕微鏡的に明らかになります。 臨床的に慢性腎不全(CRF)に相当する最終段階では、限局性(キンメルシュティール・ウィルソン)、そしてびまん性糸球体硬化症が判定されます。
疫学
微量アルブミン尿は、T1DM 発症後 5 ~ 15 年後に患者の 6 ~ 60% で検出されます。 DNF は T1DM 患者の 35% で検出され、男性および 15 歳未満で T1DM を発症した人々に多く見られます。 T2DM では、白人の 25%、アジア人の 50% で DNF が発症します。 T2DM における DNF の全体的な有病率は 4 ~ 30% です。
臨床症状
DNF に間接的に関連する比較的初期の臨床症状は動脈性高血圧です。 その他の臨床的に明らかな症状は遅れて現れます。 これらには、ネフローゼ症候群や慢性腎不全の症状が含まれます。
診断
糖尿病患者における DNF のスクリーニングには、年に 1 回の DNF 検査が含まれます。 微量アルブミン尿 DM-1 の場合は病気の発症から 5 年後、DM-2 の場合は病気の発見直後です。 さらに、計算するには少なくとも年間クレアチニンレベルが必要です。 糸球体濾過率(GFR)。 GFR は、Cockcroft-Gault の式など、さまざまな式を使用して計算できます。
男性の場合: a = 1.23 (正常な GFR 100 ~ 150 ml/分) 女性の場合: a = 1.05 (正常な GFR 85 ~ 130 ml/分)
DNF の初期段階では GFR の増加が検出されることがありますが、慢性腎不全が進行するにつれて GFR は徐々に減少します。 微量アルブミン尿は、DM-1 の発症から 5 ~ 15 年後に検出され始めます。 T2DM では、8 ~ 10% のケースで、発見直後に発見されます。これはおそらく、診断されるまでの無症候性の経過が長いためと考えられます。 T1DM における顕性タンパク尿またはアルブミン尿の発症のピークは、発症後 15 ~ 20 年の間に起こります。 タンパク尿が示すもの 不可逆性 DNF、遅かれ早かれ慢性腎不全につながります。 尿毒症は、明らかなタンパク尿の発症から平均して 7 ~ 10 年後に発症します。 GFRはタンパク尿と相関しないことに注意する必要があります。
鑑別診断
糖尿病患者におけるタンパク尿および腎不全のその他の原因。 ほとんどの場合、DNF は動脈性高血圧症、糖尿病性網膜症、または神経障害と組み合わされており、これらが存在しない場合には鑑別診断に特に注意が必要です。 DM-1 の場合の 10%、および DM-2 の場合の 30% では、タンパク尿は DNF と関連していません。
処理
♦ プライマリとセカンダリの基本条件 防止
DNF糖尿病を補償し、正常な全身血圧を維持します。 さらに、DNF の一次予防には、たんぱく質食品の摂取量を 1 日のカロリーの 35% 未満に減らすことが含まれます。
♦ 段階的に 微量アルブミン尿そして タンパク尿患者にはACE阻害薬またはアンジオテンシン受容体拮抗薬が処方されます。 動脈性高血圧を併発している場合は、必要に応じて他の降圧薬と併用して、降圧用量で処方されます。 血圧が正常であれば、これらの薬は低血圧を引き起こさない用量で処方されます。 ACE 阻害剤 (DM-1 および DM-2 用) とアンジオテンシン受容体拮抗薬 (DM-2 用) は両方とも、微量アルブミン尿からタンパク尿への移行を防ぐのに役立ちます。 場合によっては、他のパラメーターによる糖尿病の補償と組み合わせたこの治療法を背景に、微量アルブミン尿が解消されることがあります。 さらに、微量アルブミン尿の段階から始めて、
タンパク質摂取量を1日あたりのカロリーの10%未満(または体重1kgあたり0.8グラム未満)に、塩分を1日あたり3グラム未満に減らす。
♦ ステージにて 慢性腎不全、原則として、血糖降下療法の調整が必要です。 T2DM患者のほとんどは、TSPの蓄積により重度の低血糖症を発症するリスクがあるため、インスリン療法に切り替える必要があります。 腎臓はインスリン代謝の主要な部位の 1 つであるため、T1DM 患者のほとんどはインスリン必要量の減少を経験します。 血清クレアチニン値が 500 μmol/L 以上に上昇した場合は、体外療法 (血液透析、腹膜透析) または外科的 (腎移植) 治療法に対する患者の準備を検討する必要があります。 クレアチニンレベルが600〜700μmol/lに達し、糸球体濾過速度が25ml/分未満、血液透析が1000〜1200μmol/l、10ml/分未満にそれぞれ低下した場合、腎臓移植が適応となります。
予報
タンパク尿を伴う 1 型糖尿病患者の 50% と 2 型糖尿病患者の 10% が、今後 10 年間で慢性腎不全を発症します。 50 歳未満の 1 型糖尿病患者の全死亡の 15% は、DNF による慢性腎不全に関連しています。
7.8.4. 糖尿病性神経障害
糖尿病性神経障害(DNE) は、神経系の損傷症候群の組み合わせであり、その過程におけるさまざまな部分 (感覚運動、自律神経) の主な関与、および損傷の有病率と重症度に応じて分類できます (表 7.20) )。
私。 感覚運動神経障害:
対称的。
限局性(単神経障害)または多巣性(頭蓋、近位運動、四肢および体幹の単神経障害)。
II. 自律神経障害:
心血管系(起立性低血圧、心臓脱神経症候群);
胃腸(胃アトニー、胆道ジスキネジア、糖尿病性腸症);
泌尿生殖器(膀胱および性機能の機能不全を伴う);
低血糖を認識する患者の能力が損なわれている。
瞳孔機能の障害。
汗腺の機能不全(遠位無汗症、食事時の多汗症)。
テーブル 7.20。糖尿病性神経障害
 病因と病因
病因と病因
DNE の主な原因は高血糖です。 その発症機序はいくつか示唆されています。
グルコース代謝のポリオール経路の活性化により、神経細胞内のソルビトール、フルクトースが蓄積し、ミオイノシトールとグルタチオンの含有量が減少します。 これは、フリーラジカルプロセスの活性化と一酸化窒素レベルの減少につながります。
神経細胞の膜および細胞質タンパク質の非酵素的グリコシル化。
微小血管症 血管神経これは毛細血管の血流の減速と神経の低酸素状態を引き起こします。
疫学
どちらのタイプの糖尿病における DNE の有病率は約 30% です。 T1DM では、病気の発症から 5 年後に患者の 10% で検出され始めます。 T2DMにおける新たなDNE症例の発生率は、年間患者の約6%です。 最も一般的な変異型は、遠位対称感覚運動 DNE です。
臨床症状
感覚運動の日運動障害と感覚障害の複合体として現れます。 遠位型 DNE の一般的な症状は次のとおりです。 感覚異常、それは「這うような鳥肌」の感覚、しびれによって現れます。 患者は、足を触ると温かいにもかかわらず、足が冷たいと訴えることが多く、足を触ると冷たい場合、これは多発性神経障害と虚血性変化を区別する兆候です。 感覚性ニューロパシーの初期症状は、振動に対する感度の侵害です。 特徴的なのは、夜間の感覚異常と過敏症の増加が組み合わさった「レストレスレッグス」症候群です。 下肢痛ほとんどの場合、夜間に悩まされ、患者が毛布に触れることに耐えられないこともあります。 典型的な場合、閉塞性動脈疾患の痛みとは対照的に、歩くと痛みが軽減することがあります。 長年にわたって、痛みの感受性を担う小さな神経線維の死滅により、痛みが自然に止まることがあります。 知覚鈍麻「ストッキング」や「手袋」の感覚の喪失によって現れます。 深部の固有受容感覚が侵害されると、調整機能が損なわれ、動くことが困難になります(感覚失調症)。 患者は「エイリアンの足」、つまり「脱脂綿の上に立っている」ような感覚を訴えています。 栄養神経支配の違反は、皮膚、骨、腱の変性変化を引き起こします。 痛みに対する感度が低下すると、患者が気づかないうちに足に微小外傷が頻繁に発生し、感染しやすくなります。 調整機能と歩行機能が損なわれると、足の関節にかかる負荷が非生理学的に再配分されます。 その結果、脚の筋骨格系の解剖学的関係が破壊されます。
足の土踏まずが変形し、腫れ、骨折が生じ、慢性化膿性プロセスが発生します(セクション 7.8.5 を参照)。
自律的な昼光にはいくつかの形式があります。 原因 心血管の形態- 心肺複合体および大血管の神経支配の破壊。 迷走神経は最も長い神経であるため、他の神経よりも早く影響を受けます。 交感神経の影響が優位になった結果、 安静時頻脈。起立性調節に対する不十分な反応が現れる 起立性低血圧そして失神。 肺心臓複合体の自律神経除神経により、心拍数の変動がなくなります。 自律神経障害は、糖尿病患者における無症候性心筋梗塞の有病率の増加と関連しています。
症状 消化管型 DNEは、胃内容排出が遅い、または逆に急速な胃不全麻痺であり、炭水化物の吸収時間と量が無限に変化するため、インスリン療法の選択が困難になる可能性があります。 食道のアトニー、逆流性食道炎、嚥下障害。 水様の下痢。 のために 泌尿生殖器の形態 DNE は尿管と膀胱の弛緩を特徴とし、尿路感染症の傾向につながります。 勃起不全(糖尿病患者の約50%)。 逆行性射精。
栄養型 DNE のその他の考えられる症状としては、低血糖を認識する能力の障害、瞳孔機能の障害、汗腺機能の障害 (無汗症)、および糖尿病性筋萎縮症があります。
診断
糖尿病患者の神経学的検査は毎年実施する必要があります。 少なくとも、遠位感覚運動神経障害を特定することを目的とした検査の実施が含まれます。 これは、段階音叉を使用した振動感度、モノフィラメントを使用した触覚感度、および温度と痛みの感度を評価することによって行われます。 適応症に応じて、自律神経系の状態が研究されます。心臓の副交感神経支配の不全を診断するには、変動を評価しながら深呼吸中の心拍数を測定するなど、多くの機能検査が使用されます。
心拍数とバルサルバ法。 心臓の交感神経支配不全を診断するには、起立性試験が使用されます。
鑑別診断
他の原因による神経障害(アルコール性、尿毒症、B12欠乏性貧血など)。 自律神経障害の結果としての特定の臓器の機能不全の診断は、臓器の病理を除外した後にのみ確立されます。
処理
1. 血糖降下療法の最適化。
2. フットケア(7.8.5項を参照)。
3. 向精神薬(α-リポ酸)の有効性は、すべての研究で確認されているわけではありません。
4. 対症療法(鎮痛剤、勃起不全に対するシルデナフィル、起立性低血圧に対するフルドロコルチゾンなど)。
予報
初期段階では、DNE は糖尿病の持続的な代償を背景に回復する可能性があります。 DNEは潰瘍性病変患者の80%で検出され、下肢切断の主な危険因子となっています。
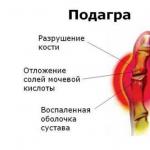
7.8.5. 糖尿病性足症候群
糖尿病性足症候群(SDS) は糖尿病における足の病理学的状態であり、末梢神経、皮膚および軟部組織、骨および関節への損傷を背景に生じ、急性および慢性の潰瘍、骨関節病変および化膿性壊死過程によって現れます(表7.21)。 。
病因と病因
DFS の病因は複数の要素からなり、顕著な感染傾向を伴う神経障害性障害と灌流障害の組み合わせによって表されます。 病因におけるリストされた要因のいずれかが優勢であることに基づいて、3 つの主要な形態が区別されます。
テーブル 7.21。糖尿病性足症候群
 I. 神経障害型(60-70 %):
I. 神経障害型(60-70 %):
変形性関節症なし。
糖尿病性変形性関節症あり。
II. 神経虚血性(混合)型(15-20 %).
Ⅲ. 虚血形態(3-7 %).
SDS の神経障害型。 糖尿病性神経障害では、最も長い神経の遠位部分が主に影響を受けます。 栄養インパルスの長期的な欠乏は、皮膚、骨、靱帯、腱、筋肉の萎縮を引き起こします。 結合構造の萎縮の結果、支持荷重の非生理学的再配分と特定の領域での過剰な増加を伴う足の変形が生じます。 これらの場所、たとえば中足骨の頭の突出領域では、皮膚の肥厚と角質増殖の形成が注目されます。 これらの領域に一定の圧力がかかると、下にある軟組織の炎症性自己融解が起こり、潰瘍性欠損が形成される前提条件が生じます。 萎縮と発汗障害の結果、皮膚が乾燥してひび割れやすくなります。 痛みに対する感受性が低下しているため、患者は起こっている変化に注意を払わないことがよくあります。 彼は、擦り傷やタコの形成につながる靴の不都合をすぐに検出することができず、ひび割れの場所に異物が入ったり小さな傷が入ったりすることに気づきません。 状況は、歩行障害や脚の不適切な位置に現れる、深部の感受性の侵害によって悪化します。 ほとんどの場合、潰瘍性欠損はブドウ球菌、連鎖球菌、腸内細菌に感染しています。 嫌気性植物相が加わることもよくあります。 神経障害性変形性関節症は、足の骨関節装置の顕著な異栄養性変化(骨粗鬆症、骨溶解、骨過症)の結果です。
虚血性SDS これは下肢の動脈のアテローム性動脈硬化の結果であり、主要な血流の中断につながります。 糖尿病性大血管症の亜型の 1 つです。
疫学
DDS は糖尿病患者の 10 ~ 25% に観察され、いくつかのデータによると、何らかの形で 30 ~ 80% に観察されます。 米国では、DDS による糖尿病患者の治療にかかる年間費用は 10 億ドルです。
臨床症状
で 神経障害性の形態 SDS は、神経障害性潰瘍と変形性関節症(進行を伴う)という 2 つの最も一般的な病変タイプを区別します。
 米。 7.12。糖尿病性足症候群における神経障害性潰瘍
米。 7.12。糖尿病性足症候群における神経障害性潰瘍
 米。 7.13。糖尿病性足症候群におけるシャルコー関節
米。 7.13。糖尿病性足症候群におけるシャルコー関節
シャルコージョイント)。 神経障害性潰瘍、原則として、それらは足裏空間と指間空間、つまり足の裏の領域に局在しています。 最も大きな圧力がかかる足の領域 (図 7.12)。
足の靱帯系の破壊的な変化は何か月もかけて進行し、重度の骨変形を引き起こす可能性があります。 糖尿病性変形性関節症そしてフォーメーション シャルコージョイント、この場合、足は比喩的に「骨の入った袋」に例えられています。
で 虚血性SDS
足の皮膚が冷たく、青白く、またはチアノーゼ状態である。 虚血に反応して表面の毛細血管が拡張するため、ピンクがかった赤色になることはあまりありません。 潰瘍性欠損は、指先、かかとの辺縁表面の先端壊死として発生します(図7.14)。
足の動脈、膝窩動脈、大腿動脈の脈拍が弱くなるか、触知できなくなります。
典型的なケースでは、患者は「間欠性跛行」を訴えます。 虚血性四肢損傷の重症度は、狭窄の重症度、側副血流の発達、血液凝固系の状態という 3 つの主な要因によって決まります。
診断
糖尿病患者の足の検査は、医師の診察を受けるたびに、少なくとも6か月に1回は実施する必要があります。 SDS の診断には次のものが含まれます。
 米。 7.14。糖尿病性足症候群の虚血性形態における末端壊死
米。 7.14。糖尿病性足症候群の虚血性形態における末端壊死
足の検査。
神経学的状態の評価 - さまざまな種類の感度、腱反射、筋電図検査;
動脈血流の状態の評価 - 血管造影、ドップラー超音波検査、ドップラー超音波検査;
足と足首関節のX線写真。
創傷分泌物の細菌学的検査。
鑑別診断
これは、異なる起源の足の創傷プロセス、ならびに下肢の血管の他の閉塞性疾患および足の関節の病状で行われます。 さらに、DFS の臨床形態を区別する必要があります (表 7.22)。
処理
処理 神経障害的に感染した VTS フォームには、次の一連のアクティビティが含まれています。
糖尿病に対する補償の最適化には、通常、インスリンの投与量を増やすことが含まれますが、糖尿病 2 の場合はインスリンに切り替える必要があります。
全身的な抗生物質療法。
足の完全な除荷(これにより、長年存在していた潰瘍が数週間以内に治癒する可能性があります)。
過角化症の領域を除去する創傷の局所治療。
フットケア、適切な選択と専用の靴の着用。 タイムリーな保守的治療が可能になります
95%のケースで手術は避けられます。
テーブル 7.22 DFSの臨床形態の鑑別診断
 処理 虚血性 VTS フォームには次のものが含まれます。
処理 虚血性 VTS フォームには次のものが含まれます。
糖尿病に対する補償の最適化には、通常、インスリンの投与量を増やすことが含まれますが、糖尿病 2 の場合はインスリンに切り替える必要があります。
潰瘍性壊死性病変がない場合は、エルゴセラピー(1日1~2時間のウォーキング、側副血流の発達を促進)。
影響を受けた血管の血行再建手術。
保存的療法: 抗凝固薬、アスピリン (100 mg/日まで)、必要に応じて線溶薬、プロスタグランジン E1 およびプロスタサイクリン製剤。
あらゆる種類の DFS で広範な化膿性壊死性病変が発生すると、切断の問題が生じます。
予報
下肢切断の総件数の 50 ~ 70% は糖尿病患者によるものです。 糖尿病患者の下肢切断は、糖尿病でない人よりも 20 ~ 40 倍多く発生します。
7.9. 糖尿病と妊娠
妊娠糖尿病(GDM) は、妊娠中に初めて確認された耐糖能障害です (表 7.23)。 この定義は、炭水化物代謝の病状が妊娠に先行する可能性を排除するものではありません。 GDM は、以前に糖尿病と診断された女性 (年齢のため、T1DM の方が多い) が妊娠した場合とは区別する必要があります。
病因と病因
GDM では、T2DM のものと似ています。 高レベルの卵巣および胎盤ステロイド、ならびに副腎皮質によるコルチゾール産生の増加は、妊娠中の生理的インスリン抵抗性の発症につながります。 GDM の発症は、妊娠中に自然に発症するインスリン抵抗性、およびその結果、素因のある人におけるインスリンの必要性の増加が膵臓の β 細胞の機能的能力を超えるという事実と関連しています。 出産後、ホルモンと代謝の関係が元のレベルに戻ると、通常は解消されます。
テーブル 7.23。妊娠糖尿病
 GDM は通常、妊娠 4 か月から 8 か月の間の第 2 学期半ばに発症します。 患者の大多数は過体重であり、2型糖尿病の病歴を持っています。 GDM を発症する危険因子、および GDM を発症するリスクが低い女性グループを表に示します。 7.24。
GDM は通常、妊娠 4 か月から 8 か月の間の第 2 学期半ばに発症します。 患者の大多数は過体重であり、2型糖尿病の病歴を持っています。 GDM を発症する危険因子、および GDM を発症するリスクが低い女性グループを表に示します。 7.24。
テーブル 7.24。妊娠糖尿病発症の危険因子
 母親の高血糖は、子供の循環系の高血糖につながります。 ブドウ糖は胎盤に容易に浸透し、母親の血液から継続的に胎児に伝わります。 アミノ酸の能動輸送と胎児へのケトン体の移行も起こります。 対照的に、インスリン、グルカゴン、および母体の遊離脂肪酸は胎児の血液に入りません。 妊娠の最初の 9 ~ 12 週間では、胎児の膵臓はまだ独自のインスリンを生成していません。 この時期は胎児の器官形成期に相当し、一定の高血糖により母親にさまざまな発達障害(心臓、脊椎、脊髄、胃腸管)が形成される可能性があります。 妊娠 12 週以降、胎児の膵臓はインスリンの合成を開始し、高血糖に反応して胎児の膵臓のβ 細胞の反応性肥大と過形成が発生します。 高インスリン血症により、胎児巨大児症が発症し、レシチン合成が阻害されるため、新生児における呼吸窮迫症候群の発生率が高くなります。 β細胞過形成と高インスリン血症の結果、重度かつ長期にわたる低血糖が起こる傾向があります。
母親の高血糖は、子供の循環系の高血糖につながります。 ブドウ糖は胎盤に容易に浸透し、母親の血液から継続的に胎児に伝わります。 アミノ酸の能動輸送と胎児へのケトン体の移行も起こります。 対照的に、インスリン、グルカゴン、および母体の遊離脂肪酸は胎児の血液に入りません。 妊娠の最初の 9 ~ 12 週間では、胎児の膵臓はまだ独自のインスリンを生成していません。 この時期は胎児の器官形成期に相当し、一定の高血糖により母親にさまざまな発達障害(心臓、脊椎、脊髄、胃腸管)が形成される可能性があります。 妊娠 12 週以降、胎児の膵臓はインスリンの合成を開始し、高血糖に反応して胎児の膵臓のβ 細胞の反応性肥大と過形成が発生します。 高インスリン血症により、胎児巨大児症が発症し、レシチン合成が阻害されるため、新生児における呼吸窮迫症候群の発生率が高くなります。 β細胞過形成と高インスリン血症の結果、重度かつ長期にわたる低血糖が起こる傾向があります。
疫学
糖尿病は生殖年齢の全女性の 0.3% に影響を及ぼし、妊婦の 0.2 ~ 0.3% はすでに最初から糖尿病を患っており、妊娠の 1 ~ 14% で GDM が発症または真の糖尿病を発症します。 GDM の有病率は集団によって異なります。たとえば、米国では妊婦の約 4% で GDM が検出されます (年間 135,000 件)。
臨床症状
GDM には存在しません。 非代償性糖尿病には非特異的な症状が現れる場合があります。
診断
空腹時血糖値の測定は、生化学的血液検査の一部としてすべての妊婦に義務付けられています。 危険にさらされている女性(表 7.24)には、以下のことが推奨されます。 経口ブドウ糖負荷試験(OGTT)。 妊娠中の女性にそれを実施するための多くの選択肢が記載されています。 最も単純なものには、次のルールが含まれます。
検査の 3 日前、女性は通常の食事をとり、通常の身体活動を維持します。
検査は、少なくとも8時間の一晩絶食した後の朝の空腹時に行われます。
空腹時に血液サンプルを採取した後、女性は 5 分以内に、75 グラムの乾燥ブドウ糖を 250 ~ 300 ml の水に溶かした溶液を飲みます。 血糖値は 2 時間後に再測定されます。
GDM の診断は以下によって確立されます。 基準:
空腹時全血グルコース(静脈、毛細血管) > 6.1 mmol/l または
静脈血血漿グルコース ≥ 7 mmol/l または
75 g グルコース負荷 2 時間後の全毛細管血中グルコースまたは静脈血漿 ≥ 7.8 mmol/l。
リスクのある女性の検査結果が正常であれば、妊娠 24 ~ 28 週目に検査が再度行われます。
鑑別診断
GDM と真の糖尿病。 妊婦の血糖。
処理
GDM と真の糖尿病における母親と胎児のリスク、糖尿病の治療法とその制御の特徴は同じです。 妊娠中の糖尿病の遅発性合併症は著しく進行する可能性がありますが、糖尿病に対する質の高い補償があれば、妊娠中絶の兆候はありません。 糖尿病(通常は 1 型糖尿病)に苦しむ女性は、合併症のリスクが最も低い若い年齢で妊娠を計画する必要があります。 妊娠が計画されている場合はキャンセルすることをお勧めします
最適な補償を達成してから数か月後に受信。 妊娠計画の禁忌は、進行性腎不全を伴う重度の腎症、重度の虚血性心疾患、矯正できない重度の増殖性網膜症、妊娠初期のケトアシドーシス(ケトン体は催奇形性因子)です。
治療の目的妊娠中の GDM および真の糖尿病は、次の検査パラメータの達成によって決まります。
空腹時血糖< 5-5,8 ммоль/л;
食後1時間の血糖値< 7,8 ммоль/л;
食後2時間で血糖が上がる< 6,7 ммоль/л;
1日の平均血糖プロファイル< 5,5 ммоль/л;
毎月のモニタリングによる HbA1c レベルは健康な人と同じ (4 ~ 6%)。
1 型糖尿病の場合、および妊娠以外の場合は、女性は集中的なインスリン療法を受ける必要がありますが、妊娠中は 1 日 7 ~ 8 回血糖レベルを評価することが推奨されます。 従来の注射で正常血糖の補償を達成することが不可能な場合は、患者をインスリンディスペンサーを使用したインスリン療法に移行することを検討する必要があります。
最初の段階では GDMの治療食事療法が処方されます。これは、主に動物由来の消化しやすい炭水化物と脂肪を使用することにより、1 日のカロリー摂取量を実際の体重 kg あたり約 25 kcal に制限することと、身体活動を増やすことで構成されます。 食事療法が治療目標を達成できない場合、患者は集中的なインスリン療法を処方されなければなりません。 妊娠中の錠剤化された血糖降下薬 (TDL) 禁忌です。女性の約 15% がインスリン療法に切り替える必要があることが判明しました。
予報
妊娠中のGDMと糖尿病の補償が不十分な場合、胎児にさまざまな病状が発生する確率は30%です(リスクは一般集団より12倍高い)。 妊娠中に GDM と診断された女性の 50% 以上が、今後 15 年間で T2DM を発症します。
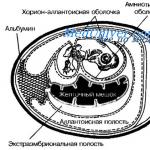
「糖尿病」という用語は、ギリシャ語の「私は漏れている」に由来しており、古代には、この病気の間に体内に入った液体は吸収されずに体内を通過すると信じられていました。 尿崩症は、古代の定義に完全に一致する稀な慢性病態です。 その原因は、腎臓による水分の排泄を調節するホルモンの欠如です。 その結果、尿量が何倍にも増加し、事実上通常の生活ができなくなります。
患者は常に喉の渇きを感じており、脱水症状を防ぐために何リットルもの水分を摂取せざるを得ません。 真性糖尿病とは異なり、尿崩症は血糖値の上昇を引き起こさず、膵臓の機能に関連せず、典型的な糖尿病合併症を引き起こしません。 これら 2 つの病気には、顕著な多尿という共通の症状が 1 つだけあります。
尿崩症 - それは何ですか?
私たちの腎臓に入った液体のすべてが尿になるわけではありません。 濾過後、原尿のほぼ全量が尿細管を通って血液中に吸収されます。このプロセスは再吸収と呼ばれます。 腎臓が通過する 150 リットルのうち、濃縮された二次尿の形で排泄されるのはわずか 1% です。 再吸収は、細胞膜の細孔を構成するタンパク質物質であるアクアポリンのおかげで可能です。 腎臓に存在する一種のアクアポリンは、バソプレシンの存在下でのみその機能を発揮します。
バソプレシンは、視床下部 (脳の一部) で合成され、下垂体 (脳の底にある特別な腺) に貯蔵されるホルモンです。 その主な機能は水分代謝を調節することです。 血液密度が増加するか、体内の水分が不足すると、バソプレシンの放出が増加します。
何らかの理由でホルモンの合成が減少したり、腎細胞がバソプレシンを認識しなくなったりすると、尿崩症が発症します。 その最初の兆候は多尿、つまり過剰な尿です。 腎臓は 1 日あたり最大 20 リットルの体液を排泄できます。 患者は常に水を飲み、排尿します。 この生活リズムは人を疲弊させ、生活の質を著しく悪化させます。 この病気の別名は尿崩症です。 尿崩症患者は障害グループ 3 に該当し、無料の治療と処方薬を受ける機会が得られます。
この病気はまれで、100万人中2~3人が罹患します。 ほとんどの場合、この病気は25歳から40歳の成人期に始まり、人口100万人あたり6人が発症します。 小児では尿崩症が発症する頻度ははるかに低くなります。
ND のさまざまな形式と種類にはどのようなものがありますか?
多尿の原因に応じて、尿崩症は次のような形態に分類されます。
- 中枢性尿崩症- 脳が損傷し、血流へのバソプレシンの放出が停止したときに始まります。 この形態は、神経手術、損傷、腫瘍、髄膜炎、その他の脳の炎症後に発生する可能性があります。 小児では、中枢型は急性または慢性の感染症または遺伝性疾患の結果であることがよくあります。 患者の重篤な症状は、視床下部核の約 80% が機能しなくなるときに現れますが、その前にホルモン合成が損傷を受けていない領域で引き継がれます。
- 腎性尿崩症- 尿細管内の受容体がバソプレシンに反応しなくなると発症します。 この形態の糖尿病では、通常、中枢性糖尿病よりも尿の生成が少なくなります。 腎臓におけるこのような障害は、尿の停滞、嚢胞形成および腫瘍、および長期にわたる炎症過程によって引き起こされる可能性があります。 胎児の腎臓の奇形によって引き起こされる先天性腎性尿崩症もあります。
- 特発性尿崩症- バソプレシンが不足している場合に診断されることが多いですが、現時点では欠乏の原因は特定できません。 これは通常、小さな腫瘍です。 成長するにつれて、最新の視覚的方法である MRI または CT を使用して地層の位置が特定されます。 特発性尿崩症は、ホルモンのレベルが高い場合にも診断できますが、腎臓の変化は検出できません。 通常、それは遺伝子変異によって説明されます。 症状は男性にのみ観察されます。 女性は損傷した遺伝子を持っており、女性の病気の兆候は実験室の方法でのみ検出でき、顕著な多尿症はありません。
- 妊娠性尿崩症- バソプレシンを破壊する胎盤によって合成されるホルモンバソプレッシナーゼが原因であるため、妊娠中の女性にのみ発生する可能性があります。 この病気の形態は出産後すぐに消えます - に関する私たちの記事。
血液中のバソプレシンの存在に加えて、尿崩症は他の基準に従って分類されます。
| 分類基準 | 糖尿病の種類 | 特性 |
| 始まる時間 | 先天性の | まれに観察されますが、通常は腎性です。 |
| 取得した | 他の病気や怪我により生前に発生した場合。 | |
| 診断時の糖尿病の重症度 | 簡単 | 1日あたり最大8リットルの多尿。 |
| 平均 | 8~14リットル | |
| 重い | > 14リットル | |
| 治療開始後の患者様の状態 | 補償 | 多尿はありません。 |
| 補助補償 | 尿量と喉の渇きが1日に数回増加します。 | |
| 代償不全 | 治療後の多尿症の持続。 |
ND開発の理由
中枢型糖尿病は、以下の状況で発症する可能性があります。
- 視床下部および下垂体の損傷 - これらの領域の損傷、近くの領域の腫れ、他の組織による圧迫。
- 脳内の腫瘍と転移。
- 視床下部および下垂体に近い脳構造への外科的介入または放射線治療的介入の結果として起こります。 このような手術は患者の命を救いますが、まれに(尿崩症の全発生率の20%)、ホルモンの産生に影響を与えます。 手術直後から糖尿病が自然治癒し、数日以内に治るケースもあります。
- 脳腫瘍を治療するために行われる放射線療法。
- 血栓症、動脈瘤、または脳卒中の結果として生じる頭の血管の循環障害。
- 神経感染症 - 脳炎、髄膜炎;
- 急性感染症 - 百日咳、インフルエンザ、水痘。 小児では、感染症により成人よりも尿崩症が起こることが多くなります。 これは、小児期の脳の解剖学的構造の特殊性によるものです。新しい血管の急速な成長、既存の血管の透過性、および不完全な血液脳関門の形成です。
- 肺肉芽腫症、結核。
- クロニジンを服用する。
- 先天的欠陥 - 小頭症、脳の一部の発育不全;
- 子宮内感染による視床下部の損傷。 この場合、ストレス、怪我、ホルモンの変化などにより、数年後に糖尿病の症状が現れることがあります。
- バソプレシン合成を不可能にする遺伝子欠陥。
- ウォルフラム症候群は、糖尿病、尿崩症、視力低下、聴力低下などを含む複雑な遺伝性疾患です。

腎性糖尿病の考えられる原因:
- 慢性腎臓病、多発性嚢胞疾患、尿路結石症による腎不全の発症。
- 腎臓組織におけるアミロイドの沈着によるタンパク質代謝の障害。
- 腎臓の骨髄腫または肉腫。
- 腎臓におけるバソプレシン受容体の遺伝的劣性。
- 特定の薬物の腎臓に対する毒性作用:
尿崩症の症状
あらゆる形態の尿崩症の最初の兆候は、夜間も止まらない排尿量の急激な増加(4リットルから)です。 患者は通常の睡眠を奪われ、徐々に神経疲労を起こします。 小児では、夜尿が始まり、その後日中に夜尿が始まります。 尿は透明で、塩分はほとんど含まれておらず、その量は0.5リットルからと多いです。 治療を行わないと、このような大量の尿により腎盂と膀胱が徐々に拡張します。
体から水分が除去されると激しい喉の渇きが始まり、患者は何リットルもの水を飲みます。 温かい飲み物は喉の渇きをさらに潤してしまうため、通常は非常に冷たい飲み物が好まれます。 消化が悪くなり、胃が伸びたりへこんだり、腸に炎症が起こります。
最初は体内の不足分を補うのに十分な水分が摂取されますが、徐々に脱水症状が始まります。 その症状は、疲労、頭痛、めまい、低血圧、不整脈などです。 尿崩症の患者さんでは、唾液の量が減少し、皮膚が乾燥し、涙液が分泌されなくなります。
男性の症状 - 女性の月経の欠如、子供の身体的および知的発達の遅れ。
診断と検査
多尿症のすべての患者は尿崩症の検査を受ける必要があります。 診断手順:
- 既往歴を聞く - 病気の期間、排尿量、その他の症状、近親者の尿崩症の症例、以前の手術や脳損傷について患者に尋ねます。 喉の渇きの性質を判断する: 夜間または患者が興味深い活動で忙しいときに喉の渇きが現れない場合、多尿の原因は尿崩症ではなく、心因性の多飲症である可能性があります。
- 糖尿病を除外するための血糖値の測定と、それを正しく行う方法。
- 尿の密度と浸透圧を計算して分析します。 密度が 1005 未満、浸透圧が 300 未満の場合、尿崩症が疑われます。
- 水分剥奪テスト - 患者は 8 時間、飲み物や流動食を絶たれます。 この間ずっと彼は医師の監督下にあります。 危険な脱水症状が発生した場合は、検査を早期に中止します。 この間に患者の体重が5%以上減少し、尿の浸透圧と濃度が増加していない場合、尿崩症が確認されたとみなされる。
- 病気の形態を判断するための検査直後の血液中のバソプレシンの量を分析します。 中枢性糖尿病では、そのレベルは低いままですが、腎性糖尿病ではそのレベルは大幅に増加します。
- 中枢性糖尿病が疑われる場合はMRI検査で脳腫瘍を検出します。
- 腎臓の超音波検査。腎炎の可能性が高い。
- 遺伝性糖尿病の疑いがある場合の遺伝子スクリーニング。
尿崩症の治療
病気の原因を特定した後、医師のあらゆる努力はそれを排除すること、つまり腫瘍を除去し、腎臓の炎症を和らげることを目的としています。 中心型が特定され、考えられる原因を治療しても糖尿病が止まらない場合は、補充療法が処方されます。 それは、患者に欠如しているホルモンの合成類似体であるデスポプレシン(錠剤ミニリン、ノーレム、ナティバ)を血液に導入することから構成されます。 用量は、自身のバソプレシンの合成の有無とその必要性に応じて個別に選択されます。 尿崩症の症状が消失すれば、その用量は適切であると考えられます。

自分自身のホルモンは生成されているが十分ではない場合、クロフィブラート、カルバマゼピン、またはクロルプロパミドが処方されることがあります。 一部の患者では、それらはバソプレシン合成の増加を引き起こす可能性があります。 小児の場合、これらの薬のうちクロルプロパミドのみが許可されていますが、血糖降下作用があるため、使用する場合は血糖を管理する必要があります。
腎性糖尿病に対する有効な治療法は証明されていません。 サイアジド系利尿薬は、体液の損失を 25 ~ 50% 減らすことができます。 尿崩症では、健康な人のように尿排泄を刺激しませんが、逆に再吸収を高めます。
薬物療法に加えて、患者には腎臓に負担をかけないようにタンパク質の量を制限した食事が処方されます。 脱水症状を防ぐには、洗い流されたビタミンや微量元素を回復するために、十分な量の液体、できればジュースやコンポートを飲む必要があります。
治療により尿崩症の代償段階に達した場合、患者は働く能力を維持しながら通常の生活を送ることができます。 病気の原因を取り除けば完全に回復することが可能です。 糖尿病が外傷、腫瘍、手術によって引き起こされた場合、ほとんどの場合、糖尿病は消失します。 また、生涯にわたる治療が必要な場合もあります。
糖尿病を疑う主な症状の 1 つは、絶え間ない喉の渇きと、1 日あたり 5 リットルから 10 リットルに達することもある過剰な排尿です。
同じ症状が尿崩症または尿崩症でも観察されます。 このかなりまれな病気は、抗利尿ホルモンであるバソプレシンの欠乏に関連しています。
バソプレシンの合成量が減少するか、腎臓の受容体がバソプレシンに反応しなくなる可能性があります。 また、薬を服用している場合、妊娠中期または妊娠後期に 1 歳未満の小児に尿崩症が発症することがあります。 後者の形態は、中枢型および腎臓型とは対照的に、予後が良好で経過も穏やかです。
尿崩症の発症:原因とメカニズム
体液が原尿から血液中に戻るためには、バソプレシンが必要です。 これは、人体の中でそのような機能を果たすことができる唯一のホルモンです。 それが機能しない場合、重度の代謝障害、尿崩症が発症します。
バソプレシンは、視床下部の視神経上核のニューロンで生成されます。 その後、神経細胞の突起に沿って下垂体に入り、そこで蓄積して血液中に放出されます。 その放出の信号は、血漿浸透圧(濃度)の増加と循環血液量の減少です。
浸透圧は、すべての溶解塩の濃度を反映します。 通常、それは 280 ~ 300 mOsm/l の範囲です。 この場合、体は生理学的条件下で機能します。 増加すると、視床下部、肝臓、脳の第 3 脳室の壁にある受容体が、尿から水分を取り出して水分を保持する必要性についての信号を送信します。
循環血液量が正常以下の場合、下垂体は胸部の内側にある心房および静脈の容量受容体から同じ信号を受け取ります。 正常な体積を維持すると、組織に栄養と酸素が供給されます。 血液量が減少すると、血管内の圧力が低下し、微小循環が阻害されます。
水分不足と過剰な塩分の影響を排除するために、バソプレシンが放出されます。 抗利尿ホルモンのレベルの上昇は、次の理由で発生します:怪我時の疼痛ショック、失血、脱水、精神病。
バソプレシンの作用は次の方向で起こります。
- 尿量が減少します。
- 尿からの水分が血液に入り、その量が増加します。
- ナトリウムおよび塩素レベルを含む血漿浸透圧が低下します。
- 特に消化器系と血管の平滑筋の緊張が高まります。
- 動脈内の圧力が上昇し、アドレナリンやノルアドレナリンに対してより敏感になります。
- 出血は止まります。
さらに、バソプレシンは人間の行動に影響を与え、社会的行動、攻撃的な反応、父親の子供への愛の形成を部分的に決定します。
ホルモンが血液に入らなくなるか、ホルモンに対する感受性が失われると、尿崩症が発症します。
尿崩症の形態
糖度
 中枢型尿崩症は、損傷や脳腫瘍、さらに視床下部や下垂体への血液供給障害を伴って発症します。 多くの場合、この病気の発生は神経感染に関連しています。
中枢型尿崩症は、損傷や脳腫瘍、さらに視床下部や下垂体への血液供給障害を伴って発症します。 多くの場合、この病気の発生は神経感染に関連しています。
下垂体腺腫の外科的治療や治療中の放射線治療は、尿崩症の症状を引き起こす可能性があります。 遺伝性ウルフラム症候群は、バソプレシンの不十分な産生を伴い、この病状の発生を刺激します。
中枢性尿崩症患者のかなりの割合で原因を特定することが困難な場合、この疾患の変種は特発性と呼ばれます。
腎臓型では、バソプレシンの受容体は血液中のバソプレシンの存在に反応しません。 これは次の理由による可能性があります。
- 受容体構造の先天性障害。
- 腎不全。
- プラズマのイオン組成の乱れ。
- リチウム系の薬を服用している。
- 末期の糖尿病性腎症。
妊婦の尿崩症は一過性(経過性)に分類され、胎盤によって産生される酵素がバソプレシンを破壊するという事実に関連しています。 出産後、妊娠性尿崩症は治ります。
また、生後 1 年目の子供は、下垂体と視床下部の形成に関連する一過性の尿崩症に悩まされます。
病気の重症度と水・電解質代謝障害のレベルは、体の脱水の程度によって異なります。 尿崩症には次のような形態があります。
- 重度 – 1日あたり14リットルの排尿。
- 平均 - 1日あたり8〜14リットルの利尿。
- 軽度 - 患者の排泄量は 1 日あたり最大 8 リットルです。
- 1日あたり4リットル未満の損失がある場合 - 部分的(部分的)尿崩症。
小児や妊婦における一過性の糖尿病は、多くの場合、軽度の状態で発生します。 薬を服用している場合(医原性) – 中等度の重症度。 中枢型および腎臓型では、尿崩症の最も重篤な経過が観察されます。
尿崩症はかなりまれな病態と考えられています。 しかし最近では、外傷性脳損傷や脳疾患に対する外科的介入の増加により、中枢性型の着実な増加が記録されています。
ほとんどの場合、尿崩症とその症状は 10 ~ 30 歳の男性で検出されます。
尿崩症の診断
尿崩症の症状は、大量の尿が生成され、脱水症状が進行することに関連しています。 さらに、血液中の電解質のバランスが崩れ、血圧が低下します。
重症度の程度は、病気の重症度とその発生原因によって決まります。 患者の主な訴えは、糖尿病と同様に、極度の口の渇き、絶え間ない口渇、皮膚や粘膜の乾燥、脱水、および頻尿、多量の排尿です。
患者は1日に6リットル以上の水分を摂取することができ、排泄される尿の量は10〜20リットルに増加します。 夜間利尿が著しく増加します。
尿崩症の典型的な症状は次のとおりです。
- 重度の疲労感、無力感。
- 不眠症または眠気の増加。
- 唾液の分泌が減少します。
- 持続的な便秘。
- 食後の胃もたれ、げっぷ。
- 吐き気と嘔吐。
- 体温の上昇。
心血管系からは、血圧の低下、脈拍の速さ、心臓機能の中断など、血管調節障害の複合的な症状が発生します。 体重は減少し、4歳を過ぎると尿失禁が起こり、患者は絶え間ない皮膚のかゆみに悩まされます。
尿中の電解質の損失の結果として、頭痛、けいれん、筋肉や体の他の部分のけいれんなどの神経症状が発生します。 男性の尿崩症は、性欲の低下や勃起不全の発症などの典型的な症状を示します。
尿崩症の診断を確定するには、臨床検査および尿崩症の原因を明らかにするための特別な検査が行われます。 病気の腎臓型と中枢型の鑑別診断が行われ、糖尿病も除外されます。
最初の段階では、尿の量、尿の濃度、浸透圧が検査されます。 尿崩症は次の値によって特徴付けられます。
- 体重1kgあたり、1日あたり40ml以上の尿が排泄されます。
- 尿の相対密度が 1005 g/l 未満に減少
- 尿浸透圧が300 mOsm/kg未満
腎臓型の尿崩症では、高カルシウム血症、高カリウム血症、血中のクレアチニンの増加、腎不全または尿路の感染過程の兆候が現れます。 糖尿病性腎症の診断指標は血糖値の上昇です。
ドライイーティングテストを実行すると、患者はすぐに脱水症状と体重減少を経験します。 中枢型尿崩症は、デスモプレシンで検査するとすぐに回復します。
診断が不明瞭な場合は、脳断層撮影や遺伝子検査を行う必要があります。
尿崩症の治療
尿崩症の治療における戦術の選択は、病気の形態によって異なります。 視床下部または下垂体の損傷による中枢型の治療には、合成的に製造されたバソプレシン類似体が使用されます。
デスモプレシンをベースにした薬は、錠剤または点鼻スプレーの形で入手できます。 商品名:バゾミリン、ミニリン、プレサイネックス、ナティバ。 腎臓での水分の再吸収を促進します。 したがって、使用する場合は、水中毒を起こさないように、のどが渇いたときにのみ飲むようにしてください。
デスモプレシンを過剰摂取したり、使用中に大量の液体を摂取したりすると、次のような症状が起こる可能性があります。
- 血圧の上昇。
- 組織浮腫の発症。
- 血液中のナトリウム濃度の低下。
- 意識障害。
用量は1日あたり10~40μgの範囲で個別に選択されます。 1回に分けて服用することも、2回に分けて服用することもできます。 通常、この薬は忍容性が良好ですが、頭痛、めまい、腸の痛み、吐き気、適度な血圧上昇などの副作用が発生する可能性があります。
デスモプレシンのスプレーや点滴を使用する場合は、粘膜の腫れにより鼻水が出ている場合には薬の吸収が遅くなるので、その場合は舌の下に点滴することもあるので注意が必要です。
中枢性尿崩症では、バソプレシンの産生を刺激するために、カルバマゼピン(フィンレプシン、ゼプトール)およびクロロプロパミドをベースとした薬剤も使用されます。
腎性尿崩症は、血液中に十分な量がある可能性があるバソプレシンに腎臓が反応できないことに関連しています。 しかし、デスモプレシンで検査しても反応は現れません。
この形態を治療するには、サイアザイド系利尿薬と非ステロイド性抗炎症薬(インドメタシン、ニメスリド、ボルタレン)が使用されます。 食事中の塩分の量は制限されています。
妊娠性尿崩症はデスモプレシン薬で治療されますが、治療は妊娠中にのみ行われ、出産後はそのような治療は必要ありません。
軽度または部分的な尿崩症の場合は、脱水症状を防ぐための適切な飲酒計画という形で非薬物療法を使用できます。
腎臓への負担を軽減するために食事療法が処方されます。 その主な原則:
- タンパク質、特に肉を制限します。
- 十分な量の脂肪と炭水化物。
- 頻繁な少量の食事。
- 新鮮な野菜や果物が含まれています。
- 喉の渇きを潤すには、フルーツドリンク、ジュース、またはコンポートを使用してください。
治療の有効性は、患者の健康状態と排尿量の減少によって評価されます。
尿崩症は、腎臓による体液の吸収障害に関連するかなりまれな病気です。 この病気は糖尿病とも呼ばれます。その発症により、尿が濃縮されなくなり、希釈された尿が大量に体外に排出されるためです。同様の病気が動物、ほとんどの場合犬と人で、あらゆる年齢で発生します。 当然のことながら、腎臓のこのような深刻な機能不全は体全体の機能に悪影響を及ぼします。 病気はどのように現れ、どのように治癒するのでしょうか?
それは何ですか?
尿崩症は視床下部または下垂体の機能不全を伴う稀な疾患(10万人に約3人)で、多尿(1日あたり6~15リットルの尿が排泄される)と多飲(喉の渇き)を特徴とします。
それは、成人と子供の両方の性別で発生します。 ほとんどの場合、18 歳から 25 歳までの若者が病気になります。 生後1年以内の子供におけるこの病気の既知の症例があります(A.D.アルブゾフ、1959年、シャラポフ対1992年)。
尿崩症の原因
尿崩症は、バソプレシン欠乏症、その絶対的または相対的欠乏によって引き起こされる病状です。 バソプレシン (抗利尿ホルモン) は視床下部で分泌され、他の機能の中でもとりわけ、排尿のプロセスを正常化する役割を果たします。 原因に応じて、この病気は遺伝性、後天性、特発性の3つのタイプに区別されるのが通例です。
この稀な病気の患者のほとんどは、原因がまだわかっていません。 このタイプの糖尿病は特発性と呼ばれ、患者の最大 70% が罹患しています。 遺伝とは遺伝的要素です。 この場合、尿崩症は、数人の家族、数世代にわたって連続して罹患することがあります。
医学ではこれを、抗利尿ホルモンの機能障害の発生に寄与する遺伝子型の重大な変化によって説明しています。 この病気の遺伝性は、間脳と中脳の構造の先天的欠陥によって説明されます。
尿崩症の原因を考えるときは、その発症のメカニズムを考慮する必要があります。
1) 中枢性尿崩症 - 視床下部でのバソプレシンの分泌が不十分な場合、または下垂体から血液中へのバソプレシンの放出が障害された場合に発生します。おそらくその原因は次のとおりです。
- 視床下部の病理は、尿排泄の調節と抗利尿ホルモンの合成に関与しているため、その機能の破壊がこの病気を引き起こします。 視床下部の機能不全の原因および誘発因子には、喉の痛み、インフルエンザ、性感染症、結核などの急性または慢性の感染症が考えられます。
- 脳および脳の炎症性病状に対する外科的介入。
- 脳震盪、外傷性脳損傷。
- 自己免疫疾患。
- バソプレシンの知覚を損なう嚢胞性、変性、炎症性腎臓病変。
- 視床下部および下垂体の腫瘍プロセス。
- また、高血圧の存在も尿崩症の悪化要因の一つです。
- 視床下部-下垂体系の血管病変。視床下部と下垂体に血液を供給する血管の脳循環に問題を引き起こします。
2) 腎性尿崩症 - この場合、バソプレシンは正常な量で産生されますが、腎臓組織はそれに適切に反応しません。 理由としては次のことが考えられます。
- ネフロンまたは腎髄質の尿細管への損傷。
- 遺伝的要因 - 先天性病理;
- 鎌状赤血球貧血;
- 血液中のカリウム濃度の増加またはカルシウム濃度の低下。
- 慢性腎不全。
- 腎臓のアミロイドーシス(組織内のアミロイドの沈着)または多発性嚢胞性疾患(複数の嚢胞の形成)。
- 腎臓組織に有毒な影響を与える可能性のある薬(デメクロシリン、アムホテリシンB、リチウム)を服用している。
- 場合によっては、病状が老年期に発生したり、別の病状による衰弱を背景に発生したりすることがあります。
場合によっては、ストレスにより喉の渇きが増加することがあります(心因性多飲)。 または、妊娠中の尿崩症。胎盤によって生成される酵素によるバソプレシンの破壊により妊娠第 3 期に発症します。 どちらのタイプの違反も、根本原因が取り除かれれば、自然に解消されます。
分類
この病気の 2 つの臨床形態を区別するのが通例です。
- 腎性尿崩症(末梢性)。 この形態の疾患は、バソプレシンの生物学的影響に対する遠位尿細管の感受性が低下しているか、完全に欠如していることの結果として起こります。 原則として、これは慢性腎臓病理(腎盂腎炎または多発性嚢胞腎を背景とする)、血液中のカリウム含有量の長期的な減少、およびタンパク質摂取が不十分な場合のカルシウムレベルの増加の場合に観察されます。食物によるもの - タンパク質飢餓、シェーグレン症候群、一部の先天性欠損症。 場合によっては、この病気は家族性です。
- 神経性尿崩症(中枢性)。 神経系、特に視床下部または下垂体後部の病理学的変化の結果として発症します。 原則として、この場合の病気の原因は、下垂体を完全または部分的に除去する手術、この領域の浸潤性病状(ヘモクロマトーシス、サルコイドーシス)、外傷または炎症性の変化です。 場合によっては、神経性尿崩症は特発性であり、同じ家族の複数のメンバーで同時に発生します。

尿崩症の症状
尿崩症の最初の兆候は、重度の痛みを伴う口渇 (多飲) と頻繁な多尿 (多尿) であり、夜間であっても患者を悩ませます。 1日あたり3〜15リットルの尿が排出され、その量は1日あたり20リットルに達することもあります。 したがって、患者は激しい喉の渇きに悩まされます。
- 男性の尿崩症の症状は、性欲と精力の低下です。
- 女性の尿崩症の症状: 無月経に至るまでの月経不順、関連する不妊症、および妊娠した場合の自然流産のリスクの増加。
- 子供の糖尿病の症状は顕著です。 新生児や幼児では、この病気の状態は通常重篤です。 体温が上昇し、原因不明の嘔吐が起こり、神経系の障害が発症します。 思春期までの年長児の尿崩症の症状は、夜尿症または夜尿症です。
その後進行すると以下のような症状が現れます。
- 大量の水分を摂取すると、胃が伸び、時には下がってしまうこともあります。
- 脱水症状(体内の水分不足)の兆候が現れます:皮膚や粘膜の乾燥(口渇)、体重の減少。
- 大量の尿が放出されるため、膀胱は引き伸ばされます。
- 体内の水分が不足すると、胃や腸での消化酵素の生成が妨げられます。 したがって、患者の食欲は減退し、胃炎や大腸炎が発症し、便秘になる傾向があります。
- 多くの場合、血圧が低下し、心拍数が増加します。
- 体内の水分が不足するため、発汗が減少します。
- 患者はすぐに疲れてしまいます。
- 時々、原因不明の吐き気や嘔吐が起こることがあります。
- 体温が上昇する可能性があります。
- 夜尿症(夜尿症)が起こることもあります。
夜間も喉の渇きと多尿が続くため、患者は精神的および感情的な障害を発症します。
- 情緒不安定(場合によっては精神病さえ発症する)および過敏性。
- 不眠症と頭痛。
- 精神活動の低下。
これらは典型的な場合の尿崩症の兆候です。 ただし、病気の症状は男性と女性、および子供では若干異なる場合があります。
診断
典型的な場合、尿崩症の診断は難しくなく、以下に基づいて行われます。
- 顕著な喉の渇き
- 1日の尿量が3リットル以上
- 血漿高浸透圧濃度(290 mOsm/kg以上、水分摂取量に依存)
- ナトリウム含有量が高い
- 尿の低浸透圧濃度 (100 ~ 200 mOsm/kg)
- 尿の相対密度が低い (<1010)
病気の原因を特定するために、X線検査、眼科検査、精神神経検査の結果が注意深く分析されます。 脳の磁気共鳴画像診断が必要です。

尿崩症の治療方法は?
この病状の治療が成功するかどうかは、バソプレシンの産生不全を引き起こす主な原因、たとえば中枢性尿崩症における脳内の腫瘍や転移を正確に特定し、除去することにかかっています。
尿崩症の治療薬は主治医によって選択されますが、それらはすべて抗利尿ホルモンの合成類似体です。 薬の作用時間に応じて、1日に数回または数日に1回(長時間作用型薬)服用する必要があります。
中枢性尿崩症には、カルバマゼピンまたはクロルプロパミドという薬が最もよく使用されます。これらの薬はバソプレシンの産生と放出を刺激します。 大量かつ頻繁な排尿を背景に体の脱水症状を防ぐために、患者には生理食塩水の点滴が投与されます。
女性の尿崩症の治療は、婦人科医との追加の相談と月経周期の修正で構成されます。
栄養のルール
糖尿病患者と砂糖は「特別な」関係にあることは誰もが知っています。 しかし、もし病気が尿崩症の場合、栄養については何が言えるでしょうか? この場合、制限は別の製品である塩に影響します。 患者が腎不全に苦しんでいない場合は、塩をサナソルなどの栄養補助食品に置き換えることができます。
この病気の食事療法では、タンパク質食品の摂取を制限します(1日あたり70g以下)。 患者には食事表番号 7 が推奨されます。
食事には次の食べ物と飲み物が含まれます。
- 甘酸っぱい味わいのベリーやフルーツ。
- 新鮮な野菜。
- 絞りたてのジュース、クワス、ハーブティー、グリーンティー。
- レモン汁を加えた水。
- 発酵乳製品および飲料。
- 赤身の肉のタイプ。
- 低脂肪の魚や魚介類。
予報
特発性尿崩症は、適切な補充療法を受ければ、患者の生命に危険を及ぼすことはありませんが、この形態からの回復は不可能です。
他の病気を背景に発生する尿崩症は、原因となった原因が取り除かれると自然に治る場合があります。
1 型糖尿病は、インスリンの絶対的な欠乏によって現れる、膵島のインスリン産生ベータ細胞の破壊を引き起こす臓器特異的な自己免疫疾患です。 場合によっては、明らかな 1 型糖尿病患者には、ベータ細胞に対する自己免疫損傷のマーカーが欠如している (特発性1型糖尿病)。
病因
1 型糖尿病は遺伝的素因を持つ病気ですが、病気の発症への寄与は小さいです(病気の発症は約 1/3 で決定されます)。 病気の母親を持つ子供が 1 型糖尿病を発症する確率は 1 ~ 2%、父親 - 3 ~ 6%、兄弟または姉妹 - 6% です。 抗膵島抗体、抗グルタミン酸デカルボキシラーゼ抗体 (GAD 65) および抗チロシンホスファターゼ抗体 (IA-2 および IA-2beta) を含む、自己免疫ベータ細胞損傷の 1 つ以上の体液性マーカーが 85 ~ 90 年代に見られます。患者の割合。 それにもかかわらず、ベータ細胞の破壊における主な重要性は細胞性免疫因子に与えられます。 1 型糖尿病は、HLA ハプロタイプ DQA および DQB と関連しています。 1 型糖尿病は、他の自己免疫内分泌疾患 (自己免疫性甲状腺炎、アジソン病) や脱毛症、白斑、クローン病、リウマチ性疾患などの非内分泌疾患と合併する頻度が高くなります。
病因
1 型糖尿病は、ベータ細胞の 80 ~ 90% が自己免疫プロセスによって破壊されると発症します。 このプロセスの速度と強度は大幅に異なる場合があります。 最も頻繁に起こるのは、 典型的なコース子供や若者の病気では、このプロセスは非常に急速に進行し、その後、病気が急速に発現します。最初の臨床症状の出現からケトアシドーシス(ケトアシドーシス昏睡まで)の発症まで、わずか数週間しかかかりません。
他の非常にまれなケースでは、通常は 40 歳以上の成人で、この病気が潜在している可能性があります。 (成人の潜在性自己免疫性糖尿病 - LADA)、さらに、そのような患者は病気の発症時に 2 型糖尿病と診断されることが多く、数年間はスルホニル尿素薬を処方することで糖尿病を補うことができます。 しかし、その後、通常は 3 年後に、絶対的なインスリン欠乏の兆候が現れます(錠剤の血糖降下薬を服用しているにもかかわらず、体重減少、ケトン尿、重度の高血糖)。
1 型糖尿病の病因は、絶対的なインスリン欠乏に基づいています。 グルコースがインスリン依存性組織(脂肪および筋肉)に入ることができないとエネルギー不足が生じ、その結果、脂肪分解およびタンパク質分解が強化され、体重減少につながります。 血糖値の上昇は高浸透圧を引き起こし、浸透圧利尿と重度の脱水を伴います。 インスリン欠乏およびエネルギー欠乏の条件下では、抑制ホルモン(グルカゴン、コルチゾール、成長ホルモン)の産生が阻害され、血糖の増加にも関わらず糖新生の刺激が引き起こされます。 脂肪組織における脂肪分解の増加は、遊離脂肪酸の濃度の大幅な増加につながります。 インスリン欠乏症では、肝臓の脂肪合成能力が抑制され、遊離脂肪酸がケト生成に含まれ始めます。 ケトン体の蓄積は、糖尿病性ケトーシスの発症につながり、その後ケトアシドーシスを引き起こします。 脱水症状とアシドーシスが進行すると昏睡状態になり、インスリン療法や水分補給がなければ必然的に死に至ります。
疫学
1 型糖尿病は、すべての糖尿病症例の 1.5 ~ 2% を占めます。 白人が生涯で 1 型糖尿病を発症するリスクは約 0.4% です。 1 型糖尿病の発症のピーク年齢は約 10 ~ 13 歳です。 ほとんどの場合、1 型糖尿病は 40 歳未満で発症します。
臨床症状
典型的なケースでは、特に子供や若者では、1 型糖尿病は明確な臨床像を伴って発症し、数か月から場合によっては数週間かけて発症します。 1 型糖尿病の発症は、感染症やその他の付随疾患によって引き起こされる場合があります。 特性 あらゆる種類の糖尿病に共通する症状、高血糖に関連する症状としては、多飲、多尿、かゆみがありますが、1 型糖尿病ではこれらが非常に顕著です。 そのため、患者は 1 日を通して最大 5 ~ 10 リットルの水分を摂取し、排泄することができます。 特定の 1 型糖尿病の場合、インスリンの絶対的な欠乏によって引き起こされる症状は、1 ~ 2 か月で 10 ~ 15 kg に達する体重減少です。 全身性および筋力の重度の衰弱、パフォーマンスの低下、および眠気を特徴とします。 病気の初期に食欲の増加を経験する患者もいますが、ケトアシドーシスが進行するにつれて食欲不振に変わります。 後者は、口からのアセトン臭(またはフルーティーな匂い)の出現、吐き気、嘔吐、しばしば腹痛(偽腹膜炎)、重度の脱水症状を特徴とし、最終的には昏睡状態に陥ります。 場合によっては、小児における 1 型糖尿病の最初の症状は、付随疾患 (通常は感染症または急性外科的病理) による昏睡に至る進行性の意識障害です。
まれに、35~40歳以上の人に1型糖尿病が発症することがあります。 (成人の潜在的な自己免疫性糖尿病)この病気はそれほど明確に現れないこともあり(中等度の多飲と多尿、体重減少なし)、日常的な血糖値の測定中に偶然検出されることもあります。 このような場合、患者は多くの場合、最初に 2 型糖尿病と診断され、錠剤の血糖降下薬が処方され、しばらくの間は糖尿病に対する許容範囲の補償が提供されます。 しかし、数年の間に(多くの場合1年以内に)、患者はインスリンの絶対的欠乏の増加によって引き起こされる症状、つまり体重減少、錠剤の血糖降下薬を背景とした正常な血糖の維持不能、ケトーシス、ケトアシドーシスを発症します。
診断
1 型糖尿病には明確な臨床像があり、比較的まれな疾患でもあることを考慮すると、1 型糖尿病を診断するための血糖値のスクリーニング測定は必要ありません。 患者の近親者がこの疾患を発症する可能性は低く、1 型糖尿病の一次予防に効果的な方法が存在しないことと合わせて、その患者の疾患の免疫遺伝マーカーを研究することが不適切であることが決定されています。 ほとんどの場合、1 型糖尿病の診断は、絶対的インスリン欠乏の重篤な臨床症状を示す患者における重大な高血糖の確認に基づいています。 経口ブドウ糖負荷試験 1 型糖尿病の診断を目的として、非常にまれに実施する必要があります。
鑑別診断
疑わしい場合(明らかな臨床症状がないのに中程度の高血糖が検出された場合、比較的高齢での症状が現れた場合)、および他の種類の糖尿病との鑑別診断の目的で、レベル判定が使用されます。 C-ペプチド(基礎と食後2時間)。 疑わしい場合の間接的な診断価値では、定義には次のようなものがある可能性があります。 免疫学的マーカー 1 型糖尿病 - 膵島、グルタミン酸デカルボキシラーゼ (GAD65) およびチロシン ホスファターゼ (IA-2 および IA-2P) に対する抗体。
処理どのタイプの糖尿病も、低血糖療法(1 型糖尿病の場合 - インスリン療法)、食事療法、患者教育という 3 つの主要な原則に基づいています。 1型糖尿病に対するインスリン療法は、 代替性そしてその目標は、受け入れられた補償基準を達成するために、生理学的ホルモンの産生を可能な限り模倣することです。 集中インスリン療法は、生理学的インスリン分泌に最も近いものです。 それに応じたインスリンの必要性 基礎分泌中間型インスリンの2回注射(朝と夕方)または持効型インスリン(グラルギン)の1回の注射によって提供されます。 基礎インスリンの総用量は、薬剤の 1 日の総必要量の半分を超えてはなりません。
食事またはボーラスインスリン分泌の代わりに、各食事の前に短時間作用型または超短時間作用型インスリンを注射します。その用量は、次の食事中に摂取されると予想される炭水化物の量と、患者が測定した既存の血糖レベルに基づいて計算されます。各インスリン注射の前に血糖計を使用します。
1 型糖尿病の発症とインスリン療法の開始後、かなり長期間が経過した後では、インスリンの必要性は少なくなり、0.3 ~ 0.4 U/kg 未満になることがあります。 この期間は寛解期と呼ばれます。 "ハネムーン"。残りの 10 ~ 15% のベータ細胞によるインスリン分泌が抑制される高血糖とケトアシドーシスが一定期間続いた後、インスリンの投与によってホルモン代謝異常が補償され、これらの細胞の機能が回復し、これらの細胞が引き継いで最小限のインスリンを体に供給します。レベル。 この期間は数週間から数年続くこともありますが、最終的には残りのベータ細胞が自己免疫によって破壊されるため、ハネムーンは終了します。