鶏胚の感染。 ニワトリ胚の実験的感染方法 他の辞書で「ニワトリ胚」の意味を調べる
作成者: 教師 Ugysheva Sh.E.
スライド 3
ウイルスの構造
スライド 4
ウイルスの構造 A – 単純なウイルス B – 複雑なウイルス
スライド 5
危険度に基づいて、ウイルスは 4 つのグループに分類されます: グループ I: エボラ出血熱、ラッサ熱、マールブルグ病、マチュポ熱、天然痘、B 型肝炎ウイルス (サル) の病原体。 グループ II: アルボウイルス、一部のアレナウイルス、狂犬病ウイルス、ヒト C 型および B 型肝炎ウイルス、HIV。 グループ III - インフルエンザウイルス、ポリオ、脳心筋炎、ワクシニア。 グループ IV - アデノウイルス、コロナウイルス、ヘルペスウイルス、レオウイルス、オンコウイルス。
スライド 6
スライド 7
ウイルス分類の原則 核酸の種類、その構造、複製戦略 サイズ、形態、ビリオンの対称性、カプソメアの数、スーパーカプシドの存在。 特定の酵素、特に RNA および DNA ポリメラーゼ、ノイラミニダーゼの存在 物理的および化学的因子、特にエーテルに対する感受性 免疫学的特性 自然の伝達機構 宿主、その組織および細胞に対する向性 病理学、封入体の形成 疾患の症状学。
スライド 8
ウイルスの分類 (RNA を含む)
スライド 9
ウイルスの分類(DNAを含む)
スライド 10
ウイルスの化学組成 ウイルスには、核酸、タンパク質、脂質、糖脂質、糖タンパク質が含まれます。 ウイルス粒子には常に 1 種類の核酸 (DNA または RNA) が含まれており、ビリオンの質量の 1% ~ 40% を占めます。 ウイルスのゲノムには、ほんの数種類のタンパク質を合成するのに十分な情報が含まれています。 その質量は細胞の100万分の1である10~15mgに達し、長さは最大0.093mm、ヌクレオチド対の数は3150(B型肝炎ウイルス)から230,000(痘瘡ウイルス)の範囲に及びます。 ウイルスタンパク質 (70 ~ 90%) は、構造タンパク質と非構造タンパク質に分けられます。 構造 - 成熟した細胞外ビリオンの一部であるタンパク質。 これらは多くの重要な機能を果たします: - 核酸を外部損傷から保護する; 敏感な細胞の膜と相互作用する; 細胞へのウイルスの浸透を確実にする; - RNA および DNA ポリメラーゼ活性などを有する。成熟したビリオンの一部ではありませんが、その複製中に形成されます。 それらは: - ウイルスゲノムの発現の制御を提供します - 細胞の生合成を抑制する可能性があるウイルスタンパク質の前駆体です。 ビリオン内の位置に応じて、タンパク質はキャプシド、スーパーキャプシド、マトリックス、コアタンパク質、および核酸関連タンパク質に分類されます。 脂質 (15 ~ 35%) は複雑なウイルスに含まれており、二重脂質層を形成するスーパーキャプシド シェルの一部です。 それらは: - ウイルスエンベロープを安定化する - 外部環境の親水性物質からビリオンの内層を保護する - ビリオンの除タンパク質に関与する。
スライド 11
ウイルスの再生産。 その特徴は、ゲノムが RNA と DNA の両方で表され、その構造と形態が多様であり、ほとんどすべてのウイルス RNA が細胞の DNA とは独立して複製できることです。ウイルスには固有の選言的複製方法があります。ゲノムとウイルスタンパク質の合成は時空間的に分離されているという事実。核酸は細胞核で複製され、タンパク質は細胞質で複製され、ビリオン全体の集合は細胞質膜の内面で発生する可能性があります。 ウイルスの複製は、真核細胞内で外来情報を再作成するための独特のシステムであり、細胞構造がウイルスのニーズに絶対的に従属することを保証します。 ウイルスの繁殖にはいくつかの段階があります。 初期のものには、細胞表面へのウイルスの吸着、細胞内への侵入(浸透)、および脱衣(脱タンパク質)が含まれます。 後期段階 (ウイルスゲノム戦略) には、ウイルス核酸合成、タンパク質合成、ビリオン構築、および細胞からのウイルス粒子の放出が含まれます。
スライド 12
ウイルスの細胞表面への付着は、非特異的および特異的という 2 つのメカニズムによって確実に行われます。 非特異的かどうかは、ウイルスの表面にある化学基と、異なる電荷を帯びた細胞との間に生じる静電相互作用の力によって決まります。 特定のメカニズム (逆吸着および非可逆吸着) は、相補的なウイルス受容体と細胞受容体によって決定されます。 それらはタンパク質、炭水化物、または脂質の性質のものである可能性があります。 たとえば、インフルエンザウイルスの受容体はシアル酸です。 吸着サイトの受容体の数は 3000 に達する場合があります。ウイルスの表面では、受容体は通常、くぼみや隙間の底にあります。 ウイルスの細胞への侵入は、高分子量の特別なブロックであるクラスリンを含む細胞膜の特別な領域における受容体エンドサイトーシス(ウイルスペクシスの一種)のメカニズムを通じて起こります。 膜は陥入し、クラスリンで覆われた細胞内空胞が形成されます。 その数は2000に達することもあります。液胞は結合してレセプトソームを形成し、後者はリソソームと融合します。 ウイルスの表面タンパク質はリソソームの膜と相互作用し、その核タンパク質が細胞質に放出されます。 しかし、ウイルスが細胞に侵入するには別のメカニズム、つまり膜融合の誘導が存在します。 それは特別なウイルス融合タンパク質(F-融合-融合)のおかげで起こります。 このプロセスの結果、ウイルスのリポタンパク質エンベロープが細胞膜と一体化し、そのゲノムが細胞に浸透します。 このようなタンパク質は、インフルエンザウイルス、パラインフルエンザ、ラブドウイルスなどで確認されています。
スライド 13
ビリオンの脱衣は多段階のプロセスであり、その間にウイルスの核装置が解放され、ゲノム発現を阻害する保護殻が消失します。 それは、リソソームとゴルジ装置という特殊な領域で発生します。 生殖の後期段階では、ウイルスの核酸とタンパク質の合成が目的となります。 複製のメカニズム(前のウイルスの正確なコピーであるウイルスゲノムの形成)は、核酸の特性に依存します。 ウイルスの種類が異なれば同じではありません。 RNA を含むウイルスの複製は、同様のパターンに従って発生します。 mRNA は母 RNA 上で合成され、RNA の中間体はウイルスゲノム合成の鋳型として機能します。 転写はメッセンジャー RNA の形成プロセスです。 これは、DNA または RNA 依存性 RNA ポリメラーゼと呼ばれる特別な酵素の助けを借りて起こります。 DNA ウイルスは細胞起源のこれらの酵素を持っていますが、RNA ウイルスは独自のウイルス特異的な転写酵素を持っています。 翻訳段階では、メッセンジャーRNAから遺伝情報が読み取られ、アミノ酸配列に翻訳されます。 このプロセスはリボソームで発生します。 RNA分子は、転移RNAによって認識されるトリプレットコード配列に従ってリボソームに移動します。 後者は特別な領域にアミノ酸を運びます。
スライド 14
スライド 15
スライド 16
ウイルスの培養 生後 6 ~ 12 日の鶏の胚。 感染経路 - 開放型、閉鎖型
スライド 17
ウイルスの培養 細胞培養物: - ヒト胚、サル腎臓、ニワトリ胚線維芽細胞などのトリプシン処理した一次培養物。 二次培養として数継代にわたって増殖することができます。 移植可能な細胞。 それらは、無限の成長と複製の能力を獲得した細胞培養物です。 これらは、腫瘍、または核型が変化した正常なヒトまたは動物の組織から得られます。 HeLa (子宮頸がん) Hep-2 (ヒト喉頭がん)、CV (ヒト口腔がん)、RD (ヒト横紋筋肉腫)、RH (ヒト胎児腎臓)、Vero (ミドリザル腎臓)、SPEV (ブタ胎児腎臓)、VNK- 32 (シリアンハムスターの腎臓)。 細胞培養二倍体細胞。 これらは同じ種類の細胞の培養物であり、二倍体の染色体セットを持ち、実験室条件で最大 100 回の継代培養に耐えることができます。 これらは、外来ウイルスによる汚染がなく、継代中に元の核型を保持し、発癌活性を持たないため、ウイルスのワクチン調製物を入手するのに便利なモデルです。 ほとんどの場合、ヒト胎児線維芽細胞 (WI-38、MRC-5、MRC-9、IMR-90)、ウシ、ブタ、ヒツジなどから得られる培養株が使用されます。 細胞培養物は冷凍保存されます。
スライド 18
細胞培養またはその増殖をサポートするために使用される栄養培地は、天然または合成 (人工) の場合があります。 天然培地 - 牛の血清、漿液腔からの液体、乳加水分解生成物、さまざまな加水分解物 (5% 血液加水分解物、0.5% ラクトアルブミン加水分解物)、または組織抽出物。 それらの化学組成は、人体に存在するものと同様の状態を作り出すのに役立ちます。 このような媒体の重大な欠点は、媒体を構成する成分の定性的および量的組成が異なる可能性があるため、非標準的な性質であることです。 合成栄養培地は、人工条件下でさまざまな塩溶液(ビタミン、アミノ酸)を組み合わせて得られるため、化学組成が標準的であるため、この欠点はありません。 これらの最も一般的に使用されるソリューションには、培地 199 (トリプシン処理および連続細胞培養の初代培養)、イーグル培地 (最小限のアミノ酸とビタミンを含み、二倍体細胞株および連続細胞株の培養に使用されます)、イーグル MEM 培地 (培養) が含まれます。特に要求の厳しい細胞株の)、培地の作成、細胞の洗浄などに使用される溶液ハンクス。
スライド 19
スライド 20
スライド 21
実験動物の感染。 ウイルス学では、ウイルスの分離と同定、特定の抗ウイルス血清の取得、ウイルス疾患の病因のさまざまな側面の研究、疾患と闘う方法とその予防方法の開発のために、多数の実験動物が広く使用されています。 最も一般的に使用されるのは、さまざまな年齢の白マウス (生後 2 日)、白ラット、モルモット、ウサギ、ホリネズミ、ワタオネズミ、サルなどです。
スライド 22
動物に感染するには、ウイルスの指向性と病気の臨床像に応じてさまざまな方法があります。 試験物質は以下の方法で投与できます。 - 口を通して - 気道内(吸入、鼻を通して) - 皮膚 - 皮内 - 皮下、筋肉内 - 静脈内 - 腹腔内 - 心臓内 - 傷ついた角膜上 - 前眼房内- 脳の中へ。
スライド 23
スライド 24
スライド 25
スライド 26
バクテリオファージ (ファージ) (古代ギリシャ語 φᾰγω - 「私は貪る」に由来) は、細菌細胞に選択的に感染するウイルスです。 ほとんどの場合、バクテリオファージは細菌内で増殖し、細菌の溶解を引き起こします。 通常、バクテリオファージは、タンパク質のコートと、一本鎖または二本鎖の核酸 (DNA、またはそれほど一般的ではないが RNA) の遺伝物質で構成されます。 粒径は20~200nm程度です。 フランス系カナダ人の微生物学者デレルのフレデリック・トゥールトとは独立して、フェリックスは1917年9月3日にバクテリオファージの発見を報告した。 これに加えて、ロシアの微生物学者ニコライ・フェドロヴィチ・ガマレヤが、1898年に移植可能な薬剤の影響下で細菌(炭疽菌)が溶解する現象を初めて観察したことが知られている。 ライフサイクル 細菌細胞との相互作用の初期段階にある温帯バクテリオファージと毒性バクテリオファージは同じサイクルを持っています。 ファージ特異的細胞受容体へのバクテリオファージの吸着。 宿主細胞へのファージ核酸の注入。 ファージと細菌の核酸の共複製。 細胞分裂。 さらに、バクテリオファージは、溶原性経路または溶解経路という 2 つのモデルに従って発生する可能性があります。 細胞分裂後の温帯バクテリオファージはプロファージ状態 (溶原性経路) にあります。 毒性バクテリオファージは、溶解モデルに従って発生します。ファージの核酸は、細菌のタンパク質合成装置を使用してファージ酵素の合成を指示します。 ファージは何らかの方法で宿主の DNA と RNA を不活性化し、ファージの酵素がそれを完全に分解します。 ファージのRNAは、タンパク質合成のための細胞装置に「従属」します。 ファージ核酸は複製し、新しいエンベロープタンパク質の合成を指示します。 新しいファージ粒子は、ファージ核酸の周囲のタンパク質の殻 (キャプシド) の自発的自己集合の結果として形成されます。 リゾチームはファージRNAの制御下で合成されます。 細胞溶解: 細胞はリゾチームの影響下で破裂します。 約200~1000個の新しいファージが放出される。 ファージは他の細菌に感染します。 1 - 頭部、2 - 尾、3 - 核酸、4 - カプシド、5 - 「首輪」、6 - 尾のタンパク質鞘、7 - 尾原線維、8 - 棘、9 - 基底板
スライド 27
ニワトリ胚の感染 ニワトリ胚はウイルスやマイコプラズマの培養に使用されます。 ウイルスの種類や感染方法に応じて、生後8〜14日の胚が使用されます。 絨毛膜尿膜、尿膜腔および羊膜腔、卵黄嚢へ。 感染前に、胚の生存率が卵鏡で判定され、気嚢の境界が殻に鉛筆でマークされます。 鶏胚の感染は、厳密な無菌条件下で、煮沸滅菌した器具を使用して箱内で行われます。 空気層の上の殻をアルコールで拭き、炎で焼き、2%ヨウ素溶液を塗り、再度アルコールで拭き、焼きます。 0.05~0.2mlのウイルス物質をツベルクリン注射器またはパスツールピペットを用いて絨毛膜尿膜に塗布する。 胚はサーモスタット内で 48 ~ 72 時間培養した後、解剖されます。 クロラント酸膜におけるウイルスの存在は、次のように判定されます。 1. さまざまな形の白っぽい不透明なスポットによって; 2. 2. 赤血球凝集反応において。
スライド 28
スライド 29
スライド 30
スライド 31
ありがとう!!!
すべてのスライドを表示
ウイルス学的研究には、生後 7 ~ 12 日の鶏の胚が使用されます ( ほとんどの場合9〜12日、場合によっては5〜12日)。
感染前に、胚の生存率が判定されます。 卵管鏡検査中、生きている胚は動きやすく、血管のパターンがはっきりと見えます。 気嚢の境界は簡単な鉛筆でマークされます。 ニワトリの胚は、空気層の上の殻をヨウ素またはアルコールで前処理した後、無菌器具を使用して無菌条件下で感染させます。
鶏胚への感染方法ウイルスの漿尿膜への適用、羊膜腔および尿膜腔への適用、卵黄嚢への適用、および胎児の体内への適用は異なる場合があります。 感染方法の選択は、研究対象のウイルスの生物学的特性によって異なります。
鶏の胚に感染するには次の 2 つの方法があります。
1) 開く - 気嚢上の殻をアルコールとヨウ素で処理し、鋭いハサミで殻を切り取り、気嚢殻のトップシートを取り除き、感染を実行します。 穴は特別なガラス蓋またはシェルで閉じられ、滅菌溶解パラフィンで密閉されます。
2) 閉鎖 - 気嚢上の殻をアルコールとヨウ素で処理し、穿刺器具で殻に穴を開け、制御下で太い針が付いた注射器を使用してウイルスを含む物質を0.1~0.2ml注入します。卵鏡の。 穴は滅菌溶解パラフィンで閉じられます。
感染した胚はサーモスタット内で 2 ~ 4 日間培養されます。 その後、血管収縮を最大限に高めるために、一日中 4℃に冷却されます。 事前にアルコールまたはヨウ素で殻を処理し、無菌条件下で開きます。
ニワトリ胚におけるウイルスの兆候は、胚の死、尿膜腔または羊水の入ったガラス上での陽性の血球凝集反応、および絨毛膜尿膜上の限局性病変(「プラーク」)によって示されます。
ウイルスは生きた細胞内でのみ培養できます。 この目的のために、動物有機体、ニワトリの胚、細胞培養など、あらゆる生物学的システムが使用されます。 実験動物を選択する場合は、次の要件を満たす必要があります。 - 動物は健康でなければなりません。 ビバリウムに新しく到着した個体は隔離されます(マウスとラットは14日間、その他は21日間)。 ウイルス病因の潜在的(隠れた)感染を除外するため。
すべての動物について、次の要件が満たされています。 - 動物はこのウイルスに対して敏感でなければなりません。 - 動物の年齢は非常に重要です。若年動物と新生児が最も感受性が高いですが、場合によっては、病気の明確な臨床徴候を特定するために成体動物が使用されます。 - 動物は同じ年齢と体重でなければなりません。 線形動物はこれに適しています。 近親交配の結果として得られたもの。
ウイルス学的研究では、実験動物の皮下、皮膚、皮内、筋肉内、腹腔内、静脈内、経口、鼻腔内、および脳内感染が使用されます。
トピック「細菌の培養。細菌の培養方法。コロニーの兆候。」の目次:ウイルス検出のための臓器培養。 ウイルス感染症の診断における鶏の胚。 ニワトリ胚ウイルスによる感染。 鶏胚ウイルスの感染方法。
すべての種類の細胞がモノスロンの形で増殖できるわけではありません。場合によっては、分化した細胞を維持できるのはモノスロンのみです。 臓器培養。 これは通常、特殊な機能を持つ組織の懸濁液であり、生存組織培養とも呼ばれます。
ウイルス感染症の診断における鶏胚
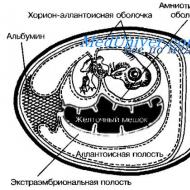
鶏の胚(図 11-20) は、特定のウイルス (インフルエンザや麻疹など) を培養するためのほぼ理想的なモデルです。 胚の閉じた空洞は、外部からの微生物の侵入や自然発生的なウイルス感染の発症を防ぎます。 胚は病理学的物質からウイルスを一次分離するために使用されます。 ウイルスを継代して保存するため、また必要な量のウイルスを入手するためです。 一部の病原体(ヘルペスウイルスなど)は、特徴的な変化を引き起こします(病気は病原体によって認識されます)。 感染は絨毛膜尿膜、羊膜腔または尿膜腔、または卵黄嚢で起こります。
絨毛膜尿膜上のウイルス感染。 通常、生後10〜12日の胚が使用されます。 卵を透過光で観察し、気嚢の位置を記録し、血管のない領域を選択します。 慎重に殻の破片を取り外し、外側の殻を解放し、穏やかな圧力で剥がします。 次に気嚢の端に穴を開けます。 この穴から吸引すると、絨毛尿膜が外膜から剥がれます。 細菌や原生動物を含まない試験材料を適用します(細菌フィルターを通過させ、殺菌剤で処理します)。 羊膜腔内の感染。 通常、生後7〜14日の胚が使用され、絨毛膜尿膜を剥離した後(上記参照)、開口部が拡張され、羊膜がピンセットでつかまれ、絨毛尿膜を通して除去されます。 それを通して、試験物質が羊腔に導入されます。
尿膜腔内のウイルス感染。 生後10日の胚は、殻とその下にある膜に開けられた穴を通して感染します(上記参照)。
卵黄嚢のウイルス感染。 生後3〜8日の胚が使用され、この年齢では卵黄嚢が卵腔のほぼ全体を占めています。 感染は気嚢に開けられた穴を通して起こります。
 米。 11-20。 発生中のニワトリの胚の概略図.
米。 11-20。 発生中のニワトリの胚の概略図.
鶏胚ウイルス感染結果の観察と記録
内容物がウイルス含有物として利用される可能性がある 卵黄嚢、尿膜腔および羊水、または胚全体を周囲の組織とともに細かく切断します。 絨毛尿膜上の特徴的な病変を特定するために、殻と外膜が除去されます。 次いで、膜を取り出し、滅菌水中に入れる。 病変の性質は暗い背景に対して研究されます。
鶏の胚 鶏の胚
(CE) - 胚発生のさまざまな段階にあるニワトリの胚。 微生物の中で。 実際には、ウイルス、リケッチア、場合によっては細菌の分離、培養、同定に使用されます。 実験目的では、透明度が高く、亀裂のない殻を備えた新鮮な受精 EC が選択されます。 孵化は、37〜37.5℃、相対湿度63〜65%の換気の良い孵卵器またはサーモスタット内で、卵の鈍端を上に向けた三脚巣で行われます。 感染のために、顕著な血管、卵黄嚢、および可動性の影を有する生後4〜13日の胚が選択されます。 感染前に、卵の殻をアルコールで処理し、燃やし、導入領域(通常は空気室の上)に2%ヨウ素チンキを塗ります。 資料または研究 殻を開けて、または開かずに、卵黄嚢(リケッチア)、尿膜腔または羊膜腔(ほとんどのウイルス)に注射され、絨毛膜尿膜に適用されます。 それほど一般的ではありませんが、胎児の体内または静脈内に注射されます。 感染した EC は、微生物の種類と研究の目的に応じた条件と期間でサーモスタット内に置かれます。 感染の結果に関する一部のデータは、顕微鏡による EC の外部検査 (血管の注入、運動性の喪失など) によって取得できます。 ただし、ECを開設する場合がほとんどです。 これを行うには、アルコールとヨードチンキで処理した後、気嚢の境界より上で殻を切り取り、最初に尿膜、次に羊水をパスツールピペットまたは注射器で吸引し、血管や羊膜への損傷を避けます。卵黄嚢。 胚と漿尿膜を殻から取り出し、滅菌皿に置き、滅菌蒸留液で洗浄します。 水をかけ検査します。 胚とその体液の研究のさらなる過程は、微生物またはウイルスの種類と実験の目的によって異なります。
(出典: 微生物用語辞典)
他の辞書で「ニワトリの胚」が何であるかを見てください。
胎児毒性- 胚毒性、物理的、生物学的、化学的およびその他の物質が発育中の胚に悪影響を与える能力。 さまざまな物質の胚毒性効果は、それらを雌に曝露することによって決定されます。 獣医学事典
「Chickens」のリクエストはここにリダイレクトされます。 他の意味も参照してください。 ? 国産鶏肉・・・ウィキペディア
鶏 鶏はどんな庭の装飾でもあります 科学的分類 王国: 動物 タイプ: 脊索動物クラス ... ウィキペディア
実験動物におけるウイルスの分離。
実験動物の選択はウイルスの種類によって異なります。 実験動物は生物学的モデルです。 場合によっては、ウイルスを実験室条件に適応させる前に、3 ~ 5 回の「盲検」無症状継代を行う必要があることがあります。 ただし、実験動物は一部のウイルスに対して感受性を持たないため、その場合は自然に感受性のある動物を使用する必要があります。 たとえば、豚コレラや馬の感染性貧血などです。
実験動物に感染させる目的:
1. 病気の発症機序を研究する。
2. 病原体からウイルスを分離します。
3. 免疫血清および高度免疫血清の製造。
4. ワクチンの製造。
5. 実験室条件でのウイルスの維持。
6. 単位体積あたりのウイルス量を決定するための滴定。
中和反応を段階的に進行させるための生物学的モデル、7.
実験動物に感染させる方法の選択は、ウイルスの指向性によって異なります。 したがって、向神経性ウイルスを培養する場合、動物は脳に感染します。 呼吸器、鼻腔内、気管内。 皮膚向性薬 - 皮下および皮内。
感染は、無菌および防腐剤の規則に従って行われます。
ウイルスを含む物質を動物の体内に導入するには、次のようなさまざまな方法があります。
皮下; - 脳内; - 皮内;
腹腔内; - 筋肉内; - 眼内;
静脈内; - 鼻腔内; - 栄養補給;
感染後、動物にマークを付け、隔離ボックスに入れて 10 日間監視します。 感染後 1 日目の動物の死亡は非特異的とみなされ、その後は考慮されません。
感染の有効性を示す 3 つの兆候:
臨床徴候の存在
動物の死
病理解剖学的変化(臓器のサイズ、形状、色、一貫性)。
鶏胚とは、鶏の受精卵の中で胚(胎芽)が発育したものです。 ニワトリやウズラの胚でのウイルスの培養は、多くのウイルスや一部の細菌(ブルセラ菌、リケッチア菌、ビブリオ菌)を培養して診断するための最も簡単で信頼できる方法の 1 つとして、最近普及しています。
多くのヒトおよび動物のウイルスは、発生中のニワトリの胚で培養できます。 胚組織、特に胚の上皮組織が豊富な胚の膜は、多くのウイルスの増殖にとって好ましい環境です。 上皮指向性の性質を持つウイルス (天然痘、ILT など) は漿尿膜上でうまく成長し、肉眼で見える変化を引き起こします。 ミクソウイルス(インフルエンザ、ニューカッスル病、犬ジステンパーなど)、伝染性気管支炎ウイルス、アヒルの子肝炎、アルボウイルスなどの代表的なウイルスは、物質が尿膜腔に導入されると胚の中でよく繁殖します。 一部のウイルスは卵黄嚢内で正常に培養できます。
利点:
1. 経済的に有利であり、さらに卵は簡単に入手できます。
2. 発生中のニワトリの胚には保護機構がありません。 免疫システムはまだ発達していません。
3. 卵の殻は、環境からの細菌やウイルスの侵入を防ぎます。
鶏の胚でウイルスを培養して分離するには、通常のサーモスタットまたはインキュベーターという非常に単純な装置が必要です。
条件:
1. 卵は感染症がないことが知られている農場から得られます。
2. 鶏の胚は白色種の鶏 (レグホン鶏、ロシアンホワイト鶏) から取得する方が良いです。なぜなら、鶏の胚は操作に対してより耐性があり、軽度の怪我では死亡しないからです。 また、他の犬種に比べて殻が白く透明で中身が見えやすいため、観察や作業をする際に便利です。
3. 孵化には、10 日以内に産まれた受精卵が選択されます。
4. 汚染されていない卵を採取します。なぜなら、孵卵前に洗浄することができず、汚れた卵は観察 (卵鏡検査) で見えにくく、操作の際に胚が感染する可能性があるためです。
卵は、温水と空気のアクセスを備えた孵卵器またはサーモスタット内で孵化します。サーモスタット内での孵卵中は、卵を1日に2〜3回回転させ、ガス交換を促進するために5〜10分間取り出す必要があります。空中に数分。 一定の湿度を維持するには、水を入れた容器をサーモスタットに入れて蒸発させます。サーモスタット内の温度は 38°でなければなりません。
胚の発育は孵化初日にすでに起こり、脳と骨格の形成が起こります。 生後7〜9日のニワトリの胚の構造(ノートを参照)。
感染には、生後7〜12日の胚が最もよく使用されます。 ニワトリの胚の作業は、無菌室ボックス内で無菌状態を厳守して行われます。
鶏の胚に感染させる目的は次のとおりです。
1. ライニングを特許素材から隔離します。
2. ワクチンの製造。
3. 研究室でウイルスを維持する。
4. ウイルスの力価測定;
中和反応を段階的に進行させるための生物学的モデル; 6.
6. ウイルス干渉とインターフェロン産生の研究。 鶏胚の感染:
感染のためには、明確な運動性を備えた生存可能な胚を選択する必要があります。 感染前に、すべての胚は暗い部屋で卵鏡を使用して注意深く検査されます。
感染前の胚の検死中、プガ(空気腔)、大きな血管の経路、および胚の存在場所の輪郭が簡単な鉛筆で殻に描かれます。つまり、胚が最も近くにある殻上の領域です。それ。 パグの模様、胚の出現場所、太い血管の経路は、感染時にウイルスを含む物質を導入する場所を選択する際のガイドとして役立ちます。
感染のために選択された鶏の胚は箱に移され、そこで作業されます。 感染前に、物質の導入部位の殻をヨウ素添加アルコールで2回処理し、燃やします。 感染線量は0.1〜0.2cmです。
ウイルスの種類や感染目的によって異なります。 ウイルスを含む物質を導入する方法:
1) 漿尿膜の感染症 , 生後7~12日の胚は、向神経性ウイルス、皮膚向性ウイルス、一部の汎向性ウイルス(天然痘、脳脊髄炎、ILT、口蹄疫、狂犬病、ペストなど)の分離と培養に使用されます。 感染には 3 つのオプションがあります。
a)プーガを開いてハサミで切り取り、殻下膜を分離し、材料を漿尿膜(CAO)に適用する。 次に、卵の穴を滅菌ガラスキャップで密閉し、キャップの端にワックスを塗ります。
b)胎芽の提示側の法会の境界で、針やすり(やすり)または鋸歯状のメスを使用して殻を一辺の長さ約1 cmの三角形に切り取り、殻の部分を除去し、星サブ膜をピンセットで剥がし、材料を導入します。 穴は滅菌カバーガラスで覆われ、端はパラフィン処理されるか、滅菌粘着テープでシールされます。
c)胚が提示される場所で約0.5 cmの面積の殻の小さな領域をメスで除去し、次にピンセットまたは針と材料を使用してこの領域の殻下膜を除去します。が注入される。 材料が卵の空洞にうまく収まらない場合は、ゴム球を使用して、卵の殻の穴から卵の空気を排出することができます。その結果、人工卵が卵の部分に形成されます。材料を導入する場所に材料を挿入すると、材料が簡単に挿入されます。 シェルの穴は絆創膏で塞がれるか、ワックスがけされます。
2) 尿膜腔内の感染症。 この感染方法は非常に簡単で、多くのウイルスの分離に使用されています。 感染症のために、生後10〜11日の胚が採取されます。 感染には 2 つのオプションがあります。
a) 感染はプーガを切断せずにプーガを通じて行われます。 針を使用して、プーガの上部からシェルに鉛筆でマークされたプーガの境界までの距離を測定し、マークされた深さまで針を挿入し、さらに0.5 cm深くして漿尿膜に穴をあけます。
b)材料は、胚の提示場所の殻の穿刺を通して無血管領域の3〜5mmの深さまで針で挿入される。 シェルの穴は絆創膏で塞がれるか、ワックスがけされます。
3) 卵黄嚢内の感染症。 感染には生後5〜8日の胚が使用されます。 感染には 2 つのオプションがあります。
a) 卵鏡の制御下で、針を法会の側面から胎芽の提示場所に対して45°の角度で卵黄嚢に挿入します。
b) 卵子を胚の提示点を下にしてスタンドに置き、針を上から下に向かって胚に向かって約 1 cm の深さまで挿入します。
注射部位は粘着テープで密閉され、パラフィン処理されます。 4) 羊膜腔内の感染。この感染方法では、ウイルスが羊水に接触しているさまざまな細胞に侵入して増殖する可能性があります。 感染を容易にするため、感染の2~3日前にパグを上向きにして胚を培養することをお勧めします。 その後、胚と羊膜が上方に移動し、感染しやすくなります。 感染には 2 つのオプションがあります。
a)プーガを開いて切り取り、ピンセットで殻下膜を除去し、羊膜を掴み、ピンセットで羊膜を引き上げ、0.1mlの用量の材料を羊腔に導入する。 次に、シェルの穴を滅菌ガラスキャップで密閉し、端にワックスを塗ります。
b) 暗室で目の管理下でプーガを通して長い針を使用して感染させる まず針の先端を直角に曲げて小さな領域を作成します。 針は、目の制御下で前胚の突起を通して挿入されます。この場合、鈍い針の圧力下で胚が動き、その後、わずかに押して羊膜に穴が開き、針がわずかに動きます。引き戻された。 この場合、胚は針の後ろで上向きに移動する必要があります。 続いて素材の紹介です。
5) 胎児の体内への感染と脳への感染。 生後7〜12日の胚が使用され、物質を体のさまざまな部分または脳に直接導入することによって感染が行われます。 感染のために、プガが開かれ、胚がピンセットで引き上げられます。 これらの感染方法では、感染した胚の数の最大 30% 以上が損傷により死亡する可能性があります。
6) 漿尿膜の大きな血管における感染症。 この感染方法は、前述の方法と同様、非常にまれに使用されます。 血管に沿って殻を剥がした後、細い針で血流に沿って直接血管内に注入します。
感染後、鶏の胚に鉛筆で印を付け、サーモスタットに入れる必要があります。 それらは目視によって毎日監視され、ウイルスの種類に応じて最長7〜8日間観察が行われます。 胚が死亡した場合は、直ちにサーモスタットから取り出し、開封するまで冷蔵庫に保管します。 最初の 14 ~ 18 時間以内に胚が死亡した場合、損傷または病理学的物質の毒性が原因である可能性があります。 したがって、実験動物に感染させる場合と同様に、疑わしい場合には、複数の継代を行い、材料ごとに複数の胚を採取することをお勧めします。
死亡した感染鶏胚、または観察期間が過ぎて摘出された鶏胚の解剖は、無菌箱詰め条件下で無菌規則をすべて守って行われます。 開いたら、殻をアルコールで処理して燃やし、その後プガを切り取ります。 開いた胚から尿膜水を丁寧に吸い出し(量は約7ml)、次に羊膜をピンセットで引き戻し、パスツールピペットで穴をあけて羊水を吸い出します(量は約7ml)。 1.5 ml)、卵黄を収集し、膜と胚を除去します。 体液、膜、胚自体の変化が注意深く検査されます。 羊水は通常完全に透明ですが、感染すると濁って血が混じることがあります。 ウイルスによって引き起こされる特徴的な変化は漿尿膜上で最も顕著です。炎症病巣が現れ、不透明で丸い形をし、出血します。 胎児の体に出血が起こる場合があります。 すべての材料は滅菌容器に収集されます。
ウイルス学では、ニワトリの胚はウイルスの単離だけでなく、抗原の蓄積と取得、生ワクチンと死菌ワクチンの調製、ウイルスの力価測定、ウイルスの中和反応の進行、ウイルスの弱毒化(弱め)、干渉の研究にも広く使用されています。ウイルスの駆除とインターフェロンの入手。