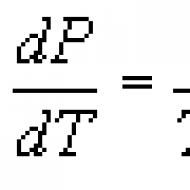क्लैपेरॉन-क्लॉसियस समीकरण। क्लैपेरॉन और क्लॉसियस-क्लैपेरॉन समीकरण किस चरण संक्रमण के लिए क्लैपेरॉन समीकरण लागू होता है?
क्लैपेरॉन-क्लॉसियस समीकरण किसी पदार्थ के एक चरण से दूसरे चरण (वाष्पीकरण, पिघलने, उर्ध्वपातन, बहुरूपी परिवर्तन, आदि) में संक्रमण की प्रक्रियाओं से संबंधित थर्मोडायनामिक समीकरण। के.-के.यू. के अनुसार, एक संतुलन प्रक्रिया के दौरान चरण संक्रमण की गर्मी (उदाहरण के लिए, वाष्पीकरण की गर्मी, संलयन की गर्मी) अभिव्यक्ति द्वारा निर्धारित की जाती है कहाँ टी -संक्रमण तापमान (आइसोथर्मल प्रक्रिया), डीपी/डीटी -किसी दिए गए संक्रमण तापमान पर तापमान के संबंध में दबाव के व्युत्पन्न का मूल्य, ( वि 2-वि 1) - पहले चरण से दूसरे चरण में संक्रमण के दौरान किसी पदार्थ के आयतन में परिवर्तन। समीकरण मूल रूप से 1834 में बी.पी.ई. क्लैपेरॉन द्वारा एक तरल के साथ थर्मल संतुलन में वाष्प को संघनित करने के लिए कार्नोट चक्र के विश्लेषण से प्राप्त किया गया था। 1850 में पी. क्लॉसियस ने समीकरण में सुधार किया और इसे अन्य चरण संक्रमणों तक विस्तारित किया। के. - के. यू. गर्मी के अवशोषण या रिहाई (तथाकथित प्रथम-क्रम चरण संक्रमण) के साथ किसी भी चरण संक्रमण पर लागू होता है, और यह चरण संतुलन की स्थितियों का प्रत्यक्ष परिणाम है (चरण संतुलन देखें) ,
जिससे यह उत्पन्न हुआ है। के. - के. यू. यदि अन्य ज्ञात हों तो समीकरण में शामिल किसी भी मात्रा की गणना के लिए इसका उपयोग किया जा सकता है। विशेष रूप से, इसका उपयोग वाष्पीकरण की गर्मी की गणना करने के लिए किया जाता है, जिसका प्रयोगात्मक निर्धारण महत्वपूर्ण कठिनाइयों से भरा होता है। अक्सर के. - के. यू. डेरिवेटिव के सापेक्ष लिखा गया डीपी/डीटीया डीटी/डीपी:
वाष्पीकरण और उर्ध्वपातन प्रक्रियाओं के लिए डीपी/डीटीसंतृप्त वाष्प दबाव में परिवर्तन को व्यक्त करता है आरतापमान के साथ टी,और पिघलने और बहुरूपी परिवर्तन प्रक्रियाओं के लिए डीटी/डीपीदबाव के साथ संक्रमण तापमान में परिवर्तन निर्धारित करता है। दूसरे शब्दों में, के. - के. यू. चर में चरण संतुलन वक्र का अंतर समीकरण है आर, टी.
K. को हल करने के लिए - K. u. यह जानना आवश्यक है कि तापमान और दबाव के साथ मात्राएँ कैसे बदलती हैं एल, वी 1और वी 2,जो एक कठिन कार्य है. आमतौर पर यह निर्भरता अनुभवजन्य रूप से स्थापित की जाती है और K. - K. u द्वारा हल की जाती है। संख्यात्मक रूप से. के. - के. यू. यह शुद्ध पदार्थों और विलयनों तथा विलयनों के व्यक्तिगत घटकों दोनों पर लागू होता है। बाद के मामले में, के. - के. यू. किसी दिए गए घटक के आंशिक संतृप्त वाष्प दबाव को उसके वाष्पीकरण की आंशिक गर्मी से संबंधित करता है। यू. आई. पॉलाकोव। महान सोवियत विश्वकोश। - एम.: सोवियत विश्वकोश.
1969-1978
.
![]()
देखें कि "क्लैपेरॉन-क्लॉसियस समीकरण" अन्य शब्दकोशों में क्या है:
क्लैपेरॉन मेंडेलीव समीकरण, एक आदर्श गैस के लिए अवस्था का समीकरण (राज्य का समीकरण देखें) (आदर्श गैस देखें), गैस के 1 मोल (एमओएल देखें) को संदर्भित करता है। 1874 में क्लैपेरॉन समीकरण के आधार पर डी.आई. मेंडेलीव (मेंडेलीव दिमित्री इवानोविच देखें) ... ... विश्वकोश शब्दकोश
क्लैपेरॉन-क्लॉसिस समीकरण- किसी पदार्थ के एक चरण से दूसरे चरण (वाष्पीकरण, पिघलने, बहुरूपी परिवर्तन, आदि) में संक्रमण की प्रक्रियाओं से संबंधित थर्मोडायनामिक समीकरण। क्लैपेरॉन क्लॉसिस समीकरण के अनुसार, चरण संक्रमण की गर्मी (उदाहरण के लिए, पिघलने की गर्मी ... धातुकर्म शब्दकोश
एक आदर्श गैस की अवस्था का समीकरण, उसके आयतन V. दबाव pi abs के बीच संबंध स्थापित करना। टी रॉय टी. का रूप है: pV=nRT. जहाँ n गैस के मोलों की संख्या है, R = 8.31431 J/mol। के) गैस स्थिरांक। 1 मोल गैस pv=RT के लिए, जहाँ v मोलर आयतन है। के.एम.यू.... ... रासायनिक विश्वकोश
अवस्था का समीकरण यह लेख थर्मोडायनामिक्स श्रृंखला का हिस्सा है। एक आदर्श गैस की स्थिति का समीकरण वान डेर वाल्स समीकरण डिटेरिसी समीकरण थर्मोडायनामिक्स के अनुभाग थर्मोडायनामिक्स समीकरण के सिद्धांत ... विकिपीडिया
- (क्लैपेरॉन-मेंडेलीव समीकरण), एक आदर्श गैस के मापदंडों (दबाव पी, मात्रा वी और पूर्ण तापमान टी) के बीच संबंध, जो इसकी स्थिति निर्धारित करता है: पीवी = बीटी, जहां गुणांक। आनुपातिकता B गैस M के द्रव्यमान और उसके मोल पर निर्भर करती है। जनता. स्थापित…… भौतिक विश्वकोश
राज्य का समीकरण स्टेट...विकिपीडिया
- (क्लैपेरॉन-मेंडेलीव समीकरण), द्रव्यमान एम की एक आदर्श गैस के दबाव पी, पूर्ण तापमान टी और मात्रा वी के बीच संबंध: पीवी = बीटी, जहां बी = एम/एम (एम परमाणु द्रव्यमान में गैस अणु का द्रव्यमान है) इकाइयाँ)। फ्रांसीसी वैज्ञानिक बी.पी.ई. द्वारा स्थापित। क्लैपेरॉन... ... आधुनिक विश्वकोश- क्लैपेरॉन मेंडेलीव समीकरण, बी. पी. ई. क्लैपेरॉन (1834) द्वारा पाया गया, भौतिक मात्राओं के बीच का संबंध जो एक आदर्श गैस की स्थिति निर्धारित करता है: गैस का दबाव पी, इसकी मात्रा वी और पूर्ण तापमान टी. के. यू.... ... महान सोवियत विश्वकोश
क्लैपेरॉन मेंडेलीव समीकरण [फ्रांसीसी के नाम पर। भौतिकी बी. क्लैपेरॉन (वी. क्लैपेरॉन; 1799 1864) और रूसी। रसायनज्ञ डी.आई. मेंडेलीव (1834 1907)], एक आदर्श गैस की अवस्था का स्तर: पीवीएम = आरटी, जहां पी दबाव है, टी गैस का थर्मोडायनामिक तापमान है, वीएम ... ... बिग इनसाइक्लोपीडिक पॉलिटेक्निक डिक्शनरी
क्लैपेरॉन और क्लॉसियस-क्लैपेरॉन समीकरण
गिब्स चरण नियम के अनुसार, दो-चरण एक-घटक प्रणाली में स्वतंत्र गहन चर की संख्या एक के बराबर है। इसलिए संबंधित एक समीकरण अवश्य होना चाहिए आरऔर टीवीऐसी व्यवस्था. यह संबंध चरण संतुलन स्थिति का परिणाम है:
जहां पदनाम पी(पी, टी)इस बात पर जोर देता है कि प्रत्येक चरण की रासायनिक क्षमता एक कार्य है आरटी.
यदि पी की निर्भरता आरऔर टीस्पष्ट रूप से ज्ञात था, तब (3.7) के संबंध में सैद्धांतिक रूप से हल किया जा सकता था आरया टीऔर लत ढूंढो आर = पी(टी)या टी = टी(आर).हालाँकि, सामान्य मामले में, निर्भरता पी नकारात्मकऔर 7" ज्ञात नहीं है और यह नहीं किया जा सकता है। लेकिन आप व्युत्पन्न पा सकते हैं आरद्वारा टी(या इसका उलटा)।
आइए मान लें कि एक पदार्थ के दो चरण ए और बी संतुलन में हैं। यदि आप तापमान को मान d7" से बदलते हैं, तो दबाव बदलना चाहिए ताकि संतुलन की स्थिति (3.7) का उल्लंघन किए बिना, दोनों चरणों की रासायनिक क्षमता समान रूप से बदल जाए, यानी:
दोनों अंतरों को चरों में विघटित करना टायर,हम पाते हैं
संबंधों के साथ (2.31) यह देता है:
इससे यह पता चलता है:
डीएफ पी कहां है? - चरण संक्रमण की एन्ट्रापी; ए एफपी यू=यू^ --दाढ़
चरण संक्रमण का आयतन (मोलर आयतन में परिवर्तन)। टी= स्थिरांक, पी =स्थिरांक).
चरण संक्रमण की एन्ट्रॉपी और एन्थैल्पी संबंध (3.5) द्वारा एक दूसरे से संबंधित हैं: एएस = एएन/टी।इसलिए (3.9) को निम्नलिखित रूप में लिखा जा सकता है: 
कहाँ टी- चरण संक्रमण तापमान.
समीकरण (3.9) और (3.10) समतुल्य हैं और उनमें से किसी एक को क्लैपेरॉन समीकरण कहा जाता है।
क्लैपेरॉन समीकरण का व्यावहारिक अनुप्रयोग इस तथ्य से सीमित है कि चरण संक्रमण की एन्थैल्पी और चरणों की दाढ़ मात्रा विभिन्न चरणों के लिए अलग-अलग तापमान पर निर्भर करती है। इसका मतलब यह है कि इस समीकरण को एकीकृत करने का कोई सामान्य तरीका नहीं है। लेकिन छोटे तापमान अंतरालों के लिए इन समीकरणों को कुछ अनुमानों को स्वीकार करके कई उद्देश्यों के लिए पर्याप्त सटीकता के साथ एकीकृत किया जा सकता है।
पहला अनुमान यह है कि एक संकीर्ण तापमान सीमा के लिए चरण संक्रमण की एन्थैल्पी को लगभग स्थिर माना जा सकता है। संघनित चरणों - ठोस और तरल - के मोलर आयतन के संबंध में भी ऐसा ही किया जा सकता है, क्योंकि वे कमजोर रूप से निर्भर होते हैं टायर से.फिर, ठोस चरणों के बीच और ठोस और तरल चरणों के बीच चरण संतुलन के लिए, दाढ़ की मात्रा में परिवर्तन को भी स्थिर माना जा सकता है। इन सन्निकटनों के साथ (3.10) को इस प्रकार एकीकृत किया गया है (पिघलने के लिए):

इसी प्रकार ठोस चरणों के बीच संतुलन के लिए।
गैस चरण के मोलर आयतन को स्थिर नहीं माना जा सकता। लेकिन कम दबाव के मामले में, अन्य अनुमान संभव हैं। सबसे पहले, कम दबाव पर गैस का मोलर आयतन किसी संघनित चरण (सीएफ) के मोलर आयतन से बहुत अधिक होता है। इसलिए, वाष्पीकरण के लिए आप ले सकते हैं:
दूसरे, कम दबाव पर, कई गैसें होती हैं
टीटीटी^गैस सीटीडी__ यात
आदर्श के करीब गुण। इसलिए ~-i L isp k t ~-।
इसे समीकरण (3.10) में प्रतिस्थापित करने पर, हम पाते हैं:

क्योंकि &आर/आर= एस!1पी आर,परिणामी संबंध को क्लॉसियस-क्लैपेरॉन समीकरण कहा जाता है:
यह तरल और ठोस दोनों चरणों (ऊर्ध्वपातन) के वाष्पीकरण पर लागू होता है।
चरण संक्रमण की निरंतर एन्थैल्पी के सन्निकटन में, यह समीकरण निम्नानुसार एकीकृत है:
इन समीकरणों को लागू करने के लिए, चरण संक्रमणों की एन्थैल्पी और सामान्य दबाव पर चरण संक्रमणों के तापमान पर डेटा का अक्सर उपयोग किया जाता है। ये भौतिक एवं रासायनिक मात्राओं की अनेक सन्दर्भ पुस्तकों में दिये गये हैं। सामान्य दबाव का मान 101,325 Pa = 101.325 kPa = 1.01325 bar = 1 atm = 760 mm Hg है। कला। = 760 टोर. संदर्भ पुस्तकों का डेटा समीकरणों (3.11) और (3.13) का उपयोग करके सामान्य से बहुत अलग दबावों पर अनुमानित गणना के आधार के रूप में कार्य करता है।
समीकरण (3.11) का उपयोग करके गणना के लिए आवश्यक संघनित चरणों की दाढ़ मात्राएँ आमतौर पर संदर्भ पुस्तकों में नहीं दी जाती हैं। लेकिन उनके बजाय आप नदी के घनत्व पर डेटा पा सकते हैं। परिभाषाओं को जानकर, उनका उपयोग मोलर वॉल्यूम की गणना करने के लिए किया जा सकता है यू टी = यू/एन,पी = वहऔर एम = टी/पी.उनसे इस प्रकार है: यू टी = एम/पी, कहाँ एम -दाढ़ जन।
दूसरी ओर, कुछ संदर्भ पुस्तकें चरण संक्रमणों की विशिष्ट ऊष्माएँ देती हैं। इस मामले के लिए, समीकरण (3.10) को निम्नलिखित रूप में लिखा जा सकता है:

जहां एएफ पी/जी और एएफ पी वाई एक चरण संक्रमण के दौरान क्रमशः विशिष्ट एन्थैल्पी और विशिष्ट मात्रा में परिवर्तन हैं (और वी= 1/आर).
यदि वाष्पीकरण की एन्थैल्पी ज्ञात नहीं है, तो कभी-कभी ट्राउटन के अंगूठे के नियम का उपयोग करके इसका अनुमान लगाया जा सकता है, जिसमें कहा गया है कि अधिकांश तरल पदार्थों के वाष्पीकरण की दाढ़ एन्ट्रापी लगभग 90 JK -1 mol -1 है। चूँकि Dfp^ - AfpR/G, L isp R/J mol -1 = 90(GM M/K), जहां 7^ सामान्य दबाव पर क्वथनांक है। वाष्पीकरण की एन्थैल्पी के इस मान को (3.13) में प्रतिस्थापित करना और लेना पी एक्ससामान्य दबाव 1 एटीएम है, और तापमान के लिए टी! सामान्य क्वथनांक टीहम तरल के ऊपर संतुलन वाष्प दबाव प्राप्त करते हैं:

ट्राउटन का नियम उच्च ध्रुवता वाले तरल पदार्थों पर लागू नहीं होता है और विशेष रूप से संबंधितपानी और अल्कोहल जैसे तरल पदार्थ। (संयुक्त तरल पदार्थ वे तरल पदार्थ होते हैं जिनके अणु एक दूसरे के साथ परस्पर क्रिया करते हैं हाइड्रोजन बांड।)यह नियम तभी संतोषजनक है जब गैर-ध्रुवीय पदार्थों पर लागू किया जाता है, और क्वथनांक लगभग 150 से 1000 K की सीमा के भीतर होता है।
क्लैपेरॉन-क्लॉसियस समीकरण (अंतर)।
यह भी पढ़ें:
|
तरल-वाष्प संतुलन वक्र या, जो समान है, किसी दिए गए पदार्थ के लिए तापमान पर संतृप्त वाष्प दबाव की निर्भरता तथाकथित क्लैपेरॉन-क्लॉसियस समीकरण को हल करके पाई जा सकती है।
थर्मोडायनामिक चक्रों की विधि हमें इस समीकरण के रूप को स्थापित करने की अनुमति देती है। मान लीजिए कि दो प्रायोगिक इज़ोटेर्म हैं, जो तापमान और (चित्र 50) के अनुरूप हैं।

प्रारंभिक अवस्था 1 में, तरल का एक मोल तापमान पर दबाव में होता है और आयतन घेर लेता है (कोई वाष्प चरण नहीं होता है)। ऊष्मा जोड़कर, हम द्रव के इस मोल को समतापीय रूप से वाष्पित कर देते हैं। इस मामले में, तरल हमेशा अपने संतृप्त वाष्प के दबाव के बराबर दबाव में रहेगा। परिणामस्वरूप, तरल गैसीय अवस्था में बदल जाएगा 2. स्थिर तापमान और दबाव पर एक मोल तरल को गैसीय अवस्था में बदलने के लिए आवश्यक ऊष्मा की मात्रा, परिभाषा के अनुसार, वाष्पीकरण की गुप्त ऊष्मा है। इस प्रकार, संक्रमण 12 पर तरल को बराबर ऊष्मा की मात्रा प्राप्त हुई।
प्रति चक्र किया गया कार्य संख्यात्मक रूप से चतुर्भुज 1234 के क्षेत्रफल के बराबर है:
![]() (3.3.1)
(3.3.1)
और चक्र दक्षता
 .
(3.3.2)
.
(3.3.2)
दूसरी ओर, 1234 चक्र एक कार्नोट चक्र है, इसलिए इसकी दक्षता है
![]() (3.3.3)
(3.3.3)
भाव (3.3.2) और (3.3.3) की तुलना करने पर, हम प्राप्त करते हैं

 .
(3.3.4)
.
(3.3.4)
समीकरण (3.3.4) को थोड़े अलग रूप में प्रस्तुत किया जा सकता है। ऐसा करने के लिए, हम किसी तरल पदार्थ के अवस्था 1 से गैसीय अवस्था 2 में संक्रमण के दौरान एन्ट्रापी में परिवर्तन का पता लगाएंगे (चित्र 50)।
 ,
(3.3.5)
,
(3.3.5)
अवस्था 1 में द्रव और अवस्था 2 में वाष्प की एन्ट्रापी क्रमशः कहाँ और हैं। अंतिम संबंध का उपयोग करते हुए, समीकरण (3.3.4) को इस प्रकार लिखा जा सकता है:
 .
(3.3.6)
.
(3.3.6)
विभेदक समीकरण (3.3.4) क्लैपेरॉन-क्लॉसियस समीकरण है। यह समीकरण तापमान में परिवर्तन के साथ संतृप्त वाष्प दबाव में परिवर्तन को दर्शाता है। इस समीकरण का समाधान खोजने के लिए, तापमान पर वाष्पीकरण की गुप्त गर्मी की निर्भरता, साथ ही तापमान और दबाव पर तरल और गैस की मात्रा की निर्भरता को जानना आवश्यक है। सामान्य स्थिति में, यह समीकरण एक अरेखीय अवकल समीकरण है, जिसका समाधान संख्यात्मक एकीकरण द्वारा पाया जाता है।
क्रांतिक तापमान से काफी कम तापमान पर, तरल द्वारा ग्रहण किया गया आयतन द्रव द्वारा ग्रहण किए गए आयतन से बहुत कम होता है, अर्थात। उदाहरण के लिए, जलवाष्प की मात्रा पानी की मात्रा से 1600 गुना अधिक है; -सी के तापमान पर तरल ऑक्सीजन के उबलने के साथ मात्रा में लगभग 300 गुना वृद्धि होती है। इसलिए, तापमान पर, समीकरण (3.3.4) का रूप ले लेगा
. (3.3.7)
इसी सन्निकटन में, संतृप्त भाप को भी एक आदर्श गैस माना जा सकता है। यह हमें समीकरण (3.3.7) को इस प्रकार लिखने की अनुमति देता है:
. (3.3.8)
समीकरण (3.3.8) के बाएँ पक्ष को से की सीमा में और दाएँ पक्ष को - से की सीमा में एकीकृत करने पर, हम प्राप्त करते हैं
 ,
(3.3.9)
,
(3.3.9)
तापमान पर प्रयोग से प्राप्त संतृप्त वाष्प दबाव कहां है, और तापमान सीमा पर वाष्पीकरण की गर्मी का औसत मूल्य है
सूत्र (3.3.9) से यह स्पष्ट है कि बढ़ते तापमान के साथ संतृप्त वाष्प का दबाव तेजी से बढ़ता है।
क्लैपेरॉन-क्लॉसियस समीकरण को इस प्रकार पुनः लिखा गया
 , (3.3.10)
, (3.3.10)
जैसा कि हम बाद में दिखाएंगे, यह बाहरी दबाव पर तरल के क्वथनांक की निर्भरता को भी निर्धारित करता है। समीकरण में (3.3.10)
बाहरी दबाव में परिवर्तन होने पर क्वथनांक में परिवर्तन होता है। इसलिए, तरल-वाष्प संतुलन वक्र को क्वथनांक वक्र भी कहा जाता है।
52. वैन डेर वाल्स समीकरण - अआदर्श गैसों की अवस्था का समीकरण। वैन डेर वाल्स समीकरण स्थिरांक का प्रायोगिक निर्धारण।
जैसा कि पहले उल्लेख किया गया है, कम तापमान और उच्च दबाव पर किसी पदार्थ के एक मोल के लिए मेंडेलीव-क्लैपेरॉन समीकरण
प्रयोगात्मक रूप से मापे गए मूल्यों से महत्वपूर्ण विचलन देता है।
वास्तविक पदार्थ की अवस्था का समीकरण खोजने के लिए कई प्रयास किए गए हैं, जो पदार्थ की सभी अवस्थाओं को नहीं तो कम से कम गैसीय और तरल को कवर कर सकता है। कई प्रस्तावित समीकरणों में से, सबसे प्रसिद्ध वैन डेर वाल्स समीकरण है:
 ,
(3.4.2)
,
(3.4.2)
किसी पदार्थ के एक मोल के लिए लिखा जाता है। मोल्स के लिए यह समीकरण है:
 .
(3.4.3)
.
(3.4.3)
स्थिरांक प्रयोगात्मक रूप से निर्धारित किए जाते हैं और विभिन्न प्रकार के अणुओं के लिए अलग-अलग मान होते हैं। समीकरण (3.4.2) व्युत्पन्न नहीं है; यह पहले से ही ज्ञात मेंडेलीव-क्लैपेरॉन समीकरण में दो सुधार पेश करके स्थापित किया गया है। उनके परिचय को उचित ठहराने के लिए, हम ध्यान दें कि समीकरण (3.4.2) में आयतन का अर्थ एक मोल गैस वाले बर्तन का आयतन है। भौतिक बिंदुओं से युक्त एक आदर्श गैस के मामले में, यह संपूर्ण आयतन अणुओं की गति के लिए उपलब्ध है। एक वास्तविक गैस में, अणु स्वयं कंटेनर के आयतन के एक निश्चित भाग पर कब्जा कर लेते हैं, और यह भाग अन्य सभी अणुओं के लिए दुर्गम होता है। वॉल्यूम के इस हिस्से को वॉल्यूम से घटाया जाना चाहिए। तब समीकरण (3.4.2) रूप लेता है
. (3.4.4)
अंतिम अभिव्यक्ति से यह स्पष्ट है कि सुधार उस आयतन के बराबर है जो गैस असीम रूप से उच्च दबाव पर लेगी, यानी, वास्तविक गैस के अणु अनंत उच्च दबाव पर भी शून्य के बराबर दूरी तक एक-दूसरे तक नहीं पहुंच सकते हैं। इसलिए, सुधार शुरू करने का मतलब अणुओं के बीच प्रतिकारक बलों को ध्यान में रखना है।
जैसा कि हम जानते हैं, अणुओं के बीच न केवल प्रतिकारक बल कार्य करते हैं, बल्कि आकर्षक बल भी कार्य करते हैं। किसी बर्तन की दीवार के पास स्थित कोई भी अणु एक शुद्ध आकर्षण बल का अनुभव करता है
आकर्षक बलों की क्रिया के क्षेत्र में स्थित अणुओं की ओर से (चित्र 51)।

आइए दीवार की सतह पर एक मंच चुनें। इस पर अणु हों। फिर परिणामी बल गैस से इस क्षेत्र के अणुओं पर कार्य करता है
 ,
(3.4.6)
,
(3.4.6)
चूँकि समरूपता की स्थितियों से सभी बलों का परिमाण और दिशा समान होती है। यदि हम बल को क्षेत्र से विभाजित करते हैं, तो हमें तथाकथित आणविक दबाव मिलता है, जिसके साथ दीवार पर स्थित अणु शेष गैस द्रव्यमान पर कार्य करते हैं:
. (3.4.7)
सूत्र (3.4.7) में प्रत्येक कारक स्पष्ट रूप से गैस के घनत्व के समानुपाती होता है, जो बदले में, गैस की मात्रा के व्युत्क्रमानुपाती होता है, इसलिए हम लिख सकते हैं:
, (3.4.8)
कहाँ ए– सकारात्मक स्थिरांक गुणांक.
इस प्रकार, आकर्षक बलों की कार्रवाई के परिणामस्वरूप, गैस की ओर से दीवार पर दबाव उस दबाव (3.4.4) से कम होगा जो दीवार अनुभव करेगी यदि अणुओं के बीच कोई आकर्षक बल न हो, यानी।
![]() .
.
हमें वैन डेर वाल्स समीकरण कहां मिलता है:
 .
(3.4.9)
.
(3.4.9)
आइए हम सूत्र (3.4.9) में अतिरिक्त दबाव की उपस्थिति की व्याख्या करें। मान लीजिए कि गैस एक भारहीन पिस्टन के नीचे एक सिलेंडर में है। बाहरी दबाव गैस को संपीड़ित करता है, यानी उसके अणुओं को एक साथ लाता है। यदि गैस के अणु एक-दूसरे को आकर्षित नहीं करते, तो गैस केवल बाहरी दबाव का अनुभव करेगी। लेकिन जैसा कि हमने पाया है, अणुओं का पारस्परिक आकर्षण भी अणुओं को एक-दूसरे के करीब लाता है, यानी यह बाहरी दबाव के समान दिशा में कार्य करता है। इसलिए, अणुओं के आकर्षण का परिणाम गैस पर बाहरी दबाव में स्पष्ट वृद्धि के रूप में परिलक्षित होता है, जैसे कि पिस्टन पर दबाव में कुछ अतिरिक्त दबाव जोड़ा गया हो।
वैन डेर वाल्स समीकरण स्थिरांक का प्रायोगिक निर्धारण
स्थिरांकों के प्रयोगात्मक निर्धारण के लिए एऔर अध्ययन के तहत गैस को एक बंद मात्रा वाले बर्तन में एक अंतर्निर्मित दबाव गेज के साथ रखा जाता है और इस गैस का दबाव विभिन्न तापमानों पर मापा जाता है। प्रयोगात्मक रूप से प्राप्त वक्र के संख्यात्मक विभेदन द्वारा हम आंशिक व्युत्पन्न निर्धारित करते हैं। वैन डेर वाल्स समीकरण से हम यह व्युत्पन्न पाते हैं
 .
(3.5.1)
.
(3.5.1)
यहाँ से हमें मूल्य मिलता है:
. (3.5.2)
वैन डेर वाल्स समीकरण (3.4.9) में अभिव्यक्ति (3.5.2) को प्रतिस्थापित करते हुए, हम एक और मात्रा की गणना करते हैं ए:
![]() .
(3.5.3)
.
(3.5.3)
अनुभव से पता चला है कि मूल्य एऔर स्थिर नहीं हैं, लेकिन तापमान पर निर्भर करते हैं, हालांकि कमजोर रूप से। गणना में वैन डेर वाल्स समीकरण का उपयोग स्थिरांक के रूप में किया जाता है एऔर फ़ंक्शंस के औसत मान और रुचि की तापमान सीमा में लें


53. वैन डेर वाल्स समीकरण की समताप रेखाएं और प्रयोगात्मक समतापी रेखाओं के साथ उनकी तुलना। VdW समीकरण से किसी पदार्थ के महत्वपूर्ण मापदंडों का निर्धारण। पदार्थ की मेटास्टेबल अवस्थाएँ सुपरसैचुरेटेड भाप और सुपरहीटेड तरल हैं। विल्सन चैम्बर और बबल चैम्बर।
चित्र में. 52 वैन डेर वाल्स गैस इज़ोटेर्म दिखाता है।
बहुत उच्च तापमान पर उनका आकार हाइपरबोलस के समान होता है; ये इज़ोटेर्म पदार्थ की गैसीय अवस्था (लगभग आदर्श गैस) की विशेषता बताते हैं। जैसे-जैसे तापमान घटता है, इज़ोटेर्म का आकार बदलता है और एक निश्चित तापमान (महत्वपूर्ण) पर यह वक्र के विभक्ति बिंदु का पता लगाता है। इससे भी कम तापमान (सबक्रिटिकल) पर, तरल-वाष्प चरण संक्रमण के अनुरूप क्षैतिज खंड के बजाय, इज़ोटेर्म में एक लहर जैसा खंड होता है (चित्र 53)।


चावल। 52 आर और पी. 53
मापन से पता चलता है कि वास्तविक पदार्थ के इज़ोटेर्म व्यावहारिक रूप से वर्गों (गैसीय अवस्था) और (तरल अवस्था) में वैन डेर वाल्स इज़ोटेर्म के साथ मेल खाते हैं। हालाँकि, मध्य भाग में, तरल-वाष्प चरण संक्रमण के अनुरूप क्षैतिज खंड 51 के बजाय, वैन डेर वाल्स इज़ोटेर्म में एक लहर जैसा खंड होता है। इस लहरदार खंड की विशेषता इस प्रकार है। धारा 12 भाप की मेटास्टेबल अवस्था (सुपरसैचुरेटेड स्टीम) से मेल खाती है, और धारा 54 तरल (सुपरहीटेड लिक्विड) की मेटास्टेबल स्थिति से मेल खाती है। बिंदु 1 पर केवल संतृप्त भाप है, और बिंदु 5 पर केवल उबलता हुआ तरल है। जहां तक लहरदार वक्र की धारा 234 का सवाल है, यह शारीरिक रूप से असंभव है, क्योंकि प्रकृति में ऐसे कोई पदार्थ नहीं हैं, जिनके स्थिर तापमान पर आयतन में वृद्धि से दबाव में वृद्धि हो। उत्तरार्द्ध तभी संभव है जब इस क्षेत्र में तापमान स्थिर न हो। सुपरसैचुरेटेड भाप (धारा 12) किसी पदार्थ की एक गैसीय अवस्था है जिसमें दबाव होता है पीकिसी दिए गए तापमान पर संतृप्त वाष्प दबाव से अधिक - शुद्ध गैस को संतृप्त वाष्प दबाव से अधिक दबाव में संपीड़ित करके प्रयोगात्मक रूप से प्राप्त किया जा सकता है, और यह संघनित नहीं होगा। सुपरसैचुरेटेड वाष्प की स्थिति, हालांकि इसमें एक निश्चित स्थिरता होती है, दो चरण की स्थिति (आइसोबार 135) की तुलना में कम स्थिर होती है, जिसमें, जैसा कि हम जानते हैं, पदार्थ का हिस्सा तरल के रूप में होता है, और हिस्सा तरल के रूप में होता है। संतृप्त वाष्प का रूप. इसलिए, थोड़े से बाहरी प्रभाव से, सुपरसैचुरेटेड वाष्प आंशिक रूप से तरल में बदल जाता है, और शेष वाष्प संतृप्त हो जाता है।
अतितापित तरल (धारा 45) - एक ऐसी स्थिति जो इस तथ्य की विशेषता है कि यह किसी दिए गए तापमान पर संतृप्त वाष्प दबाव से कम दबाव पर मौजूद होता है - शुद्ध तरल को लंबे समय तक उबालने से प्राप्त किया जा सकता है, जिसके परिणामस्वरूप गैस के बुलबुले (नाभिक) होते हैं वाष्पीकरण) को तरल से हटा दिया जाता है, और तरल को एक दिए गए दबाव पर उसके क्वथनांक से ऊपर के तापमान तक गर्म किया जाता है। अत्यधिक गरम तरल की स्थिति भी तरल और संतृप्त भाप के बीच संतुलन की स्थिति से कम स्थिर होती है। यदि किसी विदेशी पदार्थ के कणों को ऐसे अत्यधिक गर्म तरल में पेश किया जाता है, तो यह जल्दी से दो चरण की स्थिति में परिवर्तित हो जाता है।
प्राथमिक कणों के मापदंडों को रिकॉर्ड करने और मापने के लिए सुपरसैचुरेटेड भाप और सुपरहीटेड तरल की अवस्थाओं का उपयोग परमाणु भौतिकी उपकरणों (क्लाउड चैंबर और बबल चैंबर) में किया जाता है।
यदि वैन डेर वाल्स इज़ोटेर्म पर लहरदार खंड को कुछ क्षैतिज सीधी रेखा 135 द्वारा प्रतिस्थापित किया जाता है, तो इस तरह से प्राप्त इज़ोटेर्म गुणात्मक रूप से पदार्थ की दो-चरण स्थिति का सही ढंग से वर्णन करेगा। इस रेखा की स्थिति निर्धारित की जा सकती है यदि क्लॉज़ियस नोटेशन (2.13.7) में थर्मोडायनामिक्स का दूसरा नियम बंद प्रतिवर्ती चक्र 1234531 पर लागू किया जाता है:
. (3.6.1)
चूँकि पूरे पथ 1234531 पर पदार्थ का तापमान अपरिवर्तित रहता है (चूँकि यह पथ एक ही इज़ोटेर्म के दो संभावित वेरिएंट के वर्गों से बना है), अंतिम समीकरण को इस रूप में लिखा जा सकता है
. (3.6.5) प्रायोगिक डेटा से संकेत मिलता है कि वैन डेर वाल्स समीकरण, जिससे यह मान प्राप्त होता है, अनुमानित है, हालांकि पदार्थ की स्थिति में परिवर्तन की गुणात्मक तस्वीर समीकरण द्वारा काफी सही ढंग से बताई गई है। पदार्थ की स्थिति का अधिक सटीक समीकरण प्राप्त करने के लिए बड़ी संख्या में प्रयास किए जा रहे हैं। हालाँकि, इन समीकरणों में बड़ी संख्या में सुधार कारक शामिल हैं, जिनका भौतिक अर्थ स्पष्ट नहीं है, जैसा कि वैन डेर वाल्स समीकरण में है।
सबसे सामान्य रूप में, सांख्यिकीय भौतिकी के तरीकों का उपयोग करते हुए, शिक्षाविद् एन.एन. बोगोलीबोव ने राज्य का समीकरण प्राप्त किया
 ,
(3.6.12)
,
(3.6.12)
तथाकथित वायरल गुणांक कहां हैं, जो केवल तापमान के कार्य हैं। बोगोलीबॉव समीकरण से यह निष्कर्ष निकलता है कि मोलर आयतन का मान जितना बड़ा होगा, काफी सटीक परिणाम प्राप्त करने के लिए श्रृंखला के पदों की संख्या उतनी ही कम होनी चाहिए। जब घात श्रृंखला के सभी पद लुप्त हो जाते हैं, और समीकरण (3.6.12) रूप ले लेता है, यानी, जैसा कि कोई उम्मीद करेगा, बोगोलीबोव समीकरण मेंडेलीव-क्लैपेरॉन समीकरण में बदल जाता है। वायरल गुणांक की गणना विशुद्ध सैद्धांतिक तरीकों से नहीं की जा सकती है और इसलिए इसे प्रयोगात्मक डेटा का उपयोग करके निर्धारित किया जाना चाहिए। हालाँकि, यह समस्या इतनी जटिल हो जाती है कि प्रायोगिक डेटा का वर्णन करने वाले एक प्रक्षेप सूत्र के रूप में राज्य के समीकरण को प्राप्त करना अधिक उपयुक्त है।
किसी द्रव के वाष्पीकरण की ऊष्मा का निर्धारण
तरल और वाष्प के बीच संतुलन के लिए, क्लैपेरॉन-क्लॉसियस समीकरण निम्नानुसार प्राप्त किया जा सकता है।
ऊष्मागतिकी के दूसरे नियम के अनुसार, यदि कोई प्रणाली संतुलन में है, तो दी गई शर्तों के तहत ( आर, टी) कोई काम नहीं हुआ
एपी = 0; जी और -जी पी = 0; जी और = जी पी (2)
अर्थात्, शुद्ध तरल और उसके वाष्प की गिब्स मुक्त ऊर्जाएँ बराबर होती हैं (ये संतुलन की स्थितियाँ हैं)।
आइए उन स्थितियों में से एक को बदलें जो संतुलन निर्धारित करती हैं, उदाहरण के लिए, तापमान (अर्थात्, हम सिस्टम को गर्म करते हैं) टी), इसके परिणामस्वरूप एक नया दबाव, एक नया तरल-वाष्प संतुलन स्थापित होगा:
जी " और = जी " पी (3)
या जी और = जी पी (4)
यदि बाहरी पैरामीटर में परिवर्तन अनंत मात्रा में होता है - डीटी, तो आइसोबैरिक-इज़ोटेर्मल क्षमताएं एक अनंत मान से बदल जाएंगी:
डीजी और =डीजी पी (5)
आइसोबैरिक-इज़ोटेर्माल क्षमता प्रणाली की मुक्त ऊर्जा का प्रतिनिधित्व करती है और दबाव और तापमान का एक कार्य है:
डीजी=वीडीपी–एसडीटी(6)
इसलिए, इसका उपयोग संतृप्त वाष्प दबाव और तापमान के बीच मात्रात्मक संबंध स्थापित करने के लिए किया जा सकता है।
(6) को (5) में प्रतिस्थापित करने के बाद हम संतुलन की स्थिति में हैं
वी और डीपी-एस और डीटी = वी पी डीपी-एस पी डीटी(7)
कहाँ से (8)
कहाँ ( एस पी -एस और) और ( वी पी - वी और) - किसी पदार्थ के तरल से वाष्प अवस्था में संक्रमण के दौरान सिस्टम की एन्ट्रापी और आयतन में क्रमशः परिवर्तन। ऊष्मागतिकी के दूसरे नियम के अनुसार, वाष्पीकरण के दौरान किसी प्रणाली की एन्ट्रापी में परिवर्तन वाष्पीकरण की कम हुई ऊष्मा के बराबर होता है
 (9)
(9)
व्यंजक (9) को (8) में प्रतिस्थापित करने पर हमें प्राप्त होता है
 (10)
(10)
कहाँ ∆ एच आईएसपीऔर ∆ वी आईएसपी- क्रमशः, वाष्पीकरण के दौरान एन्थैल्पी और आयतन में परिवर्तन, और टी गांठ- उबलने का तापमान.
समीकरण (10) क्लैपेरॉन-क्लॉसियस समीकरण कहा जाता है . (10) के अनुसार, पानी के चरण आरेख (छवि 1) में रेखाओं का ढलान व्युत्पन्न के संकेत द्वारा निर्धारित किया जाता है डीपी/डीटीया इसका पारस्परिक डीटी/डीपी- बढ़ते दबाव के साथ तापमान में परिवर्तन की विशेषता।
चरण संक्रमणों में से, हम वाष्पीकरण और पिघलने पर विचार करते हैं। वाष्पीकरण की ऊष्मा - तरल चरण का गैसीय चरण में संक्रमण - सकारात्मक है। वाष्पीकरण की दाढ़ ऊष्मा किसी तरल पदार्थ के एक मोल को वाष्पित करने में खर्च होने वाली ऊष्मा की मात्रा है। वाष्पीकरण के दौरान गैस की मात्रा हमेशा तरल की संगत मात्रा से अधिक होती है, अर्थात समीकरण (10) में वी पी >वी और. इसीलिए डीपी/डीटी, और इसलिए डीटी/डीपीहमेशा सकारात्मक भी रहते हैं ( डीटी/डीपी> 0). नतीजतन, बढ़ते दबाव (वक्र) के साथ वाष्पीकरण तापमान हमेशा बढ़ता है ठीक हैचित्र में 1 या तालिका देखें. 1 परिशिष्ट). बढ़ते तापमान के साथ, तरल के ऊपर संतृप्त वाष्प का दबाव बढ़ता है, जो महत्वपूर्ण तापमान पर अपने अधिकतम मूल्य तक पहुंच जाता है। उत्तरार्द्ध सीमित तापमान है (उदाहरण के लिए, पानी के लिए यह 374.12 o C है) जिस पर किसी पदार्थ के तरल और वाष्प चरणों के बीच संतुलन संभव है। उच्च तापमान पर, कोई पदार्थ केवल गैसीय अवस्था में हो सकता है, और संतृप्त वाष्प की अवधारणा अपना अर्थ खो देती है।
संलयन की ऊष्मा - ठोस चरण का तरल चरण में संक्रमण भी हमेशा सकारात्मक होता है।

चावल। 1. कम दबाव पर पानी की स्थिति का आरेख
क्षेत्र: 1 - ठोस चरण (बर्फ); द्वितीय- तरल; तृतीय - बराबर.
वक्र: एओ - उर्ध्वपातन; ठीक है - वाष्पीकरण; ओवी - पिघलना।
O तीन चरणों के संतुलन के अनुरूप एक त्रिगुण बिंदु है।
सामान्य स्थिति में तरल चरण का आयतन ठोस चरण की समान मात्रा के आयतन से अधिक या कम हो सकता है। यहाँ से समीकरण (10) के अनुसार मान निकलता है डी पी/डीटीया इसका व्युत्क्रम मान डीटी/डी पी, सकारात्मक या नकारात्मक हो सकता है। इसका मतलब यह है कि बढ़ते दबाव के साथ गलनांक बढ़ या घट सकता है। परिमाण डीटी/डी पीअधिकांश पदार्थों के लिए सकारात्मक. इसका केवल पानी, बिस्मथ और कुछ अन्य पदार्थों के लिए नकारात्मक मान है, जिनके लिए पिघलने बिंदु पर तरल का घनत्व ठोस चरण के घनत्व से अधिक है ( वी और -वी टी) < 0. В связи с этим при увеличении давления температура плавления льда понижается (криваяओबी).
यह ध्यान दिया जाना चाहिए कि विचारित पैटर्न निम्न दबाव के लिए मान्य हैं।
क्लैपेरॉन-क्लॉसियस समीकरण (10) को निम्नलिखित सन्निकटन लेकर रूपांतरित किया जा सकता है:
1)चूंकि ∆ वी आईएसपी =(वी पी -वी और) >> 0 (उदाहरण के लिए, पानी के लिए, वाष्प अवस्था में मोलर आयतन संख्या पर। वी पी≈ 22400 सेमी 2, और तरल अवस्था में वी और≈ 18 सेमी 3), तो बिना किसी बड़ी त्रुटि के हम मान की उपेक्षा कर सकते हैं वी औरऔर स्वीकार करें कि ∆ वी आईएसपी ≈ वी पी .
2) बहुत अधिक दबाव और तापमान (महत्वपूर्ण से बहुत दूर) पर, आदर्श गैसों की स्थिति का समीकरण वास्तविक प्रणालियों पर लागू किया जा सकता है। इस मामले में प्राप्त त्रुटि महत्वहीन हो जाती है।
 (11)
(11)
(11) को (10) में प्रतिस्थापित करने पर हमें प्राप्त होता है:
 (12)
(12)
जो परिवर्तन के बाद
 (13)
(13)
रूप ले लेता है
 (14)
(14)
वाष्पीकरण की ऊष्मा तापमान पर निर्भर करती है : जैसे-जैसे तापमान बढ़ता है, वाष्पीकरण की गर्मी कम हो जाती है। क्रान्तिक तापमान पर वाष्पीकरण की ऊष्मा शून्य होती है। हालाँकि, क्रांतिक से दूर तापमान पर, ∆ में परिवर्तन होता है एन आईएसपीतापमान बहुत अच्छा नहीं है। बहुत विस्तृत तापमान रेंज में नहीं∆ एन आईएसपीस्थिरांक माना जा सकता है।
तापमान सीमा के भीतर क्लैपेरॉन-क्लॉसियस समीकरण (14) का एकीकरण टी 1 और टी 2, जो दबावों के अनुरूप है आर 1 और आर 2 स्थिरांक ∆ पर एन आईएसपी, देता है
 (15)
(15)
या दशमलव लघुगणक में जाने पर
 (16)
(16)
(आर- सार्वभौमिक गैस स्थिरांक 8.314 जे/मोल के के बराबर)।
समीकरण (15), (16) हमें वाष्पीकरण की गर्मी की गणना करने की अनुमति देते हैं। ऐसा करने के लिए, प्रायोगिक डेटा के आधार पर एक निर्भरता बनाई जाती है एलएनपी=एफ(1/टी) या एलजीपी=एफ(1/टी) और परिणामी सीधी रेखा पर दो बिंदुओं का चयन करें (चित्र 2)। इन बिंदुओं के अनुरूप दबाव और व्युत्क्रम तापमान के लघुगणक के मानों को समीकरण (17) में रखें:
 (17)
(17)
∆ मान एन आईएसपीसमीकरण (17) के अनुसार लिया गया तापमान अंतराल पर निर्भर करता है और वास्तविक तापमान के जितना करीब होगा, यह अंतराल उतना ही छोटा होगा। हालाँकि, ऐसी गणना के लिए क्वथनांक और वाष्प दबाव के बहुत सटीक माप की आवश्यकता होती है।
∆ की गणना करने के लिए एन आईएसपीअपेक्षाकृत विस्तृत तापमान रेंज (50...100 डिग्री सेल्सियस) में, आपको उन बिंदुओं का चयन करना चाहिए जो सीधी रेखा में सबसे सटीक रूप से फिट होते हैं एलजीपी=एफ(1/टी).
किसी तरल का क्वथनांक, किसी दिए गए तापमान पर वाष्प का दबाव और वाष्पीकरण की गर्मी पदार्थ के विशिष्ट स्थिरांक हैं , जिसके मान कई सैद्धांतिक और व्यावहारिक गणनाओं के लिए आवश्यक हैं। इन आंकड़ों के आधार पर, रसायनों की शुद्धता निर्धारित करना, आसवन द्वारा मिश्रण के पृथक्करण की गणना करना और गैस चरण में प्रतिक्रिया करने के लिए आवश्यक तरल के वाष्पीकरण के लिए ऊर्जा लागत की गणना करना संभव है।
आणविक मापदंडों का उपयोग करके वाष्पीकरण की गर्मी की गणना में हमेशा धारणाएँ शामिल होती हैं। यदि कई शर्तें पूरी होती हैं तो यह अनुमानित और उपयुक्त है। हालाँकि, एक मौलिक क्लैपेरॉन-क्लॉसियस समीकरण है जो वाष्पीकरण की गर्मी को सिस्टम की अन्य थर्मोडायनामिक विशेषताओं से जोड़ता है और थर्मोडायनामिक्स के दूसरे नियम के आधार पर सख्ती से प्राप्त किया जाता है।
बता दें कि कार्नोट चक्र को निष्पादित करने वाला कार्यशील पदार्थ दो-चरण तरल-संतृप्त वाष्प प्रणाली है। हम चित्र 8.17 में बिंदु 1 के रूप में ऐसी प्रणाली की प्रारंभिक स्थिति को दर्शाते हैं। आइए हम राज्य 1 से राज्य 2 तक के तापमान पर सिस्टम का एक आइसोबैरिक-इज़ोटेर्मल विस्तार करें। इस मामले में, तरल का एक निश्चित द्रव्यमान वाष्पित हो जाएगा और, तदनुसार, तरल के वाष्पीकरण की गर्मी के बराबर गर्मी अवशोषित हो जाएगी थर्मोस्टेट से. बिंदु 2 और 1 पर आयतन में अंतर पदार्थ के वाष्पित द्रव्यमान के लिए गैसीय और तरल अवस्था में आयतन के अंतर के बराबर है: अवस्था 2 से, दो-चरण प्रणाली रुद्धोष्म रूप से निम्न तापमान के साथ अवस्था 3 में स्थानांतरित हो जाती है 7%. अवस्था 3 से, कार्यशील पदार्थ को आइसोबेरिकली-आइसोथर्मल रूप से अवस्था 4 में स्थानांतरित किया जाता है, जबकि कुछ वाष्प संघनित होते हैं और गर्मी रेफ्रिजरेटर में छोड़ी जाती है। अवस्था 4 से, दो-चरण प्रणाली को रुद्धोष्म संपीड़न द्वारा प्रारंभिक अवस्था में स्थानांतरित किया जाता है। चक्र कार्य है:
चक्र दक्षता कहां है
![]()
छोटे तापमान (दबाव) के अंतर पर, चक्र कार्य बराबर होता है:
(83.3) और (83.2) का उपयोग करते हुए, हम (83.1) को फिर से लिखते हैं:
![]()
सीमा तक बदलने और पास करने पर, हमें मिलता है:
![]()
यह संबंध थर्मोडायनामिक्स का पहला नियम स्थापित होने से पहले फ्रांसीसी इंजीनियर क्लैपेरॉन (1832) द्वारा पाया गया था।

इस समीकरण की आधुनिक व्युत्पत्ति क्लॉसियस द्वारा दी गई थी, इसीलिए इसे क्लैपेरॉन-क्लॉसियस समीकरण कहा जाता है। यह समीकरण आपको वाष्पीकरण (विशिष्ट, दाढ़) की गर्मी की गणना करने की अनुमति देता है, यदि तापमान पर संतृप्त वाष्प दबाव की निर्भरता, और तरल और वाष्प (विशिष्ट, दाढ़) की मात्रा ज्ञात हो।
व्युत्पन्न प्रयोगात्मक रूप से पाई गई निर्भरता (तापमान पर संतृप्त वाष्प दबाव की निर्भरता) से निर्धारित होता है।
क्लैपेरॉन-क्लॉसियस समीकरण न केवल तरल-वाष्प संक्रमण के लिए, बल्कि अन्य सभी चरण संक्रमणों के लिए भी मान्य है। यह दबाव में परिवर्तन को व्यक्त करता है जिस पर चरण तापमान में परिवर्तन के साथ संतुलन में होता है। इस प्रकार, पिघलने के लिए, समीकरण (83.4) का रूप ले लेता है
![]()