Kā iegūt nātrija nitrātu no amonjaka. Kā nitrīti atšķiras no nitrātiem. Iztvaicēšanas metodes iezīmes
Ķīmija ir aizraujoša zinātne. Tie, kurus interesē ne tikai teorija, bet arī izmēģina savas prasmes praksē, precīzi zina, kas ir uz spēles. Katrs skolēns ir iepazinies ar lielāko daļu periodiskās tabulas elementu. Bet vai katram izdevās izmēģināt savu pieredzi, sajaucot reaģentus un veicot ķīmiskos testus? Arī mūsdienās ne visās mūsdienu skolās ir nepieciešamais aprīkojums un reaģenti, tāpēc ķīmija joprojām ir atvērta zinātne patstāvīgām studijām. Daudzi cenšas to uzzināt dziļāk, veicot pētījumus mājās.
Neviens pašdarinātājs nevar iztikt bez slāpekļskābes - ārkārtīgi svarīgas lietas mājsaimniecībā. Vielu ir grūti iegūt: to var iegādāties tikai specializētā veikalā, kur pirkums tiek veikts saskaņā ar dokumentiem, kas apliecina vielas miermīlīgu lietošanu. Tāpēc, ja esat pašdarināts meistars, jūs, visticamāk, nevarēsit iegūt šo komponentu. Šeit rodas jautājums, kā mājās pagatavot slāpekļskābi. Process nešķiet sarežģīts, tomēr iznākumam jābūt vielai ar pietiekamu tīrības pakāpi un nepieciešamo koncentrāciju. Šeit nevar iztikt bez eksperimentālā ķīmiķa prasmēm.
Kur tiek izmantota viela?
Slāpekļskābes izmantošana ir saprātīga drošiem nolūkiem. Vielu izmanto šādās cilvēka darbības jomās:
- krāsojošo pigmentu izveide;
- fotofilmu izstrāde;
- zāļu sagatavošana;
- plastmasas izstrādājumu pārstrāde;
- izmantošana ķīmijā;
- Mēslojums dārzkopībai un dārzkopības kultūrām;
- dinamīta ražošana.

Tīra slāpekļskābe, nemainīta, izskatās kā šķidra viela, kas, saskaroties ar gaisu, sāk izdalīt baltus tvaikus. Tas sasalst jau pie -42 o C, un vārās pie +80 o C. Kā mājās ar savām rokām izņemt tādu vielu kā slāpekļskābi?
1. metode
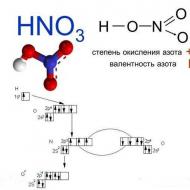
Kūpinošu vielu iegūst, pakļaujot koncentrātu nātrija (kālija) nitrātam (nātrija (kālija) nitrātam). Reakcijas rezultātā tiek iegūta vēlamā viela un nātrija (kālija) hidrosulfāts. Reakcijas shēma izskatās šādi: NaNO 3 + H 2 SO 4 => HNO 3 + NaHSO 4. Atcerieties, ka iegūtās vielas koncentrācija ir atkarīga no pirms ieiešanas reakcijā.
2. metode
Slāpekļskābes iegūšana mājās ar mazāku vielas koncentrāciju notiek tāpat, tikai nepieciešams nātrija nitrātu aizstāt ar amonija nitrātu. Ķīmiskais vienādojums izskatās šādi: NH 4 NĒ 3 + H 2 SO 4 =>(NH4) 2 SO 4 + HNO 3 . Ņemiet vērā, ka amonija nitrāts ir lētāks nekā kālija vai nātrija nitrāts, jo lielākā daļa pētnieku veic reakcijas, pamatojoties uz to.

Jo augstāka ir H 2 SO 4 koncentrācija, jo koncentrētāka būs slāpekļskābe. Lai iegūtu līdzsvarotu vielu, ir jāpalielina reakcijai nepieciešamā elektrolīta tilpums. Lai sasniegtu vēlamo rezultātu, praksē viņi izmanto iztvaicēšanas metodi, kas sastāv no elektrolīta tilpuma pakāpeniskas samazināšanas aptuveni 4 reizes salīdzinājumā ar sākotnējo.
Iztvaicēšanas metodes iezīmes
Trauku apakšā ielej izsijātas smiltis un ievieto rezervuāru ar elektrolītu. Šajā gadījumā gāzes plīts vārīšanas, uguns padevības vai samazināšanas process. Process ir ilgs, tāpēc šajā jautājumā ir svarīga pacietība. Speciālisti iesaka izmantot verdošu ūdeni – stikla vai keramikas caurules, kas paredzētas ķīmiskiem eksperimentiem, tostarp iztvaicēšanai. Tie neitralizē burbuļu veidošanos un samazina vārīšanās spēku, novēršot vielas izšļakstīšanos. Šādos apstākļos ir atļauts iegūt slāpekļskābi mājās ar koncentrāciju aptuveni 93%.
Instrumenti un reaģenti vielas praktiskai sagatavošanai
Lai reakcija notiktu, jums būs nepieciešams:
- koncentrēts H 2 SO 4 (> 95%) - 50 ml;
- amonija nitrāts, kālijs, nātrijs;
- 100 ml tilpums;
- 1000 ml tvertne;
- stikla piltuve;
- gumija;
- ūdens vanna;
- sasmalcināts ledus (var aizstāt ar sniegu vai aukstu ūdeni);
- termometrs.

Slāpekļskābes iegūšanai mājās, tāpat kā jebkurai citai ķīmiskai reakcijai, ir nepieciešami piesardzības pasākumi:
- Slāpekļskābes iegūšanas procesā mājās ir nepieciešams uzturēt temperatūru 60-70 ° C robežās. Ja šīs robežas tiek pārsniegtas, skābe sāks sadalīties.
- Reakcijas laikā var izdalīties tvaiki un gāzes, tādēļ, strādājot ar skābēm, noteikti izmantojiet aizsargmasku. Rokas ir jāaizsargā no pēkšņas saskares ar ādu, tāpēc ķīmiķi strādā gumijas cimdos. Lielajās ķīmiskajās rūpniecībās, kur cilvēks nonāk saskarē ar veselībai bīstamām vielām, darbinieki parasti strādā īpašos aizsargtērpos.
Tagad jūs zināt, kā vienkāršā reakcijā iegūt slāpekļskābi. Esiet piesardzīgs, lietojot šādu vielu un izmantojiet to tikai miermīlīgiem nolūkiem.
Slāpekļskābe ir spēcīga skābe. Viņas sāļi nitrāti- iegūti, HNO 3 iedarbojoties uz metāliem, oksīdiem, hidroksīdiem vai karbonātiem. Visi nitrāti labi šķīst ūdenī. Nitrātu jons ūdenī nehidrolizējas.
Slāpekļskābes sāļi karsējot sadalās neatgriezeniski, un sadalīšanās produktu sastāvu nosaka katjons:
a) metālu nitrāti, kas atrodas spriegumu virknē pa kreisi no magnija:
b) metālu nitrāti, kas atrodas spriegumu virknē starp magniju un varu:
c) metālu nitrāti, kas atrodas virknē spriegumu pa labi no dzīvsudraba:
d) amonija nitrāts:
Nitrāti ūdens šķīdumos praktiski neuzrāda oksidējošas īpašības, bet augstā temperatūrā cietā stāvoklī tie ir spēcīgi oksidētāji, piemēram, kausējot cietās vielas:
Cinks un alumīnijs sārmainā šķīdumā reducē nitrātus līdz NH 3:
Nitrātus plaši izmanto kā mēslojumu. Tajā pašā laikā gandrīz visi nitrāti labi šķīst ūdenī, tāpēc minerālvielu veidā tie pēc būtības ir ārkārtīgi mazi; izņēmums ir Čīles (nātrija) nitrāts un Indijas nitrāts (kālija nitrāts). Lielākā daļa nitrātu tiek iegūti mākslīgi.
Šķidrais slāpeklis tiek izmantots kā aukstumaģents un krioterapijā. Naftas ķīmijas rūpniecībā slāpekli izmanto, lai attīrītu tvertnes un cauruļvadus, pārbaudītu cauruļvadu darbību zem spiediena un palielinātu nogulšņu veidošanos. Ieguves rūpniecībā slāpekli var izmantot, lai raktuvēs izveidotu sprādziendrošu vidi, lai pārplēstu iežu slāņus.
Svarīga slāpekļa pielietojuma joma ir tā izmantošana visdažādāko slāpekli saturošu savienojumu, piemēram, amonjaka, slāpekļa mēslošanas līdzekļu, sprāgstvielu, krāsvielu uc tālākai sintēzei. Koksa ražošanā tiek izmantots liels slāpekļa daudzums (“sausā koksa dzēšana”). ).
Pārtikas rūpniecībā slāpeklis ir reģistrēts kā pārtikas piedeva. E941, kā gāzes barotne iepakošanai un uzglabāšanai, aukstumaģents un šķidrais slāpeklis tiek izmantots, pildot eļļas un negāzētos dzērienus, lai mīkstajos traukos radītu pārspiedienu un inertu atmosfēru.
Slāpekļa gāze piepilda gaisa kuģu šasijas riepu kameras.
31. Fosfors - iegūšana, īpašības, pielietojums. Allotropija. Fosfīns, fosfonija sāļi - sagatavošana un īpašības. Metālu fosfīdi, sagatavošana un īpašības.
Fosfors- D. I. Mendeļejeva periodiskās sistēmas trešā perioda 15. grupas ķīmiskais elements; ir atomskaitlis 15. Elements pieder pie pniktogēnu grupas.
Fosforu iegūst no apatīta vai fosforīta mijiedarbības rezultātā ar koksu un silīcija dioksīdu aptuveni 1600 ° C temperatūrā:
Iegūtie fosfora tvaiki uztvērējā zem ūdens slāņa kondensējas alotropā modifikācijā baltā fosfora formā. Fosforītu vietā, lai iegūtu elementāro fosforu, ar akmeņoglēm var reducēt citus neorganiskos fosfora savienojumus, piemēram, ieskaitot metafosforskābi:
Fosfora ķīmiskās īpašības lielā mērā nosaka tā alotropā modifikācija. Baltais fosfors ir ļoti aktīvs, pārejot uz sarkano un melno fosforu, ķīmiskā aktivitāte samazinās. Baltais fosfors gaisā, oksidējoties ar atmosfēras skābekli istabas temperatūrā, izstaro redzamu gaismu, mirdzums ir saistīts ar fosfora oksidācijas fotoemisijas reakciju.
Fosforu viegli oksidē skābeklis:
(ar lieko skābekli)
(ar lēnu oksidēšanos vai skābekļa trūkumu)
Mijiedarbojas ar daudzām vienkāršām vielām - halogēniem, sēru, dažiem metāliem, uzrādot oksidējošas un reducējošas īpašības: ar metāliem - oksidētājs, veido fosfīdus; ar nemetālu - reducētāju.
Fosfors praktiski nesavienojas ar ūdeņradi.
Aukstos koncentrētos sārmu šķīdumos arī disproporcijas reakcija norit lēni:
Spēcīgi oksidētāji pārvērš fosforu par fosforskābi:
Fosfora oksidēšanās reakcija notiek, kad sērkociņi tiek aizdedzināti, Bertoleta sāls darbojas kā oksidētājs:
Baltais ("dzeltenais") fosfors ir ķīmiski aktīvākais, toksiskākais un uzliesmojošākais, un tāpēc to ļoti bieži izmanto (uzliesmojošās bumbās utt.).
Sarkanais fosfors ir galvenā modifikācija, ko ražo un patērē rūpniecība. To izmanto sērkociņu, sprāgstvielu, aizdedzes kompozīciju, dažāda veida degvielu, kā arī ekstrēma spiediena smērvielu ražošanā, kā geteru kvēlspuldžu ražošanā.
Elementārais fosfors normālos apstākļos pastāv vairāku stabilu alotropu modifikāciju veidā. Visas iespējamās fosfora alotropās modifikācijas vēl nav pilnībā izpētītas (2016). Tradicionāli izšķir četras tā modifikācijas: balto, sarkano, melno un metālisko fosforu. Dažkārt tos arī sauc galvenais allotropās modifikācijas, kas nozīmē, ka visas pārējās aprakstītās modifikācijas ir šo četru sajaukums. Standarta apstākļos stabilas ir tikai trīs alotropās fosfora modifikācijas (piemēram, baltais fosfors ir termodinamiski nestabils (kvazistacionārs stāvoklis) un normālos apstākļos laika gaitā pārvēršas sarkanajā fosforā). Īpaši augsta spiediena apstākļos elementa metāliskā forma ir termodinamiski stabila. Visas modifikācijas atšķiras pēc krāsas, blīvuma un citām fizikālajām un ķīmiskajām īpašībām, īpaši ķīmiskās aktivitātes ziņā. Vielas stāvoklim pārejot termodinamiski stabilākā modifikācijā, ķīmiskā aktivitāte samazinās, piemēram, baltajam fosforam secīgi pārvēršoties sarkanā, pēc tam sarkanā melnā (metāliskā).
Fosfīns (ūdeņraža fosfīds, ūdeņraža fosfīds, fosfora hidrīds, fosfāns pH 3) ir bezkrāsaina, indīga gāze (normālos apstākļos) ar specifisku sapuvušu zivju smaku.
Fosfīnu iegūst, baltajam fosforam reaģējot ar karstu sārmu, piemēram:
To var iegūt arī, ūdenim vai skābēm iedarbojoties uz fosfīdiem:
Ūdeņraža hlorīds, karsējot, mijiedarbojas ar balto fosforu:
Fosfonija jodīda sadalīšanās:
Fosfonskābes sadalīšanās:
vai atjaunot to:
Ķīmiskās īpašības.
Fosfīns ļoti atšķiras no tā līdzinieka amonjaka. Tā ķīmiskā aktivitāte ir augstāka nekā amonjakam, tas slikti šķīst ūdenī, jo bāze ir daudz vājāka par amonjaku. Pēdējais izskaidrojams ar to, ka H–P saites ir vāji polarizētas un fosfora (3s 2) vientuļo pāru aktivitāte ir zemāka nekā slāpekļa (2s 2) aktivitāte amonjakā.
Ja nav skābekļa, karsējot, tas sadalās elementos:
spontāni aizdegas gaisā (difosfīna tvaiku klātbūtnē vai temperatūrā virs 100 °C):
Parāda spēcīgas atjaunojošas īpašības:
Mijiedarbojoties ar spēcīgiem protonu donoriem, fosfīns var radīt fosfonija sāļus, kas satur PH 4 + jonu (līdzīgi kā amonija). Fosfonija sāļi, bezkrāsainas kristāliskas vielas, ir ārkārtīgi nestabilas, viegli hidrolizējamas.
Fosfonija sāļi, tāpat kā pats fosfīns, ir spēcīgi reducējoši līdzekļi.
Fosfīdi- bināri fosfora savienojumi ar citiem mazāk elektronegatīviem ķīmiskajiem elementiem, kuros fosforam ir negatīvs oksidācijas stāvoklis.
Lielākā daļa fosfīdu ir fosfora savienojumi ar tipiskiem metāliem, kas iegūti, tiešā veidā mijiedarbojoties vienkāršām vielām:
Na + P (sarkans) → Na 3 P + Na 2 P 5 (200 °C)
Bora fosfīdu var iegūt, gan tieši mijiedarbojoties vielām aptuveni 1000 ° C temperatūrā, gan bora trihlorīda reakcijā ar alumīnija fosfīdu:
BCl 3 + AlP → BP + AlCl 3 (950 °C)
Metālu fosfīdi ir nestabili savienojumi, kas sadalās ar ūdeni un atšķaidītām skābēm. Šajā gadījumā tiek iegūts fosfīns un hidrolīzes gadījumā metāla hidroksīds, mijiedarbības gadījumā ar skābēm, sāļi.
Ca 3 P 2 + 6H 2 O → 3Ca(OH) 2 + 2PH 3
Ca 3P 2 + 6HCl → 3CaCl 2 + 2PH 3
Ar mērenu karsēšanu lielākā daļa fosfīdu sadalās. Izkusis zem fosfora tvaiku pārmērīga spiediena.
Gluži pretēji, bora fosfīds BP ir ugunsizturīgs (t pl. 2000 ° C, ar sadalīšanos), ļoti inerta viela. Tas sadalās tikai ar koncentrētām oksidējošām skābēm, saķepināšanas laikā karsējot reaģē ar skābekli, sēru, sārmiem.
32. Fosfora oksīdi - molekulārā uzbūve, ražošana, īpašības, pielietojums.
Fosfors veido vairākus oksīdus. Svarīgākie no tiem ir fosfora oksīds (V) P 4 O 10 un fosfora oksīds (III) P 4 O 6 . Bieži vien to formulas tiek rakstītas vienkāršotā formā - P 2 O 5 un P 2 O 3. Šo oksīdu struktūra saglabā fosfora atomu tetraedrisku izvietojumu.
Fosfora (III) oksīds P 4 O 6- vaska kristāliska masa, kas kūst 22,5 ° C temperatūrā un pārvēršas bezkrāsainā šķidrumā. Indīgs.
Izšķīdinot aukstā ūdenī, veidojas fosforskābe:
P 4 O 6 + 6H 2 O \u003d 4H 3 PO 3,
un, reaģējot ar sārmiem, attiecīgie sāļi (fosfīti).
Spēcīgs reducētājs. Mijiedarbojoties ar skābekli, tas tiek oksidēts līdz P 4 O 10.
Fosfora (III) oksīdu iegūst, oksidējot balto fosforu bez skābekļa.
Fosfora (V) oksīds P 4 O 10- balts kristālisks pulveris. Sublimācijas temperatūra ir 36°C. Tam ir vairākas modifikācijas, no kurām vienai (tā sauktajai gaistošajai) ir P 4 O 10 sastāvs. Šīs modifikācijas kristāliskais režģis sastāv no P 4 O 10 molekulām, kas savstarpēji savienotas ar vājiem starpmolekulāriem spēkiem, kuras karsējot viegli saplīst. Līdz ar to šīs šķirnes nepastāvība. Citas modifikācijas ir polimēru. Tos veido bezgalīgi PO 4 tetraedru slāņi.
Kad P 4 O 10 mijiedarbojas ar ūdeni, veidojas fosforskābe:
P 4 O 10 + 6H 2 O \u003d 4H 3 PO 4.
Būdams skābs oksīds, P 4 O 10 reaģē ar bāzes oksīdiem un hidroksīdiem.
Tas veidojas augstas temperatūras fosfora oksidācijas laikā skābekļa pārpalikumā (sausā gaisā).
Pateicoties tā izcilajai higroskopitātei, fosfora (V) oksīds tiek izmantots laboratorijas un rūpnieciskajās tehnoloģijās kā žāvēšanas un dehidratācijas līdzeklis. Savā žūšanas efektā tas pārspēj visas citas vielas. Ķīmiski saistīts ūdens tiek noņemts no bezūdens perhlorskābes, veidojot tās anhidrīdu:
4HClO 4 + P 4 O 10 \u003d (HPO 3) 4 + 2Cl 2 O 7.
P 4 O 10 izmanto kā gāzu un šķidrumu žāvētāju.
To plaši izmanto organiskajā sintēzē dehidratācijas un kondensācijas reakcijās.
Nitrīti un nitrāti atšķiras ne tikai pēc nosaukuma, bet arī to formulā ir dažādi elementi. Tomēr viņiem ir kaut kas kopīgs. Šo vielu darbības joma ir diezgan plaša. Tie atrodas arī cilvēka organismā, un, ja tie uzkrājas pārāk daudz, cilvēks saņem smagu saindēšanos, kas var izraisīt pat nāvi.
Kas ir nitrāti
Vienkārši sakot, nitrāti ir slāpekļskābes sāļi. To formulā tie satur viencipara anjonu. Agrāk to sauca par nitrātu. Tagad tas ir minerālvielu, kā arī lauksaimniecībā izmantojamo mēslošanas līdzekļu nosaukums.
Nitrātus iegūst ar slāpekļskābes palīdzību, kas iedarbojas uz metāliem, oksīdiem, sāļiem un hidroksīdiem. Visus nitrātus var atšķaidīt ūdenī. Cietā stāvoklī tie ir spēcīgi oksidētāji, bet to īpašības izzūd, ja šķīdumam pievieno slāpekļskābi.
Nitrāti saglabā savas īpašības parastā temperatūrā, bet izkūst zemā temperatūrā un līdz pilnīgai sadalīšanai. Šo vielu iegūšanas process ir ļoti sarežģīts, tāpēc, iespējams, tas interesēs tikai ķīmiķus.
Nitrāti ir sprāgstvielu pamats - tie ir amonīti un citas vielas. Tos galvenokārt izmanto kā minerālmēslus. Tagad nav noslēpums, ka augi šūnu veidošanai izmanto slāpekli no sāls. Augs rada hlorofilu, ar kuru tas dzīvo. Bet cilvēka organismā nitrāti kļūst par nitrītiem, kas cilvēku var nogādāt kapā.
Nitrīti ir arī sāļi
Nitrīti ir arī slāpekļskābes sāļi, taču to ķīmiskajā sastāvā ir atšķirīga formula. Ir zināmi nātrija, kalcija nitrīti. Zināmi arī svina, sudraba, sārmu, sārmzemju, 3D metālu nitrīti.
Tās ir kristāliskas vielas, kas ir raksturīgas arī kālijam vai bārijam. Dažas vielas labi šķīst ūdenī, bet citas, piemēram, sudrabs, dzīvsudrabs vai vara nitrīts, tajā slikti šķīst. Jāatzīmē, ka nitrīti arī praktiski nešķīst organiskajos šķīdinātājos. Bet, paaugstinot temperatūru, nitrītu šķīdība uzlabojas.
Cilvēce izmanto nitrītus slāpekļa krāsvielu ražošanā, kaprolaktāma iegūšanai, kā arī kā oksidējošus un reducējošus reaģentus gumijas, tekstila un metālapstrādes rūpniecībā. Piemēram, nātrija nitrīts ir labs konservants un tiek izmantots betona maisījumu ražošanā kā cietēšanas paātrinātājs un antifrīza piedeva.
Nitrīti ir cilvēka hemoglobīna inde, tāpēc tie katru dienu ir jāizvada no organisma. Tie nonāk cilvēka ķermenī tieši vai ar dažām citām vielām. Ja cilvēka ķermenis funkcionē normāli, nepieciešamais vielas daudzums paliek, un nevajadzīgais tiek izņemts. Bet, ja cilvēks ir slims, ir problēma ar saindēšanos ar nitrītiem.
(A) Nitrīti
Ievērojot atbilstību izņēmumi kas norādīti šīs apakšgrupas vispārīgajos noteikumos, šajā pozīcijā ietilpst nitrīti, slāpekļskābes metālu sāļi (HNO 2) (pozīcija ).
- nātrija nitrīts(NaNO2). Iegūst, reducējot nātrija nitrātu ar svinu un svina litharga ražošanas laikā. Bezkrāsaini kristāli, higroskopiski un labi šķīst ūdenī. Izmanto kā oksidētāju tvertņu krāsošanā; organiskajā sintēzē; gaļas pārstrādei; fotogrāfijā; kā žurku inde utt.
- Kālija nitrīts(KNO 2). Iegūst ar tādām pašām metodēm kā nātrija nitrītu vai sēra dioksīda iedarbību uz kalcija oksīda un kālija nitrāta maisījumu. Balts kristālisks pulveris vai dzeltenīgi nūjiņas; bieži satur citus sāļus kā piemaisījumus. Izšķīst ūdenī, gaisā stipri izplūst, pasliktinoties īpašībām. To izmanto tādiem pašiem mērķiem kā nātrija nitrītu.
- bārija nitrīts(Ba(NO 2) 2). Pirotehnikā izmantotie kristāli.
- Cits nitrīti. Tajos ietilpst amonija nitrīts, nestabils un sprādzienbīstams produkts; izmanto kā šķīdumu slāpekļa iegūšanai laboratorijā.
(B) Nitrāti
Ievērojot atbilstību izņēmumi kas norādīti šīs apakšpozīcijas vispārīgajos noteikumos, šajā pozīcijā ietilpst nitrāti, metālu sāļi un slāpekļskābe (pozīcija ), izņemot amonija nitrāts un nātrija nitrāts, gan tīrs, gan neattīrīts ( virsraksts vai ). (Citus izņēmumus skatiet tālāk.)
Šeit ir iekļauti arī pamata nitrāti.
- kālija nitrāts(KNO 3) (saukts arī par "salpetru"). Iegūst no nātrija nitrāta un kālija hlorīda. Tā ir bezkrāsaina kristāliska vai stiklveida masa vai balts kristālisks pulveris, kas šķīst ūdenī un higroskopisks, ja tas ir neapstrādāts. To izmanto līdzīgi kā nātrija nitrātu, kā arī šaujampulvera, ķīmisko detonatoru ražošanā, pirotehnikā, sērkociņu un metalurģijas kušņu ražošanā.
- Bismuta nitrāti:
(A) neitrāls bismuta nitrāts(Bi(NO 3) 3 5H 2 O). Iegūts, slāpekļskābei iedarbojoties uz bismutu; lieli bezkrāsaini šķidri kristāli. Izmanto bismuta oksīdu vai sāļu un dažu laku ražošanai;
b) bāzes bismuta nitrāts(BiNO 3 (OH) 2). Iegūts no neitrāla bismuta nitrāta; pērļu balts pulveris, nešķīst ūdenī. Lieto medicīnā (kuņģa-zarnu trakta slimību ārstēšanai); keramikas ražošanā (varavīksnes krāsas), kosmētikā, drošinātāju ražošanā u.c.
- magnija nitrāts(Mg (NO 3) 2 6H 2 O). Bezkrāsaini kristāli, šķīst ūdenī. To izmanto pirotehnikā, lai iegūtu ugunsizturīgus izstrādājumus (ar magnija oksīdu), kvēlspuldzes režģus utt.
- kalcija nitrāts(Ca(NO 3) 2). Iegūta, apstrādājot sasmalcinātu kaļķakmeni ar slāpekļskābi. Balta izkliedējoša masa, šķīst ūdenī, spirtā un acetonā. To izmanto pirotehnikā, sprāgstvielu, sērkociņu, mēslošanas līdzekļu u.c. ražošanā.
- dzelzs nitrāts(Fe(NO3)36H2O vai 9H2O). Zilie kristāli. To izmanto kā kodinātāju krāsošanā un apdrukā (tīrā veidā vai sajaucot ar acetātu). Medicīnā izmanto tīru ūdens šķīdumu.
- kobalta nitrāts(Co (NO 3) 2 6H 2 O). Violeti, sarkanīgi vai brūngani kristāli, šķīst ūdenī un izšķīst. Izmanto kobaltzilās vai kobaltdzeltenās un simpātisko tinšu ražošanā; keramikas dekorēšanai; kobalta elektropārklāšanai utt.
- Niķeļa nitrāts(Ni(NO3)26H2O). Ūdenī šķīstoši, šķīstoši zaļi kristāli. Izmanto keramikas (brūno pigmentu) ražošanā; krāsojot (kā kodinātāju); niķeļa galvanizācijas laikā; niķeļa oksīda vai tīra niķeļa katalizatoru iegūšanai.
- Vara nitrāts(Cu(NO 3) 2). Iegūst, izšķīdinot varu slāpekļskābē un pēc tam kristalizējot (satur 3 vai 6 ūdens molekulas, atkarībā no temperatūras). Zili vai zaļi kristāli, šķīst ūdenī, higroskopiski; indīgs. Izmanto pirotehnikā; krāsvielu ražošanā; krāsojot vai apdrukājot tekstilmateriālus (kodolu); divvērtīgā vara oksīda ražošanai un fotopapīra ražošanai; veicot galvanizāciju, piešķirt metāliem mākslīgu patinu utt.
- Stroncija nitrāts(Sg(NO 3) 2). Iegūst, stroncija oksīdam vai stroncija sulfīdam iedarbojoties uz slāpekļskābi, karsējot kā bezūdens sāli vai kā hidratētu sāli (ar 4 ūdens molekulām) pazeminātā temperatūrā. Bezkrāsains kristālisks pulveris, šķīstošs, šķīst ūdenī, karsējot sadalās. To izmanto pirotehnikā (sarkanā gaisma), sērkociņu ražošanā.
- kadmija nitrāts(Cd (NO 3) 2 4H 2 O). Iegūts no oksīda. Bezkrāsainas adatas, šķidras, šķīst ūdenī. To izmanto kā krāsvielu keramikas vai stikla rūpniecībā.
- bārija nitrāts(Ba(NO 3) 2). Iegūts no dabīgā karbonāta (viterīta) (pozīcija ). Bezkrāsaini vai balti kristāli vai kristālisks pulveris; šķīst ūdenī, indīgs. Izmanto pirotehnikā (zaļā gaisma); sprāgstvielu, optiskā stikla, keramikas glazūru, bārija sāļu vai nitrātu u.c. ražošanā.
- svina nitrāts(Рb(NO 3) 2). Svina nitrāts veidojas kā blakusprodukts svina dioksīda ražošanā, slāpekļskābei iedarbojoties uz sarkano svinu. Bezkrāsaini kristāli, šķīst ūdenī; indīgs. Izmanto pirotehnikā (dzeltenā gaisma), sērkociņu, sprāgstvielu un dažu krāsvielu ražošanā; sauļošanā, fotogrāfijā un litogrāfijā; lai iegūtu svina sāļus, kā oksidētāju organiskajā sintēzē.
Papildus iepriekšminētajam izņēmumi, Arī nav iekļautsšādus produktus.
Ievads
Maz ticams, ka kāds no jums ir dzirdējis par nātrija nitrātu. Tās vārds bieži tiek minēts skolā, ne tikai rūpniecībā. Bet tikai vārds! Kas vēl ir zināms par nātrija nitrātu? Par to mēs runāsim šodienas rakstā.
DefinīcijaNātrija nitrāts (formula NaNO 3) ir slāpekļskābes nātrija sāls. To var saukt par "nātrija nitrātu" vai "nātrija / nātrija / Čīles nitrātu".
Īpašības
Nātrija nitrātu attēlo bezkrāsaini gari kristāli ar romboedrisku vai trigonālu kristāla režģi. Tie garšo ļoti sāļi. Dažādās vielās tie šķīst atšķirīgi, bet nātrija nitrāts vislabāk "kūst" ūdenī. 380 ° C temperatūrā šis savienojums sadalās nātrija nitrītā un skābeklī. Reakcija izskatās šādi: 2NaNO 3 => 2NaNO 2 + O 2. Arī nātrija nitrāts var iesaistīties apmaiņas reakcijās, no kurām otrs reaģents ir sārmu metālu sāļi. Viens no produktiem vienmēr būs nitrāts, kura šķīdība ir daudz zemāka nekā pašlaik apspriestajai vielai. Piemēram, nātrija nitrātam reaģējot ar kālija hlorīdu, veidojas kālija nitrāts un galda sāls (nātrija hlorīds). Izkausētajam nitrātam ir spēcīgas oksidējošas īpašības, bet šķīdumā - reducējošas īpašības. Kad tas sadalās, izdalās skābeklis, un tāpēc šis savienojums var reaģēt ar nemetāliem.

Šo nitrātu var iegūt vairākos veidos:
Slāpekļskābes reakcija ar metālu vai nātrija oksīdu
Ja slāpekļskābei pievieno tīru nātriju, notiek neitralizācijas reakcija. Tās produkti būs vēlamā viela, ūdens, kā arī gāzveida slāpeklis un tā oksīdi (I, II). Ja tai pašai skābei pievieno nātrija oksīdu, rezultāts ir tagad apspriestais savienojums un ūdens.
Slāpekļskābes reakcija ar skābes sāļiem vai nātrija hidroksīdu
Ja HNO 3 pievieno skābu nātrija sāli (piemēram, tā bikarbonātu), tad veidojas vēlamā viela ūdens un oglekļa dioksīds, kas ātri iztvaiko. Ja nātrija hidroksīds kļūst par otro reaģentu, tad, tāpat kā tā oksīda un slāpekļskābes gadījumā, tiek iegūts tikai nātrija nitrāts un H 2 O.
Amonija nitrāta reakcija ar skābju sāļiem vai nātrija hidroksīdu
Slāpekļskābi var veiksmīgi aizstāt ar amonija nitrātu. Mijiedarbojoties ar nātrija hidroksīdu, veidojas vēlamā viela ūdens un gāzveida amonjaks, un, reaģējot ar nātrija bikarbonātu, šie savienojumi un oglekļa dioksīds kļūst par produktiem.
Galda sāls reakcija ar sudraba nitrātu
Šajā gadījumā notiek apmaiņas reakcija, kuras produkti ir nātrija nitrāts un sudraba hlorīds.
Pieteikums

Šo vielu izmanto kā vērtīgu slāpekļa mēslojumu. Pirotehnikas, pārtikas, stikla un metālapstrādes rūpniecība nevar iztikt bez nātrija nitrāta. Nātrija nitrātu no dabas atradnēm iegūst vairākos veidos:
Šīs vielas izskalošanās ar karstu ūdeni un kristalizācija;
Slāpekļa oksīdu absorbcija, izmantojot cepamās sodas šķīdumu;
Apmaiņas reakcija, kas ietver sulfātu / hlorīdu / nātrija karbonātu un kalcija / amonija nitrātu.
Secinājums
Šī ir nātrija nitrāta svarīgā loma. Ir arī citas vielas, bez kurām cilvēks nevar iztikt, bet par tām runāsim citreiz.