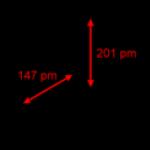
A jobb és bal kéz kiralitása. Királis molekulák. Kiralitás a farmakológiában
Koncepció kiralitás– az egyik legfontosabb a modern sztereokémiában.A modell királis, ha az egyszerű forgástengelyeken kívül egyetlen szimmetriaelem sem (sík, középpont, tükör-forgástengelyek) nincs. Királisnak nevezzük azt a molekulát, amelyet egy ilyen modell ír le (jelentése: „kézszerű”, görögül . hiro- kéz) azért, mert a kezekhez hasonlóan a molekulák sem kompatibilisek tükörképeikkel. Az 1. ábra számos egyszerű királis molekulát mutat be. Két tény teljesen nyilvánvaló: egyrészt az adott molekulapárok egymás tükörképeit jelentik, másrészt ezek a tükörreflexiók nem kombinálhatók egymással. Megjegyezzük, hogy a molekula minden esetben tartalmaz egy szénatomot négy különböző szubsztituenssel. Az ilyen atomokat aszimmetrikusnak nevezzük. Az aszimmetrikus szénatom egy királis vagy sztereogén centrum. Ez a kiralitás leggyakoribb típusa. Ha egy molekula királis, akkor két izomer formában létezhet, amelyek tárgyként és tükörképeként kapcsolódnak egymáshoz, és nem kompatibilisek a térben. Az ilyen izomereket (para) nevezzük enantiomerek.
A „királis” kifejezés nem teszi lehetővé a szabad értelmezést. Ha egy molekula királis, akkor a kézhez hasonlóan bal- vagy jobbkezesnek kell lennie. Amikor egy anyagot vagy annak egy mintáját királisnak nevezzük, ez egyszerűen azt jelenti, hogy az (ez) királis molekulákból áll; Ezenkívül egyáltalán nem szükséges, hogy minden molekula azonos legyen a kiralitás szempontjából (bal vagy jobb, R vagy S lásd az 1.3 szakaszt). Két korlátozó esetet különböztethetünk meg. Az elsőben a minta kiralitás szempontjából azonos molekulákból áll (homokirális, csak R vagy csak S); ilyen mintát hívnak enantiomer tisztaságú. A második (ellentétes) esetben a minta ugyanannyi, kiralitásban (heterokirális, mólarány) eltérő molekulából áll. R: S=1:1); egy ilyen minta is királis, de racém. Van egy köztes eset is - az enantiomerek nem ekvimoláris keveréke. Ezt a keveréket ún skálázó vagy nem racém. Így azt az állítást, hogy egy makroszkopikus minta (szemben egy egyedi molekulával) királis, nem tekinthető teljesen egyértelműnek, ezért bizonyos esetekben elégtelennek kell tekinteni. További jelzésre lehet szükség, hogy a minta racém vagy nem racém. A pontosság hiánya ennek megértésében bizonyos fajta tévhitekhez vezet, például a cikkek címében, amikor valamilyen királis vegyület szintézisét hirdetik, de továbbra sem világos, hogy a szerző csak arra a tényre akarja-e felhívni a figyelmet. a cikkben tárgyalt szerkezet kiralitása, vagy hogy a terméket valóban egyetlen enantiomer formájában kapták-e (vagyis homokirális molekulák együttese; ezt az együttest azonban nem szabad homokirális mintának nevezni). Így egy királis nem racém minta esetén helyesebb azt mondani "enantiomeresen dúsított" vagy " enantiomer tiszta".
Módszerek optikai izomerek ábrázolására
A képmódszert a szerző kizárólag az információátadás kényelmét szolgálja. Az 1. ábrán az enantiomerek képei perspektivikus képekkel vannak megadva. Ilyenkor a képsíkban fekvő összefüggéseket folytonos vonallal szokás megrajzolni; a síkon túlnyúló kapcsolatok pontozottak; a megfigyelő felé irányuló kapcsolatokat pedig vastag vonallal jelöljük. Ez az ábrázolási módszer meglehetősen informatív az egy királis centrummal rendelkező struktúrák esetében. Ugyanezek a molekulák Fischer-vetületként is ábrázolhatók. Ezt a módszert E. Fisher javasolta összetettebb szerkezetek (különösen szénhidrátok) esetében, amelyek két vagy több királis centrumot tartalmaznak.







Tükörsík
Rizs. 1
Fischer-vetületi képletek megalkotásához a tetraédert úgy forgatjuk, hogy két vízszintes síkban fekvő kötés a megfigyelő felé irányul, a függőleges síkban fekvő két kötés pedig a megfigyelőtől távolodjon el. Csak az aszimmetrikus atom esik a képsíkra. Ebben az esetben magát az aszimmetrikus atomot általában kihagyjuk, csak a metsző vonalakat és a szubsztituens szimbólumokat tartjuk meg. A szubsztituensek térbeli elrendezésének emlékezetére a vetítési képletekben gyakran megőrződnek egy szaggatott függőleges vonal (a felső és alsó szubsztituensek a rajz síkján túl vannak eltávolítva), de ez gyakran nem történik meg. Az alábbiakban példákat mutatunk be ugyanazon szerkezet egy adott konfigurációval történő ábrázolásának különböző módjaira (2. ábra).
Fischer-vetítés

Rizs. 2
Adjunk néhány példát Fischer-projekciós képletekre (3. ábra)

(+)-(L)-alanin(-)-2-butanol (+)-( D)-gliceraldehid
Rizs. 3
Mivel a tetraéder más-más oldalról is szemlélhető, minden sztereoizomer tizenkét (!) különböző vetületi képlettel ábrázolható. A vetületi képletek szabványosítása érdekében bizonyos szabályokat vezettek be azok írására. Így a fő (nómenklaturális) funkció, ha a lánc végén van, általában a tetejére kerül, a főláncot függőlegesen ábrázolják.
A „nem szabványos” írott vetületi képletek összehasonlításához ismernie kell a következő szabályokat a vetületi képletek átalakítására.
1. A képlet nem távolítható el a rajzsíkról és nem forgatható el 90 o-kal, bár a rajzsíkban 180 o-kal elforgatható anélkül, hogy a sztereokémiai jelentésük megváltozna (4. ábra)

Rizs. 4
2. Egy aszimmetrikus atomon lévő szubsztituensek két (vagy páros számú) átrendeződése nem változtatja meg a képlet sztereokémiai jelentését (5. ábra).

Rizs. 5
3. Az aszimmetrikus központban lévő szubsztituensek egy (vagy páratlan számú) átrendeződése az optikai antipód képletéhez vezet (6. ábra).

Rizs. 6
4. A rajzsíkban 90 0-val történő elforgatás a képletet antipodeálissá változtatja, kivéve, ha ezzel egyidejűleg megváltozik a szubsztituensek elhelyezkedésének feltétele a rajzsíkhoz képest, pl. Tegyük fel, hogy most az oldalsó szubsztituensek a rajzsík mögött, a felső és az alsó szubsztituensek pedig előtte vannak. Ha szaggatott vonallal rendelkező képletet használ, akkor a szaggatott vonal megváltozott tájolása közvetlenül emlékezteti Önt erre (7. ábra)

Rizs. 7
5. A permutációk helyett a vetületi képletek bármely három szubsztituens óramutató járásával megegyező vagy azzal ellentétes forgatásával transzformálhatók (8. ábra); a negyedik szubsztituens nem változtatja meg a helyzetét (ez a művelet két átrendeződésnek felel meg):

Rizs. 8
Fischer-vetületek nem alkalmazhatók olyan molekulákra, amelyek kiralitása nem a királis centrumhoz, hanem más elemekhez (tengely, sík) kapcsolódik. Ezekben az esetekben 3D képekre van szükség.
D , L - Fisher-nómenklatúra
Megvitattunk egy problémát - hogyan kell egy háromdimenziós szerkezetet síkon ábrázolni. A módszer megválasztását kizárólag a sztereó információk bemutatásának és érzékelésének kényelme határozza meg. A következő probléma az egyes sztereoizomerek nevének megalkotásával kapcsolatos. A névnek tükröznie kell a sztereogén központ konfigurációjára vonatkozó információkat. Történelmileg az optikai izomerek első nómenklatúrája az volt D, L- Fisher által javasolt nómenklatúra. Az 1960-as évekig elterjedtebb volt a királis centrumok konfigurációjának kijelölése síkbeli vetületek (Fisher) alapján, nem pedig háromdimenziós 3D képletek alapján, deszkriptorok használatával. DÉsL. Jelenleg D, L– a rendszert korlátozottan használják – főleg olyan természetes vegyületekhez, mint aminosavak, hidroxisavak és szénhidrátok. Alkalmazását szemléltető példák a 10. ábrán láthatók.

Rizs. 10
α – aminosavak esetén a konfigurációt a szimbólum jelzi L, ha a Fischer-vetületi képletben az amino – (vagy ammónium) csoport a bal oldalon található; szimbólum D az ellenkező enantiomerre használjuk. A cukrok esetében a konfiguráció megjelölése a legnagyobb számú OH-csoport orientációján alapul (a karbonilvégtől legtávolabb). Ha az OH csoport jobbra van irányítva, akkor ez egy konfiguráció D; ha a HE a bal oldalon van – konfiguráció L.
A Fischer-rendszer egy időben lehetővé tette számos, aminosavakból és cukrokból származó természetes vegyület logikus és következetes sztereokémiai taxonómiájának létrehozását. Azonban a Fischer-rendszer korlátai, valamint az a tény, hogy 1951-ben úgy tűnt, hogy a röntgendiffrakciós módszer meghatározza a csoportok valódi elrendezését a királis centrum körül, 1966-ban egy új, szigorúbb és következetesebb létrehozásához vezettek. néven ismert rendszer a sztereoizomerek leírására R, S - Kahn-Ingold-Prelog nómenklatúra (KIP). A műszerrendszerben a szokásos kémiai névhez speciális leírókat adnak R vagy S(a szövegben dőlt betűvel), szigorúan és egyértelműen meghatározva az abszolút konfigurációt.
ElnevezéstanCana-Ingolda-Preloga
Fogantyú meghatározásához R vagy S adott királis centrumra az ún kiralitási szabály. Nézzünk négy szubsztituenst, amelyek a királis centrumhoz kapcsolódnak. Ezeket a sztereokémiai prioritások egységes sorrendjében kell elhelyezni; az egyszerűség kedvéért jelöljük ezeket a szubsztituenseket A, B, D és E szimbólumokkal, és vállaljuk fel, hogy az általános elsőbbségi sorrendben (más szóval prioritás szerint) A régebbi B-nél, B régebbi D-nél, D régebbi, mint E(A>B>D>E) . A CIP kiralitási szabálya megköveteli, hogy a modellt a legalacsonyabb prioritású E szubsztituens vagy a sztereokémiailag alsóbbrendű szubsztituens által elfoglalt oldallal ellentétes oldalról vizsgáljuk (11. ábra). Ezután a maradék három szubsztituens valami háromlábú állványt alkot, amelynek lábai a néző felé irányulnak.

Rizs. tizenegy
Ha az A>B>D sorban lévő szubsztituensek szenioritása az óramutató járásával megegyező irányba esik (mint a 11. ábrán), akkor a központhoz konfigurációleírót rendelünk. R ( tól től Latin szó rectus - jobb). Egy másik elrendezésben, amikor a szubsztituensek sztereokémiai prioritása az óramutató járásával ellentétes irányban csökken, a központhoz konfigurációleírót rendelnek. S (latinból baljós - bal).
Ha a kapcsolatokat Fisher vetületekkel ábrázolja, a konfiguráció könnyen meghatározható térmodellek építése nélkül. A képletet úgy kell felírni, hogy a junior szubsztituens alul vagy felül legyen, mivel a Fischer-vetületek ábrázolására vonatkozó szabályok szerint a függőleges kapcsolatok a megfigyelőtől elfelé irányulnak (12. ábra). Ha a fennmaradó szubsztituensek az óramutató járásával megegyező irányban, csökkenő sorrendben vannak elrendezve, a vegyületet a következőképpen osztályozzuk: R)-sor, és ha az óramutató járásával ellentétes irányba, akkor a ( S)-sor, például:

Rizs. 12
Ha a junior csoport nem függőleges összeköttetéseken van, akkor le kell cserélni az alsó csoportra, de ne feledje, hogy ez megfordítja a konfigurációt. Bármely két permutációt elvégezheti a konfiguráció megváltoztatása nélkül.
Így a meghatározó tényező az sztereokémiai elsőbbség . Most beszéljük meg elsőbbségi szabályok, azaz szabályok, amelyek alapján az A, B, D és E csoportok prioritási sorrendbe kerülnek.
A szenioritás szempontjából előnyben részesítik a nagyobb atomokat atomszám. Ha a számok megegyeznek (izotópok esetén), akkor a legnagyobb atomtömegű atom öregszik (például D>H). A legfiatalabb „szubsztituens” egy magányos elektronpár (például nitrogénben). Így a prioritás nő a sorozatban: magányos pár
Vegyünk egy egyszerű példát: a bróm-klór-fluor-metán CHBrCIF-ben (13. ábra) egy sztereogén centrum van, és a két enantiomer a következőképpen különböztethető meg. Először is, a szubsztituenseket sztereokémiai rangjuk szerint rangsorolják: minél nagyobb a rendszám, annál idősebb a szubsztituens. Ezért ebben a példában Br > C1 > F > H, ahol a „>” azt jelenti, hogy „előnyösebb” (vagy „régebbi”). A következő lépés az, hogy a molekulát a legfiatalabb szubsztituenssel, jelen esetben a hidrogénnel szemközti oldalról nézzük. Látható, hogy a maradék három szubsztituens a háromszög sarkaiban helyezkedik el, és a megfigyelő felé irányul. Ha ennek a három szubsztituensnek a szenioritása az óramutató járásával megegyező irányban csökken, akkor ezt az enantiomert a következőképpen jelöljük: R. Egy másik elrendezésben, amikor a szubsztituensek szenioritása az óramutató járásával ellentétes irányban csökken, az enantiomert a következőképpen jelöljük: S. Megnevezések R És S írd dőlt betűvel és zárójelben a szerkezet neve előtt. Így a két vizsgált enantiomer neve ( S)-bróm-klór-fluor-metán és ( R)-bróm-klór-fluor-metán.

Rizs. 13
2. Ha két, három vagy mind a négy egyforma atom közvetlenül kapcsolódik egy aszimmetrikus atomhoz, a szenioritást a második öv atomjai határozzák meg, amelyek már nem a királis centrumhoz kapcsolódnak, hanem azokhoz az atomokhoz, amelyeknek ugyanolyan szenioritásuk volt.

Rizs. 14
Például a 2-bróm-3-metil-1-butanol molekulájában (14. ábra) a legmagasabb és legfiatalabb szubsztituensek könnyen meghatározhatók az első övvel - ezek a bróm és a hidrogén. A CH 2 OH és CH(CH 3) 2 csoportok első atomja alapján azonban nem lehet szenioritást megállapítani, mivel mindkét esetben szénatomról van szó. Annak meghatározásához, hogy melyik csoport a régebbi, ismét a szekvenciaszabályt alkalmazzuk, de most a következő öv atomjait veszik figyelembe. Hasonlítsunk össze két atomhalmazt (két hármast), amelyeket csökkenő prioritási sorrendben írunk fel. A szenioritást most az első pont határozza meg, ahol eltérést találunk. Csoport VAL VEL H 2 OH - oxigén, hidrogén, hidrogén VAL VEL(RÓL RŐL NN) vagy a 6-os számokban( 8 tizenegy). Csoport VAL VEL H(CH 3) 2 – szén, szén, hidrogén VAL VEL(VAL VEL CH) vagy 6( 6 61). A különbség első pontja kiemelendő: az oxigén idősebb a szénnél (atomszámban), így a CH 2 OH csoport idősebb, mint a CH(CH 3) 2. A 14. ábrán látható enantiomer konfigurációját most így jelölhetjük ( R).
Ha egy ilyen eljárás nem vezet egyértelmű hierarchia felépítéséhez, akkor a központi atomtól egyre növekvő távolságban folytatják, míg végül különbségek nem találkoznak, és mind a négy szubsztituens megkapja a rangját. Ebben az esetben az egyik vagy másik helyettes által a szolgálati idő koordinációjának egyik szakaszában megszerzett előnyt véglegesnek tekintik, és a következő szakaszokban nem kell átértékelni.
3. Ha a molekulában vannak elágazási pontok, az atomok szeniorságának megállapítására irányuló eljárást a legmagasabb szenioritású molekulalánc mentén kell folytatni. Tegyük fel, hogy meg kell határoznunk a 15. ábrán látható két szubsztituens prioritási sorrendjét. Nyilvánvaló, hogy sem az első (C), sem a második (C, C, H), sem a harmadik (C, H, F, C, H, Br) rétegben nem sikerül a megoldás. Ebben az esetben a negyedik rétegre kell lépni, de ezt az útvonal mentén kell megtenni, amelynek előnye a harmadik rétegben (Br > F) érvényesül. Ezért a döntés a helyettes elsőbbségéről BAN BEN a helyettes felett A azon az alapon történik, hogy a negyedik rétegben Br >CI annak az ágnak, amelyre az átmenetet a harmadik rétegben lévő szenioritás határozza meg, és nem azon az alapon, hogy az I atom a legmagasabb rendszámú a negyedik rétegben ( amely a kevésbé preferált és ezért nem vizsgált ágon).

Rizs. 15
4. A többszörös kapcsolatokat a megfelelő egyszerű kapcsolatok összegeként ábrázoljuk. Ennek a szabálynak megfelelően minden egyes többszörös kötéssel összekapcsolt atomhoz hozzárendelnek egy további, azonos típusú „fantom” atomot (vagy atomokat), amelyek a többszörös kötés másik végén találhatók. A komplementer (kiegészítő vagy fantom) atomok zárójelben vannak, és úgy tekintjük, hogy a következő rétegben nem hordoznak szubsztituenst.Példaként tekintsük a következő csoportok reprezentációit (16. ábra).
Csoportos bemutató

Rizs. 16
5. A szubsztituensek számának mesterséges növelésére akkor is szükség van, ha a szubsztituens (ligandum) kétfogú (vagy három- vagy négyfogú), illetve ha a szubsztituens ciklikus vagy biciklusos fragmentumot tartalmaz. Ilyenkor a ciklusos szerkezet minden egyes ágát az elágazási pont után vágjuk el [ahol magába kettéágazik], és az elágazásponti atomot (zárójelben) a vágásból származó lánc végére helyezzük. A 17. ábrán egy tetrahidrofurán (THF) származék példáján a kétfogú (gyűrűs) szubsztituens esetét vizsgáljuk. Az öttagú gyűrű két karját (egyenként) egy királis atommal kötik el, amely azután a két újonnan képződött lánc mindegyikének végére kerül. Látható, hogy a boncolás eredményeként A egy hipotetikus -CH 2 OCH 2 CH 2 -(C) szubsztituenst kapunk, amely a valódi -CH 2 OCH 2 CH 3 aciklusos szubsztituensnél idősebbnek bizonyul, mivel a fantom (C) a végén található. első szubsztituens. Éppen ellenkezőleg, a boncolás eredményeként alakult ki BAN BEN a hipotetikus –CH 2 CH 2 OCH 2 – (C) ligandum idősebbnek bizonyul, mint a valódi –CH 2 CH 2 OCH 2 CH 3 szubsztituens, mivel az utóbbi három hidrogénatomot tartalmaz a terminális szénhez, míg a előbbinek nincs ebben a rétegben. Következésképpen, figyelembe véve a szubsztituensek meghatározott sorrendjét, egy adott enantiomer konfigurációs szimbóluma S.
Határozza meg a szolgálati időt helyettes A
BAN BEN>A
helyettes A

17. ábra

Rizs. 18
Egy ciklusos szubsztituens levágásának hasonló esetét szemléltetjük az 1. ábrán látható vegyület példájával. 18 ahol szerkezet BAN BEN szemlélteti a ciklohexilgyűrű értelmezését (a szerkezetben A). Ebben az esetben a helyes prioritási sorrend két n-hesilmetil > ciklohexil > di- n-pentilmetil > N.
Most kellőképpen felkészültünk arra, hogy egy ilyen szubsztituenst fenilnek tekintsünk (19. ábra szerkezet). A). Fentebb tárgyaltuk az egyes többszörös kapcsolatok megnyitásának sémáját. Mivel (bármely Kekule szerkezetben) mind a hat szénatom kettős kötéssel kapcsolódik egy másik szénatomhoz, így (a KIP rendszerben) a gyűrű minden szénatomja egy további szénatomot hordoz „szubsztituensként”. Az így kiegészített gyűrű (19. ábra, szerkezet BAN BEN) ezután kibővül a ciklikus rendszerekre vonatkozó szabályok szerint. Ennek eredményeként a boncolást a 19. ábrán látható diagram, a szerkezet írja le VAL VEL.

Rizs. 19
6. Most olyan királis vegyületeket fogunk megvizsgálni, amelyekben a szubsztituensek közötti különbségek nem anyagi vagy szerkezeti jellegűek, hanem konfigurációbeli különbségekre redukálódnak. Az egynél több királis centrumot tartalmazó vegyületeket az alábbiakban tárgyaljuk (lásd az 1.4 fejezetet) Itt érintjük azokat a szubsztituenseket, amelyek különböznek egymástól cisz-transz– izoméria (olefin típusú). Prelog és Helmchen szerint az olefin ligandum, amelyben a vezető szubsztituens található ugyanazon az oldalon az olefin kettős kötéséből, amely a királis centrum, előnyben van ahhoz a ligandumhoz képest, amelyben a vezető szubsztituens található. transz-pozíció a királis központ felé. Ennek az álláspontnak semmi köze a klasszikushoz cisz-transz-, sem E–Z–nómenklatúra a kettős kötés konfigurációjához. A példákat a 20. ábra mutatja.

Rizs. 20
Több királis centrumot tartalmazó vegyületek
Ha egy molekulának két királis centruma van, akkor mindegyik centrumnak lehet (R)- vagy ( S)-konfiguráció esetén négy izomer létezése lehetséges - R.R., SS, R.S. És S.R.:

Rizs. 21
Mivel a molekulának csak egy tükörképe van, a vegyület enantiomerje az (R.R.) csak izomer lehet (SS). Hasonlóképpen egy másik enantiomerpár izomereket képez (R.S.) És (S.R.). Ha csak egy aszimmetrikus centrum konfigurációja változik, akkor az ilyen izomereket nevezzük diasztereomerek. A diasztereomerek sztereoizomerek, amelyek nem enantiomerek. Tehát diasztereomer párok (R.R.)/(R.S.), (R.R.)/(S.R.), (SS)/(R.S.) És (SS)/(S.R.). Bár általában két királis centrum kombinációja négy izomert eredményez, az azonos kémiai szerkezetű centrumok kombinációja csak három izomert eredményez: (R.R.) És (SS), enantiomerek lévén, és (R.S.), mindkét enantiomerre diasztereomer (R.R.) És (SS). Tipikus példa erre a borkősav (22. ábra), amelynek mindössze három izomerje van: egy pár enantiomer ill. mezo forma.

Rizs. 22
mezo-Bor sav az (R, S) izomer, amely optikailag inaktív, mivel két tükörszimmetrikus fragmentum kombinációja szimmetriasík megjelenéséhez vezet (a). mezo-Bor A sav egy példa a mezokonfigurációjú akirális vegyületre, amely azonos számú, szerkezetében azonos, de abszolút konfigurációban eltérő királis elemből épül fel.
Ha a molekulának van P királis centrumok, a sztereoizomerek maximális száma a 2. képlet segítségével számítható ki n; azonban néha az izomerek száma kevesebb lesz a mezoformák jelenléte miatt.
A két aszimmetrikus szénatomot tartalmazó molekulák sztereoizomereinek nevéhez, amelyek mindegyikén két szubsztituens azonos, a harmadik pedig különböző, gyakran használnak előtagokat. eritro-És trió- az erythrose és a treose cukrok nevéből. Ezek az előtagok a rendszer egészét jellemzik, nem pedig minden királis centrumot külön-külön. Az ilyen összefüggések Fischer-vetületek páros ábrázolásakor eritro- izomerek, ugyanazok a csoportok helyezkednek el az egyik oldalon, és ha a különböző csoportok (az alábbi példában C1 és Br) azonosak lennének, akkor a mezo formát kapnánk. Párosítva ezzel három- izomerek, ugyanazok a csoportok különböző oldalon helyezkednek el, és ha a különböző csoportok azonosak lennének, az új pár enantiomerpár maradna.

Rizs. 23
A fent tárgyalt vegyületek összes példája rendelkezik kiralitási központtal. Ilyen centrum egy aszimmetrikus szénatom. Azonban más atomok (szilícium, foszfor, kén) is lehetnek a kiralitás központja, mint például a metil-naftil-fenil-szilánban, az o-anizil-metil-fenil-foszfinban, a metil-p-tolil-szulfoxidban (24. ábra).

Rizs. 24
Királis centrumokat nem tartalmazó molekulák kiralitása
Egy molekula kiralitásának szükséges és elégséges feltétele a tükörképével való összeférhetetlensége. Egyetlen (konfigurációslag stabil) királis centrum jelenléte egy molekulában elegendő, de egyáltalán nem szükséges feltétele a kiralitás létezésének. Tekintsük azokat a királis molekulákat, amelyekben nincs királis centrum. Néhány példa a 25. és 26. ábrán látható.

Rizs. 25

Rizs. 26
Ezek kiralitási tengelyekkel rendelkező vegyületek ( axiális típusú kiralitás): allének; alkilidén-cikloalkánok; spiránok; úgynevezett atropoizomerek (bifenilek és hasonló vegyületek, amelyek kiralitása az egyes kötések körüli akadályozott forgás következtében jön létre). A kiralitás másik eleme a kiralitási sík ( síkbeli kiralitás). Ilyen vegyületek például az ansa vegyületek (amelyekben az aliciklusos gyűrű túl kicsi ahhoz, hogy az aromás gyűrű átforogjon); paraciklofánok; metallocének. Végül egy molekula kiralitása összefüggésbe hozható a molekulaszerkezet spirális szerveződésével. A molekula bal- vagy jobbkezes hélixbe burkolódhat be. Ebben az esetben helicitásról (a kiralitás spirális típusáról) beszélünk.
Annak érdekében, hogy meghatározzuk egy olyan molekula konfigurációját, amelynek kiralitási tengely, szükséges egy további pontot bevinni a sorrendszabályba: a megfigyelőhöz legközelebb eső csoportokat idősebbnek tekintjük, mint a megfigyelőtől távol eső csoportokat. Ezt a kiegészítést meg kell tenni, mivel axiális kiralitású molekulák esetén a tengely ellentétes végein azonos szubsztituensek jelenléte elfogadható. Ennek a szabálynak az alkalmazása az ábrán látható molekulákra. ábrán látható 25. 27.

Rizs. 27
A molekulákat minden esetben a bal oldali királis tengely mentén nézzük. Meg kell érteni, hogy ha a molekulákat a jobb oldalon tekintjük, akkor a konfigurációs leíró változatlan marad. Így a négy tartócsoport térbeli elrendezése megfelel a virtuális tetraéder csúcsainak, és a megfelelő vetületek segítségével ábrázolható (27. ábra). A megfelelő leíró meghatározásához standard szabályokat használunk R, S- elnevezéstan. A bifenilek esetében fontos megjegyezni, hogy a gyűrűben lévő szubsztituenseket a központtól (amelyen keresztül a királis tengely áthalad) a perifériáig tekintjük, megsértve a szabványos szekvenciaszabályokat. Tehát a bifenil esetében az ábrán. 25 szubsztituensek helyes sorrendje a jobb gyűrűben C-OSH 3 >C-H; a klóratom túl távoli ahhoz, hogy figyelembe lehessen venni. A hordozó atomok (azok, amelyek a konfigurációs szimbólumot meghatározzák) azonosnak bizonyulnak, ha a molekulát jobbról nézzük. Néha leírókat használnak az axiális kiralitás megkülönböztetésére más típusoktól aRÉs mint (vagy R aÉs S a), azonban a " előtag használata a» nem kötelező.
Alternatív megoldásként a kiralitási tengelyekkel rendelkező molekulákat spirálisnak tekinthetjük, és konfigurációjukat szimbólumokkal jelölhetjük RÉs M. Ebben az esetben a konfiguráció meghatározásához csak a legmagasabb prioritású szubsztituenseket veszik figyelembe a szerkezet elülső és hátsó (a megfigyelőtől távoli) részében (a 27. ábrán az 1. és 3. szubsztituensek). Ha a legmagasabb prioritású első 1. helyettesről a 3. elsőbbséget élvező hátsó helyettesre az óramutató járásával megegyező irányban történik az átmenet, akkor ez a konfiguráció R; az óramutató járásával ellentétes irányban ez a konfiguráció M.
ábrán. A 26. ábra olyan molekulákat mutat be a kiralitás síkjai. A királis sík meghatározása nem olyan egyszerű és egyértelmű, mint a kiralitás középpontjának és tengelyének meghatározása. Ez egy olyan sík, amely a molekula lehető legtöbb atomját tartalmazza, de nem az összeset. Valójában a kiralitás azért következik be, mert (és csak azért), mert legalább egy szubsztituens (általában több) nem esik a kiralitás síkjába. Így az ansa-vegyület királis síkja A a benzolgyűrű síkja. Paraciklofánban BAN BEN a leginkább helyettesített (alsó) gyűrűt királis síknak tekintjük. A síkbeli királis molekulák leírójának meghatározásához egy síkot az atom síkjához legközelebb eső oldaláról nézünk, de nem a síkban (ha kettő vagy több jelölt van, akkor a legmagasabb prioritású atomhoz legközelebb esőt választjuk a sorrendi szabályok szerint ). Ezt az atomot, amelyet néha teszt- vagy pilotatomnak is neveznek, nyíl jelzi a 26. ábrán. Ekkor, ha három egymást követő legmagasabb prioritású atom (a, b, c) szaggatott vonalat alkot a királis síkban, az óramutató járásával megegyező irányba hajolva, akkor a vegyület konfigurációja pR (vagy R p), és ha a vonallánc az óramutató járásával ellentétes irányba hajlik, akkor a konfigurációleíró pS(vagy S p). A síkbeli kiralitás, az axiális kiralitáshoz hasonlóan, a kiralitás egy típusának tekinthető. A hélix irányának (konfigurációjának) meghatározásához figyelembe kell venni a pilot atomot az a, b és c atomokkal együtt, a fent meghatározottak szerint. Ebből egyértelmű, hogy pR- kapcsolatok megfelelnek R-, A pS- kapcsolatok – M– helicitás.
A szerkezeti izomerek mellett az alkánok sorozatában vannak térbeli izomerek is. Ezt példaként 3-metil-hexánnal szemléltethetjük.
A C*-nak nevezett szénatom négy különböző csoporthoz kapcsolódik. Ebben a szénhidrogénben az atomok azonos kötési sorrendjével az alkilcsoportok eltérően helyezkedhetnek el a C* szénatom körüli térben. A térbeli izomerek síkon történő ábrázolására többféleképpen is lehetőség van (6.1., 6.2. ábra).
Rizs. 6.1. Háromdimenziós kép „ékek” használatával
Rizs. 6.2. Fischer vetületi képletek
A 6.2. ábrán a C* szénatom középen, a vízszintes vonal a C* szén és a képsík előtt kiálló csoportok közötti kötést, a függőleges vonal pedig a C* atom és a mögötte lévő csoportok közötti kötést jelöli. a képsík. A Fischer-vetületek csak a rajzsíkban forgathatók el és csak 180°-kal, de nem 90°-kal vagy 270°-kal. Ezek a képletek két különböző vegyületet jelentenek. Ugyanúgy különböznek egymástól, mint egy tárgy és annak tükörképe, vagy mint egy bal és jobb kéz. A bal és a jobb kéz két nagyon hasonló tárgy, de lehetetlen kombinálni őket (nem lehet a bal kesztyűt a jobb kézre tenni), ami azt jelenti, hogy két különböző tárgyról van szó.
Két vegyületet: egy tárgyat és tükörképét (I és II), amelyek egymással nem kompatibilisek, enantiomereknek nevezik (a görög „enantio” szóból - ellenkezőleg).
A vegyület azon tulajdonságát, hogy enantiomerek formájában létezik, kiralitásnak nevezik (a görög „chiros” szóból), magát a vegyületet pedig királisnak.
A 3-metil-hexán molekulának nincs szimmetriasíkja, ezért enantiomerek formájában létezhet (lásd 6.1. ábra).
Egy molekulának van kiralitása, ha nincs szimmetriasíkja. Számos olyan szerkezeti elem létezik, amelyek miatt egy molekula nem azonos a tükörképével. Ezek közül a legfontosabb a királis szénatom.
A királis atom vagy királis centrum egy szénatom, amely négy különböző csoporthoz kapcsolódik, és C*-nak jelöljük.
Annak a molekulának, amelyben a szénatomon két vagy több azonos csoport van, szimmetriasíkja van, ezért nincs kiralitása, mivel a molekula és tükörképe azonos. Az ilyen molekulákat ún akirális .
Például az izopentán nem létezhet enantiomerként, és nincs kiralitása.
Az enantiomerek egy kivételével ugyanazokat a fizikai tulajdonságokat mutatják. Például a 2-bróm-bután molekula két enantiomerként létezik. Forráspontjuk, olvadáspontjuk, sűrűségük, oldhatóságuk és törésmutatójuk azonos. Az egyik enantiomert a síkpolarizált fény forgása alapján lehet megkülönböztetni a másiktól. Az enantiomerek a polarizált fény síkját azonos szögben forgatják, de különböző irányokba: az egyik - az óramutató járásával megegyező, a másik - azonos szöggel, de az óramutató járásával ellentétes irányba.
Az enantiomerek azonos kémiai tulajdonságokkal rendelkeznek, és a kiralitást nem ismerő reagensekkel való kölcsönhatásuk sebessége azonos. Optikailag aktív reagenssel végzett reakció esetén az enantiomerek reakciósebessége eltérő. Néha annyira különböznek egymástól, hogy egy adott reagens reakciója az egyik enantiomerrel egyáltalán nem megy végbe.
Számos, az élethez fontos és szükséges molekula kétféle formában létezik. Ez a két alakzat királis, mert képeik egy ideális síktükörben nem rakhatók egymásra. Úgy viszonyulnak egymáshoz, mint a bal és a jobb kéz. Ezért hívják ezt az ingatlant kiralitás(a görög cheir szóból - kéz).
A molekulák két formáját ún enantiomerek vagy optikai izomerek. Az enantiomerek a kiralitás ellentétes értelmével rendelkeznek, azaz. az ellenkező konfiguráció. Az egyik enantiomer a síkpolarizált fény polarizációs síkját jobbra, a másik enantiomer pedig pontosan ugyanilyen szögben balra forgatja.
Egy kristály vagy molekula kiralitását az határozza meg szimmetria. Molekula akirális (nem királis), akkor és csak akkor, ha van nem megfelelő forgástengely, azaz az n-szeres elforgatás (360°/n-es elforgatás), majd ezt a tengelyre merőleges síkban való visszaverődés visszaveri a molekulát önmagára. Tehát a molekula királis, ha nincs ilyen tengelye, pl. ha az azonosságtranszformáción kívül nincs más szimmetriaművelet, amely a molekulát önmagára tükrözné. Mivel a királis molekulák nem rendelkeznek ilyen szimmetriával, ezért ún aszimmetrikus. Nem feltétlenül aszimmetrikusak (azaz szimmetria nélküliek), mivel lehetnek más típusaik is szimmetria. Azonban minden aminosav (a glicin kivételével) és sok cukor valóban aszimmetrikus és diszszimmetrikus.
Kiralitás és élet
Szinte minden biológiai polimernek homokirálisnak kell lennie ahhoz, hogy működjön (minden monomerük azonos irányú. Egy másik használt kifejezés az optikailag tiszta vagy 100%-os optikailag aktív). A fehérjékben található összes aminosav balkezes, míg a DNS-ben, RNS-ben és az anyagcsereútvonalakban lévő összes cukor jobbkezes.
Az 50%-ban jobbos és 50%-ban baloldali formákból álló keveréket ún racemát vagy racém keverék. A racém polipeptidek nem tudják kialakítani az enzimek által megkívánt speciális formákat, mivel oldalláncaik véletlenszerűen kilógnak. Ezenkívül egy nem megfelelő kiralitású aminosav tönkreteszi a stabilizáló α-hélixet a fehérjékben. A DNS nem lehet stabil helikális formában, ha csak egyetlen monomer is hibás kiralitású - lehetetlen lenne hosszú láncokat alkotni. Ez azt jelenti, hogy a DNS nem lenne képes sok információt tárolni és életet fenntartani.
A hagyományos kémia racemátokat termel
Egy elismert szerves kémia tankönyv bátran kimondja az egyetemes kémiai szabályt:
"A királis vegyületek akirális reagensekből történő szintézise mindig racém módosulást eredményez."
"Az optikai inaktív reagensek optikailag inaktív termékeket termelnek"Ez a termodinamika törvényeinek következménye. A jobb- és balkezes alakzatok szabadenergiája (G) azonos, így a szabadenergia-különbség (ΔG) nulla. A kémiai egyensúlyi állandó (K) egy olyan mennyiség, amely kifejezi a rendszerben lévő anyagok koncentrációinak kölcsönös függőségét a kémiai egyensúly elérésekor. Bármely reakció egyensúlyi állandója (K) a termékek koncentrációjának a hatóanyaghoz viszonyított egyensúlyi aránya. A két elem közötti reakciót bármely Kelvin-hőmérsékleten (T) a standard képlettel ábrázoljuk:
K = exp (–ΔG/RT)
ahol R az abszolút gázállandó (=Avogadro-szám* Boltzmann-állandó k) = 8,314 J/K.mol
A "balkezes" aminosavakat "jobbkezesre" (L →R) vagy fordítva (R →L) megváltoztató reakció esetén ΔG = 0, tehát K = 1. Így a reakció akkor ér el egyensúlyt, amikor a koncentráció A "balkezes" és a "jobb" molekulaformák azonosak, azaz. racemát keletkezik. Ez magyarázza a fenti tankönyvszabályt.
A bal oldali formák elkülönítése a jobb oldaliaktól
A racemát rezolválásához (vagyis a két enantiomer szétválasztásához) egy másik homokirális anyagot kell bevinni. Az eljárást egy szerves kémia tankönyv ismerteti. Az ötlet az, hogy egy anyag "balkezes" és "jobbkezes" formái ugyanazokkal a tulajdonságokkal rendelkeznek, kivéve, ha királis jelenségekkel foglalkoznak. Egy hasonlat: bal és jobb kezünk ugyanazt az akirális tárgyat fogja meg, például egy baseballütőt, de másképpen illeszkedik a királis tárgyakhoz, például a bal kéz kesztyűjéhez. Így a racemát megoldásához a vegyész általában élő szervezetekből származó, kész homokirális anyagot használ. Az R és L enantiomerek reakciótermékei a kizárólag jobboldali R´ fajjal, azaz R-R´ és L-R´ (úgynevezett diasztereoizomerekkel) nem egymás tükörképei. Így eltérő fizikai tulajdonságokkal rendelkeznek, mint például vízben való oldhatóságuk, ami azt jelenti, hogy szétválaszthatók.
Ez azonban nem oldja meg az élő szervezetek optikai aktivitásának eredeti eredetének rejtélyét. Legutóbbi nemzetközi konferencia "A homokiralitás és az élet eredete" világosan megmutatta, hogy ennek a kiralitásnak az eredete teljes rejtély az evolucionisták számára. Egy homokirális polimer véletlenszerű kialakulásának valószínűsége N monomerből 2 –N. Egy kis, 100 aminosavból álló fehérje esetében ez a valószínűség = 2–100 = 10–30. Megjegyezzük, hogy ez bármely homokirális polipeptid kialakulásának valószínűsége. A funkcionális homokirális polimer kialakulásának valószínűsége rendkívül kicsi, mivel sok helyen szükség van az aminosavak pontos sorrendjére. Természetesen sok homokirális polimer szükséges az élethez, ezért a valószínűségeket meg kell szorozni. A véletlen tehát nem alternatíva.
Egy másik probléma, hogy a homokirális biológiai anyagok idővel racemizálódnak. Ez az aminosav racemizációs kormeghatározási módszer alapja. Kormeghatározási módszerként nem túl megbízható, mivel a racemizáció mértéke nagymértékben függ a hőmérséklettől és a pH-tól, valamint az aminosav típusától. A racemizáció a peptidszintézisben és a hidrolízisben is óriási probléma. Ez azt mutatja, hogy az élettelen kémia a halál felé irányul, nem az élet felé.
A talidomid tragikusan emlékeztet a kiralitás fontosságára. Az 1960-as évek elején ezt a gyógyszert olyan terhes nőknek írták fel, akik reggeli rosszulléttől és hányástól szenvedtek. Míg azonban a balkezes forma erős nyugtató, a jobbkezes forma megzavarhatja a magzat fejlődését, ami súlyos születési rendellenességeket okozhat. Sajnos a gyógyszerszintézis a vártnak megfelelően racemátot eredményezett, és a helytelen enantimomert nem távolították el a gyógyszer forgalomba hozatala előtt.
Saját kémia oktatásom során az egyik szükséges kísérlet ezeket a fogalmakat demonstrálta. A 3+ 9 diszszimmetrikus komplex iont akirális reagensekből szintetizáltuk, így racemát keletkezett. Növényi eredetű homokirális savval végzett reakcióval rezolváltuk, így diasztereoizomereket képeztünk, amelyek frakcionált kristályosítással rezolválhatók. Amikor a keletkezett homokirális kristályok feloldódtak és oldott aktív szenet (katalizátort) adtunk hozzá, az anyag gyorsan racemizálódott, mivel a katalizátor felgyorsította az egyensúly létrejöttét.
Az élet eredetével foglalkozó kutatók más eszközöket próbáltak kidolgozni a szükséges homokiralitás elérésére. Sikertelen kísérletek történtek a racemátok más módszerekkel történő megoldására.
Cirkulárisan polarizált ultraibolya fény
A körkörösen polarizált fényben az elektromos tér iránya a nyaláb mentén forog, tehát ez királis jelenséget jelent. A homokirális anyagok eltérő abszorpciós intenzitással rendelkeznek a bal és a jobb CP fényben – ezt nevezik cirkuláris dikroizmus (CD). Hasonlóképpen, a CP fényt a bal- és jobbkezes enantiomerek eltérően nyelték el. Mivel a fotolízis (fénypusztulás) csak akkor megy végbe, amikor a fény fotonjai elnyelődnek, a CP fény az egyik enantiomert gyorsabban és könnyebben elpusztítja, mint a másikat. Mivel azonban a fény a "helyes" formát is tönkreteszi bizonyos mértékig, ez nem eredményezné az élethez szükséges 100%-os homokiralitást. Az egyik legjobb eredmény az volt, hogy 20%-os optikai tisztaságú kámfort kaptunk, de ez azután következett be, hogy a kiindulási anyag 99%-a megsemmisült. 35,5%-os optikai tisztaság jönne ki 99,99%-os megsemmisítés után. "Majdnem optikailag tiszta keverék (99,99%) ... az aszimptotikus ponton, ahol egyáltalán nem marad anyag."
További probléma, hogy a CD nagysága és előjele (azaz a bal- vagy jobbkezes alakzatok előnyben részesítése) a CP fény frekvenciájától függ, ami azt jelenti, hogy a felbontás csak szűk frekvenciasávon érhető el CP fénnyel. Széles sávban az enantioszelektív hatások elpusztítják.
A közelmúltban a cirkulárisan polarizált fény ötletét a kiralitás problémájának megoldásaként elevenítette fel Jeremy Bailey ausztrál csillagász 2008-ban megjelent cikkében. Tudomány, és nyilvánosságot kapott a médiában. Csapata körkörösen polarizált infravörös sugárzást észlelt a ködben. A cikkben egyetértenek abban, hogy nem találták sem a szükséges cirkulárisan polarizált ultraibolya fényt, sem bizonyítékot arra, hogy a ködben aminosavak képződnek. Tisztában vannak a CP fény rendkívül korlátozott enantioszelektivitásával és azzal is, hogy a hatás a teljes spektrumban nulla. A kémiai evolúcióba vetett hitük azonban befolyásolja az adatok értelmezését.
Nem minden evolucionistát győz meg Bailey csapatának javaslata. Például Jeffrey Bada azt mondta: – Ez csak a „talán” nevű lépések sorozata. Számomra talán ettől lesz az egész összkép nagy."
Egy másik javasolt cirkulárisan polarizált fényforrás egy neutroncsillag szinkrotron, de ez csak spekuláció, és nem oldja meg a kémiai problémákat.
Béta-bomlás és a gyenge nukleáris erő ereje
A béta-bomlás a radioaktív bomlás egyik formája, és a természetben található négy alapvető erő egyike – a gyenge nukleáris erő ereje – irányítja. Ennek az erőnek van egy kis kiralitása, amelyet paritásmegmaradásnak neveznek, ezért egyes teoretikusok úgy gondolták, hogy a β-bomlás felelős lehet az élő szervezetek kiralitásáért. A gyenge nukleáris erő erejét azonban megfelelően nevezik el - a hatás nagyon kicsi -, nagyon messze van attól, hogy a szükséges 100%-os homokiralitást hozza létre. A kiralitás egyik szakértője, William Bonnet szerves vegyész, a Standfosse Egyetem emeritus professzora elmondta: „E tanulmányok egyike sem adott meggyőző következtetéseket”. Egy másik kutató arra a következtetésre jutott:
„a szükséges rendkívüli prebiológiai körülmények nem támasztják alá a β-radiolízis gondolatát, mint az élő természetben az optikai aktivitás tulajdonságainak szelekciós tényezőjét”
A paritás meg nem őrzésének másik szempontja, hogy az L-aminosavak és D-cukrok elméleti energiája valamivel alacsonyabb, mint enantiomerjeik. De az energiakülönbség mérhetetlen - csak körülbelül 10-17 kT. Ez azt jelenti, hogy a racém aminosav keverék minden 6x10 17 molekulájára csak egy L-enantiomer felesleg lesz!
Optikailag aktív kvarcporok
A kvarc egy széles körben elterjedt ásvány, és a szilícium-dioxid (SiO 2) legelterjedtebb formája a Földön. Kristályai hatszögletűek és aszimmetrikusak. Egyes kutatók megpróbáltak optikailag aktív kvarcporokat használni, hogy az egyik enantiomerből többet szívjanak fel, mint a másikat. De próbálkozásaik nem jártak sikerrel. Ezenkívül egyenlő számú jobb- és balkezes kvarckristály található a Földön.
Önkiválasztás
Egyes királis anyagok homokirális kristályokká kristályosodnak. Louis Pasteur nemcsak a betegség csíraelméletének megalapítója volt, hanem az élet "spontán nemzedék" eszméjének megsemmisítője és kreacionista is. Ő volt az első ember a történelemben, aki megoldotta a versenytársat. Egy ilyen anyag, a nátrium-aluminát-tartarát bal és jobb oldali kristályait csipesszel választotta el.
Ez a megosztottság egy intelligens kutató külső beavatkozása miatt következett be, aki képes volt felismerni a különböző mintákat. Az állítólagos primitív Földön nem volt ilyen felfedező. Ezért a két forma, még ha véletlenül el is válna egymástól, újra feloldódna és újra racemátot alkotna.
Pasteurnek is szerencséje volt, hogy azon kevés anyagok egyikét választotta, amely magától szétesik kristályos formává. És ez az anyag is csak 23°C alatti hőmérsékleten rendelkezik ezzel a tulajdonsággal, így még szerencse, hogy a 19. századi laboratóriumokat nem fűtötték túl jól!
Sikeres alapozás
Egyes teoretikusok azt javasolták, hogy a homokirális kristályokkal túltelített oldat sikeres beoltása ugyanazt az enantiomert kristályosítaná ki. Azonban az "ősleves", ha létezne, rendkívül híg és erősen szennyezett lenne, amint azt sok kutató megjegyezte. A növekvő homokirális kristályokkal sem lehetett mit kezdeni, mivel az a megmaradt hibás enantiomer oldatába merülne. Az oldat betöményítésekor a nem megfelelő enantiomer kristályosodik ki. Az oldat hígítása feloldaná a kristályt, így a tervezett folyamatot elölről kell kezdeni.
Homokirális minta
Egyes kutatók azt javasolták, hogy a homokirális polimer véletlenül keletkezett, és sablonként szolgált. Ez a feltételezés azonban komoly problémákkal küzd. 100%-ban jobbkezes policitidilsavból (csak citozin monomereket tartalmazó RNS) szintetizáltak (okos vegyészek!). Ez irányíthatja az oligomerizációt (kis láncok képződését) (aktivált) G (guanin) nukleotidokból. Valójában a tiszta jobbkezes G-k sokkal hatékonyabban oligomerizálódnak, mint a tiszta balkezes G-k. A racém G-k azonban nem oligomerizálódtak, mert:
"ellentétes kiralitású monomerek láncdugóként épülnek be a sablonba... Ez az elnyomás komoly problémát jelent az élet keletkezésének számos elmélete számára"
A tRNS-ek kiválasztották a megfelelő enantiomereket
A kiralitás problémájának megoldására Russell Doolittle, a San Diego-i Kaliforniai Egyetem biokémia professzora tett egy kísérletet. Állította: "[tRNS-szintáz] létezésének kezdetétől fogva valószínűleg csak L-aminosavakat kötöttek" Soha nem magyarázza el, hogyan működhetnének az ilyen összetett enzimek, ha nem lennének homokirálisak, vagy hogyan működtek azelőtt, hogy az RNS homokirális ribózból épült volna fel. Dolittle „megoldása” nem más, mint a probléma elvetése. Aligha érdemelné meg a cáfolat, ha nem jelent meg egy ismert teremtésellenes könyvben, amely mond valamit a szerkesztésük minőségéről vagy a teremtésellenes érvek minőségéről.
Úgy tűnik, hogy Dolittle a teremtés/evolúció témájában folytatott korábbi televíziós vitáját próbálta megmagyarázni Duane Gish biokémikussal, amely 5000 ember előtt zajlott a Liberty Egyetemen 1981. október 13-án. Pro-Evolution Magazine Tudomány a vitát Gish javára "kudarcnak" minősítette. Másnap evolúciópárti washingtoni posta„A tudomány egy nullát veszít a kreacionizmussal szemben” címmel számolt be a vitáról. A cikk idézte Dolittle-t, aki azt mondta: "Hogyan ismerkedjek meg a feleségemmel?", ami arra utal, hogy Dolittle maga is tudta, hogy kudarcot vallott.
Mágneses mezők
Számos német kémikus Edhard Brameier vezetésével a bonni Szerves Kémiai és Biokémiai Intézetből arról számolt be, hogy egy nagyon erős mágneses mező (1,2–2,1 T) 98%-ban homokirális termékeket állít elő az akirális reagensekből. Ez lehetővé tette a kémikusoknak, például Philip Kosienskinek, a Southamptoni Egyetemről, hogy feltételezzék, hogy a Föld mágneses tere homokiralitást okozhat az életben. Bár a Föld mágneses tere csaknem 10 000-szer gyengébb, mint a kísérletben használt, Kosienski feltételezte, hogy a rengeteg idő a ma tapasztalt homokiralitáshoz vezetett volna. Valószínűleg megfeledkezett a paleomágneses tér megfordításáról!
Más vegyészek, például Tony Barrett, az Imperial College London munkatársa úgy vélte, a német kísérlet „túl szépnek tűnt, hogy igaz legyen”. Ez az óvatosság körülbelül hat héttel ezelőtt kifizetődött. Senki más nem tudta reprodukálni a német csapat eredményeit. Kiderült, hogy a munkacsoport egyik kutatója, Guido Zadel, akinek disszertációja a munka alapjául szolgált, homokirális adalékanyaggal keverte össze a reagenseket.
[Magnetokirális dikroizmus – postscript]
Következtetés
A korábban idézett tankönyv ezt írja:
„Optikailag aktív kenyeret és húst eszünk, házakban élünk, ruhát hordunk és optikailag aktív cellulózból készült könyveket olvasunk. Az izmainkat felépítő fehérjék, a májunkban és a vérünkben lévő glikogén, az enzimek és a hormonok... mind optikailag aktívak. A természetes anyagok optikailag aktívak, mivel az őket alkotó enzimek ... optikailag aktívak. Ami az optikailag aktív enzimek eredetét illeti, csak találgathatunk."
Ha az élet eredetéről csak "spekulálni" tudunk, miért mondják olyan sokan, hogy az evolúció "tény"? Ismételje elég gyakran a pletykát, és az emberek megeszik.
Linkek és jegyzetek
Az élettelen anyagból az élő anyagba való átmenet nyilvánvalóan azután következett be, hogy két alapvető életrendszer kezdetei keletkeztek és fejlődtek ki elődeik alapján: anyagcsere rendszerekÉs rendszerek az élő sejt anyagi bázisának reprodukálására. A modern szervezetekben mindkét életrendszer elérte a tökéletesség legmagasabb szintjét.
Az anyagcsere célja- fenntartani az élő szervezet egyensúlyi állapotát. Ezt a meglehetősen összetett feladatot olyan anyagok kiválasztásával oldják meg, amelyekből a szervezet számára szükséges vegyületek szintetizálódnak. Másrészt ez a rendszer eltávolítja a szervezetből mindazt, amit nem tud felvenni, vagy ami a létfontosságú folyamatok hulladékaként jelenik meg. Az anyagcsere-rendszer biztosítja a fehérjeszintézis és -lebontás kölcsönösen összehangolt biokémiai reakcióit.
Lejátszási rendszer kódolt formában teljes információt tartalmaz az éppen szükséges fehérje megalkotásához a sejtben tárolt szerves anyagokból. A programinformációk kinyerésének és megvalósításának mechanizmusát is vezérli. A reprodukciós rendszer polimer vegyületeken - polinukleotidokon keresztül látja el funkcióit. Itt a dezoxiribonukleinsav (DNS) és a ribonukleinsav (RNS) játszik kulcsszerepet. A DNS tárolja a genetikai információkat, az RNS pedig reprodukálja, és a fehérjeszintézishez szükséges kiindulási anyagokat tartalmazó tápközegbe továbbítja.
Az utóbbi időben némi előrelépés történt az alapvető életrendszerek működési mechanizmusainak tanulmányozásában. De még mindig senki sem tudja, hogyan jelent meg ez a két rendszer.
Ezen túlmenően az élő és az élettelen anyag fizikai tulajdonságai között még megmagyarázhatatlan különbség mutatkozik, ami az élet Földön való megjelenési folyamatának sajátosságait tükrözi. Az élet által generált szerves vegyületek megkülönböztető jellemzője az optikai aktivitásuk - az a képesség, hogy a rajtuk áthaladó fény polarizációs síkját egy irányba - balra vagy jobbra forgatják, az adott vegyület típusától függően. Így a szárazföldi élőlények minden fehérjemolekulája balra fordítja az áteresztett fény polarizációs síkját, ami a bal oldali térbeli konfigurációjukat jelzi (L-konfiguráció), a DNS és RNS nukleinsav molekulái pedig csak jobbra fordulnak, azaz jobbkezes vagy D-konfigurációjúak. Ugyanakkor a hasonló kémiai összetételű élettelen anyag egy olyan keverék, amelyben egyformán valószínű mindkét konfigurációjú molekulatartalom, így a rajtuk áthaladó fény polarizációs síkjának elfordulása nem következik be. Feltételezhető, hogy az élő szervezetek szerves vegyületeinek optikai aktivitása közvetlenül összefügg az élet eredetével.
A két lehetséges térszerkezet közül csak az egyik életével kapcsolatos folyamatokban a szerves molekulák megőrzését ún. kiralitás, és a megfelelő molekulák királis. Mindkét térbeli konfigurációjú szerves molekulák kaotikus keverékét nevezzük racemát, amely szerves molekulák abiogén szintézise során jön létre. Kétségtelenül a Földön a szerves vegyületek kialakulásának élet előtti időszakában csak a racemát keletkezett. A szerves vegyületekben való életre való átmenet során a molekulák hirtelen szétválogatása következett be, és megjelent a kiralitás. Az eredetről van egy vélemény: a racemátból a kiralitásba való átmenet nem az evolúció során, hanem az anyag önszerveződésének minden jellegzetes jegyével rendelkező ugrás eredményeként ment végbe. Van egy másik nézőpont is. L. Pasteur (1822-1895) terjesztette elő. Lényege, hogy az élő rendszerek tüköraszimmetriája az Univerzum bizonyos aszimmetriáját követi. A múlt században az életet és a teret egyetlen egésszé kapcsoló tudós nézetei előtt tisztelegve megjegyezzük: az Univerzum aszimmetriája sértené bármely szerves anyag szimmetriáját, annak eredetétől függően. Pasteur nézőpontját úgy próbálták kifejteni, hogy feltételezéseket fogalmaztak meg néhány olyan ágens létezéséről, amelyek aszimmetrikusan hatnak az organizmusok anyagára. Ilyen szereket azonban még nem fedeztek fel.
Genetikai információ hordozója. Nukleinsavak. A DNS és RNS molekulák összetétele és szerkezete. A komplementaritás elve. A szervezet genomja. A genetikai kód tulajdonságai. DNS replikáció. A szervezet genetikai tulajdonságai.
Dezoxiribonukleinsav (DNS)– a genetikai információ anyagi hordozója. Ez egy nagy molekulatömegű természetes vegyület, amely az élő szervezetek sejtmagjaiban található. A DNS-molekulák a hisztonfehérjékkel együtt alkotják a kromoszómák anyagát. A hisztonok a sejtmag részei, és részt vesznek a kromoszómák szerkezetének fenntartásában és megváltoztatásában a sejtciklus különböző szakaszaiban, valamint a génaktivitás szabályozásában. A DNS-molekulák egyes szakaszai meghatározott géneknek felelnek meg. A DNS-molekula a következőkből áll két polinukleotid lánc csavarodott egymás köré spirálba. A láncok négyféle nagyszámú monomerből épülnek fel - nukleotidok, amelynek specificitását a négy nitrogénbázis egyike határozza meg: adenin(A), timin(T), citozin(C) és guanin(G). Három szomszédos nukleotid kombinációja egy DNS-láncban alkotja a genetikai kódot. A DNS-lánc nukleotidszekvenciájának megsértése örökletes változásokhoz vezet a szervezetben - mutációkhoz. A DNS pontosan reprodukálódik a sejtosztódás során, ami biztosítja az örökletes jellemzők és az anyagcsere specifikus formáinak átvitelét sejt- és szervezetgenerációkon keresztül.
A DNS kettős hélix formájú szerkezeti modelljét 1953-ban javasolta J. Watson amerikai biokémikus és F. Crick angol biofizikus és genetikus. A genetikai kód megfejtéséért 1962-ben Nobel-díjat kapott J. Watson, F. Crick és M. Wilkins angol biofizikus, aki elsőként kapott kiváló minőségű röntgenképet egy DNS-molekuláról.
A DNS egy csodálatos természetes képződmény spirális szimmetriával. A DNS-lánc szerkezetének hosszú, egymásba fonódó szálai cukor- és foszfátmolekulákból állnak. A cukormolekulákhoz nitrogéntartalmú bázisok kapcsolódnak, keresztkötéseket képezve a két spirális szál között. A megnyúlt DNS-molekula egy deformált csigalépcsőhöz hasonlít. Ez valóban egy makromolekula: molekulatömege elérheti a 109-et. Ezekben a nukleotidpárokban tehát A mindig T-vel, C pedig G-vel asszociálódik. a komplementaritás elve.
A nitrogéntartalmú bázisok partnerfelismerési képessége a cukor-foszfát láncok kettős hélix formájában való feltekeredéséhez vezet, amelynek szerkezetét röntgen-megfigyelések eredményeként kísérletileg határozták meg.
A cukor-foszfát csoport a nitrogéntartalmú A, T, C vagy G bázisok egyikével együtt egy nukleotidot képezve egyfajta építőelemként ábrázolható. A DNS-molekula ilyen blokkokból áll. A nukleotidszekvencia információt kódol egy DNS-molekulában. Olyan információkat tartalmaz, amelyek például egy élő szervezet számára szükséges fehérjék előállításához szükségesek.
A DNS-molekula az enzim által katalizált replikációs folyamaton keresztül másolható, ami magában foglalja a megkettőzést. Folyamat replikáció magában foglalja a régiek felbomlását és új hidrogénkötések kialakulását. A replikáció kezdetén a két egymással szemben lévő szál letekercselődik és elválik egymástól. A feltekeredési ponton az enzim a komplementaritás elve szerint új láncot kapcsol két régi lánchoz, aminek eredményeként két egyforma kettős hélix képződik. A genetikai információ kódolása és a DNS-molekula replikációja egymással összefüggő alapvető folyamatok, amelyek az élő szervezet fejlődéséhez szükségesek.
A genetikai információt a DNS-nukleotidok szekvenciája kódolja. Alapvető dekódolási munka genetikai kód M. Nirenberg, X. Korana és R. Holley amerikai biokémikusok végezték; Nobel-díjasok 1968 Három egymást követő nukleotid alkotja a genetikai kód egy kodonjának nevezett egységet. Minden kodon egy vagy másik aminosavat kódol, amelyek száma összesen 20. Egy DNS-molekula ábrázolható betűk-nukleotidok sorozataként, amelyek nagy számából szöveget alkotnak, például ASAT-TGGAG... Egy ilyen szöveg olyan információkat tartalmaz, amelyek meghatározzák az egyes testek sajátosságait. Minden élőlény genetikai kódja, legyen az növény, állat vagy baktérium, ugyanaz. A genetikai kód ezen tulajdonsága, valamint az összes fehérje aminosav-összetételének hasonlósága az élet biokémiai egységét jelzi, amely nyilvánvalóan tükrözi az összes élőlény eredetét egyetlen őstől.
) — egy merev tárgy (térszerkezet) geometriai tulajdonsága, hogy ideális síktükörben összeférhetetlen a tükörképével.
Leírás
Egy királis objektumnak nincsenek 2. típusú szimmetriaelemei, mint például szimmetriasíkok, szimmetriaközéppontok és tükörforgástengelyek. Ha ezen szimmetriaelemek közül legalább egy jelen van, az objektum akirális. A molekulák és kristályok lehetnek királisak (például).
A királis molekulák két optikai izomerként (enantiomerként) létezhetnek, amelyek egymás tükörképei, és abban különböznek egymástól, hogy képesek a fény polarizációs síkját az óramutató járásával megegyező (D-izomerek) vagy azzal ellentétes irányba (L-izomerek) forgatni (ábra). Az enantiomereket ugyanazok a fizikai tulajdonságok, valamint azonos kémiai tulajdonságok jellemzik, amikor akirális anyagokkal lépnek kölcsönhatásba. Ugyanakkor az enantiomerek szétválasztása, például a királis módszer, alapulhat egy adott anyag enantiomereinek és egy másik anyag specifikus optikai izomerjének kölcsönhatásának különbségén. A kémiában a kiralitást leggyakrabban egy négy különböző szubsztituenst hordozó aszimmetrikus széncentrum jelenlétével társítják.
Ha egy molekulában több aszimmetrikus centrum van, akkor diasztereoizomériáról beszélnek. Ebben az esetben több enantiomerpár is létezhet (egy enantiomerpárt az összes aszimmetriacentrum egymással ellentétes konfigurációjával kell jellemezni), és a különböző enantiomerpárokból származó diasztereomerek tulajdonságai nagymértékben eltérhetnek.
Szinte minden biomolekula királis, beleértve a természetben előforduló aminosavakat és cukrokat is. A természetben ezeknek az anyagoknak a többsége bizonyos térbeli konfigurációval rendelkezik: például a legtöbb aminosav az L térbeli konfigurációhoz tartozik, a cukrok pedig a D-hez. Ebben a tekintetben az enantiomer tisztaság elengedhetetlen követelmény a biológiailag aktív gyógyszerek esetében.
Illusztrációk
Szerző
- Eremin Vadim Vladimirovics
Források
- Kémiai enciklopédia. T. 5. - M.: Nagy Orosz Enciklopédia, 1998. 538. o.
- Kémiai Technológiai Kompendium. IUPAC ajánlások. - Blackwell, 1997.