Nátrium-tioszulfát. Általános információk Nátrium-tioszulfát fizikai tulajdonságai
Termikusan nagyon instabil:
Kénsav jelenlétében lebomlik:
Reagál lúgokkal:
Halogénekkel reagál:
Tiokénsav
Ha nátrium-szulfit vizes oldatát kénnel forraljuk, és a felesleges kén kiszűrése után hagyjuk kihűlni, akkor az oldatból színtelen átlátszó kristályok szabadulnak fel, amelyek összetételét a képlet fejezi ki. Ez az anyag a tiokénsav nátriumsója.
A tiokénsav instabil. Már szobahőmérsékleten szétesik. Sói, tioszulfátjai sokkal stabilabbak. Ezek közül a leggyakrabban használt nátrium-tioszulfát, más néven hiposzulfit.
Ha némi savat, például sósavat adunk a nátrium-tioszulfát oldatához, kén-dioxid szaga jelenik meg, és egy idő után a folyadék zavarossá válik a felszabaduló kéntől.
A nátrium-tioszulfát tulajdonságainak vizsgálata arra a következtetésre jut, hogy az összetételében lévő kénatomok eltérő oxidációs szinttel rendelkeznek: az egyik oxidációs foka +4, a másik 0. . Nátrium-tioszulfát - redukálószer . A klór, bróm és más erős oxidálószerek kénsavvá vagy sójává oxidálják.
Tioszulf, te vagy- tiokénsav sói és észterei, H2S2O3. A tioszulfátok instabilak, ezért a természetben nem fordulnak elő. A legszélesebb körben használt nátrium-tioszulfát és ammónium-tioszulfát.
Szerkezet. A tioszulfát ion szerkezete

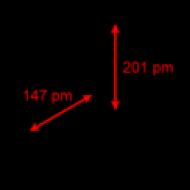
A tioszulfátion szerkezetében közel áll a szulfátionhoz. A 2− tetraéderben az S-S kötés (1,97A) hosszabb, mint az S-O kötések
Nátrium-tioszulfát meglehetősen instabil anyagok közé sorolhatók. A nátrium-tioszulfát 220°C-ra melegítve bomlik: A nátrium-tioszulfát hőbomlási reakciójában nátrium-poliszulfidot kapunk, amely szintén tovább bomlik nátrium-szulfiddá és elemi kénné. Kölcsönhatás savakkal: a tiokénsavat (hidrogén-tioszulfátot) nem lehet izolálni nátrium-tioszulfát és erős sav reakciójával, mivel instabil és azonnal lebomlik: A sósav és a salétromsav is ugyanazon a reakción megy keresztül. A bomlást kellemetlen szagú váladék kíséri.
A nátrium-tioszulfát redox tulajdonságai: a 0 oxidációs állapotú kénatomok jelenléte miatt a tioszulfát ion redukáló tulajdonságokkal rendelkezik, például gyenge oxidálószerekkel (I2, Fe3+) a tioszulfát tetrationát ionná oxidálódik: Lúgos környezetben az oxidáció nátrium-tioszulfát jóddal szulfáttá alakulhat.
Az erősebb oxidálószerek pedig szulfátionokká oxidálják :
Erős redukálószerek Az ion S2-származékokká redukálódik: A körülményektől függően a nátrium-tioszulfát oxidáló és redukáló tulajdonságokat is mutathat.
A tioszulfátok komplexképző tulajdonságai:
A tioszulfát ion erős komplexképző szer , a fényképezésben a redukálatlan ezüst-bromid fotófilmről való eltávolítására használják: Az S2O32 iont fémek koordinálják egy kénatomon keresztül, így a tioszulfát komplexek könnyen átalakulnak a megfelelő szulfidokká.
A nátrium-tioszulfát alkalmazásai
A nátrium-tioszulfátot meglehetősen széles körben használják mind a mindennapi életben, mind az iparban. A nátrium-tioszulfát fő alkalmazási területei az orvostudomány, a textilipar és a bányászat, valamint a fotózás lesz.
A nátrium-tioszulfátot a textil- és papíriparban használják a klórnyomok eltávolítására a szövetek és a papír fehérítése után, a bőrgyártásban pedig krómsav-csökkentőként.
A bányászatban nátrium-tioszulfátot használnak az ezüst kinyerésére alacsony ezüstkoncentrációjú ércekből. Az ezüst tioszulfátokkal alkotott összetett vegyületei meglehetősen stabilak, legalábbis stabilabbak, mint a fluorral, klórral, bromidokkal és tiocianátokkal alkotott összetett vegyületek. Ezért az ezüst izolálása a készítmény oldható komplex vegyülete formájában vagy iparilag jövedelmező. Dolgoznak az aranykitermelésben való felhasználásán. De ebben az esetben a komplex vegyület instabilitási állandója sokkal magasabb, és a komplexek kevésbé stabilak az ezüsthöz képest.
A nátrium-tioszulfátot először az orvostudományban használták fel. És a mai napig nem veszítette el jelentőségét az orvostudományban. Igaz, számos betegség kezelésére találtak már más, hatékonyabb gyógyszereket, így a nátrium-tioszulfátot szélesebb körben kezdték alkalmazni az állatgyógyászatban. A nátrium-tioszulfátot az orvostudományban ellenszerként használják arzénnal, higannyal és más nehézfémekkel, cianidokkal való mérgezés ellen (tiocianátokká alakítja őket):
Mint fentebb említettük, a tioszulfát ion sok fémmel, köztük sok mérgező nehézfémmel, stabil komplex vegyületeket hoz létre. A létrejövő komplex vegyületek alacsony toxikusak és kiürülnek a szervezetből. A nátrium-tioszulfát ezen tulajdonsága az alapja a toxikológiában és a mérgezések kezelésében való alkalmazásának.
A nátrium-tioszulfátot ételmérgezés esetén a belek fertőtlenítésére, a rüh kezelésére is használják (sósavval együtt), gyulladáscsökkentő és égésgátló szerként.
A nátrium-tioszulfátot széles körben használják az analitikai kémiában, mivel reagens a jodometriában. A jodometria az anyagok koncentrációjának kvantitatív meghatározásának és a jódkoncentráció meghatározásának egyik módszere, redox reakciót alkalmaznak nátrium-tioszulfáttal:
A nátrium-tioszulfát végső, meglehetősen gyakori felhasználási módja a fényképezésben történő rögzítés. És bár a közönséges fekete-fehér fényképezés már átadta helyét a színesnek, és a hétköznapi fényképezőfilmet meglehetősen ritkán, sok tekintetben elmaradva a digitális képrögzítéstől, jó néhány helyen még mindig használnak fotólemezeket és fotófilmet. Ilyenek például az orvosi és ipari röntgengépek, a tudományos berendezések és a fototeleszkópok.
Ahhoz, hogy fényképes képet kapjunk, elegendő, ha a fotófilmben lévő ezüst-bromid körülbelül 25%-a kifejlődik. A többi része pedig a fotófilmben marad, és megőrzi fényérzékenységét. Ha a fotófilmet előhívás után kivesszük a fényre, akkor a benne maradó előhívatlan halogénezüstet az előhívó előhívja és a negatív elsötétül. Még ha az összes előhívót ki is mossuk, a negatív valahogy elsötétül a fényben az ezüsthalogenid bomlása miatt.
A kép megőrzéséhez a filmen el kell távolítani róla a fejletlen ezüst halogént. Ehhez képrögzítési eljárást alkalmaznak, melynek során az ezüsthalogenideket oldható vegyületekké alakítják, és kimossák a filmről vagy fényképről. A kép rögzítésére nátrium-tioszulfátot használnak.
Az oldatban lévő nátrium-tioszulfát koncentrációjától függően különféle vegyületek képződnek. Ha a fixáló oldat kis mennyiségű tioszulfátot tartalmaz, akkor a reakció a következő egyenlet szerint megy végbe:
A keletkező ezüst-tioszulfát vízben nem oldódik, ezért nehéz elkülöníteni a fotorétegtől, meglehetősen instabil és kénsav felszabadulásával bomlik:
Az ezüst-szulfid elfeketíti a képet, és nem távolítható el a fotórétegről.
Ha az oldatban feleslegben van nátrium-tioszulfát, összetett ezüstsók képződnek:
A kapott komplex só, a nátrium-tioszulfát-argentát meglehetősen stabil, de vízben rosszul oldódik.
Ha az oldatban nagy feleslegben van tioszulfát, akkor vízben jól oldódó összetett ezüst komplex sók képződnek:
A nátrium-tioszulfát ezen tulajdonságai az alapja annak, hogy fixálószerként használják a fényképezésben.
Tetratnopinsav a polinoid savak csoportjába tartozik. Ezek általános képletű kétbázisú savak, ahol 2 és 6 közötti értékeket vehetnek fel, és esetleg többet is. Polnitionsavak instabil és csak vizes oldatokban ismert. A politiosavak sói – a politionátok – stabilabbak; egy részüket kristályok formájában kapják meg.
Politionsavak - H2SnO6 általános képletű kénvegyületek, ahol n>=2. Sóikat politionátoknak nevezik.

Tetrationát ion a tioszulfát ion jóddal történő oxidációjával nyerhető (a reakciót a jodometriában használják):
Pentationate ion SCl2 hatásával a tioszulfát ionra és Wackenroder-féle folyadékból kálium-acetát hozzáadásával nyerik. Először a kálium-tetrationát prizmás kristályai hullanak ki, majd a kálium-pentationát lemezszerű kristályai, amelyekből borkősav hatására pentationsav vizes oldata keletkezik.
Kálium-hexationát K2S6O6 a legjobban a KNO2 K2S2O3-on történő hatására szintetizálható tömény sósavban alacsony hőmérsékleten.
Nem mérgező vagy alacsony toxikus vegyületeket képez nehézfémek sóival, halogénekkel, cianidokkal. Antidotum tulajdonságokkal rendelkezik az anilin, benzol, jód, réz, higany, ciánhidrogénsav, szublimát és fenolok ellen. Arzén-, higany- és ólomvegyületekkel történő mérgezés esetén nem mérgező szulfitok képződnek. A méregtelenítés fő mechanizmusa hidrogén-cianiddal és sóival történő mérgezés esetén a cianid tiocianát ionná történő átalakítása, amely viszonylag nem mérgező, a rodonáz enzim - tioszulfát-cianid kéntranszferáz (sok szövetben megtalálható, de maximális aktivitást mutat a májban). A szervezet képes a cianid méregtelenítésére, de a rodonáz rendszer lassan működik, és cianid mérgezés esetén aktivitása nem elegendő a méregtelenítéshez. Ebben az esetben a rodonáz által katalizált reakció felgyorsításához exogén kéndonorokat kell bevinni a szervezetbe, általában nátrium-tioszulfátot.
A rüh elleni aktivitás annak köszönhető, hogy savas környezetben lebomlik kén és kén-dioxid képződésével, amelyek káros hatással vannak a rühes atkára és annak tojásaira.
Intravénás beadás után a nátrium-tioszulfát eloszlik az extracelluláris folyadékban, és változatlan formában ürül a vizelettel. Biológiai T 1/2 - 0,65 óra.
A nátrium-tioszulfát nem mérgező. Kutyákon végzett vizsgálatokban hipovolémiát figyeltek meg a nátrium-tioszulfát krónikus infúziója során, ami valószínűleg annak ozmotikus vízhajtó hatásának köszönhető.
Alkoholos delíriumban szenvedő betegek méregtelenítő termékeinek komplexében használják.
Az anyag alkalmazása Nátrium-tioszulfát
Mérgezés arzénnal, ólommal, higannyal, brómsóval, jóddal, hidrogén-cianiddal és cianidokkal; allergiás betegségek, ízületi gyulladás, neuralgia; rüh.
Ellenjavallatok
Túlérzékenység.
Használata terhesség és szoptatás alatt
Terhesség alatti alkalmazása csak feltétlenül szükséges. Nátrium-tioszulfáttal állatokon nem végeztek reprodukciós vizsgálatokat. Nem ismert, hogy a nátrium-tioszulfát okozhat-e káros magzati hatásokat, ha terhes nők szedik, vagy befolyásolja-e a reprodukciós képességet.
Az anyag mellékhatásai Nátrium-tioszulfát
Allergiás reakciók.
Az ügyintézés módjai
IV, külsőleg.
Különleges utasítások
Ciánmérgezés esetén kerülni kell az ellenszer beadásának késleltetését (gyors halálozás lehetséges). A beteget 24-48 órán keresztül szoros megfigyelés alatt kell tartani a cianidmérgezés tüneteinek kiújulásának lehetősége miatt. Ha a tünetek visszatérnek, a nátrium-tioszulfát adagolását meg kell ismételni a dózis felével.
pitvar tioszulfát Natrii thiosulfas
Na2S203-5H20 M. m 248,17
A nátrium-tioszulfát nem természetes termék, szintetikus úton nyerik.
Az iparban a nátrium-tioszulfátot gáztermelési hulladékból nyerik. Ez a módszer többlépcsős jellege ellenére gazdaságilag kifizetődő, mivel az alapanyag a gáztermelési hulladék, és különösen a szén kokszolása során keletkező világítógáz.
A világító gáz mindig tartalmaz hidrogén-szulfid keveréket, amelyet abszorberek, például kalcium-hidroxid kötnek meg. Ez kalcium-szulfidot termel.
De a kalcium-szulfid a gyártási folyamat során hidrolízisen megy keresztül, így a reakció némileg eltérően megy végbe - kalcium-hidroszulfid képződésével.
Légköri oxigénnel oxidálva a kalcium-hidroszulfid kalcium-tioszulfátot képez.
Ha a kapott kalcium-tioszulfátot nátrium-szulfáttal vagy nátrium-karbonáttal olvasztjuk össze, nátrium-tioszulfát Na 2 S 2 0 3 kapjuk.
![]()
Az oldat bepárlása után nátrium-tio-szulfát kristályosodik ki, amely gyógyszerkönyvi gyógyszer.
Megjelenése szerint a nátrium-tioszulfát (II) színtelen, átlátszó, sós-keserű ízű kristályok. Vízben nagyon könnyen oldódik. 50 °C hőmérsékleten kristályosodási vizében megolvad. Szerkezete a tiokénsav (I) sója.

Amint e vegyületek képletéből látható, a molekuláikban lévő kénatomok oxidációs foka eltérő. Az egyik kénatom oxidációs foka +6, a másik -2. A különböző oxidációs állapotú kénatomok jelenléte meghatározza tulajdonságaikat.
Így, mivel a molekulában S2- van, a nátrium-tioszulfát redukáló képességet mutat.
Magához a tiokénsavhoz hasonlóan sói sem erős vegyületek, és könnyen lebomlanak savak hatására, még olyan gyengék is, mint a szénsav.

A nátrium-tioszulfátnak azt a tulajdonságát, hogy savak hatására ként szabadul fel, a gyógyszer azonosítására használják. Ha sósavat adunk a nátrium-tioszulfát oldatához, az oldat zavarossá válik a kén felszabadulása miatt.

A nátrium-tioszulfátra nagyon jellemző az ezüst-nitrát oldattal való reakciója. Ez fehér csapadékot (ezüst-tioszulfátot) képez, amely gyorsan sárgás színűvé válik. A levegő nedvesség hatására az üledék elfeketedik az ezüst-szulfid felszabadulása miatt.
Ha a nátrium-tioszulfát ezüst-nitrát hatásának kitéve azonnal fekete csapadék képződik, ez a gyógyszer szulfidokkal való szennyeződését jelzi, amelyek ezüst-nitráttal kölcsönhatásba lépve azonnal ezüst-szulfid csapadékot szabadítanak fel.

A tiszta készítmény nem sötétedik azonnal, ha ezüst-nitrát oldattal érintkezik.
Hitelességreakcióként nátrium-tioszulfát és vas(III)-klorid-oldat reakciója is alkalmazható. Ebben az esetben vas-oxid-tioszulfát képződik, lila színű. A szín gyorsan eltűnik, mivel ez a só színtelen vasvassókká redukálódik (FeS 2 0 3 és FeS 4 0 6).
A nátrium-jóddal való kölcsönhatás során a nátrium-tioszulfát redukálószerként működik. Az S 2--ből elektronokat véve a jód I-vé redukálódik, a nátrium-tioszulfátot pedig jód oxidálja nátrium-tetratioiáttá.

A klór hasonlóan redukálódik hidrogén-kloriddá.

Ha feleslegben van klór, a felszabaduló kén kénsavvá oxidálódik.
Ezen a reakción alapult a nátrium-tioszulfát alkalmazása a klór elnyelésére az első gázálarcokban.
A készítmény nem tartalmazhat arzén, szelén, karbonátok, szulfátok, szulfidok, szulfitok, kalciumsók szennyeződéseit.
A GF X lehetővé teszi a kloridok és nehézfémsók szennyeződéseinek jelenlétét a szabványon belül.
A nátrium-tioszulfát mennyiségi meghatározását jodometriás módszerrel végezzük, amely a jóddal való kölcsönhatás reakcióján alapul. A GF legalább 99%-os és legfeljebb 102%-os nátrium-tio-szulfát-tartalmat ír elő a készítményben (a készítmény mállási határa miatt).
A nátrium-tioszulfát alkalmazása a kénfelszabadító képességén alapul. A gyógyszert halogének, cianogén és hidrogén-cianid mérgezések ellenszereként használják.

A keletkező kálium-tiocianát sokkal kevésbé mérgező, mint a kálium-cianid. Ezért hidrogén-cianiddal vagy sóival történő mérgezés esetén elsősegélynyújtásként nátrium-tioszulfátot kell alkalmazni. A gyógyszer arzén-, higany- és ólomvegyületekkel történő mérgezésre is alkalmazható; ebben az esetben nem mérgező szulfidok képződnek.
A nátrium-tioszulfátot allergiás betegségek, ízületi gyulladás, neuralgia kezelésére is használják - intravénásan 30% -os vizes oldat formájában. Ebben a tekintetben a GF X 30%-os nátrium-tioszulfát oldatot biztosít injekcióhoz (Solutio Natrii thiosulfatis 30% pro injectionibus).
5, 10, 50 ml 30%-os oldatot tartalmazó porok és ampullák formájában kapható.
A nátrium-tioszulfát kristályvizet tartalmaz, amely könnyen elpárolog, ezért hűvös helyen, jól záródó sötét üvegpalackokban kell tárolni, mivel a fény elősegíti a bomlását. Az oldatok állás közben zavarossá válnak a felszabaduló kén miatt. Ez a folyamat szén-dioxid jelenlétében felgyorsul. Ezért a nátrium-tioszulfát oldatot tartalmazó lombikok vagy palackok kalcium-klorid csővel vannak felszerelve, amely nátronmésszel van megtöltve, amely felszívja azt.
A nátrium-tioszulfát egy szintetikus vegyület, amely a kémiában nátrium-szulfátként, az élelmiszeriparban pedig E539 adalékanyagként ismert, élelmiszergyártásban való felhasználásra engedélyezett.
A nátrium-tioszulfát savasságot szabályozó (antioxidáns), csomósodást gátló vagy tartósítószerként funkcionál. A tioszulfát élelmiszer-adalékanyagként történő használata lehetővé teszi az eltarthatóság és a termék minőségének növelését, valamint a rothadás, savanyúság és erjedés megelőzését. Ez az anyag tiszta formájában részt vesz az étkezési jódozott só előállításának technológiai folyamataiban, mint jódstabilizátor, és sütőliszt feldolgozására használják, amely hajlamos a csomósodásra és csomósodásra.
Az E539 élelmiszer-adalékanyag használata kizárólag az ipari szférára korlátozódik, az anyag kiskereskedelmi forgalomba nem kerül. Orvosi célokra a nátrium-tioszulfátot súlyos mérgezés ellenszereként, külső használatra pedig gyulladáscsökkentő szerként használják.
Általános információ
A tioszulfát (hiposzulfit) egy szervetlen vegyület, amely a tiokénsav nátriumsója. Az anyag színtelen, szagtalan por, mely alaposabb vizsgálat után átlátszó monoklin kristályoknak bizonyul.
A hiposzulfit instabil vegyület, amely a természetben nem fordul elő. Az anyag kristályos hidrátot képez, amely 40 °C fölé melegítve saját kristályos vizében megolvad és feloldódik. Az olvadt nátrium-tioszulfát túlhűl, és körülbelül 220 ° C-on a vegyület teljesen megsemmisül.
Nátrium-tioszulfát: szintézis
A nátrium-szulfátot először mesterségesen, a laboratóriumban, a Leblanc-módszerrel állították elő. Ez a vegyület a szódagyártás mellékterméke, amely a kalcium-szulfid oxidációjával képződik. Oxigénnel kölcsönhatásba lépve a kalcium-szulfid részben tioszulfáttá oxidálódik, amelyből nátrium-szulfát segítségével Na 2 S 2 O 3 -ot nyernek.
 A modern kémia számos módszert kínál a nátrium-szulfát szintézisére:
A modern kémia számos módszert kínál a nátrium-szulfát szintézisére:
- nátrium-szulfidok oxidációja;
- forrásban lévő kén nátrium-szulfittal;
- hidrogén-szulfid és kén-oxid kölcsönhatása nátrium-hidroxiddal;
- forrásban lévő ként nátrium-hidroxiddal.
A fenti módszerekkel a reakció melléktermékeként vagy vizes oldat formájában nátrium-tioszulfát állítható elő, amelyből a folyadékot el kell párologtatni. A nátrium-szulfát lúgos oldatát úgy állíthatjuk elő, hogy szulfidját oxigénes vízben oldjuk.
A tiszta, vízmentes tioszulfát vegyület nátriumsó és salétromsav és kén reakciójának eredménye egy formamid néven ismert anyagban. A szintézis reakciója 80 °C hőmérsékleten megy végbe, és körülbelül fél óráig tart, termékei a tioszulfát és annak oxidjai.
A hiposzulfit minden kémiai reakcióban erős redukálószerként működik. Erős oxidálószerekkel való reakciók során a Na 2 S 2 O 3 szulfáttá vagy kénsavvá oxidálódik, gyenge anyagokkal pedig tetrationsóvá. A tioszulfát oxidációs reakciója az anyagok meghatározására szolgáló jodometriás módszer alapja.
Külön figyelmet érdemel a nátrium-tioszulfát kölcsönhatása a szabad klórral, amely erős oxidálószer és mérgező anyag. A hiposzulfitot a klór könnyen oxidálja, és ártalmatlan vízoldható vegyületekké alakítja. Így ez a vegyület megakadályozza a klór pusztító és mérgező hatását.
Ipari körülmények között a tioszulfátot a gáztermelési hulladékból vonják ki. A legelterjedtebb nyersanyag a világítógáz, amely a szén kokszolása során szabadul fel, és hidrogén-szulfid szennyeződéseket tartalmaz. Kalcium-szulfidot szintetizálnak belőle, amelyet hidrolízisnek és oxidációnak vetnek alá, majd nátrium-szulfáttal kombinálva tioszulfátot állítanak elő. A többlépcsős eljárás ellenére ezt a módszert tartják a leginkább költséghatékony és környezetbarát módszernek a hiposzulfit kinyerésére.
| Szisztematikus név | Nátrium-tioszulfát |
|---|---|
| Hagyományos nevek | Nátrium-diszulfid, nátrium-hiposzulfit (nátrium) szóda, antiklór |
| Nemzetközi jelölés | E539 |
| Kémiai formula | Na2S2O3 |
| Csoport | Szervetlen tioszulfátok (sók) |
| Az összesítés állapota | Színtelen monoklin kristályok (por) |
| Oldhatóság | Benne oldódik, benne oldhatatlan |
| Olvadási hőmérséklet | 50 °C |
| Kritikus hőmérséklet | 220 °C |
| Tulajdonságok | Reduktív (antioxidáns), komplexképző |
| Étrend-kiegészítő kategória | Savanyúságot szabályozó szerek, csomósodást gátló szerek (csomósodásgátlók) |
| Eredet | Szintetikus |
| Toxicitás | Nem vizsgálták, az anyag feltételesen biztonságos |
| Felhasználási területek | Élelmiszer-, textil-, bőripar, fényképezés, gyógyszeripar, analitikai kémia |
Nátrium-tioszulfát: alkalmazás
 A nátrium-diszulfidot sokféle célra használták jóval azelőtt, hogy a vegyületet étrend-kiegészítőkbe és gyógyszerekbe foglalták volna. Az antiklórt gézkötések és gázmaszkszűrők impregnálására használták, hogy megvédjék a légzőrendszert a mérgező klórtól az első világháború idején.
A nátrium-diszulfidot sokféle célra használták jóval azelőtt, hogy a vegyületet étrend-kiegészítőkbe és gyógyszerekbe foglalták volna. Az antiklórt gézkötések és gázmaszkszűrők impregnálására használták, hogy megvédjék a légzőrendszert a mérgező klórtól az első világháború idején.
A hiposzulfit modern alkalmazási területei az iparban:
- fényképészeti film feldolgozása és képek fényképészeti papírra történő rögzítése;
- ivóvíz klórmentesítése és bakteriológiai elemzése;
- klórfoltok eltávolítása szövetek fehérítése során;
- aranyérc kilúgozás;
- rézötvözetek és patina gyártása;
- bőrcserzés.
A nátrium-szulfátot az analitikai és szerves kémiában reagensként használják, semlegesíti az erős savakat, semlegesíti a nehézfémeket és azok mérgező vegyületeit. A tioszulfát reakciói különböző anyagokkal a jodometria és a bromometria alapját képezik.
Élelmiszer-adalékanyag E539
A nátrium-tioszulfát nem széles körben használt élelmiszer-adalékanyag, és a vegyület instabilitása és bomlástermékeinek toxicitása miatt nem hozzáférhető szabadon. A hiposzulfit az étkezési jódozott só és sütőipari termékek előállításának technológiai folyamataiban, mint savtartalom-szabályozó és csomósodást gátló anyag.
Az E539 adalékanyag antioxidánsként és tartósítószerként működik a zöldség- és halkonzerv, desszertek és alkoholos italok gyártásában. Ez az anyag része a friss, szárított és fagyasztott zöldségek és gyümölcsök felületének kezelésére használt vegyszereknek is.
Az E539 tartósítószert és antioxidánst az ilyen termékek minőségének javítására és eltarthatóságának növelésére használják:
- friss és fagyasztott zöldségek, gyümölcsök, tenger gyümölcsei;
- , diófélék, magvak;
- Zöldségek, gombák és hínár, olajban vagy olajban konzerválva;
- lekvárok, zselék, kandírozott gyümölcsök, gyümölcspürék és töltelékek;
- friss, fagyasztott, füstölt és szárított hal, tenger gyümölcsei, konzervek;
- liszt, keményítők, szószok, fűszerek, ecet, ;
- fehér és cukornád, édesítőszerek (dextróz és), cukorszirupok;
- gyümölcs- és zöldséglevek, édes víz, alacsony alkoholtartalmú italok, szőlőitalok.
Az étkezési jódozott só előállítása során az E539 élelmiszer-adalékanyagot használják a jód stabilizálására, amely jelentősen meghosszabbíthatja a termék eltarthatóságát és megőrzi tápértékét. A konyhasóban az E539 maximális megengedett koncentrációja 250 mg/1 kg.
A sütés során a nátrium-tioszulfátot aktívan használják különféle adalékanyagok részeként a termék minőségének javítása érdekében. A sütést javító szerek vagy oxidatívak vagy reduktívak. Az E539 csomósodásgátló egy helyreállító javítószer, amely lehetővé teszi a tulajdonságok megváltoztatását.
A sűrű lisztből készült, rövidre szakadó glutént tartalmazó tészta nehezen feldolgozható, megsül, nem éri el a kívánt térfogatot és sütés közben megreped. Az E539 csomósodást gátló szer tönkreteszi a diszulfid kötéseket és strukturálja a sikérfehérjéket, aminek következtében a tészta jól megkel, a morzsa laza és rugalmas lesz, a kéreg nem reped meg sütés közben.
A vállalkozásoknál csomósodásgátló szert adnak a liszthez az élesztővel együtt közvetlenül a tészta dagasztása előtt. A liszt tioszulfát tartalma a pékáru gyártási technológiájától függően tömegének 0,001-0,002%-a. Az E539 adalék egészségügyi szabványa 50 mg/1 kg búzaliszt.
Az E539 csomósodásgátlót technológiai folyamatokban szigorú adagolásban alkalmazzák, így a liszttermékek fogyasztása során nem áll fenn a tioszulfát-mérgezés veszélye. A kiskereskedelmi értékesítésre szánt lisztet értékesítés előtt nem dolgozzák fel. A normál határokon belül a kiegészítő biztonságos és nincs mérgező hatása a szervezetre.
Használata az orvostudományban és hatása a szervezetre
A szóda-hiposzulfit az egyik leghatékonyabb és legbiztonságosabb gyógyszerként szerepel az Egészségügyi Világszervezet alapvető gyógyszerek listáján. Szubkután, intramuszkulárisan és intravénásan injekciós oldat formájában vagy külső szerként alkalmazzák.
A huszadik század elején a nátrium-tioszulfátot először a hidrogén-cianid-mérgezés ellenszereként használták. Nátrium-nitrittel kombinálva a tioszulfát különösen súlyos cianidmérgezés esetén javasolt, és intravénásan adják be, hogy a cianidot nem mérgező tiocianátokká alakítsák, amelyek biztonságosan kiürülhetnek a szervezetből.
A nátrium-szulfát orvosi felhasználása:
A hiposzulfit emberi szervezetre gyakorolt hatását szájon át fogyasztva nem vizsgálták, ezért lehetetlen megítélni az anyag előnyeit és ártalmait tiszta formában vagy élelmiszerek részeként. Az E539 adalékanyaggal nem történt mérgezés, ezért általában nem mérgezőnek tartják.
A nátrium-tioszulfát és a jogszabályok
A nátrium-tioszulfát szerepel azon élelmiszer-adalékanyagok listáján, amelyeket Oroszországban és Ukrajnában élelmiszergyártásra engedélyeztek. Az E539 csomósodásgátlót és savanyúságot szabályozó anyagot a megállapított egészségügyi és higiéniai szabványoknak megfelelően kizárólag ipari célokra használják.
Tekintettel arra, hogy a vegyi anyag emberi szervezetre gyakorolt hatását szájon át adva még nem vizsgálták, az E539 adalékanyag nem engedélyezett az EU-ban és az USA-ban.
Az orvosi gyakorlatban injekciós oldat formájában méregtelenítő és érzéketlenítő szerként vagy külsőleg rovarölő szerként, állatgyógyászatban bőrbetegségek elleni szerként, gyógyszeriparban gyógyszergyártásban; 30%-os nátrium-tioszulfát injekciós oldatok készítéséhez.Nátrium-tioszulfátot is használnak
- klórnyomok eltávolítására a szövetek fehérítése után
- ezüst ércekből való kinyerésére;
- rögzítő a fotózásban;
- reagens a jodometriában
- mérgezés ellenszere: As, Br, Hg és más nehézfémek, cianidok (tiocianáttá alakítja) stb.
- bélfertőtlenítéshez;
- rüh kezelésére (sósavval együtt);
- gyulladásgátló és égésgátló szer;
- molekulatömeg-meghatározási közegként használható a fagyáspont csökkentésével (krioszkópiai állandó 4,26°)
- az élelmiszeriparban E539 élelmiszer-adalékanyagként van bejegyezve.
- adalékok betonhoz.
- a szövetek jódtól való tisztítására
Leírás
Fizikai-kémiai jellemzők
Színtelen, átlátszó, szagtalan kristályokCsomagolás
Zsák 40 kg. Kiszerelés 1 kg. Zsák 35 kg. Zsák 0,5 kg. 1 kg-os zsák. 5 kg-os zsák. Zsák 10 kg.
Tárolás
Kiszerelés: egyenként 0,5 kg; 1 kg; 5 kg; 10 kg; 35 kg; 40 kg; 45 kg polietilén fóliából vagy polimer bevonatú csomagolópapírból készült zacskóban vagy zacskóban.
Tárolás: Száraz helyen, jól csomagolt edényekben. Felhasználhatósági idő - 5 év.
Gyógyszerkönyvi nátrium-tioszulfát, amelyet a róla elnevezett vegyi üzem állít elő. L.Ya. Karpova
| Tömegtört, % | Norma | |
|---|---|---|
| Na2S2O3*5H2O | 99,0-102,0 | |
| kalcium | nincs reakció | |
| szulfidok | kiállod a próbát | |
| szulfitok és szulfátok | Max. | 0,01 |
| kloridok | Max. | 0,005 |
| nehéz fémek | Max. | 0,001 |
| arzén, szelén | nincs reakció | |
| mirigy | Max. | 0,002 |
| lúgosság | a fenolftalein rózsaszín elszíneződésének hiánya | |
| Mikrobiológiai tisztaság | megfelel az Állami Alap XI. számának 2. számának 193. o |
- Termékkód: 264-01
- Elérhetőség: raktáron