Definíció, képlet, tulajdonságok. Mi az arzén? Az arzén jellemzői, tulajdonságai és alkalmazása Az arzén fizikai tulajdonságai
Az arzén a periódusos rendszer 4. periódusának 5. csoportjába tartozó kémiai elem, 33-as rendszámmal. Törékeny acél színű félfém, zöldes árnyalattal. Ma közelebbről megvizsgáljuk, mi az arzén, és megismerkedünk ennek az elemnek az alapvető tulajdonságaival.
Általános jellemzők
Az arzén egyedisége abban rejlik, hogy szó szerint mindenhol megtalálható - kőzetekben, vízben, ásványokban, talajban, növény- és állatvilágban. Ezért gyakran nem kevesebbnek nevezik, mint mindenütt jelenlévő elemnek. Az arzén akadálytalanul eloszlik a Föld bolygó minden földrajzi régiójában. Ennek oka vegyületeinek illékonysága és oldhatósága.
Az elem neve a rágcsálók irtására való felhasználásához kapcsolódik. A latin Arsenicum szó (a periódusos rendszerben az arzén képlete As) a görög Arsen szóból származik, ami „erős” vagy „erős”.
Egy átlagos felnőtt teste körülbelül 15 mg-ot tartalmaz ebből az elemből. Főleg a vékonybélben, a májban, a tüdőben és a hámban koncentrálódik. Az anyag felszívódását a gyomor és a belek végzik. Az arzén antagonistái a kén, a foszfor, a szelén, néhány aminosav, valamint az E- és C-vitamin. Maga az elem rontja a cink, a szelén, valamint az A-, C-, B9- és E-vitamin felszívódását.
Sok más anyaghoz hasonlóan az arzén is lehet méreg és gyógyszer is, minden az adagtól függ.
Az ilyen elem, mint az arzén, hasznos funkciói között szerepel:
- A nitrogén és a foszfor felszívódásának serkentése.
- A hematopoiesis javítása.
- Kölcsönhatás ciszteinnel, fehérjékkel és liponsavval.
- Az oxidatív folyamatok gyengülése.
A felnőttek napi arzénszükséglete 30-100 mcg.
Történelmi hivatkozás
Az emberi fejlődés egyik szakaszát „bronznak” nevezik, mivel ebben az időszakban az emberek a kőfegyvereket bronzra cserélték. Ez a fém ón és réz ötvözete. Egyszer a bronz olvasztásakor a kézművesek véletlenül a réz-arzén-szulfid ásvány mállási termékeit használták a rézérc helyett. A kapott ötvözet könnyen önthető és kiválóan kovácsolt. Akkoriban még senki sem tudta, mi az az arzén, de az ásványi anyagok lelőhelyeit szándékosan keresték a kiváló minőségű bronz előállításához. Idővel ezt a technológiát elhagyták, nyilván annak a ténynek köszönhető, hogy használata során gyakran előfordult mérgezés.
Az ókori Kínában a realgar nevű kemény ásványt (As 4 S 4) használták. Kőfaragáshoz használták. Mivel a hőmérséklet és a fény hatására a realgar egy másik anyaggá alakult - 2 S 3 -ként, azt is hamarosan elhagyták.
A Kr.e. 1. században idősebb Plinius római tudós, Dioscorides botanikussal és orvossal együtt leírta az orpiment nevű arzén ásványt. Nevét latinból „aranyfesték”-nek fordítják. Az anyagot sárga festékként használták.
A középkorban az alkimisták az elem három formáját osztályozták: sárga (As 2 S 3 szulfid), vörös (As 4 S 4 szulfid) és fehér (As 2 O 3 oxid). A 13. században a sárga arzén szappannal való hevítésével az alkimisták fémszerű anyagot kaptak. Valószínűleg ez volt az első példa a mesterségesen nyert tiszta elemre.
Hogy mi az arzén tiszta formájában, azt a 17. század elején fedezték fel. Ez akkor történt, amikor Johann Schröder az oxidot szénnel redukálva izolálta ezt az elemet. Néhány évvel később Nicolas Lemery francia kémikusnak sikerült előállítania az anyagot úgy, hogy oxidját szappannal és hamuzsírral keverve hevítette. A következő évszázadban az arzén már jól ismert volt félkő állapotában.

Kémiai tulajdonságok
Mengyelejev periódusos rendszerében az arzén kémiai elem az ötödik csoportban található, és a nitrogéncsaládba tartozik. Természetes körülmények között ez az egyetlen stabil nuklid. Az anyag több mint tíz radioaktív izotópját mesterségesen állítják elő. Felezési idejük tartománya meglehetősen széles - 2-3 perctől több hónapig.
Bár az arzént néha fémnek is nevezik, valószínűbb, hogy nem fém. Savakkal kombinálva nem képez sókat, hanem maga is savképző anyag. Ez az oka annak, hogy az elemet félfémként azonosítják.
Az arzén a foszforhoz hasonlóan különféle allotróp konfigurációkban található. Egyikük, a szürke arzén, törékeny anyag, amely törve fémes fényt ad. Ennek a félfémnek az elektromos vezetőképessége 17-szer alacsonyabb, mint a rézé, de 3,6-szor nagyobb, mint a higanyáé. A hőmérséklet emelkedésével csökken, ami a tipikus fémekre jellemző.
Az arzéngőznek a folyékony nitrogén hőmérsékletére (-196 °C) történő gyors lehűtésével sárga foszforra emlékeztető, lágy sárgás anyag nyerhető. Hevítés és ultraibolya fény hatására a sárga arzén azonnal szürkévé válik. A reakciót hőkibocsátás kíséri. Amikor a gőzök inert atmoszférában lecsapódnak, az anyag egy másik formája képződik - amorf. Ha arzéngőz válik ki, tükörfilm jelenik meg az üvegen.
Ennek az anyagnak a külső elektronhéja ugyanolyan szerkezetű, mint a foszfor és a nitrogén. A foszforhoz hasonlóan az arzén is három kovalens kötést képez. Száraz levegőn stabil alakja van, és a páratartalom növekedésével elhomályosodik, és fekete oxidréteggel borítja. A gőz meggyújtásakor az anyagok kék lánggal égnek.
Mivel az arzén közömbös, nem hatnak rá a víz, a lúgok és a savak, amelyek nem rendelkeznek oxidáló tulajdonságokkal. Ha egy anyag híg salétromsavval érintkezik, ortoarzénsav, tömény savval pedig ortoarzénsav képződik. Az arzén a kénnel is reagál, és különböző összetételű szulfidokat képez.

A természetben lenni
Természetes körülmények között egy kémiai elem, például az arzén gyakran megtalálható a rézzel, nikkellel, kobalttal és vassal alkotott vegyületekben.
Az ásványi anyagok összetétele, amelyet az anyag képez, annak félig fémes tulajdonságainak köszönhető. A mai napig több mint 200 ásványi anyag ismert ebből az elemből. Mivel az arzén negatív és pozitív oxidációs állapotban is létezhet, könnyen kölcsönhatásba lép sok más anyaggal. Az arzén pozitív oxidációja során fémként (szulfidokban), negatív oxidációja során nemfémként (arzenidekben) működik. Az ezt az elemet tartalmazó ásványi anyagok meglehetősen összetett összetételűek. A kristályrácsban egy félfém helyettesítheti a kén-, antimon- és fématomokat.
Összetételi szempontból sok arzéntartalmú fémvegyület valószínűleg nem az arzenidekhez, hanem az intermetallikus vegyületekhez tartozik. Néhányukat a fő elem változó tartalma különbözteti meg. Az arzenidek egyidejűleg több fémet is tartalmazhatnak, amelyek atomjai közeli ionsugár esetén helyettesíthetik egymást. Minden arzenidnek minősített ásvány fémes fényű, átlátszatlan, nehéz és tartós. A természetes arzenidek közül (összesen körülbelül 25 van) a következő ásványok jegyezhetők meg: skutterudit, rammelsbreggit, nikkelin, lellingrit, klinózafflorit és mások.
Kémiai szempontból érdekesek azok az ásványok, amelyekben az arzén a kénnel egyidejűleg van jelen, és fémszerepet játszik. Nagyon összetett szerkezettel rendelkeznek.
Az arzénsav természetes sói (arzenátok) különböző színűek lehetnek: eritrit - kobalt; az simplezit, az annabergit és a scoride zöld, a rooseveltit, kettigit és gernessit pedig színtelen.
Kémiai tulajdonságait tekintve az arzén meglehetősen közömbös, így natív állapotában olvasztott kockák és tűk formájában is megtalálható. A rögben lévő szennyeződések tartalma nem haladja meg a 15%-ot.
A talajban az arzéntartalom 0,1-40 mg/kg. A vulkánok területein és olyan helyeken, ahol arzénérc található, ez a szám elérheti a 8 g/kg-ot is. Az ilyen helyeken a növények elpusztulnak, az állatok pedig megbetegednek. Hasonló probléma jellemző a sztyeppekre és sivatagokra, ahol az elem nem mosódik ki a talajból. Az agyagos kőzeteket dúsítottnak tekintik, mivel négyszer több arzénanyagot tartalmaznak, mint a közönséges kőzetek.
Ha egy tiszta anyagot a biometilezés során illékony vegyületté alakítanak át, akkor azt nemcsak a víz, hanem a szél is ki tudja vinni a talajból. Normál területeken a levegő arzénkoncentrációja átlagosan 0,01 μg/m 3 . Azon ipari területeken, ahol gyárak és erőművek működnek, ez a szám elérheti az 1 μg/m3-t.
Az ásványvíz mérsékelt mennyiségű arzént tartalmazhat. A gyógyászati ásványvizekben az általánosan elfogadott szabványok szerint az arzén koncentrációja nem haladhatja meg a 70 µg/l-t. Itt érdemes megjegyezni, hogy nagyobb arányban is csak ilyen víz rendszeres fogyasztása esetén fordulhat elő mérgezés.
A természetes vizekben az elem különféle formákban és vegyületekben megtalálható. A háromértékű arzén például sokkal mérgezőbb, mint az ötértékű arzén.

Arzén beszerzése
Az elemet ólom-, cink-, réz- és kobaltércek feldolgozása során, valamint aranybányászat során nyerik. Egyes polifémes ércekben az arzéntartalom elérheti a 12%-ot is. Amikor 700 °C-ra melegítik, szublimáció következik be - egy anyag szilárd halmazállapotból gázhalmazállapotba való átmenete, megkerülve a folyékony állapotot. Ennek a folyamatnak a fontos feltétele a levegő hiánya. Amikor az arzénérceket levegőn hevítik, illékony oxid képződik, amelyet „fehér arzénnek” neveznek. A szénnel való kondenzációnak kitéve tiszta arzén nyerhető vissza.
Az elem megszerzésének képlete a következő:
- 2As 2S3 +9O 2 =6SO 2 +2As 2O 3;
- As 2 O 3 +3C=2As+3CO.
Az arzénbányászat veszélyes iparág. Paradox az a tény, hogy ezzel az elemmel a legnagyobb környezetszennyezés nem az azt termelő vállalkozások, hanem az erőművek és színesfémkohászati üzemek közelében jelentkezik.
Egy másik paradoxon, hogy a fémarzén termelési volumene meghaladja az igényt. Ez nagyon ritka jelenség a fémbányászatban. A fölösleges arzént úgy kell ártalmatlanítani, hogy a fémtartályokat régi bányákba kell elásni.
Az arzénércek legnagyobb lelőhelyei a következő országokban koncentrálódnak:
- Réz-arzén - USA, Grúzia, Japán, Svédország, Norvégia és közép-ázsiai államok.
- Arany-arzén - Franciaország és az USA.
- Arzén-kobalt - Kanada és Új-Zéland.
- Arzén-ón - Anglia és Bolívia.
Meghatározás
Az arzén laboratóriumi meghatározását sárga szulfidok sósavoldatokból történő kicsapásával végezzük. Az elem nyomait a Gutzeit-módszerrel vagy a Marsh-reakcióval határozzuk meg. Az elmúlt fél évszázad során mindenféle szenzitív elemzési technikát hoztak létre, amellyel akár nagyon kis mennyiségben is kimutatható ez az anyag.
Néhány arzénvegyületet szelektív hibrid módszerrel elemeznek. Ez magában foglalja a vizsgált anyag arzin illékony elemmé történő redukálását, amelyet azután folyékony nitrogénnel hűtött tartályban lefagyasztanak. Ezt követően, amikor a tartály tartalmát lassan felmelegítjük, a különböző arzinok egymástól elkülönítve párologni kezdenek.

Ipari felhasználás
A bányászott arzén csaknem 98%-át nem használják fel tiszta formájában. Vegyületeit széles körben használják különféle iparágakban. Évente több száz tonna arzént bányásznak és dolgoznak fel. Hozzáadják csapágyötvözetekhez azok minőségének javítása érdekében, kábelek és ólom akkumulátorok keménységének növelésére használják, valamint félvezető eszközök gyártásában is használják germániummal vagy szilíciummal együtt. És ezek csak a legambiciózusabb területek.
Adalékanyagként az arzén vezetőképességet kölcsönöz néhány „klasszikus” félvezetőnek. Az ólom hozzáadása jelentősen növeli a fém szilárdságát, a réz pedig a folyékonyságot, a keménységet és a korrózióállóságot. Arzént néha bizonyos típusú bronzokhoz, sárgarézekhez, babbittekhez és ötvözetekhez is adnak. A kohászok azonban gyakran megpróbálják elkerülni ennek az anyagnak a használatát, mivel nem biztonságos az egészségre. Egyes fémek esetében a nagy mennyiségű arzén is káros, mert rontja az eredeti anyag tulajdonságait.
Az arzén-oxidot az üveggyártásban üvegfehérítőként használják. Ebben az irányban használták az ősi üvegfúvók. Az arzénvegyületek erős fertőtlenítő hatásúak, így szőrmék, plüssállatok és bőrök tartósítására, valamint vízszállításra és fa impregnálására szolgáló szennyeződésgátló festékek készítésére is szolgálnak.
Egyes arzénszármazékok biológiai aktivitása miatt az anyagot növényi növekedést serkentő szerek, valamint gyógyszerek, köztük haszonállatok féreghajtó szerek előállítására használják. Az ezt az elemet tartalmazó termékek gyomok, rágcsálók és rovarok irtására szolgálnak. Korábban, amikor az emberek nem gondoltak arra, hogy az arzén felhasználható-e élelmiszertermelésre, az elemet szélesebb körben alkalmazták a mezőgazdaságban. Miután azonban felfedezték mérgező tulajdonságait, helyettesítőt kellett találni.
Ennek az elemnek fontos felhasználási területei: mikroáramkörök, száloptikák, félvezetők, filmelektronika gyártása, valamint mikrokristályok előállítása lézerekhez. Erre a célra gáznemű arzinokat használnak. A lézerek, diódák és tranzisztorok gyártása pedig nem teljes gallium- és indiumarzenidek nélkül.

Gyógyszer
Az emberi szövetekben és szervekben az elem főként a fehérjefrakcióban, kisebb mértékben a savban oldódó frakcióban van jelen. Részt vesz az erjedésben, a glikolízisben és a redox reakciókban, valamint biztosítja az összetett szénhidrátok lebontását is. A biokémiában ennek az anyagnak a vegyületeit specifikus enziminhibitorként használják, amelyek szükségesek a metabolikus reakciók vizsgálatához. Az arzén nyomelemként szükséges az emberi szervezet számára.
Az elem felhasználása az orvostudományban kevésbé kiterjedt, mint a termelésben. Mikroszkópos dózisait mindenféle betegség és patológia diagnosztizálására, valamint fogászati betegségek kezelésére használják.
A fogászatban arzént használnak a pép eltávolítására. Az arzénsavat tartalmazó paszta kis adagja szó szerint egy napon belül biztosítja a fog elhalását. Működésének köszönhetően a pép eltávolítása fájdalommentes és akadálytalan.
Az arzént széles körben használják a leukémia enyhe formáinak kezelésére is. Lehetővé teszi a leukociták kóros képződésének csökkentését vagy akár elnyomását, valamint serkenti a vörös vérképzést és a vörösvértestek felszabadulását.
Az arzén olyan, mint a méreg
Ennek az elemnek minden vegyülete mérgező. Az akut arzénmérgezés hasi fájdalmat, hasmenést, hányingert és központi idegrendszeri depressziót okoz. Az ezzel az anyaggal való mérgezés tünetei a kolera tüneteihez hasonlítanak. Ezért a bírói gyakorlatban gyakran találkoztak szándékos arzénmérgezés korábbi eseteivel. Bűnügyi célokra az elemet leggyakrabban trioxid formájában használták.
Mérgezés tünetei
Eleinte az arzénmérgezés fémes ízben a szájban, hányásban és hasi fájdalomban nyilvánul meg. Ha nem tesznek intézkedéseket, görcsök, sőt bénulás léphet fel. A legrosszabb esetben a mérgezés végzetes lehet.
A mérgezés oka lehet:
- Arzénvegyületeket tartalmazó por belélegzése. Általában olyan arzéngyártó üzemekben fordul elő, ahol nem tartják be a munkavédelmi szabályokat.
- Mérgezett étel vagy víz fogyasztása.
- Bizonyos gyógyszerek alkalmazása.
Elsősegély
Az arzénmérgezés legszélesebb körben elérhető és legismertebb ellenszere a tej. A benne található kazein fehérje oldhatatlan vegyületeket képez a mérgező anyaggal, amely nem szívódik fel a vérbe.

Akut mérgezés esetén az áldozat gyors segítése érdekében gyomormosást kell végezni. Kórházi körülmények között hemodialízist is végeznek, amelynek célja a vesék tisztítása. A gyógyszerek között univerzális ellenszert használnak - Unithiol. Ezenkívül antagonista anyagok is használhatók: szelén, cink, kén és foszfor. A jövőben a betegnek aminosav- és vitaminkomplexumot kell előírnia.
Arzén hiány
A kérdésre válaszolva: „Mi az arzén?”, érdemes megjegyezni, hogy az emberi szervezetnek kis mennyiségben szüksége van rá. Az elem immuntoxikusnak tekinthető, feltételesen nélkülözhetetlen. Részt vesz az emberi szervezet szinte valamennyi legfontosabb biokémiai folyamatában. Ennek az anyagnak a hiányát a következő jelek jelezhetik: a trigliceridek koncentrációjának csökkenése a vérben, a szervezet fejlődésének és növekedésének romlása.
Általános szabály, hogy súlyos egészségügyi problémák hiányában nem kell tartani az arzén hiányától az étrendben, mivel az elem szinte minden növényi és állati eredetű termékben megtalálható. A tenger gyümölcsei, a gabonafélék, a szőlőbor, a gyümölcslevek és az ivóvíz különösen gazdagok ebben az anyagban. 24 órán belül az elfogyasztott arzén 34%-a kiürül a szervezetből.
Vérszegénység esetén étvágyfokozásra szedik az anyagot, szelénmérgezés esetén pedig hatékony ellenszerként hat.
Történetünk egy nem túl gyakori, de eléggé ismert elemről szól; olyan elemről, amelynek tulajdonságai az összeférhetetlenségig összeegyeztethetetlenek. Nehéz összeegyeztetni azt a szerepet is, amelyet ez az elem játszott és játszik az emberiség életében. Különböző időpontokban, különböző körülmények között, különböző formában méregként és gyógyító szerként, káros és veszélyes ipari hulladékként, a leghasznosabb, pótolhatatlan anyagok összetevőjeként hat. Tehát a 33-as rendszámú elem.
Mivel ez egyike azoknak az elemeknek, amelyek pontos felfedezésének dátumát nem állapították meg, ezért csak néhány megbízható tény közlésére szorítkozunk: ; ősidők óta ismert:Dioscorides műveiben (Kr. u. 1. század) említik a kalcinálást, amelyet ma arzén-szulfidnak neveznek;a III-IV században. a Zosimosnak tulajdonított töredékes feljegyzésekben említést tesznek a fémarzénról.
U Olympiodorus görög író (i.sz. 5. század) leírta a fehér arzén előállítását szulfid égetésével; a 8. században Geber arab alkimista arzén-trioxidot szerzett; a középkorban az emberek arzén-trioxiddal találkoztak az arzéntartalmú termékek feldolgozása soránércek, a gáznemű As2O3 fehér füstjét pedig ércfüstnek nevezzük; a szabad fémarzén előállítását Albert von Bolstedt német alkimistának tulajdonítják, és körülbelül 1250-re nyúlik vissza, bár a görög és arab alkimisták kétségtelenül korábban szerezték meg (trioxidjának szerves anyagokkal való hevítésével), mint Bolstedt; 1733-ban bebizonyosodott, hogy a fehér arzén a „föld”, a fémarzén oxidja; 1760-ban a francia Louis Claude Cadet megszerezte az első szerves arzénvegyületet, amely Cadet folyadék vagy kakodil-oxid néven ismert; ennek képlete [(CH3)2As]2O; 1775-ben Karl Wilhelm Scheele arzénsavat és arzént szerzett; 1789-ben Antoine Laurent független kémiai elemként ismerte fel az arzént.
Az elemi arzén ezüstszürke vagy ónfehér anyag, amely frissen törve fémes fényű. De a levegőben gyorsan elhalványul. 600°C fölé hevítve az arzén olvadás nélkül szublimál, és 37 atm nyomáson 818°C-on megolvad. Az arzén az egyetlen fém, amelynek forráspontja normál nyomáson az olvadáspontja alatt van.
Arzén pusztító fegyver
Még egyszer vissza kell térnünk a 33. számú elem halálos tulajdonságaihoz. Nem titok, hogy széles körben használták, és talán még mindig használják vegyi fegyverek gyártásában, amelyek nem kevésbé bűnösek, mint az atomfegyverek.
Az arzénvegyületek az ismert kémiai harci szerek (CWA) összes fő csoportjába tartoznak. Az általában mérgező anyagok közé tartozik az arzin és az arzén AsH3. Az összes arzénvegyület közül ez a legmérgezőbb: elég fél órán át levegőt lélegezni, amelynek literje 0,00005 g AsH3-at tartalmaz, hogy néhány napon belül a következő világba kerüljünk. A 0,005 g/l AsH3 koncentráció azonnal megöl. Úgy gondolják, hogy az AsH3 biokémiai hatásmechanizmusa az, hogy molekulái „blokkolják” az eritrocita enzim - kataláz - molekuláit; emiatt felhalmozódik a vérben, tönkreteszi azt. Az aktív szén gyengén szívja fel az arzint, ezért egy közönséges gázálarc nem véd az arzin ellen.
Az első világháború alatt próbálkoztak az arzin felhasználásával, de ennek volatilitása és instabilitása segített elkerülni tömeges felhasználását. Most sajnos megvannak a technikai lehetőségek a terület hosszú távú arzinnal való szennyezésére. Bizonyos fémek arzenidjeinek vízzel való reakciójával jön létre. Maguk az arzenidek pedig veszélyesek az emberekre és az állatokra, ezt az amerikai csapatok Vietnamban bebizonyították... Sok fém arzenidjeit is az általános vegyi anyagok közé kell sorolni.
A mérgező anyagok másik nagy csoportja – az irritáló anyagok – szinte teljes egészében arzénvegyületekből áll. Tipikus képviselői a difenil-klór-arzin (C6H5)2AsCl és a difenil-cianoarzin (C6H5)2AsCN.
Az ebbe a csoportba tartozó anyagok szelektíven hatnak a nyálkahártyák idegvégződéseire - főként a felső légutak membránjai. Ez arra készteti a testet, hogy tüsszögéssel vagy köhögéssel reflexszerűen felszabadítsa az irritáló anyagot. A könnyezőszerekkel ellentétben ezek az anyagok még enyhe mérgezés esetén is hatnak azután is, hogy az érintett kikerült a mérgezett légkörből. Néhány órán belül az embert elviselhetetlen fájdalom rázza meg, fájdalom jelentkezik a mellkasban és a fejben, és önkéntelenül is folyni kezdenek a könnyek. Plusz hányás, légszomj, félelemérzet; mindez teljes kimerültséghez vezet, ráadásul ezek az anyagok a szervezet általános mérgezését okozzák.
De elég erről. Az emberiség abban a reményben él, hogy a mérgező anyagokat, amelyekről beszéltünk (és még sok hasonlót), soha többé nem használják fel.
Az arzén a középkori és újkori mérgezők klasszikus mérge
és az orvostudomány a modern sport- és rehabilitációs gyógyászatban
Mérgező és mérgező kövek és ásványi anyagok
Arzén(lat. Arsenicum), As, Mengyelejev periodikus rendszerének V. csoportjába tartozó kémiai elem, 33-as rendszám, 74,9216 atomtömeg; acélszürke kristályok. Az elem egy stabil 75 As izotópból áll. Bármilyen formában mérgező, gyógyszer.
Történelmi hivatkozás.
Az arzén kénnel alkotott természetes vegyületeit (orpiment As 2 S 3, realgar As 4 S 4) ismerték az ókori világ népei, akik ezeket az ásványokat gyógyszerként és festékként használták. Az arzén-szulfidok elégetésének terméke is ismert volt - arzén(III)-oxid As 2 O 3 („fehér arzén”).
Az arsenikon név már korszakunk elején is megtalálható; a görög arzén szóból származik – erős, bátor és az arzénvegyületek jelölésére szolgál (a szervezetre gyakorolt hatásuk alapján). Úgy gondolják, hogy az orosz név a „mysh” szóból származik ("halál" - az arzénkészítmények használata után a jakok leölésére, valamint az egerek és patkányok kiirtására). A szabad arzén kémiai előállítását i.sz. 1250-nek tulajdonítják. 1789-ben A. Lavoisier felvette az arzént a kémiai elemek listájára.
Arzén. Belorechenskoye lelőhely, Észak. Kaukázus, Oroszország. ~10x7 cm Fotó: A.A. Evseev.
Az arzén eloszlása a természetben.
A földkéreg (clarke) átlagos arzéntartalma 1,7 * 10-4% (tömeg), ilyen mennyiségben a legtöbb magmás kőzetben van jelen. Mivel az arzénvegyületek magas hőmérsékleten illékonyak (száraz vulkáni szublimáció a batolitokon), az elem fémgőzök formájában szublimálódik a légkörbe és a levegőbe (mirázsok - a hullámok alatti levegő) nem halmozódik fel a repedéseken és csöveken keresztül szublimálódó magmás lávafolyamatok során. ; koncentrálódik, gőzökből és forró mélyvizekből kristályképző katalizátorokra - fémvasra (S, Se, Sb, Fe, Co, Ni, Cu és más elemekkel együtt) rakódik le.
A vulkánkitörések során (az arzén száraz szublimációja során) az arzén illékony vegyületei formájában kerül a légkörbe. Mivel az arzén többértékű, migrációját a redox környezet befolyásolja. A földfelszín oxidáló körülményei között arzenátok (As 5+) és arzenitek (As 3+) keletkeznek.
Ezek ritka ásványok, amelyek az arzénlelőhelyeken találhatók. A natív arzén és az As 2+ ásványok még ritkábban fordulnak elő. Az ásványok és arzénvegyületek közül (kb. 180) az arzenopirit FeAsS ipari jelentőségű (a vasatom a piritképződés központja, a kiinduló „egykristály” képlete Fe + (As + S)).

Arsenopirit véna. Trifonovskaya bánya, Kochkarskoe lelőhely (Au), Plast, Dél-Ural, Oroszország. Arzén. Fotó: A.A. Evseev.
Kis mennyiségű arzén nélkülözhetetlen az élethez. Az arzénlerakódásokkal és a fiatal vulkánok tevékenységével járó területeken azonban a talaj egyes helyeken akár 1% arzént is tartalmaz, ami az állatbetegségekhez és a növényzet pusztulásához kapcsolódik. Az arzén felhalmozódása különösen jellemző a sztyeppek és sivatagok tájaira, amelyek talajában az arzén inaktív. Nedves éghajlaton, valamint a növények és a talaj öntözése során az arzén kimosódik a talajból.
Az élőanyagban átlagosan 3·10 -5% arzén, a folyókban 3,10 -7%. A folyók által az óceánba szállított arzén viszonylag gyorsan kicsapódik. A tengervízben 1 * 10 -7% arzén van (sok arany van ott, ami kiszorítja), de az agyagokban és palákban van arzén (folyók és tározók partjai mentén, agyagos fekete képződményekben és a víz mentén). kőbányák szélei) - 6,6 * 10 - 4 %. Az üledékes vasércek, ferromangán és más vascsomók gyakran arzénban gazdagodnak.
Az arzén fizikai tulajdonságai.
Az arzénnek számos allotróp módosulata van. Normál körülmények között a legstabilabb az úgynevezett fémes, vagy szürke arzén (α-As) - acélszürke törékeny kristályos tömeg (tulajdonságok szerint - például pirit, arany keverék, vas-pirit); frissen törve fémes fényű, levegőn gyorsan elhomályosul, mivel vékony As 2 O 3 film borítja.
Az arzént ritkán nevezik ezüst keveréknek – a cári hivatalnokok esete A.M. Romanov a 17. század közepén, az „ezüst”, nem képlékeny, por alakú, őrölhető - méreg az egész orosz cár számára. A leghíresebb spanyol botrány a mérgezők kocsmában a Don Quijote malom közelében, a spanyolországi Almadenbe vezető úton, ahol vörös cinóbert bányásznak az európai kontinensen (a szüzek eladásával kapcsolatos botrányok az Orosz Föderáció Krasznodari területén, a faluban of Novy, kristályos vörös cinóber, nem akar dolgozni) .

Arsenopirit. Prizmás kristályok drúza kalcit szferulitokkal. Freiberg, Szászország, Németország. Fotó: A.A. Evseev.
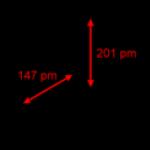
A szürke arzén kristályrácsa romboéder (a = 4,123Å, α szög = 54 o 10", x = 0,226), réteges. Sűrűsége 5,72 g/cm 3 (20 o C-on), elektromos ellenállása 35 * 10 -8 ohm *m, vagy 35*10 -6 ohm*cm, az elektromos ellenállás hőmérsékleti együtthatója 3,9·10 -3 (0 o -100 o C), Brinell keménység 1470 MN/m 2 vagy 147 kgf/mm 2 (3-4 Moocy szerint); az arzén diamágneses.
Légköri nyomáson az arzén 615 o C-on olvadás nélkül szublimál, mivel az α-As hármaspontja 816 o C-on és 36 at nyomáson van.
Az arzéngőz 800 o C-ig As 4 molekulából áll, 1700 o C felett - csak As 2. Amikor az arzéngőz lecsapódik a folyékony levegővel hűtött felületen, sárga arzén képződik - átlátszó, viaszosan lágy kristályok, amelyek sűrűsége 1,97 g/cm 3, tulajdonságai hasonlóak a fehér foszforhoz.
Fénynek vagy alacsony hőnek kitéve szürke arzénné válik. Üveges-amorf módosulatok ismertek: fekete arzén és barna arzén, amelyek 270 o C fölé hevítve szürke arzénná alakulnak.
Az arzén kémiai tulajdonságai.
Az arzénatom külső elektronjainak konfigurációja 3d 10 4s 2 4p 3. A vegyületekben az arzén oxidációs állapota +5, +3 és -3. A szürke arzén kémiailag kevésbé aktív, mint a foszfor. Levegőn 400 o C fölé melegítve az arzén megég, As 2 O 3 képződik.
Az arzén közvetlenül halogénekkel kombinálódik; normál körülmények között az AsF 5 gáz; AsF 3, AsCl 3, AsBr 3 - színtelen illékony folyadékok; Az AsI 3 és az As 2 I 4 vörös kristályok. Ha az arzént kénnel hevítjük, szulfidokat kapunk: narancsvörös As 4 S 4 és citromsárga As 2 S 3.
Halványsárga ezüst-szulfid As 2 S 5 ( arzenopirit) úgy választják le, hogy H 2 S-t arzénsav (vagy sói) jéggel hűtött, füstölgő sósavval készült oldatába vezetnek: 2H 3 AsO 4 + 5H 2 S = As 2 S 5 + 8H 2 O; Kb. 500 o C-on As 2 S 3 -ra és kénre bomlik.
Minden arzén-szulfid nem oldódik vízben és híg savakban. Az erős oxidálószerek (HNO 3 + HCl, HCl + KClO 3 keverékek) H 3 AsO 4 és H 2 SO 4 keverékévé alakítják őket.
Mivel a 2 S 3 szulfid könnyen feloldódik az ammónium és alkálifémek szulfidjaiban és poliszulfidjaiban, savak sóit képezve - tioarzén H 3 AsS 3 és tioarzén H 3 AsS 4 .
Oxigénnel az arzén oxidokat termel: arzén-oxid (III) As 2 O 3 - arzén-anhidrid és arzén-oxid (V) As 2 O 5 - arzén-anhidrid. Az első közülük az oxigén arzénre vagy szulfidjaira gyakorolt hatására jön létre, például 2As 2S 3 + 9O 2 = 2As 2 O 3 + 6SO 2.
Ahogy a 2 O 3 gőzei színtelen üveges masszává kondenzálódnak, amely kis köbös kristályok képződése miatt idővel átlátszatlanná válik, sűrűsége 3,865 g/cm 3 . A gőzsűrűség az As 4 O 6 képletnek felel meg; 1800 o C felett a gőz As 2 O 3-ból áll.
2,1 g As 2 O 3 100 g vízben (25 o C-on) oldódik. Az arzén(III)-oxid amfoter vegyület, túlnyomórészt savas tulajdonságokkal. A H 3 AsO 3 ortoarzénsavnak és a metaarsenikus HAsO 2 -nak megfelelő sók (arzenitek) ismertek; maguk a savak nem kerültek elő. Csak az alkálifém- és ammónium-arzenit oldódik vízben.
Mivel a 2 O 3 és az arzenitek általában redukálószerek (például As 2 O 3 + 2I 2 + 5H 2 O = 4HI + 2H 3 AsO 4), de oxidálószerek is lehetnek (például As 2 O 3 + 3C = 2As + 3CO ).
Az arzén(V)-oxidot arzénsav H 3 AsO 4 (kb. 200 o C) hevítésével állítják elő. Színtelen, körülbelül 500 o C-on As 2 O 3 -ra és O 2 -re bomlik. Az arzénsavat koncentrált HNO 3 As vagy As 2 O 3 hatására állítják elő.
Az arzénsav sói (arzenátok) vízben oldhatatlanok, kivéve az alkálifém- és ammóniumsókat. Ismertek olyan sók, amelyek megfelelnek az ortoarzén H 3 AsO 4, metaarsenic HAsO 3 és piroarzén H 4 As 2 O 7 savaknak; az utolsó két savat nem szabad állapotban kaptuk. Fémekkel ötvözve az arzén többnyire vegyületeket (arzenideket) képez.
Arzén beszerzése.
Az arzént iparilag arzén-pirit hevítésével állítják elő:
FeAsS = FeS + As
vagy (ritkábban) az As 2 O 3 redukciója szénnel. Mindkét eljárást tűzálló agyagból készült retortákban hajtják végre, amelyek az arzéngőz kondenzálására szolgáló tartályhoz vannak csatlakoztatva.
Az arzén-anhidridet arzénércek oxidatív pörkölésével vagy polifémes ércek pörkölésének melléktermékeként nyerik, amelyek szinte mindig tartalmaznak arzént. Az oxidatív pörkölés során As 2 O 3 gőzök keletkeznek, amelyek a gyűjtőkamrákban lecsapódnak.
A nyers As 2 O 3-at 500-600 o C-on szublimálással tisztítják. A tisztított As 2 O 3-at arzén és készítményei előállítására használják.
Az arzén használata.
Kis mennyiségű (0,2-1,0 tömeg%) arzént adnak a lövésgyártáshoz használt ólomba (az arzén növeli az olvadt ólom felületi feszültségét, aminek következtében a lövés gömbszerű formát ölt, az arzén kismértékben növeli ólom keménysége). Az antimon részleges helyettesítőjeként az arzén egyes babbit- és nyomóötvözetekben található.
A tiszta arzén nem mérgező, de minden vegyülete, amely vízben oldódik, vagy gyomornedv hatására feloldódhat, rendkívül mérgező; Az arzénhidrogén különösen veszélyes. A gyártás során használt arzénvegyületek közül az arzén-anhidrid a legmérgezőbb.
Szinte minden színesfém-szulfidérc, valamint a vas (kén) pirit tartalmaz arzén-keveréket. Ezért oxidatív pörkölésük során a kén-dioxiddal együtt SO 2 mindig As 2 O 3 képződik; Nagy része a füstcsatornákban kondenzálódik, de tisztítóberendezések hiányában vagy alacsony hatékonysága esetén az érckemencék kipufogógázai észrevehető mennyiségű As 2 O 3 -ot visznek el.
A tiszta arzén, bár nem mérgező, levegőn tárolva mindig mérgező As 2 O 3 bevonattal van bevonva. Megfelelően elvégzett szellőztetés hiányában a fémek (vas, cink) arzéntartalmú ipari kén- vagy sósavval történő maratása rendkívül veszélyes, mert így arzénhidrogén keletkezik.

Arzén a szervezetben.
Az arzén nyomelemként mindenütt jelen van az élő természetben. Az átlagos arzéntartalom a talajban 4*10 -4%, a növényi hamuban - 3*10 -5%. A tengeri élőlények arzéntartalma magasabb, mint a szárazföldi élőlényekben (halakban 0,6-4,7 mg/1 kg nyersanyag, a májban halmozódik fel).
A legnagyobb mennyiségben (1 g szövetre vetítve) a vesében és a májban található (lenyeléskor nem halmozódik fel az agyban). Sok arzén található a tüdőben és a lépben, a bőrben és a hajban; viszonylag kevés - a cerebrospinális folyadékban, az agyban (főleg az agyalapi mirigyben), az ivarmirigyekben és másokban.
Az arzén főként a szövetekben található fehérje frakció("a testépítők és sportolók köve"), még kevésbé - a savban oldódó, és csak egy kis része található a lipidfrakcióban. Progresszív izomdisztrófia kezelésére alkalmazzák – nem halmozódik fel az agyban és a csontokban (sportdopping, túszok és koncentrációs táborok foglyai, például "Auschwitz" lengyelországi kezelése, EU, 1941-1944).
Az arzén részt vesz a redox reakciókban: összetett biológiai szénhidrátok és cukrok oxidatív lebontásában, fermentációban, glikolízisben stb. Javítja a szellemi képességeket (elősegíti a cukrok lebontásának folyamatát az agyban). Az arzénvegyületeket a biokémiában specifikus enziminhibitorként használják metabolikus reakciók tanulmányozására. Elősegíti a biológiai szövetek lebontását (gyorsítja). Aktívan használják a fogászatban és az onkológiában - a gyorsan növekvő és korai öregedő rákos sejtek és daganatok eltávolítására.
Tallium, arzén és ólom keveréke (kemény szulfidötvözet): Hutchinsonite (Hutchinsonite)


Az ásványi képlet: (Pb, Tl)S` Ag2S * 5 As2 S5 - komplex szulfid és adzenid-karbid só. Rombusz. A kristályok prizma alakúak vagy tű alakúak. A dekoltázs tökéletes a (010) szerint. Az aggregátumok sugárirányú tű alakúak, szemcsések. Keménysége 1,5-2. Fajsúly 4.6. Piros. Gyémánt fénye. Hidrotermikus lerakódásokban dolomittal, Zn, Fe, As és szulfoarzenidek szulfidjaival és arzenideivel. A magma kalderákon és nyílt vulkáni nyílásokon keresztül történő száraz kén- és arzénszublimációja, valamint a Föld forró magmájából származó mély magmás plutonitok repedései révén történő száraz szublimáció eredménye. Ezüstöt tartalmaz. Egyike annak a tíznek az emberi és állati egészségre nagyon veszélyes és rákkeltő kőnek és ásványnak, amely modern körülmények között más kőzetek között káros, egészségre veszélyes (engedély nélküli kezelés esetén) és megtévesztő érces szépség formájában kristályosodik ki. A képen - Hutchinsonite orpimenttel.
Mérgező ásványok. Hutchinsonite - a Cambridge-i Egyetemről származó Hutchinson ásványkutatóról kapta a nevét, és megjelenésében ólomra hasonlít (sugárzás elleni védelemre használható). 1861-ben nyitották meg. Tallium, arzén és ólom halálos keveréke (kemény ötvözete). Ezzel az ásványi anyaggal való érintkezés hajhulláshoz (alopecia, kopaszság, kopaszság), összetett bőrbetegségekhez és halálhoz vezethet. Minden fő összetevője mérgező. Nagyon hasonlít az ólomhoz, a természetes ezüsthöz, a pirithez ("száraz pirit") és az arzenopirithez. Hasonló a stibnithez (antimonvegyület, szintén nagyon mérgező). Hasonló a zeolitokhoz is. A hutchinsonit tallium, ólom és arzén veszélyes és feltűnő karbid keveréke. Három ritka, nagyon drága és értékes ércfém mérgező, halálos ásványi koktélt alkot, amelyet a lehető legnagyobb gondossággal kell kezelni. Egyszerre hat az agyra, a szívre és a májra.
A tallium az ólom sötét párja. Ez a sűrű, zsíros fém atomtömegében hasonló az ólomhoz, de még halálosabb. A tallium egy ritka fém, amely rendkívül mérgező vegyületekben jelenik meg, amelyek furcsa elemek kombinációiból (keményötvözetek) állnak. A tallium expozíciójának hatásai veszélyesebbek, mint az ólom, és közé tartozik a hajhullás (alopecia, kopaszság), a bőrrel való érintkezésből eredő súlyos betegségek és sok esetben a halál. A Hutchinsonitet John Hutchinsonról, a Cambridge-i Egyetem híres ásványkutatójáról nevezték el. Ez az ásvány Európa hegyvidéki vidékein, leggyakrabban érctelepeken található. Az orvosi fogászatban stb. népszerű ásvány. Az alkoholisták félnek az ásványtól.
A Hutchinsonitet (Hutchinsonitet) néha tréfásan „száraznak” vagy „szilárd alkoholnak”, „szilárd alkoholnak” nevezik (és nem csak a mérgezésnek a szervezetre és az emberi egészségre gyakorolt káros hatásai miatt). Az élelmiszer-alkohol (alkohol) kémiai képlete a C2H5 (OH). A Hutchinsonite (Hutchinsonite) kémiai képlete - 5 As2 S5 * (Pb, Tl) S` Ag2 S vagy 5 As2 S5 * (Pb, Tl) S` Ag Ag S. A Hutchinsonite (Hutchinsonite) képletét néha másképp írják át - As2 S5 * ( Pb) + As2 S5 * (Tl) + As2 S5 * S + As2 S5 * Ag + As2 S5 * AgS. A gyártás során a komponensek kémiai szétválasztását a különböző alkoholok típusa szerint is végrehajtják (a tömegben és tömegben eltérő mechanikai dúsítási rétegek, amelyeket ultrahanggal összezúznak és centrifugában vagy vibrációs platformon elválasztanak - az "Aliens" horrorfilm "). A kémiai képlet más hasonló változatai is lehetségesek (az összetétel változó).
ADR 6.1
Mérgező anyagok (méreg)
Belélegzés, bőrrel való érintkezés vagy lenyelés esetén mérgezés veszélye áll fenn. Veszélyes a vízi környezetre vagy a csatornarendszerre
Használjon maszkot, amikor vészhelyzetben elhagyja a járművet
ADR 3
Gyúlékony folyadékok
Tűzveszély. Robbanásveszély. A tárolóedények felrobbanhatnak melegítés hatására (rendkívül veszélyes – könnyen megégnek)
ADR 2.1
Gyúlékony gázok
Tűzveszély. Robbanásveszély. Nyomás alatt lehet. Fulladásveszély. Égési sérülést és/vagy fagyási sérülést okozhat. A tárolóedények felrobbanhatnak melegítés hatására (rendkívül veszélyes – gyakorlatilag nem égnek)
Használjon fedelet. Kerülje az alacsony felületű területeket (lyukak, alföld, árkok)
Piros gyémánt, ADR szám, fekete vagy fehér láng
ADR 2.2
Gázpalack Nem gyúlékony, nem mérgező gázok.
Fulladásveszély. Nyomás alatt lehet. Fagyási sérülést okozhatnak (hasonlóan az égéshez - sápadtság, hólyagok, fekete gáz gangréna - nyikorgás). A tárolóedények hevítés hatására felrobbanhatnak (rendkívül veszélyes - szikra, láng, gyufa robbanás, gyakorlatilag nem égnek el)
Használjon fedelet. Kerülje az alacsony felületű területeket (lyukak, alföld, árkok)
Zöld gyémánt, ADR szám, fekete vagy fehér gázpalack (palack, termosz típusú)
ADR 2.3
Mérgező gázok. Halálfej
Mérgezésveszély. Nyomás alatt lehet. Égési sérülést és/vagy fagyási sérülést okozhat. A tartályok felrobbanhatnak melegítés hatására (rendkívül veszélyes – a gázok azonnali szétterjedése a környező területen)
Használjon maszkot, amikor vészhelyzetben elhagyja a járművet. Használjon fedelet. Kerülje az alacsony felületű területeket (lyukak, alföld, árkok)
Fehér gyémánt, ADR szám, fekete koponya és keresztezett csontok
| A szállítás során különösen veszélyes rakomány neve | Szám ENSZ | Osztály ADR |
| Arzén(III)-oxid ARZÉN-TRIOXID | 1561 | 6.1 |
| 1685 | 6.1 | |
| 1557 | 6.1 | |
| 1561 | 6.1 | |
| Kalcium-arzénsav ARSENÁT VEGYÜLET, SZILÁRD, N.Z.K. szervetlen, beleértve: Arsenati, n.c.c., arzenit, n.c.c., arzén-szulfidok, n.c.c. | 1557 | 6.1 |
| Kalcium-arzenát KALCIUMARZENÁT | 1573 | 6.1 |
| KALCIUM-ARZENÁT | 1573 | 6.1 |
| KALCIUMARZENÁT ÉS KALCIUMARZENIT KEVERÉK, SZILÁRD | 1574 | 6.1 |
| Kalcium-arzenit | 1557 | 6.1 |
| AMMÓNIUMARZENÁT | 1546 | 6.1 |
| Arzén-anhidrid ARZÉN-TRIOXID | 1561 | 6.1 |
| ARSEN | 1558 | 6.1 |
| ARZÉN POR | 1562 | 6.1 |
| Hidrogén arzén Arzin | 2188 | 2 |
| Arzén-szóda oldat | 1556 | 6.1 |
| ARZÉN-BROMID | 1555 | 6.1 |
| ARZÉN-PENTOOXID | 1559 | 6.1 |
| ARSEN VEGYÜLET, FOLYADÉK, N.Z.K. szervetlen, többek között: Arsenati, n.c.c., Arzenit, n.c.c., de arzén-szulfidok, n.c.c. | 1556 | 6.1 |
| ARSEN VEGYÜLET, SZILÁRD, N.Z.K. szervetlen, többek között: Arsenati, n.c.c., Arzenit, n.c.c., de arzén-szulfidok, n.c.c. | 1557 | 6.1 |
| ARZÉN-TRIOXID | 1561 | 6.1 |
| ARZÉN-TRIKLORID | 1560 | 6.1 |
| ARSINE | 2188 | 2 |
| VAS(II)ARZENÁT | 1608 | 6.1 |
| VAS(III)ARZENÁT | 1606 | 6.1 |
| VAS(III)ARZENIT | 1607 | 6.1 |
| KÁLIUMARZENÁT | 1677 | 6.1 |
| KÁLIUMARZENIT | 1678 | 6.1 |
| ARZÉNSAV, SZILÁRD | 1554 | 6.1 |
| ARZÉNSAV, FOLYÉKONY | 1553 | 6.1 |
| MÁGNÉZIUM-ARZENÁT | 1622 | 6.1 |
| RÉZARZENIT | 1586 | 6.1 |
| RÉZ-ACETOARZENIT | 1585 | 6.1 |
| Nátrium-arzénsav NÁTRIUMARZENIT SZILÁRD ANYAG | 2027 | 6.1 |
| Nátrium-arzénsav NÁTRIUMARZENÁT | 1685 | 6.1 |
| NÁTRIUM-AZID | 1687 | 6.1 |
| NÁTRIUMARZENÁT | 1685 | 6.1 |
| NÁTRIUM-ARZENIT SZILÁRD ANYAG | 2027 | 6.1 |
| NÁTRIUM-ARZENIT VIZES OLDAT | 1686 | 6.1 |
| Ón arzenid | 1557 | 6.1 |
| Arzén ón Ón arzenit | 1557 | 6.1 |
| 2760 | 3 | |
| ARZÉN TARTALMÚ ROSZTÍTÓSZER FOLYADÉK, GYÚLÉKONY, MÉRGEZŐ, 23 o C alatti lobbanásponttal | 2760 | 3 |
| ARZÉN TARTALMÚ NÖVÉNYVÉDŐSZER, SZILÁRD, MÉRGEZŐ | 2759 | 6.1 |
| ARZÉN TARTALMÚ NÖVÉNYVÉDŐSZER, FOLYÉKONY, MÉRGEZŐ | 2994 | 6.1 |
| ARZÉN TARTALMÚ NÖVÉNYVÉDŐSZER, FOLYÉKONY, MÉRGEZŐ, GYÚLÉKONY, lobbanáspontja legalább 23 o C | 2993 | 6.1 |
| MERKURY (II) ARSENÁT | 1623 | 6.1 |
| ÓLOM ARSENATHI | 1617 | 6.1 |
| ÓLOMARZENIT | 1618 | 6.1 |
| ARZÉN-SZERVES VEGYÜLET, FOLYÉKONY, N.Z.K. | 3280 | 6.1 |
| ARZÉN-SZERVES VEGYÜLET, SZILÁRD, N.Z.K.* | 3465 | 6.1 |
| EZÜSTARZENIT | 1683 | 6.1 |
| STRONCIUMARZENIT | 1691 | 6.1 |
| CINKARZENÁT, CINKARZENIT vagy CINKARZENÁT ÉS CINKARZENIT KEVERÉK | 1712 | 6.1 |
Néhányan, akik a középkorban kolerában haltak meg, nem haltak bele. A betegség tünetei hasonlóak azokhoz arzénmérgezés.
Miután ezt felismerték, a középkori üzletemberek elkezdték az elem trioxidját méregként kínálni. Anyag. A halálos adag mindössze 60 gramm.
Részletekre osztották, több héten keresztül adták be. Emiatt senki sem gyanította, hogy a férfi nem halt bele kolerába.
Az arzén íze kis adagokban nem érezhető, például ételben vagy italban. A modern valóságban természetesen nincs kolera.
Az embereknek nem kell aggódniuk az arzén miatt. Inkább az egerektől kell félni. A mérgező anyag egyfajta méreg a rágcsálók számára.
Az elemet egyébként az ő tiszteletükre nevezték el. Az „arzén” szó csak az orosz nyelvű országokban létezik. Az anyag hivatalos neve arsenicum.
Megnevezés – As. A sorozatszám 33. Ez alapján feltételezhetjük az arzén tulajdonságainak teljes listáját. De ne tételezzük fel. Mindenképpen megvizsgáljuk a kérdést.
Az arzén tulajdonságai
Az elem latin neve „erős”-nek felel meg. Nyilvánvalóan ez az anyagnak a szervezetre gyakorolt hatására utal.
Ittas állapotban hányás kezdődik, az emésztés felborul, a gyomor megfordul, az idegrendszer működése részben leáll. nem tartozik a gyengék közé.
A mérgezés az anyag bármely allotróp formájából következik be. Az alltrópia ugyanazon dolog megnyilvánulásainak létezése, amelyek szerkezetükben és tulajdonságaiban különböznek egymástól. elem. Arzén legstabilabb fém formában.
Az acélszürke romboéderek törékenyek. Az egységek jellegzetes fémes megjelenésűek, de nedves levegővel érintkezve fénytelenné válnak.
Arzén - fém, amelynek sűrűsége közel 6 gramm köbcentiméterenként. Az elem többi formájának mutatója alacsonyabb.
A második helyen amorf arzén. Az elemek jellemzői: - majdnem fekete színű.
Ennek a formának a sűrűsége 4,7 gramm köbcentiméterenként. Külsőleg az anyag hasonlít.
A hétköznapi emberek szokásos arzénállapota sárga. A köbös kristályosodás instabil, és 280 Celsius fokra hevítve vagy egyszerű fény hatására amorf lesz.
Ezért a sárgák puhák, mint a sötétben. A szín ellenére az aggregátumok átlátszóak.
Az elem számos módosításából egyértelmű, hogy ez csak fél fém. A kérdésre egyértelmű válasz: „ Az arzén fém vagy nem fém", Nem.

A kémiai reakciók megerősítésként szolgálnak. A 33. elem savképző. A savban való tartózkodás azonban önmagában nem ad.
A fémek másképp csinálják a dolgokat. Az arzén esetében még az egyik legerősebbvel való érintkezéskor sem működnek.
Sószerű vegyületek „születnek” az arzén és az aktív fémek reakciói során.
Ez az oxidálószerekre vonatkozik. A 33. anyag csak velük lép kölcsönhatásba. Ha a partner nem rendelkezik kifejezett oxidáló tulajdonságokkal, a kölcsönhatás nem megy végbe.
Ez még a lúgokra is vonatkozik. vagyis Az arzén kémiai elem elég inert. Hogyan érheti el, ha a reakciók listája nagyon korlátozott?
Arzénbányászat
Az arzént más fémek melléktermékeként bányászják. Elkülönülnek, így marad a 33. szubsztancia.
A természetben vannak az arzén vegyületei más elemekkel. Tőlük nyerik ki a 33. fémet.
Az eljárás jövedelmező, mert az arzénnel együtt gyakran , , és .
Szemcsés tömegben vagy ón színű köbös kristályokban található. Néha sárga árnyalat van.
Arzén vegyületÉs fém A Ferrumnak van egy „testvére”, amelyben a 33. szubsztancia helyett a . Ez egy közönséges pirit, arany színű.
Az aggregátumok hasonlóak az arzénes változathoz, de nem szolgálhatnak arzénércként, bár szennyeződésként arzént is tartalmaznak.
Az arzén egyébként a közönséges vízben is előfordul, de ismét szennyeződésként.

A tonnánkénti elem mennyisége olyan kicsi, de még a melléktermékbányászatnak sincs értelme.
Ha a világ arzénkészletei egyenletesen oszlanak el a földkéregben, akkor csak 5 gramm lenne tonnánként.
Tehát az elem nem közös, mennyisége összehasonlítható a , , .
Ha megnézi azokat a fémeket, amelyekkel az arzén ásványokat képez, akkor ez nem csak a kobaltnál és a nikkelnél van így.
A 33. elem összes ásványi száma eléri a 200-at. Az anyag natív formája is megtalálható.
Jelenlétét az arzén kémiai tehetetlensége magyarázza. Olyan elemek mellett képződve, amelyekkel nincs reakció, a hős csodálatos elszigeteltségben marad.
Ebben az esetben gyakran tű alakú vagy köbös aggregátumokat kapnak. Általában együtt nőnek.
Az arzén használata
Az arzén elemhez tartozik kettős, nemcsak fém és nem fém tulajdonságait mutatja.
Az elem emberi felfogása is kettős. Európában a 33. anyagot mindig is méregnek tartották.
1733-ban még rendeletet is adtak ki, amely megtiltotta az arzén adásvételét.
Ázsiában a „mérget” az orvosok 2000 éve használják a pikkelysömör és a szifilisz kezelésére.
A modern orvosok bebizonyították, hogy a 33. elem megtámadja az onkológiát kiváltó fehérjéket.
A 20. században néhány európai orvos is az ázsiaiak oldalára állt. 1906-ban például nyugati gyógyszerészek találták fel a salvarsan gyógyszert.

Ez lett az első a hivatalos gyógyászatban, és számos fertőző betegség ellen alkalmazták.
Igaz, a gyógyszerrel szembeni immunitás, mint az arzén kis dózisú állandó bevitele, kialakul.
A gyógyszer 1-2 kúrája hatásos. Ha az immunitás kialakult, az emberek halálos adagot vehetnek be az elemből, és életben maradhatnak.
Az orvosok mellett a kohászok is érdeklődtek a 33. elem iránt, és elkezdték hozzáadni a sörét előállításához.
Azon az alapon készül, ami benne van nehéz fémek. Arzén növeli az ólmot és lehetővé teszi, hogy kifröccsenései gömb alakúak legyenek öntéskor. Helyes, ami javítja a tört minőségét.
Arzén is megtalálható a hőmérőkben, vagy inkább azokban. Bécsinek hívják, a 33-as anyag oxidjával keverve.
A vegyület derítőszerként szolgál. Az arzént az ókorban az üvegfúvók is használták, de mattító adalékként.
Az üveg átlátszatlanná válik, ha jelentős mennyiségű mérgező elem van benne.

Az arányokat megfigyelve sok üvegfúvó megbetegedett és idő előtt meghalt.
A bőrgyári szakemberek pedig szulfidokat használnak arzén.
Elem fő- alcsoportok Egyes festékekben a periódusos rendszer 5. csoportja szerepel. A bőriparban az arzén segít eltávolítani a szőrt.
Arzén ára
A tiszta arzént leggyakrabban fémes formában kínálják. Az árakat kilogrammonként vagy tonnánként határozzák meg.
1000 gramm körülbelül 70 rubelbe kerül. A kohászok számára készen kínálnak például arzént és rezet.
Ebben az esetben kilónként 1500-1900 rubelt számítanak fel. Az arzén-anhidritet kilogrammban is árulják.
Bőrgyógyszerként használják. Az ágens nekrotikus, azaz elzsibbad az érintett terület, és nemcsak a betegség kórokozóját, hanem magukat a sejteket is elpusztítja. A módszer radikális, de hatékony.
Az arzén nem fém, és kémiai tulajdonságaiban hasonló vegyületeket képez. A nem fémes tulajdonságok mellett azonban az arzén fémes tulajdonságokkal is rendelkezik. Normál körülmények között levegőben az arzén enyhén oxidálódik a felületről. Az arzén és analógjai sem vízben, sem szerves oldószerekben nem oldódnak.
Az arzén kémiailag aktív. Normál hőmérsékletű levegőben még a tömör (olvasztott) fémarzén is könnyen oxidálódik; hevítéskor a por alakú arzén meggyullad és kék lánggal ég, As 2 O 3 oxidot képezve. Termikusan kevésbé stabil nem illékony oxid Mint 2 O 5 is ismert.
Melegítve (levegő hiányában), Szublimál (szublimációs hőmérséklet 615 o C). A gőz As 4 molekulából áll, jelentéktelen (körülbelül 0,03%-os) As 2 molekula keverékével.
Az arzén az oxidáló-redukáló elemek csoportjába tartozik. Erős redukálószerek hatására oxidáló tulajdonságokat mutat. Így a felszabadulás pillanatában fémek és hidrogén hatására képes a megfelelő fém- és hidrogénvegyületek előállítására:
6Ca +As 4 = 2Ca 3 As 2
Erős oxidálószerek hatására az arzén három- vagy ötértékű állapotúvá alakul. Például levegőben hevítve az oxigénnel oxidált arzén megég és fehér füstöt képez - arzén(III)-oxid As 2 O 3:
As 4 + 3O 2 =2As 2 O 3
Az arzén-oxid gázfázisban stabil formái a szeszkvioxid (arzén-anhidrid) As 2 O 3 és dimerje As 4 O 6. 300 o C-ig a gázfázisban a fő forma a dimer, e felett a hőmérséklet észrevehetően disszociál, és 1800 o C felett a gáznemű oxid gyakorlatilag monomer As 2 O 3 molekulákból áll.
As 4 O 6 és As 2 O 3 gázhalmazállapotú keveréke képződik az As oxigénben történő elégetése során, az As szulfid ásványok, például arzenopirit, színesfémércek és polimerércek oxidatív pörkölése során.
Amikor az As 2 O 3 (As 4 O 6) gőz 310 o C felett lecsapódik, az As 2 O 3 üveges formája képződik. A gőz 310 o C alatti lecsapódásakor az arzenolit színtelen polikristályos köbös módosulata képződik. Az As 2 O 3 minden formája jól oldódik savakban és lúgokban.
As(V)-oxid (arzén-anhidrid) As 2 O 5 – az ortorombikus rendszer színtelen kristályai. Melegítéskor az As 2 O 5 As 4 O 6 -ra (gáz) és O 2 -re disszociál. Az As 2 O 5-öt a H 3 AsO 4 koncentrált oldatainak dehidratálásával, majd a kapott hidrátok kalcinálásával állítják elő.
Ismeretes az As 2 O 4 oxid, amelyet As 2 O 3 és As 2 O 5 szinterelésével állítanak elő 280 o C-on vízgőz jelenlétében. Ismeretes a gáznemű AsO-monoxid is, amely elektromos kisülés során képződik As-trioxid gőzben csökkentett nyomáson.
Vízben oldva az As 2 O 5 ortoarzén H 3 AsO 3 vagy As(OH) 3 és metaarsenikus HAsO 2 vagy AsO(OH) képződik, amelyek csak oldatban léteznek, és amfoter, túlnyomórészt savas tulajdonságokkal rendelkeznek.
A savakkal kapcsolatban az arzén a következőképpen viselkedik:
— az arzén nem lép reakcióba sósavval, de oxigén jelenlétében arzén-triklorid AsCl 3 képződik:
4As +3O2 +12HCl = 4AsCl3 +6H2O
- híg salétromsav, hevítéskor az arzént oxidálják orthorzén sav H 3 AsO 3 és tömény salétromsav – ortoarzénsav H 3 AsO 4:
3As + 5HNO 3 + 2H 2 O = 3H 2 AsO 4 + 5NO
Ortoarzénsav(arzénsav) H 3 AsO 4 *0,5H 2 O – színtelen kristályok; olvadáspont – 36 o C (bomlás közben); vízben oldódik (88 tömeg% 20 o C-on); nedvszívó; vizes oldatokban – hárombázisú sav; kb. 100 o C-ra melegítve vizet veszít, piroarzénsavvá alakul H 4 As 5 O 7, magasabb hőmérsékleten metaarsensavvá HAsO 3. Az As vagy As 2 O 3 koncentrált HNO 3 -mal történő oxidációjával nyerik. Vízben könnyen oldódik, erőssége megközelítőleg megegyezik a foszforral.
Az arzénsav oxidáló tulajdonságai csak savas környezetben észrevehetők. Az arzénsav reverzibilis reakciókkal képes a HI-t I2-vé oxidálni:
H 3 AsO 4 + 2HI = H 3 AsO 3 + I 2 + H 2 O
Orthoarsenic sav (arzénsav) H 3 AsO 3 csak vizes oldatban létezik; gyenge sav; As 2 O 3 vízben való feloldásával nyerik; köztes termék arzenit (III) és más vegyületek előállításánál.
- tömény kénsav reakcióba lép az arzénnel az alábbi egyenlet szerint, és képződik orthorzén savak:
2As + 3H 2SO 4 = 2H 3 AsO 3 + 3SO 2
- a lúgos oldatok oxigén hiányában nem lépnek reakcióba az arzénnel. Amikor az arzént lúgokkal forralják, az arzénsav H 3 AsO 3 sójává oxidálódik. Lúgokkal összeolvasztva arzin (arzén hidrogén) AsH 3 és arzenátok (III) keletkeznek. Vigyen fel AsH-t 3
félvezető anyagok arzénnal történő adalékolásához nagy tisztaságú As elérése érdekében.
Ismeretesek az instabil magasabb arzinok: diarzin Mint 2 H 4, már -100 o C-on lebomlik; triarzin As 3 H 5 .
A fémes arzén könnyen reagál halogénekkel, illékony halogenideket adva AsHal 3:
Mint +3Cl 2 = 2AsCl 3
Az AsCl 3 színtelen olajos folyadék, amely levegőben füstölög, és megszilárdulva gyöngyházfényű kristályokat képez.
A C F 2 AsF 5 - pentafluoridot is képez - színtelen gáz, amely vízben és lúgoldatokban (kis hővel), dietil-éterben, etanolban és benzolban oldódik.
A porított arzén spontán meggyullad F 2 és Cl 2 környezetben.
S, Se és Te esetén az arzén képezi a megfelelőt kalkogenidek:
szulfidok - As 2 S 5, As 2 S 3 (orpiment ásvány a természetben), As 4 S 4 (realgar ásvány) és As 4 S 3 (dimorfit ásvány); szelenidek – As 2 Se 3 és As 4 Se 4; tellurid – As 2 Te 3 . Az arzénkalkogenidek levegőben stabilak, vízben nem oldódnak, lúgos oldatokban jól oldódnak, melegítéskor pedig HNO 3 -ban. Félvezető tulajdonságokkal rendelkeznek, és átlátszóak a spektrum infravörös tartományában.
A legtöbb fémnél fémvegyületeket ad - arzenidek. Gallium-arzenid és indium arzenid– fontos félvezető vegyületek.
Számos ismert arzénszerves kapcsolatokat. A szerves arzénvegyületek As-C kötést tartalmaznak. Néha a szerves arzénvegyületek közé tartozik minden As-t tartalmazó szerves vegyület, például az arzénsav (RO) 3 As és az arzénsav (RO) 3 AsO észterei. A szerves arzénvegyületek legnagyobb csoportja a 3-as koordinációs számmal rendelkező As származékok. Ide tartoznak az R n AsH 3-n szerves arzinok, az R 2 As-AsR 2 tetraorganodiarzinok, a ciklikus és lineáris poliarganoarzinok (RAs) n, valamint az organoarszonos és diarganoarzinok. savak és származékaik R n AsX 3-n (X= OH, SH, Hal, OR', NR 2' stb.). A legtöbb szerves arzén vegyület folyadék, poliorganoarzin és szerves sava A szilárd anyagokhoz hasonlóan a CH 3 AsH 2 és a CF 3 AsH 2 gázok. Ezek a vegyületek általában szerves oldószerekben oldódnak, vízben korlátozottan oldódnak, és viszonylag stabilak oxigén és nedvesség hiányában. Egyes tetraorganodiarzinok levegőben gyúlékonyak.