A hidrogén-peroxid katalitikus bomlásának reakciója. Hidrogén-peroxid bontási katalizátorok. Feladatok és kérdések
És a természeti erőforrások
Kémiai és Ökológiai Tanszék
A BOMLÁSI REAKCIÓ SEBESSÉGÉNEK VIZSGÁLATA
HIDROGÉN-PEROXID KATALIZÁTOR JELENLÉTÉBEN
GAZOMETRIAI MÓDSZERREL.
a "Fizikai és kolloid kémia" tudományágban
szakkörre 060301.65 − Gyógyszertár
Velikij Novgorod
1 A munka célja………………………………………………………………………………..3
2 Elméleti alapelvek…………………………………………….3
4 Kísérleti rész…………………………………………………………4
4.1 A hidrogén-peroxid lebontása mangán-dioxid MnO2 jelenlétében…………………………………………………………………………………………….4
4.2 Hidrogén-peroxid lebontása katalizátor jelenlétében T2 hőmérsékleten................................................. ................................................................ ................................................6
5 A jelentés tartalmára vonatkozó követelmények…………………………………………………..6
6 Minta tesztkérdések és feladatok………………………………7
1 A MUNKA CÉLKITŰZÉSEI
1. Határozza meg a sebességi állandót, a reakció sorrendjét, a felezési időt T1 hőmérsékleten!
2. Készítsen grafikont a felszabaduló O2 mennyiségéről az idő függvényében, és határozza meg grafikusan a felezési időt.
3. Határozza meg a reakció aktiválási energiáját, számítsa ki a reakciósebesség hőmérsékleti együtthatóját!
2 ELMÉLETI ALAPVETŐ RENDELKEZÉSEK
A hidrogén-peroxid felhasználása számos technológiai folyamatban, az orvostudományban és a mezőgazdaságban oxidáló tulajdonságain alapul. A H2O2 bomlási folyamata vizes oldatokban spontán módon megy végbe, és a következő egyenlettel ábrázolható:
Н2О2®Н2О +1/2 О2
A folyamat katalizátor segítségével gyorsítható. Ezek lehetnek anionok és kationok, például CuSO4 (homogén katalízis). A szilárd katalizátorok (szén, fémek, sók és fém-oxidok) szintén gyorsító hatással vannak a H2O2 bomlására. A H2O2 bomlás heterogén katalitikus reakciójának lefolyását a közeg pH-ja, a felület állapota, valamint a katalitikus mérgek, például C2H5OH, CO, HCN, H2S befolyásolják.
A növények, állatok és emberek sejtjeiben a hidrogén-peroxid katalitikus bomlása is megtörténik. Az eljárást a kataláz és peroxidáz enzimek hatására hajtják végre, amelyek a nem biológiai természetű katalizátorokkal ellentétben kivételesen magas katalitikus aktivitással és hatásspecifitással rendelkeznek.
A H2O2 bomlását O2 felszabadulása kíséri. A felszabaduló oxigén térfogata arányos a lebontott hidrogén-peroxid mennyiségével. A munka gázometrikus módszert alkalmaz.
3 BIZTONSÁGI KÖVETELMÉNYEK
Ennek a laboratóriumi munkának az elvégzésekor be kell tartania a kémiai laboratóriumban végzett munka általános szabályait.
4 KÍSÉRLETI RÉSZ
4.1 A hidrogén-peroxid bomlása mangán-dioxid jelenlétébenMnO2 .
A kísérlet megkezdése előtt el kell készíteni egy katalizátort: egy kis üvegrudat kenjünk be BF ragasztóval vagy keményítőpasztával. Csak a végét kell megkenni ragasztóval, az óraüvegre önteni kevés MnO2 port, a pálcika végét a porhoz érinteni, hogy egy kis mennyiségű MnO2 maradjon az üvegen. A ragasztót néhány percig (1-2 percig) szárítjuk. A H2O2 gyűjtésére szolgáló rendszerben a nyomást légköri nyomásra kell hozni: nyissa ki a reakciócső dugóját, és egy kiegyenlítő lombikkal állítsa nullára a bürettában lévő vízszintet.
A H2O2 bomlási sebességét mérő készülék diagramja az 1. ábrán látható.
víz
 |
kémcső H2O2-val
Gif" width="10">.gif" width="10"> katalizátor
1. ábra – Eszköz a H2O2 bomlás kinetikájának tanulmányozására.
Pipettával vagy mérőhengerrel mérjünk ki 2 ml 3%-os H2O2 oldatot és öntsük az 1. kémcsőbe. Ha a kísérletet szobahőmérsékleten végezzük, készítsünk stopperórát és egy táblázatot a kísérleti adatok rögzítéséhez Merítsük be a felvitt katalizátort egy darab üvegrudat a kémcsőbe. Zárja le a reakcióedényt egy dugóval. Először 30 másodperc elteltével jegyezze fel a felszabaduló oxigén mennyiségét, majd az intervallumot 1 percre növelheti.
A bürettában lévő folyadékszint csökkenésével a kiegyenlítő lombik leereszkedik, hogy a folyadékszint a bürettában és a lombikban ne változzon, a szintkülönbség minimális.
A reakció akkor tekinthető befejezettnek, ha a bürettában a folyadékszint csökkenése megszűnik.
A H2O2 –V¥ teljes lebomlásának megfelelő oxigéntérfogat akkor érhető el, ha a reakcióedényt egy pohár forró vízbe helyezzük. A kémcső szobahőmérsékletre hűtése után. Ezután meghatározzuk a H2O2 teljes lebomlásának megfelelő O2 térfogatát.
táblázat - Kísérleti adatok
Feltételezve, hogy a reakció elsőrendű, a reakció sebességi állandóját az elsőrendű kinetikai egyenlet segítségével számítjuk ki:
A kísérlet eredményei alapján kiszámítjuk a reakciósebesség-állandó átlagos értékét.
A hidrogén-peroxid felezési idejét a következő egyenlettel számítjuk ki:
t0,5 = 0,693/k a sebességi állandó átlagértékével.
A sebességi állandót és a felezési időt grafikusan határozzuk meg a Vt = f (t) és ln(V¥ – Vt) = f (t) függéssel, amelyeket a 2. és 2. ábra mutat be. 3. Hasonlítsa össze a kapott eredményeket két módszerrel - analitikai és grafikus.

V¥https://pandia.ru/text/80/128/images/image032_11.gif" width="211" height="12">.gif" width="616" height="64">
t, menta t, min
Rizs. 2 – Függőség Vt = f(t) 3. ábra – Függőség ln(V¥ – Vt) = f(t)
4.2 Hidrogén-peroxid lebontása katalizátor jelenlétében T2 hőmérsékleten
A kísérletet megismételjük úgy, hogy a reakcióedényt vízfürdőbe vagy egy pohár vízbe helyezzük T2 hőmérsékleten (a tanár utasítása szerint). Az adatok bekerülnek a táblázatba:
Ismerve a k1 és k2 sebességi állandókat két különböző hőmérsékleten, az Arrhenius-egyenlet segítségével kiszámíthatjuk az Ea aktiválási energiát:
Ea = 
Ezenkívül kiszámíthatja a hőmérsékleti együtthatót a Van't Hoff-szabály segítségével:
k2/k1 = γ ∆t/10
5 JELENTÉS TARTALMI KÖVETELMÉNYEI
A jelentésnek tartalmaznia kell:
1. a munka célja;
2. a peroxid bomlása során felszabaduló oxigén térfogatának mérési eredményei;
3. a hidrogén-peroxid reakciósebesség-állandójának és felezési idejének (félkonverziójának) kiszámítása;
4. a Vt = f(t) függés grafikonja és a hidrogén-peroxid felezési idejének grafikus meghatározása;
5. ln(V¥ – Vt) = f(t) grafikonja a reakciósebesség állandó meghatározásához;
6. a peroxid bomlása során felszabaduló oxigén térfogatának mérési eredményei magas hőmérsékleten és a reakciósebesség állandó kiszámítása;
7. az aktiválási energia kiszámítása az Arrhenius-egyenlet segítségével és a reakciósebesség hőmérsékleti együtthatójának kiszámítása a van’t Hoff-szabály segítségével;
8. következtetések.
6 MINTA TESZT KÉRDÉSEK ÉS FELADATOK
1. A reakciósebesség állandó a következőktől függ:
a) a reagensek jellege;
b) hőmérséklet;
c) a reagensek koncentrációi;
d) a reakció kezdete óta eltelt idő.
2. A reakció sorrendje
a) formai érték;
b) csak kísérletileg határozták meg;
c) elméletileg kiszámítható;
d) egyenlő a p + q kitevők összegével, a υ = k · CAp · CBq egyenletben.
3. Kémiai reakció aktiválási energiája
a) energiatöbblet a molekulák átlagos energiájához képest, amely a molekulák ütközésének aktiválásához szükséges;
b) a reagensek természetétől függ;
c) J/mol-ban mérve;
d) növekszik, ha katalizátort vezetünk a rendszerbe.
4. Egy bizonyos radioaktív izotóp felezési ideje 30 nap. Számítsa ki azt az időt, amely után az izotóp mennyisége az eredeti 10%-a lesz!
5. Egy elsőrendű reakció bizonyos hőmérsékleten 30 perc alatt 25%-kal megy végbe. Számítsa ki a kiindulási anyag felezési idejét!
6. Hányszorosára nő a reakciósebesség, ha a hőmérséklet 40K-kal emelkedik, ha a reakciósebesség hőmérsékleti együtthatója 3?
7. A hőmérséklet 40 K-vel történő emelésével egy bizonyos reakció sebessége 39,06-szorosára nőtt. Határozza meg a reakciósebesség hőmérsékleti együtthatóját!
Kémia és kémiai technológia
Cikkek Rajzok Táblázatok Az oldalról MagyarHidrogén-peroxid bontási katalizátorok
A peroxidvegyületek bomlása bizonyos fémek (vas, réz, mangán, kobalt, króm) és sóik jelenlétében megy végbe, amelyek katalizátorok. Ezért a koncentrált hidrogén-peroxid, perecetsav és számos más peroxid szerves anyagok hiányában felrobbanhat.A 80-90%-os hidrogén-peroxid gyakorlati alkalmazásra talált egykomponensű üzemanyagként. A V-2 rakétában segédüzemanyagként használták ember-gáz keverék kialakításához, melynek segítségével a rakétahajtóművet üzemanyagot szállító szivattyúk turbináit hajtják. A hidrogén-peroxid lebontását szilárd vagy folyékony katalizátorok segítségével végezzük.
Az ólom az egyik legaktívabb heterogén katalizátor. Ennek a katalitikus eljárásnak különböző minőségi jellemzőit publikálták, nevezetesen, hogy a kétértékű ólom savas oldatban nincs hatással a hidrogén-peroxidra, lebontásához ezüst közeg szükséges, amelyben ólom-dioxid képződik. E katalízis mechanizmusának tanulmányozása eredményeként arra a következtetésre jutottunk, hogy a kétértékű ólom Pb(OH) közötti redox ciklusként írható le. és ólom ólom PbzO. A nagy katalitikus aktivitás feltételei akkor állnak fenn, ha mindkét anyag szilárd fázisként van jelen erősen lúgos oldatban, és magasabb oxidok képződnek. A különböző pH-tartományok hatása a következőképpen jellemezhető. Az ólom-nitrát hidrogén-peroxidban oldódik, tiszta, stabil oldatokat képezve. Lúg hozzáadásakor fehéressárga csapadék képződik, és csekély aktivitás lép fel. További lúg hozzáadásával a csapadék narancsvörös színűvé válik, és megindul a peroxid gyors bomlása. Mint kiderült, az e pont eléréséhez szükséges lúgmennyiség fordítottan arányos az oldott ólom mennyiségével, ez a jelenség az öregedés még nem tisztázott hatására rakódik rá. A katalízis leállításához szükséges pirofoszfát mennyisége megközelítőleg megegyezik az ólom-pirofoszfát Pb P O képzéséhez szükséges mennyiséggel. A katalitikus aktivitás csúcspontja körülbelül 0,2 N. lúgkoncentráció esetén magasabb koncentrációknál az ólom oldhatósága plumbit és plumbát formájában növekszik és a katalitikus aktivitás csökken. Kísérlet történt a ciklikus oxidációs-redukciós folyamat jelenlétének bizonyítására radioaktív nyomjelzőkkel, de ez kudarccal végződött, mivel hidrogén-nitrát hiányában is csere történik a kétértékű ólomion és az ólom-dioxid között a salétromban. sav (ami megfelel az irodalmi adatoknak) és a Plu.mbit és a Plumbate között bázikus oldatban (ami ellentmond a publikált adatoknak
A katalizátor felületének növelésének a katalitikus aktivitására gyakorolt hatása egy példával szemléltethető. A hidrogén-peroxid vízre és oxigénre bomlik. Ennek a folyamatnak a katalizátora a platina. Simára őrölt platina felületen a H2O2 bomlási reakciója szinte nem gyorsul fel. Az érdes felületen gyenge oxigénfelszabadulás figyelhető meg. A porított platina meglehetősen gyorsan lebontja a hidrogén-peroxidot a platinafeketén, a folyamat nagyon energikusan megy végbe, és a platina kolloid oldatának hozzáadása heves reakcióhoz vezet, amelyet néha robbanás kísér.
Az ólomvegyületek aktív bomlási katalizátorok. Az ólomberendezések csak olyan körülmények között használhatók sikeresen, ahol szulfátok vannak jelen, ami inert ólom-szulfát bevonat képződését okozza. Egyes esetekben ólmot használnak olyan üzemekben, amelyek elektrolitikus peroxodiszulfát eljárással állítanak elő hidrogén-peroxidot, illetve a nyers gyapjú fehérítésénél szulfátok jelenlétében. Azonban az ólom bármilyen, de nagyon híg peroxid oldattal érintkezve veszélyes lehet, ezért kerülni kell.
A hidrogén-peroxid oldatok tárolása során negatív katalizátorokat használnak, hogy megakadályozzák annak lebomlását. Ilyen katalizátorként, úgynevezett stabilizátorként kis mennyiségű foszforsav, szalicilsav és húgysav használható (például 1 g húgysav elegendő 30 liter tömény peroxidhoz), amelyek megvédik a hidrogén-peroxidot a bomlástól.
A szilárd hidrogén-peroxid szokatlanul inert. Például, ha lehűtjük, 0,5 N-t vezetünk a 90%-os hidrogén-peroxidba -55°-on. permanganát oldatot, rozsdarészecskéket vagy más katalizátorokat, és ne hagyja, hogy a peroxid felolvadjon; bomlás egyáltalán nem figyelhető meg. A bomlás csak megolvadás után kezdődik.
Minél tisztább a hidrogén-peroxid, annál lassabban bomlik le a tárolás során. A H2O2 lebontásának különösen aktív katalizátorai bizonyos fémek (Cp, Fe, Mn stb.) vegyületei, és ezek nyomai is észrevehetőek, analitikailag közvetlenül nem határozhatók meg. E fémek megkötésére kis mennyiségű (körülbelül 1 10 000) nátrium-pirofoszfátot - N34P207 - gyakran adnak a hidrogén-peroxidhoz stabilizátorként.
A gőzgáz generátor egy kamra, amelyben a katalizátort helyezik el. A hidrogén-peroxidot a kamrába táplálják, ahol vízgőzre és oxigénre bomlik, hő szabadul fel. Folyékony katalizátor is használható a hidrogén-peroxid lebontására. Ebben az esetben a gőz-gáz generátor kamrája a folyékony katalizátor hidrogén-peroxiddal való összekeverésére és az utóbbi lebontására szolgáló kamra.
A H2O2 nagyon tömény (80%-os és magasabb) vizes oldatait egymástól függetlenül energiaforrásként használják (a H2O2 gyors lebontására szolgáló katalizátorok segítségével egy liter folyékony hidrogén-peroxidból kb. 5000 liter oxigénkeveréket kaphatunk és 700 °C-ra melegített vízgőz), valamint sugárhajtómű-üzemanyagok oxidálószereként. A hidrogén-peroxidot oxidálószerként is használják a vegyiparban, számos peroxidvegyület előállításának kiindulási anyagaként, polimerizációs folyamatok iniciátoraként, valamint egyes porózus termékek gyártásánál. borok mesterséges érlelésére, hajfestésre, folteltávolításra stb.
A hidrogén-peroxidot széles körben használják gőzgáz előállítására a rakétahajtórendszer turbószivattyú-egységének működtetéséhez. A szivattyú működését biztosító tüzelőanyagnak egyrészt kellően magas energiamutatókkal kell rendelkeznie a szivattyúk minimális költséggel történő működéséhez, másrészt viszonylag alacsony égési hőmérséklettel kell rendelkeznie. A turbószivattyús egység hajtásához legszélesebb körben használt egykomponensű üzemanyag a 80-85%-os hidrogén-peroxid. A hidrogén-peroxid 80%-ának lebontásakor 450-500°C hőmérsékletű gőzgáz keletkezik.A gőzgáz előállítása során a peroxidon kívül egy katalizátor is elfogy. Egy kilogramm peroxid lebontásához 0,05 kg folyékony katalizátort használnak fel, amely NaMn04 (nátrium-permanganát) 35%-os alkoholos oldata.
Matheson és Maas adiabatikus kaloriméterben meghatározták a hidrogén-peroxid 10 grammos oldatának bomláshőjét. Mangán-dioxidot használtak bomlási katalizátorként. E szerzők szerint a bomlás hirtelen véget ért, és a szerzők nem vezettek be korrekciót a maradék hidrogén-peroxidra vonatkozóan. A vízgőzre korrekciót végeztünk, és kiszámítottuk a kaloriméter vízegyenértékének egy részét. A hígítási hő lineáris extrapolálásával négy meghatározás átlaga alapján (két meghatározás 38,05%-os peroxiddal és kettő 97,15%-os peroxiddal) számítottuk ki a vízmentes hidrogén-neroxid bomláshőjét (-23,45 kcal/mol).
A bomlási reakciók jellemzőek a rakéta üzemanyag-komponenseire, amelyek endoterm anyagok. Normál hőmérsékleten általában hosszú ideig tárolhatók bomlás nélkül, de a hőmérséklet emelkedésével vagy katalizátor hatására megindul a bomlás, amely a keletkező hő hatására öngyorsul. Így a 350 °C-ra melegített hidrazin teljesen nitrogénné és ammóniává bomlik, vas-, króm-, réz- és egyéb katalizátorok jelenlétében pedig sokkal intenzívebben. Jellegzetes anyag, amely hőkibocsátással képes lebomlani, a hidrogén-peroxid. Tiszta formájában meglehetősen stabil, és csak 140°C fölé melegítve kezd el vízzé és oxigénné bomlani hő felszabadulásával. Az abszolút tiszta H2O2 forrásig melegíthető (151,4 °C) és bomlás nélkül desztillálható, de a hidrogén-peroxidot melegítő edény falán a legkisebb karcolások is bomlást okozhatnak. A peroxid bomlási sebessége függ koncentrációjától, pH-értékétől, hőmérsékletétől, a bomlást katalizáló szennyeződések vagy stabilizátorok természetétől és mennyiségétől, valamint a H2O2-t tartalmazó edények felületének fizikai és kémiai természetétől.
Az elemi szén nem lép sztöchiometrikus reakcióba a hidrogén-peroxiddal, bár a keletkező bomlás bizonyos fokú változást okoz a szén felületében. Roop és Schlee arról számolt be, hogy a hidrogén-peroxid a karbonátot hangyasavvá és formaldehiddé oxidálja, később
A cink szokatlan tulajdonságokkal rendelkezik, katalizátorként és stabilizátorként is funkcionálhat. A 451. oldalon leírtak szerint a cink 90%-os hidrogén-peroxid oldatban stabilizáló hatású. Megfigyelték [1153], hogy a hidrogén-peroxid koncentrációjának csökkenésével ez a hatás gyengül, és a 40 tömeg% alatti oldatokban. % hidrogén-peroxid, a cink már bomlási katalizátorként működik. Ezt a katalitikus hatást más katalizátorokkal való keverékekben is megtalálták. Weiss 156] kimutatta, hogy a fémes cink lebontja a hidrogén-peroxidot, és hidrogént és oxigént szabadít fel. Eddig nem javasoltak olyan mechanizmust, amely megmagyarázhatná a cink kettős hatását. A kadmium hatását csak gyenge oldatokban vizsgálták, és vagy gyenge katalitikus tulajdonságokat tulajdonítanak neki, vagy teljesen hatástalannak tartják
Az extrahálás után az antrachionos oldat kb. 0,1-0,3% vizet, kis mennyiségű hidrogén-peroxidot (jellemzően 0,17 g/szén koncentrációt jeleznek), valamint különféle oxidált szerves anyagokat, például szerves savakat, aldehideket, ketonokat, stb. stb. Ezek a vegyületek megmérgezhetik a nikkel-hidrogénező katalizátort, ezért a recirkuláció előtt el kell távolítani őket. A német eljárás szerint a munkaoldatot 33 tömeg%-os vizes kálium-karbonát oldattal szárítják, ez az oldat a hidrogén-peroxid egy részét is kivonja. A szerves anyagokat és a víznyomokat adszorpció útján távolítják el az agyagrétegről. A visszamaradt hidrogén-peroxidot nikkel-ezüst katalizátorrétegen bomlásnak vetik alá, és néha a hidrogénező redukált oldatának kis mennyiségét (körülbelül 10%-át) a visszatérő folyadékhoz adják, mielőtt azt a katalizátorral együtt a hordozóhoz juttatnák. a hidrogén-peroxid és az oldott oxigén jobb eltávolítása érdekében. Ezáltal kis mennyiségű víz keletkezik, amely a munkaoldatban marad.
Egykomponensű üzemanyagként hidrogén-peroxidot, katalizátorként kalcium- vagy nátrium-permanganát vizes oldatával együtt használták. Ezt az üzemanyagot 300, 500 és 1000 kg tolóerős Focke-Wulf és Henkel repülőgépekhez és lövedékrepülőgépek indítószerkezeteihez használták, ezekben a rendszerekben a hidrogén-peroxid katalitikus lebontását H2O2 és koncentrált Kampoy oldat egyidejű adagolásával hajtják végre. a folyékony-hajtóanyagú rakétamotor kamrába vagy a Ca(MnO 4)2-be. A reakció gyorsan megindul, a nyomás 0,01-0,02 másodperc alatt 50-70 kg/cm-re egyenletesen emelkedik.
A turbina meghajtásához szükséges gőzgázt vagy egy speciális alkatrészből nyerik, amely nem a motor tüzelőanyagának összetevője, vagy azokból az alkatrészekből, amelyeken a rakétamotor működik. A hidrogén-peroxidot gyakran használják gőzgáz forrásaként. A hidrogén-peroxidból gőzgáz előállításához gőzgáz-generátorban bomlik le katalizátorok segítségével - olyan anyagokkal, amelyek elősegítik a bomlást.
Az oxigén és a nedvesség hatása sok fémre kis mennyiségű hidrogén-peroxidot termel, amelyet minőségileg kolorimetriás módszerrel, például titánsóval, vagy Russell-effektussal határoztak meg. Ez a hatás azon a tényen alapul, hogy a fényképészeti lemezek nagyon érzékenyek nagyon kis mennyiségű hidrogén-peroxidra. Így Russell kimutatta, hogy számos anyag, köztük különféle fémek, különösen a felület friss polírozása után, fényképes képeket adnak, ha sötétben a fényképezőlap közelében tartják őket. Bebizonyosodott, hogy ennek oka a hidrogén-peroxid felszabadulása. A hidrogén-peroxidot a megadott módszerek egyikével a következő fémek oxidációjában találták meg: cink, ólom, ón, ezüst, higany, réz, alumínium, kadmium, magnézium és vas. Valószínűleg sok más fém oxidációja során is keletkezik. Nagyon nehéz kinyitni olyan fémeken, amelyek a hidrogén-peroxid lebontásának aktív katalizátorai, mint például a vas, a réz és az ólom. Nyilvánvalóan a fémek autooxidációja során keletkező hidrogén-peroxid koncentrációját a képződési és bomlási reakciók egymáshoz viszonyított sebessége határozza meg; az, hogy egyik vagy másik szerző felfedezi-e a hidrogén-peroxidot, az általa alkalmazott technika érzékenységétől, valamint a kísérleti körülményeket. Magasabb koncentrációjú hidrogén-peroxid található a frissen őrölt fém felületén, és (legalábbis az alumínium esetében) enyhén vagy mérsékelten savas vagy enyhén lúgos vizes oldatokban is. Az oxidációs folyamat során a fém negatív potenciált kap. A fém anódos polarizációja elnyomja a hidrogén-peroxid képződését, míg a katódos polarizáció elősegíti ezt a képződést. Nem lehet biztosan megmondani, hogy a hidrogén-peroxid képződéséhez szükséges-e mind a víz, mind az oxigén jelenléte, de nagyon valószínű, hogy szükséges. Egy kísérletben egy száraz nitrogénben lévő alumíniumminta gyenge fényképezési képet adott, de valószínűleg oxigént és vizet (vagy csak vizet) adszorbeált a levegőből, mielőtt inert atmoszférába helyezték volna.
A hidrogén-peroxid azon képessége, hogy katalizátorok jelenlétében lebomlik, lehetővé teszi, hogy az ezzel az oxidálószerrel működő motorok ne rendelkezzenek speciális gyújtószerkezettel az indításhoz. Hidrogén-peroxiddal lehetséges az úgynevezett termikus motorindítás. A hidrogén-peroxidot az előkamrába juttatják (kis térfogat a fő égéstérhez csatlakozik), ahol az itt található katalizátor hatására lebomlik. A hidrogén-peroxid forró gáznemű bomlástermékei belépnek a motor fő égésterébe. Miután az égéstérben létrejön a szükséges nyomás a tüzelőanyag normál elégetéséhez, egy éghető alkatrészt vezetnek be.
Polimerizációs katalizátorként leggyakrabban a vízben oldódó peroxid vegyületeket használják, amelyek a bomlás során szabad gyököket termelnek. Ilyen vegyületek a hidrogén-peroxid, kálium-peroxid, perszulfátok és perborátok. A monomerben oldódó peroxidvegyület a benzoil-peroxid. Azt is megállapították, hogy a diazoamino-benzol aktiválja a butadién polimerizációját. Reakciókatalizátorként olyan tercier aminokat használnak, amelyek legalább az egyik polimerizálható komponensben oldódnak.
Formaldehid Hidrogén-peroxid polimer P a 3 J Bomlástermékek Kadmium vagy cink kelátvegyülete alkilidén-diacetátokban, 10-80°C 1 0 w e A katalizátor ugyanaz
A katalizátor használható vizes oldat formájában, fúvókán keresztül a bontókamrába hidrogén-peroxiddal egyidejűleg befecskendezve, vagy szilárd formában. Ez utóbbi esetben egy kerámia fúvókát impregnálnak a katalizátorral, amelyre a permetezett hidrogén-peroxid esik. 1 kg szilárd katalizátor akár 2000 kg 80%-os hidrogén-peroxidot is képes lebontani.
A hidrogén-peroxid jó oxidálószer, különösen lúgos oldatban. A peroxid feleslegét általában lúgos oldat forralásával bontják le. A bomlást felgyorsítja katalizátorok, például nikkelsók, jodid és platinafeket bevezetése. Shulek és Schakach klóros vízzel eltávolították a felesleges oxidálószert, és kálium-cianidot vezettek be a felesleges klór elpusztítására.
Ezekkel a módszerekkel porózus elasztomereket és hőre lágyuló műanyagokat állítanak elő, amelyeknél a keletkező bomlástermékek nem károsak. Nagyszámú pórusképző anyagot használnak, amelyek közül a leggyakoribb a nátrium- és ammónium-hidrogén-karbonát, az ammónium-nitrát, a kalcium-karbonát, a diazo-származékok és a diizocianátok. Pórusképző szerként a gázzal telített aktív szenet javasolják A Teleili eljárásban a porózus gumi előállításához a gázforrás a hidrogén-peroxid, amely élesztőkatalizátor hatására oxigén felszabadulásával bomlik le. Ebben az esetben a pórusképző anyagot a koaguláció előtt a latexbe vagy a vulkanizálás előtt az elasztomer masszába keverik, és az anyagot egyenletesen kell elosztani a műanyag masszában, mielőtt gázfejlődés megtörténne.
Jelenleg számos eljárás ismert perecetsav előállítására, amelyet különféle telítetlen vegyületek epoxidálására használnak. A módszer megválasztása attól függ, hogy az oxidáción átmenő kettős kötés hol helyezkedik el a molekulában. Az iparban két fő epoxidációs módszert használnak. Az első szerint a hidrogén-peroxidot ecetsav, telítetlen vegyület és savas katalizátor keverékéhez adják. A közbenső termékként képződött perecetsav az olefint epoxicsoportokat tartalmazó vegyületté oxidálja. Egy másik módszer szerint az acetaldehidet levegővel megfelelő oldószerben acetaldehid-monoperacetáttá oxidálják, amely hőbomláskor perecetsavat eredményez. A melléktermékként képződött ecetsavat és acetaldehidet vákuumban történő desztillációval távolítják el. Mivel az epoxidáció a perecetsavat ecetsavvá alakítja, a folyamat melléktermékként az acetaldehidet ecetsavvá alakítja.
A homogén és heterogén katalízis közötti kapcsolat csak kevéssé ismert, főleg azért, mert a katalizátor állapotát meghatározó változók (például pH és koncentráció) teljes tartományában nem vizsgálták azokat az elemeket, amelyek mindkét típusú katalízist előidézhetik. . A vas említhető katalizátorként, amelyben megfigyelhető az átmenet a homogénből a heterogén mechanizmusba. Savas oldatban a reakció tisztán homogén. Ha azonban a pH-t növeljük, kolloid anyag kezd megjelenni, és ezzel egyidejűleg sebességváltozás következik be (lásd 76. ábra, 440. oldal). Még magasabb pH-értékeknél makroszkopikus ülepedés és egyéb kinetikai változások is előfordulhatnak. A katalízis sebességét a fizikai forma változásai is befolyásolhatják (katalizátorhordozó jelenléte, a katalizátor szinterezése, vagy a kristályszerkezet megváltozása). Bár még nem határozták meg teljesen azt a pH-t, amelynél a kolloid anyag megjelenni kezd, kétségtelen, hogy a pH növekedésével a homogénből a heterogén bomlásba megy át. A változó mechanizmus természetét illetően azonban továbbra is jelentős bizonytalanságok vannak. Egyes esetekben mindkét típusú lebomlás minőségileg ugyanazzal a mechanizmussal magyarázható, mint például a ciklikus oxidáció és a redukció. Ugyanakkor a kolloid vagy szilárd halmazállapotú katalizátor komplex kialakulása vagy kicsapódása meghatározhatja a jelenlévő teljes katalizátor mennyiségének azt a t-hányadát, amely ténylegesen részt tud venni a reakcióban, és így befolyásolni a megfigyelt katalizátor sebességét. bomlás. Ez a típusú komplexképződés akkor következik be, amikor a polimerizációt peroxidok katalizálják. Tisztán heterogén katalízis esetén a megfigyelt sebesség a szilárd katalizátor diszperziós fokától függ, mivel ez a diszperzió határozza meg a közeggel érintkező felület méretét. Éppen ellenkezőleg, lehetséges, hogy a homogén rendszerből a heterogén rendszerbe való átmenet során a hidrogén-peroxid reakciójának jellege radikálisan megváltozik, például az ionos mechanizmus gyökössé válhat. Lehetséges, hogy a feltételek változásával az egyik mechanizmusból a másikba való átmenet viszonylag finom fokozatossággal jár. A homogén és heterogén katalízis közötti különbségek tisztázásánál mindig figyelembe kell venni az oldatból történő adszorpciónak a homogén katalízisre gyakorolt lehetséges hatását. Így az egyvegyértékű ezüst, amely homogén diszpergálva nem rendelkezik katalitikus tulajdonságokkal, könnyen adszorbeálódik az üvegen. Adszorbeált állapotban katalitikus tulajdonságokat szerezhet a fémre való valódi redukció vagy csak a polarizáció eredményeként. Az üvegfelület utólagos lúgosabb oldattal való érintkezése szintén aktiválhatja az adszorbeált ezüstöt. Ez különösen üvegelektróda felület esetén észrevehető.
Ezeknek a tényezőknek a fémólomra gyakorolt hatása nagyon drámai. Ha oxidfilmtől mentes polírozott ólmot hidrogén-peroxidba merítünk, akkor annak aktivitása nagyon alacsonynak bizonyul. Fokozatosan fehér csapadék képződik, amely felhalmozódása után vörös ólommá alakul, majd a katalitikus aktivitás gyors megnyilvánulása következik be. Ha a fém ólmot rövid időre hidrogén-peroxid oldatba merítjük és azonnal eltávolítjuk, akkor a fémhez tapadt kis mennyiségű folyadék rövid ideig nyugodt állapotban marad, majd az ólomfilm PbzO4 képződése után. a fémen heves vihar hatására hirtelen leszakad a felszínről.bomlás. Ebben a folyamatban az ólom oldódása következik be, ami minden bizonnyal összefügg az ólom passzivitás megfigyelt romlásával a hidrogén-peroxid hatására, de a peroxid nem befolyásolja a dendritek növekedését rajta. Leírják az ólomkatalizátorok gyakorlati alkalmazását koncentrált hidrogén-peroxid lebontására energiatermelésre használt rendszerekben.
Gyakran nehéz meghatározni, hogy a reakcióelegyből izolált peroxidok hidrogén-peroxidok vagy szerves peroxidok-e, egészen a közelmúltig kevés kísérlet történt ezen peroxidok szerkezetének meghatározására. A peroxidok természetére vonatkozó következtetések a következő bizonyítékok alapján vonhatók le: 1) a peroxid bomlása során keletkező gáz és folyadék összetétele (például a hidrogén-peroxid oxigént és vizet ad, az oxi-alkil-hidroperoxid lúgos lebomláskor formában, hidrogént és savat ad; a metil-hidroperoxid platinafeketén lebomolva szén-dioxidot ad) 2) különféle színreakciók, például a titánsó felhasználásával végzett reakció, amelyet a hidrogén-peroxidra nagyon specifikusnak tartanak (lásd a 10. fejezetet) 3) jellemzők a kálium-jodid savas oldatával való reakció (például a metil-hidroperoxid csak vas-szulfát, mint katalizátor jelenlétében reagál, de nem reagál ammónium-molibdát jelenlétében; emellett a jodid oxidációs sebessége a jódhoz való viszony észrevehetően függ a peroxid természetétől) 4) oldhatatlan szervetlen peroxidok, például kalcium-peroxid vagy nátrium-peroxoborát képződése megfelelő adalékok hozzáadásával a termékhez, amely igazolja a hidrogén-peroxid vagy hidroxi-alkil-hidroperoxidok jelenlétét 5) összehasonlítás abszorpciós spektrumok ezekkel a spektrumokkal ismert peroxidokra 6) eloszlási együtthatók meghatározása éterrel 7) kromatográfiás elválasztási módszerek 8) különböző peroxidok hőbomlási sebességének meghatározása a reakciózóna hőmérsékletén és 9) polarográfiai módszerek
Egy konkrét esetben, amikor a 30 tömegszázalékos hidrogén-peroxid oldatban a nitrát jelenléte károsnak bizonyult, azt főleg aktív szénen történő adszorpcióval távolították el belőle, a peroxid viszonylag csekély bomlásával. Laboratóriumi módszerként javasolták a hidrogén-peroxid tisztítását is oly módon, hogy gyorsan, keverés közben először vas(III)-klorid-oldatot, majd kalcium-karbonátot adnak hozzá, és az elegyet gyorsan átszűrik egy Gooch-tégelyen. Az ezt követő tömény kénsav hozzáadása eltávolítja a maradék sárga színt és kicsapja a kalciumot. Az első két hozzáadott anyag valószínűleg vizes vas-hidroxid (P1) csapadékot képez, amely nagy adszorpciós kapacitásával kis mennyiségű szennyeződést képes megkötni. A vasvegyületek azonban erőteljes bomlási katalizátorok, és a kezelés után visszamaradó kis mennyiségek is jelentős bomlást okozhatnak. Nehéz elképzelni, hogy ez a fajta, elfogadhatatlan szennyeződés bevezetésével társuló technika bármilyen előnnyel járna az ón-oxid-hidráttal végzett kicsapás módszerével szemben. A legjobb esetben a peroxid észrevehető bomlása fordulhat elő, a legrosszabb esetben ez a folyamat veszélyekkel jár, ha katalitikusan aktív anyagokat adnak a peroxidhoz, különösen, ha ezeket észrevehető koncentrációban adják be. Ezért a leírt módszer semmilyen körülmények között nem ajánlható.
A szifonokat pedig különféle hidrogén-peroxidot gyártó cégektől lehet beszerezni, és itt nem foglalkozunk ezekkel a kérdésekkel. A legfontosabb óvintézkedések a következők: 1) kerülni kell a peroxid érintkezését aktív katalizátorokkal, például vasat, rezet, mangánt és a legtöbb más fémet tartalmazó anyagokkal, valamint porral és lúgos vegyületekkel, amelyek gyors bomlást okozhatnak 2) kerülni kell a szerves anyagokkal való érintkezést. az olyan anyagokat, amelyek meggyulladhatnak vagy robbanásveszélyes keveréket képezhetnek tömény hidrogén-peroxiddal 3) azokat a berendezéseket, amelyekben a hidrogén-peroxidot lehet tárolni vagy ideiglenesen tárolni, mindig megfelelően szellőztetni kell. 4) kerülni kell a túl magas hőmérsékletet. A hidrogén-peroxid élettani hatásait a 153. oldalon ismertetjük. A körülbelül 50 tömegszázalékos vagy annál kisebb koncentrációjú peroxid általában nem okoz azonnali lángot a véletlenül kiömlött gyúlékony anyagokban, például ruházatban, de ha hagyjuk megszáradni, mivel a víz jobban elpárolog. könnyen megnő a peroxid koncentrációja, ami néha spontán égéshez vezet. A katalitikus szennyeződéseket vagy más gyúlékony anyagokat tartalmazó szennyezett anyagok, mint például a fa vagy a ruházat, különösen a gyapjú, gyakran spontán égnek, ha koncentrált hidrogén-peroxid hatásának vannak kitéve. A kiömlött peroxidot minden esetben bő vízzel le kell mosni.
Egyes ipari központokban nehéz a hidrogén-peroxidot tartalmazó szennyvizet víztestekbe engedni. Így a 40 mg/l-t meghaladó hidrogén-peroxid koncentráció mérgező hatással van a pisztrángfiatalokra, az alacsonyabb koncentráció 48 órás periódus alatt teljesen ártalmatlan. A víz maradék hidrogén-peroxidtól való megtisztításának legjobb módja a vízben lévő egyéb hulladékok természetétől függ; például, ha redukálószerek (hidrazin vagy metil-alkohol) vannak jelen, például egy rakéta-tesztállomás szennyvízében, tanácsos hogy először kölcsönhatást váltson ki a peroxid és ezen anyagok között. Mivel a hidrogén-peroxid könnyen lebomlik lúgos környezetben, valamint különféle fémkatalizátorok hatására, a maradék peroxid feldolgozásának egyik módszere szerint, javasolt mész hozzáadása a vízhez, hogy a pH-t 11-re állítsuk, majd hozzáadjuk. oldható mangánsót, például kloridot, úgy, hogy a mangán koncentrációja körülbelül 4 mg/l legyen. Ezen a pH-n úgy tűnik, hogy a mangán finom mangán-oxid-hidrát csapadékká alakul, amely nagyon hatékony katalizátor. A keveréket addig kell keverni, amíg a peroxid teljesen le nem bomlik, majd az üledék leülepedése után a szennyvizet egy tartályba kell engedni. A leülepedett iszap valószínűleg újra felhasználható.
A töltésátvitel elve természetesen nagy jelentőséggel bír, de ezek a jelenségek még mindig nem teljesen egyértelműek, és nem kapcsolódnak konzisztens megbízható elmélethez. Például a bárium-peroxid, amely szinte teljes egészében ionokból áll, stabil. Az alábbiakban idézett munkák azt mutatják, hogy az elektrondonor szubsztituensek acil-peroxidokba bevitele felgyorsítja a bomlást. Nyilvánvalóan az ilyen összehasonlítások csak analóg eljárásokra érvényesek, vagyis arra, hogy ugyanazt a kötést ugyanabban a környezetben csak egy homogén vagy heterogén folyamat következtében szakítsák meg, amely ugyanazt vagy egyenértékű reagenst, iniciátort vagy katalizátort érinti. Így, ha figyelembe vesszük a homogén bomlást a gázfázisban, akkor a szerves peroxidok látszólag kevésbé stabilak, mint a hidrogén-peroxid. Éppen ellenkezőleg, a vasionnal való reakciók példája azt mutatja, hogy a hidrogén-peroxid a legreaktívabb az összes vizsgált peroxid közül. Különbséget kell tenni minden peroxid robbanással vagy robbanással szembeni érzékenysége és szigorúan meghatározott feltételek melletti reakciósebessége között. Az általános kémia alapjai, 2. kötet, 3. kiadás (1973) -- [
O.S.ZAYTSEV
KÉMIAI KÖNYV
KÖZÉPISKOLAI TANÁROK SZÁMÁRA,
PEDAGÓGIAI EGYETEMI DIÁKOK ÉS 9-10 OSZTÁLYOS ISKOLÁSOK,
AKIK DÖNTÉSÜK, HOGY A KÉMIÁNAK ÉS A TERMÉSZETTUDOMÁNYNAK SZAKÍTOK EL
TANKÖNYV FELADAT LABORATÓRIUM GYAKORLATI TUDOMÁNYOS TÖRTÉNETEK OLVASÁSHOZ
Folytatás. Lásd: 4–14., 16–28., 30–34., 37–44., 47., 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22/2004
§ 8.1 Redox reakciók
(folytatás)
FELADATOK ÉS KÉRDÉSEK
1. Az elektron-ion módszerrel a sztöchiometrikus együtthatók kiválasztására készítsen egyenleteket a redox reakciókra, amelyek a következő sémák szerint mennek végbe (a víz képlete nincs feltüntetve):


Felhívjuk figyelmét, hogy a vegyületek szerves anyagokat tartalmaznak! Próbáljon együtthatókat találni oxidációs állapotok vagy vegyértékek segítségével.
2.
Válasszon két elektród reakcióegyenletet:

Állítson össze egy összegző egyenletet az elektródfolyamatok két felírt egyenletéből! Nevezze meg az oxidálószert és a redukálószert! Számítsa ki a reakció EMF-jét, annak Gés az egyensúlyi állandó. Vonjunk le következtetést ennek a reakciónak az egyensúlyi eltolódásának irányáról!
Ha elfelejtette, mit kell tennie, emlékezzen a fent elmondottakra. Ebből a listából bármelyik két egyenletet felírhatod. Nézd meg az elektródpotenciál értékeit, és írd át az egyik egyenletet az ellenkező irányba. Melyik, miért és miért? Ne feledje, hogy a megadott és fogadott elektronok számának egyenlőnek kell lennie, szorozza meg az együtthatókat egy bizonyos számmal (melyik?)és összeadjuk a két egyenletet. Az elektródpotenciálokat is összegzik, de nem szorozzuk meg a folyamatban részt vevő elektronok számával. A pozitív EMF érték a reakció lehetőségét jelzi. Számításhoz Gés egyensúlyi állandók, cserélje ki a kiszámított EMF-értéket a korábban levezetett képletekre.
3. Stabil a kálium-permanganát vizes oldata? A kérdés másképpen is megfogalmazható a következőképpen: reagál-e a permanganát ion vízzel oxigént képezve, ha

4. A levegő oxigénnel történő oxidációját vizes oldatban a következő egyenlet írja le:
O 2 + 4H + + 4 e= 2H 2O, E= 0,82 V.
Határozza meg, hogy lehetséges-e a 2. feladat bármely egyenletének jobb oldalára felírt anyagokat levegő oxigénjével oxidálni, amelyek jobb oldalára a redukálószereket írjuk! A tanár megmondja az egyenlet számát.
Ezt a feladatot nehéznek találhatja végrehajtani. Ez a karaktered fő hibája - úgy tűnik, hogy a feladat lehetetlen, és azonnal feladja a megoldást, bár minden szükséges tudással rendelkezik. Ebben az esetben fel kell írnia az oxigén és a hidrogénionok közötti reakció egyenletét és az Önt érdeklő egyenletet. Nézze meg, melyik reakciónak van nagyobb az elektronadó képessége (potenciálja inkább negatív vagy kevésbé pozitív legyen), írja át az egyenletét az ellenkező irányba, megfordítva az elektródpotenciál előjelét, és összegezze a másik egyenlettel. A pozitív EMF-érték reakció lehetőségét jelzi.
5.
Írja fel a permanganátion és a hidrogén-peroxid H 2 O 2 reakciójának egyenletét! A reakció során Mn 2+ és O 2 képződik. Milyen esélyeket kaptál?
És a következő egyenletet találtam ki:
7H 2O 2 + 2 + 6H + = 2Mn2+ + 6O2 + 10H2O.
Keresse meg a hibát, ha én követtem el, vagy magyarázza el, miért különböznek az esélyei. Ez a feladat arra szolgál, hogy tesztelje intelligenciáját és a kémia más szakaszaiból származó anyagok ismereteit.
A permanganát ion reakciója hidrogén-peroxiddal savas oldatban (kénsavban) több, különböző együtthatójú egyenlettel ábrázolható, például:
5H 2O 2 + 2 + 6H + = 2Mn 2+ + 5O 2 + 8H 2O,
7H 2O 2 + 2 + 6H + = 2Mn2+ + 6O2 + 10H2O,
9H 2O 2 + 2 + 6H + = 2Mn2+ + 7O2 + 12H2O.
Adja meg ennek okát, és írjon fel legalább még egy egyenletet a permanganát ion hidrogén-peroxiddal való reakciójára!
Ha meg tudta magyarázni egy ilyen furcsa jelenség okát, magyarázza meg a következő egyenletek felírásának lehetőségét:
3H 2O 2 + 2 + 6H + = 2Mn2+ + 4O2 + 6H2O,
H 2 O 2 + 2 + 6H + = 2Mn 2+ + 3O 2 + 4H 2 O.
Menthetnek-e reakciók e két egyenlet szerint?
Válasz. A permanganát ionok hidrogén-peroxiddal való reakciója a hidrogén-peroxid bomlásának párhuzamos reakciójára épül:
2H 2O 2 = O 2 + 2H 2 O.
Az alapreakcióegyenletet végtelenül sok ebből az egyenletből összegezheti, és sok különböző sztöchiometrikus együtthatójú egyenletet kaphat.
6. Ez a feladat esszé vagy jelentés témájaként szolgálhat.
Beszéljük meg a Fe 3+ -ionok hidrogén-peroxiddal történő redukciós reakciójának lehetőségét vizes oldatban:
2Fe 3+ + H 2O 2 = 2Fe 2+ + O 2 + 2H+.
Számítsa ki a reakció EMF-jét, annak Gés az egyensúlyi állandó standard elektródpotenciálok felhasználásával:

A reakciósebességnek a komponensek koncentrációjától való függésének vizsgálata kimutatta, hogy ha a Fe 3+ vagy a H 2 O 2 egyedi koncentrációját megkétszerezzük, a reakciósebesség megkétszereződik. Mi a reakció kinetikai egyenlete? Határozza meg, hogyan változik a reakció sebessége, ha a Fe 3+ vagy a H 2 O 2 koncentrációja háromszorosára nő. Jósolja meg, hogyan változik a reakciósebesség, ha az oldatot kétszer vagy tízszer vízzel hígítják.
A következő reakciómechanizmust javasolták:
H 2 O 2 = H + H + (gyors),
Fe 3+ + H = Fe 2+ + HO 2 (lassú),
Fe 3+ + HO 2 = Fe 2+ + H + + O 2 (gyors).
Bizonyítsuk be, hogy ez a mechanizmus nem mond ellent a sebesség fent említett függésének a reaktánsok koncentrációjától. Melyik szakasz korlátozza? Mi a molekulárissága és mi a sorrendje? Mi a reakció általános sorrendje? Vegye figyelembe az összetett ionok és molekulák, például a H és a HO 2 létezését, és azt, hogy minden reakció két vagy akár három részecskét termel. (Miért nincsenek szakaszok egy részecske kialakulásával?)
7. Fordítás oroszra.
Fontos reakciótípus az elektrontranszfer reakció, más néven oxidációs-redukciós vagy redox reakció. Egy ilyen reakció során úgy tűnik, hogy egy vagy több elektron átkerül egyik atomról a másikra. Az oxidáció egy olyan szó, amely eredetileg oxigéngázzal való kombinációt jelentett, de annyi más reakciót tekintettek az oxigénnel való reakciókhoz, hogy a kifejezést végül kiterjesztették minden olyan reakcióra, amelyben egy anyag vagy faj elektronokat veszít. A redukció az elektronok erősítése. Úgy tűnik, hogy a kifejezés eredete a kohászati terminológiából származik: az érc redukálása fémjévé. A redukció éppen az oxidáció ellentéte. Az oxidáció nem mehet végbe anélkül, hogy redukció ne lenne párosulva; vagyis az elektronok nem veszhetnek el, hacsak valami más nem nyeri meg őket.
LABORATÓRIUMI KUTATÁS
A felkínált feladatok, mint korábban, rövid kutatási cikkek. A kísérletekhez olyan reakciókat választottak ki, amelyek nemcsak a kémiában, hanem az ökológiában is fontosak. Egyáltalán nem szükséges az összes kísérletet elvégezni - válassza ki azokat, amelyek érdeklik. Célszerű kis csoportokban (2-3 fő) dolgozni. Ez csökkenti a kísérletezési időt, elkerüli a hibákat, és ami a legfontosabb, lehetővé teszi a tudományos kommunikációt, amely fejleszti a tudományos nyelvet.
1. A hidrogén-peroxid redox tulajdonságai.
A hidrogén-peroxid H 2 O 2 a legfontosabb oxidálószer, amelyet a mindennapi életben, a technológiában és a víz szerves szennyeződésektől való megtisztításánál használnak. A hidrogén-peroxid környezetbarát oxidálószer, mert bomlástermékei - oxigén és víz - nem szennyezik a környezetet. A hidrogén-peroxid és peroxid szerves vegyületek szerepe a biológiai oxidációs-redukciós folyamatokban ismert.
A hidrogén-peroxid 3-6%-os háztartási és oktatási célú oldatait általában 30%-os oldatból készítik vízzel hígítva. A hidrogén-peroxid a tárolás során lebomlik, oxigént szabadít fel (Szorosan lezárt edényben nem tárolható!). Minél alacsonyabb a hidrogén-peroxid koncentrációja, annál stabilabb. A bomlás lassításához adjon hozzá foszfort, szalicilsavat és egyéb anyagokat. A vas, a réz, a mangán és a kataláz enzim sói különösen erős hatással vannak a hidrogén-peroxidra.
A 3%-os hidrogén-peroxid oldatot a gyógyászatban szájöblítésre és gargarizálásra használják szájgyulladás és torokfájás esetén.
A hidrogén-peroxid 30%-os oldatát ún perhidrol. A perhidrol nem robbanásveszélyes. Amikor a perhidrol a bőrre kerül, égési sérüléseket, égést, viszketést és felhólyagosodást okoz, a bőr pedig kifehéredik. Az égett területet gyorsan le kell öblíteni vízzel. A perhidrolt a gyógyászatban gennyes sebek kezelésére és szájgyulladás kezelésére használják. A kozmetológiában az arc bőrén lévő öregségi foltok eltávolítására használják. A hidrogén-peroxid foltok a ruházaton nem távolíthatók el. A textiliparban a hidrogén-peroxidot gyapjú és selyem, valamint szőrmék fehérítésére használják.
A hidrogén-peroxid koncentrált (90–98%-os) oldatainak gyártása folyamatosan növekszik. Az ilyen oldatokat alumínium tartályokban tárolják nátrium-pirofoszfát Na 4 P 2 O 7 hozzáadásával. A tömény oldatok robbanásszerűen lebomlanak. A hidrogén-peroxid koncentrált oldata oxidkatalizátoron 700 °C-on vízgőzre és oxigénre bomlik, amely sugárhajtóművekben üzemanyag oxidálószereként szolgál.
A hidrogén-peroxid oxidáló és redukáló tulajdonságokat is mutathat.
A hidrogén-peroxid oxidálószerének szerepe jellemzőbb:
H 2 O 2 + 2H + + 2 e= 2H 2O,
például reakcióban:
2KI + H 2 O 2 + H 2 SO 4 = I 2 + K 2 SO 4 + 2H 2 O.
Hidrogén-peroxid redukálószerként:
1) savas környezetben:
H 2 O 2 – 2 e= O2+2H+;
2) alap (lúgos) környezetben:
H 2 O 2 + 2OH - – 2 e= O 2 + 2H 2 O.
Példák reakciókra:
1) savas környezetben:
2KMnO4 + 5H 2O 2 + 3H 2SO 4 = K 2SO 4 + 2 MnSO 4 + 5O 2 + 8H 2O;
2) a fő környezetben:
2KMnO 4 + H 2 O 2 + 2KOH = 2K 2 MnO 4 + O 2 + 2H 2 O
A hidrogén-peroxid oxidáló tulajdonságai savas környezetben, redukáló tulajdonságai pedig lúgos környezetben kifejezettebbek.
1a. A hidrogén-peroxid bomlása.
Öntsön 2-3 ml hidrogén-peroxid oldatot egy kémcsőbe, és melegítse fel az oldatot vízfürdőben. Meg kell kezdeni a gázkibocsátást. (Melyik?) Kísérletileg bizonyítsa be, hogy pontosan ezt a gázt várta.
Cseppentsen egy szem mangán-dioxidot egy másik kémcsőbe hidrogén-peroxid oldattal. Bizonyítsuk be, hogy ugyanaz a gáz szabadul fel.
Írja fel a hidrogén-peroxid bomlásának egyenletét és külön az elektronok befogadásának és felszabadulásának egyenleteit! Milyen típusú redox reakció ez?
Számítsa ki a reakció EMF-jét, ha:
![]()
A két reakció közül melyiknek van nagyobb elektrondonor képessége, és azt az ellenkező irányba kell átírni? Az emf reakció értékéből számolja ki G reakció és egyensúlyi állandó.
Hasonlítsa össze az eredményeket a GÉs termodinamikai adatokból kapott egyensúlyi állandó:
A számításaid eredménye megegyezik? Ha az eredményekben eltérés mutatkozik, próbálja meg megtalálni az okokat.
1b. Hidrogén-peroxid kimutatása.
A kénsavval hígított és megsavanyított kálium-jodid oldatához (2-3 ml) adjunk néhány csepp hidrogén-peroxid oldatot. Az oldat sárgásbarna lesz. Ha néhány csepp keményítőoldatot adunk hozzá, a keverék színe azonnal kékre változik. Írd fel a reakcióegyenletet! (tudod a keletkezett anyagokat!).
Számítsa ki a reakció EMF-jét, hogy megbizonyosodjon arról, hogy a reakció lehetséges (válassza ki a kívánt reakciót):

1. század Fekete ólom-szulfid és hidrogén-peroxid.
A régi mesterek ólomfehér alapú festékekkel festették festményeiket, amelyek a 2PbCO 3 Pb(OH) 2 fehér bázikus karbonátot tartalmazták. Idővel az ólomfehér feketévé válik, és a festékek színe megváltozik a hidrogén-szulfid hatására, és fekete ólom-szulfid PbS képződik. Ha a festményt óvatosan letöröljük híg hidrogén-peroxid oldattal, az ólom-szulfid fehér ólom-szulfát PbSO 4 -dá alakul, és a festmény szinte teljesen visszanyeri eredeti megjelenését.
Öntsünk 1–2 ml 0,1 M ólom-nitrát Pb(NO 3) 2 vagy ólom-acetát Pb(CH 3 COO) 2 oldatot egy kémcsőbe (a gyógyszertárakban ólomápolóként kapható). Öntsünk bele egy kevés kénhidrogén- vagy nátrium-szulfid-oldatot. A keletkezett fekete csapadékból leöntjük az oldatot, és hidrogén-peroxid oldattal kezeljük. Írd fel a reakcióegyenleteket!
Minden ólomvegyület mérgező!
1 év Hidrogén-peroxid oldat készítése hidroperitből.
Ha nem sikerült hidrogén-peroxid oldatot előállítani, akkor laboratóriumi munkákhoz használhat hidroperitot, amelynek tablettáit a gyógyszertárban lehet megvásárolni.
A hidroperit hidrogén-peroxid és karbamid (karbamid) NH 2 CONH 2 H 2 O 2 komplex vegyülete. Vízben oldva hidrogén-peroxid és karbamid NH 2 CONH 2 oldatot kapunk. Hidroperit oldatot használnak a hidrogén-peroxid oldat helyett antiszeptikumként és hajfestéskor. A száj és a torok öblítéséhez oldjunk fel 1 tablettát egy pohár vízben (0,25%-os hidrogén-peroxid oldat). Egy hidroperit tabletta tömege 1,5 g, és 15 ml-nek felel meg
(1 evőkanál) 3%-os hidrogén-peroxid oldat.
Számítsa ki, hány hidroperit tablettát kell feloldani 100 ml vízben, hogy körülbelül 1%-os hidrogén-peroxid oldatot kapjunk. Mekkora térfogatú oxigén (n.o.) nyerhető egy tablettából hidroperitből?
Kísérletileg határozza meg, hány milliliter oxigén nyerhető ki egy tablettából hidroperitből. Javasoljon egy tervet a készülékhez, és szerelje össze. Csökkentse a felszabaduló oxigén mennyiségét a normál körülményekre. A pontosabb számítási eredmények érdekében figyelembe veheti az oldat feletti víz gőznyomását, amely szobahőmérsékleten (20 °C) körülbelül 2300 Pa.
Sok 19. századi kutató, akik tiszta hidrogén-peroxidot szereztek, megjegyezte ennek a vegyületnek a veszélyeit. Tehát amikor megpróbálták szétválasztani N
2 O 2 vízből híg oldatokból dietil-éterrel extrahálva, majd az illékony étert desztillálva, a keletkező anyag néha látható ok nélkül felrobbant. Az egyik ilyen kísérletben Yu.V. Bruhl német kémikus vízmentes H 2 O 2 , amely ózonszagú volt, és felrobbant, amikor egy nem olvadt üvegrúd hozzáért. A kis mennyiségű H ellenére 2 O 2 (összesen 12 ml) a robbanás olyan erős volt, hogy kerek lyukat ütött az asztal deszkáján, megsemmisítette a fiókja tartalmát, valamint az asztalon és a közelben álló palackokat és műszereket.Fizikai tulajdonságok. A tiszta hidrogén-peroxid nagyon különbözik a H ismert 3%-os oldatától 2 O 2 , ami az otthoni gyógyszeres szekrényben van. Először is csaknem másfélszer nehezebb, mint a víz (sűrűsége 20°C-on 1,45 g/cm 3). A H2O2 megfagy a víz mínusz 0,41 ° C-os fagyáspontjánál valamivel alacsonyabb hőmérsékleten, de ha gyorsan lehűtjük a tiszta folyadékot, az általában nem fagy meg, hanem túlhűtve átlátszó üveges masszává alakul. Megoldások H 2 O 2 fagyasztás sokkal alacsonyabb hőmérsékleten: 30%-os oldat mínusz 30°C-on és 60%-os oldat mínusz 53°C-on. Forr H 2 O 2 a közönséges víznél magasabb hőmérsékleten, 150,2 °C-on. Nedvesíti az üveget H 2 O 2 rosszabb, mint a víz, és ez egy érdekes jelenséghez vezet a vizes oldatok lassú desztillációja során: miközben a víz desztillálódik az oldatból, az a szokásos módon cseppek formájában folyik a hűtőszekrényből a vevőbe; mikor kezd desztillálódni 2 O 2 , a folyadék folyamatos vékony sugárban jön ki a hűtőből. A bőrön a tiszta hidrogén-peroxid és tömény oldata fehér foltokat hagy maga után, és súlyos kémiai égés következtében égő érzést okoz.A hidrogén-peroxid előállításának szentelt cikkében Tenard nem nagyon hasonlította össze ezt az anyagot a sziruppal; talán arra gondolt, hogy a tiszta H
2 O 2 , a cukorsziruphoz hasonlóan erősen megtöri a fényt. Valójában a vízmentes H törésmutatója 2 O 2 (1,41) sokkal nagyobb, mint a vízé (1,33). Azonban vagy a félreértelmezés eredményeként, vagy a francia nyelvből való gyenge fordítás miatt szinte minden tankönyvben még mindig azt írják, hogy a tiszta hidrogén-peroxid „sűrű, szirupos folyadék”, sőt elméletileg ezt a hidrogénkötések kialakulásával magyarázzák. De a víz hidrogénkötéseket is képez. Valójában az N viszkozitása 2 O 2 ugyanaz, mint a kissé lehűtött (körülbelül 13 °C-os) vízé, de nem mondható el, hogy a hideg víz olyan sűrű, mint a szirup.Bomlási reakció. A tiszta hidrogén-peroxid nagyon veszélyes anyag, mivel bizonyos körülmények között robbanásveszélyes lebomlása lehetséges: H 2 O 2 ® H 2 O + 1/2 O 2 98 kJ felszabadulás molenként H 2 O 2 (34 g). Ez nagyon nagy energia: nagyobb, mint ami akkor szabadul fel, amikor hidrogén és klór keverékének robbanása során 1 mól HCl képződik; elegendő 2,5-szer több vizet teljesen elpárologtatni, mint amennyi ebben a reakcióban keletkezik. A H tömény vizes oldatai is veszélyesek 2 O 2 , jelenlétükben sok szerves vegyület könnyen spontán meggyullad, és becsapódáskor az ilyen keverékek felrobbanhatnak. Tömény oldatok tárolásához használjon különösen tiszta alumíniumból készült edényeket vagy viaszos üvegedényeket.Gyakrabban találkozik kevésbé tömény, 30%-os H-oldattal
2 O 2 , amit perhidrolnak hívnak, de veszélyes is egy ilyen megoldás: égési sérüléseket okoz a bőrön (hatásakor a színezőanyagok elszíneződése miatt a bőr azonnal kifehéredik), szennyeződések bejutása esetén robbanásveszélyes forralás lehetséges. Dekompozíció H 2 O 2 oldatait pedig, beleértve a robbanásveszélyeseket is, számos anyag okozza, például nehézfém-ionok, amelyek ebben az esetben katalizátor szerepet töltenek be, sőt porszemcsék is. 2 O 2 a reakció erős exotermitása, a folyamat láncos jellege és a H bomlás aktiválási energiájának jelentős csökkenésével magyarázható. 2 O 2 különböző anyagok jelenlétében, amint az a következő adatok alapján ítélhető meg:A kataláz enzim megtalálható a vérben; Ennek köszönhető, hogy a gyógyszerészeti „hidrogén-peroxid” „forr” az oxigén felszabadulásából, amikor a vágott ujj fertőtlenítésére használják. A H koncentrált oldatának bomlási reakciója 2 O 2 nem csak az emberek használnak katalázt; Ez a reakció segíti a bombázó bogarat az ellenségek elleni küzdelemben azáltal, hogy forró patakot enged rájuk ( cm . ROBBANÓANYAGOK). Egy másik enzim, a peroxidáz másként működik: nem bontja le a H-t 2 O 2 , de jelenlétében más anyagok hidrogén-peroxiddal történő oxidációja következik be.A hidrogén-peroxid reakcióit befolyásoló enzimek fontos szerepet játszanak a sejt életében. A szervezetet a tüdőből érkező oxigén oxidációs reakcióival látják el energiával. Ezekben a reakciókban közbensően H képződik
2 O 2 , ami káros a sejtre, mert visszafordíthatatlan károsodást okoz a különböző biomolekulákban. A kataláz és a peroxidáz együttesen alakítják át a H-t 2 O 2 vízbe és oxigénbe.H bomlási reakció
2 O 2 gyakran radikális láncmechanizmuson keresztül megy végbe ( cm. LÁNCREAKCIÓK), míg a katalizátor szerepe a szabad gyökök beindítása. Így a H vizes oldatainak keverékében 2 O 2 és Fe 2+ (az ún. Fenton-reagens) a Fe-ionból elektrontranszfer reakció megy végbe 2+ H 2 O 2 molekulánként Fe-ion képződésével 3+ és egy nagyon instabil radikális anion . , amely azonnal OH-anionná bomlik és szabad hidroxilgyök OH. ( cm. SZABAD RADIKÁLISOK). Radikális HE. nagyon aktív. Ha a rendszerben szerves vegyületek vannak, akkor különféle reakciók lehetségesek hidroxilcsoportokkal. Így az aromás vegyületek és a hidroxisavak oxidálódnak (a benzol például fenollá alakul), a telítetlen vegyületek hidroxilcsoportokat kapcsolhatnak a kettős kötéshez: CH 2 = CHCH 2OH + 2OH. ® NOCH2CH(OH)CH2 OH, és polimerizációs reakcióba léphet. Megfelelő reagensek hiányában OH. reagál H2O2-vel kevésbé aktív HO gyök képződésével 2 . , amely képes a Fe-ionok redukálására 2+ , amely lezárja a katalitikus ciklust: H 2 O 2 + Fe 2+ ® Fe 3+ + OH . + OH OH . + H 2 O 2 ® H 2 O + HO 2 .HO 2 . + Fe 3+
® Fe 2+ + O 2 + H + ® H 2 O. Bizonyos körülmények között a H láncbomlása lehetséges 2 O 2 , melynek leegyszerűsített mechanizmusa a diagrammal ábrázolható. + H 2 O 2 ® H 2 O + HO 2 . 2 . +H2O2® H 2 O + O 2 + OH . stb.H bomlási reakciók
2 O 2 különféle változó vegyértékű fémek jelenlétében fordulnak elő. Komplex vegyületekké kötve gyakran jelentősen fokozzák aktivitásukat. Például a rézionok kevésbé aktívak, mint a vasionok, de ammóniakomplexekben 2+ kötődnek , a H gyors lebomlását okozzák 2 O 2 . A Mn-ionok hasonló hatást fejtenek ki 2+ komplexekbe kötve bizonyos szerves vegyületekkel. Ezen ionok jelenlétében meg lehetett mérni a reakciólánc hosszát. Ehhez először megmértük a reakció sebességét az oxigén oldatból való felszabadulási sebességével. Ezután nagyon alacsony koncentrációban (kb. 10 5 mol/l) inhibitor olyan anyag, amely hatékonyan reagál a szabad gyökökkel és így megszakítja a láncot. Az oxigén felszabadulása azonnal leállt, de körülbelül 10 perc elteltével, amikor az összes inhibitor elfogyott, ugyanazzal a sebességgel újraindult. A reakciósebesség és a láncvégződés sebességének ismeretében könnyen kiszámítható a lánchossz, amely 10-nek bizonyult 3 linkeket A nagy lánchossz határozza meg a H-lebontás nagy hatékonyságát 2 O 2 a leghatékonyabb katalizátorok jelenlétében, amelyek nagy sebességgel termelnek szabad gyököket. A jelzett lánchossznál a H bomlási sebesség 2 O 2 valójában ezerszeresére nő.A H néha észrevehető bomlása
2 O 2 olyan szennyeződések nyomait is okozhatják, amelyek analitikailag szinte észrevehetetlenek. Így az egyik leghatékonyabb katalizátornak a fémozmium szolja bizonyult: erős katalitikus hatása már 1:10 hígításnál is megfigyelhető volt. 9 , azaz 1 g Os 1000 tonna vízre. Az aktív katalizátorok palládium, platina, irídium, arany, ezüst kolloid oldatai, valamint egyes fémek szilárd oxidjai (MnO) 2, Co 2 O 3, PbO 2 stb., amelyek önmagukban nem változnak. A bomlás nagyon gyorsan mehet végbe. Tehát, ha egy kis csipet MnO 2 csepegtessük kémcsőbe 30%-os H oldattal 2 O 2 , a kémcsőből egy gőzoszlop tör ki folyadékfröccsenéssel. Töményebb oldatok esetén robbanás következik be. A platina felületén a bomlás halkabban megy végbe. Ebben az esetben a reakció sebességét erősen befolyásolja a felület állapota. Walter Spring német kémikus a 19. század végén vezényelt. ilyen élmény. Egy alaposan megtisztított és polírozott platina csészében a H 38%-os oldatának bomlási reakciója 2 O 2 60°C-ra melegítve sem ment. Ha tűvel alig észrevehető karcolást csinál a csésze alján, akkor a már hideg (12°C-on) oldat oxigénbuborékokat kezd kibocsátani a karcolás helyén, ill. hevítéskor a bomlás ezen a helyen érezhetően felerősödik. Ha egy ilyen oldatba szivacsos platinát vezetnek, amely nagyon nagy felülettel rendelkezik, akkor robbanásveszélyes bomlás lehetséges.A H gyors bomlása
2 O 2 hatékony előadáskísérlethez használható, ha a katalizátor hozzáadása előtt felületaktív anyagot (szappant, sampont) adunk az oldathoz. A felszabaduló oxigén gazdag fehér habot hoz létre, amelyet „elefántfogkrémnek” neveznek.Egyes katalizátorok elindítják a H nem lánc szerinti bomlását
2 O 2, például: H 2 O 2 + 2I + 2H + ® 2H 2 O + I 2 ® 2I + 2H + + O 2. Fe-ionok oxidációja esetén nem láncreakció is fellép 2+ savas oldatokban: 2FeSO 4 + H 2 O 2 + H 2 SO 4 ® Fe 2 (SO 4) 3 + 2H 2 O. Mivel a vizes oldatok szinte mindig nyomokban tartalmaznak különféle katalizátorokat (az üvegben lévő fémionok is katalizálhatják a bomlást), a H oldatai 2 O 2 , akár hígítva is, a hosszú távú tárolás során fémionokat megkötő inhibitorokat és stabilizátorokat adnak hozzá. Ebben az esetben az oldatokat enyhén savanyítják, mivel a tiszta víz üvegre gyakorolt hatására gyengén lúgos oldat keletkezik, amely elősegíti a H lebomlását. 2 O 2 . A H dekompozíciójának mindezen jellemzői 2 O 2 lehetővé teszi az ellentmondás feloldását. A tiszta H megszerzéséhez 2 O 2 csökkentett nyomáson kell desztillálni, mivel az anyag lebomlik 70 ° C feletti hőmérsékleten, sőt, bár nagyon lassan, szobahőmérsékleten (a Chemical Encyclopedia szerint, évi 0,5% -os sebességgel). Ebben az esetben hogyan kaptuk meg a 150,2°C-os atmoszférikus nyomású forráspontot, amely ugyanabban az enciklopédiában szerepel? Általában ilyen esetekben egy fiziko-kémiai törvényt alkalmaznak: a folyadék gőznyomásának logaritmusa lineárisan függ az inverz hőmérséklettől (a Kelvin-skálán), tehát ha pontosan megméri a H gőznyomást 2 O 2 több (alacsony) hőmérsékleten könnyen kiszámítható, hogy ez a nyomás milyen hőmérsékleten éri el a 760 Hgmm-t. És ez a forráspont normál körülmények között.Elméletileg OH gyökök
. iniciátorok hiányában is kialakulhat, gyengébb OO kötés szakadása következtében, de ehhez elég magas hőmérséklet szükséges. Annak ellenére, hogy a H-molekulában ennek a kötésnek a megszakításának energiája viszonylag alacsony 2 O 2 (ez 214 kJ/mol, ami 2,3-szor kisebb, mint a vízmolekulában lévő HOH kötésnél), az OO kötés még mindig elég erős ahhoz, hogy a hidrogén-peroxid szobahőmérsékleten abszolút stabil legyen. És még forrásponton (150 °C) is nagyon lassan kell bomlani. A számítás azt mutatja, hogy mikorEzen a hőmérsékleten a 0,5%-os bomlás is meglehetősen lassan megy végbe, még akkor is, ha a lánc hossza 1000 láncszem. A számítások és a kísérleti adatok közötti eltérést a folyadékban és a reakcióedény falában lévő legkisebb szennyeződések okozta katalitikus bomlás magyarázza. Ezért a H bomlás aktiválási energiáját sok szerző mérte 2 O 2 mindig lényegesen kevesebb, mint 214 kJ/mol, még „katalizátor hiányában is”. Valójában a bomlási katalizátor mindig jelen van, mind jelentéktelen szennyeződések formájában az oldatban, mind az edény falai formájában, ezért a vízmentes H melegítése 2 O 2 atmoszférikus nyomáson történő forrásig többszörösen robbanásokat okozott.Bizonyos körülmények között a H bomlása
2 O 2 nagyon szokatlanul fordul elő, például ha H oldatot melegítünk 2 O 2 kálium-jodát KIO jelenlétében 3 , akkor a reagensek bizonyos koncentrációinál oszcillációs reakció figyelhető meg, az oxigén felszabadulása időszakosan leáll, majd 40-800 másodperces periódussal újraindul.A H kémiai tulajdonságai 2 O 2 . A hidrogén-peroxid egy sav, de nagyon gyenge. H disszociációs állandó 2 O 2 H + + HO 2 25°C-on egyenlő 2,4 10 12 , ami 5 nagyságrenddel kisebb, mint H esetében 2 S. Közepes sók H 2 O 2 Az alkáli- és alkáliföldfémeket általában peroxidoknak nevezik. cm. PEROXIDOK). Vízben oldva szinte teljesen hidrolizálódnak: Na 2 O 2 + 2H 2 O ® 2NaOH + H 2 O 2 . A hidrolízist az oldatok savanyítása segíti elő. Mint sav H 2 O 2 savas sókat is képez, például a Ba(HO). 2) 2, NaHO 2 stb. A savas sók kevésbé érzékenyek a hidrolízisre, de hevítés hatására könnyen lebomlanak, és oxigént szabadítanak fel: 2NaHO 2® 2NaOH + O 2 . Lúg szabadult fel, akárcsak H 2 O 2 , elősegíti a bomlást.Megoldások H
2 O 2 , különösen a koncentráltak, erős oxidáló hatásúak. Így a H 65%-os oldatának hatására 2 O 2 papíron, fűrészporon és egyéb gyúlékony anyagokon meggyulladnak. A kevésbé koncentrált oldatok sok szerves vegyületet, például indigót színtelenítenek. A formaldehid oxidációja szokatlanul megy végbe: H 2 O 2 nem vízzé redukálódik (a szokásos módon), hanem szabad hidrogénné: 2HCHO + H 2 O 2 ® 2НСООН + Н 2 . Ha 30%-os H oldatot vesz be 2 O 2 és 40%-os HCHO oldattal, majd enyhe melegítés után heves reakció indul meg, a folyadék felforr és habzik. A H híg oldatainak oxidatív hatása 2 O 2 a legkifejezettebb savas környezetben, például H 2 O 2 + H 2 C 2 O 4 ® 2H 2 O + 2CO 2 , de lúgos környezetben is lehetséges az oxidáció:Na + H 2 O 2 + NaOH® Na 2; 2K 3 + 3H 2 O 2® 2KCrO 4 + 2KOH + 8H 2 O. Fekete ólom-szulfid oxidációja fehér szulfáttá PbS+ 4H 2 O 2 ® PbSO 4 + 4H 2 Az O használható az elszíneződött ólomfehér helyreállítására régi festményeken. Fény hatására a sósav is oxidálódik: H 2 O 2 + 2HCl ® 2H 2 O + Cl 2. H 2 O 2 hozzáadása savakra nagymértékben növeli hatásukat a fémekre. Így a H keverékében 2 O 2 és hígítsuk a H-t 2 SO 4 a réz, az ezüst és a higany feloldódik; a jód savas környezetben HIO periodikus savvá oxidálódik 3 , kén-dioxid kénsavvá stb.Szokatlan módon a borkősav kálium-nátriumsójának (Rochelle-só) oxidációja kobalt-klorid, mint katalizátor jelenlétében megy végbe. A reakció során KOOC(CHOH)
2 COONa + 5H 2 O 2 ® KHCO 3 + NaHCO 3 + 6H 2 O + 2CO 2 rózsaszín CoCl 2 színe zöldre változik a tartaráttal komplex vegyület, a borkősav-anion képződése miatt. Ahogy a reakció lezajlik és a tartarát oxidálódik, a komplex tönkremegy, és a katalizátor ismét rózsaszínűvé válik. Ha kobalt-klorid helyett réz-szulfátot használunk katalizátorként, a köztes vegyület a kiindulási reagensek arányától függően narancssárga vagy zöld színű lesz. A reakció befejeződése után a réz-szulfát kék színe visszaáll.A hidrogén-peroxid teljesen eltérően reagál erős oxidálószerek, valamint olyan anyagok jelenlétében, amelyek könnyen oxigént bocsátanak ki. Ilyen esetekben N
2 O 2 redukálószerként is működhet az egyidejű oxigén felszabadulásával (a H ún. reduktív lebontása 2 O 2 ), például: 2KMnO4 + 5H2O2 + 3H2SO4® K 2SO 4 + 2 MnSO 4 + 5O 2 + 8H 2O;Ag 2 O + H 2 O 2
® 2Ag + H 2O + O 2; O 3 + H 2 O 2 ® H 2 O + 2O 2; ® NaCl + H 2 O + O 2 . Az utolsó reakció azért érdekes, mert gerjesztett oxigénmolekulákat termel, amelyek narancssárga fluoreszcenciát bocsátanak ki ( cm. KLÓR AKTÍV). Hasonlóképpen a fémarany felszabadul az aranysók oldataiból, a fémhiganyt pedig a higany-oxidból nyerik ki stb. Ilyen szokatlan tulajdonság 2 O 2 lehetővé teszi például a kálium-hexaciano-ferrát(II) oxidációját, majd a körülmények megváltoztatásával a reakciótermék visszaállítását az eredeti vegyületre ugyanazzal a reagenssel. Az első reakció savas környezetben, a második lúgos környezetben játszódik le:2K 4 + H 2 O 2 + H 2 SO 4® 2K3 + K2S04 + 2H20;2K3 + H2O2 + 2KOH
® 2K 4 + 2H 2 O + O 2.(„Kettős karakter” N 2 O 2 megengedte az egyik kémiatanárnak, hogy összehasonlítsa a hidrogén-peroxidot a híres angol író, Stevenson történetének hősével. Dr. Jekyll és Mr. Hyde furcsa esete, az általa kitalált kompozíció hatására drámaian megváltoztathatta karakterét, tekintélyes úriemberből vérszomjas mániákus lett.)H 2 O 2 kinyerése. H 2 O 2 molekulák mindig kis mennyiségben keletkeznek a különféle vegyületek égése és oxidációja során. Amikor éget H 2 O 2 úgy keletkezik, hogy hidrogénatomokat vonnak el a kiindulási vegyületekből köztes hidroperoxid gyökök által, például: HO 2 . + CH 4 ® H 2 O 2 + CH 3 . , vagy az aktív szabad gyökök rekombinációja eredményeként: 2OH. ® Н 2 О 2 , Н . + DE 2 . ® H 2 O 2 . Például, ha oxigén-hidrogén lángot irányítanak egy jégdarabra, akkor az olvadt víz észrevehető mennyiségű H-t tartalmaz. 2 O 2 , a szabad gyökök rekombinációja eredményeként keletkezik (a H molekula lángjában 2 O 2 azonnal szétesik). Hasonló eredmény érhető el más gázok égésekor is. Oktatás N 2 O 2 alacsony hőmérsékleten is előfordulhat különböző redox folyamatok eredményeként.Az iparban a hidrogén-peroxidot már régóta nem Tenara-módszerrel állítják elő bárium-peroxidból, hanem korszerűbb módszereket alkalmaznak. Ezek egyike a kénsavoldatok elektrolízise. Ebben az esetben az anódnál a szulfátionok perszulfát ionokká oxidálódnak: 2SO
4 2 2e ® S 2 O 8 2 . A perkénsavat ezután hidrolizálják: H 2 S 2 O 8 + 2H 2 O ® H 2 O 2 + 2H 2 SO 4 . A katódon szokás szerint hidrogénfejlődés megy végbe, így a teljes reakciót a 2H egyenlet írja le 2 O ® H 2 O 2 + H 2 . De a fő modern módszer (a világtermelés több mint 80%-a) egyes szerves vegyületek, például az etil-antrahidrokinon oxidációja légköri oxigénnel szerves oldószerben, míg a H2 antrahidrokinonból képződik. 2 O 2 és a megfelelő antrakinon, amelyet azután ismét redukálnak hidrogénnel a katalizátoron antrahidrokinonná. A hidrogén-peroxidot vízzel eltávolítjuk és desztillációval bepároljuk. Hasonló reakció játszódik le izopropil-alkohol használatakor (hidroperoxid közbenső képződése esetén): (CH) 3) 2 CHOH + O 2 ® (CH 3) 2 C(UN) OH ® (CH 3) 2 CO + H 2 O 2 . Ha szükséges, a kapott acetont izopropil-alkohollá is redukálhatjuk.A H 2 O 2 alkalmazása. A hidrogén-peroxidot széles körben használják, globális termelése évente több százezer tonnát tesz ki. Szervetlen peroxidok előállítására, rakéta-üzemanyagok oxidálószereként, szerves szintézisekben, olajok, zsírok, szövetek, papír fehérítésére, félvezető anyagok tisztítására, értékes fémek ércekből való kinyerésére (például urán oldhatatlan formájának átalakításával) oldhatóvá), szennyvízkezelésre. Az orvostudományban az N 2 O 2 nyálkahártya gyulladásos megbetegedéseinél (sztomatitisz, torokfájás) öblítésre és kenésre, gennyes sebek kezelésére használják. A kontaktlencse tokok fedelében néha nagyon kis mennyiségű platina katalizátor van. A fertőtlenítéshez a lencséket tolltartóba töltik 3%-os H oldattal 2 O 2 , de mivel ez a megoldás káros a szemre, a tolltartót egy idő után megfordítják. Ebben az esetben a fedélben lévő katalizátor gyorsan lebontja a H-t 2 O 2 tiszta vízhez és oxigénhez.Egykor divat volt „peroxiddal” szőkíteni a hajat, ma már biztonságosabb hajfestékek is léteznek.
Bizonyos sók jelenlétében a hidrogén-peroxid egyfajta szilárd „koncentrátumot” képez, amelyet kényelmesebb szállítani és használni. Tehát, ha hidrogént adunk egy nagyon lehűtött, telített nátrium-borát-oldathoz (bórax),
2 O 2 a nátrium-peroxoborát Na nagy átlátszó kristályai jelenlétében 2 [(BO 2) 2 (OH) 4 ]. Ezt az anyagot széles körben használják szövetek fehérítésére és mosószerek összetevőjeként. Molekulák H 2 O 2 A vízmolekulákhoz hasonlóan képesek behatolni a sók kristályos szerkezetébe, olyasmiket képezve, mint a kristályos hidrátok, peroxohidrátok, pl. 2 CO 3 3 H 2 O 2, Na 2 CO 3 1,5 H 2 O; ez utóbbi vegyület közismert nevén "persol".Az úgynevezett „hidroperit” CO(NH
2) 2 H 2 O 2 egy klatrát vegyület, amely H-molekulákat tartalmaz 2 O 2 a karbamid kristályrács üregeibe.Az analitikai kémiában a hidrogén-peroxid felhasználható egyes fémek meghatározására. Például, ha hidrogén-peroxidot adunk a titán(IV)-só-titanil-szulfát oldatához, az oldat élénk narancssárgává válik a pertitánsav képződése miatt:
TiOSO 4 + H 2 SO 4 + H 2 O 2 ® H 2 + H 2 O.Színtelen molibdát ion MoO 4 2-t H 2 O 2 oxidál intenzív narancssárga színű peroxid anionná. Kálium-dikromát savanyított oldata H jelenlétében 2 O 2 perkrómsavat képez: K2 Cr 2 O 7 + H 2 SO 4 + 5H 2 O 2® H 2 Cr 2 O 12 + K 2 SO 4 + 5H 2O, ami elég gyorsan lebomlik: H 2 Cr 2 O 12 + 3H 2 SO 4 ® Cr 2 (SO 4) 3 + 4H 2 O + 4O 2. Ha ezt a két egyenletet összeadjuk, akkor a kálium-dikromát hidrogén-peroxiddal való redukciójának reakcióját kapjuk:K 2 Cr 2 O 7 + 4H 2 SO 4 + 5 H 2 O 2® Cr 2 (SO 4) 3 + K 2 SO 4 + 9H 2 O + 4O 2.A perkrómsavat vizes oldatból éterrel extrahálhatjuk (éteres oldatban sokkal stabilabb, mint vízben). Az éteri réteg intenzív kék színűvé válik.Ilja Leenson
IRODALOM Dolgoplosk B.A., Tinyakova E.I. A szabad gyökök keletkezése és reakcióik. M., Kémia, 1982A hidrogén-peroxid kémiája és technológiája. L., Kémia, 1984
A hidrogén-peroxid (peroxid) színtelen, szirupszerű folyadék, amelynek sűrűsége - -on megszilárdul. Ez egy nagyon törékeny anyag, amely robbanásszerűen vízre és oxigénre bomlik, és nagy mennyiségű hőt szabadít fel:
A hidrogén-peroxid vizes oldatai stabilabbak; hűvös helyen elég sokáig eltarthatók. A perhidrol, a kereskedelmi forgalomba kerülő oldat, tartalmaz. A hidrogén-peroxid erősen koncentrált oldataihoz hasonlóan stabilizáló adalékokat is tartalmaz.
A hidrogén-peroxid bomlását katalizátorok gyorsítják. Ha például egy kevés mangán-dioxidot dob a hidrogén-peroxid oldatába, heves reakció lép fel, és oxigén szabadul fel. A hidrogén-peroxid bomlását elősegítő katalizátorok közé tartozik a réz, vas, mangán, valamint ezen fémek ionjai. Ezeknek a fémeknek már nyomai is bomlást okozhatnak.
A hidrogén égésekor köztes termékként hidrogén-peroxid képződik, de a hidrogénláng magas hőmérséklete miatt azonnal vízzé és oxigénné bomlik.

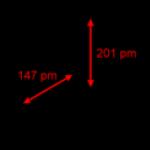
Rizs. 108. A molekula szerkezetének vázlata. A szög közel van -hoz, a szög közel -hez. Linkek hossza: .
Ha azonban hidrogénlángot irányítasz egy jégdarabra, akkor a keletkező vízben hidrogén-peroxid nyomai találhatók.
A hidrogén-peroxid az atomos hidrogén oxigénre gyakorolt hatására is keletkezik.
Az iparban a hidrogén-peroxidot főként elektrokémiai módszerekkel állítják elő, például kénsav vagy ammónium-hidrogén-szulfát oldatainak anódos oxidációjával, majd a keletkező peroxo-kénsav hidrolízisével (lásd 132. §). Az ebben az esetben lezajló folyamatokat a következő diagrammal lehet ábrázolni:
![]()
A hidrogén-peroxidban a hidrogénatomok kovalensen kötődnek oxigénatomokhoz, amelyek között egyszerű kötés is van. A hidrogén-peroxid szerkezete a következő szerkezeti képlettel fejezhető ki: H-O-O-H.
A molekulák jelentős polaritással rendelkeznek, ami térszerkezetükből adódik (106. ábra).
A hidrogén-peroxid molekulában a hidrogén- és oxigénatomok közötti kötések polárisak (a közös elektronok oxigén felé történő elmozdulása miatt). Ezért vizes oldatban poláris vízmolekulák hatására a hidrogén-peroxid le tudja hasítani a hidrogénionokat, azaz savas tulajdonságokkal rendelkezik. A hidrogén-peroxid vizes oldatban nagyon gyenge kétbázisú sav, amely kis mértékben ugyan, de ionokra bomlik:
Második szakasz disszociáció
gyakorlatilag nincs szivárgás. Elnyomja a víz jelenléte, egy olyan anyag, amely a hidrogén-peroxidnál nagyobb mértékben hidrogénionokat képezve disszociál. Ha azonban hidrogénionok kötődnek (például ha lúgot viszünk az oldatba), a disszociáció egy második lépésben megtörténik.
A hidrogén-peroxid közvetlenül reagál néhány bázissal sókat képezve.
Így amikor a hidrogén-peroxid a bárium-hidroxid vizes oldatára hat, a hidrogén-peroxid báriumsójának csapadéka válik ki:
A hidrogén-peroxid sóit peroxidoknak vagy peroxidoknak nevezzük. Pozitív töltésű fémionokból és negatív töltésű ionokból állnak, amelyek elektronszerkezetét a diagram ábrázolja:
![]()
A hidrogén-peroxidban az oxigén oxidációs foka -1, azaz a vízben és a molekuláris oxigénben mért oxigén oxidációs foka között egy köztes érték (0). Ezért a hidrogén-peroxid oxidálószerként és redukálószerként is rendelkezik, azaz redox kettősséget mutat. Ennek ellenére inkább az oxidáló tulajdonságok jellemzik, mivel az elektrokémiai rendszer standard potenciálja
amelyben oxidálószerként működik, 1,776 V, míg az elektrokémiai rendszer standard potenciálja
amelyben a hidrogén-peroxid redukálószer, egyenlő 0,682 V. Más szóval, a hidrogén-peroxid képes oxidálni azokat az anyagokat, amelyek nem haladják meg az 1,776 V-ot, és csak azokat redukálják, amelyek meghaladja a 0,682 V-ot. A táblázat szerint. 18 (a 277. oldalon) láthatja, hogy az első csoport sokkal több anyagot tartalmaz.
Az olyan reakciókra, amelyekben oxidálószerként szolgál, például a kálium-nitrit oxidációja
és a jód elválasztása a kálium-jodidtól:
Használják szövetek és szőrmék fehérítésére, gyógyászatban (3%-os oldat fertőtlenítőszer), élelmiszeriparban (élelmiszerek befőzéséhez), mezőgazdaságban vetőmagok kezelésére, valamint számos szerves vegyület előállítására. , polimerek és porózus anyagok. A hidrogén-peroxidot erős oxidálószerként használják a rakétákban.
A hidrogén-peroxidot régi olajfestmények megújítására is használják, amelyek idővel elsötétültek, mivel a fehér ólom fekete ólom-szulfiddá alakul a levegőben lévő hidrogén-szulfid nyomai hatására. Amikor az ilyen festményeket hidrogén-peroxiddal mossák, az ólom-szulfid fehér ólom-szulfáttá oxidálódik: