アンモニアから硝酸ナトリウムを得る方法。 亜硝酸塩は硝酸塩とどう違うのですか。 蒸着法の特徴
化学は魅力的な科学です。 理論に興味があるだけでなく、実際に自分のスキルを試してみたい人は、何が問題になっているかを正確に知っています。 すべての生徒は周期表のほとんどの元素に精通しています。 しかし、誰もが試薬の混合や化学試験の実施を自分の経験として試すことができたでしょうか? 現在でも、すべての現代の学校に必要な設備や試薬が揃っているわけではないため、化学は独立した研究のためのオープンサイエンスのままです。 多くの人は、家で調べてそれをより深く知ろうとしています。
家庭内で非常に重要な硝酸なしでは、日曜大工をする人は一人もいません。 この物質を入手するのは困難です。それは専門店でのみ購入でき、そこでは物質の平和的使用を確認する文書に従って購入が行われます。 したがって、自家製マスターの場合、このコンポーネントを入手できない可能性が高くなります。 ここで、家庭で硝酸を作る方法が問題になります。 プロセスは複雑ではないようですが、出力される物質は十分な純度および必要な濃度の物質でなければなりません。 ここでは、実験化学者のスキルなしではできません。
その物質はどこで使用されていますか?
安全な目的のためには、硝酸の使用が合理的です。 この物質は人間の活動の次のような分野で使用されます。
- 着色顔料の作成。
- 写真フィルムの現像。
- 薬の準備。
- プラスチック製品のリサイクル。
- 化学での使用。
- 園芸および園芸作物用の肥料。
- ダイナマイトの製造。

純粋な硝酸は変化せずに液体物質のように見え、空気と接触すると白い蒸気を放出し始めます。 それはすでに-42℃で凍結し、+80℃で沸騰します。自宅で自分の手で硝酸などの物質を除去するにはどうすればよいですか?
方法 1
濃縮物を硝酸ナトリウム(カリウム)に曝露すると発煙物質が得られます(硝酸ナトリウム(カリウム))。 反応の結果、目的物と硫酸水素ナトリウム(カリウム)が得られる。 反応スキームは次のようになります。 NaNO 3 + H 2 それで 4 => HNO 3 + NaHSO 4. 得られる物質の濃度は反応に入る前に依存することに注意してください。
方法 2
家庭でより低濃度の硝酸を入手することも同様に行われ、硝酸ナトリウムを硝酸アンモニウムに置き換えるだけで済みます。 化学方程式は次のようになります。 NH 4 いいえ 3 + H 2 それで 4 =>(NH4) 2 それで 4 + HNO 3 . ほとんどの研究者が硝酸アンモニウムをベースに反応を行っているため、硝酸アンモニウムは硝酸カリウムや硝酸ナトリウムよりも手頃な価格であることに注意してください。

H 2 SO 4 濃度が高くなるほど、硝酸の濃度も高くなります。 バランスのとれた物質を得るには、反応に必要な電解質の量を増やす必要があります。 望ましい結果を達成するために、実際には、電解質の量を元の量から約 4 倍に徐々に減少させる蒸発法が使用されます。
蒸着法の特徴
ふるいにかけた砂を皿の底に注ぎ、電解質の入った容器を置きます。 この場合、ガスストーブを沸騰させたり、火を弱めたり、弱めたりするプロセス。 このプロセスには時間がかかるため、この問題に関しては忍耐が重要です。 専門家は、蒸発などの化学実験用に設計されたガラスまたはセラミック管の熱湯を使用することを推奨しています。 泡の発生を中和し、沸騰の力を弱め、物質の飛び散りを防ぎます。 このような条件下では、濃度約93%の硝酸を家庭で入手することが許容されます。
物質を実際に調製するためのツールと試薬
反応を起こすには以下が必要です。
- 濃H 2 SO 4 (> 95%) - 50 ml;
- 硝酸アンモニウム、カリウム、ナトリウム;
- 容量100ml。
- 1000ml容器。
- ガラス漏斗。
- ガム;
- 水浴;
- 砕いた氷(雪または冷水に置き換えることができます)。
- 温度計。

家庭で硝酸を入手する場合は、他の化学反応を行う場合と同様に、次のような注意が必要です。
- 家庭で硝酸を得るプロセスでは、温度を60〜70℃以内に維持する必要があります。これらの制限を超えると、酸は分解し始めます。
- 反応中に蒸気やガスが放出される可能性があるため、酸を扱う場合は必ず保護マスクを使用してください。 突然の皮膚接触から手を保護する必要があるため、化学者はゴム手袋をして作業します。 人が健康に有害な物質と接触する大規模な化学産業では、作業員は通常、特別な防護服を着て作業します。
これで、簡単な反応で硝酸を得る方法がわかりました。 このような物質を使用する場合は注意し、平和的な目的でのみ使用してください。
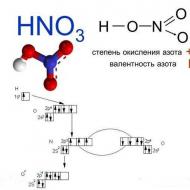
硝酸は強酸です。 彼女の塩 硝酸塩- 金属、酸化物、水酸化物、または炭酸塩に対する HNO 3 の作用によって得られます。 すべての硝酸塩は水によく溶けます。 硝酸イオンは水中では加水分解しません。
硝酸塩は加熱すると不可逆的に分解し、分解生成物の組成はカチオンによって決まります。
a) マグネシウムの左側の一連の電圧にある金属の硝酸塩:
b) マグネシウムと銅の間の一連の電圧にある金属の硝酸塩:
c) 水銀の右側の一連の電圧にある金属の硝酸塩:
d) 硝酸アンモニウム:
水溶液中の硝酸塩は実際には酸化特性を示さないが、固体状態の高温では強力な酸化剤となる。たとえば、固体が溶融する場合である。
アルカリ溶液中の亜鉛とアルミニウムは硝酸塩を NH 3 に還元します。
硝酸塩は肥料として広く使用されています。 同時に、ほとんどすべての硝酸塩は水への溶解度が高いため、ミネラルの形では本質的に非常に微量です。 例外はチリ硝酸ナトリウム(ナトリウム)とインド硝酸カリウムです。 ほとんどの硝酸塩は人工的に得られます。
液体窒素は冷媒として、また凍結療法に使用されます。 石油化学産業では、窒素はタンクやパイプラインのパージ、圧力下でのパイプラインの動作テスト、堆積物の生成の増加に使用されます。 採掘では、窒素を使用して鉱山内に防爆環境を作り、岩層を破裂させることができます。
窒素の重要な応用分野は、アンモニア、窒素肥料、爆薬、染料など、窒素を含むさまざまな化合物のさらなる合成に窒素を使用することです。コークスの製造(「乾式コークス急冷」)では、大量の窒素が使用されます。 」)コークス炉バッテリーからコークスを降ろすとき、およびロケット内の燃料をタンクからポンプまたはエンジンに「絞り出す」とき。
食品業界では、窒素は食品添加物として登録されています。 E941、包装および保管のためのガス媒体、冷媒、液体窒素は、オイルや非炭酸飲料を瓶詰めするときに使用され、ソフトコンテナ内に過圧と不活性雰囲気を作り出します。
航空機の着陸装置のタイヤ室には窒素ガスが充填されています。
31. リン - 入手、特性、用途。 同素性。 ホスフィン、ホスホニウム塩 - 調製と特性。 金属リン化物の調製と特性。
リン- D. I. メンデレーエフの周期系の第 3 周期の 15 族の化学元素。 原子番号は 15 です。この元素はプニクトゲンのグループに属します。
リンは、約 1600 °C の温度でコークスおよびシリカとの相互作用の結果として、アパタイトまたは亜リン酸塩から得られます。
結果として生じるリン蒸気は、受容器内の水層の下で凝縮し、白リンの形の同素体修飾になります。 亜リン酸塩の代わりに、リン元素を得るために、メタリン酸などの他の無機リン化合物を石炭で還元できます。
リンの化学的性質は主にその同素体修飾によって決まります。 白リンは非常に活性が高く、赤リンや黒リンに変化する過程で化学的活性は低下します。 空気中の白リンは、室温で大気中の酸素によって酸化されると可視光を放射し、その輝きはリンの酸化による光電子放出反応によるものです。
リンは酸素によって容易に酸化されます。
(酸素過剰で)
(酸化が遅い、または酸素が不足している場合)
多くの単純な物質(ハロゲン、硫黄、一部の金属)と相互作用し、酸化および還元特性を示します。金属とは酸化剤としてリン化物を形成します。 非金属 - 還元剤を使用。
リンは実際には水素と結合しません。
冷たい濃縮アルカリ溶液でも、不均化反応はゆっくりと進行します。
強力な酸化剤はリンをリン酸に変換します。
マッチに点火するとリンの酸化反応が起こり、ベルトレ塩が酸化剤として作用します。
白(「黄」)リンは化学的に最も活性があり、有毒で可燃性であるため、(焼夷弾などで)非常に頻繁に使用されます。
赤リンは、産業によって生産および消費される主な変性物です。 これは、白熱灯の製造におけるゲッターとして、マッチ、爆薬、発火組成物、さまざまな種類の燃料、極圧潤滑剤の製造に使用されます。
通常の条件下では、リン元素はいくつかの安定した同素体修飾の形で存在します。 リンの考えられるすべての同素体修飾はまだ十分に研究されていません(2016)。 伝統的に、その修飾のうち、白、赤、黒、金属リンの 4 つが区別されます。 と呼ばれることもあります 主要同素体修飾は、記載されている他のすべての修飾がこれら 4 つの混合物であることを意味します。 標準条件下では、リンの 3 つの同素体修飾のみが安定です (たとえば、白リンは熱力学的に不安定 (準定常状態) であり、通常の条件下では時間の経過とともに赤リンに変化します)。 超高圧の条件下では、要素の金属形態は熱力学的に安定しています。 すべての修飾は、色、密度、その他の物理的および化学的特性、特に化学活性が異なります。 物質の状態が熱力学的により安定した変化に移行すると、たとえば白リンが赤に、次に赤から黒(金属)に順次変化する間に化学活性が低下します。
ホスフィン (リン化水素, リン化水素, 水素化リン、ホスファン pH 3) は、腐った魚のような特有の臭いを持つ無色の有毒ガスです (通常の条件下)。
ホスフィンは、白リンと熱アルカリを反応させることによって得られます。たとえば、次のとおりです。
また、リン化物に対する水または酸の作用によっても得られます。
塩化水素は加熱すると白リンと相互作用します。
ヨウ化ホスホニウムの分解:
ホスホン酸の分解:
または復元します:
化学的特性。
ホスフィンは、対応するアンモニアとは大きく異なります。 その化学活性はアンモニアよりも高く、塩基はアンモニアよりもはるかに弱いため、水にはほとんど溶けません。 後者は、H-P 結合が弱く分極しており、アンモニア中のリン (3s 2) の非共有電子対活性が窒素 (2s 2) よりも低いという事実によって説明されます。
酸素が存在しない状態で加熱すると、次の元素に分解されます。
空気中で自然発火します(ジホスフィン蒸気の存在下、または 100 °C 以上の温度で)。
強力な修復特性を示します。
強力なプロトン供与体と相互作用すると、ホスフィンは PH 4 + イオン (アンモニウムと同様) を含むホスホニウム塩を生成することがあります。 ホスホニウム塩は無色の結晶物質であり、非常に不安定で、容易に加水分解されます。
ホスホニウム塩は、ホスフィン自体と同様、強力な還元剤です。
リン化物- リンと他の電気陰性度の低い化学元素との二元化合物。リンは負の酸化状態を示します。
ほとんどのリン化物は、リンと典型的な金属との化合物であり、単体物質の直接相互作用によって得られます。
Na + P (赤) → Na 3 P + Na 2 P 5 (200 °C)
リン化ホウ素は、約 1000 °C の温度での物質の直接相互作用と、三塩化ホウ素とリン化アルミニウムの反応の両方によって得られます。
BCl 3 + AlP → BP + AlCl 3 (950 °C)
金属リン化物は、水や希酸により分解する不安定な化合物です。 この場合、ホスフィンが得られ、加水分解の場合は金属水酸化物が、酸との相互作用の場合は塩が得られます。
Ca 3 P 2 + 6H 2 O → 3Ca(OH) 2 + 2PH 3
Ca 3 P 2 + 6HCl → 3CaCl 2 + 2PH 3
適度に加熱すると、ほとんどのリン化物は分解します。 リン蒸気の過剰圧力下で溶解。
対照的に、リン化ホウ素 BP は耐火性 (t pl. 2000 ° C、分解を伴う) であり、非常に不活性な物質です。 濃酸化性酸でのみ分解し、焼結中に酸素、硫黄、アルカリと加熱すると反応します。
32. 酸化リン - 分子構造、生産、特性、用途。
リンはいくつかの酸化物を形成します。 これらの中で最も重要なものは、酸化リン (V) P 4 O 10 と酸化リン (III) P 4 O 6 です。 多くの場合、それらの式は P 2 O 5 および P 2 O 3 という簡略化された形式で書かれます。 これらの酸化物の構造は、リン原子の四面体配置を保持しています。
酸化リン(III) P 4 O 6- ワックス状の結晶質の塊で、22.5℃で融解し、無色の液体に変わります。 有毒。
冷水に溶解すると亜リン酸が形成されます。
P 4 O 6 + 6H 2 O \u003d 4H 3 PO 3、
アルカリと反応すると、対応する塩(亜リン酸塩)が生成します。
強力な還元剤。 酸素と相互作用すると、P 4 O 10 に酸化されます。
酸化リン (III) は、酸素の非存在下で白リンを酸化することによって得られます。
酸化リン (V) P 4 O 10- 白色の結晶性粉末。 昇華温度は36℃です。 これにはいくつかの修飾があり、そのうちの 1 つ (いわゆる揮発性) は P 4 O 10 という組成を持っています。 この変形の結晶格子は、弱い分子間力によって相互接続された P 4 O 10 分子で構成されており、加熱すると簡単に破壊されます。 したがって、この品種の変動性は高くなります。 他の修飾はポリマー性です。 それらは、PO 4 四面体の無限の層によって形成されます。
P 4 O 10 が水と相互作用すると、リン酸が形成されます。
P4O10+6H2O\u003d4H3PO4.
酸性酸化物である P 4 O 10 は、塩基性酸化物および水酸化物と反応します。
これは、過剰酸素(乾燥空気)中でのリンの高温酸化中に形成されます。
酸化リン (V) は、その優れた吸湿性により、乾燥剤および脱水剤として研究室および工業技術で使用されています。 その乾燥効果においては、他のすべての物質を上回ります。 化学的に結合した水は、無水過塩素酸の無水物の形成とともに無水過塩素酸から除去されます。
4HClO 4 + P 4 O 10 \u003d (HPO 3) 4 + 2Cl 2 O 7.
P 4 O 10 は、気体および液体の乾燥剤として使用されます。
有機合成の脱水縮合反応に広く使用されています。
亜硝酸塩と硝酸塩は名前が異なるだけでなく、その式に含まれる元素も異なります。 ただし、それらには共通点があります。 これらの物質の範囲は非常に広いです。 これらは人間の体内にも存在しており、過剰に蓄積すると重度の中毒を引き起こし、死に至る場合もあります。
硝酸塩とは何ですか
簡単に言うと、硝酸塩は硝酸の塩です。 彼らの式には、一桁の陰イオンが含まれています。 昔は硝酸塩と呼ばれていました。 現在、これは鉱物の名前であり、農業で使用される肥料の名前でもあります。
硝酸塩は、金属、酸化物、塩、水酸化物に作用する硝酸の助けを借りて得られます。 すべての硝酸塩は水で希釈できます。 固体状態では強力な酸化剤ですが、溶液に硝酸を添加するとその性質は消失します。
硝酸塩は常温ではその性質を保ちますが、低温では完全に分解してしまうまで溶けます。 これらの物質を入手するプロセスは非常に複雑なので、おそらく化学者だけが興味を持つでしょう。
硝酸塩は爆発物の基礎であり、アンモナイトやその他の物質です。 これらは主にミネラル肥料として使用されます。 さて、植物が細胞を構築するために塩からの窒素を使用することは秘密ではありません。 植物はクロロフィルを生成し、それによって生きています。 しかし、硝酸塩は人体内では亜硝酸塩となり、人を墓場に導く可能性があります。
亜硝酸塩も塩です
亜硝酸塩も硝酸の塩ですが、化学組成の式が異なります。 亜硝酸ナトリウム、亜硝酸カルシウムが知られている。 鉛、銀、アルカリ、アルカリ土類、3D 金属の亜硝酸塩も知られています。
これらはカリウムやバリウムにも固有の結晶物質です。 一部の物質は水によく溶けますが、銀、水銀、亜硝酸銅などの物質は水に溶けにくいものもあります。 亜硝酸塩も実際には有機溶媒に溶解しないことは注目に値します。 しかし、温度を上げると、亜硝酸塩の溶解度が向上します。
人類は亜硝酸塩を窒素染料の製造、カプロラクタムの製造に使用し、またゴム、繊維、金属加工産業における酸化剤および還元剤としても使用しています。 たとえば、亜硝酸ナトリウムは優れた防腐剤であり、硬化促進剤および不凍添加剤としてコンクリート混合物の製造に使用されます。
亜硝酸塩は人間のヘモグロビンにとって毒であるため、毎日体から除去する必要があります。 それらは直接、または他の物質とともに人体に入ります。 人間の体が正常に機能していれば、必要な量の物質が残り、不要なものは除去されます。 しかし、人が病気の場合、亜硝酸塩中毒の問題が発生します。
(A) 亜硝酸塩
コンプライアンスの対象 例外このサブグループの一般規定に規定されている場合、この項には亜硝酸塩、亜硝酸の金属塩 (HNO 2) が含まれます (見出し )。
- 亜硝酸ナトリウム(NaNO2)。 硝酸ナトリウムを鉛で還元することにより、また鉛リサージの生産中に得られます。 無色の結晶で、吸湿性があり、水によく溶けます。 建染の酸化剤として使用されます。 有機合成において。 肉の加工用。 写真において。 殺鼠剤など
- 亜硝酸カリウム(KNO 2)。 亜硝酸ナトリウムと同じ方法、または酸化カルシウムと硝酸カリウムの混合物に二酸化硫黄を作用させることによって得られます。 白色の結晶性粉末または黄色がかった棒。 多くの場合、不純物として他の塩が含まれています。 水に溶けますが、空気中では強くぼやけ、特性が低下します。 亜硝酸ナトリウムと同じ目的で使用されます。
- 亜硝酸バリウム(Ba(NO 2) 2)。 花火に使われる結晶。
- 他の 亜硝酸塩。 これらには、不安定で爆発性の生成物である亜硝酸アンモニウムが含まれます。 実験室で窒素を得る溶液として使用されます。
(B) 硝酸塩
コンプライアンスの対象 例外この小見出しの一般規定に規定されている場合、この見出しには硝酸塩、金属塩および硝酸が含まれます(見出し )。 を除外する硝酸アンモニウムと硝酸ナトリウム、純粋および未精製の両方 ( 見出しまた )。 (その他の例外については以下を参照してください。)
塩基性硝酸塩もここに含まれます。
- 硝酸カリウム(KNO 3) (「硝石」とも呼ばれます)。 硝酸ナトリウムと塩化カリウムから得られます。 それは、無色の結晶またはガラス状の塊、または白色の結晶性粉末であり、水に可溶で、粗製の場合は吸湿性を有する。 硝酸ナトリウムと同様に、火薬、化学雷管の製造、花火、マッチや冶金用フラックスの製造にも使用されます。
- 硝酸ビスマス:
(A) 中性硝酸ビスマス(Bi(NO 3) 3 5H 2 O)。 ビスマスに硝酸を作用させることによって得られます。 大きな無色の潮解性の結晶。 ビスマスの酸化物または塩および一部のワニスの製造に使用されます。
(b) 塩基性硝酸ビスマス(BiNO 3 (OH) 2)。 中性硝酸ビスマスから得られます。 真珠白色の粉末で、水に溶けません。 医学(胃腸疾患の治療)に使用されます。 セラミックス(虹色)の製造、化粧品、ヒューズの製造など。
- 硝酸マグネシウム(Mg(NO 3) 2 6H 2 O)。 無色の結晶で、水に溶けます。 火工品で耐火物(酸化マグネシウムを含む)、白熱グリッドなどを得るために使用されます。
- 硝酸カルシウム(Ca(NO 3) 2)。 砕いた石灰石を硝酸で処理して得られます。 白色の広がる塊で、水、アルコール、アセトンに可溶。 花火、爆薬、マッチ、肥料などの製造に使用されます。
- 硝酸第二鉄(Fe(NO 3) 3 6H 2 O または 9H 2 O)。 青い結晶。 染色や印刷における媒染剤として使用されます(純粋な形で、またはアセテートと混合して)。 純粋な水溶液は医療に使用されます。
- 硝酸コバルト(Co(NO 3) 2 6H 2 O)。 紫色、赤みがかった、または茶色がかった結晶で、水に溶け、潮解性があります。 コバルトブルーまたはコバルトイエローおよび共感インクの製造に使用されます。 陶磁器の装飾用。 コバルトなどの電着塗装に。
- 硝酸ニッケル(Ni(NO 3) 2 6H 2 O)。 水溶性の潮解性のある緑色の結晶。 セラミック(茶色の顔料)の製造に使用されます。 染色時(媒染剤として)。 ニッケルの電気メッキ中。 酸化ニッケルまたは純粋なニッケル触媒を得る。
- 硝酸第一銅(Cu(NO 3) 2)。 銅を硝酸に溶解し、その後結晶化させることによって得られます(温度に応じて 3 個または 6 個の水分子を含みます)。 青または緑の結晶、水に溶け、吸湿性。 有毒。 花火で使用されます。 染料の製造において。 繊維材料を染色またはプリントする場合(媒染)。 二価酸化銅の製造および印画紙の製造用。 電気メッキを施す際、金属に人工的な緑青を与えるためなど。
- 硝酸ストロンチウム(Sg(NO 3) 2)。 無水塩または水和塩 (水分子 4 つ) として低温で加熱すると、酸化ストロンチウムまたは硫化ストロンチウムが硝酸に作用して得られます。 無色の結晶性粉末で、潮解性があり、水に溶け、加熱すると分解します。 火工品(赤色光)やマッチの製造に使用されます。
- 硝酸カドミウム(Cd(NO 3) 2 4H 2 O)。 酸化物から得られる。 無色の針状で潮解性があり、水に溶ける。 セラミックやガラス産業で着色剤として使用されます。
- 硝酸バリウム(Ba(NO 3) 2)。 天然炭酸塩(ウィザライト)から得られます(見出し )。 無色または白色の結晶または結晶性粉末。 水に溶け、有毒。 花火で使用されます (緑色の光)。 爆発物、光学ガラス、セラミック釉薬、バリウム塩または硝酸塩などの製造において。
- 硝酸鉛(Рb(NO 3) 2)。 硝酸鉛は、鉛丹に対する硝酸の作用により二酸化鉛を製造する際の副生成物として形成されます。 無色の結晶で、水に溶けます。 有毒。 花火(黄色光)、マッチ、爆薬、一部の染料の製造に使用されます。 日焼け、写真、リソグラフィー。 有機合成における酸化剤として鉛塩を得る。
上記に加えて 例外、 また 含まれていない以下の製品。
序章
硝酸ナトリウムについて聞いたことがある人はいないでしょう。 業界だけでなく学校でもその名前がよく出てきます。 ただし名前だけ! 硝酸ナトリウムについて他に何が知られていますか? それが今日の記事でお話しすることです。
意味硝酸ナトリウム (式 NaNO 3) は硝酸のナトリウム塩です。 「硝酸ナトリウム」または「硝酸ナトリウム/ナトリウム/チリ硝酸塩」と呼ばれることもあります。
プロパティ
硝酸ナトリウムは、菱面体晶または三方晶系の結晶格子を有する無色の長い結晶で表されます。 とても塩辛い味がします。 物質によって溶解度は異なりますが、硝酸ナトリウムは水に最もよく「溶けます」。 この化合物は380℃の温度で亜硝酸ナトリウムと酸素に分解します。 反応は次のようになります: 2NaNO 3 => 2NaNO 2 + O 2。また、硝酸ナトリウムは交換反応を起こすことがあり、その 2 番目の試薬はアルカリ金属塩です。 生成物の 1 つは常に硝酸塩であり、現在議論されている物質よりも溶解度がはるかに低くなります。 たとえば、硝酸ナトリウムが塩化カリウムと反応すると、硝酸カリウムと食塩(塩化ナトリウム)が形成されます。 議論された硝酸塩は、溶融状態では強い酸化特性を示し、溶液では還元特性を示します。 分解すると酸素が放出され、これによりこの化合物は非金属と反応する可能性があります。

この硝酸塩はいくつかの方法で入手できます。
硝酸と金属または酸化ナトリウムの反応
純ナトリウムを硝酸に加えると中和反応が起こります。 その生成物は、目的の物質である水のほか、窒素ガスとその酸化物 (I、II) になります。 酸化ナトリウムを同じ酸に加えると、結果は今議論されている化合物と水になります。
硝酸と酸性塩または水酸化ナトリウムとの反応
酸性ナトリウム塩 (例えば、重炭酸塩) を HNO 3 に添加すると、目的の物質である水と二酸化炭素が形成され、すぐに蒸発します。 水酸化ナトリウムが 2 番目の反応物になる場合、その酸化物と硝酸の場合と同様、硝酸ナトリウムと H 2 O のみが得られます。
硝酸アンモニウムと酸性塩または水酸化ナトリウムとの反応
硝酸は硝酸アンモニウムに置き換えることができます。 水酸化ナトリウムとの相互作用中に、目的の物質である水とアンモニアガスが形成され、重炭酸ナトリウムと反応すると、これらの化合物と二酸化炭素が生成物になります。
食塩と硝酸銀の反応
この場合、交換反応が起こり、その生成物は硝酸ナトリウムと塩化銀です。
応用

この物質は貴重な窒素肥料として使用されます。 花火、食品、ガラス、金属加工産業は硝酸ナトリウムなしでは成り立ちません。 硝酸ナトリウムは、いくつかの方法で天然鉱床から抽出されます。
この物質は熱水で浸出して結晶化します。
重曹溶液を使用した窒素酸化物の吸収。
硫酸塩・塩化物・炭酸ナトリウムとカルシウム・硝酸アンモニウムの交換反応。
結論
これが硝酸ナトリウムの重要な役割です。 他にも人にとって欠かすことのできない物質がありますが、それについてはまた別の機会にお話します。