A csirkeembriók fertőzése. Csirkeembriók kísérleti fertőzésének módszerei Nézze meg, mi a „Csirkeembrió” más szótárakban
Felkészítő: Ugysheva Sh.E. tanár.
3. dia
A vírusok szerkezete
4. dia
A vírusok szerkezete A – egyszerű vírus B – összetett vírus
5. dia
Veszélyességük alapján a vírusokat négy csoportba sorolják: I. csoport: Ebola, Lassa, Marburg, Machupo-láz, himlő és hepatitis B vírus (majmok) kórokozói. II. csoport: arbovírusok, egyes arenavírusok, veszettségvírusok, humán hepatitis C és B vírusok, HIV. III. csoport - influenzavírusok, gyermekbénulás, encephalomyocarditis, vaccinia. IV. csoport - adenovírusok, koronavírusok, herpeszvírusok, reovírusok, onkovírusok.
6. dia
7. dia
A vírusok osztályozásának elvei A nukleinsav típusa, szerkezete, replikációs stratégiája A virion mérete, morfológiája, szimmetriája, kapszomerek száma, szuperkapszid jelenléte. Specifikus enzimek jelenléte, különösen RNS és DNS POLIMERÁZOK, neuraminidázok Fizikai és kémiai anyagokkal, különösen éterrel szembeni érzékenység Immunológiai tulajdonságok Természetes átviteli mechanizmusok Tropizmus a gazdaszervezetbe, annak szöveteibe és sejtjeibe Patológia, zárványképződés Betegségek tünete.
8. dia
A vírusok osztályozása (RNS-tartalmú)
9. dia
A vírusok osztályozása (DNS-tartalmú)
10. dia
A vírusok kémiai összetétele A vírusok közé tartoznak a nukleinsavak, fehérjék, lipidek, glikolipidek és glikoproteinek. Mindig tartalmaznak egyfajta nukleinsavat (DNS-t vagy RNS-t), amely a virion tömegének 1-40%-át teszi ki. A vírusgenomok csak néhány fehérje szintéziséhez elegendő információt tartalmaznak. Tömegük eléri a 10-15 mg-ot, ami 1 milliószor kisebb, mint a sejteké, hosszuk pedig akár 0,093 mm.A nukleotidpárok száma 3150-től (hepatitis B vírus) 230 000-ig (variola vírus) terjed. A vírusfehérjéket (70-90%) szerkezeti és nem strukturális fehérjékre osztják. Strukturális - fehérjék, amelyek az érett extracelluláris virionok részét képezik. Számos fontos funkciót látnak el: - megvédik a nukleinsavat a külső károsodástól; kölcsönhatásba lépnek az érzékeny sejtek membránjaival; biztosítják a vírus bejutását a sejtbe; - RNS és DNS polimeráz aktivitással rendelkeznek stb. A nem szerkezeti fehérjék nem részei az érett virionoknak, hanem szaporodásuk során jönnek létre. Ezek: - szabályozzák a vírusgenom expresszióját - olyan vírusfehérjék prekurzorai, amelyek képesek elnyomni a sejtbioszintézist. A virionban elfoglalt helyüktől függően a fehérjéket kapszidra, szuperkapszidra, mátrixra, magfehérjékre és nukleinsav-asszociált fehérjékre osztják. A lipideket (15-35%) komplex vírusok tartalmazzák, és a szuperkapszid héj részét képezik, így kettős lipidréteget alkotnak. Ezek: - stabilizálják a vírusburkot - védelmet nyújtanak a virionok belső rétegeinek a külső környezetben lévő hidrofil anyagoktól - részt vesznek a virionok fehérjementesítésében.
11. dia
Vírusok szaporodása. Jellemzői, hogy a genomokat RNS és DNS egyaránt képviseli, szerkezetükben és formájukban változatosak, szinte minden vírus RNS képes a sejt DNS-étől függetlenül replikálódni A vírusok saját diszjunktív szaporodási módszerrel rendelkeznek, amely az a tény, hogy a genom és a vírusfehérjék szintézise térben és időben elválik egymástól: a sejtmagban a nukleinsavak, a citoplazmában a fehérjék replikálódnak, a citoplazma membrán belső felületén pedig teljes virionok összegyűjtése történhet. A vírusreprodukció egy egyedülálló rendszer az eukarióta sejtekben lévő idegen információk újrateremtésére, és biztosítja a sejtszerkezetek abszolút alárendeltségét a vírusok szükségleteinek. A vírusok szaporodásának számos szakasza van. A koraiak közé tartozik a vírusok adszorpciója a sejtfelszínen, behatolása (penetrációja) a sejtbe és levetkőzése (fehérjementesítése). A késői szakaszok (vírusgenom-stratégia) magukban foglalják a vírus nukleinsav-szintézisét, a fehérjeszintézist, a virionok összeállítását és a vírusrészecskék sejtből történő felszabadulását.
12. dia
A vírusok sejtfelszínhez kötődését két mechanizmus biztosítja: nem specifikus és specifikus. A nemspecifikus az elektrosztatikus kölcsönhatás erői határozzák meg, amelyek a vírusok és a különböző töltéseket hordozó sejtek felszínén lévő kémiai csoportok között lépnek fel. A specifikus mechanizmust (reverz és nem reverzibilis adszorpció) a komplementer vírus- és celluláris receptorok határozzák meg. Lehetnek fehérje-, szénhidrát- vagy lipid jellegűek. Például az influenzavírusok receptora a sziálsav. A receptorok száma az adszorpciós helyeken elérheti a 3000-et. A vírusok felszínén a receptorok általában a mélyedések, rések alján helyezkednek el. A vírusok behatolása a sejtbe a receptor endocitózis (a viropexis egyik változata) mechanizmusán keresztül történik a sejtmembránok speciális területein, amelyek egy speciális, nagy molekulatömegű blokkot - klatrint - tartalmaznak. A membránok behatolnak, és klatrinnal bevont intracelluláris vakuolák képződnek. számuk elérheti a 2000-et. A vakuolák egyesülve receptoszómákká alakulnak, és ez utóbbiak egyesülnek a lizoszómákkal. A vírusok felszíni fehérjéi kölcsönhatásba lépnek a lizoszómák membránjaival, és nukleoproteinjük a citoplazmába kerül. Van azonban egy másik mechanizmus is a vírusok behatolására a sejtbe - a membránfúzió kiváltása. Egy speciális vírus fúziós fehérjének (F- fúzióból - fúzióból) köszönhetően fordul elő. A folyamat eredményeként a vírus lipoprotein buroka beépül a sejtmembránba, és genomja behatol a sejtbe. Ilyen fehérjét azonosítottak influenzavírusokban, parainfluenzában, rhabdovírusokban stb.
13. dia
A virionok levetkőzése többlépcsős folyamat, melynek során felszabadul a nukleáris apparátusuk, eltűnnek a genomexpressziót gátló védőburkok. Speciális területeken fordul elő - lizoszómák és a Golgi-készülék. A szaporodás későbbi szakaszai a vírusos nukleinsavak és fehérjék szintézisére irányulnak. A replikáció mechanizmusa (a vírusgenomok kialakulása, amelyek az előd pontos másolata) a nukleinsav jellemzőitől függ. Ez nem ugyanaz a különböző típusú vírusok esetében. Az RNS-t tartalmazó vírusokban a replikáció hasonló minták szerint megy végbe. Az mRNS szintetizálódik az anya-RNS-en, és az RNS közbenső formái templátként szolgálnak a vírusgenom szintéziséhez. A transzkripció a hírvivő RNS képződésének folyamata. Speciális enzimek, az úgynevezett DNS- vagy RNS-függő RNS-polimerázok segítségével történik. A DNS-vírusok sejtes eredetű enzimekkel rendelkeznek, míg az RNS-vírusok saját vírusspecifikus transzkriptázokkal rendelkeznek. A transzlációs szakaszban a genetikai információt kiolvassák a hírvivő RNS-ből, és aminosavszekvenciává fordítják. A folyamat a riboszómákban megy végbe. Az RNS-molekulák a transzfer RNS-ek által felismert triplett kódszekvencia szerint mozognak a riboszómákba. Ez utóbbiak speciális területeken hordozzák az aminosavakat.
14. dia
15. dia
16. dia
Vírusok tenyésztése Csirkeembriók 6-12 napos korig. A fertőzés módjai - nyitott, zárt
17. dia
Vírusok tenyésztése Sejttenyészetek: - humán embriók, majomvesék, csirkeembrió fibroblasztok, stb. primer tripszinezett tenyészetei; több passzázson is képesek növekedni másodlagos kultúraként; átültethető sejtek; olyan sejttenyészetek, amelyek korlátlan növekedésre és szaporodásra képesek; Ezeket daganatokból vagy normál emberi vagy állati szövetekből nyerik, amelyek megváltozott kariotípussal rendelkeznek. HeLa (nyaki karcinóma) Hep-2 (humán gége karcinóma), CV (humán szájüregi karcinóma), RD (humán rhabdomyosarcoma), RH (humán embrionális vese), Vero (zöld majomvese), SPEV (sertés embrionális vese), VNK- 32 (szíriai hörcsög vese). Sejttenyészet diploid sejtek; Ezek azonos típusú sejtkultúrák, diploid kromoszómakészlettel rendelkeznek, és laboratóriumi körülmények között akár 100 szubkultúrát is képesek ellenállni. Kényelmes modellek a vírusok vakcinakészítményeinek előállítására, mivel mentesek az idegen vírusok általi szennyeződéstől, megőrzik eredeti kariotípusukat az átoltások során, és nincs onkogén aktivitásuk. Leggyakrabban humán embrionális fibroblasztokból (WI-38, MRC-5, MRC-9, IMR-90), tehenekből, sertésekből, juhokból és hasonlókból származó tenyésztővonalakat használnak. A sejttenyészeteket fagyasztva tároljuk.
18. dia
A sejttenyészetek vagy növekedésük támogatására használt tápközegek lehetnek természetesek vagy szintetikusak (mesterségesek). Természetes táptalajok - szarvasmarha vérszérum, savós üregekből származó folyadékok, tejhidrolízis termékek, különféle hidrolizátumok (5% hemohidrolizátum, 0,5% laktoalbumin hidrolizátum) vagy szövetkivonatok. Kémiai összetételük elősegíti az emberi testben létező állapotokhoz hasonló feltételek megteremtését. Az ilyen médiumok jelentős hátránya a nem szabványos jellegük, mivel az őket alkotó összetevők minőségi és mennyiségi összetétele változhat. A szintetikus tápközegeknek ez a hátránya nincs, mert kémiai összetételük szabványos, mert különféle sóoldatok (vitaminok, aminosavak) mesterséges körülmények között történő kombinálásával nyerik őket. A leggyakrabban használt oldatok közé tartozik a 199-es táptalaj (primer tripszinezett és folyamatos sejtkultúrák tenyésztése), az Eagle táptalaj (minimális aminosav- és vitaminkészletet tartalmaz, és diploid sejtvonalak és folyamatos sejtvonalak tenyésztésére használják), az EagleMEM táptalaj (tenyésztés). különösen igényes sejtvonalak), Hanks oldat, amelyet táptalaj készítésére, sejtek mosására stb.
19. dia
20. dia
21. dia
Laboratóriumi állatok fertőzése. Számos laboratóriumi állatot széles körben használnak a virológiában vírusok izolálására és azonosítására, specifikus vírusellenes szérumok előállítására, a vírusos betegségek patogenezisének különböző aspektusainak tanulmányozására, a betegségek leküzdésére és megelőzésére szolgáló módszerek kidolgozására. A leggyakrabban használt különböző korú (két napos) fehér egerek, fehér patkányok, tengerimalacok, nyulak, gopherek, gyapotfarkú patkányok, majmok és mások.
22. dia
Az állatok megfertőzésének többféle módja van, a vírusok tropizmusától és a betegség klinikai képétől függően. A vizsgálati anyag beadható: - a szájon keresztül - a légutakba (inhaláció, orron keresztül) - bőrön - intradermálisan - szubkután, intramuszkulárisan - intravénásan - intraperitoneálisan - intracardialisan - a karcolt szaruhártyára - a szem elülső kamrájába - az agyba.
23. dia
24. dia
25. dia
26. dia
A bakteriofágok (fágok) (az ógörög φᾰγω szóból – „felfalom”) olyan vírusok, amelyek szelektíven fertőzik meg a baktériumsejteket. Leggyakrabban a bakteriofágok a baktériumok belsejében szaporodnak, és lízisüket okozzák. A bakteriofágok jellemzően fehérjeburkolatból és egy- vagy kétszálú nukleinsav (DNS vagy ritkábban RNS) genetikai anyagából állnak. A részecskeméret körülbelül 20-200 nm. Függetlenül Frederick Twort-tól, D'Herelle francia-kanadai mikrobiológustól, Felix 1917. szeptember 3-án számolt be bakteriofágok felfedezéséről. Ezzel együtt ismeretes, hogy Nikolai Fedorovich Gamaleya orosz mikrobiológus 1898-ban először figyelte meg a baktériumok (antrax bacillus) lízisének jelenségét egy átültethető ágens hatására. Életciklus A mérsékelt és virulens bakteriofágok a baktériumsejttel való interakció kezdeti szakaszában ugyanazt a ciklust folytatják. Bakteriofágok adszorpciója fágspecifikus sejtreceptorokon. Fág nukleinsav injektálása gazdasejtbe. Fág és bakteriális nukleinsav együttes replikációja. Sejtosztódás, mitózis. Továbbá a bakteriofág két modell szerint fejlődhet: lizogén vagy lítikus úton. A mérsékelt égövi bakteriofágok a sejtosztódás után profág állapotban vannak (lizogén út). Virulens bakteriofágok a Lytic modell szerint fejlődnek: A fág nukleinsava irányítja a fág enzimek szintézisét, ehhez a bakteriális fehérjeszintetizáló apparátust. A fág így vagy úgy inaktiválja a gazda DNS-t és RNS-t, és a fág enzimek teljesen lebontják; A fág RNS-e „alárendelte” a sejtes apparátust a fehérjeszintézishez. A fág nukleinsav replikálja és irányítja az új burokfehérjék szintézisét. Új fágrészecskék keletkeznek a fehérjehéj (kapszidok) spontán önszerveződésének eredményeként a fág nukleinsav körül; A lizozim szintetizálása a fág RNS szabályozása alatt történik. Sejtlízis: a sejt lizozim hatására felrobban; körülbelül 200-1000 új fág szabadul fel; a fágok más baktériumokat is megfertőznek. 1 - fej, 2 - farok, 3 - nukleinsav, 4 - kapszid, 5 - "gallér", 6 - a farok fehérjehüvelye, 7 - farokszál, 8 - tüskék, 9 - alaplemez
27. dia
A csirkeembrió fertőzése A csirkeembriót vírusok és mikoplazmák tenyésztésére használják. Az embriókat 8-14 napos korban használják, a vírus típusától és a fertőzés módjától függően; a chorion-allantois membránhoz, az allantois és a magzatvíz üregébe, a sárgája zsákba. A fertőzés előtt ovoszkóppal meghatározzák az embrió életképességét, és ceruzával megjelölik a légzsák határait a héjon. A csirkeembriók fertőzését dobozban, szigorúan aszeptikus körülmények között, forralással sterilizált műszerrel végezzük. A légtér feletti héjat alkohollal áttöröljük, lángon megégetjük, 2%-os jódoldattal megkenjük, ismét alkohollal letöröljük és elégetjük. A vírusos anyagot 0,05-0,2 ml mennyiségben a chorion-allantois membránra visszük fel tuberkulin fecskendővel vagy Pasteur pipettával. Az embriókat 48-72 órás, termosztátban történő inkubálás után feldaraboljuk. A vírus jelenlétét a chrolantois membránban a következők határozzák meg: 1. Különböző formájú fehéres, átlátszatlan foltok; 2. A hemagglutinációs reakcióban.
28. dia
29. dia
30. dia
31. dia
Köszönöm!!!
Az összes dia megtekintése
A virológiai vizsgálatokhoz 7-12 napos csirkeembriókat használnak ( leggyakrabban 9-12 nap, néha 5-12 nap).
A fertőzés előtt meghatározzák az embrió életképességét. Az ovoszkópia során az élő embriók mozgékonyak, az érrendszer jól látható. A légzsák határait egyszerű ceruzával jelöljük. A csirkeembriókat aszeptikus körülmények között, steril eszközökkel fertőzzük meg, miután a légtér feletti héjat jóddal vagy alkohollal előkezelték.
A csirkeembriók fertőzésének módszerei különböző lehet: a vírus alkalmazása a chorioallantois membránra, a magzatvíz és az allantois üregébe, a tojássárgája zsákba és az embrió testébe. A fertőzési módszer megválasztása a vizsgált vírus biológiai tulajdonságaitól függ.
A csirkeembriók megfertőzésének két módja van:
1) nyitott - a légzsák feletti héjat alkohollal és jóddal kezelik, éles ollóval levágják a héjat, eltávolítják a légzsák héjának felső lapját, és megfertőzik. A lyukat speciális üvegfedéllel vagy héjjal zárják le, és steril olvasztott paraffinnal zárják le.
2) Zárt - a légzsák feletti héjat alkohollal és jóddal kezelik, lyukat készítenek a héjon szúróeszközzel és 0,1-0,2 ml vírustartalmú anyagot fecskendeznek be egy fecskendővel, vastag tűvel az ellenőrzés alatt egy ovoszkópé. A lyukat steril olvasztott paraffinnal zárjuk le.
A fertőzött embriókat 2-4 napig termosztátban inkubálják. Ezután egész nap 4°C-ra hűtik a maximális érszűkület érdekében. Nyissa ki steril körülmények között, miután a héjat előzőleg alkohollal vagy jóddal kezelte.
A vírust csirkeembrióban az embrió elpusztulása, az allantois- vagy magzatvízzel történő üvegen fellépő pozitív hemagglutinációs reakció, valamint a chorion-allantois membrán gócos elváltozásai („plakkok”) jelzik.
A vírusok csak élő sejtekben tenyészthetők. Erre a célra bármilyen biológiai rendszert használnak: állati szervezeteket, csirkeembriókat, sejtkultúrákat. A laboratóriumi állatok kiválasztásakor az alábbi követelményeket kell betartani: - az állatoknak egészségesnek kell lenniük. A viváriumba újonnan érkezőket karanténban tartják (egereket és patkányokat 14 napig, másokat 21 napig). A vírusos etiológiájú látens (rejtett) fertőzések kizárása.
Minden állat esetében teljesülnek a következő követelmények: - az állatoknak érzékenyeknek kell lenniük erre a vírusra; - nagy jelentősége van az állat életkorának: a fiatalok és az újszülöttek a legérzékenyebbek, de bizonyos esetekben felnőtt állatokat is felhasználnak a betegség egyértelmű klinikai tüneteinek azonosítására; - az állatoknak azonos korúnak és testtömegűnek kell lenniük; Erre jobban megfelelnek a lineáris állatok, pl. beltenyésztés eredményeként kapott.
A virológiai vizsgálatokhoz laboratóriumi állatok szubkután, bőr, intradermális, intramuszkuláris, intraperitoneális, intravénás, orális, intranazális és intracerebrális fertőzését alkalmazzák.
A "Baktériumok tenyésztése. A baktériumok tenyésztésének módszerei. A telepek jelei." témakör tartalomjegyzéke:Szervtenyészetek a vírus kimutatására. Csirkeembriók a vírusfertőzések diagnosztizálásában. Csirke embrióvírussal való fertőzés. A csirkeembrió vírussal való fertőzés módszerei.
Nem minden sejttípus képes monoslomon formájában növekedni, bizonyos esetekben a differenciált sejtek fenntartása csak szervkultúra. Általában speciális funkciójú szövetszuszpenzióról van szó, amelyet túlélő szövettenyészetnek is neveznek.
Csirkeembriók a vírusfertőzések diagnosztizálásában
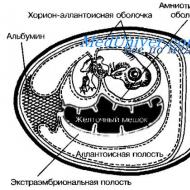
Csirke embriók(11-20. ábra) szinte ideális modellek bizonyos vírusok (például influenza és kanyaró) tenyésztésére. Az embrió zárt ürege megakadályozza a mikroorganizmusok kívülről való behatolását, valamint a spontán vírusfertőzések kialakulását. Az embriókat a vírusok kóros anyagból történő elsődleges izolálására használják; átjuttatásukra és tartósításukra, valamint a szükséges vírusmennyiség beszerzésére. Egyes kórokozók (például herpeszvírusok) jellegzetes elváltozásokat okoznak (a betegség felismerhető róluk). A fertőzést a chorion-allantois membránon, a magzatvízben vagy az allantois üregben vagy a tojássárgája üregében hajtják végre.
Vírusfertőzés a chorion-allantois membránon. Általában 10-12 napos embriókat használnak. A tojásokat áteresztő fényben nézzük, feljegyezzük a légzsák helyét, és kiválasztunk egy erek nélküli területet. Óvatosan távolítsa el a héjtöredéket, engedje el a külső héjat, és finom nyomással húzza le. Ezután egy lyukat készítenek a légzsák szélén. Ezen a lyukon keresztül történő leszíváskor a chorion-allantois membrán leválik a külső membránról. A baktériumoktól és protozoonoktól mentes vizsgálati anyagot felvisszük rá (baktériumszűrőn átengedjük és baktericidekkel kezeljük). Fertőzés a magzatvíz üregében. Jellemzően 7-14 napos embriókat használnak, amelyeknél a chorion-allantois membrán leválása után (lásd fent) a nyílást kitágítják, a magzatburkot csipesszel megragadják és a chorion-allantois membránon keresztül eltávolítják. Ezen keresztül a vizsgálati anyagot a magzatvíz üregébe juttatják.
Vírusfertőzés az allantois üregében. A 10 napos embriókat a héjon és az alatta lévő membránokon kialakított lyukakon keresztül fertőzik meg (lásd fent).
Vírusfertőzés a tojássárgája tasakban. 3-8 napos embriókat használnak, amelyekben ebben a korban a tojássárgája szinte a teljes tojásüreget elfoglalja. A fertőzés a légzsákban kialakított lyukon keresztül történik.
 Rizs. 11-20. Egy fejlődő csibeembrió sematikus ábrázolása.
Rizs. 11-20. Egy fejlődő csibeembrió sematikus ábrázolása.
A csirkeembrió vírussal való fertőzés eredményeinek megfigyelése és rögzítése
A tartalom vírus tartalmú anyagként használható peteburok, allantois és magzatvíz, vagy a teljes embrió, a környező szövetekkel együtt darabokra vágva. A chorion-allantois membrán jellegzetes elváltozásainak azonosításához a héjat és a külső membránt eltávolítják. Ezután a membránt eltávolítjuk és steril vízbe helyezzük. A léziók természetét sötét háttér előtt tanulmányozzuk.
Csirkeembrió Csirkeembrió
(CE) - az embrionális fejlődés különböző szakaszaiban elhelyezkedő csirkeembrió. A mikrobiolban. a gyakorlatban vírusok, rickettsia és néha baktériumok izolálására, tenyésztésére és azonosítására használják. Laboratóriumi célokra friss, trágyázott, jól átlátszó és repedésmentes héjú EC-ket választanak ki. A keltetést háromlábú fészkekben végezzük, a tojás tompa végével felfelé, jól szellőző inkubátorokban vagy termosztátokban 37-37,5 °C-on, relatív páratartalom 63-65%. A fertőzéshez 4-13 napos embriókat választanak ki kifejezett erekkel, tojássárgájával és mozgó árnyékkal. A fertőzés előtt a tojáshéjat alkohollal kezelik, elégetik, és a bejuttatási területen (általában a légkamra felett) 2% -os jódotinktúrával megkenik. Anyag vagy kutatás a héjat felnyitva vagy anélkül fecskendezik a sárgájazsákba (rickettsia), az allantois vagy magzatvíz üregeibe (a legtöbb vírus), és a chorion-allantois membránra helyezik. Ritkábban az embrió testébe vagy intravénásan adják be. A fertőzött EC-ket termosztátba helyezzük a mikroba típusától és a vizsgálat céljaitól függő feltételek mellett és időtartamra. Néhány adat a fertőzés eredményeiről az EC külső mikroszkópos vizsgálatával nyerhető (erek injekciója, mobilitás elvesztése stb.). A legtöbb esetben azonban az EC megnyitásra kerül. Ehhez alkoholos és jódos tinktúrával történő kezelés után a légzsák határa felett levágják a héjat, először az allantois, majd a magzatvizet Pasteur pipettával vagy fecskendővel szívják ki, elkerülve az erek és a peteburok. Az embriót és a chorioallantois membránt eltávolítjuk a héjból, steril edényekbe helyezzük, és steril desztillátummal mossuk. öntsük és vizsgáljuk meg. Az embrió és folyadékai vizsgálatának további menete a mikroba vagy vírus típusától és a kísérlet céljától függ.
(Forrás: Dictionary of Microbiology Terms)
Nézze meg, mi a „csirkeembrió” más szótárakban:
EMBRIOOTOXICITÁS- embriotoxicitás, fizikai, biológiai, kémiai és egyéb szerek azon képessége, hogy negatív hatást gyakoroljanak a fejlődő embrióra. Különböző anyagok embriotoxikus hatását a nőstényeknek való kitétel határozza meg... ... Állatorvosi enciklopédikus szótár
A "Csirkék" kérése ide kerül átirányításra; lásd még más jelentéseket is. ? Házi csirke ... Wikipédia
Csirkék A csirkék minden udvar díszei Tudományos besorolás Királyság: Állatok Típus: Chordata osztály ... Wikipédia
Vírusok izolálása laboratóriumi állatokban.
A laboratóriumi állatok kiválasztása a vírus típusától függ. A laboratóriumi állatok biológiai modellek. Néha 3-5 „vak”, tünetmentes átoltás szükséges ahhoz, hogy a vírust a laboratóriumi körülményekhez igazítsák. A laboratóriumi állatok azonban nem érzékenyek egyes vírusokra, ilyenkor természetesen fogékony állatokat kell használni. Mint például a sertéspestis és a lovak fertőző vérszegénysége esetén.
A laboratóriumi állatok fertőzésének célja:
1. Tanulmányozza a betegség patogenezisét;
2. izolálja a vírust a kórokozó anyagból;
3. Immun- és hiperimmun szérumok előállítása;
4. vakcinák előállítása;
5. Vírusok karbantartása laboratóriumi körülmények között;
6. Titrálás az egységnyi térfogatú vírus mennyiségének meghatározására;
7. Biológiai modell a semlegesítési reakció szakaszolására;
A laboratóriumi állatok fertőzésének módszerének megválasztása a vírus tropizmusától függ. Így a neurotróp vírusok tenyésztésekor az állatok az agyba fertőződnek; légúti intranazálisan, intratracheálisan; dermatróp - szubkután és intradermálisan.
A fertőzést az aszepszis és az antiszeptikumok szabályainak betartásával végezzük.
Számos módja van a vírustartalmú anyagok bejuttatásának az állatok testébe:
Bőr alatti; - Intracerebrális; - Intradermális;
intraperitoneális; - Intramuszkuláris; - Intraokuláris;
Intravénás; - Intranazális; - Táplálkozási;
A fertőzés után az állatokat megjelöljük, elkülönített dobozba helyezzük, és 10 napig megfigyeljük. Az állat elhullása a fertőzést követő első napon nem specifikusnak minősül, és később nem veszik figyelembe.
3 jel jelzi a fertőzés hatékonyságát:
Klinikai tünetek jelenléte
Egy állat halála
Patoanatómiai változások (a szerv mérete, alakja, színe és állaga).
A csirkeembrió egy megtermékenyített csirketojás, amelyben embrió (embrió) fejlődik. A vírusok csirke- és fürjeembriókon történő tenyésztése a közelmúltban széles körben elterjedt, mint az egyik legegyszerűbb és legmegbízhatóbb módszer számos vírus és néhány baktérium - Brucella, Rickettsia, Vibrio - tenyésztésére és diagnosztizálására.
Számos emberi és állati vírus tenyészthető fejlődő csirkeembriókban. Az embrionális szövetek, különösen az embrió membránjai, amelyek csírahámszövetekben gazdagok, számos vírus szaporodásához kedvező környezet. Az epitheliotrop tulajdonságú vírusok (himlő, ILT stb.) sikeresen fejlődnek a chorioallantois membránon, makroszkóposan látható elváltozásokat okozva. A myxovírusok különböző képviselői (influenza, Newcastle-kór, kutyapír stb.), fertőző bronchitis vírusok, kiskacsa hepatitis, arbovírusok stb. jól szaporodnak az embrióban, amikor az anyagot az allantois üregébe juttatják. Egyes vírusok sikeresen tenyészthetők a tojássárgája tasakban.
Előnyök:
1. Gazdaságilag jövedelmező, ráadásul a tojás könnyen beszerezhető;
2. A fejlődő csirkeembriókban hiányoznak a védőmechanizmusok, mert az immunrendszer még nem fejlődött ki;
3. A tojáshéj megakadályozza, hogy a környezetből származó baktériumok és vírusok behatoljanak rajta;
A vírusok csirkeembriókon történő tenyésztéséhez és izolálásához nagyon egyszerű felszerelésre van szükség - normál termosztátra vagy inkubátorra.
Körülmények:
1. A tojásokat olyan gazdaságokból nyerik, amelyekről ismert, hogy mentesek a fertőző betegségektől;
2. A csirkeembriókat érdemes fehér csirkefajtákból (Leghorn, Russian White) beszerezni, mert azok jobban ellenállnak a manipulációnak és nem halnak bele kisebb sérülésekbe. Ezenkívül a héjuk fehér és átlátszóbb, mint más fajtáké, és könnyebben átlátható, ami kényelmes a megtekintéshez és a megfigyeléshez a velük végzett munka során;
3. Az inkubációhoz a legfeljebb 10 napja lerakott megtermékenyített petéket kell kiválasztani;
4. Vegyünk szennyezetlen tojásokat, mert keltetés előtt nem moshatók, és a piszkos tojások kevésbé láthatóak megtekintéskor (ovoszkópia) és a velük való munka során a manipuláció során az embrió megfertőződhet;
A tojásokat inkubátorban vagy vízmelegítésű, levegős termosztátban keltetik, a termosztátban való keltetés során pedig a tojásokat napi 2-3 alkalommal meg kell fordítani, és a jobb gázcsere érdekében 5-10-re ki kell venni. percek a levegőbe. Egy bizonyos páratartalom fenntartása érdekében a termosztátba egy edényt helyeznek el párologtatás céljából, a termosztát hőmérsékletének 38°-nak kell lennie.
Az embrió fejlődése már az inkubáció első napján megtörténik, megtörténik az agy és a csontváz lerakása. A csirkeembrió szerkezete 7-9 napos korban(lásd a jegyzetfüzetet).
Fertőzésre leggyakrabban 7-12 napos embriókat használnak. A csirkeembriókkal végzett munka steril szobadobozban történik, az aszepszis legszigorúbb betartásával.
A csirkeembriók megfertőzésének célja:
1. Válassza le a bélést a lakkanyagtól;
2. Vakcinák fejlesztése;
3. A vírus fenntartása laboratóriumban;
4. Vírusok titrálása;
5. Biológiai modell a semlegesítési reakció szakaszolására;
6. Vírusinterferencia és interferontermelés vizsgálata; A csirkeembriók fertőzése:
A fertőzéshez jól meghatározott motilitású, életképes embriókat kell kiválasztani. A fertőzés előtt minden embriót gondosan megvizsgálnak egy elsötétített szobában ovoszkóp segítségével.
Az embriók fertőzés előtti gyertyázása során a héjon egyszerű ceruzával körvonalazzák a pugát (légüreget), a nagy erek lefutását és az embrió megjelenési helyét, vagyis azt a területet a héjon, ahol az embrió a legközelebb fekszik az embrióhoz. azt. A mopsz megjelölése, az embrió megjelenési helye és a nagy erek lefutása ezután támpontul szolgál a vírus tartalmú anyag fertőzéskori bejuttatási helyének kiválasztásakor.
A fertőzésre kiválasztott csirkeembriókat egy dobozba helyezik át, ahol megmunkálják őket. A fertőzés előtt az anyag bevezetésének helyén lévő héjat kétszer kezelik jódozott alkohollal és elégetik. A fertőzés dózisa 0,1-0,2 cm.
A vírus típusától és a fertőzés céljától függően különbözőek lehetnek vírustartalmú anyagok bejuttatásának módjai:
1) A chorioallantois membrán fertőzése , 7-12 napos embriókat neurotrop, dermatróp és egyes pantropikus vírusok (himlő, agyvelőgyulladás, ILT, ragadós száj- és körömfájás, veszettség, pestis stb.) izolálására és tenyésztésére használnak. 3 fertőzési lehetőség van:
a) nyissuk ki a pugát és vágjuk le ollóval, válasszuk le az alhéj membránját és vigyünk fel anyagot a chorioallantois membránra (CAO). A tojásban lévő lyukat ezután steril üvegkupakkal lezárjuk, és a kupak széleit viaszoljuk;
b) tűreszelővel (reszelővel) vagy fogazott szikével vágjunk ki a héjból egy kb. 1 cm oldalhosszúságú háromszöget a puja peremén az embrió bemutatási oldalán, távolítsuk el a héj metszetét és csillag alatti membránt csipesszel és bevezetjük az anyagot. A lyukat steril fedőüveggel fedjük le, a széleit paraffinizáljuk vagy steril ragasztószalaggal lezárjuk.
c) a héj egy kis, körülbelül 0,5 cm-es területét szikével eltávolítjuk az embrió bemutatásának helyén, majd ezen a területen csipesszel vagy tűvel eltávolítjuk a héj alatti membránt és az anyagot befecskendezik. Ha az anyag nem illeszkedik jól a tojás üregébe, gumiburával a tojás héjában lévő lyukon keresztül kiszivattyúzhatja a levegőt a tojásból, és ennek eredményeként mesterséges tojás képződik a tojáson. hely, ahol az anyagot bevezetik, majd az anyag könnyen beilleszthető. A héjon lévő lyukat ragasztógipsszel borítják vagy viaszolják.
2) Fertőzés az allantois üregben. Ez a fertőzési módszer nagyon egyszerű, és számos vírus izolálására használják. A fertőzéshez 10-11 napos embriókat vesznek. Két fertőzési lehetőség van:
a) a fertőzés a pugán keresztül történik anélkül, hogy levágnák. Tű segítségével mérjük meg a puga tetejétől a puga határáig a távolságot, amelyet ceruzával jelölünk a héjon, és szúrjuk be a tűt a megjelölt mélységig, és mélyítsük még 0,5 cm-rel a chorioallantois membrán átszúrásához;
b) az anyagot az embrió megjelenési helyén a héjon átszúrással tűvel szúrják be 3-5 mm mélységig, avaszkuláris területen. A héjon lévő lyukat ragasztógipsszel borítják vagy viaszolják.
3) Fertőzés a sárgája zsákban. A fertőzésre 5-8 napos embriókat használnak. Két fertőzési lehetőség van:
a) a tűt a puja oldaláról ovoszkóp felügyelete mellett az embrió megjelenési helyéhez képest 45°-os szögben a tojássárgája zsákba szúrják;
b) a tojást az állványra helyezzük az embrió megjelenési pontjával lefelé, és a tűt felülről lefelé az embrió felé szúrjuk körülbelül 1 cm mélységig.
Az injekció beadási helyét ragasztószalaggal lezárjuk és paraffinizáljuk. 4) Fertőzés a magzatvíz üregében. Ezzel a fertőzési módszerrel a vírus behatolhat és szaporodhat a magzatvízzel érintkező különféle sejtekben. A fertőzés megkönnyítése érdekében ajánlott az embriókat a fertőzés előtt 2-3 nappal inkubálni úgy, hogy a mopsz felfelé nézzen. Ezután az embrió és az amnion felfelé mozog, és kényelmesebb a fertőzés. Két fertőzési lehetőség van:
a) nyissa ki és vágja le a pugát, csipesszel távolítsa el a héj alatti membránt, és fogja meg az amniont, csipesszel húzza fel az amniont, és 0,1 ml-es adagban adagolja a magzatüregbe. A héjon lévő lyukat ezután steril üvegkupakkal lezárják, és a széleit viaszosnak kell kezelni;
b) fertőzés hosszú tűvel pugán keresztül egy sötét szobában, szemellenőrzés mellett.A tű hegyét először derékszögben meghajlítjuk, hogy kis területet hozzunk létre. A tűt a szem irányítása alatt szúrják be az előembrió kiemelkedésén keresztül, ilyenkor egy tompa tű nyomására az embrió megmozdul, majd enyhe nyomással átszúrják az amniont és a tűt enyhén megnyomják. visszahúzta. Ebben az esetben az embriónak felfelé kell mozognia a tű mögött. Ezután bevezetik az anyagot.
5) Fertőzés az embrió testébe és fertőzés az agyba. 7-12 napos embriókat használnak, a fertőzést úgy hajtják végre, hogy az anyagot a test különböző részeibe vagy közvetlenül az agyba juttatják. Fertőzés céljából a pugát kinyitják, és az embriót csipesszel felhúzzák. Ezekkel a fertőzési módszerekkel a fertőzött embriók számának akár 30%-a vagy több is elpusztulhat sérülés következtében.
6) Fertőzés a chorioallantois membrán nagy ereiben. Ezt a fertőzési módszert az előzőhöz hasonlóan nagyon ritkán használják. Az anyagot vékony tűvel fecskendezik be, miután eltávolították a héjat az ér mentén, közvetlenül az edénybe a véráramlás mentén.
Fertőzés után a csirkeembriókat egyszerű ceruzával meg kell jelölni és termosztátba kell helyezni. Naponta megtekintéssel figyelik őket, a megfigyelést a vírus típusától függően legfeljebb 7-8 napig végzik. Ha az embriók elpusztulnak, azonnal ki kell venni a termosztátból, és kinyitásig hűtőszekrénybe helyezni. Ha az embrió az első 14-18 órán belül elpusztul, annak oka lehet a kóros anyag sérülése vagy toxicitása. Ezért, csakúgy, mint a laboratóriumi állatok megfertőzésekor, kétes esetekben ajánlatos több passzálást végezni, és minden anyaghoz több embriót venni.
Az elhullott fertőzött, illetve a megfigyelési idő lejárta után eltávolított csirkeembriók boncolása az aszepszis szabályai szerint steril boxolási körülmények között történik. Felbontáskor a héjat alkohollal kezelik és elégetik, majd a pugát levágják. A felnyílt embrióból először óvatosan kiszívják az allantois folyadékot (mennyisége kb. 7 ml), majd csipesszel visszahúzzák a magzatvízhártyát, Pasteur pipettával átszúrják és kiszívják a magzatvizet (mennyisége 1,0- 1,5 ml), majd a sárgáját összegyűjtjük, a membránokat eltávolítjuk és az embriót eltávolítjuk. A folyadékot, a membránokat és magát az embriót gondosan megvizsgálják a változások szempontjából. A magzatvíz általában teljesen tiszta, de fertőzött állapotban zavaros és véres lehet. A vírus okozta jellegzetes elváltozások a chorioallantois membránon a legkifejezettebbek: gyulladásos gócok jelennek meg, átlátszatlanok, kerek alakúak, bevérzések. Vérzések fordulhatnak elő az embrió testén. Minden anyagot steril tartályokba kell gyűjteni.
A virológiában a csirkeembriókat széles körben használják nemcsak vírusok izolálására, hanem antigének felhalmozására és kinyerésére, élő és elölt vakcinák készítésére, vírusok titrálására, vírussemlegesítési reakció lebonyolítására, vírusok attenuálására (gyengítésére), vírusok interferenciájának tanulmányozására. vírusok és interferon beszerzése .