Diabetes insipidus nőknél, férfiaknál és gyermekeknél. Diabetes mellitus gyermekeknél Idiopátiás diabetes mellitus
7.1. A DIABÉTES MELLITUS OSZTÁLYOZÁSA
Cukorbetegség(DM) az anyagcsere-betegségek csoportja, amelyet az inzulin szekréciójának és/vagy hatékonyságának csökkenése miatti hiperglikémia jellemez. A cukorbetegséggel együtt kialakuló krónikus hiperglikémia számos szervből és rendszerből, elsősorban a szívből, az erekből, a szemből, a veséből és az idegekből származó szövődmények kialakulásával jár. Összességében a lakosság 5-6%-a szenved cukorbetegségben. A világ gazdaságilag fejlett országaiban 10-15 évente megduplázódik a cukorbetegek száma. A cukorbetegség várható élettartama 10-15%-kal csökken.
A cukorbetegség okai nagyon változatosak. Az esetek túlnyomó többségében a cukorbetegség abszolút inzulinhiány miatt alakul ki (1-es típusú diabetes mellitus DM-1), vagy a perifériás szövetek csökkent inzulinérzékenysége és a hasnyálmirigy β-sejtek szekréciós diszfunkciója kombinációja (2-es típusú diabetes mellitus SD-2). Egyes esetekben nehéz a beteget DM-1-be vagy DM-2-be besorolni, de a gyakorlatban a DM kompenzálása sokkal fontosabb, mint a típus pontos meghatározása. Az etiológiai osztályozás a cukorbetegség négy fő klinikai osztályát azonosítja (7.1. táblázat).
A leggyakoribb DM-1-et (7.5. pont), DM-2-t (7.6. pont) és a terhességi DM-et (7.9. pont) külön fejezetekben tárgyaljuk. Tovább más speciális típusok csak a cukorbetegség 1%-át teszi ki. Úgy tűnik, hogy az ilyen típusú cukorbetegség etiológiája és patogenezise jobban tanulmányozott az 1-es és különösen a 2-es cukorbetegséghez képest. Számos DM-változatot monogénes öröklődés okoz genetikai rendellenességek a működésbenβ -sejtek. Ez magában foglalja az autoszomálisan dominánsan öröklött MODY-szindróma különféle változatait. fiatalkori cukorbetegség- felnőtt típusú cukorbetegség fiataloknál), amelyekre jellemző a megsértés, de nem az inzulinszekréció hiánya, a perifériás szövetek normális érzékenysége mellett.
asztal 7.1. A diabetes mellitus osztályozása
Alkalmilag ritka az inzulin hatásának genetikai hibái, az inzulinreceptor mutációjával (leprechaunizmus, Rabson-Mandehall szindróma) társul. A DM természetesen együtt alakul ki az exokrin hasnyálmirigy betegségei, ami a β-sejtek pusztulásához vezet (hasnyálmirigy-gyulladás, hasnyálmirigy-eltávolítás, cisztás fibrózis, hemokromatózis), valamint számos endokrin betegségben, amelyekben a kontrainsuláris hormonok túlzott termelése lép fel (akromegália, Cushing-szindróma). Gyógyszerek és vegyszerek(vacor, pentamidin, nikotinsav, diazoxid stb.) ritkán okoznak cukorbetegséget, de hozzájárulhatnak a betegség manifesztálásához és dekompenzációjához inzulinrezisztenciában szenvedő egyéneknél. Sor fertőző betegségek(rubeola, citomegalia, coxsackievírus és adenovírus fertőzések) a β-sejtek pusztulásával járhat, míg a legtöbb betegben a DM-1 immunogenetikai markerei kimutathatók. NAK NEK az immunmediált cukorbetegség ritka formái ide tartozik a „merev-rnan” szindrómában (egy autoimmun neurológiai betegség) szenvedő betegeknél kialakuló cukorbetegség, valamint az inzulinreceptorok elleni autoantitesteknek való kitettség miatt kialakuló cukorbetegség. A cukorbetegség különböző változatai fokozott gyakorisággal fordulnak elő
számos genetikai szindróma, különösen Down-szindróma, Klinefelter-szindróma, Turner-szindróma, Wolfram-szindróma, Prader-Willi-szindróma és számos más.
7.2. A SZÉNHIDRÁT-ANYAGCSERE ÉLETTANI KLINIKAI VONATKOZÁSAI
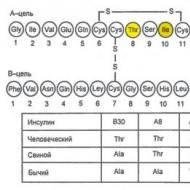
Inzulin A hasnyálmirigy Langerhans-szigeteinek (PLI) β-sejtjei szintetizálják és választják ki. Ezenkívül a Langerhans-szigetek glukagont (α-sejtek), szomatosztatint (δ-sejtek) és hasnyálmirigy-polipeptidet (PP-sejtek) választanak ki. A szigetsejtek hormonjai kölcsönhatásba lépnek egymással: a glukagon általában serkenti az inzulinszekréciót, a szomatosztatin pedig elnyomja az inzulin és a glukagon szekrécióját. Az inzulinmolekula két polipeptid láncból áll (A lánc - 21 aminosav; B lánc - 30 aminosav) (7.1. ábra). Az inzulinszintézis a preproinzulin képződésével kezdődik, amelyet a proteáz lehasít, és képződik proinzulin. A Golgi apparátus szekréciós szemcséiben a proinzulin inzulinra bomlik és C-peptid, amelyek az exocitózis folyamata során kerülnek a vérbe (7.2. ábra).
Az inzulinszekréció fő stimulátora a glükóz. Az inzulin a megnövekedett vércukorszint hatására szabadul fel kétfázisú(7.3. ábra). Az első vagy akut fázis több percig tart, és a felhalmozódott felszabaduláshoz kapcsolódik
 Rizs. 7.1. Az inzulinmolekula elsődleges szerkezetének diagramja
Rizs. 7.1. Az inzulinmolekula elsődleges szerkezetének diagramja
 Rizs. 7.2. Inzulin bioszintézis séma
Rizs. 7.2. Inzulin bioszintézis séma
az étkezések közötti időszakban a β-sejtben jelen lévő inzulin. A második fázis addig folytatódik, amíg a glikémiás szint el nem éri a normál éhgyomri szintet (3,3-5,5 mmol/l). A szulfonilureák hasonló hatással vannak a β-sejtekre.
A portálrendszeren keresztül az inzulin eléri máj- fő célszerve. A máj receptorai megkötik a kiválasztott hormon felét. A másik fele a szisztémás keringésbe kerülve eléri az izmokat és a zsírszövetet. A legtöbb inzulin (80%) a májban megy keresztül proteolitikus lebontáson, a többi a vesében, és csak egy kis mennyiség metabolizálódik közvetlenül az izom- és zsírsejtek által. Az élettartam normális
 Rizs. 7.3. Az inzulin kétfázisú felszabadulása glükóz hatására
Rizs. 7.3. Az inzulin kétfázisú felszabadulása glükóz hatására
egy felnőtt ember naponta 35-50 egység inzulint választ ki, ami 0,6-1,2 egység 1 testtömegkilogrammonként. Ez a váladék táplálkozási és bazálisra oszlik. Élelmiszer-elválasztás az inzulin étkezés utáni glükózszint-emelkedésnek felel meg, azaz. ennek köszönhetően a táplálék hiperglikémiás hatása semlegesül. Az étrendi inzulin mennyisége megközelítőleg megfelel a bevitt szénhidrátok mennyiségének - körülbelül 1-2,5 egység
10-12 g szénhidráthoz (1 kenyéregység - XE). Bázis inzulin szekréció optimális szintű glikémiát és anabolizmust biztosít az étkezések közötti intervallumokban és alvás közben. A bazális inzulin körülbelül 1 U/óra sebességgel választódik ki, hosszan tartó fizikai aktivitás vagy hosszan tartó koplalás esetén jelentősen csökken. Az étrendi inzulin a napi inzulintermelés legalább 50-70%-át teszi ki (7.4. ábra).
Az inzulinszekréciót nem csak az étel befolyásolja, hanem az is napi
 Rizs. 7 .4.
Normál napi inzulintermelési minta
Rizs. 7 .4.
Normál napi inzulintermelési minta
ny ingadozások: Az inzulinszükséglet a kora reggeli órákban növekszik, majd a nap folyamán fokozatosan csökken. Tehát reggelire 1 XE-nként 2,0-2,5 egység inzulin választódik ki, ebédre - 1,0-1,5 egység, vacsorára - 1,0 egység. Az inzulinérzékenység változásának egyik oka a reggelente számos ellenszigetelő hormon (elsősorban kortizol) magas szintje, amely az éjszaka elején fokozatosan a minimumra csökken.
Fő Az inzulin élettani hatásai stimulálják a glükóz transzfert az inzulinfüggő szövetek sejtmembránjain keresztül. Az inzulin fő célszervei a máj, a zsírszövet és az izom. Az inzulinfüggetlen szövetek, amelyek glükózellátása nem függ az inzulin hatásaitól, elsősorban a központi és perifériás idegrendszert, az erek endotéliumát, a vérsejteket, stb. a zsírok szintézise a májban és a zsírszövetben, a fehérjék szintézise a májban, az izmokban és más szervekben. Mindezek a változások a glükóz hasznosítását célozzák, ami a vérszintjének csökkenéséhez vezet. Az inzulin fiziológiai antagonistája glukagon, amely serkenti a glikogén és zsírok mobilizálását a raktárból; Normális esetben a glukagon szintje az inzulintermeléssel kölcsönösen változik.
Az inzulin biológiai hatásait közvetíti annak receptorok amelyek a célsejteken helyezkednek el. Az inzulinreceptor egy glikoprotein, amely négy alegységből áll. A vér magas inzulinszintjével a receptorok száma a leszabályozás elve szerint csökken, ami a sejt inzulinérzékenységének csökkenésével jár. Miután az inzulin a sejtreceptorhoz kötődik, a keletkező komplex bejut a sejtbe. Az izom- és zsírsejteken belül az inzulin a sejten belüli hólyagok mobilizálását idézi elő, amelyek tartalmazzák glükóz transzporter GLUT-4. Ennek eredményeként a vezikulák a sejtfelszínre költöznek, ahol a GLUT-4 a glükóz belépési pontjaként működik. A fizikai aktivitás hasonló hatással van a GLUT-4-re.
7.3. LABORATÓRIUMI DIAGNOSZTIKA ÉS A DIABETES MELLITUS KOMPENZÁCIÓS KRITÉRIUMAI
A cukorbetegség laboratóriumi diagnózisa a vércukorszint meghatározásán alapul, és a diagnosztikai kritériumok mindenki számára azonosak.
SD típusai és változatai (7.2. táblázat). Más laboratóriumi vizsgálatok (glükózuria szint, glikált hemoglobinszint meghatározása) adatait nem szabad felhasználni a cukorbetegség diagnózisának igazolására. A cukorbetegség diagnózisa az egyik kettős kimutatása alapján állapítható meg három kritérium:
1. A cukorbetegség nyilvánvaló tüneteivel (polyuria, polydipsia) és a teljes kapilláris vérben a glükóz szintje meghaladja a 11,1 mmol/l-t, függetlenül a napszaktól és az előző étkezéstől.
2. Ha az éhgyomri teljes kapilláris vér glükózszintje meghaladja a 6,1 mmol/l-t.
3. Ha a teljes kapilláris vér glükózszintje 75 gramm glükóz bevétele után 2 órával (orális glükóz tolerancia teszt) több mint 11,1 mmol/l.
asztal 7.2. A diabetes mellitus diagnosztizálásának kritériumai
 A cukorbetegség diagnosztizálásának legfontosabb és legjelentősebb tesztje az éhomi glikémia szintjének meghatározása (minimum 8 óra éhezés). Az Orosz Föderációban a glikémiás szintet általában teljes vérben értékelik. A glükóztesztet számos országban széles körben alkalmazzák
A cukorbetegség diagnosztizálásának legfontosabb és legjelentősebb tesztje az éhomi glikémia szintjének meghatározása (minimum 8 óra éhezés). Az Orosz Föderációban a glikémiás szintet általában teljes vérben értékelik. A glükóztesztet számos országban széles körben alkalmazzák
vérplazmában. Orális glükóz tolerancia teszt(OGTT; a glükózszint meghatározása 75 gramm vízben oldott glükóz elfogyasztása után 2 órával) e tekintetben kisebb jelentőséget kap. Az OGTT alapján azonban diagnosztizálják károsodott glükóz tolerancia(NTG). IGT-t akkor diagnosztizálnak, ha az éhgyomri teljes kapilláris vér glükózszintje nem haladja meg a 6,1 mmol/l-t, és 2 órával a glükózterhelés után 7,8 mmol/l felett, de 11,1 mmol/l alatt van. A szénhidrát-anyagcsere zavar másik változata az károsodott éhomi glükóz(NGNT). Ez utóbbi akkor állapítható meg, ha a teljes kapilláris vér glikémiája üres gyomorban 5,6-6,0 mmol/l tartományban van, és 2 órával a glükózterhelés után 7,8 mmol/l alatt van. Az NTG és az NGNT jelenleg a kifejezés alatt szerepel prediabetes, mivel mindkét betegcsoportban magas a cukorbetegség manifesztálódása és a diabéteszes macroangiopathia kialakulásának kockázata.
A cukorbetegség diagnosztizálásához a glikémiás szintet szabványos laboratóriumi módszerekkel kell meghatározni. A glikémiás értékek értelmezésekor figyelembe kell venni, hogy a teljes vénás vér éhgyomri glükózszintje megfelel a teljes kapilláris vérben lévő szintjének. Étkezés vagy OGTT után szintje a vénás vérben megközelítőleg 1,1 mmol/l-rel alacsonyabb, mint a kapilláris vérben. A plazma glükóztartalma körülbelül 0,84 mmol/l-rel magasabb, mint a teljes vérben. A kompenzáció és a cukorbetegség terápia megfelelőségének felmérése érdekében a glikémia szintjét a kapilláris vérben hordozható készülékkel mérik. glükométerek maguk a betegek, hozzátartozóik vagy egészségügyi személyzet.
Bármilyen típusú cukorbetegség esetén, valamint jelentős glükózterhelés esetén kialakulhat glükózuria, ami az elsődleges vizeletből a glükóz visszaszívódási küszöbérték túllépésének a következménye. A glükóz reabszorpciós küszöbértéke egyénenként jelentősen változik (≈ 9-10 mmol/l). A glucosuria nem használható külön indikátorként a cukorbetegség diagnosztizálására. Normális esetben, kivéve a jelentős finomított szénhidráttartalmú étrendi terhelést, glucosuria nem fordul elő.
Termékek keton testek(aceton, acetoacetát, β-hidroxi-butirát) abszolút inzulinhiány esetén jelentősen felerősödik. A DM-1 dekompenzációjával, kifejezett ketonuria(vizeletbe mártott tesztcsíkokkal tesztelve). Egészséges embereknél enyhe (nyomnyi) ketonuria mutatható ki koplalás és alacsony szénhidráttartalmú diéta során.
Fontos laboratóriumi mutató, amelyet a cukorbetegség típusainak differenciáldiagnózisára, valamint az inzulinhiány kialakulásának azonosítására használnak cukorbeteg-2-es betegeknél, a szint. C-peptid. A vér C-peptid szintje közvetve megítélheti a hasnyálmirigy β-sejtjeinek inzulin-kiválasztó képességét. Ez utóbbiak proinzulint termelnek, amelyből a C-peptid a szekréció előtt lehasad, és az inzulinnal egyenlő mennyiségben kerül a vérbe. Az inzulin 50%-ban kötődik a májban, felezési ideje a perifériás vérben körülbelül 4 perc. A C-peptidet a máj nem távolítja el a véráramból, és felezési ideje a vérben körülbelül 30 perc. Ezenkívül nem kötődik a perifériás sejtreceptorokhoz. Ezért a C-peptid szintjének meghatározása megbízhatóbb teszt a szigeti apparátus működésének értékelésére. A leginformatívabb a C-peptid szintjének tanulmányozása a stimulációs tesztek hátterében (evés vagy glukagon beadása után). A teszt nem tájékoztató jellegű, ha a cukorbetegség súlyos dekompenzációjának hátterében végzik, mivel a súlyos hiperglikémia toxikus hatással van a β-sejtekre (glukotoxicitás). Az előző néhány nap inzulinkezelése nem befolyásolja a vizsgálati eredményeket.
Alapvető kezelés célja Bármely típusú cukorbetegség esetében a késői szövődmények megelőzése, amely számos paraméter stabil kompenzációja mellett elérhető (7.3. táblázat). A cukorbetegség szénhidrát-anyagcsere kompenzációjának minőségének fő kritériuma a szint glikált (glikozilált) hemoglobin (HbA1c). Ez utóbbi a glükózhoz nem kovalensen kötődő hemoglobin. A glükóz az inzulintól függetlenül jut be az eritrocitákba, a hemoglobin glikozilációja pedig visszafordíthatatlan folyamat, mértéke egyenesen arányos azzal a glükózkoncentrációval, amellyel fennállásának 120 napja alatt érintkezett. A hemoglobin kis része glikozilált és normális; cukorbetegségben jelentősen növelhető. A HbA1c szint, ellentétben a folyamatosan változó glükózszinttel, szervesen tükrözi az elmúlt 3-4 hónap glikémiáját. Ebben az intervallumban javasolt a HbA1c szint meghatározása a cukorbetegség kompenzációjának felméréséhez.
A krónikus hiperglikémia messze nem az egyetlen kockázati tényező a cukorbetegség késői szövődményeinek kialakulásában és progressziójában. Ennek köszönhetően DM kompenzációs értékelés komplexum alapján
laboratóriumi és műszeres kutatási módszerek (7.3. táblázat). A szénhidrát-anyagcsere állapotát jellemző mutatók mellett a legfontosabb a vérnyomás szintje és a vér lipidspektruma.
asztal 7.3. A diabetes mellitus kompenzációjának kritériumai
 A fenti kompenzációs kritériumok mellett egyéni megközelítésre van szükség a cukorbetegség kezelési céljainak megtervezésekor. A cukorbetegség késői szövődményei (különösen a mikroangiopátia) kialakulásának és progressziójának valószínűsége a betegség időtartamának növekedésével nő. Ha tehát azoknál a gyermekeknél és fiatal betegeknél, akiknek a kórtörténete később akár több évtizedet is elérhet, optimális glikémiás mutatók elérése szükséges, akkor azoknál a betegeknél, akiknél a cukorbetegség idős korban jelentkezett, szigorú euglikémiás kompenzáció, ami jelentősen növeli a cukorbetegség kockázatát. hipoglikémia, nem mindig tanácsos.
A fenti kompenzációs kritériumok mellett egyéni megközelítésre van szükség a cukorbetegség kezelési céljainak megtervezésekor. A cukorbetegség késői szövődményei (különösen a mikroangiopátia) kialakulásának és progressziójának valószínűsége a betegség időtartamának növekedésével nő. Ha tehát azoknál a gyermekeknél és fiatal betegeknél, akiknek a kórtörténete később akár több évtizedet is elérhet, optimális glikémiás mutatók elérése szükséges, akkor azoknál a betegeknél, akiknél a cukorbetegség idős korban jelentkezett, szigorú euglikémiás kompenzáció, ami jelentősen növeli a cukorbetegség kockázatát. hipoglikémia, nem mindig tanácsos.
7.4. INzulinkészítmények és inzulinterápia
Az inzulinkészítmények létfontosságúak az 1-es típusú cukorbetegségben szenvedő betegek számára; ráadásul a T2DM-es betegek akár 40%-a is kapja ezeket. Általánosnak a cukorbetegség inzulinterápia felírásának indikációi, amelyek közül sok valójában átfedi egymást:
1. 1-es típusú diabetes mellitus
2. Pancreatectomia
3. Ketoacidotikus és hiperozmoláris kóma
4. 2-es típusú diabetes mellitus esetén:
Az inzulinhiány egyértelmű jelei, például progresszív fogyás és ketózis, súlyos hiperglikémia;
Főbb sebészeti beavatkozások;
Akut makrovaszkuláris szövődmények (stroke, miokardiális infarktus, gangréna stb.) és súlyos fertőző betegségek, amelyeket a szénhidrát-anyagcsere dekompenzációja kísér;
Az éhgyomri glükózszint több mint 15-18 mmol/l;
Stabil kompenzáció hiánya, annak ellenére, hogy a különböző tablettázott hipoglikémiás gyógyszerek maximális napi adagját írták elő;
A cukorbetegség késői szövődményeinek késői szakaszai (súlyos polyneuropathia és retinopátia, krónikus veseelégtelenség).
5. Képtelenség elérni a terhességi cukorbetegség kompenzációját diétás terápiával.
Eredet szerint Az inzulinkészítmények három csoportba sorolhatók:
Állati eredetű inzulinok (sertéshús);
Humán inzulinok (félszintetikus, génmanipulált);
Inzulinanalógok (lispro, aszpart, glargin, detemir).
A humán inzulin előállítási technológiájának fejlődése a sertés inzulin(egy az egyben aminosavtól különbözik) az utóbbi időben jelentősen csökkent. A sertés inzulin felhasználható emberi inzulin előállítására félszintetikus módszer, amely magában foglalja egy különböző aminosav helyettesítését a molekulájában. A legmagasabb minőség génmanipuláció humán inzulinok. Megszerzésükhöz az emberi genom inzulinszintézisért felelős régióját társítják a genommal E. coli vagy élesztőkultúra, melynek eredményeként az utóbbiak elkezdenek humán inzulint termelni. Teremtés inzulin analógok különböző aminosavak átrendeződését alkalmazva a kívánt és legkedvezőbb farmakokinetikával rendelkező gyógyszerek előállítása volt a cél. Így a lispro inzulin (Humalog) egy analóg
ultrarövid hatású inzulin, hipoglikémiás hatása az injekció beadása után 15 percen belül kialakul. Ezzel szemben a glargin inzulinanalógot (Lantus) hosszú távú hatás jellemzi, amely egész nap tart, míg a gyógyszer kinetikáját a plazmakoncentráció kifejezett csúcsainak hiánya jellemzi. A legtöbb jelenleg használt inzulinkészítményt és analógjait itt állítják elő koncentrációk 100 E/ml. Által a hatás időtartama Az inzulinok 4 fő csoportra oszthatók (7.4. táblázat):
asztal 7.4. A gyógyszerek és inzulinanalógok farmakokinetikája
 1.
Ultra-rövid hatású (lispro, aszpart).
1.
Ultra-rövid hatású (lispro, aszpart).
2. Rövid hatású (egyszerű humán inzulin).
3. Közepes hatású (semleges protamin Hagedorn inzulinok).
4. Hosszú hatású (glargin, detemir).
5. Változó hatástartamú inzulinok keverékei (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Kábítószer ultrarövid akció A [lispro (Humalog), az aszpart (Novorapid)] inzulinanalógok. Előnyük a hipoglikémiás hatás gyors kifejlődése az injekció beadása után (15 perc elteltével), amely lehetővé teszi az injekció beadását közvetlenül étkezés előtt vagy akár közvetlenül étkezés után, valamint a rövid hatástartam (kevesebb, mint 3 óra), ami csökkenti a hipoglikémia. Kábítószer rövid színészi játék(egyszerű inzulin, reguláris inzulin) 100 U/ml koncentrációjú inzulint tartalmazó oldat. Egy egyszerű inzulin injekciót adnak be 30 perccel étkezés előtt; A hatás időtartama körülbelül 4-6 óra. Az ultrarövid és rövid hatású gyógyszerek subcutan, intramuszkulárisan és intravénásan is beadhatók.
A drogok között átlagos hatástartam A leggyakrabban használt drogok a semleges Hagedorn protamin (NPH). Az NPH egy fehérje, amely nem kovalensen adszorbeálja az inzulint, lelassítva annak felszívódását a szubkután depóból. Az NPH inzulinok hatásos időtartama általában körülbelül 12 óra; csak szubkután adják be. Az NPH inzulin szuszpenzió, ezért az egyszerű inzulinnal ellentétben az injekciós üvegben zavaros, és hosszú ideig állva hagyva szuszpenzió képződik, amelyet az injekció beadása előtt alaposan össze kell keverni. Az NPH inzulinok, ellentétben más hosszú hatású gyógyszerekkel, bármilyen arányban keverhetők rövid hatású inzulinnal (egyszerű inzulin), és a keverék összetevőinek farmakokinetikája nem változik, mivel az NPH nem köt meg további mennyiségű egyszerű inzulint ( 7.5. ábra). Ezenkívül a protamint az inzulinanalógok (Novomix-30, Humalog-Mix-25) standard keverékeinek előállítására használják.
A hosszú hatású gyógyszerek közül jelenleg aktívan használják az inzulin analógokat. glargin(Lantus) és detemir(Levemir). Ezen gyógyszerek farmakokinetikájának kedvező tulajdonsága, hogy az NPH inzulinokkal ellentétben egységesebb és hosszabb ideig tartó gyógyszerellátást biztosítanak a szubkután depóból. Ebben a tekintetben a glargin csak naponta egyszer írható fel, gyakorlatilag a napszaktól függetlenül.
 Rizs. 7.5. Különféle inzulinkészítmények farmakokinetikája:
Rizs. 7.5. Különféle inzulinkészítmények farmakokinetikája:
a) egykomponensű; b) standard inzulinkeverékek
Az egykomponensű inzulinkészítmények mellett széles körben használják a klinikai gyakorlatban. standard keverékek.Általában rövid hatású vagy ultrarövid hatású inzulin és közepes hatású inzulin keverékeiről beszélünk. Például a „Humulin-MZ” gyógyszer 30% egyszerű inzulint és 70% NPH inzulint tartalmaz egy palackban; a "Novomix-30" gyógyszer 30% aszpart inzulint és 70% aszpart inzulin kristályos protamin szuszpenziót tartalmaz; a "Humalog-Mix-25" gyógyszer 25% lispro inzulint és 75% lispro inzulin protamin szuszpenziót tartalmaz. Előny
a standard inzulinkeverékek két injekció helyettesítése egy, és valamivel nagyobb pontossággal a keverék összetevőinek adagolásában; A hátránya a keverék egyes komponenseinek egyedi adagolásának lehetetlensége. Ez határozza meg a standard inzulinkeverékek alkalmazásának preferenciáját a T2DM vagy az ún hagyományos inzulinterápia(fix dózisú inzulin felírása), míg a intenzív inzulinterápia(rugalmas dózisválasztás a glikémiás indikátoroktól és az élelmiszerben lévő szénhidrát mennyiségtől függően) előnyös az egykomponensű gyógyszerek alkalmazása.
A sikeres inzulinterápia kulcsa a szigorú betartás injekciós technikák. Az inzulin adagolásának többféle módja van. A legegyszerűbb és legmegbízhatóbb módszer az inzulin beadása. fecskendő. Az inzulin beadásának kényelmesebb módja az injekciós injekció fecskendő tollak, amely inzulintartályt (patront), adagolórendszert és injekciós tűt tartalmazó kombinált eszköz.
Fenntartó terápia céljából (ha nem a cukorbetegség súlyos dekompenzációjáról vagy kritikus állapotokról beszélünk) az inzulint szubkután adják be. A rövid hatású inzulin injekciókat a has bőr alatti zsírszövetébe, a hosszú hatású inzulint - a comb vagy a váll szövetébe javasolt beadni (7.6 a ábra). Az injekciókat mélyen a bőr alatti szövetbe adják be, szélesen összenyomott bőrön keresztül, 45°-os szögben (7.6. b ábra). A beteget tanácsolni kell, hogy naponta változtassa meg az inzulin injekció beadásának helyét ugyanazon a területen, hogy megelőzze a lipodystrophiák kialakulását.
NAK NEK az inzulin felszívódását befolyásoló tényezők a szubkután depóból figyelembe kell venni az inzulin adagját (az adag növelésével megnő a felszívódás időtartama), az injekció beadásának helyét (hasi szövetből gyorsabb a felszívódás), és a környezeti hőmérsékletet (az injekció helyének felmelegítése és masszírozása felgyorsítja a felszívódást ).
Bonyolultabb beadási mód, amely azonban sok betegnél jó kezelési eredményeket tesz lehetővé, az alkalmazása inzulin adagoló, vagy folyamatos szubkután inzulin adagolásra szolgáló rendszerek. Az adagoló egy hordozható eszköz, amely egy számítógépből áll, amely beállítja az inzulinadagolás módját, valamint egy katéteren és egy miniatűr tűn keresztül a bőr alatti inzulinadagoló rendszert.
 Rizs. 7.6. Inzulin injekciók: a) tipikus injekciós helyek; b) az inzulinfecskendő tűjének helyzete az injekció beadása közben
Rizs. 7.6. Inzulin injekciók: a) tipikus injekciós helyek; b) az inzulinfecskendő tűjének helyzete az injekció beadása közben
zsírszövet. Adagoló segítségével rövid vagy ultrarövid hatású inzulin folyamatos alapinjekcióját végezzük (kb. 0,5-1 E/óra sebességgel), étkezés előtt pedig a szénhidráttartalomtól és a glikémiás szinttől függően a a beteg ugyanannak a rövid hatású inzulinnak a szükséges bolus adagját adja be. Az adagolós inzulinterápia előnye a rövid (vagy akár ultrarövid) hatású inzulin önmagában történő beadása, ami önmagában valamivel fiziológiásabb, mivel a hosszú hatástartamú inzulinkészítmények felszívódása nagy ingadozásoknak van kitéve; e tekintetben a rövid hatású inzulin folyamatos adagolása kezelhetőbb folyamatnak tűnik. Az adagolót alkalmazó inzulinterápia hátránya az eszköz folyamatos viselésének szükségessége, valamint az injekciós tű hosszú távú jelenléte a bőr alatti szövetben, ami az inzulinellátás folyamatának időszakos ellenőrzését igényli. Az adagolós inzulinterápia elsősorban 1-es típusú cukorbetegségben szenvedő betegek számára javasolt, akik készek elsajátítani kezelésének technikáját. Különösen ebben a tekintetben kell figyelmet fordítani a kifejezett „hajnali” jelenségben szenvedő betegekre, valamint a T1DM-ben szenvedő terhes és terhességet tervező betegekre, valamint a betegekre.
a rendezetlen életmóddal rendelkezők (rugalmasabb étrend lehetősége).
7.5. 1. TÍPUSÚ CUKRÉBÉSZ
CD-1 - szervspecifikus autoimmun a hasnyálmirigy szigeteinek inzulintermelő β-sejtjeinek pusztulásához vezető betegség, amely abszolút inzulinhiányban nyilvánul meg. Egyes esetekben a nyilvánvaló T1DM-ben szenvedő betegeknél hiányoznak a β-sejtek autoimmun károsodásának markerei (idiopátiás DM-1).
Etiológia
A DM-1 örökletes hajlamú betegség, de a betegség kialakulásához csekély mértékben járul hozzá (körülbelül 1/3-ban határozza meg kialakulását). A T1DM konkordancia aránya egypetéjű ikreknél csak 36%. A T1D kialakulásának valószínűsége egy beteg anyával rendelkező gyermeknél 1-2%, egy apánál - 3-6%, egy testvérnél - 6%. Az autoimmun β-sejt-károsodás egy vagy több humorális markere, köztük a hasnyálmirigy-szigetek elleni antitestek, a glutamát-dekarboxiláz (GAD65) és a tirozin-foszfatáz elleni antitestek (IA-2 és ΙΑ-2β) a betegek 85-90%-ában kimutatható. . Mindazonáltal a β-sejtek elpusztításában a fő szerepet a celluláris immunitási faktorok kapják. A T1DM olyan HLA haplotípusokhoz kapcsolódik, mint pl DQAÉs DQB míg csak allélok HLA-DR/DQ hajlamosíthat a betegség kialakulására, míg mások védő hatásúak. A DM-1-et fokozott gyakorisággal kombinálják más autoimmun endokrin (autoimmun pajzsmirigygyulladás, Addison-kór) és nem endokrin betegségekkel, mint pl. alopecia, vitiligo, Crohn-betegség, reumás betegségek (7.5. táblázat).
Patogenezis
A DM-1 akkor nyilvánul meg, amikor a β-sejtek 80-90%-a elpusztul egy autoimmun folyamat során. Ennek a folyamatnak a sebessége és intenzitása jelentősen változhat. Leggyakrabban amikor tipikus tanfolyam gyermekek és fiatalok betegségei miatt ez a folyamat meglehetősen gyorsan lezajlik, majd a betegség gyors manifesztációja következik, amelyben az első klinikai tünetek megjelenésétől a ketoacidózis kialakulásáig (akár ketoacidotikus kómáig) csak néhány hét telik el.
asztal 7.5. 1-es típusú diabetes mellitus
 A táblázat folytatása. 7.5
A táblázat folytatása. 7.5
 Más, sokkal ritkább esetekben, általában 40 év feletti felnőtteknél, a betegség látens lehet. (felnőttek látens autoimmun cukorbetegsége – LADA), Ugyanakkor a betegség kezdetén az ilyen betegeknél gyakran diagnosztizálnak diabetes mellitus-2-t, és több éven át a cukorbetegség kompenzációja szulfonilurea gyógyszerek felírásával érhető el. De később, általában 3 év elteltével, megjelennek az abszolút inzulinhiány jelei (fogyás, ketonuria, súlyos hiperglikémia, annak ellenére, hogy tablettázott hipoglikémiás gyógyszereket szedtek).
Más, sokkal ritkább esetekben, általában 40 év feletti felnőtteknél, a betegség látens lehet. (felnőttek látens autoimmun cukorbetegsége – LADA), Ugyanakkor a betegség kezdetén az ilyen betegeknél gyakran diagnosztizálnak diabetes mellitus-2-t, és több éven át a cukorbetegség kompenzációja szulfonilurea gyógyszerek felírásával érhető el. De később, általában 3 év elteltével, megjelennek az abszolút inzulinhiány jelei (fogyás, ketonuria, súlyos hiperglikémia, annak ellenére, hogy tablettázott hipoglikémiás gyógyszereket szedtek).
A T1DM patogenezise, mint jeleztük, abszolút inzulinhiányon alapul. Az, hogy a glükóz nem tud bejutni az inzulinfüggő szövetekbe (zsír és izom), energiahiányhoz vezet, ami fokozott lipolízist és proteolízist eredményez, amelyek súlycsökkenéssel járnak. A glikémiás szint emelkedése hiperozmolaritást okoz, amely ozmotikus diurézissel és súlyos kiszáradással jár. Inzulinhiány és energiahiány esetén a kontrainsuláris hormonok (glükagon, kortizol, növekedési hormon) termelése gátlástalan, ami a növekvő glikémia ellenére a glükoneogenezis stimulálását idézi elő. A zsírszövetben a fokozott lipolízis a szabad zsírsavak koncentrációjának jelentős növekedéséhez vezet. Inzulinhiány esetén a máj liposzintetikus kapacitása elnyomódik, és szabaddá válik
zsírsavak kezdenek részt venni a ketogenezisben. A ketontestek felhalmozódása diabéteszes ketózis, majd ezt követően ketoacidózis kialakulásához vezet. A kiszáradás és az acidózis fokozatos növekedésével kóma alakul ki (lásd 7.7.1 pont), amely inzulinterápia és rehidratáció hiányában elkerülhetetlenül halállal végződik.
Járványtan
A T1DM az összes cukorbetegség 1,5-2%-át teszi ki, és ez a relatív szám tovább csökken a T2DM előfordulásának gyors növekedése miatt. A T1DM kialakulásának kockázata egy kaukázusi emberben körülbelül 0,4%. Az 1-es típusú cukorbetegség előfordulása évente 3%-kal növekszik: az új esetek miatt 1,5%-kal, a betegek várható élettartamának növekedése miatt további 1,5%-kal. A T1DM prevalenciája a lakosság etnikai összetételétől függően változik. 2000-ben Afrikában 0,02%, Dél-Ázsiában és Dél- és Közép-Amerikában 0,1%, Európában és Észak-Amerikában 0,2% volt. A DM-1 incidenciája Finnországban és Svédországban a legmagasabb (30-35 eset/100 ezer lakos évente), a legalacsonyabb pedig Japánban, Kínában és Koreában (0,5-2,0 eset). A T1DM megnyilvánulásának csúcskora körülbelül 10-13 év. Az esetek túlnyomó többségében a T1DM 40 éves kor előtt jelentkezik.
Klinikai megnyilvánulások
BAN BEN tipikus esetek, Különösen gyermekeknél és fiataloknál a T1DM élénk klinikai képpel debütál, amely több hónap vagy akár hét alatt alakul ki. A T1DM megnyilvánulását fertőző és egyéb kísérő betegségek válthatják ki. Jellegzetes minden típusú cukorbetegségre jellemző tünetek, hiperglikémiához társulnak: polydipsia, polyuria, bőrviszketés, de az 1-es típusú cukorbetegség esetén nagyon hangsúlyosak. Így a nap folyamán a betegek akár 5-10 liter folyadékot is ihatnak és üríthetnek ki. Különleges 1-es típusú cukorbetegség esetén az abszolút inzulinhiány okozta tünet a 10-15 kg-os fogyás 1-2 hónap alatt. Súlyos általános és izomgyengeség, csökkent teljesítmény és álmosság jellemzi. A betegség kezdetén egyes betegeknél megnövekszik az étvágy, ami a ketoacidózis kialakulásával anorexiának ad helyet. Ez utóbbira jellemző az acetonszag (vagy gyümölcsszag) megjelenése a szájból, hányinger
jegyzetek, hányás, gyakran hasi fájdalom (pszeudoperitonitis), súlyos kiszáradás és kóma kialakulásával végződik (lásd 7.7.1 pont). Egyes esetekben a T1DM első megnyilvánulása gyermekeknél egyidejű betegségek, általában fertőző vagy akut sebészeti patológiák miatti progresszív tudatzavar egészen kómáig.
Viszonylag ritka esetekben a T1DM kialakulása 35-40 év felettieknél (felnőttek látens autoimmun cukorbetegsége) előfordulhat, hogy a betegség nem jelentkezik ilyen egyértelműen (közepes polidipsia és polyuria, nincs testsúlycsökkenés), sőt a glikémiás szint rutin meghatározása során véletlenül is kimutatható. Ezekben az esetekben a betegnél gyakran először diagnosztizálják a diabetes mellitus-2-t, és tablettázott hipoglikémiás gyógyszereket (TGD) írnak fel, amelyek egy ideig elfogadható kompenzációt biztosítanak a cukorbetegségért. Azonban több éven át (gyakran egy éven belül) a betegnél a növekvő abszolút inzulinhiány okozta tünetek jelentkeznek: fogyás, képtelenség fenntartani a normális glikémiát a TSP hátterében, ketózis, ketoacidózis.
Diagnosztika
Tekintettel arra, hogy a DM-1 egyértelmű klinikai képpel rendelkezik, és viszonylag ritka betegség, a glikémiás szintek szűrése a DM-1 diagnosztizálása céljából nem indokolt. Alacsony a betegség kialakulásának valószínűsége a betegek közvetlen hozzátartozói körében, ami a T1DM elsődleges megelőzésére szolgáló hatékony módszerek hiányával együtt meghatározza a betegség immunogenetikai markereinek tanulmányozásának helytelenségét náluk. A T1DM diagnózisa az esetek túlnyomó többségében a jelentős hiperglikémia kimutatásán alapul az abszolút inzulinhiány súlyos klinikai megnyilvánulásaiban szenvedő betegeknél. A T1DM diagnosztizálására szolgáló OGTT-t nagyon ritkán kell elvégezni.
Megkülönböztető diagnózis
Kétes esetekben (mérsékelt hiperglikémia kimutatása nyilvánvaló klinikai megnyilvánulások hiányában, viszonylag előrehaladott korban való megnyilvánulás), valamint más típusú cukorbetegségekkel történő differenciáldiagnózis céljából szintmeghatározást alkalmaznak. C-peptid(alap és 2 órával étkezés után). A definíciónak kétes esetekben közvetett diagnosztikai értéke lehet immunológiai markerek CD-1 - antitestek a szigetekre
PZH, glutamát-dekarboxilázhoz (GAD65) és tirozin-foszfatázhoz (IA-2 és IA-2β). A DM-1 és DM-2 differenciáldiagnózisát a táblázat mutatja be. 7.6.
asztal 7.6. Differenciáldiagnózis és különbségek a DM-1 és DM-2 között
 Kezelés
Kezelés
Bármilyen típusú cukorbetegség kezelése három fő elven alapul: glükóz-csökkentő terápia (diabet-1 esetén - inzulinterápia), diéta és betegoktatás. Inzulinterápia DM-1 kopásokkal helyettesítő jellegű célja pedig a hormon élettani termelésének maximális utánzása az elfogadott kompenzációs kritériumok elérése érdekében (7.3. táblázat). A fiziológiás inzulinszekrécióhoz a legközelebb áll intenzív inzulinterápia. Az annak megfelelő inzulinszükséglet bazális szekréció két közepes hatástartamú inzulin injekcióval (reggel és este) vagy egy hosszú hatástartamú inzulin (glargin) injekcióval biztosítható. A bazális inzulin teljes dózisa
A mennyiség nem haladhatja meg a gyógyszer teljes napi szükségletének felét. Élelmiszer vagy bolus inzulin szekréció minden étkezés előtt rövid vagy ultrarövid hatású inzulin injekcióval helyettesítik, és az adagot a következő étkezés során várható szénhidrátmennyiség és a meglévő glikémiás szint alapján számítják ki, amelyet a páciens határoz meg egy glükométert minden inzulin injekció előtt (7.7. ábra).
Hozzávetőleges intenzív inzulinterápia, amely szinte minden nap változik, a következőképpen ábrázolható. Feltételezhető, hogy a napi inzulinszükséglet körülbelül 0,5-0,7 egység testtömeg-kilogrammonként (70 kg-os betegnél körülbelül 35-50 egység). Ennek az adagnak körülbelül 1/3-1/2-e lesz hosszú hatású inzulin (20-25 E), 1/2-2/3-a rövid vagy ultrarövid hatású inzulin. Az NPH inzulin adagja 2 injekcióra oszlik: reggel a dózis 2/3-a (12 egység), este - 1/3 (8-10 egység).
Célja első fázis Az inzulinterápia kiválasztása az éhomi glükózszint normalizálására irányul. Az NPH inzulin esti adagját általában 22-23 órakor adják be, a reggeli adagot rövid hatású inzulin injekcióval együtt, reggeli előtt. Az NPH inzulin esti adagjának kiválasztásakor szem előtt kell tartani annak lehetőségét, hogy számos
 Rizs. 7.7. Intenzív inzulinterápia
Rizs. 7.7. Intenzív inzulinterápia
egészen tipikus jelenségek. A reggeli hiperglikémia oka lehet a hosszú hatástartamú inzulin elégtelen adagja, mivel reggelre jelentősen megnő az inzulinszükséglet (a „hajnal” jelenség). Az elégtelen adag mellett a reggeli hiperglikémiát okozhatja annak túlzott mennyisége - Somogyi-jelenség(Somogyi), poszthipoglikémiás hiperglikémia. Ez a jelenség azzal magyarázható, hogy a szövetek maximális érzékenysége az inzulinra hajnali 2 és 4 óra között figyelhető meg. Általában ekkor a legalacsonyabb a fő kontrainsuláris hormonok (kortizol, növekedési hormon stb.) szintje. Ha a hosszú hatástartamú inzulin esti adagja túlzott, akkor ebben az időben hipoglikémia. Klinikailag rossz alvásként rémálmokkal, eszméletlen alvási cselekvésekkel, reggeli fejfájással és fáradtsággal nyilvánulhat meg. A hipoglikémia kialakulása ebben az időben jelentős glukagon és más kontrainzuláris hormonok kompenzációs felszabadulását okozza, amit hiperglikémia reggel. Ha ebben a helyzetben az esti, hosszú hatástartamú inzulin adagját nem csökkentik, hanem növelik, az éjszakai hipoglikémia és a reggeli hiperglikémia súlyosbodni fog, ami végső soron krónikus inzulin-túladagolási szindrómához (Somogyi-szindróma) vezethet, ami az elhízás kombinációja. a cukorbetegség krónikus dekompenzációjával, gyakori hipoglikémiával és progresszív késői szövődményekkel. A Somogyi-jelenség diagnosztizálásához hajnali 3 óra körüli glikémiás szint vizsgálata szükséges, ami az inzulinterápia kiválasztásának szerves része. Ha az NPH esti adagjának biztonságos éjszakai hipoglikémiára való csökkentése reggeli hiperglikémiával (hajnali jelenség) kíséri, a betegnek figyelmeztetni kell, hogy korábban (6-7 óra között) keljen fel, miközben az éjszaka beadott inzulin továbbra is normális marad. glikémiás szintek.
Az NPH inzulin második injekcióját általában reggeli előtt adják be a rövid hatású (ultrarövid hatású) inzulin reggeli injekciójával együtt. Ebben az esetben az adagot elsősorban a glikémiás szint alapján választják ki a fő napi étkezések (ebéd, vacsora) előtt; emellett korlátozhatja a hipoglikémia kialakulását az étkezések közötti időközökben, például délben, reggeli és ebéd között.
Teljes adag inzulin hosszú hatású(glargine) naponta egyszer kerül beadásra, és nem mindegy, hogy mikor. Kinetika
A glargin inzulin és a detemir kedvezőbb a hipoglikémia kialakulásának kockázata szempontjából, beleértve az éjszakaiakat is.
A rövid vagy ultrarövid hatású inzulin adagja még az inzulin felírásának első napján is függ az elfogyasztott szénhidrát mennyiségétől (kenyér egység) és az injekció beadása előtti vércukorszinttől. Hagyományosan az inzulinszekréció normál napi ritmusa alapján a rövid hatású inzulin adagjának (6-8 egység) körülbelül 1/4-e kerül vacsorára, a fennmaradó adag körülbelül egyenlő arányban oszlik meg reggelire és ebédre (10-12 egység). egységek). Minél magasabb a kezdeti glikémiás szint, annál kevésbé fog csökkenni a beadott inzulin egységenként. Rövid hatású inzulin injekciót étkezés előtt 30 perccel, ultrarövid hatású inzulin injekciót közvetlenül étkezés előtt, vagy akár közvetlenül étkezés után adnak be. A rövid hatású inzulin adagjának megfelelőségét a glikémiás indikátorok értékelik étkezés után 2 órával és a következő étkezés előtt.
Az intenzív inzulinterápia során az inzulin adagjának kiszámításához elegendő az XE számát csak a szénhidrát-komponens alapján kiszámítani. Ebben az esetben nem minden szénhidrát tartalmú terméket veszünk figyelembe, hanem csak az úgynevezett megszámlálhatóakat. Ez utóbbiak közé tartozik a burgonya, a gabonatermékek, a gyümölcsök, a folyékony tejtermékek és az édes termékek. Az emészthetetlen szénhidrátot tartalmazó termékeket (a legtöbb zöldséget) nem veszik figyelembe. Speciális cseretáblázatokat fejlesztettek ki, amelyek segítségével a szénhidrát mennyiségét XE-ben kifejezve kiszámítható a szükséges inzulinadag. Egy XE 10-12 g szénhidrátnak felel meg (10.7. táblázat).
1 XE-t tartalmazó étkezés elfogyasztása után a glikémiás szint 1,6-2,2 mmol/l-rel emelkedik, i.e. körülbelül annyival, amennyivel a glükózszint csökken 1 egység inzulin beadásakor. Más szóval, minden egyes, az elfogyasztott ételben található XE-hez körülbelül 1 egység inzulint kell előre beadnia (a napszaktól függően). Ezenkívül figyelembe kell venni a glikémiás szint önellenőrzésének eredményeit, amelyet minden injekció előtt végeznek, és a napszakot (körülbelül 2 E inzulin 1 XE reggel és ebédre, 1 U 1 XE-nként vacsoránál). Tehát, ha hiperglikémiát észlelnek, növelni kell az inzulin adagját, amelyet a következő étkezésnek megfelelően számítanak ki (az XE száma alapján), és fordítva, ha hipoglikémiát észlelnek, kevesebb inzulint kell beadni.
asztal 7.7. Az 1 XE-t alkotó termékek egyenértékű cseréje
 Például, ha egy beteg glikémiás szintje 7 mmol/l 30 perccel az 5 XE-t tartalmazó tervezett vacsora előtt, 1 egység inzulint kell beadnia, hogy a glikémia normális szintre csökkenjen: 7 mmol/l-ről kb. 5 mmol/l. Ezenkívül 5 egység inzulint kell beadni az 5 XE fedezésére. Így ebben az esetben a páciens 6 egység rövid vagy ultrarövid hatású inzulint fog beadni.
Például, ha egy beteg glikémiás szintje 7 mmol/l 30 perccel az 5 XE-t tartalmazó tervezett vacsora előtt, 1 egység inzulint kell beadnia, hogy a glikémia normális szintre csökkenjen: 7 mmol/l-ről kb. 5 mmol/l. Ezenkívül 5 egység inzulint kell beadni az 5 XE fedezésére. Így ebben az esetben a páciens 6 egység rövid vagy ultrarövid hatású inzulint fog beadni.
A T1DM megnyilvánulása és az inzulinterápia kellően hosszú ideig tartó megkezdése után az inzulinszükséglet kicsi és 0,3-0,4 U/kg-nál kisebb lehet. Ezt az időszakot remissziós szakasznak nevezzük, ill "Nászút". A hiperglikémia és ketoacidózis időszaka után, amelyek a megmaradt β-sejtek 10-15%-ával elnyomják az inzulinszekréciót, a hormonális-anyagcserezavarok inzulin adagolásával történő kompenzálása helyreállítja e sejtek működését, amelyek aztán átveszik a szervezet inzulinellátását. minimális szinten. Ez az időszak több héttől több évig is eltarthat, de végül a megmaradt β-sejtek autoimmun pusztulása miatt véget ér a „nászút”.
Diéta az önkontroll és az inzulinadag kiválasztásának készségével rendelkező képzett betegek T1DM esetén liberalizálható, pl. közeledik szabadon. Ha a beteg nem túlsúlyos vagy alulsúlyos, akkor a diéta legyen
izokalorikus. A T1DM táplálékának fő összetevője a szénhidrátok, amelyek a napi kalóriák körülbelül 65%-át teszik ki. Előnyben kell részesíteni a komplex, lassan felszívódó szénhidrátokat tartalmazó termékeket, valamint az élelmi rostokban gazdag termékeket. Kerülni kell a könnyen emészthető szénhidrátot tartalmazó termékeket (liszt, édesség). A fehérjék arányát 10-35%-ra kell csökkenteni, ami segít csökkenteni a mikroangiopátia kialakulásának kockázatát, a zsírok arányát pedig 25-35%-ra kell csökkenteni, míg a zsírok limitálása a kalóriák legfeljebb 7%-át teszi ki. csökkenti az ateroszklerózis kialakulásának kockázatát. Ezenkívül kerülni kell az alkoholtartalmú italok, különösen az erős italok fogyasztását.
A T1DM-ben szenvedő betegekkel végzett munka szerves része és a hatékony kompenzáció kulcsa betegoktatás. A betegnek élete során önállóan kell változtatnia az inzulin adagját minden nap, számos tényezőtől függően. Nyilván ehhez bizonyos készségek elsajátítására van szükség, amelyeket meg kell tanítani a páciensnek. A „DM-1-es betegiskola” endokrinológiai kórházakban vagy ambulánsan szerveződik, és 5-7 strukturált ülésből áll, ahol egy orvos vagy speciálisan képzett nővér interaktívan, különféle szemléltetőeszközök segítségével tanítja meg a betegeknek az alapelveket. önuralom.
Előrejelzés
Inzulinterápia hiányában az 1-es típusú cukorbetegségben szenvedő beteg elkerülhetetlenül meghal ketoacidotikus kómában. Nem megfelelő inzulinterápia esetén, amelynek hátterében a cukorbetegség kompenzációjának kritériumai nem teljesülnek, és a beteg krónikus hiperglikémiás állapotban van (7.3. táblázat), késői szövődmények kezdenek kialakulni és előrehaladni (7.8. pont). A T1DM-ben a diabéteszes mikroangiopátia (nefropátia és retinopátia) és a neuropátia (diabéteszes láb szindróma) manifesztációi a legnagyobb klinikai jelentőséggel bírnak ebből a szempontból. Az 1-es típusú cukorbetegség makroangiopátiája viszonylag ritkán kerül előtérbe.
7.6. 2. TÍPUSÚ CUKRÉBÉSZ
2-es típusú diabetes mellitus- krónikus betegség, amely az inzulinrezisztencia és a β-sejtek szekréciós diszfunkciója miatti hiperglikémia kialakulásával járó szénhidrát-anyagcsere-zavarban nyilvánul meg,
valamint a lipidanyagcsere az érelmeszesedés kialakulásával. Mivel a betegek halálának és rokkantságának fő oka a szisztémás atherosclerosis szövődményei, a T2DM-et néha szív- és érrendszeri betegségnek is nevezik.
asztal 7.8. 2-es típusú diabetes mellitus
 Etiológia
Etiológia
A T2DM egy örökletes hajlamú multifaktoriális betegség. A T2DM konkordanciája egypetéjű ikreknél eléri a 80%-ot vagy még többet. A legtöbb T2DM-es beteg a T2DM jelenlétét jelzi közvetlen családjában; Ha az egyik szülő T2DM-ben szenved, annak valószínűsége, hogy egy leszármazottban az élet során kialakul, 40%. Nem találtak egyetlen gént sem, amelynek polimorfizmusa meghatározná a T2DM-re való hajlamot. A T2DM-re való örökletes hajlam megvalósulásában nagy szerepet játszanak a környezeti tényezők, elsősorban az életmód sajátosságai. A T2DM kialakulásának kockázati tényezői a következők:
Elhízás, különösen zsigeri (lásd 11.2. bekezdés);
Etnikai hovatartozás (különösen a hagyományos életmód nyugatira váltása esetén);
Mozgásszegény életmód;
Étkezési jellemzők (nagy finomított szénhidrát fogyasztás és alacsony rosttartalom);
Artériás magas vérnyomás.
Patogenezis
Patogenetikailag a T2DM az anyagcserezavarok heterogén csoportja, ez határozza meg jelentős klinikai heterogenitását. Patogenezise az inzulinrezisztencián (a szövetek inzulin által közvetített glükózfelhasználásának csökkenésén) alapul, amely a β-sejtek szekréciós diszfunkciójának hátterében fordul elő. Így az inzulinérzékenység és az inzulinszekréció egyensúlyhiánya áll fenn. Szekréciós diszfunkcióβ -sejtek az inzulin „korai” szekréciós felszabadulásának lelassításából áll, válaszul a vércukorszint emelkedésére. Ebben az esetben a szekréció 1. (gyors) fázisa, amely a vezikulák felhalmozódott inzulinnal való kiürítéséből áll, gyakorlatilag hiányzik; A szekréció 2. (lassú) fázisa a folyamatosan stabilizáló hiperglikémia hatására, tónusos üzemmódban következik be, és a túlzott inzulinszekréció ellenére a glikémia szintje az inzulinrezisztencia hátterében nem normalizálódik (7.8. ábra).
A hiperinzulinémia következménye az inzulinreceptorok érzékenységének és számának csökkenése, valamint szuppresszió.
az inzulin hatását közvetítő posztreceptor mechanizmusok (inzulinrezisztencia). Az izom- és zsírsejtekben a fő glükóz transzporter (GLUT-4) tartalma 40%-kal csökken a zsigeri elhízással küzdő egyénekben és 80%-kal a 2-es típusú cukorbetegségben szenvedőkben. A hepatocyták inzulinrezisztenciája és a portális hiperinzulinemia lép fel a máj glükóz túltermelése,és éhgyomri hiperglikémia alakul ki, amelyet a legtöbb T2DM-ben szenvedő betegnél észlelnek, beleértve a betegség korai szakaszát is.
Maga a hiperglikémia hátrányosan befolyásolja a β-sejtek szekréciós aktivitásának jellegét és szintjét (glükotoxicitás). A hosszú távú, sok éven és évtizeden keresztül fennálló hiperglikémia végül a β-sejtek inzulintermelésének kimerüléséhez vezet, és a beteg bizonyos tüneteket tapasztalhat. inzulinhiány- fogyás, ketózis egyidejű fertőző betegségekkel. Azonban a maradék inzulintermelés, amely elegendő a ketoacidózis megelőzéséhez, szinte mindig megmarad a T2DM-ben.
Járványtan
A T2DM meghatározza a cukorbetegség egészének epidemiológiáját, mivel az esetek 98%-át ez teszi ki. A T2DM prevalenciája országonként és etnikai csoportonként eltérő. Európai nyelven
 Rizs. 7.8. A β-sejtek szekréciós diszfunkciója 2-es típusú diabetes mellitusban (az inzulinszekréció 1. gyors fázisának elvesztése)
Rizs. 7.8. A β-sejtek szekréciós diszfunkciója 2-es típusú diabetes mellitusban (az inzulinszekréció 1. gyors fázisának elvesztése)
országokban, az USA-ban és az Orosz Föderációban, a lakosság mintegy 5-6%-át teszi ki. A T2DM incidenciája az életkorral növekszik: a felnőttek körében a T2DM prevalenciája 10%, a 65 év felettiek körében eléri a 20%-ot. A T2DM előfordulása 2,5-szer magasabb az amerikai őslakosok és a hawaiiak körében; a pima indiánok körében (Arizona) eléri az 50%-ot. India, Kína, Chile és afrikai országok hagyományos életmódot folytató vidéki lakossága körében a T2DM prevalenciája nagyon alacsony (kevesebb, mint 1%). A nyugati ipari országokba bevándorlók körében viszont jelentős szintet ér el. Így az USA-ban és Nagy-Britanniában élő indiai és kínai bevándorlók körében a T2DM prevalenciája eléri a 12-15%-ot.
A WHO előrejelzése szerint az elkövetkező 20 évben 122%-kal nő a cukorbetegek száma a világon (135-ről 300 millióra). Ennek oka egyrészt a népesség progresszív öregedése, másrészt az urbanizált életmód terjedése és romlása. Az elmúlt években a T2DM jelentős „fiatalodása” ment végbe, és megnőtt az előfordulása a gyermekek körében.
Klinikai megnyilvánulások
A legtöbb esetben, nincsenek kifejezett klinikai megnyilvánulások,és a diagnózist a glikémiás szintek rutinszerű meghatározásával állítják fel. A betegség általában 40 éves kor felett jelentkezik, míg a betegek túlnyomó többsége elhízott és a metabolikus szindróma egyéb összetevőiben szenved (lásd 11.2 pont). A betegek nem panaszkodnak teljesítménycsökkenésre, ha ennek nincs más oka. A szomjúság és a polyuria panaszai ritkán érnek el jelentős mértékű súlyosságot. A betegeket gyakran bőr- és hüvelyviszketés zavarja, ezért bőrgyógyászhoz és nőgyógyászhoz fordulnak. Mivel a T2DM tényleges megnyilvánulásától a diagnózisig gyakran sok év (átlagosan körülbelül 7 év) telik el, sok betegnél a klinikai kép dominál. a cukorbetegség késői szövődményeinek tünetei és megnyilvánulásai. Ráadásul a T2DM-ben szenvedő beteg első orvosi látogatása nagyon gyakran késői szövődmények miatt következik be. Így a betegek sebészeti kórházakban kerülhetnek kórházba a lábak fekélyes elváltozásaival (diabetikus láb szindróma), forduljon szemészhez a progresszív látásvesztés miatt (diabetikus retinopátia), szívroham, agyvérzés miatt kórházba kell kerülni
tami, a lábak ereinek eltüntető elváltozásai olyan intézményekben, ahol először észlelik a hiperglikémiát.
Diagnosztika
A 7.3. bekezdésben a cukorbetegség minden típusára jellemző diagnosztikai kritériumokat mutatjuk be. A DM-2 diagnózisa az esetek túlnyomó részében a DM-2 tipikus klinikai tüneteivel (elhízás, 40-45 év feletti életkor, DM-2 pozitív családi anamnézis, egyéb komponensek) hiperglikémia azonosításán alapul. a metabolikus szindróma), klinikai és laboratóriumi jelek hiányában abszolút inzulinhiány (kifejezett fogyás, ketózis). A T2DM magas prevalenciájának, jellemző hosszú távú tünetmentes lefolyásának és a súlyos szövődmények korai diagnózissal történő megelőzésének lehetőségének kombinációja előre meghatározza a szükségességet. szűrés, azok. vizsgálat elvégzése a T2DM kizárására a betegség tünetét nem hordozó személyek körében. A fő teszt, amint jeleztük, az elhatározás éhgyomri vércukorszint. A következő helyzetekben van feltüntetve:
1. Minden 45 év feletti embernél, különösen testtömeg-többlet esetén (BMI több mint 25 kg/m2) 3 évenkénti időközönként.
2. Fiatalabb korban testtömeg-többlet (BMI több mint 25 kg/m2) és további kockázati tényezők jelenlétében, amelyek közé tartozik:
Mozgásszegény életmód;
CD-2 közeli rokonoknál;
A T2DM kialakulásának magas kockázatának kitett nemzetiségekhez való tartozás (afro-amerikaiak, spanyolajkúak, indiánok stb.);
Nők, akik 4 kg-nál nagyobb súlyú gyermeket szültek és/vagy akiknek a kórtörténetében terhességi cukorbetegség szerepel;
artériás magas vérnyomás (≥ 140/90 Hgmm);
HDL-szint > 0,9 mmol/l és/vagy trigliceridek > 2,8 mmol/l;
Policisztás petefészek szindróma;
NTG és NGNT;
Szív-és érrendszeri betegségek.
A T2DM előfordulásának jelentős növekedése a gyermekek körében megköveteli a glikémiás szintek szűrésének szükségességét. gyermekek és serdülők körében(10 évtől kezdődően 2 éves időközzel vagy az elejével
pubertás, ha ez korábbi életkorban következett be), fokozottan veszélyeztetett csoportokba tartoznak, amelyek közé tartoznak a gyermekek túlzott testsúllyal(BMI és/vagy testsúly > 85. percentilis életkor vagy az ideális testsúly 120%-ánál nagyobb testtömeg esetén) a következő további kockázati tényezők bármelyikével kombinálva:
CD-2 első vagy másodfokú rokonok körében;
Magas kockázatú nemzetiséghez tartozik;
Inzulinrezisztenciával kapcsolatos klinikai tünetek (acanthosis nigricans, artériás magas vérnyomás, diszlipidémia);
Cukorbetegség, beleértve a terhességi cukorbetegséget is, az anyában.
Megkülönböztető diagnózis
A DM-2 és DM-1 differenciáldiagnózisa a legnagyobb klinikai jelentőségű, melynek alapelveit a 7.5. bekezdés ismerteti (7.6. táblázat). Amint jeleztük, a legtöbb esetben klinikai adatokon alapul. Azokban az esetekben, amikor a cukorbetegség típusának megállapítása nehéz, vagy a cukorbetegség valamely ritka változatának gyanúja merül fel, ideértve az örökletes szindrómákat is, a legfontosabb gyakorlati kérdés, amelyre választ kell adni, az, hogy a betegnek szüksége van-e inzulinkezelésre.
Kezelés
A DM2 kezelésének fő összetevői a következők: diétaterápia, fokozott fizikai aktivitás, hipoglikémiás terápia, a DM késői szövődményeinek megelőzése és kezelése. Mivel a T2DM-ben szenvedő betegek többsége elhízott, az étrendnek a fogyás (hipokaloriás) és a késői szövődmények, elsősorban a makroangiopátia (atherosclerosis) megelőzésére kell irányulnia. Hipokalóriás diéta minden túlsúlyos (BMI 25-29 kg/m2) vagy elhízott (BMI > 30 kg/m2) beteg számára szükséges. A legtöbb esetben a napi kalóriabevitelt nőknek 1000-1200 kcal-ra, férfiaknak 1200-1600 kcal-ra kell csökkenteni. A fő élelmiszer-összetevők ajánlott aránya a DM-2-hez hasonló a DM-1-hez (szénhidrátok - 65%, fehérjék 10-35%, zsírok legfeljebb 25-35%). Használat alkohol korlátozni kell, mivel jelentős plusz kalóriaforrás, valamint a terápia alatti alkoholfogyasztás
A szulfonilureák és az inzulin lenyelése hipoglikémia kialakulását idézheti elő (lásd 7.7.3 pont).
Ajánlások a a fizikai aktivitás növelése egyénre kell szabni. Kezdetben közepes intenzitású, 30-45 perces aerob testmozgás (séta, úszás) napi 3-5 alkalommal (hetente kb. 150 perc) javasolt. A jövőben a fizikai aktivitás fokozatos növelésére van szükség, ami jelentősen hozzájárul a testtömeg csökkenéséhez és normalizálásához. Ezenkívül a fizikai aktivitás csökkenti az inzulinrezisztenciát, és hipoglikémiás hatással rendelkezik. A diétás terápia és a fokozott fizikai aktivitás kombinációja glükózcsökkentő gyógyszerek felírása nélkül lehetővé teszi a cukorbetegség kompenzációjának fenntartását a kitűzött céloknak megfelelően (7.3. táblázat) a T2DM-ben szenvedő betegek körülbelül 5%-ánál.
Gyógyszerek a hipoglikémiás terápia A T2DM-mel négy fő csoportra osztható.
I. Az inzulinrezisztenciát csökkentő gyógyszerek (szenzibilizátorok). Ebbe a csoportba tartoznak a metformin és a tiazolidindionok. Metformin az egyetlen jelenleg használt gyógyszer a csoportból biguanidok. Hatásmechanizmusának fő összetevői a következők:
1. A glükoneogenezis elnyomása a májban (a máj glükóztermelésének csökkenése), ami az éhomi vércukorszint csökkenéséhez vezet.
2. Csökkent inzulinrezisztencia (a perifériás szövetek, elsősorban az izmok fokozott glükózfelhasználása).
3. Az anaerob glikolízis aktiválása és a glükóz felszívódásának csökkentése a vékonybélben.
Metformin a 2-es típusú cukorbetegségben, elhízással és éhomi hiperglikémiában szenvedő betegek glükózcsökkentő terápiájában az első számú gyógyszer. A kezdő adag 500 mg este vagy vacsora közben. Ezt követően az adagot fokozatosan 2-3 grammra emelik 2-3 adagban. A mellékhatások közül viszonylag gyakori a dyspepsia (hasmenés), amely általában átmeneti, és a gyógyszer szedése után 1-2 héttel magától elmúlik. Mivel a metforminnak nincs stimuláló hatása az inzulintermelésre, hipoglikémia nem fordul elő a gyógyszer monoterápia során.
kialakul (hatása antihiperglikémiás, nem hipoglikémiás). A metformin alkalmazásának ellenjavallata a terhesség, a súlyos szív-, máj-, vese- és egyéb szervi elégtelenség, valamint egyéb eredetű hipoxiás állapotok. Rendkívül ritka szövődmény, amely akkor fordul elő, ha a metformint a fenti ellenjavallatok figyelembevétele nélkül írják fel, a tejsavas acidózis, amely az anaerob glikolízis hiperaktivációjának következménye.
Tiazolidindionok(pioglitazon, roziglitazon) peroxiszóma proliferátor által aktivált receptor γ (PPAR-γ) agonisták. A tiazolidindionok aktiválják a glükóz és a lipidek metabolizmusát az izom- és zsírszövetben, ami az endogén inzulin aktivitásának növekedéséhez vezet, pl. Az inzulinrezisztencia (inzulinérzékenyítők) megszüntetésére. A pioglitazon napi adagja 15-30 mg/nap, a roziglitazon - 4-8 mg (1-2 adagra). A tiazolidindionok és a metformin kombinációja nagyon hatékony. A tiazolidindionok alkalmazásának ellenjavallata a máj transzaminázok szintjének emelkedése (2,5-szeres vagy több). A hepatotoxicitás mellett a tiazolidindionok mellékhatásai közé tartozik a folyadékretenció és az ödéma, amelyek gyakrabban alakulnak ki, ha a gyógyszereket inzulinnal kombinálják.
II. Gyógyszerek befolyásoljákβ -sejteket, és elősegíti a fokozott inzulinszekréciót. Ebbe a csoportba tartoznak a szulfonil-karbamidok és a glinidek (étkezési glikémiás szabályozók), amelyeket elsősorban az étkezés utáni glikémiás szint normalizálására használnak. Fő célpont szulfonil-karbamidok(PSM) a hasnyálmirigy-szigetek β-sejtjei. A PSM-ek a β-sejtmembrán specifikus receptoraihoz kötődnek. Ez az ATP-függő káliumcsatornák bezárásához és a sejtmembrán depolarizációjához vezet, ami viszont elősegíti a kalciumcsatornák megnyílását. A kalcium bejutása a β-sejtekbe azok degranulációjához és inzulin felszabadulásához vezet a vérbe. A klinikai gyakorlatban meglehetősen sok PSM-et alkalmaznak, amelyek a glükózcsökkentő hatás időtartamában és súlyosságában különböznek (7.9. táblázat).
asztal 7.9. Szulfonilureák
 A PSM fő és meglehetősen gyakori mellékhatása a hipoglikémia (lásd 7.7.3 pont). Előfordulhat a gyógyszer túladagolásával, felhalmozódásával (veseelégtelenség),
A PSM fő és meglehetősen gyakori mellékhatása a hipoglikémia (lásd 7.7.3 pont). Előfordulhat a gyógyszer túladagolásával, felhalmozódásával (veseelégtelenség),
az étrend be nem tartása (étkezések kihagyása, alkoholfogyasztás) vagy étrend (jelentős fizikai aktivitás, amely előtt nem csökkentették a PSM adagját vagy nem vettek szénhidrátot).
A csoporthoz glinides(étkezési glikémiás szabályozók) közé tartozik repaglinid(benzoesav származék; napi adag 0,5-16 mg/nap) ill nateglinid(D-fenilalanin származék; napi adag 180-540 mg/nap). Beadásuk után a gyógyszerek gyorsan és reverzibilisen kölcsönhatásba lépnek a β-sejt szulfonilurea-receptorával, ami az inzulinszint rövid távú emelkedését eredményezi, ami utánozza a normál inzulinszekréció első fázisát. A gyógyszereket 10-20 perccel a főétkezések előtt kell bevenni, általában napi 3 alkalommal.
III. Olyan gyógyszerek, amelyek csökkentik a glükóz felszívódását a bélben.
Ebbe a csoportba tartozik az akarbóz és a guargumi. Az akarbóz hatásmechanizmusa az α-glikozidázok reverzibilis blokádja a vékonybélben, aminek eredményeként a szekvenciális fermentáció és a szénhidrátok felszívódásának folyamatai lelassulnak, csökken a felszívódás és a glükóz májba jutásának sebessége. , és az étkezés utáni glikémia szintje csökken. Az akarbóz kezdeti adagja 50 mg naponta háromszor, ezt követően az adag napi háromszor 100 mg-ra emelhető; a gyógyszert közvetlenül étkezés előtt vagy közben kell bevenni. Az akarbóz fő mellékhatása a bélrendszeri dyspepsia (hasmenés, puffadás), amely a fel nem szívódott szénhidrátok vastagbélbe jutásával jár. Az akarbóz glükóz-csökkentő hatása igen mérsékelt (7.10. táblázat).
A klinikai gyakorlatban a tablettázott hipoglikémiás gyógyszereket hatékonyan kombinálják egymással és az inzulin gyógyszerekkel, mivel a legtöbb betegben egyszerre észlelik az éhomi és az étkezés utáni hiperglikémiát. Számos rögzített kombinációk gyógyszerek egy tablettában. Leggyakrabban a metformint különféle PSM-ekkel kombinálják egy tablettában, valamint a metformint tiazolidindionokkal.
asztal 7.10. A tablettázott hipoglikémiás gyógyszerek hatásmechanizmusa és potenciális hatékonysága
 IV. Inzulinok és inzulin analógok
IV. Inzulinok és inzulin analógok
Egy bizonyos szakaszban a T2DM-ben szenvedő betegek 30-40% -a kezd inzulinkészítményeket kapni. A 2-es típusú cukorbetegség inzulinkezelésére vonatkozó javallatok a 7.4 pont elején találhatók. A T2DM-ben szenvedő betegek inzulinkezelésre való átültetésének leggyakoribb módja a hosszú hatástartamú inzulin (NPH inzulin, glargin vagy detemir) felírása glükóz-csökkentő gyógyszerek tablettáival kombinálva. Abban az esetben, ha az éhgyomri vércukorszint a metformin felírásával nem szabályozható, vagy ez utóbbi ellenjavallt, a beteg esti (éjszakai) inzulin injekciót ír elő. Ha az éhgyomri és a posztprandiális glikémiát tabletta gyógyszerekkel nem lehet szabályozni, a beteget monoinzulin terápiára helyezik át. Jellemzően a T2DM esetében az inzulinterápia az ún "hagyományos" séma amely magában foglalja a hosszú és rövid hatású inzulin fix dózisú felírását. Ebben a tervben
Kényelmesek az egy üvegben rövid (ultrarövid) és hosszú hatástartamú inzulint tartalmazó standard inzulinkeverékek. A hagyományos inzulinterápia megválasztását meghatározza, hogy T2DM esetén gyakran olyan idős betegeknek írják fel, akiket nehéz megtanítani az önálló inzulinadag módosítására. Ezenkívül az intenzív inzulinterápia, amelynek célja a szénhidrát-anyagcsere kompenzációjának fenntartása a normoglikémiát megközelítő szinten, megnöveli a hipoglikémia kockázatát. Míg az enyhe hipoglikémia nem jelent komoly kockázatot fiatalabb betegeknél, nagyon kedvezőtlen szív- és érrendszeri következményei lehetnek az idősebb betegeknél, akiknél alacsonyabb a hipoglikémia előfordulási küszöbe. A T2DM-ben szenvedő fiatal betegek, valamint a hatékony tanulás ígéretes lehetőségeivel rendelkező betegek az inzulinterápia intenzív változatát írhatják elő.
Előrejelzés
A T2DM-ben szenvedő betegek rokkantságának és halálának fő oka a késői szövődmények (lásd 7.8 pont), leggyakrabban a diabéteszes macroangiopathia. Egyes késői szövődmények kialakulásának kockázatát olyan tényezők együttese határozza meg, amelyeket a vonatkozó fejezetekben tárgyalunk. Kifejlődésük egyetemes kockázati tényezője a krónikus hiperglikémia. Így a 2-es típusú cukorbetegségben szenvedő betegek HbA1c-szintjének 1%-os csökkenése a teljes mortalitás körülbelül 20%-kal, 2%-kal, illetve 3%-kal - körülbelül 40%-kal - csökkenéséhez vezet.
7.7. A DIABÉTESZ MELLITUS AKUT SZÖVŐDÉSE
7.7.1. Cukorbetegség során jelentkező acetonsav felszaporodás a szervezetben
Diabéteszes ketoacidózis (DKA)- a DM-1 dekompenzációja, amelyet az inzulin abszolút hiánya okoz, amely időben történő kezelés hiányában ketoacidotikus kómával (KC) és halállal végződik.
Etiológia
A DKA-t az inzulin abszolút hiánya okozza. A változó súlyosságú DKA-t a legtöbb betegben a T1DM manifesztációja idején határozzák meg (az összes DKA eset 10-20%-a).
Egy megállapított T1DM diagnózisú betegben DKA alakulhat ki az inzulin adagolásának leállításával, gyakran maga a beteg (a DKA esetek 13%-a), kísérő betegségek, elsősorban fertőző betegségek hátterében, az inzulinszint növekedésének hiányában. inzulin adag
asztal 7.11. Cukorbetegség során jelentkező acetonsav felszaporodás a szervezetben
 A T1DM-ben szenvedő fiatal betegeknél a DKA kialakulása eseteinek akár 20%-a pszichés problémákkal és/vagy étkezési zavarokkal (súlygyarapodástól való félelem, hipoglikémiától való félelem, tinédzserkori problémák) társul. A DKA meglehetősen gyakori oka számos országban az
A T1DM-ben szenvedő fiatal betegeknél a DKA kialakulása eseteinek akár 20%-a pszichés problémákkal és/vagy étkezési zavarokkal (súlygyarapodástól való félelem, hipoglikémiától való félelem, tinédzserkori problémák) társul. A DKA meglehetősen gyakori oka számos országban az
az inzulin megvonása a beteg által a népesség egyes szegmenseinek magas gyógyszerköltsége miatt (7.11. táblázat).
Patogenezis
A DKA patogenezise az inzulin abszolút hiányán alapul, amely kombinálódik a szigetellenes hormonok, például a glukagon, a katekolaminok és a kortizol termelésének növekedésével. Ennek eredményeként jelentősen megnő a máj glükóztermelése, és megsérti a perifériás szövetek felhasználását, megnő a hiperglikémia és megsérti az extracelluláris tér ozmolaritását. Az inzulinhiány a kontrainsuláris hormonok relatív feleslegével kombinálva a DKA-ban szabad zsírsavak felszabadulásához (lipolízis) és a májban ketontestekké (β-hidroxi-butirát, acetoacetát, aceton) történő kontrollálatlan oxidációjához vezet, ami hyperketonémia, majd ezt követően metabolikus acidózis kialakulása. Súlyos glikozuria következtében ozmotikus diurézis, kiszáradás, nátrium-, kálium- és egyéb elektrolitvesztés alakul ki (7.9. ábra).
Járványtan
Az új DKA-esetek előfordulási gyakorisága 1000 1-es típusú cukorbetegből évente 5-8, és közvetlenül függ a cukorbetegek orvosi ellátásának megszervezésétől. Az Egyesült Államokban évente körülbelül 100 000 kórházi kezelés történik DKA miatt, és a 13 000 dolláros betegenkénti kórházi kezeléssel évente több mint 1 milliárd dollárt költenek a DKA fekvőbeteg-ellátására. Az Orosz Föderációban 2005-ben a T1DM-ben szenvedő gyermekek 4,31%-ánál, a serdülők 4,75%-ánál és a felnőtt betegek 0,33%-ánál regisztráltak DKA-t.
Klinikai megnyilvánulások
A DKA kialakulása az azt okozó októl függően több héttől egy napig is eltarthat. A legtöbb esetben a DKA-t a dekompenzált cukorbetegség tünetei előzik meg, de előfordulhat, hogy nincs idejük kifejlődni. A DKA klinikai tünetei közé tartozik a poliuria, polidipsia, fogyás, diffúz hasi fájdalom ("diabetikus pszeudoperitonitis"), kiszáradás, súlyos gyengeség, acetonszag a leheletből (vagy gyümölcsszag) és a tudat fokozatos elhomályosodása. A DKA-val járó valódi kóma a közelmúltban viszonylag ritkán alakult ki a korai diagnózis miatt. A fizikális vizsgálat a kiszáradás jeleit tárja fel: csökkent
 Rizs. 7.9. A ketoacidotikus kóma patogenezise
Rizs. 7.9. A ketoacidotikus kóma patogenezise
a bőr turgora és a szemgolyó sűrűsége, tachycardia, hipotenzió. Előrehaladott esetekben Kussmaul légzés alakul ki. A DKA-ban szenvedő betegek több mint 25%-ánál hányás alakul ki, amely színű kávézaccra emlékeztethet.
Diagnosztika
Klinikai képadatok, 1-es típusú cukorbetegségre utaló jelek, valamint laboratóriumi vizsgálati adatok alapján. A DKA-t hiperglikémia (egyes esetekben enyhe), ketonuria, metabolikus acidózis, hiperozmolaritás jellemzi (7.12. táblázat).
asztal 7.12. A diabetes mellitus akut szövődményeinek laboratóriumi diagnosztikája
 A cukorbetegség akut dekompenzációjában szenvedő betegek vizsgálatakor meg kell határozni a glikémia, a kreatinin és a karbamid, valamint az elektrolit szintjét, amelyek alapján kiszámítják az effektív ozmolaritást. Ezenkívül a sav-bázis állapot értékelése szükséges. Hatékony ozmolaritás(EO) kiszámítása a következő képlettel történik: 2 *. Általában az EO 285-295 mOsm/l.
A cukorbetegség akut dekompenzációjában szenvedő betegek vizsgálatakor meg kell határozni a glikémia, a kreatinin és a karbamid, valamint az elektrolit szintjét, amelyek alapján kiszámítják az effektív ozmolaritást. Ezenkívül a sav-bázis állapot értékelése szükséges. Hatékony ozmolaritás(EO) kiszámítása a következő képlettel történik: 2 *. Általában az EO 285-295 mOsm/l.
A legtöbb DKA-s betegnél leukocitózis, melynek súlyossága arányos a vér ketontesteinek szintjével. Szint nátrium,általában csökken a folyadék ozmotikus kiáramlása miatt az intracelluláris terekből az extracelluláris terekbe, válaszul a hiperglikémiára. Ritkábban a nátriumszint tévesen csökkenhet súlyos hiper-
trigliceridémia. Szint kálium szérumszintje kezdetben megemelkedhet az extracelluláris terekből való elmozdulása miatt.
Megkülönböztető diagnózis
A cukorbetegek eszméletvesztésének egyéb okai. A hiperozmoláris kómával végzett differenciáldiagnózis általában nem okoz nehézséget (idős T2DM-es betegeknél alakul ki), és nincs nagy klinikai jelentősége, mert A kezelési elvek mindkét állapot esetében hasonlóak. Ha nem lehetséges azonnal meghatározni az eszméletvesztés okát egy cukorbetegnél, glükóz adása javasolt, mert a hipoglikémiás állapotok sokkal gyakoribbak, és a gyors pozitív dinamika a glükóz adagolásának hátterében önmagában lehetővé teszi az eszméletvesztés okának kiderítését.
Kezelés
A DKA kezelése magában foglalja a rehidratációt, a hiperglikémia korrekcióját, az elektrolitzavarokat, valamint a cukorbetegség dekompenzációját okozó betegségek kezelését. A kezelést legoptimálisabban egy speciális egészségügyi intézmény intenzív osztályán végzik. Súlyos egyidejű szívpatológiával nem rendelkező felnőtt betegeknél, még a prehospitális stádiumban is elsőrendű intézkedésként folyadékpótlás Izotóniás oldat (0,9% NaCl) adagolása körülbelül egy liter/óra sebességgel (kb. 15-20 ml/testtömeg-kilogramm/óra) javasolt. A folyadékhiány teljes kompenzációját, amely DKA-ban 100-200 ml/ttkg, a kezelés első napján el kell érni. Egyidejű szív- vagy veseelégtelenség esetén ezt az időtartamot meg kell növelni. Gyermekek számára az izotóniás oldat ajánlott térfogata rehidratációs terápiához 10-20 ml/ttkg/óra, míg az első 4 órában nem haladhatja meg az 50 ml/ttkg-ot. A teljes rehidratáció elérése körülbelül 48 óra elteltével ajánlott. Miután a glikémia szintje körülbelül 14 mmol/l-re csökken a párhuzamos inzulinterápia hátterében, áttérnek 10%-os glükózoldat transzfúziójára, amely folytatja a rehidratációt.
A „kis adagok” fogalma jelenleg elfogadott inzulin a DKA kezelésében. Csak rövid hatású inzulint használnak. Az intravénás inzulin legoptimálisabb alkalmazása az
Lina. Az inzulin intramuszkuláris beadása, amely kevésbé hatékony, csak mérsékelt súlyosságú DKA esetén, stabil hemodinamikával és akkor, ha intravénás terápia nem lehetséges. Utóbbi esetben az injekciókat az egyenes hasizomba adják, míg az inzulinfecskendőre intramuszkuláris injekciós tűt helyeznek (a megbízható intramuszkuláris injekció érdekében), és ezzel a tűvel szívják fel az inzulint az injekciós üvegből a fecskendőbe.
Az intravénás inzulin beadásának többféle lehetősége van. Először az inzulint lehet befecskendezni az infúziós rendszer „gumiszalagjába”, míg a szükséges mennyiségű inzulint egy inzulinfecskendőbe szívják fel, majd 1 ml izotóniás oldatot adnak hozzá. Amíg a glikémiás szint el nem éri a 14 mmol/l-t, a beteg óránként 6-10 egység rövid hatású inzulint kap; további (párhuzamosan a rehidratáló oldat módosításával izotóniásról 10%-os glükózra) az óránként meghatározott glikémiás mutatóktól függően az inzulin adagja óránként 4-8 egységre csökken. A glikémiás szint csökkentésének javasolt mértéke nem haladhatja meg az 5 mmol/l-t óránként. Az intravénás inzulinterápia másik lehetősége egy perfúzor használata. A perfúzor oldatának elkészítéséhez a következő arányt kell alkalmazni: 2 ml 20%-os humán albumin oldatot adunk 50 U rövid hatású inzulinhoz, majd 50 mg 0,9%-os izotóniás oldatot. Ha az inzulin intramuszkuláris adagolási módját választjuk, kezdetben 20 egység rövid hatású inzulint adunk be, majd óránként 6 egység, majd miután a glikémiás szint eléri a 14 mmol/l-t, az adagot óránként 4 egységre csökkentjük. A hemodinamika teljes stabilizálása és a sav-bázis rendellenességek kompenzációja után a beteget szubkután inzulin injekciókra helyezik.
Mint jeleztük, annak ellenére, hogy jelentős káliumhiány a szervezetben (teljes veszteség 3-6 mmol/kg), DKA-val az inzulinterápia megkezdése előtti szintje enyhén emelkedhet. Azonban, ha a plazma káliumszintje 5,5 mmol/l alatt van, az inzulinterápia megkezdésével egyidejűleg javasolt a kálium-klorid-oldat transzfúziójának megkezdése. A káliumhiány sikeres korrekciója csak a pH normalizálódása mellett következik be. Alacsony pH-n jelentősen csökken a kálium beáramlása a sejtbe, ezért lehetőség szerint célszerű a transzfundált kálium-klorid adagját egy adott pH-értékhez igazítani (7.13. táblázat).
asztal 7.13. A káliumhiány korrekciós sémája
 * A számításokhoz a következő adatokat használjuk:
* A számításokhoz a következő adatokat használjuk:
1 g KCl = 13,4 mmol; 1 mmol KCl = 0,075 g KS1 4%-os oldatában: 100 ml-ben - 4 g KS1, 25 ml-ben - 1 g KS1, 10 ml-ben 0,4 g KS1.
A cukorbetegség dekompenzációját gyakran a fertőző betegségek(pyelonephritis, fertőzött fekély diabéteszes láb szindrómában, tüdőgyulladás, arcüreggyulladás stb.). Létezik egy szabály, amely szerint DKA esetén szinte minden alacsony lázas vagy lázas betegnek antibiotikum terápiát írnak fel, még látható fertőzési forrás hiányában is, mivel a testhőmérséklet emelkedése nem jellemző. DKA.
Előrejelzés
A DKA halálozási aránya 0,5-5%, a legtöbb esetben a késői és szakképzetlen orvosi ellátás miatt. A halálozás a legmagasabb (akár 50%) az idős betegek körében.
7.7.2. Hiperozmoláris kóma
Hiperozmoláris kóma A (GOC) a T2DM ritka akut szövődménye, amely súlyos kiszáradás és hiperglikémia eredményeként alakul ki abszolút inzulinhiány hiányában, és magas mortalitással jár (7.14. táblázat).
Etiológia
A GOC általában idősebb T2DM-ben szenvedő betegeknél alakul ki. Az ilyen betegek leggyakrabban egyedül vannak, ellátás nélkül élnek, elhanyagolják állapotukat és önkontrollukat, és nem fogyasztanak elegendő folyadékot. A dekompenzációt gyakran fertőzések (diabéteszes láb szindróma, tüdőgyulladás, akut pyelonephritis), agyi rendellenességek okozzák
vérkeringési és egyéb olyan állapotok, amelyek következtében a betegek rosszul mozognak, nem szednek glükózcsökkentő gyógyszereket, folyadékot.
asztal 7.14. Hiperozmoláris kóma (HOC)
 Patogenezis
Patogenezis
A fokozódó hiperglikémia és az ozmotikus diurézis súlyos kiszáradást okoz, amely a fenti okok miatt kívülről nem pótolódik. A hiperglikémia és a kiszáradás eredménye a plazma hiperozmolaritása. A GOC patogenezisének szerves összetevője az inzulin relatív hiánya és a kontrainsuláris hormonok feleslege, azonban a T2DM-ben fennmaradó maradék inzulinszekréció elegendő a lipolízis és ketogenezis elnyomására, aminek következtében a ketoacidózis kialakulása nem következik be. előfordul.
Egyes esetekben mérsékelt acidózis észlelhető a hiperlaktatémia következtében a szöveti hipoperfúzió hátterében. Súlyos hiperglikémia esetén az agy-gerincvelői folyadék ozmotikus egyensúlyának fenntartása érdekében a nátriumtartalom megnő, az agysejtekből származik, ahová cserébe kálium kerül. Az idegsejtek transzmembrán potenciálja megszakad. A progresszív kábultság görcsös szindrómával együtt alakul ki (7.10. ábra).
Járványtan
A GOC-k az akut hiperglikémiás állapotok 10-30%-át teszik ki T2DM-ben szenvedő felnőtteknél és idős betegeknél. Az esetek körülbelül 2/3-ában a GOC olyan egyénekben alakul ki, akik korábban nem diagnosztizáltak cukorbetegséget.
Klinikai megnyilvánulások
A hiperozmoláris kóma klinikai képének jellemzői a következők:
A kiszáradás és a hipoperfúzió jeleinek és szövődményeinek összessége: szomjúság, száraz nyálkahártyák, tachycardia, artériás hipotenzió, hányinger, gyengeség, sokk;
Fokális és generalizált rohamok;
Láz, hányinger és hányás (az esetek 40-65%-ában);
A kísérő betegségek és szövődmények gyakran a mélyvénás trombózis, a tüdőgyulladás, az agyi érkatasztrófák és a gastroparesis.
Diagnosztika
A klinikai kép alapján a beteg életkora és 2-es típusú cukorbetegség története, súlyos hiperglikémia ketonuria hiányában és ketoacidózis. A GOC tipikus laboratóriumi jeleit a táblázat mutatja be. 7.12.
 Rizs. 7 .10.
A hiperozmoláris kóma patogenezise
Rizs. 7 .10.
A hiperozmoláris kóma patogenezise
Megkülönböztető diagnózis
Egyéb akut állapotok, amelyek cukorbetegeknél alakulnak ki, leggyakrabban egyidejű patológiával, amelyek a cukorbetegség súlyos dekompenzációjához vezetnek.
Kezelés
A GOC kezelése és monitorozása, néhány jellemző kivételével, nem különbözik a ketoacidotikus diabéteszes kómánál leírtaktól (7.7.1. szakasz):
Nagyobb térfogatú kezdeti folyadékpótlás 1,5-2 liter 1. óránként; 1 l - a 2. és 3. órában, majd 500 ml/óra izotóniás nátrium-klorid oldat;
A káliumtartalmú oldatok adagolásának szükségessége általában nagyobb, mint ketoacidotikus kómában;
Az inzulinterápia hasonló a CC-hez, de az inzulinigény kisebb, és a glikémiás szintet óránként legfeljebb 5 mmol/l-rel kell csökkenteni, hogy elkerüljük az agyödéma kialakulását;
A hipotóniás oldat (NaCl 0,45%) beadását legjobb elkerülni (csak súlyos hypernatraemia esetén: > 155 mmol/L és/vagy effektív ozmolaritás > 320 mOsm/L);
Nincs szükség bikarbonát adagolására (csak speciális intenzív osztályokon pH-értékű acidózis esetén< 7,1).
Előrejelzés
A GOC mortalitása magas, és 15-60% között mozog. A legrosszabb prognózis a súlyos egyidejű patológiában szenvedő idős betegeknél van, amelyek gyakran a cukorbetegség dekompenzációjának és a GOC kialakulásának okai.
7.7.3. Hipoglikémia
Hipoglikémia- a szérum glükózszint csökkenése (<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etiológia
Az inzulin és analógjai, valamint a szulfonilureák túladagolása;
elégtelen táplálékfelvétel a változatlan glükózcsökkentő terápia hátterében;
Alkoholtartalmú italok fogyasztása;
Fizikai aktivitás az állandó glükózcsökkentő terápia hátterében és/vagy további szénhidrátbevitel nélkül;
Cukorbetegség késői szövődményei (autonóm neuropátia gastroparesissel, veseelégtelenség) és számos más betegség (mellékvese-elégtelenség, hypothyreosis, májelégtelenség, rosszindulatú daganatok) kialakulása változatlan glükózcsökkentő terápiával (a TSP szedésének folytatása és felhalmozódása a háttérben veseelégtelenség, az inzulin azonos dózisának fenntartása);
Az inzulin beadási technikájának megsértése (intramuszkuláris injekció szubkután helyett);
Mesterséges hipoglikémia (a glükózszint-csökkentő gyógyszerek szándékos túladagolása a páciens részéről);
Szerves hiperinzulinizmus – insulinoma (lásd a 10.3. pontot).
Patogenezis
A hipoglikémia patogenezise a glükóz vérbe jutása, felhasználása, az inzulin szintje és az ellenszigetelő hormonok közötti egyensúly felborulása. Normális esetben 4,2-4,7 mmol/l közötti glikémiás szinten az inzulin termelése és felszabadulása a β-sejtekből visszaszorul. A glikémiás szint 3,9 mmol/l alá csökkenése az ellenszigetelő hormonok (glükagon, kortizol, növekedési hormon, adrenalin) termelésének serkentésével jár együtt. Neuroglikopeniás tünetek akkor alakulnak ki, ha a glikémiás szint 2,5-2,8 mmol/l alá csökken. Túladagolás esetén inzulinés/vagy drogok szulfonil-karbamidok hipoglikémia alakul ki egy exogén vagy endogén hormon közvetlen hipoglikémiás hatása miatt. A szulfonil-karbamid gyógyszerek túladagolása esetén a hipoglikémiás tünetek a roham leállítása után többször is kiújulhatnak, mivel egyes gyógyszerek hatásideje elérheti az egy napot vagy többet. Az inzulintermelést nem serkentő TSP-k (metformin, tiazolidindionok) önmagukban nem okozhatnak hipoglikémiát, de szulfonilureákhoz vagy inzulinhoz adva ez utóbbit azonos dózisban szedve hipoglikémiát okozhat a hipoglikémiás szer felhalmozódása miatt. kombinációs terápia hatása (7.15. táblázat).
asztal 7.15. Hipoglikémia
 A táblázat vége. 7.15
A táblázat vége. 7.15
 Felvételkor alkohol a májban a glükoneogenezis elnyomódik, ami a hipoglikémia elleni legfontosabb tényező. Testmozgás elősegítik a glükóz inzulinfüggetlen hasznosítását, aminek következtében változatlan glükózcsökkentő terápia mellett és/vagy további szénhidrátbevitel hiányában hipoglikémiát okozhatnak.
Felvételkor alkohol a májban a glükoneogenezis elnyomódik, ami a hipoglikémia elleni legfontosabb tényező. Testmozgás elősegítik a glükóz inzulinfüggetlen hasznosítását, aminek következtében változatlan glükózcsökkentő terápia mellett és/vagy további szénhidrátbevitel hiányában hipoglikémiát okozhatnak.
Járványtan
Az intenzív inzulinkezelésben részesülő 1-es típusú cukorbetegségben szenvedő betegeknél enyhe, gyorsan visszafordítható hipoglikémia hetente többször előfordulhat, és viszonylag ártalmatlan. Minden intenzív inzulinkezelésben részesülő betegre évente 1 súlyos hipoglikémia fordul elő. A legtöbb esetben a hipoglikémia éjszaka alakul ki. A 2-es típusú cukorbetegségben az inzulint kapó betegek 20%-ánál és a szulfonilureát kapó betegek 6%-ánál alakul ki legalább egy súlyos hipoglikémiás epizód 10 év alatt.
Klinikai megnyilvánulások
A tüneteknek két fő csoportja van: adrenerg, amely a szimpatikus idegrendszer aktiválásával és a mellékvesék általi adrenalin felszabadulásával jár, és a neuroglikopén, amely a központi idegrendszer működési zavarával jár, fő energiaszubsztrátjának hiánya miatt. . NAK NEK adrenerg tünetek: tachycardia, mydriasis; szorongás, agresszivitás; remegés, hideg verejték, paresztézia; hányinger, erős éhség, fokozott nyálfolyás; hasmenés, túlzott vizelés. NAK NEK neuroglikopén a tünetek közé tartozik az asthenia,
csökkent koncentráció, fejfájás, félelem, zavartság, tájékozódási zavar, hallucinációk; beszéd-, látás-, viselkedészavarok, amnézia, tudatzavar, görcsök, átmeneti bénulás, kóma. Előfordulhat, hogy nincs egyértelmű kapcsolat a tünetek súlyossága és sorrendje között, mivel a hipoglikémia súlyosabbá válik. Csak adrenerg vagy csak neuroglikopeniás tünetek jelentkezhetnek. Egyes esetekben a normoglikémia helyreállítása és a folyamatos terápia ellenére a betegek kábulatban vagy akár kómás állapotban maradhatnak több órán vagy akár napon keresztül. Az elhúzódó hipoglikémia vagy annak gyakori epizódjai a központi idegrendszerben (elsősorban az agykéregben) visszafordíthatatlan változásokhoz vezethetnek, amelyek megnyilvánulásai jelentősen változnak a delírikus és hallucinációs-paranoid epizódoktól a tipikus epilepsziás rohamokig, amelyek elkerülhetetlen következménye a tartós demencia. .
A betegek szubjektíven könnyebben tolerálják a hiperglikémiát, mint az enyhe hipoglikémiás epizódokat. Ezért sok beteg a hipoglikémiától való félelem miatt szükségesnek tartja a glikémiát viszonylag magas szinten tartani, ami valójában a betegség dekompenzációjának felel meg. Ennek a sztereotípiának a leküzdése néha jelentős erőfeszítést igényel az orvosoktól és a kiképző személyzettől.
Diagnosztika
A cukorbetegségben szenvedő betegek hipoglikémiájának klinikai képe az alacsony vércukorszint laboratóriumi (általában glükométerrel) kimutatásával kombinálva.
Megkülönböztető diagnózis
Egyéb eszméletvesztéshez vezető okok. Ha a cukorbetegségben szenvedő beteg eszméletvesztésének oka nem ismert, és lehetetlen a glikémiás szint gyors elemzése, glükóz adása javasolt. Gyakran meg kell határozni a cukorbetegségben szenvedő betegek gyakori hipoglikémia kialakulásának okát. Leggyakrabban a nem megfelelő glükózcsökkentő terápia és a beteg alacsony szintű ismerete a betegségről. Emlékeztetni kell arra, hogy számos betegség (mellékvese-elégtelenség, pajzsmirigy alulműködés, vese- és májelégtelenség), beleértve a rosszindulatú daganatokat is, a glükózcsökkentő terápia szükségességének csökkenéséhez vezethet, egészen annak teljes megszüntetéséig („eltűnt cukorbetegség”). .
Kezelés
Az enyhe hipoglikémia kezelésére, amelyben a beteg eszméleténél van és tud önmagán segíteni, általában elegendő 1-2 kenyéregység (10-20 g glükóz) szénhidráttartalmú ételt vagy folyadékot bevenni. Ezt a mennyiséget például 200 ml édes gyümölcslé tartalmazza. Az italok hatékonyabban enyhítik a hipoglikémiát, mivel folyékony formában a glükóz sokkal gyorsabban szívódik fel. Ha a tünetek a folyamatos szénhidrátbevitel ellenére tovább súlyosbodnak, intravénás glükóz vagy intramuszkuláris glukagon szükséges. Az eszméletvesztéssel járó súlyos hipoglikémiát hasonló módon kezelik. Ebben az esetben a páciens körülbelül 50 ml-t kap 40%-os glükóz oldat intravénásan. A glükóz adagolását addig kell folytatni, amíg a roham le nem áll és a glikémia normalizálódik, bár nagyobb adagra - legfeljebb 100 ml-re - általában nincs szükség. glukagon intramuszkulárisan vagy szubkután adják be (általában gyárilag elkészített töltött fecskendővel). Néhány perc múlva a glikémiás szint normalizálódik a glukagon glikogenolízisének köszönhetően. Ez azonban nem mindig történik meg: ha a vér inzulinszintje magas, a glukagon hatástalan. A glukagon felezési ideje rövidebb, mint az inzuliné. Alkoholizmus és májbetegség esetén a glikogén szintézis károsodik, és a glukagon adagolása hatástalan lehet. A glukagon beadásának mellékhatása lehet a hányás, ami az aspiráció veszélyét okozhatja. A beteg hozzátartozóinak tanácsos elsajátítani a glukagon injekció technikáját.
Előrejelzés
Az enyhe hipoglikémia képzett betegeknél a betegség jó kompenzációja mellett biztonságos. A gyakori hipoglikémia a cukorbetegség rossz kompenzációjának jele; a legtöbb esetben az ilyen betegeknek többé-kevésbé súlyos hiperglikémiája és magas glikált hemoglobinszintje van a nap többi részében. A cukorbetegség késői szövődményeiben szenvedő idős betegeknél a hipoglikémia érrendszeri szövődményeket, például szívinfarktust, stroke-ot és retinavérzést okozhat. Az akár 30 percig tartó hipoglikémiás kómának megfelelő kezeléssel és gyors eszméletvesztéssel általában nincs szövődménye vagy következménye.
7.8. A DIABÉTESZ MELLITUS KÉSŐI SZÖVŐDÉSE
Mindkét típusú cukorbetegségben késői szövődmények alakulnak ki. Klinikailag a cukorbetegségnek öt fő késői szövődménye van: makroangiopátia, nephropathia, retinopátia, neuropátia és diabéteszes láb szindróma. A cukorbetegség bizonyos típusai esetében a késői szövődmények nem specifikusságát az a tény határozza meg, hogy fő patogenetikai kapcsolatuk a krónikus hiperglikémia. Ebben a tekintetben a T1DM megnyilvánulása idején a betegek késői szövődményei szinte soha nem fordulnak elő, évek és évtizedek alatt alakulnak ki, a terápia hatékonyságától függően. Általában a T1DM esetében a legnagyobb klinikai jelentősége az diabéteszes mikroangiopátia(nefropátia, retinopátia) és neuropátia (diabéteszes láb szindróma). Ezzel szemben a T2DM esetében a késői szövődmények gyakran már a diagnózis idején észlelhetők. Először is, ez annak a ténynek köszönhető, hogy a T2DM jóval a diagnózis felállítása előtt manifesztálódik. Másodszor, az atherosclerosisnak, amely klinikailag makroangiopátiával nyilvánul meg, számos, a cukorbetegséggel közös patogenezis összefüggése van. A T2DM-ben a legnagyobb klinikai jelentőséget általában a cukorbetegek szerzik makroangiopátia, amelyet a betegek túlnyomó többségénél a diagnózis felállításakor észlelnek. Minden konkrét esetben az egyes késői szövődmények halmaza és súlyossága a betegség jelentős időtartama ellenére paradox teljes hiányuktól a súlyos formában lehetséges összes lehetőség kombinációjáig változik.
A késői szövődmények fő halálok cukorbetegek, és prevalenciáját is figyelembe véve a legtöbb országban ez a legfontosabb egészségügyi és szociális egészségügyi probléma. Ennek köszönhetően kezelés fő célja a cukorbetegek megfigyelése pedig annak késői szövődményeinek (elsődleges, másodlagos, harmadlagos) megelőzése.
7.8.1. Diabéteszes makroangiopátia
Diabéteszes makroangiopátia- egy gyűjtőfogalom, amely egyesíti a nagy artériák ateroszklerotikus elváltozásait a cukorbetegségben,
klinikailag szívkoszorúér-betegségben (CHD), az agyi erek, az alsó végtagok, a belső szervek atherosclerosisában és az artériás magas vérnyomásban nyilvánul meg (7.16. táblázat).
asztal 7.16. Diabéteszes makroangiopátia
 Etiológia és patogenezis
Etiológia és patogenezis
Valószínűleg hasonló az atherosclerosis etiológiájához és patogeneziséhez a cukorbetegségben nem szenvedő egyénekben. Az ateroszklerotikus plakkok nem különböznek mikroszkopikus szerkezetükben a cukorbetegségben szenvedő és nem szenvedő egyénekben. A cukorbetegségben azonban további kockázati tényezők előtérbe kerülhetnek, vagy a cukorbetegség súlyosbíthatja az ismert nem specifikus tényezőket. Ezek a cukorbetegség esetén a következők:
1. Hiperglikémia. Az érelmeszesedés kialakulásának kockázati tényezője. A T2DM-ben szenvedő betegek HbA1c-szintjének 1%-os emelkedése nő
A szívinfarktus kialakulásának kockázata 15%. A hiperglikémia aterogén hatásának mechanizmusa nem teljesen tisztázott, talán az LDL-anyagcsere végtermékeinek és az érfal kollagénjének glikozilációjához kapcsolódik.
2. Artériás magas vérnyomás(AG). A patogenezisben nagy jelentőséget tulajdonítanak a vesekomponensnek (diabetikus nefropátia). A 2-es típusú cukorbetegségben a magas vérnyomás nem kevésbé jelentős kockázati tényező a szívroham és a szélütés szempontjából, mint a hiperglikémia.
3. Dislipidémia. A 2-es típusú cukorbetegségben az inzulinrezisztencia szerves összetevője, a hyperinsulinaemia a HDL-szint csökkenését, a trigliceridszint emelkedését és a sűrűség csökkenését okozza, i.e. az LDL fokozott atherogenitása.
4. Elhízottság, amely a legtöbb T2DM-ben szenvedő betegtől szenved, az ateroszklerózis, a szívinfarktus és a stroke független kockázati tényezője (lásd 11.2 pont).
5. Inzulinrezisztencia. A hiperinzulinémia és az inzulin-proinzulin-szerű molekulák magas szintje növeli az érelmeszesedés kialakulásának kockázatát, amely endothel diszfunkcióval járhat.
6. Véralvadási zavar. Cukorbetegségben a fibrinogén, a thrombocyta-gátló aktivátor és a von Willebrand faktor szintjének növekedését határozzák meg, ami a véralvadási rendszer protrombotikus állapotának kialakulását eredményezi.
7. endothel diszfunkció, plazminogén inhibitor aktivátor és sejtadhéziós molekulák fokozott expressziója jellemez.
8. Oxidatív stressz, ami az oxidált LDL és F2-izoprosztánok koncentrációjának növekedéséhez vezet.
9. Szisztémás gyulladás amelyben a fibrinogén és a C-reaktív fehérje expressziója fokozódik.
A 2-es típusú cukorbetegségben a koszorúér-betegség kialakulásának legjelentősebb kockázati tényezői a megnövekedett LDL-szint, a HDL-szint csökkenése, az artériás magas vérnyomás, a hiperglikémia és a dohányzás. Az egyik különbség a cukorbetegség érelmeszesedési folyamata között az elterjedtebb és az okklúziós elváltozás distalis jellege, azok. A folyamat gyakran viszonylag kisebb artériákat érint, ami bonyolítja a műtéti kezelést és rontja a prognózist.
Járványtan
A szívkoszorúér-betegség kialakulásának kockázata a 2-es típusú cukorbetegeknél hatszor nagyobb, mint a nem cukorbetegeknél, míg férfiaknál és nőknél azonos. Az 1-es típusú cukorbetegek 20%-ánál, a 2-es típusú cukorbetegek 75%-ánál észlelik az artériás magas vérnyomást. Általában a cukorbetegeknél kétszer gyakrabban fordul elő, mint azoknál, akiknél nincs. A perifériás erek obliteráló atherosclerosisa a cukorbetegek 10%-ában alakul ki. Az agyi erek thromboemboliája a cukorbetegek 8%-ánál alakul ki (2-4-szer gyakrabban, mint a cukorbetegeknél).
Klinikai megnyilvánulások
Alapvetően nem különböznek a cukorbetegségben nem szenvedőkétől. A T2DM klinikai képében gyakran előtérbe kerülnek a makrovaszkuláris szövődmények (szívinfarktus, stroke, a lábak ereinek elzáródása), amelyek kialakulásával gyakran észlelik először a hiperglikémiát a betegnél. Talán az egyidejű autonóm neuropátia miatt a cukorbetegeknél a szívizominfarktusok akár 30%-a tipikus anginás roham (fájdalommentes infarktus) nélkül következik be.
Diagnosztika
Az érelmeszesedés szövődményeinek (koszorúér-betegség, cerebrovaszkuláris baleset, a láb artériáinak elzáródása) diagnosztizálásának alapelvei nem különböznek a cukorbetegségben nem szenvedőkétől. Mérés vérnyomás(BP) vizsgálatot kell végezni a cukorbeteg minden orvosi látogatásakor, és a mutatók meghatározását. lipid spektrum A cukorbetegség vérvizsgálatát (összkoleszterin, trigliceridek, LDL, HDL) évente legalább egyszer el kell végezni.
Megkülönböztető diagnózis
Egyéb szív- és érrendszeri betegségek, tünetekkel járó artériás magas vérnyomás, másodlagos diszlipidémia.
Kezelés
♦ Vérnyomás szabályozás. Cukorbetegség esetén a szisztolés vérnyomás megfelelő szintje 130 Hgmm alatti, a diasztolés vérnyomás pedig 80 Hgmm (7.3. táblázat). A legtöbb betegnek több vérnyomáscsökkentő gyógyszerre van szüksége e cél eléréséhez. A cukorbetegség vérnyomáscsökkentő terápiájában a választott gyógyszerek az ACE-gátlók és az angiotenzin receptor blokkolók, amelyeket szükség esetén tiazid diuretikumokkal egészítenek ki. A szívinfarktuson átesett cukorbetegek által választott gyógyszerek a β-blokkolók.
♦ Dislipidémia korrekciója. A lipidspektrum indikátorok célszintjeit a táblázat tartalmazza. 7.3. A lipidcsökkentő terápia választott gyógyszerei a 3-hidroxi-3-metil-glutaril-CoA-reduktáz gátlók (sztatinok).
♦ Trombocita terápia. Az aszpirin terápia (75-100 mg/nap) javallott 40 év feletti cukorbetegek számára, akiknél fokozott a cardiovascularis patológia kialakulásának kockázata (szövődményes családi anamnézis, artériás magas vérnyomás, dohányzás, diszlipidémia, mikroalbuminuria), valamint minden az atherosclerosis klinikai megnyilvánulásai, mint másodlagos megelőzés.
♦ Koszorúér-betegség szűrése és kezelése. A szívkoszorúér-betegség kizárására szolgáló stressztesztek olyan betegek számára javasoltak, akiknél szív- és érrendszeri betegségek tünetei vannak, valamint ha az EKG patológiát észlel.
Előrejelzés
A T2DM-ben szenvedő betegek 75%-a, a T1DM-es betegek 35%-a szív- és érrendszeri betegségekben hal meg. A T2DM-ben szenvedő betegek körülbelül 50%-a hal meg a koszorúér-betegség szövődményei miatt, 15%-a pedig az agyi thromboembolia következtében. A szívinfarktus okozta halálozás a cukorbetegeknél meghaladja az 50%-ot.
7.8.2. Diabéteszes retinopátia
Diabéteszes retinopátia(DR) - a retina ereinek mikroangiopátiája, amelyet mikroaneurizmák, vérzések, exudatív változások és az újonnan képződött erek proliferációja jellemez, ami részleges vagy teljes látásvesztéshez vezet (7.17. táblázat).
Etiológia
A DR kialakulásának fő etiológiai tényezője a krónikus hiperglikémia. Más tényezők (artériás magas vérnyomás, diszlipidémia, dohányzás, terhesség stb.) kisebb jelentőséggel bírnak.
Patogenezis
A DR patogenezisének fő kapcsolatai a következők:
A retina ereinek mikroangiopátiája, amely az erek lumenének szűküléséhez vezet hipoperfúzió kialakulásával;
Vaszkuláris degeneráció mikroaneurizmák kialakulásával;
Progresszív hipoxia, serkenti a vaszkuláris proliferációt, és zsíros degenerációhoz és kalcium-sók lerakódásához vezet a retinában;
asztal 7.17. Diabéteszes retinopátia
 váladékozással járó mikroinfarktusok, amelyek puha „vattafoltok” kialakulásához vezetnek;
váladékozással járó mikroinfarktusok, amelyek puha „vattafoltok” kialakulásához vezetnek;
A lipidek lerakódása sűrű váladékok képződésével;
A proliferáló erek elszaporodása a retinában söntök és aneurizmák képződésével, ami a vénák tágulásához és a retina hipoperfúzió súlyosbodásához vezet;
A lopás jelensége az ischaemia további progressziójával, amely infiltrátumok és hegek kialakulását okozza;
Retina leválás az ischaemiás dezintegráció és a vitreoretinalis trakciók kialakulása következtében;
Hemorrhagiás infarktusból, masszív vaszkuláris invázióból és aneurizmák szakadásából eredő üvegtesti vérzések;
Az írisz ereinek proliferációja (diabetikus rubeózis), ami másodlagos glaukóma kialakulásához vezet;
Maculopathia retina ödémával.
Járványtan
A DR a vakság leggyakoribb oka a fejlett országok munkaképes lakosságában, és a vakság kialakulásának kockázata a DM-ben szenvedő betegeknél 10-20-szor nagyobb, mint az általános populációban. A T1DM diagnosztizálásakor a DR szinte egyetlen betegnél sem mutatható ki, 5 év után a betegek 8%-ánál, harminc éves diabéteszes tapasztalattal pedig a betegek 98%-ánál mutatják ki a betegséget. A T2DM diagnosztizálása idején a DR a betegek 20-40% -ában, a tizenöt éves T2DM tapasztalattal rendelkező betegek 85% -ában észlelhető. A DM-1-ben a proliferatív retinopátia viszonylag gyakoribb, a DM-2-ben pedig a maculopathia (a maculopathiás esetek 75%-a).
Klinikai megnyilvánulások
Az általánosan elfogadott besorolás szerint a DR-nek 3 szakasza van
(7.18. táblázat).
Diagnosztika
A T1DM-ben szenvedő betegeknél a betegség kezdete után 3-5 évvel, a T2DM-ben szenvedő betegeknél pedig közvetlenül a diagnózist követően a teljes szemészeti vizsgálat, beleértve a direkt szemészeti vizsgálatot retina fényképezéssel. A jövőben az ilyen vizsgálatokat évente meg kell ismételni.
asztal 7.18. A diabéteszes retinopátia osztályozása
 Megkülönböztető diagnózis
Megkülönböztető diagnózis
Egyéb szembetegségek cukorbetegeknél.
Kezelés
A diabéteszes retinopátia, valamint más késői szövődmények kezelésének alapelve a cukorbetegség optimális kompenzációja. A diabéteszes retinopátia kezelésének és a vakság megelőzésének leghatékonyabb módja a lézeres fotokoaguláció. Célja
 Rizs. 7.11. Diabéteszes retinopátia:
Rizs. 7.11. Diabéteszes retinopátia:
a) nonproliferatív; b) preproliferatív; c) proliferatív
A lézeres fotokoaguláció az újonnan képződött erek működésének leállítása, amelyek olyan súlyos szövődmények kialakulásának fő veszélyét jelentik, mint a hemophthalmus, a húzós retinaleválás, az írisz rubeosis és a másodlagos glaukóma.
Előrejelzés
Vakságot a cukorbetegek 2%-ánál észlelnek (az 1-es típusú cukorbetegek 3-4%-ánál és a 2-es típusú cukorbetegek 1,5-2%-ánál). A DR-hez kapcsolódó új vaksági esetek becsült előfordulási gyakorisága 3,3 eset/100 000 lakos évente. Az 1-es típusú cukorbetegségben a HbA1c 7,0%-ra csökkentése a DR kialakulásának kockázatát 75%-kal, a DR progressziójának kockázatát pedig 60%-kal csökkenti. A 2-es típusú cukorbetegségben a HbA1c 1%-os csökkenése 20%-kal csökkenti a DR kialakulásának kockázatát.
7.8.3. Diabéteszes nefropátia
Diabéteszes nefropátia(DNF) albuminuria (több mint 300 mg albumin naponta vagy proteinuria több mint 0,5 g fehérje naponta) és/vagy csökkent vesefiltrációs funkció cukorbetegeknél húgyúti fertőzések, szívelégtelenség vagy egyéb betegségek hiányában. vesebetegségek. A mikroalbuminuria definíciója szerint 30-300 mg/nap vagy 20-200 mcg/perc albuminkiválasztás.
Etiológia és patogenezis
A DNF fő kockázati tényezői a cukorbetegség időtartama, a krónikus hiperglikémia, az artériás magas vérnyomás, a diszlipidémia és a szülők vesebetegsége. A DNF-ben az első dolog, ami érintett glomeruláris apparátus vese
1. Az egyik lehetséges mechanizmus, amellyel magas vércukorszint elősegíti a glomeruláris károsodás kialakulását, a szorbit felhalmozódását a glükóz metabolizmus poliol útvonalának aktiválása miatt, valamint számos fejlett glikációs végterméket.
2. Hemodinamikai rendellenességek, nevezetesen intraglomeruláris hipertónia(a vese glomerulusaiban megemelkedett vérnyomás) a patogenezis lényeges összetevője
Az intraglomeruláris hipertónia oka az arteriolák tónusának megsértése: az afferens kitágulása és az efferens szűkülése.
asztal 7.19. Diabéteszes nefropátia
 Ez viszont számos humorális faktor, például angiotenzin-2 és endotelin hatására, valamint a glomeruláris alapmembrán elektrolit tulajdonságainak megsértése miatt következik be. Ezenkívül az intraglomeruláris hipertóniát elősegíti a szisztémás hipertónia, amelyet a DNF-ben szenvedő betegek többségében észlelnek. Az intraglomeruláris hipertónia következtében az alapmembránok és a filtrációs pórusok károsodnak,
Ez viszont számos humorális faktor, például angiotenzin-2 és endotelin hatására, valamint a glomeruláris alapmembrán elektrolit tulajdonságainak megsértése miatt következik be. Ezenkívül az intraglomeruláris hipertóniát elősegíti a szisztémás hipertónia, amelyet a DNF-ben szenvedő betegek többségében észlelnek. Az intraglomeruláris hipertónia következtében az alapmembránok és a filtrációs pórusok károsodnak,
amelyen át kezdenek behatolni a nyomok (mikroalbuminuria), majd jelentős mennyiségű albumint (proteinuria). A bazális membránok megvastagodása megváltoztatja elektrolit tulajdonságaikat, ami önmagában azt eredményezi, hogy a szűrési pórusok méretének változása nélkül is több albumin kerül az ultrafiltrátumba.
3. Genetikai hajlam. Az artériás hipertónia gyakrabban fordul elő DNF-ben szenvedő betegek rokonainál. Bizonyíték van a DNF és az ACE gén polimorfizmusa közötti kapcsolatra. Mikroszkóposan a DNF segítségével a glomeruláris bazális membránok megvastagodását, a mezangium tágulását, valamint az afferens és efferens arteriolák rostos elváltozásait mutatják ki. Az utolsó szakaszban, amely klinikailag krónikus veseelégtelenségnek (CRF) felel meg, fokális (Kimmelstiel-Wilson), majd diffúz glomerulosclerosis kerül meghatározásra.
Járványtan
A mikroalbuminuria a T1DM-ben szenvedő betegek 6-60%-ánál észlelhető 5-15 évvel a megjelenése után. A DNF-et a T1DM-ben szenvedők 35%-ánál mutatják ki, gyakrabban a férfiaknál és azoknál, akiknél a T1DM 15 éves koruk előtt alakult ki. A T2DM-ben a DNF a kaukázusiak 25%-ánál és az ázsiaiak 50%-ánál alakul ki. A DNF általános prevalenciája T2DM-ben 4-30%.
Klinikai megnyilvánulások
Egy viszonylag korai klinikai megnyilvánulás, amely közvetve kapcsolódik a DNF-hez, az artériás hipertónia. Más klinikailag nyilvánvaló megnyilvánulások későn jelentkeznek. Ezek közé tartoznak a nefrotikus szindróma és a krónikus veseelégtelenség megnyilvánulásai.
Diagnosztika
A cukorbetegeknél a DNF-szűrés éves vizsgálatot foglal magában mikroalbuminuria DM-1 esetében 5 évvel a betegség manifesztációja után, DM-2 esetében pedig közvetlenül annak észlelése után. Ezenkívül legalább éves kreatininszint szükséges a kiszámításhoz glomeruláris filtrációs ráta (GFR). A GFR különféle képletekkel számítható ki, például a Cockcroft-Gault képlet segítségével:
Férfiaknál: a = 1,23 (normál GFR 100 - 150 ml/perc) Nőknél: a = 1,05 (normál GFR 85 - 130 ml/perc)
A DNF kezdeti szakaszában a GFR növekedése észlelhető, amely a krónikus veseelégtelenség kialakulásával fokozatosan csökken. A mikroalbuminuria a DM-1 megjelenése után 5-15 évvel kezdődik; T2DM esetén az esetek 8-10%-ában azonnal észlelése után észlelhető, valószínűleg a betegség diagnózis előtti hosszú tünetmentes lefolyása miatt. A nyilvánvaló proteinuria vagy albuminuria csúcsfejlődése T1DM-ben 15-20 évvel a kialakulás után következik be. Proteinuria jelzi visszafordíthatatlanság DNF, amely előbb-utóbb krónikus veseelégtelenséghez vezet. Az urémia átlagosan 7-10 évvel a nyilvánvaló proteinuria megjelenése után alakul ki. Meg kell jegyezni, hogy a GFR nem korrelál a proteinuriával.
Megkülönböztető diagnózis
A proteinuria és a veseelégtelenség egyéb okai cukorbetegeknél. A legtöbb esetben a DNF-et artériás hipertóniával, diabéteszes retinopátiával vagy neuropátiával kombinálják, ezek hiányában a differenciáldiagnózisnak különösen óvatosnak kell lennie. DM-1 esetén az esetek 10%-ában, DM-2 esetén pedig 30%-ban a proteinuria nem társul DNF-hez.
Kezelés
♦ Az elsődleges és másodlagos alapfeltételek megelőzés
DNF a cukorbetegség kompenzációja és a normál szisztémás vérnyomás fenntartása. Ezenkívül a DNF elsődleges megelőzése magában foglalja a fehérjetartalmú élelmiszerek fogyasztásának csökkentését - a napi kalória kevesebb mint 35% -át.
♦ Szakaszokban mikroalbuminuriaÉs proteinuria betegeknek ACE-gátlókat vagy angiotenzin-receptor-blokkolókat írnak fel. Egyidejű artériás magas vérnyomás esetén vérnyomáscsökkentő adagokban írják fel őket, szükség esetén más vérnyomáscsökkentő gyógyszerekkel kombinálva. Normál vérnyomás esetén ezeket a gyógyszereket olyan dózisokban írják fel, amelyek nem vezetnek hipotenzió kialakulásához. Mind az ACE-gátlók (DM-1 és DM-2), mind az angiotenzin receptor blokkolók (DM-2 esetén) segítenek megakadályozni a mikroalbuminuria proteinuriába való átmenetét. Egyes esetekben, ennek a terápiának a hátterében, a cukorbetegség más paraméterekkel történő kompenzálásával kombinálva, a mikroalbuminuria megszűnik. Ezenkívül a mikroalbuminuria szakaszától kezdve szükséges
a fehérjebevitel csökkentése a napi kalória 10%-a alá (vagy kevesebb, mint 0,8 gramm/testtömegkilogramm), a só pedig napi 3 gramm alá.
♦ A színpadon krónikus veseelégtelenség,általában a glükózcsökkentő terápia módosítása szükséges. A legtöbb T2DM-ben szenvedő beteget inzulinkezelésre kell váltani, mivel a TSP felhalmozódása súlyos hipoglikémia kialakulásának kockázatával jár. A legtöbb T1DM-ben szenvedő beteg inzulinszükséglete csökken, mivel a vese az inzulin metabolizmusának egyik fő helye. Ha a szérum kreatinin szint 500 μmol/L-re vagy többre emelkedik, fel kell vetni a páciens extrakorporális (hemodialízis, peritoneális dialízis) vagy sebészeti (vesetranszplantáció) kezelési módszerre való felkészítését. A vesetranszplantáció akkor javasolt, ha a kreatininszint eléri a 600-700 µmol/l-t és a glomeruláris filtrációs ráta 25 ml/perc alá csökken, hemodialízis - 1000-1200 µmol/l, illetve 10 ml/perc alá.
Előrejelzés
Az 1-es típusú cukorbetegek 50%-ánál és a proteinuriás 2-es típusú cukorbetegek 10%-ánál krónikus veseelégtelenség alakul ki a következő 10 évben. Az 50 év alatti, 1-es típusú cukorbetegségben szenvedő betegek összes halálozásának 15%-a a DNF okozta krónikus veseelégtelenséghez kapcsolódik.
7.8.4. Diabéteszes neuropátia
Diabéteszes neuropátia A (DNE) az idegrendszer károsodásának szindrómáinak kombinációja, amely a különböző részeinek a folyamatban való túlnyomó részvétele (szenzomotoros, vegetatív), valamint a károsodás gyakorisága és súlyossága szerint osztályozható (7.20. táblázat). ).
ÉN. Szenzomotoros neuropátia:
Szimmetrikus;
Fokális (mononeuropathia) vagy polifokális (cranialis, proximális motoros, végtagok és törzs mononeuropathiája).
II. Autonóm (autonóm) neuropátia:
Cardiovascularis (ortosztatikus hipotenzió, szív denervációs szindróma);
Gasztrointesztinális (gyomor atónia, epeúti diszkinézia, diabéteszes enteropathia);
Urogenitális (a húgyhólyag és a szexuális funkciók diszfunkciójával);
A beteg hipoglikémia felismerési képessége károsodott;
Károsodott pupillafunkció;
A verejtékmirigyek diszfunkciója (distalis anhidrosis, hyperhidrosis étkezés közben).
asztal 7.20. Diabéteszes neuropátia
 Etiológia és patogenezis
Etiológia és patogenezis
A DNE fő oka a hiperglikémia. Patogenezisének számos mechanizmusa javasolt:
A glükóz metabolizmus poliol-útvonalának aktiválása, ami a szorbit, a fruktóz felhalmozódását és a mioinozitol és a glutation tartalmának csökkenését eredményezi az idegsejtekben. Ez viszont a szabad gyökös folyamatok aktiválásához és a nitrogén-monoxid szintjének csökkenéséhez vezet;
Idegsejtek membrán- és citoplazmatikus fehérjéinek nem enzimatikus glikozilációja;
Mikroangiopátia vasa ideg ami a kapilláris véráramlás lelassulásához és az idegi hipoxiához vezet.
Járványtan
A DNE prevalenciája mindkét típusú cukorbetegségben körülbelül 30%. A T1DM esetében a betegség kezdetétől számított 5 év elteltével a betegek 10% -ánál kezdik kimutatni. Az új DNE esetek előfordulása T2DM-ben a betegek körülbelül 6%-a évente. A leggyakoribb változat a disztális szimmetrikus szenzomotoros DNE.
Klinikai megnyilvánulások
Szenzormotoros NAP motoros és szenzoros zavarok komplexeként nyilvánul meg. A DNE disztális formájának gyakori tünete az paresztézia, amelyek a „kúszó libabőr” érzésében, zsibbadásban nyilvánulnak meg. A betegek gyakran panaszkodnak hideg lábakra, bár érintésre melegek maradnak, ami megkülönbözteti a polyneuropathiát az ischaemiás elváltozásoktól, amikor a láb hideg tapintású. A szenzoros neuropátia korai megnyilvánulása a rezgésérzékenység megsértése. Jellemző a „nyugtalan láb” szindróma, amely éjszakai paresztézia és fokozott érzékenység kombinációja. Lábfájdalom leggyakrabban éjszaka zavarják, és néha a beteg nem tudja elviselni a takaró érintését. Jellemző esetben a fájdalom, ellentétben az okkluzív artériás megbetegedések esetén, járás közben csökkenhet. Az évek során a fájdalom spontán megszűnhet a fájdalomérzékenységért felelős kis idegrostok elhalása miatt. Hipoesztézia az érzékenység elvesztésével nyilvánul meg „harisnya” és „kesztyűs” módon. A mély, proprioceptív érzékenység megsértése koordinációs zavarokhoz és mozgási nehézségekhez (szenzoros ataxia) vezet. A beteg „idegen lábakra” panaszkodik, „vattán állva” érzésére. A trofikus beidegzés megsértése a bőr, a csontok és az inak degeneratív elváltozásaihoz vezet. A fájdalomérzékenység csökkenése a láb gyakori, a beteg által észrevétlen mikrotraumáihoz vezet, amelyek könnyen megfertőződnek. A koordináció és a járás megzavarása a láb ízületeinek terhelésének nem fiziológiás újraeloszlásához vezet. Ennek eredményeként a láb izom-csontrendszerében az anatómiai kapcsolatok megszakadnak.
A lábboltozat deformálódik, duzzanat, törések, krónikus gennyes folyamatok alakulnak ki (lásd 7.8.5 pont).
Az autonóm nappali fénynek számos formája létezik. Ok kardiovaszkuláris forma- a kardiopulmonális komplexum és a nagy erek beidegzésének megzavarása. A vagus ideg a leghosszabb ideg, ezért korábban érintett, mint mások. A szimpatikus hatások túlsúlya következtében nyugalmi tachycardia. Megjelenik az ortosztázisra adott nem megfelelő válasz ortosztatikus hipotenzióés ájulás. A pulmonalis-kardiális komplex autonóm denervációja a szívfrekvencia-variabilitás hiányához vezet. Az autonóm neuropátia a csendes szívinfarktus megnövekedett gyakoriságával jár a cukorbetegek körében.
Tünetek gyomor-bélrendszeri forma A DNE a gyomor lassú, vagy fordítva gyors kiürülésével járó gastroparesis, amely nehézségeket okozhat az inzulinterápia kiválasztásában, mivel a szénhidrát felszívódásának ideje és térfogata korlátlanul változik; nyelőcső atónia, reflux oesophagitis, dysphagia; vizes hasmenés. Mert urogenitális forma A DNE-t az ureterek és a hólyag atóniája jellemzi, ami húgyúti fertőzésekre való hajlamhoz vezet; merevedési zavar (a cukorbetegek körülbelül 50%-a); retrográd ejakuláció.
A vegetatív DNE egyéb lehetséges megnyilvánulásai a hipoglikémia felismerési képességének károsodása, a pupilla működésének károsodása, a verejtékmirigyek károsodott működése (anhidrosis) és a diabéteszes amyotrophia.
Diagnosztika
A cukorbetegek neurológiai vizsgálatát évente kell elvégezni. Ez legalább olyan tesztek elvégzését foglalja magában, amelyek célja a disztális szenzomotoros neuropátia azonosítása. Ez a rezgésérzékenység fokozatos hangvillával, a tapintási érzékenység monofil segítségével, valamint a hőmérséklet- és fájdalomérzékenység értékelésével történik. A jelzések szerint tanulmányozzák az autonóm idegrendszer állapotát: a szív paraszimpatikus beidegzésének elégtelenségének diagnosztizálására számos funkcionális tesztet alkalmaznak, mint például a szívfrekvencia mérése mély légzés során a variabilitás felmérésével.
pulzusszám és Valsalva manőver; A szív szimpatikus beidegzésének elégtelenségének diagnosztizálására ortosztatikus tesztet alkalmaznak.
Megkülönböztető diagnózis
Más eredetű neuropátiák (alkoholos, urémiás, B 12-hiányos vérszegénységgel stb.). Egy adott szerv autonóm neuropátia következtében fellépő diszfunkciójának diagnózisát csak a szervi patológia kizárása után állapítják meg.
Kezelés
1. A glükózcsökkentő terápia optimalizálása.
2. Lábápolás (lásd a 7.8.5. pontot).
3. A neurotróp gyógyszerek (α-liponsav) hatékonyságát nem minden tanulmány erősíti meg.
4. Tüneti terápia (fájdalomcsillapítás, szildenafil merevedési zavar esetén, fludrokortizon ortosztatikus hipotenzió esetén stb.).
Előrejelzés
A kezdeti szakaszban a DNE reverzibilis lehet a cukorbetegség tartós kompenzációjának hátterében. A DNE a fekélyes elváltozásban szenvedő betegek 80%-ában kimutatható, és ez a lábamputáció fő kockázati tényezője
7.8.5. Diabéteszes láb szindróma
Diabéteszes láb szindróma(SDS) a láb kóros állapota cukorbetegségben, amely a perifériás idegek, a bőr és a lágyrészek, a csontok és az ízületek károsodásának hátterében alakul ki, és akut és krónikus fekélyekkel, osteoartikuláris elváltozásokkal és gennyes-nekrotikus folyamatokkal nyilvánul meg (7.21. táblázat). .
Etiológia és patogenezis
A DFS patogenezise többkomponensű, és a neuropátiás és perfúziós rendellenességek kombinációja jelenti, amelyek kifejezett fertőzési hajlammal rendelkeznek. A felsorolt tényezők egyik vagy másik patogenezisben való túlsúlya alapján 3 fő formát különböztetünk meg
asztal 7.21. Diabéteszes láb szindróma
 I. Neuropathiás forma(60-70 %):
I. Neuropathiás forma(60-70 %):
Osteoarthropathia nélkül;
Diabéteszes osteoarthropathiával.
II. Neuroischaemiás (vegyes) forma(15-20 %).
III. Ischaemiás forma(3-7 %).
Az SDS neuropátiás formája. Diabéteszes neuropátiában elsősorban a leghosszabb idegek disztális részei érintettek. A trofikus impulzusok hosszú távú hiánya a bőr, a csontok, a szalagok, az inak és az izmok hypotrophiájához vezet. A kötőszerkezetek hypotrophiájának eredménye a láb deformációja a támasztó terhelés nem fiziológiás újraeloszlásával és bizonyos területeken túlzott növekedésével. Ezeken a helyeken, például a lábközépcsontok fejének vetületének területén, a bőr megvastagodását és a hiperkeratózisok képződését figyelik meg. Az ezekre a területekre nehezedő állandó nyomás a mögöttes lágyszövet gyulladásos autolíziséhez vezet, ami megteremti a fekélyes defektus kialakulásának előfeltételeit. A sorvadás és a csökkent izzadás következtében a bőr kiszárad és könnyen repedezett. A fájdalomérzékenység csökkenése miatt a páciens gyakran nem figyel a bekövetkező változásokra. Nem tudja azonnal észlelni a cipők kellemetlenségeit, amelyek horzsolásokhoz és bőrkeményedésekhez vezetnek, és nem veszi észre idegen testek vagy apró sebek bejutását a repedés helyére. A helyzetet súlyosbítja a mély érzékenység megsértése, amely járási zavarokban és a lábak helytelen elhelyezésében nyilvánul meg. Leggyakrabban a fekélyes hiba staphylococcusokkal, streptococcusokkal és bélbaktériumokkal fertőzött; az anaerob flóra gyakran csatlakozik. A neuropátiás osteoarthropathia a láb osteoartikuláris apparátusának kifejezett disztrófiás változásainak eredménye (osteoporosis, osteolysis, hyperostosis).
Az SDS ischaemiás formája az alsó végtagok artériáinak érelmeszesedésének következménye, ami a fő véráramlás megzavarásához vezet, pl. a diabéteszes macroangiopathia egyik változata.
Járványtan
A DDS-t a cukorbetegek 10-25%-ánál, egyes adatok szerint ilyen vagy olyan formában a cukorbetegek 30-80%-ánál figyelik meg. Az Egyesült Államokban a diabetes mellitusban szenvedő betegek DDS-sel történő kezelésének éves költsége 1 milliárd dollár.
Klinikai megnyilvánulások
Nál nél neuropátiás forma Az SDS a léziók két leggyakoribb típusát különbözteti meg: a neuropátiás fekélyt és az osteoarthropathiát (a fejlődéssel együtt
 Rizs. 7.12. Neuropatikus fekély diabéteszes láb szindrómában
Rizs. 7.12. Neuropatikus fekély diabéteszes láb szindrómában
 Rizs. 7.13. Charcot ízület diabéteszes láb szindrómában
Rizs. 7.13. Charcot ízület diabéteszes láb szindrómában
Charcot ízület). neuropátiás fekélyek,Általában a talp és az interdigitális terek területén helyezkednek el, pl. a láb legnagyobb nyomású területein (7.12. ábra).
A láb szalagrendszerében végbemenő destruktív elváltozások hónapokig előrehaladhatnak, és súlyos csontdeformációhoz vezethetnek - diabéteszes osteoarthropathiaés a formáció Charcot ízület, ebben az esetben a lábat képletesen egy „csontzsákhoz” hasonlítják
Nál nél az SDS ischaemiás formája
a láb bőre hideg, sápadt vagy cianotikus; ritkábban rózsaszínes-vörös árnyalatú a felületes kapillárisok ischaemia hatására bekövetkező kitágulása miatt. A fekélyes hibák akrális nekrózis formájában jelentkeznek - az ujjak hegyén, a sarkak marginális felületén (7.14. ábra).
A láb, poplitealis és femoralis artériákban a pulzus gyengült vagy nem tapintható.
Tipikus esetekben a betegek „szakaszos claudiációról” panaszkodnak. Az ischaemiás végtagkárosodás súlyosságát három fő tényező határozza meg: a szűkület súlyossága, a kollaterális véráramlás kialakulása és a véralvadási rendszer állapota.
Diagnosztika
A cukorbetegek lábainak vizsgálatát minden orvosi látogatás alkalmával, legalább félévente egyszer el kell végezni. Az SDS diagnózisa a következőket tartalmazza:
 Rizs. 7.14. Akral nekrózis a diabéteszes láb szindróma ischaemiás formájában
Rizs. 7.14. Akral nekrózis a diabéteszes láb szindróma ischaemiás formájában
A lábak vizsgálata;
A neurológiai állapot értékelése - különböző típusú érzékenység, ínreflexek, elektromiográfia;
Az artériás véráramlás állapotának felmérése - angiográfia, Doppler ultrahang, Doppler ultrahang;
A láb és a boka ízületeinek röntgenfelvétele;
A sebváladék bakteriológiai vizsgálata.
Megkülönböztető diagnózis
Különböző eredetű lábakon lévő sebfolyamatokkal, valamint az alsó végtagok edényeinek egyéb elzáródásával és a láb ízületeinek patológiájával végzik. Ezenkívül meg kell különböztetni a DFS klinikai formáit (7.22. táblázat).
Kezelés
Kezelés neuropátiásan fertőzött A VTS űrlap a következő tevékenységeket tartalmazza:
A cukorbetegség kompenzációjának optimalizálása általában magában foglalja az inzulin adagjának növelését, diabetes-2 esetén pedig az arra való átállást;
Szisztémás antibiotikum terápia;
A láb teljes tehermentesítése (ez évek óta fennálló fekélyek néhány héten belüli gyógyulásához vezethet);
A seb helyi kezelése a hyperkeratosis területek eltávolításával;
Lábápolás, speciális cipők megfelelő kiválasztása és viselése. Az időben történő konzervatív terápia lehetővé teszi
az esetek 95%-ában kerülje a műtétet.
asztal 7.22. A DFS klinikai formáinak differenciáldiagnózisa
 Kezelés ischaemiás A VTS űrlapok a következőket tartalmazzák:
Kezelés ischaemiás A VTS űrlapok a következőket tartalmazzák:
A cukorbetegség kompenzációjának optimalizálása általában magában foglalja az inzulin adagjának növelését, diabetes-2 esetén pedig az arra való átállást;
Fekélyes-nekrotikus elváltozások hiányában ergoterápia (napi 1-2 óra séta, a kollaterális véráramlás kialakulásának elősegítése);
Revaszkularizációs műveletek az érintett ereken;
Konzervatív terápia: véralvadásgátló szerek, aszpirin (100 mg/napig), szükség esetén fibrinolitikumok, prosztaglandin E1 és prosztaciklin készítmények.
A kiterjedt gennyes-nekrotikus elváltozások kialakulása minden típusú DFS-ben felveti az amputáció kérdését.
Előrejelzés
Az elvégzett lábamputációk 50-70%-a cukorbetegek körében történik. A cukorbetegeknél a láb amputációja 20-40-szer gyakrabban fordul elő, mint a cukorbetegeknél.
7.9. CUKRÉBÉSZ ÉS TERHESSÉG
Terhességi diabetes mellitus(GDM) a glükóztolerancia rendellenessége, amelyet először a terhesség alatt azonosítottak (7.23. táblázat). Ez a meghatározás nem zárja ki annak lehetőségét, hogy a szénhidrát-anyagcsere patológiája megelőzheti a terhességet. A GDM-et meg kell különböztetni azoktól a helyzetektől, amikor egy korábban diagnosztizált cukorbetegségben szenvedő nő (életkora miatt gyakrabban T1DM) teherbe esik.
Etiológia és patogenezis
A GDM-ben hasonlóak a T2DM-hez. A petefészek- és méhlepény-szteroidok magas szintje, valamint a mellékvesekéreg kortizol-termelésének fokozódása fiziológiás inzulinrezisztencia kialakulásához vezet a terhesség alatt. A GDM kialakulása azzal függ össze, hogy a terhesség alatt természetesen kialakuló inzulinrezisztencia, és ennek következtében az arra hajlamos egyének fokozott inzulinigénye meghaladja a hasnyálmirigy β-sejtjeinek funkcionális kapacitását. Szülés után a hormonális és anyagcsere-viszonyok eredeti szintre való visszatérésével általában elmúlik.
asztal 7.23. Terhességi diabetes mellitus
 A GDM általában a 2. trimeszter közepén, a terhesség 4 és 8 hónapja között alakul ki. A betegek túlnyomó többsége túlsúlyos, és kórtörténetében diabetes mellitus-2 szerepel. A GDM kialakulásának kockázati tényezőit, valamint a GDM kialakulásának alacsony kockázatával rendelkező nők csoportjait a táblázat tartalmazza. 7.24.
A GDM általában a 2. trimeszter közepén, a terhesség 4 és 8 hónapja között alakul ki. A betegek túlnyomó többsége túlsúlyos, és kórtörténetében diabetes mellitus-2 szerepel. A GDM kialakulásának kockázati tényezőit, valamint a GDM kialakulásának alacsony kockázatával rendelkező nők csoportjait a táblázat tartalmazza. 7.24.
asztal 7.24. A terhességi diabetes mellitus kialakulásának kockázati tényezői
 Az anyai hiperglikémia hiperglikémiához vezet a gyermek keringési rendszerében. A glükóz könnyen áthatol a placentán, és az anya véréből folyamatosan átjut a magzatba. Megtörténik az aminosavak aktív transzportja és a ketontestek átadása is a magzatba. Ezzel szemben az inzulin, a glukagon és az anyai szabad zsírsavak nem jutnak be a magzat vérébe. A terhesség első 9-12 hetében a magzati hasnyálmirigy még nem termel saját inzulint. Ez az idő a magzati organogenezis azon fázisának felel meg, amikor állandó hiperglikémiával az anyában különböző fejlődési rendellenességek (szív, gerinc, gerincvelő, gyomor-bél traktus) alakulhatnak ki. A terhesség 12. hetétől a magzati hasnyálmirigy elkezdi szintetizálni az inzulint, és hiperglikémiára válaszul a magzati hasnyálmirigy β-sejtjeinek reaktív hipertrófiája és hiperpláziája alakul ki. A hiperinzulinémia miatt magzati makroszómia alakul ki, valamint a lecitin szintézis gátlása, ami magyarázza az újszülötteknél a légzési distressz szindróma gyakori előfordulását. A β-sejtes hiperplázia és a hyperinsulinaemia következtében súlyos és hosszan tartó hipoglikémia alakul ki.
Az anyai hiperglikémia hiperglikémiához vezet a gyermek keringési rendszerében. A glükóz könnyen áthatol a placentán, és az anya véréből folyamatosan átjut a magzatba. Megtörténik az aminosavak aktív transzportja és a ketontestek átadása is a magzatba. Ezzel szemben az inzulin, a glukagon és az anyai szabad zsírsavak nem jutnak be a magzat vérébe. A terhesség első 9-12 hetében a magzati hasnyálmirigy még nem termel saját inzulint. Ez az idő a magzati organogenezis azon fázisának felel meg, amikor állandó hiperglikémiával az anyában különböző fejlődési rendellenességek (szív, gerinc, gerincvelő, gyomor-bél traktus) alakulhatnak ki. A terhesség 12. hetétől a magzati hasnyálmirigy elkezdi szintetizálni az inzulint, és hiperglikémiára válaszul a magzati hasnyálmirigy β-sejtjeinek reaktív hipertrófiája és hiperpláziája alakul ki. A hiperinzulinémia miatt magzati makroszómia alakul ki, valamint a lecitin szintézis gátlása, ami magyarázza az újszülötteknél a légzési distressz szindróma gyakori előfordulását. A β-sejtes hiperplázia és a hyperinsulinaemia következtében súlyos és hosszan tartó hipoglikémia alakul ki.
Járványtan
A cukorbetegség a reproduktív korú nők 0,3%-át érinti, a várandós nők 0,2-0,3%-a már kezdetben cukorbeteg, és a terhességek 1-14%-ában GDM alakul ki vagy nyilvánul meg valódi cukorbetegségben. A GDM prevalenciája a különböző populációkban eltérő, az Egyesült Államokban például a terhes nők körülbelül 4%-ánál (évente 135 ezer eset) mutatják ki.
Klinikai megnyilvánulások
Hiányzik a GDM-ben. A dekompenzált cukorbetegség nem specifikus tünetei lehetnek.
Diagnosztika
Az éhgyomri vércukorszint meghatározása minden terhes nő számára javasolt, biokémiai vérvizsgálat részeként. A veszélyeztetett nőknek (7.24. táblázat) ajánlott orális glükóz tolerancia teszt(OGTT). Számos lehetőséget ismertettek a terhes nőknél történő végrehajtására. Ezek közül a legegyszerűbb a következő szabályokat foglalja magában:
3 nappal a vizsgálat előtt a nő normális étrendet folytat, és fenntartja szokásos fizikai aktivitását;
A vizsgálatot reggel, éhgyomorra, legalább 8 órás éjszakai koplalás után kell elvégezni;
Miután éhgyomorra vett vérmintát, a nő 5 percen belül megiszik egy oldatot, amely 75 gramm száraz glükózból áll, 250-300 ml vízben feloldva; A vércukorszintet 2 óra elteltével újra meghatározzák.
A GDM diagnózisát a következők állapítják meg kritériumok:
Éhgyomri teljes vércukor (vénás, kapilláris) > 6,1 mmol/l vagy
Vénás vérplazma glükóz ≥ 7 mmol/l vagy
Teljes kapilláris vércukorszint vagy vénás vérplazma 2 órával 75 g glükóz ≥ 7,8 mmol/l terhelés után.
Ha egy veszélyeztetett nő teszteredményei normálisak, a tesztet a terhesség 24-28. hetében meg kell ismételni.
Megkülönböztető diagnózis
GDM és valódi cukorbetegség; glükózuria terhes nőknél.
Kezelés
Az anya és a magzat kockázata, valamint a cukorbetegség kezelésének megközelítése és a kontroll jellemzői GDM és valódi cukorbetegség esetén azonosak. A cukorbetegség terhesség alatti késői szövődményei jelentősen előrehaladhatnak, de a cukorbetegség jó minőségű kompenzációjával nincs jelzés a terhesség megszakítására. A cukorbetegségben (általában 1-es típusú cukorbetegségben) szenvedő nőnek fiatal korban kell megterveznie a terhességet, amikor a szövődmények kockázata a legalacsonyabb. Ha terhességet terveznek, javasolt a
fogadás több hónappal az optimális kompenzáció elérése után. A terhesség-tervezés ellenjavallata a súlyos nephropathia progresszív veseelégtelenséggel, súlyos ischaemiás szívbetegség, súlyos, nem korrigálható proliferatív retinopátia, ketoacidózis a terhesség korai szakaszában (a ketontestek teratogén tényezők).
A kezelés célja A GDM és a valódi cukorbetegség terhesség alatt a következő laboratóriumi paraméterek elérése:
Böjt glikémia< 5-5,8 ммоль/л;
Glikémia étkezés után 1 órával< 7,8 ммоль/л;
Glikémia evés után 2 órával< 6,7 ммоль/л;
Átlagos napi glikémiás profil< 5,5 ммоль/л;
A HbA1c szint havi monitorozással megegyezik az egészséges emberekével (4-6%).
Az 1-es típusú cukorbetegségben, valamint a terhességen kívül a nőnek intenzív inzulinkezelésben kell részesülnie, azonban ajánlott napi 7-8 alkalommal felmérni a glikémia szintjét a terhesség alatt. Ha a normoglikémiás kompenzáció nem érhető el hagyományos injekciókkal, fontolóra kell venni a beteg inzulinkezelésre való áthelyezését inzulinadagoló segítségével.
Az első szakaszban GDM kezelése Diétás terápiát írnak elő, amely a napi kalóriabevitel megközelítőleg 25 kcal/ttkg-ra való korlátozásából áll, elsősorban a könnyen emészthető állati eredetű szénhidrátok és zsírok miatt, valamint a fizikai aktivitás bővítése. Ha a diétás terápia nem éri el a kezelési célokat, a betegnek intenzív inzulinterápiát kell előírni. Bármilyen tablettázott glükóz-csökkentő gyógyszer (TDL) terhesség alatt ellenjavallt. Kiderült, hogy a nők körülbelül 15%-át kell inzulinterápiára váltani.
Előrejelzés
A terhesség alatt a GDM és a cukorbetegség nem kielégítő kompenzációjával a magzatban a különféle patológiák kialakulásának valószínűsége 30% (a kockázat 12-szer magasabb, mint az általános populációban). A terhesség alatt GDM-vel diagnosztizált nők több mint 50%-ánál T2DM alakul ki a következő 15 évben.
A „cukorbetegség” kifejezés a görög „szivárogok” szóból származik; az ókorban azt hitték, hogy a betegség során a szervezetbe jutó folyadék felszívódás nélkül áthalad a szervezeten. A Diabetes insipidus egy ritka krónikus patológia, amely teljes mértékben megfelel az ősi meghatározásnak. Ennek oka egy hormon hiánya, amely szabályozza a víz vesék általi kiválasztását. Ennek eredményeként a vizelet mennyisége többszörösére nő, gyakorlatilag megfosztva az embert a normális élettől.
A beteg folyamatosan szomjas, és kénytelen liter folyadékot inni, hogy megakadályozza a kiszáradást. A diabetes mellitustól eltérően a diabetes insipidus nem vezet a vércukorszint emelkedéséhez, nem kapcsolódik a hasnyálmirigy teljesítményéhez, és nem okoz tipikus diabéteszes szövődményeket. Ennek a két betegségnek csak egy közös tünete van - kifejezett polyuria.
Diabetes insipidus - mi ez?
Nem minden folyadék, amely a vesénkbe kerül, vizeletté válik. Szűrés után az elsődleges vizelet szinte teljes mennyisége visszaszívódik a vérbe a vesetubulusokon keresztül, ezt a folyamatot reabszorpciónak nevezik. A 150 literből, amelyet a vesék áthaladnak magukon, csak 1% ürül koncentrált másodlagos vizelet formájában. A reabszorpció az akvaporinoknak – a sejtmembránok pórusait alkotó fehérjeanyagoknak – köszönhetően lehetséges. Az aquaporin egyik típusa, amely a vesékben található, csak vazopresszin jelenlétében látja el funkcióit.
A vazopresszin egy hormon, amely a hipotalamuszban (az agy egy részében) szintetizálódik, és az agyalapi mirigyben (az agy alján található speciális mirigyben) raktározódik. Fő feladata a vízanyagcsere szabályozása. Ha nő a vérsűrűség, vagy nincs elég folyadék a szervezetben, a vazopresszin felszabadulása megnő.
Ha valamilyen oknál fogva a hormon szintézise lecsökken, vagy a vesesejtek már nem érzékelik a vazopressint, cukorbetegség insipidus alakul ki. Első tünete a polyuria, a túlzott vizelet. A vesék naponta akár 20 liter folyadékot is képesek kiválasztani. A beteg folyamatosan vizet iszik és vizel. Ez az életritmus kimeríti az embert, és jelentősen rontja életminőségét. A betegség másik neve diabetes insipidus. A diabetes insipidusban szenvedők 3. rokkantsági csoportot, ingyenes kezelési lehetőséget és felírt gyógyszereket kapnak.
A betegség ritka, 1 millió emberből 2-3 embert érint. Leggyakrabban a betegség felnőttkorban kezdődik, 25 és 40 év között - 1 millió lakosonként 6 ember. A diabetes insipidus sokkal ritkábban alakul ki gyermekeknél.
Melyek az ND különböző formái és típusai?
A polyuria okától függően a diabetes insipidus a következő formákra oszlik:
- Központi diabetes insipidus- akkor kezdődik, amikor az agy megsérül, és a vazopresszin felszabadulása a véráramba leáll. Ez a forma idegsebészeti beavatkozások, sérülések, daganatok, agyhártyagyulladás és egyéb agyi gyulladások után alakulhat ki. Gyermekeknél a központi forma gyakran akut vagy krónikus fertőzés vagy genetikai rendellenesség eredménye. A betegeknél a súlyos tünetek akkor jelentkeznek, amikor a hipotalamusz magjainak mintegy 80%-a megszűnik, ezt megelőzően a hormonszintézist a sértetlen területek veszik át.
- Nefrogén diabetes insipidus- akkor alakul ki, amikor a vesetubulusok receptorai nem reagálnak a vazopresszinre. A cukorbetegség ezen formájával általában kevesebb vizelet termelődik, mint központi cukorbetegség esetén. A vesék ilyen rendellenességeit a vizelet stagnálása, a cisztás formációk és daganatok, valamint a hosszú távú gyulladásos folyamat okozhatja. A renális diabetes insipidusnak van egy veleszületett formája is, amelyet a magzat vesefejlődési rendellenességei okoznak.
- Idiopátiás diabetes insipidus- A diagnózist gyakran akkor állítják fel, ha nincs elegendő vazopresszin, de hiányának oka jelenleg nem azonosítható. Ez általában egy kis daganat. Ahogy nő, a formációt modern vizuális módszerekkel helyezik el: MRI vagy CT. Az idiopátiás diabetes insipidus akkor is diagnosztizálható, ha a hormon szintje magas, de a vesékben bekövetkezett változások nem mutathatók ki. Általában génmutációval magyarázzák. A tünetek csak férfiaknál figyelhetők meg. A nők egy sérült gén hordozói, a betegség jeleit csak laboratóriumi módszerekkel lehet kimutatni, nincs kifejezett poliuria.
- Terhességi diabetes insipidus- csak terhes nőknél lehetséges, mivel oka a placenta által szintetizált vazopresszináz hormon, amely elpusztítja a vazopresszint. A betegségnek ez a formája a szülés után azonnal eltűnik – erről szóló cikkünk.
A vazopresszin vérben való jelenléte mellett a diabetes insipidust más kritériumok szerint is osztályozzák:
| Osztályozási kritériumok | A cukorbetegség típusai | Jellegzetes |
| Kezdési idő | veleszületett | Ritkán megfigyelhető, általában nefrogén. |
| szerzett | Élet közben más betegségek vagy sérülések miatt fordult elő. | |
| A cukorbetegség súlyossága a diagnóziskor | könnyen | Polyuria akár 8 liter naponta. |
| átlagos | 8-14 l | |
| nehéz | > 14 l | |
| A beteg állapota a kezelés megkezdése után | kártérítés | Nincs polyuria. |
| részkompenzáció | A vizelet mennyisége és a szomjúság naponta többször is megnő. | |
| dekompenzáció | A poliuria fennmaradása a terápia beadása után. |
Az ND kialakulásának okai
A cukorbetegség központi formája a következő helyzetekben alakulhat ki:
- a hipotalamusz és az agyalapi mirigy sérülései - ezen területek károsodása, duzzanat a közeli területen, más szövetek általi összenyomás;
- daganatok és metasztázisok az agyban;
- a hipotalamuszhoz és az agyalapi mirigyhez közeli agyi struktúrákban végzett műtéti vagy sugárterápiás beavatkozás eredményeként. Az ilyen műveletek megmentik a beteg életét, de ritka esetekben (a diabetes insipidus teljes előfordulásának 20% -a) befolyásolják a hormon termelését. Vannak öngyógyító cukorbetegség esetei, amely közvetlenül a műtét után kezdődik, és néhány napon belül elmúlik;
- agydaganatok kezelésére adott sugárterápia;
- keringési rendellenességek a fej ereiben trombózis, aneurizma vagy stroke következtében;
- neurofertőző betegségek - encephalitis, meningitis;
- akut fertőzések - szamárköhögés, influenza, bárányhimlő. Gyermekeknél a fertőző betegségek gyakrabban vezetnek diabetes insipidushoz, mint felnőtteknél. Ennek oka a gyermekkori agy anatómiájának sajátosságai: az új erek gyors növekedése, a meglévők átjárhatósága és a hiányosan kialakult vér-agy gát;
- tüdő granulomatózis, tuberkulózis;
- klonidin szedése;
- veleszületett rendellenességek - mikrokefália, az agy egyes részeinek fejletlensége;
- a hipotalamusz károsodása méhen belüli fertőzés következtében. A cukorbetegség tünetei ebben az esetben akár évekkel később jelentkezhetnek, stressz, sérülés vagy hormonális változások miatt.
- génhiba, amely lehetetlenné teszi a vazopresszin szintézist;
- A Wolfram-szindróma egy összetett örökletes rendellenesség, amely magában foglalja a cukorbetegséget és a diabetes insipidust, valamint a rossz látást és hallást.

A nefrogén cukorbetegség lehetséges okai:
- veseelégtelenség kialakulása krónikus vesebetegség, policisztás betegség, urolithiasis miatt;
- a fehérje-anyagcsere zavara amiloid lerakódásával a veseszövetekben;
- myeloma vagy veseszarkóma;
- a vazopresszin receptorok genetikai inferioritása a vesékben;
- bizonyos gyógyszerek toxikus hatásai a vesére:
A diabetes insipidus tünetei
A diabetes insipidus bármilyen formájának első jele az erősen megnövekedett vizelés (4 literről), amely éjszaka nem áll meg. A beteget megfosztják a normális alvástól, és fokozatosan ideges kimerültség alakul ki. Gyermekeknél éjszakai, majd nappali bevizelés kezdődik. A vizelet tiszta, szinte sók nélkül, adagjai nagyok, fél litertől. Kezelés nélkül ilyen mennyiségű vizelet miatt a vesemedence és a hólyag fokozatosan kitágul.
Válaszul a folyadék eltávolítására a szervezetből, súlyos szomjúság kezdődik, a betegek liter vizet isznak. Általában előnyben részesítik a nagyon hideg italokat, mivel a melegek rosszabbul oltják a szomjat. Az emésztés romlik, a gyomor megnyúlik és lesüllyed, és irritáció lép fel a belekben.
Eleinte az elfogyasztott víz elegendő a szervezet hiányának kielégítésére, majd fokozatosan megkezdődik a kiszáradás. Tünetei a fáradtság, fejfájás és szédülés, alacsony vérnyomás, szívritmuszavarok. Diabetes insipidusban szenvedő betegnél csökken a nyál mennyisége, a bőr kiszárad, a könnyfolyadék nem választódik ki.
Tünetek férfiaknál - nőknél a menstruáció hiánya, gyermekeknél a fizikai és intellektuális fejlődés késése.
Diagnosztika és vizsgálat
Minden polyuriában szenvedő beteget diabetes insipidusra kell szűrni. Diagnosztikai eljárás:
- Anamnézis felvétel - a beteg megkérdezése a betegség időtartamáról, a kiürült vizelet mennyiségéről, egyéb tünetekről, közeli hozzátartozói diabetes insipidus eseteiről, korábbi műtétekről vagy agysérülésekről. A szomjúság természetének meghatározása: ha éjszaka hiányzik, vagy amikor a páciens érdekes tevékenységgel van elfoglalva, a polyuria oka nem diabetes insipidus, hanem pszichogén polydipsia lehet.
- A vércukorszint meghatározása a diabetes mellitus kizárására - és hogyan kell ezt helyesen csinálni.
- Vizeletelemzés sűrűségének és ozmolaritásának kiszámításával. Az 1005-nél kisebb sűrűség és a 300-nál kisebb ozmolaritás a diabetes insipidus mellett szól.
- Vízmegvonási teszt - a pácienst 8 órán keresztül meg kell fosztani minden italtól és folyékony ételtől. Egész idő alatt az orvosok felügyelete alatt áll. Veszélyes kiszáradás esetén a tesztet korán le kell állítani. Diabetes insipidus akkor tekinthető megerősítettnek, ha a beteg testtömege ez idő alatt legalább 5%-kal csökkent, és a vizelet ozmolaritása és sűrűsége nem nőtt.
- A vérben lévő vazopresszin mennyiségének elemzése közvetlenül a vizsgálat után a betegség formájának meghatározására. Központi cukorbetegségben szintje alacsony marad, nefrogén formában erősen megemelkedik.
- MRI, ha a központi cukorbetegség gyanúja az agy daganatának kimutatására szolgál.
- A vesék ultrahangja nagy valószínűséggel nefrogén formában.
- Genetikai szűrés örökletes cukorbetegség gyanúja miatt.
A diabetes insipidus kezelése
A betegség okának azonosítása után az orvosok minden erőfeszítése annak megszüntetésére irányul: a daganatok eltávolítása, a vesék gyulladásának enyhítése. Ha a centrális formát azonosítják, és a cukorbetegség a valószínű ok kezelése után sem áll le, helyettesítő terápiát írnak elő. Ez abból áll, hogy a vérbe juttatják a páciensben hiányzó hormon szintetikus analógját - a despopressint (Minirin, Nourem, Nativa tabletták). Az adagolást egyénileg választják ki, a saját vazopresszin szintézisének jelenlététől és annak szükségességétől függően. Az adag megfelelőnek tekinthető, ha a diabetes insipidus tünetei megszűnnek.

Ha a saját hormonja termelődik, de nem elegendő, akkor klofibrátot, karbamazepint vagy klórpropamidot írhatnak fel. Egyes betegekben fokozhatják a vazopresszin szintézist. Gyermekek számára ezekből a gyógyszerekből csak a klórpropamid megengedett, de ennek alkalmazásakor a vércukorszint szabályozása szükséges, mivel hipoglikémiás hatása van.
Nincsenek bizonyítottan hatékony kezelések a nefrogén cukorbetegség kezelésére. A tiazidok csoportjába tartozó diuretikumok 25-50%-kal csökkenthetik a folyadékvesztést. Diabetes insipidusban nem serkentik a vizeletürítést, mint az egészséges embereknél, hanem éppen ellenkezőleg, fokozzák annak reabszorpcióját.
A gyógyszerek mellett a betegek korlátozott mennyiségű fehérjét tartalmazó étrendet írnak elő, hogy ne terheljék túl a veséket. A kiszáradás megelőzése érdekében elegendő folyadékot kell inni, lehetőleg gyümölcsleveket vagy kompótokat, hogy helyreállítsák a kimosott vitaminokat és mikroelemeket.
Ha a kezelés segített elérni a diabetes insipidus kompenzációjának szakaszát, a beteg normális életet élhet, miközben megőrzi munkaképességét. A teljes gyógyulás akkor lehetséges, ha a betegség okát megszüntették. Leggyakrabban a cukorbetegség eltűnik, ha sérülés, daganat vagy műtét okozta. Más esetekben a betegek élethosszig tartó kezelést igényelnek.
Az egyik vezető tünet, amellyel a diabetes mellitusra gyanakodhatunk, az állandó szomjúságérzet és a túlzott vizeletürítés, amely a napi 5 és 10 litert is elérheti.
Ugyanezek a tünetek a diabetes insipidus vagy diabetes insipidus esetében is megfigyelhetők. Ez a meglehetősen ritka betegség a vazopresszin antidiuretikus hormon hiányával jár.
Előfordulhat, hogy a vazopresszin csökkent mennyiségben szintetizálódik, vagy a vese receptorai már nem reagálnak rá. Ezenkívül a diabetes insipidus kialakulhat egy évesnél fiatalabb gyermekeknél, a terhesség második vagy utolsó trimeszterében, gyógyszerek szedése közben. Ez utóbbi formák a centrális és renális formákkal ellentétben kedvező prognózisúak és enyhe lefolyásúak.
A diabetes insipidus kialakulása: okai és mechanizmusa
Ahhoz, hogy a folyadék az elsődleges vizeletből visszakerüljön a vérbe, vazopresszinre van szükség. Ez az egyetlen hormon az emberi szervezetben, amely képes ilyen funkciót ellátni. Ha nem működik, súlyos anyagcserezavar alakul ki - diabetes insipidus.
A vazopresszin a hipotalamusz neuronjaiban termelődik - a nucleus supraopticusban. Ezután a neuronok folyamatai mentén az agyalapi mirigybe kerül, ahol felhalmozódik és a vérbe kerül. A felszabadulás jele a plazma ozmolaritás (koncentráció) növekedése és a keringő vér térfogatának csökkenése.
Az ozmolaritás az összes oldott só koncentrációját tükrözi. Általában 280 és 300 mOsm/l között van. Ebben az esetben a szervezet fiziológiás körülmények között működik. Ha növekszik, akkor a hipotalamuszban, a májban és az agy 3. kamrájának falában lévő receptorok jeleket adnak a folyadék visszatartásának szükségességéről, és azt a vizeletből veszik ki.
Az agyalapi mirigy ugyanazokat a jeleket kapja a pitvarban és a mellkason belüli vénákban lévő volumenreceptoroktól, ha a keringő vér térfogata a normál alatt van. A normál térfogat fenntartása lehetővé teszi a szövetek tápanyag- és oxigénellátását. Amikor a vér mennyisége csökken, az erekben a nyomás csökken, és a mikrocirkuláció gátolt.
A folyadékhiány és a felesleges só következményeinek kiküszöbölésére vazopresszin szabadul fel. Az antidiuretikus hormon szintjének emelkedése a következő okok miatt következik be: fájdalom sokk sérülés közben, vérveszteség, kiszáradás, pszichózis.
A vazopresszin hatása a következő irányokban történik:
- A vizeletkibocsátás csökken.
- A vizeletből származó víz bejut a vérbe, növelve annak térfogatát.
- A plazma ozmolaritása csökken, beleértve a nátrium- és klórszintet is.
- A simaizom tónusa nő, különösen az emésztőrendszerben és az erekben.
- Az artériák nyomása megnő, és érzékenyebbé válnak az adrenalinra és a noradrenalinra.
- A vérzés leáll.
Ezenkívül a vazopresszin befolyásolja az emberi viselkedést, részben meghatározva a szociális viselkedést, az agresszív reakciókat és az apákban a gyermekek iránti szeretetet.
Ha a hormon nem jut be a vérbe, vagy az érzékenység megszűnik, diabetes insipidus alakul ki.
A diabetes insipidus formái
Cukorszint
 A centrális típusú diabetes insipidus sérülésekkel és agydaganatokkal, valamint a hipotalamusz vagy az agyalapi mirigy vérellátásának zavarával alakul ki. A betegség előfordulása gyakran neuroinfekcióval jár.
A centrális típusú diabetes insipidus sérülésekkel és agydaganatokkal, valamint a hipotalamusz vagy az agyalapi mirigy vérellátásának zavarával alakul ki. A betegség előfordulása gyakran neuroinfekcióval jár.
Az agyalapi mirigy adenoma sebészeti kezelése vagy a kezelés alatti sugárzás a diabetes insipidus tüneteinek kialakulását okozhatja. A genetikai Wolfram-szindrómát a vazopresszin elégtelen termelése kíséri, ami serkenti ennek a patológiának az előfordulását.
Ha nehéz megállapítani az okot, ami a diabetes insipidus központi formájában szenvedő betegek jelentős részében megfigyelhető, a betegség ezen változatát idiopátiásnak nevezik.
A vese formában a vazopresszin receptorai nem reagálnak a vérben való jelenlétére. Ennek a következő okai lehetnek:
- A receptorszerkezet veleszületett rendellenessége.
- Veseelégtelenség.
- A plazma ionösszetételének zavarai.
- Lítiumtartalmú gyógyszerek szedése.
- Diabéteszes nefropátia késői stádiumban.
A terhes nőknél kialakuló Diabetes insipidust átmenetinek (múlónak) sorolják, ez azzal a ténnyel jár, hogy a placenta által termelt enzimek elpusztítják a vazopresszint. A szülés után a terhességi diabetes insipidus megszűnik.
Ezenkívül az első életévben a gyermekek átmeneti diabetes insipidusban szenvednek, amely az agyalapi mirigy és a hipotalamusz kialakulásához kapcsolódik.
A betegség súlyossága és a víz-elektrolit anyagcsere zavarának mértéke a szervezet kiszáradtságának mértékétől függ. A diabetes insipidusnak a következő formái vannak:
- Súlyos – napi 14 liter vizelés.
- Átlagos - diurézis 8-14 liter naponta.
- enyhe - a betegek akár 8 litert is ürítenek naponta.
- Ha napi 4 liternél kevesebbet veszít - részleges (részleges) diabetes insipidus.
A gyermekek és terhes nők átmeneti cukorbetegsége gyakran enyhe formában fordul elő. Ha gyógyszereket szed (iatrogén) - közepes súlyosságú. A centrális és vese formában a diabetes insipidus legsúlyosabb lefolyása figyelhető meg.
A Diabetes insipidust meglehetősen ritka patológiának tekintik. A közelmúltban azonban a központi formák folyamatos növekedését észlelték a traumás agysérülések és az agyi betegségek sebészeti beavatkozásainak növekedése miatt.
Leggyakrabban a diabetes insipidust és annak tüneteit 10-30 éves férfiaknál észlelik.
Diabetes insipidus diagnózisa
A diabetes insipidus tünetei nagy mennyiségű vizelettel és dehidratáció kialakulásával járnak. Emellett a vér elektrolit-egyensúlyának felborulása és vérnyomásesés alakul ki.
A súlyossági fokot a betegség súlyossága és előfordulásának oka határozza meg. A betegek fő panasza a cukorbetegséghez hasonlóan az erős szomjúság, az állandó szájszárazság, a száraz, dehidratált bőr és nyálkahártya, valamint a gyakori és bőséges vizelés.
A betegek naponta több mint 6 liter folyadékot ihatnak meg, és a kiürült vizelet mennyisége 10-20 literre nő. Az éjszakai diurézis jelentősen megnő.
A diabetes insipidus tipikus tünetei a következők:
- Erős fáradtság, tehetetlenség.
- Álmatlanság vagy fokozott álmosság.
- Csökkent nyáltermelés.
- Tartós székrekedés.
- Nehézség a gyomorban étkezés után, böfögés.
- Hányinger és hányás.
- Megnövekedett testhőmérséklet.
A szív- és érrendszerből a károsodott érrendszeri szabályozás tünetegyüttese alakul ki - vérnyomásesés, gyors pulzus, szívműködési megszakítások. Csökken a testsúly, a gyermekeknél 4 éves kor után vizelet-inkontinencia alakul ki, a betegeket pedig állandó bőrviszketés zavarja.
A neurológiai tünetek a vizelet elektrolit-vesztésének következményeként alakulnak ki - fejfájás, görcsök vagy izomrángások és más testrészek. A férfi diabetes insipidusnak olyan tipikus megnyilvánulása van, mint a csökkent libidó és az erekciós diszfunkció kialakulása.
A diabetes insipidus diagnózisának megerősítésére laboratóriumi diagnosztikát és speciális vizsgálatokat végeznek a diabetes insipidus eredetének tisztázására. A betegség vese- és központi formáinak differenciáldiagnózisát végzik, és kizárják a cukorbetegséget is.
Az első szakaszban a vizelet térfogatát, sűrűségét és ozmolalitását vizsgálják. A diabetes insipidust a következő értékek jellemzik:
- Minden testtömegkilogrammra több mint 40 ml vizelet ürül naponta.
- A vizelet relatív sűrűségének csökkenése 1005 g/l alá
- A vizelet ozmolalitása kevesebb, mint 300 mOsm/kg
A diabetes insipidus vese formájában a következő tünetek jelennek meg: hypercalcaemia, hyperkalaemia, emelkedett kreatinin a vérben, veseelégtelenség jelei vagy fertőző folyamat a húgyúti rendszerben. Diabéteszes nephropathiában a diagnosztikai indikátor a vércukorszint emelkedése.
A száraz étkezési teszt elvégzésekor a betegek gyorsan kiszáradási tüneteket és súlycsökkenést tapasztalnak. A diabetes insipidus központi formája gyorsan megfordul a dezmopresszinnel végzett tesztelés során.
Ha a diagnózis nem egyértelmű, agyi tomográfiát, valamint genetikai vizsgálatot kell végezni.
Diabetes insipidus kezelése
A diabetes insipidus kezelésében alkalmazott taktika megválasztása a betegség formájától függ. A hipotalamusz vagy az agyalapi mirigy károsodása miatti központi forma kezelésére szintetikusan előállított vazopresszin analógot használnak.
A dezmopresszin alapú gyógyszer tabletta vagy orrspray formájában kapható. Kereskedelmi nevek: Vazomirin, Minirin, Presaynex és Nativa. Elősegíti a víz visszaszívódását a vesékben. Ezért használatakor csak akkor szabad inni, ha szomjas, nehogy vízmérgezést okozzon.
Ha túladagolja a dezmopresszint vagy nagy mennyiségű folyadékot fogyaszt a használata közben, a következők fordulhatnak elő:
- Fokozott vérnyomás.
- Szövetödéma kialakulása.
- Csökkent nátriumkoncentráció a vérben.
- Károsodott tudat.
Az adagot egyénileg választják ki napi 10-40 mcg között. Egyszer bevehető vagy két adagra osztva. Általában a gyógyszer jól tolerálható, de mellékhatások fejfájás és szédülés, bélfájdalom, hányinger és mérsékelt vérnyomás-emelkedés formájában jelentkezhetnek.
A dezmopresszin spray vagy cseppek használatakor emlékezni kell arra, hogy a nyálkahártya duzzanata miatti orrfolyásnál a gyógyszer felszívódása lelassul, így ilyen esetekben a nyelv alá csepegtethető.
A diabetes insipidus központi formája esetén karbamazepin (Finlepsin, Zeptol) és klórpropamid alapú gyógyszereket is alkalmaznak a vazopresszin termelésének serkentésére.
A nefrogén diabetes insipidus azzal jár, hogy a vesék nem tudnak reagálni a vazopresszinre, amely elegendő mennyiségben lehet a vérben. Dezmopresszinnel végzett teszteléskor azonban nem jelentkezik reakció.
Ennek a formának a kezelésére tiazid diuretikumokat és nem szteroid gyulladáscsökkentő szereket használnak - Indometacin, Nimesulide, Voltaren. A só mennyisége az étrendben korlátozott.
A terhességi diabetes insipidust dezmopresszin gyógyszerekkel kezelik, a kezelést csak terhesség alatt végezzük, szülés után nincs szükség ilyen terápiára.
Enyhe vagy részleges diabetes insipidus esetén a kiszáradás megelőzésére megfelelő ivási rend formájában nem gyógyszeres kezelés alkalmazható.
A vesék terhelésének csökkentése érdekében diétás táplálkozást írnak elő. Fő elvei:
- A fehérje korlátozása, különösen a hús.
- Elegendő mennyiségű zsír és szénhidrát.
- Gyakori kis étkezések.
- Friss zöldségek és gyümölcsök felvétele.
- A szomjúság oltásához használjon gyümölcsitalokat, gyümölcsleveket vagy kompótokat.
A kezelés hatékonyságát a betegek közérzete és a kiürült vizelet mennyiségének csökkenése alapján értékelik.
A Diabetes insipidus egy meglehetősen ritka betegség, amely a vesék általi folyadék felszívódásának károsodásával jár. Ezt a betegséget cukorbetegségnek is nevezik, mivel kialakulása ahhoz a tényhez vezet, hogy a vizelet nem koncentrálódik, és nagy mennyiségben hígítva elhagyja a szervezetet.Hasonló betegség fordul elő állatokban, leggyakrabban kutyákban és emberekben, és bármely életkorban. Természetesen a vesék ilyen súlyos meghibásodása negatívan befolyásolja az egész szervezet működését. Hogyan nyilvánul meg a betegség és hogyan gyógyítható?
Ami?
A Diabetes insipidus egy ritka betegség (körülbelül 3/100 000), amely a hipotalamusz vagy az agyalapi mirigy diszfunkciójához kapcsolódik, amelyet polyuria (napi 6-15 liter vizelet kiválasztása) és polydipsia (szomjúság) jellemez.
Mindkét nemnél előfordul, felnőtteknél és gyermekeknél egyaránt. Leggyakrabban a fiatalok - 18 és 25 év közöttiek - betegek. A betegségnek ismert esetei vannak gyermekeknél az első életévben (A.D. Arbuzov, 1959, Sharapov V.S. 1992).
A diabetes insipidus okai
A Diabetes insipidus olyan patológia, amelyet a vazopresszin hiány, annak abszolút vagy relatív hiánya okoz. A vazopresszin (antidiuretikus hormon) a hipotalamuszban választódik ki, és más funkciók mellett felelős a vizelési folyamat normalizálásáért. Az eredet okai szerint ennek a betegségnek három típusát szokás megkülönböztetni: genetikai, szerzett, idiopátiás.
A legtöbb beteg esetében, akik ebben a ritka betegségben szenvednek, az ok még mindig ismeretlen. Ezt a típusú cukorbetegséget idiopátiásnak nevezik, és a betegek 70 százalékát érinti. A genetikai tényező örökletes tényező. Ebben az esetben a diabetes insipidus esetenként több családtagot és több generációt is érint egymás után.
Az orvostudomány ezt a genotípus súlyos változásaival magyarázza, amelyek hozzájárulnak az antidiuretikus hormon működésében fellépő zavarokhoz. Ennek a betegségnek az örökletes természetét a diencephalon és a középagy szerkezetének veleszületett hibája magyarázza.
A diabetes insipidus okainak mérlegelésekor figyelembe kell venni a kialakulásának mechanizmusait:
1) Centrális diabetes insipidus - akkor fordul elő, ha a hypothalamusban a vazopresszin elégtelen szekréciója van, vagy ha az agyalapi mirigyből a vérbe történő felszabadulása károsodott, feltehetően ennek okai:
- A hipotalamusz patológiája, mivel felelős a vizeletkiválasztás szabályozásáért és az antidiuretikus hormon szintéziséért, működésének megzavarása vezet ehhez a betegséghez. A hipotalamusz diszfunkciójának okai és provokáló tényezői lehetnek akut vagy krónikus fertőző betegségek: torokfájás, influenza, szexuális úton terjedő betegségek, tuberkulózis.
- Sebészeti beavatkozások az agyban és az agy gyulladásos patológiái.
- Agyrázkódás, traumás agysérülés.
- Autoimmun betegség.
- Cisztás, degeneratív, gyulladásos veseelváltozások, amelyek rontják a vazopresszin észlelését.
- A hipotalamusz és az agyalapi mirigy daganatos folyamatai.
- Ezenkívül a magas vérnyomás jelenléte az egyik súlyosbító tényező a diabetes insipidus során.
- A hipotalamusz-hipofízis rendszer érrendszeri elváltozásai, amelyek az agyi keringési problémákhoz vezetnek a hipotalamusz és az agyalapi mirigyet ellátó erekben.
2) Vese diabetes insipidus - ebben az esetben a vazopresszin normál mennyiségben termelődik, de a veseszövet nem reagál rá megfelelően. Az okok a következők lehetnek:
- a nephron vagy a vese velőcsatornáinak károsodása;
- örökletes tényező - veleszületett patológia;
- sarlósejtes vérszegénység;
- megnövekedett kálium vagy csökkent kalciumszint a vérben;
- krónikus veseelégtelenség;
- amiloidózis (amiloid lerakódása a szövetekben) vagy policisztás betegség (több ciszta kialakulása) a vesékben;
- olyan gyógyszerek szedése, amelyek toxikus hatással lehetnek a veseszövetre (Demeclocilin, Amfotericin B, Lítium);
- néha a patológia idős korban vagy egy másik patológia általi gyengülés hátterében fordul elő.
Néha a stressz miatt fokozott szomjúságérzet léphet fel (pszichogén polidipsia). Vagy a terhesség alatti diabetes insipidus, amely a 3. trimeszterben alakul ki a placenta által termelt enzimek által a vazopresszin tönkretétele miatt. Mindkét típusú jogsértés önmagában megszűnik a kiváltó ok megszüntetése után.
Osztályozás
Ennek a betegségnek két klinikai formáját szokás megkülönböztetni:
- Nefrogén diabetes insipidus (perifériás). A betegség ezen formája a disztális vesetubulusok vazopresszin biológiai hatásaira való érzékenységének csökkenése vagy teljes hiánya következménye. Ez általában krónikus vesepatológia (pyelonephritis vagy policisztás vesebetegség hátterében), a vér káliumtartalmának hosszú távú csökkenése és a kalciumszint növekedése esetén figyelhető meg, elégtelen fehérjebevitel mellett. tápláléktól – fehérjeéhezés, Sjögren-szindróma és néhány születési rendellenesség. Egyes esetekben a betegség családi eredetű.
- Neurogén diabetes insipidus (központi). Az idegrendszer kóros elváltozásai következtében alakul ki, különösen a hipotalamuszban vagy az agyalapi mirigy hátsó részében. Általában a betegség oka ebben az esetben az agyalapi mirigy teljes vagy részleges eltávolítására irányuló műtét, e terület infiltratív patológiája (hemokromatózis, szarkoidózis), trauma vagy gyulladásos természetű változások. Egyes esetekben a neurogén diabetes insipidus idiopátiás, és egyidejűleg ugyanazon család több tagjában fordul elő.

A diabetes insipidus tünetei
A diabetes insipidus legelső jelei a súlyos, fájdalmas szomjúságérzet (polydipsia) és a gyakori túlzott vizelés (polyuria), amelyek még éjszaka is zavarják a betegeket. Naponta 3-15 liter vizelet szabadulhat fel, mennyisége néha eléri a napi 20 litert is. Ezért a beteget erős szomjúság gyötri.
- A diabetes insipidus tünetei férfiaknál a csökkent libidó és potencia.
- A diabetes insipidus tünetei nőknél: menstruációs zavarok amenorrhoeáig, ezzel járó meddőség, és ha mégis bekövetkezik a terhesség, a spontán vetélés fokozott kockázata.
- A cukorbetegség tünetei gyermekeknél kifejezettek. Újszülötteknél és kisgyermekeknél ez a betegség általában súlyos. Emelkedik a testhőmérséklet, megmagyarázhatatlan hányás lép fel, idegrendszeri zavarok alakulnak ki. Idősebb gyermekeknél egészen serdülőkorig a diabetes insipidus tünete az ágybavizelés vagy bevizelés.
Később, ahogy előrehalad, a következő tünetek jelennek meg:
- A nagy mennyiségű folyadék fogyasztása miatt a gyomor megnyúlik, sőt néha leesik;
- Megjelennek a kiszáradás (a szervezetben lévő vízhiány) jelei: száraz bőr és nyálkahártya (szájszárazság), testtömeg csökkenés;
- A nagy mennyiségű vizelet felszabadulása miatt a hólyag megnyúlik;
- A szervezet vízhiánya miatt az emésztőenzimek termelődése a gyomorban és a belekben megszakad. Ezért a beteg étvágya csökken, gyomorhurut vagy vastagbélgyulladás alakul ki, és hajlamos a székrekedésre;
- A vérnyomás gyakran csökken, és a pulzusszám nő;
- Mivel nincs elég víz a szervezetben, az izzadás csökken;
- A beteg gyorsan elfárad;
- Néha megmagyarázhatatlan hányinger és hányás jelentkezik;
- A testhőmérséklet emelkedhet.
- Néha ágybavizelés (enuresis) fordul elő.
Mivel a szomjúság és a túlzott vizelés éjszaka is fennáll, a beteg mentális és érzelmi zavarokat okoz:
- érzelmi labilitás (néha még pszichózis is kialakul) és ingerlékenység;
- álmatlanság és fejfájás;
- csökkent szellemi aktivitás.
Tipikus esetekben ezek a diabetes insipidus tünetei. A betegség megnyilvánulásai azonban kissé eltérhetnek a férfiak és a nők, valamint a gyermekek körében.
Diagnosztika
Tipikus esetekben a diabetes insipidus diagnózisa nem nehéz, és a következőkön alapul:
- kifejezett szomjúság
- a napi vizelet mennyisége több mint 3 liter naponta
- plazma hiperozmolalitás (több mint 290 mOsm/kg, a folyadékbeviteltől függ)
- magas nátriumtartalom
- a vizelet hipoozmolalitása (100-200 mOsm/kg)
- a vizelet alacsony relatív sűrűsége (<1010)
A betegség okának meghatározásához a röntgen-, szemészeti és neuropszichiátriai vizsgálatok eredményeit gondosan elemzik. Az agy mágneses rezonancia képalkotása szükséges.

Hogyan kezeljük a diabetes insipidust?
Ennek a patológiának a terápiájának sikeres kimenetele a vazopresszin termelési kudarcokat okozó fő ok pontos azonosításában és megszüntetésében rejlik, például egy daganat vagy metasztázisok az agyban a diabetes insipidus központi formájában.
A diabetes insipidus kezelésére szolgáló gyógyszereket a kezelőorvos választja ki, mindegyik az antidiuretikus hormon szintetikus analógja. A gyógyszer hatásának időtartamától függően a gyógyszert naponta többször vagy néhány naponta egyszer kell bevenni (hosszú hatású gyógyszerek).
A központi formájú diabetes insipidus esetében leggyakrabban a karbamazepin vagy a klórpropamid gyógyszereket használják - ezek a gyógyszerek serkentik a vazopresszin termelését és felszabadulását. A test kiszáradásának megelőzése érdekében a bőséges és gyakori vizelés hátterében a beteg intravénás sóoldatokat kap.
A diabetes insipidus nőknél történő kezelése a nőgyógyász további konzultációjából és a menstruációs ciklus korrekciójából áll.
Táplálkozási szabályok
Mindenki tudja, hogy a cukorbetegeknek „különleges” kapcsolatuk van a cukrokkal. De mit lehet mondani a táplálkozásról, ha a betegség cukorinsipidus? Ebben az esetben a korlátozás egy másik terméket – a sót – érint. Ha a beteg nem szenved veseelégtelenségben, akkor a só helyettesíthető étrend-kiegészítővel, például Sanasollal.
A betegség diétája magában foglalja a fehérjetartalmú élelmiszerek fogyasztásának korlátozását (legfeljebb 70 g naponta). A betegnek a 7. sz. étrendi táblázat ajánlott.
Az étrend a következő ételeket és italokat tartalmazza:
- Édes-savanyú ízű bogyók és gyümölcsök.
- Friss zöldségek.
- Frissen facsart gyümölcslevek, kvas, teák - gyógynövényes és zöld.
- Víz citromlével.
- Erjesztett tejtermékek és italok.
- Sovány húsfajták.
- Alacsony zsírtartalmú hal és tenger gyümölcsei.
Előrejelzés
Az idiopátiás diabetes insipidus, megfelelő helyettesítő terápia mellett, nem jelent veszélyt a beteg életére, azonban ebből a formából lehetetlen felépülni.
A Diabetes insipidus, amely valamilyen más betegség hátterében jelentkezik, bizonyos esetekben spontán elmúlik, miután a kiváltó ok megszűnt.
Az 1-es típusú diabetes mellitus egy szervspecifikus autoimmun betegség, amely a hasnyálmirigy-szigetek inzulintermelő béta-sejtjeinek pusztulásához vezet, ami abszolút inzulinhiányban nyilvánul meg. Egyes esetekben a nyilvánvaló 1-es típusú diabetes mellitusban szenvedő betegeknél hiányoznak a béta-sejtek autoimmun károsodásának markerei (1-es típusú idiopátiás diabetes mellitus).
Etiológia
Az 1-es típusú diabetes mellitus örökletes hajlamú betegség, de a betegség kialakulásához csekély mértékben járul hozzá (körülbelül 1/3-ban határozza meg kialakulását). Az 1-es típusú cukorbetegség kialakulásának valószínűsége egy beteg anya gyermekénél 1-2%, apa - 3-6%, testvére - 6%. Az autoimmun béta-sejt-károsodás egy vagy több humorális markere, köztük a hasnyálmirigy-szigetek elleni antitestek, az anti-glutamát-dekarboxiláz antitestek (GAD 65) és az anti-tirozin-foszfatáz antitestek (IA-2 és IA-2béta), megtalálhatók a 85-90. a betegek %-a. Mindazonáltal a béta-sejtek elpusztításában a fő jelentőséget a sejtes immunitási faktoroknak tulajdonítják. Az 1-es típusú diabetes mellitus a HLA DQA és DQB haplotípusaihoz kapcsolódik. Az 1-es típusú diabetes mellitus fokozott gyakorisággal kombinálódik más autoimmun endokrin (autoimmun pajzsmirigygyulladás, Addison-kór) és nem endokrin betegségekkel, például alopecia, vitiligo, Crohn-betegség, reumás betegségek.
Patogenezis
Az 1-es típusú cukorbetegség akkor nyilvánul meg, amikor a béta-sejtek 80-90%-a elpusztul egy autoimmun folyamat során. Ennek a folyamatnak a sebessége és intenzitása jelentősen változhat. Leggyakrabban amikor tipikus tanfolyam gyermekek és fiatalok betegségei miatt ez a folyamat meglehetősen gyorsan lezajlik, majd a betegség gyors manifesztációja következik, amelyben az első klinikai tünetek megjelenésétől a ketoacidózis kialakulásáig (akár ketoacidotikus kómáig) csak néhány hét telik el.
Más, sokkal ritkább esetekben, általában 40 év feletti felnőtteknél, a betegség látens lehet. (felnőttek látens autoimmun cukorbetegsége – LADA), Ezenkívül a betegség kezdetén az ilyen betegeknél gyakran diagnosztizálnak 2-es típusú cukorbetegséget, és a cukorbetegség kompenzációja több éven keresztül elérhető szulfonilurea gyógyszerek felírásával. De később, általában 3 év elteltével, megjelennek az abszolút inzulinhiány jelei (fogyás, ketonuria, súlyos hiperglikémia, annak ellenére, hogy tablettázott hipoglikémiás gyógyszereket szedtek).
Az 1-es típusú diabetes mellitus patogenezise az abszolút inzulinhiányon alapul. Az, hogy a glükóz nem tud bejutni az inzulinfüggő szövetekbe (zsír és izom), energiahiányhoz vezet, ami fokozott lipolízist és proteolízist eredményez, amelyek súlycsökkenéssel járnak. A glikémiás szint emelkedése hiperozmolaritást okoz, amely ozmotikus diurézissel és súlyos kiszáradással jár. Inzulinhiány és energiahiány esetén a kontrainsuláris hormonok (glükagon, kortizol, növekedési hormon) termelése gátlástalan, ami a növekvő glikémia ellenére a glükoneogenezis stimulálását idézi elő. A zsírszövetben a fokozott lipolízis a szabad zsírsavak koncentrációjának jelentős növekedéséhez vezet. Inzulinhiány esetén a máj liposzintetikus kapacitása elnyomódik, és a szabad zsírsavak kezdenek bekerülni a ketogenezisbe. A ketontestek felhalmozódása diabéteszes ketózis, majd ezt követően ketoacidózis kialakulásához vezet. A kiszáradás és az acidózis fokozatos növekedésével kóma alakul ki, amely inzulinterápia és folyadékpótlás hiányában elkerülhetetlenül halállal végződik.
Járványtan
Az 1-es típusú diabetes mellitus az összes cukorbetegség 1,5-2%-át teszi ki. Az 1-es típusú cukorbetegség kialakulásának kockázata egy kaukázusi embernél körülbelül 0,4%. Az 1-es típusú diabetes mellitus megnyilvánulásának csúcskora körülbelül 10-13 év. Az esetek túlnyomó többségében az 1-es típusú cukorbetegség 40 éves kor előtt jelentkezik.
Klinikai megnyilvánulások
Tipikus esetekben, Különösen gyermekeknél és fiataloknál az 1-es típusú diabetes mellitus egyértelmű klinikai képpel debütál, amely több hónapon vagy akár hetekig is kialakul. Az 1-es típusú diabetes mellitus megnyilvánulását fertőző és egyéb kísérő betegségek válthatják ki. Jellegzetes minden típusú cukorbetegségre jellemző tünetek, hiperglikémiához társulnak: polydipsia, polyuria, viszketés, de 1-es típusú diabetes mellitusban ezek nagyon kifejezettek. Így a nap folyamán a betegek akár 5-10 liter folyadékot is ihatnak és üríthetnek ki. Különleges Az 1-es típusú cukorbetegségnél az abszolút inzulinhiány okozta tünet a 10-15 kg-os fogyás 1-2 hónap alatt. Súlyos általános és izomgyengeség, csökkent teljesítmény és álmosság jellemzi. A betegség kezdetén egyes betegeknél megnövekszik az étvágy, ami a ketoacidózis kialakulásával anorexiának ad helyet. Ez utóbbira jellemző az acetonszag (vagy gyümölcsszag) megjelenése a szájból, hányinger, hányás, gyakran hasi fájdalom (pszeudoperitonitis), súlyos kiszáradás és kóma kialakulásával végződik. Egyes esetekben az 1-es típusú diabetes mellitus első megnyilvánulása gyermekeknél a tudatosság progresszív károsodása egészen kómáig az egyidejű betegségek, általában fertőző vagy akut sebészeti patológiák következtében.
Ritka esetekben az 1-es típusú cukorbetegség kialakulása 35-40 év felettieknél (felnőttek látens autoimmun cukorbetegsége) előfordulhat, hogy a betegség nem jelentkezik ilyen egyértelműen (közepes polidipsia és polyuria, nincs testsúlycsökkenés), sőt a glikémiás szint rutin meghatározása során véletlenül is kimutatható. Ezekben az esetekben gyakran először diagnosztizálják a 2-es típusú cukorbetegséget, és tablettázott hipoglikémiás gyógyszereket írnak fel, amelyek egy ideig elfogadható kompenzációt biztosítanak a diabetes mellitus számára. A betegnél azonban több év alatt (gyakran egy éven belül) az egyre fokozódó abszolút inzulinhiány okozta tünetek jelentkeznek: fogyás, a tablettázott glükózcsökkentő gyógyszerek hátterében a normális vércukorszint fenntartásának képtelensége, ketózis, ketoacidózis.
Diagnosztika
Tekintettel arra, hogy az 1-es típusú diabetes mellitusnak egyértelmű klinikai képe van, és viszonylag ritka betegség, a glikémiás szintek szűrése az 1-es típusú diabetes mellitus diagnosztizálására nem indokolt. A betegek közeli hozzátartozóiban a betegség kialakulásának valószínűsége alacsony, ami az 1-es típusú cukorbetegség elsődleges megelőzésére szolgáló hatékony módszerek hiányával együtt meghatározza a betegség immunogenetikai markereinek tanulmányozásának nem megfelelőségét. Az 1-es típusú diabetes mellitus diagnózisa az esetek túlnyomó többségében a jelentős hiperglikémia azonosításán alapul az abszolút inzulinhiány súlyos klinikai megnyilvánulásaiban szenvedő betegeknél. Orális glükóz tolerancia teszt az 1-es típusú diabetes mellitus diagnosztizálásához nagyon ritkán kell elvégezni.
Megkülönböztető diagnózis
Kétes esetekben (mérsékelt hiperglikémia kimutatása nyilvánvaló klinikai megnyilvánulások hiányában, viszonylag előrehaladott korban való megnyilvánulás), valamint más típusú diabetes mellitus esetén történő differenciáldiagnózis céljából szintmeghatározást alkalmaznak. C-peptid(alap és 2 órával étkezés után). A definíciónak kétes esetekben közvetett diagnosztikai értéke lehet immunológiai markerek 1-es típusú diabetes mellitus - a hasnyálmirigy-szigetek, a glutamát-dekarboxiláz (GAD65) és a tirozin-foszfatáz (IA-2 és IA-2P) elleni antitestek.
Kezelés bármely típusú cukorbetegség három fő elven alapul: hipoglikémiás terápia (1-es típusú diabetes mellitus esetén - inzulinterápia), diéta és betegoktatás. Az 1-es típusú diabetes mellitus inzulinterápiája az helyettesítő jellegű célja pedig a fiziológiás hormontermelés lehető legnagyobb mértékű utánzása az elfogadott kompenzációs kritériumok elérése érdekében. Az intenzív inzulinterápia áll a legközelebb a fiziológiás inzulinszekrécióhoz. Az annak megfelelő inzulinszükséglet bazális szekréció két közepes hatástartamú inzulin injekcióval (reggel és este) vagy egy hosszú hatástartamú inzulin (glargin) injekcióval biztosítható. A bazális inzulin teljes adagja nem haladhatja meg a gyógyszer teljes napi szükségletének felét.
Élelmiszer vagy bolus inzulin szekréció minden étkezés előtt rövid vagy ultrarövid hatású inzulin injekciókkal helyettesítik, és az adagot a következő étkezés során várható szénhidrátmennyiség és a meglévő vércukorszint alapján számítják ki, amelyet a páciens egy glükométerrel minden inzulin injekció előtt.
Az 1-es típusú diabetes mellitus megnyilvánulása és az inzulinterápia meglehetősen hosszú ideig tartó megkezdése után az inzulinszükséglet kicsi és 0,3-0,4 E/kg alatt lehet. Ezt az időszakot remissziós szakasznak nevezzük, ill "Nászút". A hiperglikémia és ketoacidózis időszaka után, amelyek a megmaradt béta-sejtek 10-15%-ában elnyomják az inzulin kiválasztását, a hormonális-anyagcserezavarok inzulin adagolásával történő kompenzálása helyreállítja e sejtek működését, amelyek aztán átveszik a szervezet minimális inzulinellátását. szint. Ez az időszak több héttől több évig is eltarthat, de végül a megmaradt béta-sejtek autoimmun pusztulása miatt véget ér a nászút.