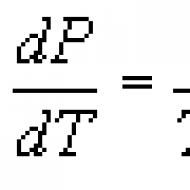Klepeirona-Klausiusa vienādojums. Klepeirona un Klausija-Kleirona vienādojumi Kurām fāzu pārejām ir piemērojams Klepeirona vienādojums?
Klepeirona-Klausiusa vienādojums termodinamiskais vienādojums, kas attiecas uz vielas pārejas procesiem no vienas fāzes uz otru (iztvaikošana, kušana, sublimācija, polimorfā transformācija utt.). Saskaņā ar K. - K. u. fāzes pārejas siltumu (piemēram, iztvaikošanas siltumu, saplūšanas siltumu) līdzsvara procesa laikā nosaka izteiksme Kur T - pārejas temperatūra (izotermisks process), dp/dT — spiediena atvasinājuma vērtība attiecībā pret temperatūru noteiktā pārejas temperatūrā, ( V 2-V 1) - vielas tilpuma izmaiņas tās pārejas laikā no pirmās fāzes uz otro. Sākotnēji vienādojumu 1834. gadā ieguva B. P. E. Klepeirons, analizējot Kārno ciklu tvaiku kondensēšanai termiskā līdzsvarā ar šķidrumu. 1850. gadā P. Klausijs uzlaboja vienādojumu un attiecināja to uz citām fāzu pārejām. K. - K. u. piemērojams jebkurām fāzu pārejām, ko pavada siltuma absorbcija vai izdalīšanās (tā sauktā pirmās kārtas fāzes pāreja), un tā ir tieša fāzes līdzsvara apstākļu sekas (sk. Fāzes līdzsvars) ,
no kā tas ir atvasināts. K. - K. u. var izmantot, lai aprēķinātu jebkuru no vienādojumā iekļautajiem lielumiem, ja pārējie ir zināmi. Jo īpaši to izmanto, lai aprēķinātu iztvaikošanas siltumu, kura eksperimentālā noteikšana ir saistīta ar ievērojamām grūtībām. Bieži vien K. - K. u. rakstīts attiecībā pret atvasinājumiem dp/dT vai dT/dp:
Iztvaikošanas un sublimācijas procesiem dp/dT izsaka piesātināta tvaika spiediena izmaiņas R ar temperatūru T, kā arī kausēšanas un polimorfās transformācijas procesiem dT/dp nosaka pārejas temperatūras izmaiņas ar spiedienu. Citiem vārdiem sakot, K. - K. u. ir mainīgo fāzes līdzsvara līknes diferenciālvienādojums r, T.
Atrisināt K. - K. u. ir jāzina, kā lielumi mainās atkarībā no temperatūras un spiediena L, V 1 Un V 2, kas ir grūts uzdevums. Parasti šo atkarību nosaka empīriski un atrisina K. - K. u. skaitliski. K. - K. u. attiecas gan uz tīrām vielām, gan uz šķīdumiem un atsevišķām šķīdumu sastāvdaļām. Pēdējā gadījumā K. - K. u. saista noteiktas sastāvdaļas daļēju piesātināta tvaika spiedienu ar tā daļējo iztvaikošanas siltumu. Ju. I. Poļakovs. Lielā padomju enciklopēdija. - M.: Padomju enciklopēdija.
1969-1978
.
![]()
Skatiet, kas ir “Klepeirona-Klausiusa vienādojums” citās vārdnīcās:
KLEIRONA MENDELEJEVA VIENĀDOJUMS, stāvokļa vienādojums (sk. STĀVOKĻU VIENĀDOTĀJUMS) ideālai gāzei (sk. IDEĀLĀ GĀZE), kas attiecas uz 1 molu (sk. MOL) gāzes. 1874. gadā D.I. Mendeļejevs (sk. MENDEĻEJEVS Dmitrijs Ivanovičs), pamatojoties uz Klepeirona vienādojumu ... enciklopēdiskā vārdnīca
KLEIRONA-KLAUZA VIENĀDĀJUMS- termodinamiskais vienādojums, kas saistīts ar vielas pārejas procesiem no vienas fāzes uz otru (iztvaikošana, kušana, polimorfā transformācija utt.). Saskaņā ar Clapeyron Clausis vienādojumu fāzes pārejas siltums (piemēram, kušanas siltums ... Metalurģijas vārdnīca
Ideālas gāzes stāvokļa vienādojums, nosakot sakarību starp tās tilpumu V. spiediens pi abs. t roy T. Ir forma: pV=nRT. kur n ir gāzes molu skaits, R = 8,31431 J/mol. K) gāzes konstante. 1 molam gāzes pv=RT, kur v ir molārais tilpums. K.M.u...... Ķīmiskā enciklopēdija
Stāvokļa vienādojums Šis raksts ir daļa no sērijas Termodinamika. Ideālas gāzes stāvokļa vienādojums Van der Vālsa vienādojums Diteriči vienādojums Termodinamikas sadaļas Termodinamikas principi Vienādojums ... Wikipedia
- (Klepeirona-Mendeļejeva vienādojums), sakarība starp ideālās gāzes parametriem (spiediens p, tilpums V un absolūtā temperatūra T), kas nosaka tās stāvokli: pV=BT, kur koeficients. proporcionalitāte B ir atkarīga no gāzes M masas un tās mola. masu. Uzstādīts…… Fiziskā enciklopēdija
Stāvokļa vienādojums Stat ... Wikipedia
- (Klapeirona-Mendeļejeva vienādojums), sakarība starp spiedienu p, absolūto temperatūru T un ideālas gāzes ar masu M tilpumu V: pV=BT, kur B=M/m (m ir gāzes molekulas masa atomu masā vienības). Izveidoja franču zinātnieks B.P.E. Klepeirons...... Mūsdienu enciklopēdija- Klepeirona Mendeļejeva vienādojums, ko atradis B. P. E. Klepeirons (1834) sakarība starp fizikālajiem lielumiem, kas nosaka ideālās gāzes stāvokli: gāzes spiedienu p, tilpumu V un absolūto temperatūru T. K. u.... Lielā padomju enciklopēdija
Klapeirona Mendeļejeva vienādojums [nosaukts franču vārdā. fizika B. Klepeirons (V. Klepeirons; 1799 1864) un krievu val. ķīmiķis D.I. Mendeļejevs (1834, 1907)], ideālas gāzes stāvokļa līmenis: pVm = RT, kur p ir spiediens, T ir gāzes termodinamiskā temperatūra, Vm ... ... Lielā enciklopēdiskā politehniskā vārdnīca
KLEIRONA UN KLAUZIJA-KLEIRONA VIENĀDĀJUMI
Kā izriet no Gibsa fāzes noteikuma, neatkarīgo intensīvo mainīgo skaits divfāžu vienkomponentu sistēmā ir vienāds ar vienu. Tāpēc ir jābūt saistītam vienādojumam R Un TVšāda sistēma. Šīs attiecības ir fāzes līdzsvara nosacījuma sekas:
kur apzīmējums p(p, T) uzsver, ka katras fāzes ķīmiskais potenciāls ir funkcija rT.
Ja p atkarība no R Un T bija skaidri zināms, tad (3.7) principā varētu atrisināt attiecībā uz R vai T un atrast atkarību R = p(T) vai T = T(r). Tomēr vispārīgā gadījumā atkarība p negatīvs un 7" nav zināms, un to nevar izdarīt. Bet jūs varat atrast atvasinājumu R Autors T(vai tā apgriezti).
Pieņemsim, ka vienas vielas divas fāzes a un b ir līdzsvarā. Ja maināt temperatūru par vērtību d7", tad spiedienam jāmainās tā, lai abu fāžu ķīmiskie potenciāli mainītos vienādi, nepārkāpjot līdzsvara nosacījumus (3.7), t.i.:
Abu diferenciāļu sadalīšana mainīgajos Tyr, mēs saņemam
Kopā ar attiecībām (2.31) tas dod:
No tā izrādās:
kur ir Df P? - fāzes pārejas entropija; A fp U=U^ -- molārs
fāzes pārejas tilpums (molārā tilpuma izmaiņas ar T= konst., p = const).
Fāzes pārejas entropija un entalpija ir savstarpēji saistītas ar attiecību (3.5): AS = AN/T. Tāpēc (3.9) var uzrakstīt šādā formā: 
Kur T- fāzes pārejas temperatūra.
Vienādojumi (3.9) un (3.10) ir līdzvērtīgi, un vienu no tiem sauc par Klepeirona vienādojumu.
Klepeirona vienādojuma praktisko pielietojumu ierobežo fakts, ka fāzu pārejas entalpija un fāžu molārie tilpumi dažādās fāzēs ir atšķirīgi atkarīgi no temperatūras. Tas nozīmē, ka nav vispārēja veida, kā integrēt šo vienādojumu. Bet maziem temperatūras intervāliem šos vienādojumus var integrēt ar precizitāti, kas ir pietiekama daudziem mērķiem, pieņemot noteiktus tuvinājumus.
Pirmais tuvinājums ir tāds, ka šauram temperatūras diapazonam var pieņemt, ka fāzes pārejas entalpija ir aptuveni nemainīga. To pašu var izdarīt attiecībā uz kondensēto fāžu - cieto un šķidro - molārajiem tilpumiem, jo tie ir vāji atkarīgi no Tyr. Tad fāzu līdzsvaram starp cietajām fāzēm un starp cietajām un šķidrajām fāzēm molārā tilpuma izmaiņas var pieņemt arī nemainīgas. Ar šiem tuvinājumiem (3.10.) ir integrēts šādi (kausēšanai):

Līdzīgi līdzsvaram starp cietajām fāzēm.
Gāzes fāzes molāro tilpumu nevar uzskatīt par nemainīgu. Bet zema spiediena gadījumā ir iespējami citi tuvinājumi. Pirmkārt, gāzes molārais tilpums zemā spiedienā ir daudz lielāks nekā jebkuras kondensētās fāzes molārais tilpums (sk.). Tāpēc iztvaicēšanai varat ņemt:
Otrkārt, zemā spiedienā daudzām gāzēm ir
tt t^gas CT d__ Jat
īpašības tuvu ideālam. Tāpēc ~-i L isp k t ~-.
Aizvietojot to vienādojumā (3.10), mēs iegūstam:

Jo &r/r= s!1p R, iegūto attiecību sauc par Clausius-Clapeyron vienādojumu:
To var izmantot gan šķidrās, gan cietās fāzes iztvaicēšanai (sublimācijai).
Aptuvinot fāzes pārejas nemainīgo entalpiju, šis vienādojums ir integrēts šādi:
Lai piemērotu šos vienādojumus, bieži tiek izmantoti dati par fāzu pāreju entalpijām un fāzu pāreju temperatūrām normālā spiedienā. Tie ir doti daudzās fizikālo un ķīmisko daudzumu uzziņu grāmatās. Normāls spiediens ir vērtība 101 325 Pa = 101,325 kPa = 1,01325 bar = 1 atm = 760 mm Hg. Art. = 760 torr. Dati no atsauces grāmatām kalpo par pamatu aptuveniem aprēķiniem, izmantojot vienādojumus (3.11) un (3.13) pie spiediena, kas būtiski neatšķiras no parastā.
Kondensēto fāžu molārie tilpumi, kas nepieciešami aprēķiniem, izmantojot vienādojumu (3.11.), parasti nav norādīti atsauces grāmatās. Bet to vietā jūs varat atrast datus par upju blīvumu. Tos var izmantot molāro tilpumu aprēķināšanai, zinot definīcijas U t = U/n, p = ka Un M = t/p. No tiem izriet: U t = M/ p, kur M - molārā masa.
No otras puses, dažās atsauces grāmatās ir norādīti fāzu pāreju specifiskie siltumi. Šajā gadījumā vienādojumu (3.10) var uzrakstīt šādā formā:

kur Af p/g un Af P y ir attiecīgi izmaiņas īpatnējā entalpijā un īpatnējā tilpumā fāzes pārejas laikā (un v= 1/r).
Ja iztvaikošanas entalpija nav zināma, to dažkārt var aptuveni novērtēt, izmantojot Trutona īkšķa likumu, kas nosaka, ka vairumam šķidrumu iztvaikošanas molārā entropija ir aptuveni 90 J K -1 mol -1 . Tā kā Dfp^ - AfpR/G, L isp R/J mol -1 = 90(G M/K), kur 7^ ir viršanas temperatūra normālā spiedienā. Šo iztvaikošanas entalpijas vērtību aizstājot ar (3.13) un pieņemot par p x normāls spiediens ir 1 atm, un temperatūrai T! normālu viršanas temperatūru T mēs iegūstam līdzsvara tvaika spiedienam virs šķidruma:

Trouton noteikums neattiecas uz šķidrumiem ar augstu polaritāti un jo īpaši uz saistītašķidrumi, piemēram, ūdens un spirti. (Saistītie šķidrumi ir šķidrumi, kuru molekulas mijiedarbojas viena ar otru ūdeņraža saites.) Noteikums ir apmierinošs tikai tad, ja to piemēro nepolārām vielām un ar viršanas temperatūru diapazonā no aptuveni 150 līdz 1000 K.
Klepeirona-Klausiusa vienādojums (diferenciālis).
Lasi arī:
|
Šķidruma-tvaiku līdzsvara līkni vai, kas ir tas pats, piesātināta tvaika spiediena atkarību no temperatūras konkrētai vielai var atrast, atrisinot tā saukto Klepeirona-Klausiusa vienādojumu.
Termodinamisko ciklu metode ļauj noteikt šī vienādojuma formu. Lai ir divas eksperimentālās izotermas, kas atbilst temperatūrām un (50. att.).

Sākotnējā stāvoklī 1 viens mols šķidruma atrodas zem spiediena temperatūrā un aizņem tilpumu (nav tvaika fāzes). Pievienojot siltumu, mēs izotermiski iztvaicējam šo šķidruma molu. Šajā gadījumā šķidrums vienmēr būs zem spiediena, kas vienāds ar tā piesātināto tvaiku spiedienu. Rezultātā šķidrums pārvērtīsies gāzveida stāvoklī 2. Siltuma daudzums, kas nepieciešams, lai konstantā temperatūrā un spiedienā pārvērstu vienu molu šķidruma gāzveida stāvoklī, pēc definīcijas ir latentais iztvaikošanas siltums. Tādējādi 12. pārejā šķidrums saņēma siltuma daudzumu, kas vienāds ar .
Ciklā veiktais darbs ir skaitliski vienāds ar četrstūra 1234 laukumu:
![]() (3.3.1)
(3.3.1)
un cikla efektivitāti
 .
(3.3.2)
.
(3.3.2)
No otras puses, 1234 cikls ir Carnot cikls, tātad tā efektivitāte ir
![]() (3.3.3)
(3.3.3)
Salīdzinot izteiksmes (3.3.2) un (3.3.3), iegūstam

 .
(3.3.4)
.
(3.3.4)
Vienādojumu (3.3.4.) var attēlot nedaudz citā formā. Lai to izdarītu, mēs atradīsim entropijas izmaiņas šķidruma pārejas laikā no stāvokļa 1 uz gāzveida stāvokli 2 (50. att.).
 ,
(3.3.5)
,
(3.3.5)
kur un ir attiecīgi šķidruma entropijas 1. stāvoklī un tvaiku 2. stāvoklī. Izmantojot pēdējo sakarību, vienādojumu (3.3.4.) var uzrakstīt šādi:
 .
(3.3.6)
.
(3.3.6)
Diferenciālvienādojums (3.3.4.) ir Klepeirona–Klausiusa vienādojums. Šis vienādojums atspoguļo piesātināta tvaika spiediena izmaiņas, temperatūrai mainoties par . Lai atrastu šī vienādojuma risinājumu, ir jāzina latentā iztvaikošanas siltuma atkarība no temperatūras, kā arī šķidruma un gāzes tilpumu atkarība no temperatūras un spiediena. Vispārīgā gadījumā šis vienādojums ir nelineārs diferenciālvienādojums, kura atrisinājumu atrod ar skaitlisko integrāciju.
Temperatūrā, kas ir ievērojami zemāka par kritisko, šķidruma aizņemtais tilpums ir daudz mazāks par šķidruma aizņemto tilpumu, t.i. Tā, piemēram, ūdens tvaiku tilpums ir 1600 reižu lielāks par ūdens tilpumu, šķidrā skābekļa vārīšanās temperatūrā – C ir saistīta ar tilpuma palielināšanos aptuveni 300 reizes. Tāpēc temperatūrā (3.3.4.) vienādojums pieņems formu
. (3.3.7)
Tādā pašā tuvinājumā piesātinātu tvaiku var uzskatīt arī par ideālu gāzi. Tas ļauj mums uzrakstīt vienādojumu (3.3.7) šādi:
. (3.3.8)
Integrējot vienādojuma (3.3.8) kreiso pusi diapazonā no līdz , bet labo pusi - diapazonā no līdz , iegūstam
 ,
(3.3.9)
,
(3.3.9)
kur ir piesātinātā tvaika spiediens, kas iegūts eksperimentā temperatūrā, un ir vidējā iztvaikošanas siltuma vērtība temperatūras diapazonā
No formulas (3.3.9.) ir skaidrs, ka piesātināto tvaiku spiediens palielinās eksponenciāli, palielinoties temperatūrai.
Klepeirona-Klausiusa vienādojums pārrakstīts kā
 , (3.3.10)
, (3.3.10)
kā mēs parādīsim vēlāk, tas arī nosaka šķidruma viršanas temperatūras atkarību no ārējā spiediena. Vienādojumā (3.3.10.)
ir viršanas temperatūras izmaiņas, kad ārējais spiediens mainās par . Tāpēc šķidruma un tvaika līdzsvara līkni sauc arī par viršanas līkni.
52. Van der Vālsa vienādojums — Neideālu gāzu stāvokļa vienādojums. Van der Vālsa vienādojuma konstantu eksperimentālā noteikšana.
Kā minēts iepriekš, zemā temperatūrā un augstā spiedienā Mendeļejeva-Klapeirona vienādojums vienam vielas molam
dod būtiskas novirzes no eksperimentāli izmērītajām vērtībām.
Ir veikti daudzi mēģinājumi atrast reālās vielas stāvokļa vienādojumu, kas varētu aptvert ja ne visus matērijas stāvokļus, tad vismaz gāzveida un šķidro. No daudzajiem piedāvātajiem vienādojumiem slavenākais ir van der Vālsa vienādojums:
 ,
(3.4.2)
,
(3.4.2)
rakstīts uz vienu molu vielas. Moliem šis vienādojums ir:
 .
(3.4.3)
.
(3.4.3)
Konstantes tiek noteiktas eksperimentāli, un tām ir dažādas vērtības dažādiem molekulu veidiem. Vienādojums (3.4.2.) nav atvasināts, to nosaka, ieviešot divus labojumus jau zināmajā Mendeļejeva–Klapeirona vienādojumā. Lai pamatotu to ieviešanu, mēs atzīmējam, ka vienādojumā (3.4.2) tilpums nozīmē trauka tilpumu, kurā ir viens mols gāzes. Ideālas gāzes gadījumā, kas sastāv no materiāliem punktiem, viss šis tilpums ir pieejams molekulu kustībai. Reālā gāzē pašas molekulas aizņem noteiktu daļu no tvertnes tilpuma, un šī daļa nav pieejama visām pārējām molekulām. Šī tilpuma daļa ir jāatņem no tilpuma. Tad vienādojums (3.4.2) iegūst formu
. (3.4.4)
No pēdējās izteiksmes ir skaidrs, ka korekcija ir vienāda ar tilpumu, ko gāze aizņemtu bezgalīgi augstā spiedienā, t.i., reālas gāzes molekulas nevar tuvoties viena otrai līdz attālumam, kas vienāds ar nulli, pat bezgalīgi augstā spiedienā. Tāpēc korekcijas ieviešana nozīmē aptuveni ņemt vērā atgrūšanas spēkus starp molekulām.
Kā zināms, starp molekulām darbojas ne tikai atgrūdoši spēki, bet arī pievilcīgi spēki. Jebkura molekula, kas atrodas netālu no trauka sienas, piedzīvo neto pievilkšanas spēku
no molekulu puses, kas atrodas pievilcīgo spēku darbības sfērā (51. att.).

Izvēlēsimies platformu uz sienas virsmas. Lai uz tā būtu molekulas. Tad iegūtais spēks, kas iedarbojas uz šīs zonas molekulām no gāzes
 ,
(3.4.6)
,
(3.4.6)
jo no simetrijas nosacījumiem visiem spēkiem ir vienāds lielums un virziens. Ja spēku sadala ar laukumu, iegūstam tā saukto molekulāro spiedienu, ar kuru pie sienas esošās molekulas iedarbojas uz pārējo gāzes masu:
. (3.4.7)
Katrs no formulas (3.4.7) faktoriem acīmredzami ir proporcionāls gāzes blīvumam, kas savukārt ir apgriezti proporcionāls gāzes tilpumam, tāpēc varam rakstīt:
, (3.4.8)
Kur a– pozitīvs nemainīgs koeficients.
Tādējādi pievilcīgo spēku darbības rezultātā spiediens uz sienu no gāzes puses būs mazāks par spiedienu (3.4.4), kāds piedzīvotu sienu, ja starp molekulām nebūtu pievilcīgu spēku, t.i.
![]() .
.
Kur mēs atrodam van der Vālsa vienādojumu:
 .
(3.4.9)
.
(3.4.9)
Izskaidrosim papildu spiediena parādīšanos formulā (3.4.9.). Ļaujiet gāzei atrasties cilindrā zem bezsvara virzuļa. Ārējam spiedienam ir tendence saspiest gāzi, tas ir, tuvināt tās molekulas. Ja gāzes molekulas nepievilktu viena otru, gāze piedzīvotu tikai ārēju spiedienu. Bet molekulu savstarpējai pievilkšanai, kā mēs noskaidrojām, ir arī tendence tuvināt molekulas viena otrai, tas ir, tā darbojas tādā pašā virzienā kā ārējais spiediens. Tāpēc molekulu pievilkšanas rezultāts atspoguļojas acīmredzamā ārējā spiediena palielinājumā uz gāzi, it kā spiedienam uz virzuli būtu pievienots kāds papildu spiediens.
Van der Vālsa vienādojuma konstantu eksperimentālā noteikšana
Eksperimentālai konstantu noteikšanai a un pētāmo gāzi ievieto slēgtā tilpuma traukā ar iebūvētu manometru un mēra šīs gāzes spiedienu dažādās temperatūrās. Ar eksperimentāli iegūtās līknes skaitlisko diferenciāciju nosaka daļējo atvasinājumu. No van der Vālsa vienādojuma mēs atrodam šo atvasinājumu
 .
(3.5.1)
.
(3.5.1)
No šejienes mēs iegūstam vērtību:
. (3.5.2)
Aizvietojot izteiksmi (3.5.2) van der Vālsa vienādojumā (3.4.9), mēs aprēķinām citu lielumu. a:
![]() .
(3.5.3)
.
(3.5.3)
Pieredze rāda, ka vērtības a un nav konstantes, bet ir atkarīgas no temperatūras, kaut arī vāji. Aprēķinos, izmantojot van der Vālsa vienādojumu kā konstantes a un ņemiet funkciju vidējās vērtības un interesējošo temperatūras diapazonu


53. Van der Vālsa vienādojuma izotermas un to salīdzinājums ar eksperimentālajām izotermām. Vielas kritisko parametru noteikšana no VdW vienādojuma. Metasstabi vielas stāvokļi ir pārsātināts tvaiks un pārkarsēts šķidrums. Vilsona kamera un burbuļu kamera.
Attēlā 52 parāda van der Vālsa gāzes izotermas.
Ļoti augstā temperatūrā to forma ir tuvu hiperbolām; šīs izotermas raksturo vielas gāzveida stāvokli (gandrīz ideāla gāze). Temperatūrai pazeminoties, izotermas forma mainās un noteiktā temperatūrā (kritiskā) tā nosaka līknes lēciena punktu. Vēl zemākā temperatūrā (subkritiskā) šķidruma-tvaiku fāzes pārejai atbilstoša horizontāla griezuma vietā izotermām ir viļņveidīgs posms (53. att.).


Rīsi. 52 R un lpp. 53
Mērījumi liecina, ka reālās vielas izotermas sekcijās (gāzveida stāvoklī) un (šķidrais stāvoklis) praktiski sakrīt ar van der Vāla izotermu. Taču vidusdaļā horizontālā posma 51 vietā, kas atbilst šķidruma-tvaiku fāzes pārejai, van der Vālsa izotermai ir viļņveidīgs posms. Šo viļņoto daļu raksturo šādi. 12. sadaļa atbilst tvaika metastabilajam stāvoklim (pārsātināts tvaiks), bet 54. sadaļa atbilst šķidruma (pārkarsēta šķidruma) metastabilajam stāvoklim. 1. punktā ir tikai piesātināts tvaiks, bet 5. punktā ir tikai verdošs šķidrums. Kas attiecas uz viļņveida līknes 234. iedaļu, tas ir fiziski neiespējami, jo dabā nav vielu, kurām nemainīgā temperatūrā tilpuma palielināšanās izraisītu spiediena palielināšanos. Pēdējais ir iespējams tikai tad, ja temperatūra šajā zonā nav nemainīga. Pārsātināts tvaiks (12. sadaļa) ir vielas gāzveida stāvoklis, kurā spiediens lpp lielāks par piesātināta tvaika spiedienu noteiktā temperatūrā - var iegūt eksperimentāli, saspiežot tīru gāzi līdz spiedienam, kas ir lielāks par piesātinātā tvaika spiedienu, un tā nekondensēsies. Pārsātināto tvaiku stāvoklis, lai gan tam ir noteikta stabilitāte, ir mazāk stabils nekā divfāžu stāvoklis (izobārs 135), kurā, kā zināms, daļa vielas ir šķidruma formā, bet daļa atrodas piesātināta tvaika forma. Tāpēc ar nelielu ārēju ietekmi pārsātinātie tvaiki daļēji pārvēršas šķidrumā, bet atlikušie tvaiki kļūst piesātināti.
Pārkarsēts šķidrums (45. sadaļa) - stāvoklis, kas raksturīgs ar to, ka tas pastāv spiedienā, kas ir zemāks par piesātināta tvaika spiedienu noteiktā temperatūrā, var iegūt, ilgstoši vārot tīru šķidrumu, kā rezultātā veidojas gāzes burbuļi (kodoli). iztvaikošana) tiek noņemti no šķidruma, un šķidrums tiek uzkarsēts līdz temperatūrai, kas pārsniedz tā viršanas temperatūru noteiktā spiedienā. Pārkarsēta šķidruma stāvoklis arī izrādās mazāk stabils nekā līdzsvara stāvoklis starp šķidrumu un piesātinātu tvaiku. Ja šādā pārkarsētā šķidrumā tiek ievadītas svešas vielas daļiņas, tas ātri pāriet uz divfāžu stāvokli.
Pārsātināta tvaika un pārkarsēta šķidruma stāvokļus izmanto kodolfizikas instrumentos (mākoņu kamerā un burbuļu kamerā), lai reģistrētu un izmērītu elementārdaļiņu parametrus.
Ja uz van der Vālsa izotermas viļņoto posmu aizstāj ar kādu horizontālu taisni 135, tad šādā veidā iegūtā izoterma kvalitatīvi pareizi aprakstīs vielas divfāžu stāvokli. Šīs līnijas pozīciju var noteikt, ja slēgtajam atgriezeniskajam ciklam 1234531 piemēro otro termodinamikas likumu Klausiusa apzīmējumā (2.13.7.):
. (3.6.1)
Tā kā visā ceļā 1234531 vielas temperatūra paliek nemainīga (jo šo ceļu veido vienas izotermas divu iespējamo variantu posmi), pēdējo vienādojumu var ierakstīt formā
. (3.6.5) ar eksperimentāliem datiem norāda, ka van der Vālsa vienādojums, no kura iegūta šī vērtība, ir aptuvens, lai gan kvalitatīvo priekšstatu par vielas stāvokļa izmaiņām vienādojums sniedz diezgan pareizi. Ir daudz mēģinājumu iegūt precīzāku vielas stāvokļa vienādojumu. Tomēr šie vienādojumi satur lielu skaitu korekcijas koeficientu, kuru fiziskā nozīme ir neskaidra, tāpat kā van der Vālsa vienādojumā.
Vispārīgākajā formā, izmantojot statistiskās fizikas metodes, akadēmiķis N. N. Bogoļubovs ieguva stāvokļa vienādojumu.
 ,
(3.6.12)
,
(3.6.12)
kur ir tā sauktie viriālie koeficienti, kas ir tikai temperatūras funkcijas. No Bogoļubova vienādojuma izriet, ka jo lielāka ir molārā tilpuma vērtība, jo mazāks ir rindas terminu skaits, lai iegūtu diezgan precīzu rezultātu. Kad visi pakāpju rindas termini izzūd un vienādojums (3.6.12.) iegūst formu , t.i., kā varētu sagaidīt, Bogoļubova vienādojums pārvēršas Mendeļejeva–Klepeirona vienādojumā. Vīrusu koeficientus nevar aprēķināt ar tīri teorētiskām metodēm, tāpēc tie jānosaka, izmantojot eksperimentālos datus. Tomēr šī problēma izrādās tik sarežģīta, ka ir pareizāk iegūt stāvokļa vienādojumu vienkārši interpolācijas formulas veidā, kas apraksta eksperimentālos datus.
Šķidruma iztvaikošanas siltuma noteikšana
Lai nodrošinātu līdzsvaru starp šķidrumu un tvaiku, Klepeirona-Klausiusa vienādojumu var iegūt šādi.
Saskaņā ar otro termodinamikas likumu, ja sistēma ir līdzsvarā, tad noteiktos apstākļos ( R, T) darbs netiek veikts
Ap = 0; G un -G P = 0; G un = G P (2)
tas ir, tīra šķidruma un tā tvaiku Gibsa brīvās enerģijas ir vienādas (tie ir līdzsvara apstākļi).
Mainīsim vienu no nosacījumiem, kas nosaka līdzsvaru, piemēram, temperatūru (tas ir, mēs sildām sistēmu par T), tā rezultātā tiks izveidots jauns spiediens, jauns šķidruma-tvaiku līdzsvars:
G " un = G " P (3)
vai G un = G P (4)
Ja ārējā parametra izmaiņas notiek bezgalīgi mazā apmērā - dT, tad izobariski izotermiskie potenciāli mainīsies par bezgalīgi mazu vērtību:
dG un =dG P (5)
Izobāriskais-izotermiskais potenciāls atspoguļo sistēmas brīvo enerģiju un ir spiediena un temperatūras funkcija:
dG=VdP–SDT(6)
tādēļ to var izmantot, lai noteiktu kvantitatīvu sakarību starp piesātināta tvaika spiedienu un temperatūru.
Pēc (6) aizstāšanas ar (5) mēs esam līdzsvara stāvoklī
V un dP-S un dT = V P dP-S P dT(7)
no kurienes (8)
Kur ( S P -S un) Un ( V P - V un) - izmaiņas, attiecīgi, sistēmas entropijā un tilpumā vielas pārejas laikā no šķidruma uz tvaika stāvokli. Saskaņā ar otro termodinamikas likumu sistēmas entropijas izmaiņas iztvaikošanas laikā ir vienādas ar samazinātu iztvaikošanas siltumu.
 (9)
(9)
Aizstājot izteiksmi (9) ar (8), mēs iegūstam
 (10)
(10)
kur ∆ H isp un ∆ V isp- attiecīgi entalpijas un tilpuma izmaiņas iztvaikošanas laikā, un T ķīpa- viršanas temperatūra.
(10) vienādojums sauc par Klepeirona-Klausiusa vienādojumu . Saskaņā ar (10) līniju slīpumu ūdens fāzes diagrammā (1. att.) nosaka atvasinājuma zīme. dP/dT vai tā abpusēja dT/dP- raksturojot temperatūras izmaiņas, palielinoties spiedienam.
No fāzu pārejām mēs uzskatām iztvaikošanu un kušanu. Iztvaikošanas siltums – šķidrās fāzes pāreja gāzveida fāzē – ir pozitīvs. Molārais iztvaikošanas siltums ir siltuma daudzums, kas iztērēts, lai iztvaicētu vienu molu šķidras vielas. Gāzes tilpums iztvaikošanas laikā vienmēr ir lielāks par atbilstošo šķidruma tilpumu, tas ir, vienādojumā (10) V P >V un. Tāpēc dP/dT, un tāpēc dT/dP vienmēr ir pozitīvi ( dT/dP> 0). Līdz ar to iztvaikošanas temperatūra vienmēr palielinās, palielinoties spiedienam (līkne labi attēlā. 1 vai skatīt tabulu. 1 pielikums). Palielinoties temperatūrai, piesātinātā tvaika spiediens virs šķidruma palielinās, sasniedzot maksimālo vērtību kritiskajā temperatūrā. Pēdējā ir ierobežojošā temperatūra (piemēram, ūdenim tā ir 374,12 o C), pie kuras ir iespējams līdzsvars starp vielas šķidruma un tvaika fāzēm. Augstākā temperatūrā viela var būt tikai gāzveida stāvoklī, un piesātināto tvaiku jēdziens zaudē savu nozīmi.
Sapludināšanas siltums – cietās fāzes pāreja uz šķidro fāzi arī vienmēr ir pozitīva.

Rīsi. 1. Ūdens stāvokļa diagramma zemā spiedienā
Reģioni: 1 - cietā fāze (ledus); II- šķidrums; III - pag.
Līknes: AO - sublimācija; OK - iztvaikošana; OV - kušana.
O ir trīskāršs punkts, kas atbilst trīs fāžu līdzsvaram.
Šķidrās fāzes tilpums vispārīgā gadījumā var būt lielāks vai mazāks par tāda paša daudzuma cietās fāzes tilpumu. No šejienes saskaņā ar vienādojumu (10) izriet, ka vērtība dP/dT vai tā apgrieztā vērtība dT/dP, var būt pozitīva vai negatīva. Tas nozīmē, ka kušanas temperatūra var pieaugt vai kristies, palielinoties spiedienam. Lielums dT/dP pozitīvs lielākajai daļai vielu. Tam ir negatīva vērtība tikai ūdenim, bismutam un dažām citām vielām, kurām šķidruma blīvums kušanas temperatūrā ir lielāks par cietās fāzes blīvumu ( V un -V T) < 0. В связи с этим при увеличении давления температура плавления льда понижается (криваяOB).
Jāņem vērā, ka aplūkotie modeļi ir derīgi zemam spiedienam.
Klapeirona-Klausiusa vienādojumu (10) var pārveidot, veicot šādus tuvinājumus:
1) Kopš ∆ V isp =(V P -V un) >> 0 (piemēram, ūdenim molārais tilpums tvaika stāvoklī Nr. V P≈ 22400 cm 2 un šķidrā stāvoklī V un≈ 18 cm 3), tad bez lielas kļūdas vērtību varam neņemt vērā V un un pieņemt, ka ∆ V isp ≈ V P .
2) Pie ne pārāk augsta spiediena un temperatūras (tālu no kritiskās) ideālo gāzu stāvokļa vienādojumu var piemērot reālām sistēmām. Šajā gadījumā iegūtā kļūda izrādās nenozīmīga.
 (11)
(11)
Aizstājot (11) ar (10), mēs iegūstam:
 (12)
(12)
kas pēc transformācijas
 (13)
(13)
ieņem formu
 (14)
(14)
Iztvaikošanas siltums ir atkarīgs no temperatūras : temperatūrai paaugstinoties, iztvaikošanas siltums samazinās. Kritiskajā temperatūrā iztvaikošanas siltums ir nulle. Tomēr temperatūrā, kas ir tālu no kritiskās, mainās ∆ N isp ar temperatūru nav ļoti lielas. Ne pārāk plašā temperatūras diapazonā∆ N isp var uzskatīt par nemainīgu.
Clapeyron-Clausius vienādojuma (14) integrācija temperatūras diapazonā T 1 un T 2, kas atbilst spiedieniem R 1 un R 2 pie nemainīgas ∆ N isp, dod
 (15)
(15)
vai pārejot uz decimāllogaritmiem
 (16)
(16)
(R- universālā gāzes konstante, kas vienāda ar 8,314 J/mol K).
Vienādojumi (15), (16) ļauj aprēķināt iztvaikošanas siltumu. Lai to izdarītu, pamatojoties uz eksperimentāliem datiem, tiek veidota atkarība lnP=f(1/T) vai lgP=f(1/T) un izvēlieties divus punktus iegūtajā taisnē (2. att.). Spiediena un apgrieztās temperatūras logaritma vērtības, kas atbilst šiem punktiem, aizstājiet vienādojumā (17):
 (17)
(17)
∆ vērtība N isp saskaņā ar vienādojumu (17) ir atkarīgs no ņemtā temperatūras intervāla un jo tuvāk patiesajam, jo mazāks šis intervāls. Tomēr šāds aprēķins prasa ļoti precīzus viršanas punkta un tvaika spiediena mērījumus.
Lai aprēķinātu ∆ N isp salīdzinoši plašā temperatūras diapazonā (50...100 o C) jāizvēlas punkti, kas visprecīzāk atbilst taisnei lgP=f(1/T).
Šķidruma viršanas temperatūra, tvaika spiediens noteiktā temperatūrā un iztvaikošanas siltums ir īpašas matērijas konstantes , kuru vērtības ir nepieciešamas daudziem teorētiskiem un praktiskiem aprēķiniem. Pamatojoties uz šiem datiem, ir iespējams noteikt ķīmisko vielu tīrību, aprēķināt maisījumu atdalīšanu ar destilāciju, kā arī aprēķināt enerģijas izmaksas šķidruma iztvaicēšanai, kas nepieciešama reakcijas veikšanai gāzes fāzē.
Iztvaikošanas siltuma aprēķināšana, izmantojot molekulāros parametrus, vienmēr ietver pieņēmumus. Tas ir aptuvens un piemērots, ja ir izpildīti vairāki nosacījumi. Tomēr ir fundamentāls Klepeirona-Klausiusa vienādojums, kas savieno iztvaikošanas siltumu ar citiem sistēmas termodinamiskajiem raksturlielumiem un tiek iegūts, stingri pamatojoties uz otro termodinamikas likumu.
Lai darba viela, kas veic Karno ciklu, ir divfāžu ar šķidrumu piesātināta tvaiku sistēma. Šādas sistēmas sākuma stāvokli mēs attēlojam kā 1. punktu 8.17. attēlā. Veiksim sistēmas izobārisku-izotermisku izplešanos temperatūrā no stāvokļa 1 līdz stāvoklim 2. Šajā gadījumā iztvaikos noteikta šķidruma masa un attiecīgi tiks absorbēts siltums, kas vienāds ar šķidruma iztvaikošanas siltumu. no termostata. Tilpuma starpība 2. un 1. punktā ir vienāda ar tilpumu starpību gāzveida un šķidrā stāvoklī iztvaicētajai vielas masai: No 2. stāvokļa divfāzu sistēma tiek adiabātiski pārnesta uz stāvokli 3 ar zemāku temperatūru 7%. No 3. stāvokļa darba viela izobariski-izotermiski tiek pārnesta uz stāvokli 4, savukārt daļa tvaiku kondensējas un siltums tiek izvadīts ledusskapī.No 4. stāvokļa divfāzu sistēma ar adiabātisku kompresiju tiek pārnesta uz sākotnējo stāvokli. Cikla darbs ir:
kur ir cikla efektivitāte
![]()
Pie nelielām temperatūras (spiediena) atšķirībām cikla darbs ir vienāds ar:
Izmantojot (83.3) un (83.2), mēs pārrakstām (83.1):
![]()
Aizstājot un pārejot līdz robežai, mēs iegūstam:
![]()
Šīs attiecības atklāja franču inženieris Klepeirons (1832), pirms tika noteikts pirmais termodinamikas likums.

Mūsdienu šī vienādojuma atvasinājumu sniedza Klausijs, tāpēc to sauc par Klepeirona-Klausiusa vienādojumu. Šis vienādojums ļauj aprēķināt iztvaikošanas siltumu (īpatnējo, molāro), ja ir zināma piesātinātā tvaika spiediena atkarība no temperatūras un šķidruma un tvaika tilpumi (īpatnējais, molārais).
Atvasinājumu nosaka no eksperimentāli atrastās atkarības (piesātināta tvaika spiediena atkarības no temperatūras).
Clapeyron-Clausius vienādojums ir derīgs ne tikai šķidruma-tvaika pārejai, bet arī visām pārējām fāzu pārejām. Tas izsaka spiediena izmaiņas, pie kurām fāze ir līdzsvarā ar temperatūras izmaiņām. Tādējādi kausēšanai vienādojums (83.4) iegūst formu
![]()