肝臓と炭水化物の代謝。 肝臓はどのように機能するのでしょうか?
- 1. 興奮性組織の概念。 興奮性組織の基本特性。 刺激物。 刺激の分類。
- 2. 腎血流の特徴。 ネフロン:尿の形成と排尿のプロセスの構造、機能、特徴。 一次尿と二次尿。 尿の組成。
- 1. 細胞膜の構造と機能に関する現代的な考え方。 細胞膜電位の概念。 膜電位の出現に関する膜理論の基本的な規定。 休息のポテンシャル。
- 2.胸腔内圧、その意味。 肺組織の弾力性。 肺の弾性牽引力を決定する要因。 気胸。
- 3. タスク。 「熱中症」と熱性失神の発症条件は人間でも同じなのでしょうか?
- 1. 興奮と抑制の過程における細胞膜電位の変化の特徴。 活動電位、そのパラメーターと意味。
- 2. 心筋の自動性:概念、原因、特徴に関する現代的な考え方。 心臓のさまざまな部分の自動性の程度。 スタニウス・エクスペリエンス。
- 3. タスク。 どの呼吸がより効果的かを判断します。
- 1. 神経細胞の一般的特徴:分類、構造、機能
- 2. 血液による酸素の輸送。 血液中の酸素結合の分圧、二酸化炭素分圧、pH、血液温度への依存性。 ボーア効果。
- 3. タスク。 水中での冷却は、同じ温度の静止空気中でよりも 20° 大きくなる理由を説明してください。
- 1. 神経線維と神経の構造と種類。 神経線維と神経の基本的な性質。 神経線維に沿った興奮伝播のメカニズム。
- 2. 血管の種類。 血管を通る血液の移動のメカニズム。 静脈を通る血液の動きの特徴。 血管内の血液の動きを示す基本的な血行動態指標。
- 3. タスク。 大量の肉を食べる前に、1人の被験者はコップ1杯の水を飲み、2番目の被験者はコップ1杯のクリームを飲み、3番目の被験者はコップ1杯のスープを飲みました。 これは肉の消化にどのような影響を与えるのでしょうか?
- 1. シナプスの概念。 シナプスの構造と種類。 興奮と抑制のシナプス伝達のメカニズム。 仲介者。 受容体。 シナプスの基本的な性質。 エファプティック送信の概念。
- 2. 体内の炭水化物代謝の特徴。
- 3. タスク。 細胞膜がイオンに対して完全に不透過性である場合、静止電位はどのように変化するでしょうか?
- 1. 人間の適応の一般的なパターン。 進化と適応の形態。 アダプトゲン因子。
- 2. 血液中の二酸化炭素の輸送
- 2.体内の脂肪代謝の特徴。
- 3. タスク。 神経をテトロドトキシンで治療すると、PPは増加しますが、PDは発生しません。 これらの違いの理由は何でしょうか?
- 1. 神経中枢の概念。 神経中枢の基本的な性質。 神経プロセスの機能と可塑性の補償。
- 2. 消化: 空腹と満腹の概念、生理学的基礎。 食品センター。 空腹と満腹の状態を説明する基本理論。
- 1.中枢神経系の活動における調整の基本原理の特徴。
- 2. 心筋の伝導性: 概念、メカニズム、特徴。
- 3. タスク。 胆嚢からの胆汁の流出に遅れがある人。 これは脂肪の消化に影響しますか?
- 1. 脊髄の機能的組織。 運動と自律機能の調節における脊髄中枢の役割。
- 2. 熱生成と熱伝達: それらを決定するメカニズムと要因。 熱生成と熱伝達における代償的な変化。
- 1. 延髄、中脳、間脳、小脳の機能の特徴、身体の運動反応および自律反応におけるそれらの役割。
- 2. 体温一定を調節する神経液性メカニズム
- 1. 中枢神経系の最高位部門としての大脳皮質、その重要性、組織。 大脳皮質における機能の局在化。 神経活動の動的定型。
- 2. 消化管の基本的な機能。 消化プロセスの調節の基本原則。 I.P.パブロフによると、消化器官に対する神経的および体液性の影響の主な影響。
- 3. タスク。 被験者の心電図を分析したところ、心室心筋の回復プロセスが損なわれていると結論づけられました。 この結論は心電図のどのような変化に基づいてなされたのでしょうか?
- 1. 自律神経系 (ANS) の機能組織と機能。 自律神経系の交感神経と副交感神経の部門の概念。 それらの特徴、違いは臓器の活動に影響を与えます。
- 2. 内分泌腺の概念。 ホルモン: 概念、一般的な特性、化学構造による分類。
- 3. タスク。 ピアノを習う子供は、最初は手で弾くだけでなく、頭、足、さらには舌を使って自分自身を「助け」ます。 この現象はどのようなメカニズムで起こるのでしょうか?
- 1. 視覚感覚系の特徴。
- 2. 体内のタンパク質代謝の特徴。
- 3. タスク。 ある種のキノコに含まれる毒は、心臓の絶対反射周期を急激に短縮させます。 これらのキノコによる中毒は死に至る可能性がありますか? なぜ?
- 1. 運動感覚系の特徴。
- 3. タスク。 あなたがいる場合:
- 1. 聴覚、痛み、内臓、触覚、嗅覚、味覚の感覚系の概念。
- 2. 性ホルモン、体内の機能。
- 1.無条件反射の概念、さまざまな指標によるそれらの分類。 単純な反射と複雑な反射の例。 本能。
- 2. 胃腸管における消化の主な段階。 消化を実行する酵素に応じた消化の分類。 プロセスの局在化に応じた分類。
- 3. タスク。 医薬品の影響下で、ナトリウムイオンに対する膜の透過性が増加しました。 膜電位はどのように変化するのでしょうか?またその理由は何ですか?
- 1. 条件反射抑制の種類と特徴。
- 2. 肝臓の基本的な機能。 肝臓の消化機能。 消化過程における胆汁の役割。 胆汁の形成と胆汁の排泄。
- 1. 動作制御の基本パターン。 運動制御におけるさまざまな感覚システムの関与。 運動能力:生理学的基礎、その形成の条件と段階。
- 2. 空洞と頭頂部の消化の概念と特徴。 吸引機構。
- 3. 目的。 失血とともに尿量が減少する理由を説明してください。
- 1. 高次神経活動の種類とその特徴。
- 3. タスク。 展示会に参加するために猫を準備するとき、飼い主の中には猫を寒い場所に置き、同時に脂肪の多い食べ物を与える人もいます。 なぜ彼らはこんなことをするのでしょうか?
- 2. 心臓活動の神経、反射、体液性調節の特徴。
- 3. タスク。 離断をシミュレートするには、薬物がどのタイプの受容体をブロックする必要がありますか。
- 1. 心臓の電気活動。 心電図検査の生理学的基礎。 心電図。 心電図解析。
- 2. 腎臓活動の神経および体液性調節。
- 1. 骨格筋の基本的な性質。 単一収縮。 陣痛と破傷風の合計。 最適と悲観の概念。 パラバイオシスとその段階。
- 2. 下垂体の機能。 下垂体前葉と後葉のホルモン、その影響。
- 2. 排泄プロセス: 排泄器官を意味します。 腎臓の基本的な機能。
- 3. タスク。 細胞膜内の化学因子の影響により、興奮時に活性化できるカリウムチャネルの数が増加しました。 これは活動電位にどのような影響を与えるのでしょうか?またその理由は何ですか?
- 1.疲労の概念。 生理学的症状と疲労の進行段階。 疲労時の体の基本的な生理学的および生化学的変化。 「アクティブ」レクリエーションのコンセプト。
- 2. 恒温生物と変温生物の概念。 体温を一定に保つ意味と仕組み。 体のコアとシェルの温度の概念。
- 1. 平滑筋、心筋、骨格筋の比較特性。 筋肉の収縮のメカニズム。
- 1.「血液系」の概念。 血液の基本的な機能と構成。 血液の物理化学的性質。 血液緩衝システム。 血漿とその組成。 造血の調節。
- 2. 甲状腺とそのホルモンの重要性。 機能亢進と機能低下。 副甲状腺、その役割。
- 3. タスク。 エネルギー供給者としてどのメカニズムが支配的ですか:
- 1. 赤血球:構造、組成、機能、測定方法。 ヘモグロビン: 構造、機能、測定方法。
- 2. 呼吸の神経的および体液性の調節。 呼吸センターの概念。 呼吸センターの自動化。 肺の機械受容体からの反射の影響、その重要性。
- 3. タスク。 心臓の m-コリン作動性受容体の興奮がこの臓器の活動の阻害につながり、平滑筋の同じ受容体の興奮がそのけいれんを伴う理由を説明してください。
- 1. 白血球:種類、構造、機能、測定方法、計数。 白血球のフォーミュラ。
- 3. タスク。 10歳、13歳、16歳で検査を行った10代の若者の大腿四頭筋におけるI型筋線維とII型筋線維の比率を3回研究した結果はどうなるでしょうか?
- 1. 血液型の教義。 血液型と Rh 因子、それらの決定方法。 輸血。
- 2. 体内の代謝の主な段階。 代謝の調節。 タンパク質、脂肪、炭水化物の代謝における肝臓の役割。
- 3. タスク。 瀉血中は血圧の低下が観察されますが、その後血圧は元の値に戻ります。 仕組みは何ですか?
- 1. 血液凝固:メカニズム、プロセスの重要性。 抗凝固システム、線維素溶解。
- 2. 心臓: 心周期の構造、位相。 心臓の活動の基本的な指標。
- 1. 心筋の興奮性:概念、メカニズム。 心周期のさまざまな期間における興奮性の変化。 期外収縮。
エネルギー物質が細胞に入った瞬間からの体内のエネルギー物質の変化は、第2段階、つまり間質代謝の段階を特徴づけます。 間質代謝中に、アセチルコエンザイム A、α-ケトグルタル酸、オキサロ酢酸が代謝の第一段階の生成物のほとんどから形成されます。 これらの物質はクエン酸回路で酸化を受けます。 酸化プロセスの結果、アデノシン三リン酸の高エネルギー結合に蓄えられたエネルギーが放出されます。
代謝の最終段階では、尿、汗、皮脂腺の排泄物とともに不完全な分解生成物が放出されます。 代謝の過程で、細胞構造が形成され、エネルギーが放出されます。 交換のこれら 2 つの側面は連携して機能します。 しかし、代謝のプラスチックとエネルギーの側面におけるさまざまな栄養素の役割は同じではありません。
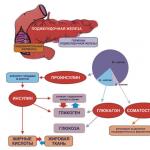
代謝とエネルギーの調節における中枢の役割は、視床下部の核によって演じられます。 それらは、空腹感と満腹感の生成、熱交換、浸透圧調節に直接関係しています。 視床下部には、グルコース、水素イオン、体温、浸透圧、つまり身体の内部環境の最も重要な恒常性定数の濃度の変化に反応する多感覚ニューロンが含まれています。 視床下部の核では、内部環境の状態が分析され、遠心性システムを通じて体のニーズに合わせて代謝の過程を適応させる制御信号が生成されます。
自律神経系の交感神経部門と副交感神経部門は、遠心性代謝調節システムのリンクとして使用されます。 神経終末から放出されるメディエーターは、組織の機能と代謝に直接的または間接的に影響を与えます。 視床下部の制御影響下で、内分泌系が位置し、代謝とエネルギーを調節するための遠心性システムとして使用されます。 視床下部、下垂体、その他の内分泌腺からのホルモンは、細胞の成長、生殖、分化、発達、その他の機能に直接影響を与えます。 ホルモンは、血液中のグルコース、遊離脂肪酸、ミネラルなどの物質の必要なレベルの維持に関与しています。
栄養素の化学エネルギーは ATP の再合成に使用され、細胞内で起こるあらゆる種類の仕事やプロセスを実行します。 したがって、代謝およびエネルギーに対する調節効果を発揮する最も重要なエフェクターは、臓器および組織の細胞です。 代謝調節には、細胞内で起こる生化学反応の速度に影響を与えることが含まれます。
細胞のタンパク質、脂肪、炭水化物の代謝の統合は、共通のエネルギー源を通じて行われます。 単純および複雑な有機化合物、高分子および超分子構造の生合成では、リン酸化プロセスにエネルギーを供給する ATP または他の酸化化合物の還元にエネルギーを供給する NAD H、NADP H が一般的なエネルギー源として使用されます。物質。
炭水化物の代謝
炭水化物代謝プロセスは肝細胞で活発に発生します。 肝臓はグリコーゲンの合成と分解を通じて、血液中のグルコース濃度を維持します。 食後、門脈血中のグルコース濃度が20 mmol/lに達すると、グリコーゲンの活発な合成が起こります。 肝臓のグリコーゲン貯蔵量は 30 ~ 100 g で、短期間の絶食中はグリコーゲン分解が起こりますが、長期絶食の場合、主な血糖源はアミノ酸とグリセロールからの糖新生です。
肝臓は糖の相互変換を実行します。 ヘキソース(フルクトース、ガラクトース)のグルコースへの変換。
ペントースリン酸経路の活発な反応により、ミクロソームの酸化とグルコースからの脂肪酸とコレステロールの合成に必要な NADPH が生成されます。
脂質代謝
食事中に、グリコーゲンの合成やその他の合成に使用されない過剰なグルコースが肝臓に入ると、コレステロールやトリアシルグリセロールなどの脂質に変換されます。 肝臓は TAG を保存できないため、超低密度リポタンパク質 (VLDL) を使用してタグを除去します。 コレステロールは主に胆汁酸の合成に使用され、低密度リポタンパク質 (LDL) および VLDL の組成にも含まれます。
絶食、長時間の筋肉運動、I型糖尿病、脂肪の多い食事など、特定の条件下では、ほとんどの組織で代替エネルギー源として使用されるケトン体の合成が肝臓で活性化されます。
タンパク質の代謝
1日に体内で合成されるタンパク質の半分以上は肝臓で発生します。 すべての肝臓タンパク質の更新速度は 7 日ですが、他の臓器ではこの値は 17 日以上に相当します。 これらには、肝細胞自体のタンパク質だけでなく、アルブミン、多くのグロブリン、血液酵素、フィブリノーゲンや血液凝固因子など、輸出されるタンパク質も含まれます。
アミノ酸は、アミノ基転移および脱アミノ化、脱炭酸反応を伴う異化反応を起こし、生体アミンが形成されます。 コリンとクレアチンの合成反応は、アデノシルメチオニンからのメチル基の移動により発生します。 肝臓は過剰な窒素を利用して尿素に取り込みます。
尿素合成の反応はトリカルボン酸回路と密接に関係しています。
"
肝臓は代謝の中心器官であり、代謝恒常性の維持に関与しており、タンパク質、脂肪、炭水化物の代謝反応に相互作用することができます。
炭水化物とタンパク質の代謝の「接続」部位は、トリカルボン酸回路からのピルビン酸、オキサロ酢酸、α-ケトグルタル酸であり、アミノ基転移反応でそれぞれアラニン、アスパラギン酸、グルタミン酸に変換されます。 アミノ酸をケト酸に変換するプロセスも同様に進行します。
炭水化物は脂質代謝とさらに密接に関係しています。
- ペントースリン酸経路で形成される NADPH 分子は、脂肪酸とコレステロールの合成に使用されます。
- リン酸グリセルアルデヒドこれもペントースリン酸経路で形成され、解糖系に含まれてジヒドロキシアセトンリン酸に変換されます。
- グリセロール-3-リン酸、ジオキシアセトンリン酸解糖から形成され、トリアシルグリセロールの合成のために送られます。 また、この目的のために、ペントースリン酸経路の構造再構成の段階で合成されるグリセルアルデヒド-3-リン酸を使用することができる。
- 「グルコース」と「アミノ酸」アセチル-SCoAは、脂肪酸とコレステロールの合成に関与することができます。
炭水化物の代謝
炭水化物代謝プロセスは肝細胞で活発に発生します。 肝臓はグリコーゲンの合成と分解を通じて、血液中のグルコース濃度を維持します。 アクティブ グリコーゲン合成食後、門脈血液中のグルコース濃度が20 mmol/lに達すると起こります。 肝臓のグリコーゲン貯蔵量は 30 ~ 100 g です。短期間の絶食では、 グリコーゲン分解、長期間の絶食の場合、血糖の主な供給源は次のとおりです。 糖新生アミノ酸とグリセロールから。
肝臓が実行します 相互変換糖類、つまり ヘキソース(フルクトース、ガラクトース)のグルコースへの変換。
活発な反応 ペントースリン酸経路ミクロソームの酸化とグルコースからの脂肪酸とコレステロールの合成に必要な NADPH の生成を提供します。
脂質代謝
食事中に、グリコーゲンの合成やその他の合成に使用されない過剰なグルコースが肝臓に入ると、脂質に変換されます。 コレステロールそして トリアシルグリセロール。 肝臓は TAG を保存できないため、非常に低密度のリポタンパク質を使用してタグを除去します ( VLDL)。 コレステロールは主に合成に使用されます 胆汁酸、低密度リポタンパク質にも含まれています( LDL) そして VLDL.
絶食、長時間の筋肉運動、I型糖尿病、脂肪の多い食事など、特定の条件下では、ほとんどの組織で代替エネルギー源として使用されるケトン体の合成が肝臓で活性化されます。
タンパク質の代謝
1日に体内で合成されるタンパク質の半分以上は肝臓で発生します。 すべての肝臓タンパク質の更新速度は 7 日ですが、他の臓器ではこの値は 17 日以上に相当します。 これらには、肝細胞自体のタンパク質だけでなく、「輸出」されるタンパク質も含まれており、これが「血液タンパク質」の概念を構成します。 アルブミン、 多くの グロブリン, 酵素血液も同様に フィブリノーゲンそして 凝固因子血。
アミノ酸アミノ基転移および脱アミノ化、脱炭酸反応による生体アミンの形成による異化反応を受けます。 合成反応が起こる コリンそして クレアチンアデノシルメチオニンからのメチル基の転移によるもの。 肝臓は過剰な窒素を利用して体内に取り込みます。 尿素.
尿素合成の反応はトリカルボン酸回路と密接に関係しています。

尿素合成とTCAサイクルの間の密接な相互作用
顔料交換
色素代謝における肝臓の関与は、疎水性ビリルビンの親水性形態への変換です。 直接ビリルビン)およびその胆汁への分泌。
色素代謝には交換も含まれます 腺鉄は体中の多数のヘムタンパク質の一部であるためです。 肝細胞にはタンパク質が含まれています フェリチン鉄貯蔵庫の役割を果たし、合成されます。 ヘプシジン、胃腸管での鉄の吸収を調節します。
代謝機能評価
臨床現場では、特定の機能を評価する方法があります。
炭水化物代謝への参加は次のように評価されます。
- による グルコース濃度血、
- 耐糖能試験曲線の傾きによって、
- その後の「糖」曲線に沿って
それなし タンパク質代謝への肝臓の関与体は数日しか生きられず、その後死に至ります。 タンパク質代謝における肝臓の最も重要な機能には次のものがあります。
1. アミノ酸の脱アミノ化。
2. 体液からの尿素の生成とアンモニアの抽出。
3. 血漿タンパク質の形成。
4. さまざまなアミノ酸の相互変換とアミノ酸からの他の化合物の合成。
予備 脱アミノ化アミノ酸は、エネルギーを獲得し、炭水化物や脂肪に変換する際に使用するために必要です。 体の他の組織、特に腎臓でも少量の脱アミノ化が起こりますが、これらのプロセスの重要性は肝臓でのアミノ酸の脱アミノ化に匹敵しません。
肝臓での尿素の形成体液からアンモニアを抽出するのに役立ちます。 アミノ酸の脱アミノ化中に大量のアンモニアが生成され、腸内の細菌によって追加量が継続的に生成され、血液に吸収されます。 これに関して、肝臓で尿素が生成されないと、血漿中のアンモニア濃度が急速に増加し始め、肝臓の昏睡や死につながります。 門脈と大静脈の間にシャントが形成されるために肝臓を通る血流が急激に減少する場合でも、血液中のアンモニア含有量が急激に増加し、中毒症の条件を作り出します。
全て 主要な血漿タンパク質一部のガンマグロブリンを除いて、肝細胞によって形成されます。 それらはすべての血漿タンパク質の約 90% を占めます。 残りのガンマ グロブリンは、主にリンパ組織の形質細胞によって産生される抗体です。 肝臓によるタンパク質生成の最大速度は 15 ~ 50 g/日であるため、体が血漿タンパク質の約半分を失っても、その量は 1 ~ 2 週間以内に回復できます。
それを考慮する必要があります 血漿タンパク質の減少血液は肝細胞の有糸分裂の急速な開始と肝臓のサイズの増加を引き起こします。 この効果は肝臓による血漿タンパク質の放出と組み合わされ、血液中のタンパク質の濃度が正常値に戻るまで続きます。 慢性肝疾患(肝硬変を含む)では、血液中のタンパク質、特にアルブミンのレベルが非常に低い値に低下し、全身性の浮腫や腹水を引き起こすことがあります。
中でも 重要な肝機能アミノ酸を含む化合物とともに特定のアミノ酸を合成する能力を指します。 たとえば、いわゆる非必須アミノ酸は肝臓で合成されます。 このような合成プロセスには、アミノ酸と同様の化学構造 (ケト位置の酸素を除く) を持つケト酸が含まれます。 アミノラジカルは、ナジック酸に存在するアミノ酸からケト酸に移動し、ケト位の酸素の位置に移動する、アミノ基転移のいくつかの段階を経ます。
子宮内の胎児が生後わずか数週間のとき、すでに造血と細胞内での赤血球の循環のプロセスが始まっています。 そして、発生の初期段階では、これらの機能は胃や心臓ではなく肝臓によって行われており、この臓器に解剖学的役割がいかに重要であるかが理解できます。
生化学
成人の体の肝腺の重量は1.2〜1.5 kgに達するため、その「肩」に数十の機能が割り当てられていることは驚くべきことではありません。 臓器の体積の 70% は水ですが、肝臓の生化学は非常に多様です。
- 乾燥残渣の 1/2 はタンパク質であり、その 90% はグロブリンです。
- 肝細胞の総質量の 5% が脂質に割り当てられています。
- 150 ~ 200 g はグリコーゲンの割合で、「雨の日」に備えたブドウ糖の貯蔵量を表します。
量的な意味では、肝臓の生化学は相対的な概念です。浮腫では水分量が 80% に増加し、脂肪性疾患では逆に 55% に減少します。 後者の場合、脂肪量が最大20%増加し、細胞の大幅な変性を伴う場合は最大50%増加する可能性があります。 グリコーゲンレベルの条件性を無視することはできません。グリコーゲンレベルは、重度の実質病変の場合には大幅に減少しますが、逆に、遺伝的病理であるグリコーゲン生成の場合には最大20%増加しますが、その有病率はわずか0.0014~0.0025%です。
バリア機能と解毒機能
肝臓は静脈と動脈から同時に血液を受け取る体内の唯一の腺であり、そのためフィルターの役割を果たします。 1時間に約100リットルの血液が通過するため、徹底的に洗浄する必要があります。 肝臓の中和抗毒性および保護機能は、次のタスクを実行することです。
- 食物、アルコール、薬剤によって体内に侵入する有毒物質を不活性化します。
- 赤血球、タンパク質などの生物学的分解生成物の除去。
- アンモニアと腸の機能中に生じる毒(フェノール、スカトール、インドール)の結合。
- 特別な細胞による病原性細菌の摂取と消化(食作用)。
- 化学変化による重金属の破壊と体からの除去。
体内に入るアミノ酸の体積の約 60% は最終的に肝臓に到達し、そこでタンパク質に合成されます。 残りは全身の血流に入ります。

肝臓のバリア機能は「隔離」と「絶対排除」の2段階に分かれています。 最初の段階では、物質の有害性の程度と最適な中和作用が決定されます。 たとえば、有毒なアンモニアは尿素に変換され、アルコールは酵素酸化後に酢酸に、インドール、フェノール、スカトールはエッセンシャルオイルに変換されます。 毒の中には体に有益な物質に変化するものもあります。
2 番目のグループには、「溶けた」、または食細胞によって捕捉された細菌とウイルスが含まれます。 また、肝臓の中和機能は、膵臓や生殖器系の過剰なホルモンを体から除去することを目的としています。
科学者らの計算によると、肝臓は1年で肺から吸い込まれた5kgの防腐剤、4kgの殺虫剤、2kgの重元素(樹脂)を人体から浄化する必要がある。
胆汁分泌
肝臓のもう 1 つの重要な機能は、1 日あたり約 0.5 ~ 1.2 リットルの胆汁の生成です。 97%が水分で構成されており、残りの3%はコレステロール、無機塩、脂肪酸、胆汁色素などの成分で構成されています。 胆汁(膀胱)の 30% のみが胆道の上皮細胞によって形成され、70%(肝臓)は肝細胞によって合成されます。 1 つ目は濃いオリーブ色で pH 6.5 ~ 7.5 の範囲の酸性度を持ち、2 つ目は琥珀色で pH 7.5 ~ 8.2 の酸性度を持ちます。 肝胆汁の一部はその後も胆管に入り、水の再吸収の影響を受けて嚢胞性胆汁に変わります。 したがって、肝不全の場合、患者の胆汁分泌が必然的に障害されることは明らかです。

胆汁酸の循環は消化管のすべての器官(腸、胃、膵臓など)の働きに影響を与えるため、消化における肝臓の主な役割はまさに胆嚢の働きを刺激することです。
交換プロセス
消化は、体内に入る微量元素の選択、それらの精製、変換、および体全体への分布が起こるプロセスです。 したがって、ヒト肝臓の消化機能は、代謝プロセスへの肝細胞の関与として理解できます。
グリコーゲン合成からなる肝臓の貯蔵機能は、血糖値の調節にも役割を果たします。
人間の肝臓の代謝機能の本質は、炭水化物、脂質、タンパク質、ホルモン、酵素、免疫グロブリンの最適なバランスを常に維持することです。 肝細胞はホルモンのチロキシンを活性型に変換するため、甲状腺の機能との明らかな関係があります。 鉄分はインスリン、アドレナリン、エストロゲンの処理に関与しているため、栄養不足やウイルス、アルコール、薬物の形での日々の攻撃によるヘモグロビンの不足は、肝臓の代謝機能に悪影響を及ぼします。

炭水化物、脂肪、タンパク質のレベルを制御する膵臓の状態は、肝細胞の働きにおいて非常に重要です。 したがって、炭水化物が過剰になると脂肪の合成が増加し、逆に炭水化物が不足すると脂質とタンパク質からブドウ糖が生成されます。 肝細胞がグリコーゲンで完全に満たされている場合、グルコースが脂肪に直接変換されることはほとんどありません。 色素代謝における肝臓の役割は胆嚢の働きと関連しています。胆汁分泌が障害されると停滞が始まり、その結果、蓄積したビリルビンが血流を通って臓器に運ばれ、全身に有毒な影響を及ぼします。
肝細胞は他の臓器よりも 30 ~ 60% 多くのタンパク質を蓄えているため、血液の貯蔵庫です。 肝臓は、赤血球、グルコース、デンプンを貯蔵することにより、重篤な失血の場合に体にエネルギーと強さを与える能力を持っています。
その他の機能
人体における肝臓の役割が、心臓や脳の正常な機能の重要性に匹敵することは明らかです。 脾臓と胆嚢がなくても大丈夫ですが、肝臓がなければ大丈夫ではありません。 肝臓には合計で数十の主要な機能がありますが、科学者たちはこの臓器に関する新しい事実を毎年発見しています。 バリア機能、消化機能、代謝機能に加えて、次のタスクも実行します。
体内の肝臓のこれらすべての機能は同様に重要ですが、造血のプロセスへの参加は胚発生の段階でのみ観察されます。 その後、形成された消化器系のおかげでこの仕事は胃に移され、肝細胞はすでに形成された赤血球の洗浄に従事しています。 正常な肝臓の 25% の割合でも臓器が再生するには十分であるという証拠がありますが、実際の修復は起こらず、肝臓の増加は残りの肝細胞の量の増加と結合細胞の成長によって行われます。組織。 したがって、肝臓は病原性微生物や毒素と毎日戦っているため、アルコールや樹脂で肝臓を殺す必要はありません。
ダイエットその5

病気の肝臓の食事は、胃腸管に化学的、熱的、機械的刺激を引き起こさない食品で構成されます。
肝臓病の治療には薬物療法だけでなく、特別な食事療法も含まれます。 適切な栄養補給は患者の回復の前提条件です。
- 適応症
- ダイエットその5の特徴
- 食事療法の期間
- 許可されている製品と禁止されている製品
- 化学組成
治療用栄養の特徴は、病人に役立つ製品の選択だけでなく、それらの適切な準備にもあります。 さらに、規則正しい食事と摂取する食品の温度も重要です。
適応症
肝臓を治療し、浄化するために、読者はエレナ・マリシェバの方法をうまく活用しています。 この方法を慎重に研究した結果、私たちはそれを皆さんに紹介することにしました。 
ダイエット No. 5 は、栄養士の M.I. ペブズナーによって開発されました。 現在、医療ではこの専門家によって開発された 15 のプログラムが使用されています。 これらのプログラムにはそれぞれ独自のシリアル番号があります。 患者が特定の病気に罹患しているかどうかに応じて、医師は適切な表を処方します。
食事療法 5 は、肝臓および胆道の病気に処方されます。 次の場合に表示されます。
- 胆石。
- 膵炎。
- 胆嚢炎。
- その他の肝臓疾患。
食事 5 は、肝硬変や肝炎、膵臓の病変にも効果があります。 この治療食は、急性および慢性の両方で発生する肝炎に処方されます。
肝臓のための食事メニュー 5 を含む健康的で優しい食事のおかげで、患者は徐々に胆汁分泌の改善を経験し、肝機能と胆道の機能が回復します。
ダイエットその5の特徴
エレナ・ニコラエバ博士、肝臓学者、准教授:「即効性があり、肝臓に特異的に作用して病気を無効にするハーブがあります。 […]個人的に、私は必要な抽出物をすべて含む唯一の薬を知っています…」 
確立された食事療法は、体に必要な物質を提供し、エネルギーを節約し、影響を受けた臓器の機能を正常化するのに役立ちます。
胃腸管は炎症過程にも関与していることが多いため、患者が摂取する食物は、胃腸管に化学的、熱的、機械的刺激を引き起こしてはなりません。
肝疾患のために消費される製品には以下が含まれていてはなりません:
- コレステロール。
- 膨満感を引き起こす物質。
- 飽和脂肪酸。
- 大量の抽出物。
- 塩がたっぷり。
食事療法の期間
私はおそらく、肝臓病によるほぼすべての症状に耐えなければならなかった「幸運な」人の一人でした。 私にとって、病気の説明をすべての詳細とすべてのニュアンスを含めて編集することができました。
食事療法に切り替える前に、患者は医師が提案したレジメンに従って5日間食事をする試用期間を受けます。 この期間中に患者の体が新しい食事を正常に認識した場合、さらに5週間はそれを守り続けます。 必要に応じて、患者が完全に回復するまで食事番号 5 を延長することができます。
食事番号 5 は、非常に長い間、肝臓や膵臓の病気によく使用されてきました。 したがって、一部の患者には、1年半以上穏やかな食事を続けるようアドバイスされる場合があります。 食事療法の拡張は医師の同意がある場合にのみ行われます。
肝臓病の悪化段階が始まる期間中、医師は患者をより優しい食べ物を食べることを含む食事療法5aに移行させることができます。
許可されている製品と禁止されている製品
薬で体を壊さないでください! 科学と伝統医学の交差点で、高価な薬を使わずに肝臓を治療できる
肝臓病の食事表は以下の表に従って作成されています。
| 製品 | できる | 禁止されています |
| 小麦粉 | 古くなった小麦またはライ麦パン、リンゴ、魚、肉、カッテージチーズを入れた焼きパイ | 焼きたてのお菓子、マフィン、揚げ菓子、パイ生地 |
| 肉 | 筋を含まない赤身の肉、ウサギ、子羊肉、牛肉、茹でたソーセージ、七面鳥 | 脂肪の多い肉、家禽の皮、レバー、腎臓、燻製製品、アヒル、ガチョウ、脳 |
| 魚 | 低脂肪の煮物または焼き物 | 脂肪分、塩分、燻製、缶詰食品 |
| お食い初め | パスタ入りミルクスープ、野菜スープ | 肉、魚、キノコのスープ、オクローシカ |
| 乳製品 | 低脂肪乳、ケフィア、カッテージチーズ、サワークリーム、ヨーグルト | 全脂肪乳、ケフィア、カッテージチーズ、発酵ベークミルク、サワークリーム、塩味の脂肪カッテージチーズ、クリーム |
| 野菜 | 生、ゆで、煮込み野菜、酸っぱいザワークラウト | スイバ、ネギ、大根、ほうれん草、ニンニク、キノコ |
| お菓子とフルーツ | すべてのベリーとフルーツ、ゼリー、ドライフルーツ、ジャム、マシュマロ、マーマレード、チョコレートを含まないキャンディー、蜂蜜 | アイスクリーム、チョコレート、クリームケーキ |
| 飲料 | フルーツジュース、ミルク入りコーヒー、紅茶、ローズヒップ煎じ薬 | 紅茶、ココア、冷たい飲み物、アルコール |
ダイエット中は、次のルールを遵守する必要があります。
- 患者は茹でたもの、蒸したもの、またはオーブンで調理した食べ物のみを許可されています。
- 最初の食事は、空腹時に水分を摂取してから 1 ~ 2 時間後に摂取されます。
- 筋のある肉や繊維の多い野菜はザルなどで濾すようにしましょう。
- 合格した野菜と小麦粉は食事から完全に除外されます。
- 食事は頻繁に少量ずつとるべきです。
- メニューにはタンパク質を多く含む必要がありますが、脂肪と炭水化物の量は最小限に抑える必要があります。
- 食器は20℃以上、52℃以下に加熱した場合にのみ摂取できます。
- 肝臓病に苦しむ患者は空腹を感じさせてはなりません。
化学組成
肝臓のための食事番号 5 の化学組成は次のとおりです。
- タンパク質120g、そのうち動物性タンパク質60g。
- 砂糖を含む炭水化物140 g(1日の摂取量は70 gを超えてはなりません)。
- 最大90%が脂肪で、そのうち40%は植物由来である必要があります。
- 塩分は10g以下。 患者が浮腫に苦しんでいる場合は、塩分を完全に排除するか、その量を1日あたり5 gに減らします。
- 少なくとも1.5〜2リットルの液体。
一日の食事のエネルギー値は約2500kcalです。
肝臓の食事療法には、患者の責任ある態度と規律が必要です。 製品を選択するときは、治療食について覚えておく必要があります。その正しい遵守が、患者の全身状態の迅速な回復と改善の鍵です。
肝機能:人体における主な役割、そのリストと特徴
肝臓は消化器系の腹部腺器官です。 それは腹部の右上象限の横隔膜の下に位置します。 肝臓は、他のほぼすべての臓器を多かれ少なかれサポートする重要な臓器です。
肝臓は体の中で 2 番目に大きな臓器 (最も大きな臓器は皮膚) で、重さは約 1.4 kg です。 4つの葉があり、非常に柔らかい構造で、色はピンクがかった茶色です。 いくつかの胆管も含まれています。 この記事では重要な肝機能について説明します。
肝臓の生理学
人間の肝臓の発達は妊娠 3 週目に始まり、15 歳までに成熟した構造に達します。 9週目頃には相対的に最大のサイズ(胎児の体重の10%)に達します。 これは健康な新生児の体重の約5%に相当します。 肝臓は成人の体重の約2%を占めます。 重さは成人女性で約1400g、男性で約1800gです。
それはほぼ完全に胸の後ろに位置しますが、吸気中に下端が右肋骨弓に沿って感じることができます。 グリソン嚢と呼ばれる結合組織の層が肝臓の表面を覆っています。 カプセルは、肝臓内の最小の血管を除くすべての血管に広がります。 鎌状靱帯は肝臓を腹壁と横隔膜に付着させ、肝臓を大きな右葉と小さな左葉に分割します。
1957 年、フランスの外科医クロード・クノーは 8 つの肝臓セグメントについて説明しました。 それ以来、X 線写真の研究により、血液供給の分布に基づいて平均 20 のセグメントが記述されています。 各セグメントには独自の独立した血管枝があります。 肝臓の排泄機能は胆汁の枝によって代表されます。
肝葉のそれぞれは何を担っているのでしょうか? それらは末梢の動脈、静脈、胆管に役立ちます。 人間の肝臓の小葉には、一方の小葉と他方の小葉を隔てる小さな結合組織があります。 結合組織が不十分であると、門脈路と個々の小葉の境界を決定することが困難になります。 中心静脈は、その内腔が大きいことと、門脈三管を包む結合組織がないため、識別が容易です。
- 人体における肝臓の役割は多岐にわたり、500以上の機能を果たします。
- 血糖値やその他の化学物質のレベルを維持するのに役立ちます。
- 胆汁分泌は消化と解毒に重要な役割を果たします。
肝臓は多くの機能を備えているため、急速な損傷を受けやすいです。
肝臓はどのような機能を果たしていますか?
肝臓は、簡単に言うと、体の機能、解毒、代謝(グリコーゲン貯蔵の調節を含む)、ホルモン調節、タンパク質合成、赤血球の分解と分解において重要な役割を果たしています。 肝臓の主な機能は、脂肪を分解して消化しやすくする化学物質である胆汁を生成することです。 血漿のいくつかの重要な要素の生成と合成を実行し、ビタミン (特に A、D、E、K、B-12) や鉄などのいくつかの重要な栄養素も貯蔵します。 肝臓の次の機能は、単糖グルコースを貯蔵し、血糖値が低下した場合に有用なグルコースに変換することです。 肝臓の最もよく知られた機能の 1 つは、アルコールや薬物などの有毒物質を血液から除去する解毒システムとしての機能です。 また、ヘモグロビン、インスリンを破壊し、ホルモンレベルのバランスを維持します。 さらに、古い血球を破壊します。
肝臓は人体の中で他にどのような機能を果たしていますか? 肝臓は健康な代謝機能に不可欠です。 炭水化物、脂質、タンパク質をブドウ糖、コレステロール、リン脂質、リポタンパク質などの有用な物質に変換し、全身のさまざまな細胞で利用されます。 肝臓はタンパク質の不要な部分を分解し、それらをアンモニア、そして最終的には尿素に変換します。
交換
肝臓の代謝機能とは何ですか? 重要な代謝器官であり、その代謝機能はインスリンや他の代謝ホルモンによって制御されています。 グルコースは細胞質での解糖によってピルビン酸に変換され、その後ピルビン酸はミトコンドリアで酸化されて、TCAサイクルと酸化的リン酸化によってATPを生成します。 この状態では、解糖生成物は脂質生成による脂肪酸の合成に使用されます。 長鎖脂肪酸は、肝細胞のトリアシルグリセロール、リン脂質、および/またはコレステロールエステルに組み込まれます。 これらの複合脂質は、脂肪滴および膜構造内に貯蔵されるか、低密度リポタンパク質粒子として循環中に分泌されます。 絶食状態では、肝臓はグリコーゲン分解および糖新生を通じてグルコースを放出する傾向があります。 短期間の絶食中は、肝臓の糖新生が内因性グルコース産生の主な供給源となります。
また、絶食は脂肪組織の脂肪分解を促進し、非エステル化脂肪酸の放出を引き起こします。これは、β酸化とケトン生成にもかかわらず、肝臓のミトコンドリアでケトン体に変換されます。 ケトン体は肝臓外組織に代謝燃料を提供します。 人間の解剖学的構造に基づいて、肝臓のエネルギー代謝は神経信号とホルモン信号によって厳密に制御されています。 交感神経系は代謝を刺激しますが、副交感神経系は肝臓の糖新生を抑制します。 インスリンは解糖と脂質生成を刺激しますが、糖新生を阻害し、グルカゴンはインスリンの作用に反対します。 CREB、FOXO1、ChREBP、SREBP、PGC-1α、CRTC2 などの複数の転写因子および転写活性化因子は、代謝経路の重要なステップを触媒する酵素の発現を制御し、それによって肝臓のエネルギー代謝を制御します。 肝臓のエネルギー代謝の異常は、インスリン抵抗性、糖尿病、非アルコール性脂肪肝疾患の一因となります。
保護
肝臓のバリア機能は、門脈と体循環の間を保護することです。 細網内皮系では、感染に対する効果的な障壁となります。 また、非常に変化しやすい腸内容物と門脈血の間の代謝バッファーとしても機能し、全身循環を厳密に制御します。 肝臓は、グルコース、脂肪、アミノ酸を吸収、貯蔵、放出することにより、恒常性において重要な役割を果たします。 また、ビタミンA、D、B12を貯蔵および放出します。 薬物や細菌毒素など、腸から吸収されるほとんどの生物学的に活性な化合物を代謝または解毒します。 肝動脈から全身血液を投与する場合と同じ機能の多くを実行し、心拍出量の合計 29% を処理します。
肝臓の保護機能は、血液から有害な物質 (アンモニアや毒素など) を除去し、それらを中和するか、害の少ない化合物に変換することです。 さらに、肝臓はほとんどのホルモンを変換し、多かれ少なかれ活性のある他の生成物に変えます。 肝臓のバリアの役割は、血液から細菌やその他の異物を吸収するクッパー細胞によって代表されます。
合成と切断
ほとんどの血漿タンパク質は肝臓によって合成および分泌され、その中で最も豊富に含まれるのはアルブミンです。 その合成および分泌のメカニズムは、最近より詳細に示されています。 ポリペプチド鎖の合成は、最初のアミノ酸がメチオニンである遊離ポリリボソーム上で開始されます。 生成されるタンパク質の次のセグメントには疎水性アミノ酸が豊富に含まれており、これはアルブミン合成ポリリボソームの小胞膜への結合を媒介すると考えられます。 プレプロアルブミンと呼ばれるアルブミンは、顆粒小胞体の内部に輸送されます。 プレプロアルブミンは、N 末端から 18 アミノ酸の加水分解切断によってプロアルブミンに還元されます。 プロアルブミンはゴルジ体に輸送されます。 最後に、さらに 6 個の N 末端アミノ酸が除去されて、血流に分泌される直前にアルブミンに変換されます。
体内の肝臓の代謝機能の一部はタンパク質合成です。 肝臓はさまざまなタンパク質を担っています。 肝臓によって産生される内分泌タンパク質には、アンギオテンシノーゲン、トロンボポエチン、インスリン様成長因子 I などがあります。小児では、肝臓は主にヘム合成を担当します。 成人では、骨髄はヘム生成装置ではありません。 ただし、成人の肝臓はヘム合成の 20% を実行します。 肝臓は、ほぼすべての血漿タンパク質(アルブミン、α-1-酸性糖タンパク質、ほとんどの凝固カスケードおよび線溶経路)の生成において重要な役割を果たしています。 注目すべき例外: ガンマグロブリン、第 III 因子、第 IV 因子、第 VIII 因子。 肝臓によって生成されるタンパク質: プロテイン S、プロテイン C、プロテイン Z、プラスミノーゲン アクチベーター阻害剤、アンチトロンビン III。 肝臓によって合成されるビタミン K 依存性タンパク質には、第 II 因子、第 VII 因子、第 IX 因子、および第 X 因子、プロテイン S および C が含まれます。
内分泌
肝臓は毎日約 800 ~ 1000 ml の胆汁を分泌します。胆汁には食事中の脂肪の消化に必要な胆汁酸塩が含まれています。
胆汁は、特定の代謝老廃物、薬物、有毒物質を排泄するための媒体でもあります。 肝臓から、一連のチャネルによって胆汁が総胆管に運ばれ、胆汁は小腸の十二指腸に流れ込み、胆嚢に接続され、胆汁はそこで濃縮されて保存されます。 十二指腸に脂肪が存在すると、胆嚢から小腸への胆汁の流れが刺激されます。
人間の肝臓の内分泌機能には、非常に重要なホルモンの生成が含まれます。
- インスリン様成長因子 1 (IGF-1)。 下垂体から放出される成長ホルモンは肝細胞上の受容体に結合し、肝細胞に IGF-1 を合成させ、放出させます。 IGF-1 はインスリン受容体に結合し、体の成長も刺激するため、インスリン様の効果があります。 ほぼすべての細胞タイプが IGF-1 に応答します。
- アンジオテンシン。 これはアンジオテンシン 1 の前駆体であり、レニン-アンジオテンシン-アルドステロン系の一部です。 それはレニンによってアンジオテンシンに変換され、次に、低血圧時に血圧を上昇させるように作用する他の基質に変換されます。
- トロンボポエチン。 負のフィードバック システムは、このホルモンを適切なレベルに維持するために機能します。 骨髄前駆細胞が血小板の前駆体である巨核球に成長できるようにします。
造血
肝臓は造血の過程でどのような機能を果たしますか? 哺乳動物では、肝臓前駆細胞が周囲の間葉に侵入するとすぐに、胎児肝臓に造血前駆細胞が定着し、一時的に主要な造血器官になります。 この分野の研究では、未熟な肝前駆細胞が造血をサポートする環境を生成できることが示されています。 しかし、肝臓前駆細胞が成熟するように誘導されると、胎児肝臓から成人骨髄への造血幹細胞の移動と一致して、結果として生じる細胞は血球の発達をサポートできなくなります。 これらの研究は、胎児肝臓内の血液と実質の区画の間には、肝形成と造血の両方のタイミングを制御する動的な相互作用が存在することを示しています。
免疫学的
肝臓は重要な免疫学的器官であり、循環抗原や腸内細菌叢からの内毒素にさらされる機会が多く、特に自然免疫細胞 (マクロファージ、自然リンパ球、粘膜関連不変 T 細胞) が豊富に含まれています。 ホメオスタシスでは、多くのメカニズムにより免疫応答が抑制され、依存症 (耐性) が引き起こされます。 耐性は、肝向性ウイルスの慢性持続または肝移植後の同種移植片の摂取にも関連します。 肝臓の解毒機能は、感染症や組織損傷に反応して免疫系を迅速に活性化します。 ウイルス性肝炎、胆汁うっ滞、非アルコール性脂肪性肝炎などの基礎となる肝疾患に応じて、免疫細胞の活性化を仲介するトリガーが異なります。
分子危険パターン、トール様受容体シグナル伝達、インフラマソーム活性化などの保存されたメカニズムにより、肝臓で炎症反応が開始されます。 肝セルロースおよびクッパー細胞の興奮性活性化により、ケモカインを介した好中球、単球、ナチュラルキラー (NK) 細胞、およびナチュラルキラー T (NKT) 細胞の浸潤が引き起こされます。 線維症に対する肝内免疫応答の最終的な結果は、マクロファージと樹状細胞の機能的多様性に依存しますが、炎症促進性 T 細胞集団と抗炎症性 T 細胞集団の間のバランスにも依存します。 医学の目覚ましい進歩により、恒常性から疾患に至るまで肝臓における免疫応答の微調整が理解されるようになり、急性および慢性肝疾患の将来の治療の有望な標的が示されました。
ビデオ
肝臓の構造と機能。
タンパク質代謝に関する肝臓の最も重要な機能の 1 つは、門脈を通って血液とともに腸から肝臓に送られるアミノ酸からの尿素の形成 (尿素生成) です。 肝臓における尿素の形成には、アミノ酸からアンモニアが除去されることによるアミノ酸の脱アミノ化が含まれ、そこに二酸化炭素が加えられることで尿素が形成されます。
アルブミンは浸透圧を維持し、ビリルビンやウロビリンなどの親水性物質に結合して輸送します。 主に細網内皮系で産生されるグロブリンは、a1-、a2-、b-、および y-グロブリンという個別のサブフラクションに分類されます。 ショウブグロブリンは、血液脂質と糖タンパク質のキャリアです。 α-グロブリンは脂溶性ビタミン、ホルモン、銅を輸送します。 β-グロブリンは鉄、リン脂質、ビタミン、ホルモンを輸送します。 γ-グロブリンは抗体のキャリアです。 フィブリノーゲンとプロトロンビンは血液凝固プロセスに関与します。
1. 血清中の総タンパク質量の測定。 血清中の総タンパク質を測定するために、さまざまな方法が提案されています。 最も一般的に使用される方法の 1 つは屈折率測定法です。 この目的のために、屈折計という装置が使用されます。この装置は、検査対象の液体中のタンパク質の量に応じて光線の屈折角を変化させることに基づいています。 屈折計の指示計のタンパク質量への換算は、特別な表に従って行われます。
健康な人では、血清中の総タンパク質の含有量は6〜8 g%、アルブミン - 4.6〜6.5 g%、グロブリン - 1.2〜2.3 g%、フィブリノーゲン - 0.2〜0.4 g%の範囲です。 アルブミン-グロブリン比 (A/G) は 1.5 ~ 2.4 の範囲です。
2. 紙電気泳動によるタンパク質画分の測定。 この方法の原理は以下の通りである。 特別なチャンバー内で、血清または血漿を一滴垂らし、電解質で湿らせた紙テープに電流を流すと、電位の差とタンパク質分子のサイズに応じてタンパク質画分が分離されます。 。 この方法を使用すると、血清および血漿中のアルブミン、α-、α2-、β-およびγ-グロブリン、さらにはフィブリノーゲンの量を測定することができます。
健康な人では、紙上の電気泳動によって測定されたタンパク質画分の相対含有量は次のとおりです: アルブミン%、α1-グロブリン 3 ~ 6%、α2-グロブリン 7 ~ 10%、β-グロブリン%、γ-グロブリン%。
肝疾患では、タンパク質の総量はほとんど変化しません。 長期にわたる慢性疾患、特に肝硬変の場合にのみ、低タンパク質血症(タンパク質の総量の減少)が観察されます。 炎症性肝疾患である肝炎では、アルブミン量が中程度に減少し、γ-グロブリンが増加します。 肝硬変では、アルブミン量が大幅に減少し、γ-グロブリンが顕著に増加します。 閉塞性黄疸では、アルブミン量が減少し、α2、β、γ グロブリンが中程度増加します。
3. 血液中のフィブリノーゲンおよびプロトロンビンの含有量の測定。通常、肝臓実質の損傷(肝炎、肝硬変)、特に急性の場合には減少します。 これらの病変では、血中のプロトロンビンのレベルが低下する可能性があり、ビタミン K (通常、肝臓でのプロトロンビンの合成を促進します) を投与した後でも増加しません。閉塞性黄疸では、ビタミン K の投与後に血中のプロトロンビンのレベルが上昇します。ビタミンKの投与。
4. 堆積物サンプル。 これらには、Takata-Ara テスト (フクシンスレム テスト)、ホルモール テスト、ベルトマン凝固テスト、チモール テストなどが含まれます。 これらの検査の本質は、肝実質に損傷のある患者の血清に特定の物質が添加されると、血清が濁るということですが、これは健康な人には起こらないことです。 この濁りの原因は、タンパク質代謝に関連した肝機能障害の結果として、血液タンパク質の細かいものと粗いものとの正常な関係が崩れることです。 これらのテストの手順は、実験室技術に関する特別なマニュアルに記載されています。
脂質代謝に関連した肝機能を研究するには、血中のコレステロール量を測定します。 通常、これは mg% に相当します。 閉塞性黄疸では、コレステロール量は正常のままであるか、増加することさえありますが、肝実質性黄疸では、肝実質がコレステロールの合成に大きな役割を果たしているため、コレステロール量は減少することがよくあります。
脂質代謝における肝臓の役割はコレステロール合成に限定されません。 肝臓はコレステロールを分解して放出するとともに、リン脂質や中性脂肪を合成します。 血液中のコレステロールの 60 ~ 75% はエステルの形であり、残りのコレステロールは遊離の状態です。 したがって、脂質代謝における肝臓の役割を判断するには、総コレステロール量を測定するだけでなく、遊離コレステロールとエステル化コレステロールを分離して測定することも重要です。 ほとんどの脂質はタンパク質と脂質の複合体の一部として血液中に存在することにも注意してください。 これらにはリポタンパク質画分が含まれ、その量的比率は電気泳動によって決定されます。 リポタンパク質は肝臓で合成され、肝細胞によって血液中に放出されます。 肝疾患では、エステル化コレステロールの割合が減少し、場合によってはリポタンパク質画分の比率が変化します。 しかし、脂肪代謝の障害は重度のびまん性肝障害の場合にのみ観察され、脂肪代謝指標の決定が難しいため、臨床では広く使用されていません。
肝臓の中和機能を研究するために、Kwik-Pytel 検査が普及しています。 これは、馬尿酸が正常な肝臓で安息香酸とアミノ酸のグリココから合成されるという事実に基づいています。 サンプルは次のように実行されます。 検査日の朝、患者は朝食(バターを塗ったパン100gと砂糖を入れた紅茶1杯)を食べます。 1 時間後、彼は膀胱をいっぱいまで空にし、コップ半分の水に 6 g の安息香酸ナトリウムを溶かしたものを飲みます。 次に、患者が 4 時間で排泄したすべての尿が収集されます (この間、患者は飲酒しません)。 排泄された尿の量を測定し、150mlを超える場合は、氷酢酸を数滴加え、150mlになるまで蒸発させます。 この後、尿を化学ビーカーに注ぎ、NaClを尿100mlごとに30gの割合で加え、塩が完全に溶解するまで加熱します。 15〜20℃に冷却した後、H 2 SO 4 の10規定溶液1〜2mlを加えると、馬尿酸の結晶が沈殿する。 結晶化を促進するために、液体を撹拌します。 次に、尿は氷または冷水で冷却され、小さなフィルターでろ過されます。 沈殿物は、洗浄水に H2SO4 が完全になくなるまで洗浄されます。これは、BaCl2 を含むサンプルによって証明されます。 フィルターを備えた漏斗を、馬尿酸が沈殿しているのと同じガラスに下げ、そこに熱湯100mlを注ぎ、沈殿物全体が溶解するように壁に沿ってピペッティングします。 この後、指示薬としてフェノールフタレイン溶液を数滴加え、加熱した半規定水酸化ナトリウム溶液で滴定します。
計算は次のように行う。 0.5規定の水酸化ナトリウム溶液1mlは0.5規定の安息香酸ナトリウム溶液1mlに相当し、後者1mlは馬尿酸0.072gに相当します。 したがって、0.5規定の水酸化ナトリウム溶液のミリリットル数に0.072を掛けると、馬尿酸の量がグラム単位で求められます。 馬尿酸 0.15 g が水 150 μl に溶けずに残るため、この数値を馬尿酸の計算量に加算する必要があります。 通常、健康な人は安息香酸ナトリウムを 6 g 摂取すると、4 時間で 3 ~ 3.5 g の馬尿酸を分泌します。 分泌量が少ない場合は、肝臓の合成(中和)機能が低下していることを示します。
尿にタンパク質が含まれている場合は、まずタンパク質を除去する必要があります。
肝臓の排泄機能を研究するには、肝臓で吸着され、胆汁とともに十二指腸に排泄されるビリルビンとさまざまな色素を負荷した検査が行われます。
ビリルビン検査 (バーグマンとエルボットによる)。
被験者には、10 cm3 のソーダ溶液に溶かした 0.15 g のビリルビンが静脈内注射され、3 時間後に血液のビリルビン含有量が検査されます。 通常、血液中のビリルビンのレベルは正常のままです。 一部の肝疾患では、高ビリルビン血症が検出されます。これは、肝細胞が血液からビリルビンを分泌する能力の低下を示します。 この検査を使用すると、負荷のない血液中のビリルビンのレベルが正常であることが判明した場合でも、この肝機能の違反を検出できます。
肝臓の水分調節機能を研究するには、水分負荷試験が使用されます。 患者は900mlの薄茶を6時間摂取します(1時間ごとに150ml)。 水分を摂取する前に、必ず膀胱を空にします。 総利尿が測定されます。 健康な人の場合、飲酒した水分は 6 時間以内に排出されますが、心不全や腎不全を除けば、体液貯留は肝障害を示します。
肝臓の酵素活性は、血清中のさまざまな酵素の活性を測定することによって研究されます。 この目的のために、比色法と分光測光法が使用されます。 これらの方法は、特定の実験室マニュアルに記載されています。
肝疾患の重要な診断価値は、細胞酵素であるトランスアミナーゼ (アミノトランスフェラーゼ) とアルドラーゼの活性の増加です。 トランスアミナーゼの中で最も重要なのは、グルタミノオキサロ酢酸トランスアミナーゼおよびグルタミノピルビン酸トランスアミナーゼの活性の測定です。
通常、グルタミノオキサロ酢酸トランスアミナーゼの活性は12から40ユニット(平均25ユニット)、グルタミノピルビン酸トランスアミナーゼは10から36ユニット(平均21ユニット)、アルドラーゼは5から8ユニットの範囲にあります。
トランスアミナーゼとアルドラーゼは肝細胞と心筋に大量に存在します。 これらの臓器が損傷すると(肝炎、心筋梗塞)、これらの酵素が大量に血液に入ります。 したがって、ボトキン病では、黄疸が出現する前であっても、また黄疸症状の場合でも、トランスアミナーゼとアルドラーゼの活性が大幅に増加します。 機械的黄疸および溶血性黄疸では、これらの酵素の活性は正常か、わずかに増加します。
肝臓疾患中の肝臓実質の変化をより詳細に研究するには、肝臓穿刺が実行され、続いて肝臓穿刺の細胞学的検査が行われます。 この方法は、肝臓がんの診断に特に価値があります。 ただし、合併症(出血、感染、胆嚢の穿刺など)の可能性があるため、穿刺は正確な診断を確立することが著しく困難な場合にのみ適応されます。
肝臓の穿刺は、滅菌して脱水した 2 ~ 5 グラムの注射器に取り付けられた静脈針を使用して行われます。 まず、肝臓を注意深く触診して、穿刺部位を特定します。 肝臓がびまん性に変化している場合、臓器のどこにでも穿刺が行われますが、特定の場所にのみ変化が疑われる場合には、その領域に穿刺が行われます。 肝臓が肋骨弓の下から突き出ていない場合、またはわずかに突き出ている場合は、右中間腋窩線に沿ってIX-X肋間腔に穿刺します。
注射器内に血液の最初の滴が現れたら、針を抜きます。 注射器のプランジャーで針の内容物をスライドガラス上に吹き飛ばし、塗抹標本を作成します。 塗抹標本はロマノフスキーに従って染色され、顕微鏡で検査されます。
組織片を取得するには、弁の役割をする特殊なロッドを備えた長さ 7 cm、直径 1.2 mm のメンギーニ針を使用して肝臓の穿刺生検が行われます。 針はゴムチューブを介して、3 mg の生理食塩水を含む 10 グラムの注射器に接続されます。 生理食塩水は肝臓組織をより簡単に取得するのに役立ち、針を使用すると円筒状の部分が確実に取得されます。
肝炎や肝硬変では、塗抹標本により肝細胞の異栄養性変化や間葉系要素の存在が明らかになります。 肝臓がんの場合 - 非定型がん細胞。
肝臓の腹腔鏡検査。 肝臓や胆道の病気を診断する際の重要な研究方法は、腹腔鏡検査法、つまり腹腔とその中にある臓器の検査です。 腹腔鏡検査を行うには、気腹を適用した後に腹腔内に挿入される特別な装置である腹腔鏡が使用されます。 腹腔鏡の光学管を通して腹部臓器を検査し、写真撮影します。 肝臓を検査することで、肝臓の大きさ、色、表面の性質、前縁の状態、硬さを判断することができます。 肝臓の針生検は、腹腔鏡を介して実行できます。
肝臓スキャン。 最近、さまざまな臓器を研究するための放射性同位元素法が臨床現場に導入され始めています。 これらの方法の 1 つはスキャン方法です。これは、研究対象のさまざまな点での放射能レベルの自動トポグラフィー記録です。
スキャン装置 (スキャナー) は、高感度のガンマ線トポグラフです。 その主なコンポーネントは次のとおりです。 ガンマ線を記録するシンチレーション センサー。 放射性放射線を電気インパルスのエネルギーに変換し、研究対象上で特定の軌道に沿って自動的に移動する検出器。 研究対象の物体の線画像を生成する記録装置。
肝臓スキャンは、ヨウ素 131 で標識されたローズベンガルの色素溶液、または金 198 同位体のコロイド溶液を使用して実行されます。 ローズベンガルは肝実質細胞に選択的に蓄積し、胆汁によって腸に放出されます。 金198は主に肝臓のクッパー細胞に蓄積し、そこからは実質的に排泄されません。 これらの溶液の 1 つが 200 マイクロキュリーの用量で静脈内投与され、1 分後に研究が始まります。
通常、スキャノグラムでは、肝臓は肋骨弓の下から突き出ておらず、その輪郭は滑らかで、その構成は変化しておらず、陰影の分布は均一で、肝臓の端では強度が低くなります。それらは中心部よりも少ないです。
肝臓疾患の場合、スキャングラムには、肝臓の境界の変化、陰影のびまん性の弱まり(慢性肝炎の場合)、陰影の強度の不均一(肝硬変の場合)、肝疾患による特定の領域の陰影の欠如が示されます。放射性指標(癌、エキノコックス、膿瘍など)の吸収の欠陥。
人間の肝臓
肝臓は横隔膜の下の右季肋部にあります。
下面には肝臓の門があり、肝動脈、門脈と肝静脈、胆管、リンパ管が区別できます。
肝臓の構造成分は、実質細胞(肝細胞)、胆管上皮、細網内皮系の細胞、肝被膜を形成する結合組織です。
肝臓の主要な構造単位は肝細胞です。 肝細胞は臓器の総質量の 60% 以上を占めます。 肝実質の 20% は内皮細胞です。 残りの20%は間質(管の細胞、結合組織など)で占められています。 肝細胞の数は3,000億個以上あります。
肝臓の構造の基礎は、肝細胞から形成される小葉です。 小葉の中心には肝静脈系の一部である中心静脈があります。 中心静脈から小葉の周囲まで、肝細胞がビームを形成して位置しています。 小葉の周囲に沿って門脈があり、門脈、肝動脈および胆管の枝が区別されます。
肝臓は分節構造を持ち、独自の血液とリンパの流れ、胆汁の流出、神経支配のシステムを持っています。
肝細胞は、2 つの極を持つ不規則な六角形です。 2 つの隣接する肝細胞がビームの直径を形成し、ビームの長さは中心静脈から小葉の周囲まで放射状に向いています。 梁の間には、中心静脈に血液を運ぶ毛細血管の役割を果たす正弦波があります。
血液は肝動脈(体積の 1/3)と門脈(2/3)を通って肝臓に入ります。 肝臓の総血流量は 1300 ml/分で、これは心拍出量の 1/4 です。 動脈血流は腸間膜動脈で始まります。 次に、血流は細静脈と静脈を通って門脈系に入り、そこでの圧力は前記毛細血管内の圧力よりも2倍低くなります(10〜5 mm Hg)。 門脈は小葉間の毛細血管に分裂し、肝静脈系に集まり、そこでの圧力はさらに低くなります(5〜0 mm Hg)。 美術。 門脈システム内の総圧力降下は 120 mmHg です。 美術。 静脈系を通る血液の動きは、示された勾配だけでなく、両方の毛細管ネットワークの総抵抗、神経および体液性の調節の影響下で変化する血管の内腔のサイズによっても決定されます。
小葉を取り囲む門脈路には、結合組織とともに、少数のリンパ球、マクロファージ、形質細胞、および白血球が含まれています。 門脈には、門脈の枝、肝動脈、小葉間胆管のいわゆるトライアドが含まれています。
解毒プロセスを実行するには、物質が肝臓に入らなければなりません。 通常、中毒の原因は胃腸管ですが、循環血液から物質が直接侵入する可能性もあります(敗血症の場合)。 消化プロセスの結果、つまり腸を通って門脈系を通過した部分は、特別な触媒である酵素の助けを借りて複雑な処理を受けます。 得られた生成物が完全に無毒になった場合にのみ肝臓から排出され、さらに腎臓または肺を通る呼気によって排泄されます。 他の排出経路(皮膚など)も考えられますが、重要な部分は体そのものによって利用されます。
肝臓のさまざまな機能は次のように列挙できます。
- 多数の特殊なタンパク質、炭水化物、脂質の合成。
- 消化のための胆汁酸と重炭酸塩の生成。
- 腸と体循環の間の緩衝剤。
- ほとんどの疎水性代謝産物、異物、薬物の主な排泄経路。
肝臓におけるタンパク質の代謝
肝臓はアミノ酸の恒常性の中枢です。 その中で、アミノ酸の合成、交換、さらにはアミノ酸と必要な変換を行う多くの酵素の合成が行われます。 肝臓の病理学的プロセスは、アミノ酸の比率の違反を伴い、さらにはアミノ酸の総量が増加する可能性があります。 どうやら、これは合成物質ではなく、アミノ酸に関する肝臓の調節機能の違反によるものと思われます。 アミノ酸代謝の障害は、多くの既知の病気を引き起こします。 したがって、肝脳ジストロフィー(ウィルソン病)は、高アミノ酸血症および高アミノ酸尿症を伴います。 フェニルアラニン、チロシン、トリプトファン、メチオニンの含有量の増加も、病理学的プロセスの発生につながります。
肝臓は、アミノ酸分解産物、特にアンモニアの代謝において重要な役割を果たします。 健康な肝臓では、アンモニアは完全に変換され、尿素の大部分を占めます。 知られているように、尿素は有毒な生成物ではなく、腎臓から排泄されます。 アンモニアから尿素への変換が肝臓における最も安定したプロセスの 1 つであることは重要であり、肝臓組織の 90% が除去され、多くの機能が失われたとしても、尿素生成機能は保存されています。
肝臓はまた、アルブミン (12 ~ 15 g/日)、最大 80% のグロブリン、さまざまな因子などの主要なタンパク質も合成します。 凝固。 主なものはアルブミンです。 アルブミンの半減期は 7 ~ 26 日であるため、肝臓のアルブミン合成機能の低下は 2 ~ 3 週間後に臨床的に現れます。
多くの血液凝固因子、特にプロトロンビン (半減期 12 時間) とフィブリノーゲン (半減期 4 日) は肝細胞の核および細胞質で合成されます。
形質細胞、肝臓の網様細胞、およびクッパー細胞では、抗体の主な供給源であるγ-グロブリンが合成されます。 純粋な形でのタンパク質の合成に加えて、肝臓は糖タンパク質、リポタンパク質、セルロプラスミン、トランスフェリンのタンパク質複合体を合成します。 タンパク質組成の違反は、定性的および量的の両方で、(肝臓に関連して)肝臓の合成機能の阻害、つまりタンパク質貯蔵量の枯渇と関連している可能性があります。 さらに、低タンパク質血症は、異化作用の増加、失血、腹水の発生、消化不良時のタンパク質損失、および組織透過性の増加によって引き起こされる可能性があります。
肝臓における脂質と胆汁酸の代謝
一次胆汁酸(コール酸およびケノデオキシコール酸)の合成は、タウリンおよびグリシンと結合して塩を形成し、コレステロールから行われます。 脂質を溶解する強力な洗浄剤である胆汁酸塩は、ミセルと呼ばれる凝集体に含まれています。 それらは、疎水性基が内側に配向し、親水性基、ヒドロキシル基およびカルボキシル基が外側に配向するように組織されています。 腸内では、一次胆汁酸の塩が二次胆汁酸、デオキシコール酸とリトコール酸に変換されます。 胆汁酸は、胆汁毛細管および胆管を通って十二指腸に分泌されます。 胆汁酸の90~95%は腸から吸収され、血液とともに肝臓に戻ります。 それらの循環(再循環)の一定のプロセスがあります。 肝臓に戻る酸は、コレステロールからの新しい胆汁酸の生成を抑制します。 コレステロールの正常な合成における酸の役割は大きく、胆汁酸代謝のさまざまな障害には、コレステロール自体の重大な代謝障害が伴うことを心に留めておく必要があります。
肝臓は、脂質の性質を持つ多くのホルモン薬、複合脂質、およびリポタンパク質を合成します。 肝臓はコレステロール代謝において最も重要な役割を果たしており、コレステロールの 90% は肝臓 (および腸) で合成されます。 肝臓質量のかなりの部分(最大 40%)がコレステロールの合成に関与していることは重要です。 人は食物からコレステロールの大部分を摂取しますが、その摂取が不十分な場合、体は脂肪酸の分解の中間生成物から必要な量を合成します。 同時に、肝臓自体のコレステロールの 3 分の 1 が胆汁酸に変換され、その後ステロイドホルモンに代謝され、一部はビタミン D2 (7-デヒドロコレステロール) になります。
脂肪酸は非常に有毒ですが、肝機能が正常であれば、体はこれを感じません。 肝臓の病理学的過程において、未消化の脂肪酸が血液中に蓄積し、血液脳関門を通過する能力があり、脳に顕著な毒性作用を及ぼします。 脂肪酸の変換障害は、肝臓の重度のジストロフィー性変化、特にミトコンドリアとリソソームの損傷で発生する可能性があります。
胆汁うっ滞では、胆汁酸とともに、コレステロールとβ-リポタンパク質が血液中に蓄積します。 中性脂肪とリン脂質が増加する可能性があります。 このような胆汁うっ滞は、胆汁の流出の違反とその成分の分泌の違反の両方に関連している可能性があります。 後者は脂質合成を劇的に増加させる可能性があります。 アルコール中毒では、脂肪輸送、リポタンパク質合成の急激な増加、およびリポタンパク質リパーゼ活性の抑制を伴う肝機能障害が起こります。 Fredrickson によれば、この場合に発症する高脂血症は、IV 型および V 型の異リポタンパク質血症に似ています。 5 番目のタイプは、血漿の著しい濁りを特徴とします。 肝生検中に、肝細胞内の重大な脂肪封入体の形で脂質代謝の重大な障害が見られることは重要です。 肝細胞自体は重度の変性状態にあり、一部には核に壊死の痕跡が見られます。
肝臓での糖質代謝
腸で吸収された炭水化物の大部分は肝臓で吸収されます。 肝細胞では、ガラクトースとフルクトースがグルコースに変換されます。 グルコースは、一部のアミノ酸、乳酸、ピルビン酸からも合成されます。 肝臓のおかげで血糖の安定性は維持されます。
肝臓はグリコーゲンの合成を行い、グリコーゲン代謝を調節します。 後者は腸から来る単糖類から合成されます。 グリコーゲンは血糖値の調節因子の1つであり、筋肉の収縮に必要です。 肝臓に入った単糖類のほとんどはグリコーゲンに変換されます。 血清中のグルコースレベルの低下(アドレナリン、グルカゴンの放出を伴う)は、グリコーゲンの分解の増加を伴い、その結果、不足しているグルコースが置き換えられます。
炭水化物代謝の調節は肝臓によって非常によく補われているため、たとえ負荷が異なっていても、糖の測定に関連する検査値は肝機能を評価するための情報にはほとんどなりません。 これは、糖曲線の変化がさまざまな理由によって引き起こされる可能性があるという事実によるものです。腸内でのグルコースの吸収障害や、そもそも膵臓の損傷であるため、炭水化物の指標を使用して肝臓の機能状態を判断する必要があります。代謝を求める場合は、グルコースではなくガラクトース曲線を使用することをお勧めします。 肝臓はグルコース-1-リン酸を合成しますが、その欠乏はガラクトース血症の発症につながります。
上記は、炭水化物代謝における肝臓の関与を制限するものではありません。 炭水化物代謝に関与する肝細胞酵素の遺伝的に決定された欠損は、ガラクトース、フルクトース、またはグリコーゲンからのグルコースの合成を損なう可能性があり、後者の肝臓への蓄積につながります。
肝臓におけるホルモンの代謝
ヘパリンは肝臓で合成されます。 このプロセスが中断されると、血液凝固障害が発生します。 肝臓はホルモン代謝において重要な役割を果たします。 ステロイドホルモンは肝臓では合成されませんが、肝臓はその不活化を担っています。 肝臓が損傷すると、血中のこれらのホルモンのレベルが上昇する可能性があります。 続発性アルドステロン症が発症し、尿中の 17-ケトステロイドおよび 17-オキシココルチコステロイドの排泄が減少し、エストロゲンの含有量と排泄が増加します。 肝臓は、ヒドロコルチゾンに結合してインスリンを不活化する輸送タンパク質であるトランスコルチンを合成します。 肝機能が低下すると、低血糖が起こることがあります。 チロシンからのアドレナリン、ノルアドレナリン、ドーパミンの合成の信頼性は肝臓に関連しています。 後者は肝臓自体で合成されます。
肝臓でのビタミンの代謝
肝臓はビタミン A、D、K、PP の主要な貯蔵庫であり、ビタミン C、B1、B12、葉酸が大量に含まれています。 肝臓損傷におけるビタミン代謝の違反は明らかに十分に考慮されていません。 腸内の胆汁酸の分泌が低下すると、脂溶性ビタミンの吸収が悪くなります。 しかし、水溶性ビタミンの吸収には胆汁の存在も必要です。 ビタミン A が不足すると、栄養障害が発生します。 これは慢性肝疾患、特に肝硬変で特に顕著です。
ビタミンB1(チアミン)。 その生物学的活性は補酵素の特性、つまり脱炭酸、α-ケト酸、ペントース回路などの重要な生化学プロセスを触媒する特定の酵素の構築に関与するコカルボキシラーゼへの変換によるものです。
ビタミン D (カルシフェロール) は再生プロセスに関与し、さらにリンとカルシウムの代謝を調節します。
ビタミン K (ヴィカゾール) は、正常な血液凝固に必要な脂溶性ビタミンです。 したがって、プロトロンビン含有量が相対的に減少しても、ビタミンKを導入することで回復することができます。ビタミンKは黄疸の鑑別診断に使用されます。 したがって、ビタミンKの投与によって血液凝固とプロトロンビンの低レベルが正常化された場合、これは閉塞過程を示していますが、症状が改善しない場合は、ほとんどの場合、肝細胞性黄疸について話しています。 閉塞性黄疸に対するビタミンKの投与はプロトロンビンのレベルを増加させますが、細胞死を伴う実質性黄疸の場合は増加しません。 肝臓の実質プロセス中に、アスコルビン酸とニコチン酸の欠乏も観察されます。
肝臓における微量元素の代謝
微量元素は、鉄、銅、亜鉛、マンガン、モリブデンの貯蔵量の形で肝臓に常に存在します。 肝臓はそれらの代謝を調節します。 肝臓の病理学的過程では、微量元素の貯蔵量が急激に減少し、循環血液中に微量元素が大量に過剰に生成されますが、これは重篤な疾患の前提条件です。
肝臓における酵素の代謝
わずか 1 年前、2,000 を少し超える酵素が知られていました。 新たに発見されたものにより、その数は毎年約 100 個増加しており、タンパク質の約 50% は酵素の合成に使用されるため、タンパク質の代謝障害は常に酵素障害となります。 酵素の恒常性は、水、電解質、酸と同じくらい重要であり、おそらくそれ以上に重要です。
- 素材を評価する
サイト内の素材の転載は固く禁止されています!
このサイトの情報は教育目的で提供されており、医学的アドバイスや治療を目的としたものではありません。
過剰なタンパク質は有害ですか?
腎臓が健康であればこの質問はしないでください。腎臓に病気がある場合はタンパク質の摂取量を管理してください。 最も賢明なアプローチは、両足で同時に摂取するのではなく、食事中のタンパク質摂取量を徐々に増やして高レベルにすることですが、それだけです。
一般的に、タンパク質をより多く摂取する場合は、より多くの水を飲むことをお勧めします。 なぜこれを行う必要があるのかについて明確な科学的根拠はありませんが、合理的なアプローチである可能性があります。
08/26:08更新
活動的な男性アスリートの観察と尿中の尿素、クレアチニン、およびアルブミンレベルの測定では、被験者の体重1kgあたり1.28~2.8gのタンパク質摂取量の範囲では有意な変化は観察されないことが示されました(1)。 この研究は7日間しか続きませんでしたが、別の研究ではタンパク質摂取と腎臓の健康(閉経後の女性)との間に関連性は見られませんでした(2)。 この場合の「タンパク質の増加」は 1.1 ± 0.2 g/kg 体重と定義され、これは糸球体濾過速度の増加と関連していました (2)。 看護師を対象とした研究でもこれらの結果が確認されています。 しかし、このタンパク質の安全性に関する知見は腎不全やその他の腎臓病には当てはまらず、乳製品以外の動物性タンパク質は他のタンパク質よりも体に有害である可能性があることを示唆しています(3)。
タンパク質の摂取が腎臓の機能変化を引き起こすことが示唆されています (4)。 タンパク質は腎臓の機能に影響を与える可能性があるため (5,6)、タンパク質を摂取すると腎臓に損傷を与える可能性があります。 最も顕著な結果は、マウスでの実験で得られました(一度にタンパク質を毎日の食事の 10 ~ 15% から 35 ~ 45% の範囲で摂取) (7,8)。 また、健康な人を対象としたある研究では、タンパク質の摂取量を2倍(体重1kgあたり1.2から2.4g)に増やすと、血中のタンパク質代謝レベルが通常よりも高くなることがわかりました。 体には糸球体濾過率の増加という適応する傾向がありましたが、これは 7 日以内に尿酸と血中尿素のレベルを正常にするのに十分ではありませんでした (9)。
これらすべての研究は主に、タンパク質が多すぎると急激な変化が起こり、徐々に量を増やすプロセスは腎機能を悪化させないことを示唆しています(10)。 これは、比較的長期間にわたってタンパク質の摂取量を徐々に変更する方が合理的であることを意味します。
腎臓病のある人は、避けられないと思われる状態の悪化を遅らせるために、タンパク質制限食を使用することをお勧めします(11、12)。 腎臓病患者のタンパク質摂取量のコントロールに失敗すると、腎機能の低下が加速します (または少なくとも減速はしません) (3)。
通常の食事の一部としての通常レベルのタンパク質摂取が、健康なラットやヒトの肝臓に有害であると信じる理由はありません。 しかし、十分に長い絶食(48時間以上)後に非常に大量のタンパク質を摂取すると、急性肝障害を引き起こす可能性があることを示唆する予備研究があります。
プロテインが肝臓に有害となるのはどのような場合ですか?
現在の肝疾患(肝硬変)の治療基準では、血中のアンモニアの蓄積を引き起こし(13、14)、肝性脳症の発症に悪影響を与えるため、タンパク質の摂取量を減らすことが推奨されています(15)。
少なくとも 1 つの動物モデルでは、5 日間の十分なタンパク質摂取期間とタンパク質欠乏期間の間のサイクル中に肝臓損傷が発生することが示されています (16)。 48時間の絶食後に40~50%のカゼインを含む食事を摂取した場合にも同様の効果が観察されました(17)。 最新の研究では、35%および50%のカゼインを摂取したグループは、対照グループのタンパク質摂取量の下限と比較して、アスパラギン酸アミノトランスフェラーゼ(AST)およびアラニンアミノトランスフェラーゼ(ALT)のレベルが高かったことが指摘されました。 これは、一般的にリフィーディング症候群(長期間の栄養失調後の代謝障害)の背景と、肝酵素に対するマイナスの副作用に対する身体の効果的な反応を示しています(18,19)。 この研究では、肝酵素レベルの増加が、熱ショックタンパク質をコードする細胞保護遺伝子 Hsp72 の発現 (活性) の減少、および c-Fos および nur-77 遺伝子の活性の増加と同時に観察されました。ダメージに反応して活性化されます。
要約すると、48時間の絶食後の再給餌時のタンパク質摂取量の増加(35~50%)が肝臓障害を引き起こす可能性があるという動物実験からの予備的な証拠があります。 より短い期間の絶食は考慮されなかった。
最後に、アフラトキシン (一部のナッツや種子で形成される有毒物質) は、高タンパク質の食事では発がん性 (がんの原因) が高く (20)、低タンパク質の食事では有害性が低いことが知られています (20)。 )。 これは、毒素がシトクロム P450 酵素系によって生物活性化され、その全体的な活性が食事中のタンパク質の用量の増加とともに増加するという事実によって説明されます。 同様の現象が、P450 システムによって代謝される薬物でも観察されます。代謝率の上昇により、高タンパク質の食事と併せて投与量の増加が必要になる場合があります (24)。
上記の研究では、タンパク質を単独で大量に摂取しても、アフラトキシンの経口投与が必要であるため、マイナスの副作用は生じませんが、これは避けられた可能性があります。 しかし、その一方で、それでも言及する価値があります。
1974年には、このテーマに関する別の研究もあり、35%のカゼインを含む食餌がラットのALTおよびASTレベルを増加させることが示されました(25)。 しかし、この研究結果は再現されていないようです。
上記の状況を除けば、タンパク質自体が肝臓に悪影響を与えることはありません。 つまり、肝臓が健康であれば、安全にタンパク質を摂取することができます。
アミノ酸って酸ですよね? 酸味についてはどうでしょうか?
理論的には、アミノ酸の過剰な酸性による害を証明することが可能です。 しかし、これは臨床上の問題ではありません。それらの酸性度は問題を引き起こすには低すぎるのです。
骨塩密度 (BMD)
大規模な観察研究の分析では、タンパク質の摂取と骨折のリスク(骨の健康の指標)との間に関連性がないことが示されています。 例外は、食事からのタンパク質の増加により、総カルシウム摂取量が 1 日あたり 400 mg/1000 kcal を下回る場合です (ただし、最高四分位と比較した場合、ハザード比は 1.51 とかなり弱かったです) (26)。 論理的には予想されることですが、他の研究では同様の相関関係は見つかりませんでした(27,28)。
ある介入研究では、タンパク質の摂取が実際に骨密度にプラスの影響を与えることが示されました。 しかし、この関係は、硫黄含有アミノ酸の酸化から得られる硫酸塩の影響が制御された場合にのみ明らかになった(29)。
大豆タンパク質自体は、閉経後の女性の骨組織に対して追加の保護効果があるようですが、これは大豆のイソフラボン含有量に関係している可能性があります(30)。 詳細については、大豆イソフラボンに関するよくある質問のリストをお読みください。
腎臓は、糸球体濾過速度、つまり血液の濾過速度を劇的に増加させることができます。 彼らはタンパク質の摂取に応じてこれを行います(31)。 一部の病気では、この代償機構が機能しないため、そのような場合には、タンパク質摂取量の制御が治療の一部となります(32)。
さらに、腎臓は重炭酸塩緩衝系を通じて体内の酸塩基バランスの調節に関与しています(33)。 酸塩基バランスの違反は、病理学的症状の出現や腎臓合併症の発症につながる可能性があります。
健康な腎臓にはこれらの保護能力があるように見えますが、病気になると機能が低下し始めます。
筋力トレーニングの役割
ある研究では、ラットが食事中の大量のタンパク質に急性曝露され、腎機能が悪化したことが報告されています。 しかし、「レジスタンストレーニング」は悪影響を軽減し、一部には保護効果がありました(8)。
1. Poortmans JR、Dellalieux O 定期的な高タンパク質の食事には、アスリートの腎臓機能に対する潜在的な健康リスクがありますか。 Int J Sport Nutr Exerc Metab。 (2000)
2. Beasley JM, et al バイオマーカーで補正されたタンパク質摂取量の増加は、閉経後の女性における腎機能障害とは関連しません。 J・ニュートル (2011)
3. Knight EL, et al 正常な腎機能または軽度の腎不全を持つ女性の腎機能低下に対するタンパク質摂取の影響。 アン・インターン医師。 (2003)
4. Brendle E、Sieberth HG、Hautmann RE 健康な被験者の腎機能に対する慢性的な食事性タンパク質摂取の影響。 Eur J クリン ニュートル。 (1996)
5. King AJ、Levey AS 食事タンパク質と腎機能。 J Am Soc ネフロル。 (1993)
6. 食事によるタンパク質摂取と腎機能
7. Wakefield AP ら エネルギーの 35% がタンパク質由来の食事は、メスの Sprague-Dawley ラットに腎臓損傷を引き起こします。 Br J Nutr. (2011)
8. Aparicio VA, et al ラットの腎臓、骨、代謝パラメータに対する高ホエータンパク質摂取とレジスタンストレーニングの効果。 Br J Nutr. (2011)
9. Frank H, 他 健康な若い男性における腎臓の血行力学および関連変数に対する、通常のタンパク質食と比較した短期高タンパク質食の影響。 J・クリン・ナトルです。 (2009)
10. Wiegmann TB, et al 慢性的な食事によるタンパク質摂取量を制御して変化させても、糸球体濾過速度は変化しません。 私はJ腎臓の病気です。 (1990)
11. Levey AS, et al 腎疾患における食事療法の研究における、進行性腎疾患の進行に対する食事タンパク質制限の影響。 私はJ腎臓の病気です。 (1996)
12. }