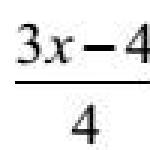A bázisok tipikus reakciói. Tipikus savreakciók, bázisok, oxidok, sók (magatartásuk feltételei) tipikus reakciók sav-oxid asztal
Az "oxidok" fogalma magában foglalja az anyagok végtelen sokféleségét: folyadék, például hidrogén-oxid vagy víz; szilárd, például szilícium-oxid (IV) - homok és sok kvarc fajtája, beleértve a chalcedont és az ametiszt, hegyi kristály és a mountion; Gáznemű, például szén-oxidok (IV) és (II) - szén-dioxid és árkokozó gázok.
Az enyém szerint kémiai tulajdonságok Az összes oxid sós formázásra és nem formáló.
Néhány oxid-oxidot. Összetételük nem fémelemeket tartalmaz, például: nitrogén-oxidok (I) és (II) - N2O és NO, szén-oxid (II) - CO és mások.
A sóképző oxidok között alapvető, sav- és amfoter-oxidok vannak. Az utolsóval megismerkedhet a 9. fokozatban.
| A fő oxidok olyan oxidok, amelyek megfelelnek az alapnak. |
Például,
A fő oxidok közé tartoznak a fém-oxidok, amelyek kis oxidációs fokokkal (+1 és +2), azaz az IA-metalok oxidjai és az időszakos rendszer D. I. Mendeleev, Hgo, MPO és néhány más. Minden nagyobb oxid szilárd anyag.
A fő oxidok tipikus reakciói

Laboratóriumi tapasztalat 27
A fő oxidok savakkal való kölcsönhatása
A csőben helyezzen el egy kicsit (térfogat a mérkőzés fejével) réz-oxid (II) por. Jelölje meg a színt.
Öntsünk egy kémcsőbe réz (II) -oxid 1-2 ml kénsavoldat. A reakció felgyorsítása érdekében a vizsgálócső tartalma kissé melegíti a tartalmat. Mit nézel?
Helyezzen egy üveg vagy porcelánlemezre 1-2 csepp a kapott oldat, üvegpálca vagy pipetta segítségével, és pontszámot. Mi alakult egy üveglapon?
Írjon molekuláris és ionos egyenleteket a réz (II) -oxid és a kénsav között.


Ábra. 144.
A fő oxid vízzel való kölcsönhatása
Ez a reakció csak akkor halad, ha egy oldható bázis alakul ki - a pályán, ezért Cuo + H 2 O ≠, mivel a Cu (IT) 2 oldhatatlan.

Ábra. 145.
Savas sav-oxidLaboratóriumi tapasztalat 28. szám
A fő oxidok vízzel való kölcsönhatása
Töltsön be két kémcsőbe 2-3 ml desztillált vízben. Add hozzá az egyes csövekhez 2-3 csepp fenolftalein oldathoz.
Helyezze az 1. tesztcsőbe egy kicsit (legfeljebb fele a megfelelő fej) kalcium-oxid, a 2.-réz-oxid (II).
Keverje össze a csövek tartalmát. Mit nézel?
A reakciók molekuláris és ionos egyenleteit.
A fő oxidok vízzel történő kölcsönhatásának következtetése.
A sav-oxidok közé tartoznak a nem fémoxidok:

valamint a fém-oxidok, amelyek nagy mennyiségű oxidációval rendelkeznek, például:

Laboratóriumi tapasztalat 29. szám
Az lúgos sav-oxidok kölcsönhatása
Öntsük 2 ml mészvizet a kémcsőbe. Ismertesse a megoldást.
Használva egy csövet egy finom véget, fújja át a lime vizet a kémcsőben, amit kilégz. Mit nézel?
Molekuláris és ionos reakcióegyenleteket készítsen.
Mi a lényege a sav-oxiddal való reakciójának lényege?

Ez a reakció azonban csak akkor lehetséges, ha a savas oxid vízben oldódik. És ha szilícium-oxidot (IV) szedsz, a reakció szinte nem megy:
Laboratóriumi tapasztalat 30. szám
A sav-oxidok vízzel való kölcsönhatása
Öntsük az 1. csőbe 2-3 ml desztillált vízbe, és a második szén-szén-monoxid-oldat (IV) vízben).
Helyezze az 1. tesztcsőbe egy kicsit (a spatula csúcsán) szilícium-oxid (IV). Adjunk hozzá 2-3 cseppet a lacmus oldatához minden csőre. Keverje össze a csövek tartalmát. Mit nézel?
Tegye a reakció molekuláris egyenleteit.
A savas oxidok vízzel történő kölcsönhatásának következtetése.
Kulcsszavak és kifejezések
- Az oxidok nem képződnek és sóképződnek.
- Az oxidok alaposak és savasak.
- Az alapoxidok tipikus tulajdonságai: a savakkal, savas oxidokkal és vízzel való kölcsönhatás.
- A savas oxidok jellemző tulajdonságai: kölcsönhatásuk bázisokkal, fő oxidokkal és vízzel.
- A sav és a fő oxidok vízzel való áramlásának feltételei.
Munka számítógéppel
- Lépjen kapcsolatba az elektronikus alkalmazással. Vizsgálja meg a leckét, és hajtsa végre a javasolt feladatokat.
- Keressen online e-mail címeket az interneten, amely további forrásokként szolgálhat, amely feltárja a kulcsszavak és kifejezés kifejezések tartalmát. Hívja meg segítségét a tanárnak egy új lecke elkészítésében - készítsen üzenetet a következő bekezdés kulcsszavai és kifejezések alapján.
Kérdések és feladatok
Megegyezés
A felhasználók regisztrálására vonatkozó szabályok a "Quality Sign" webhelyen:
Tilos a felhasználók regisztrálása becenevekkel, mint például: 111111, 123456, ytsukenb, lox i.t.p.
Tilos újra regisztrálni a webhelyen (kettős számlák létrehozása);
Tilos más emberek adatait használni;
Ne használjon más emberek e-mail címét;
A helyszíni viselkedési szabályok, fórum és a megjegyzések:
1.2. Közzététel a többi felhasználó személyes adatainak kérdőívében.
1.3. Bármely pusztító intézkedés az erőforrás tekintetében (pusztító szkriptek, jelszóválasztás, biztonsági megsértés stb.).
1.4. Használjon obszcén szavak és kifejezések becenevét; A törvényeket megsértő bővítések Orosz Föderáció, etika és erkölcsi szabályok; Szavak és kifejezések, amelyek hasonlóak a beceneves adminisztrációhoz és a moderátorokhoz.
4. A 2. kategória megsértése: teljes tilalmat kell büntetni minden típusú üzenetek indulásának 7 napig. 4.1. Az Orosz Föderáció büntető törvénye alá tartozó kapcsolódó információk, az Orosz Föderáció igazgatási kódja és az Orosz Föderáció Alkotmányával ellentétes.
4.2. Propaganda bármilyen formában a szélsőségesség, az erőszak, a kegyetlenség, a fasizmus, a nácizmus, a terrorizmus, a rasszizmus; Az intetnikus, vallási és társadalmi rally felbukkanása.
4.3. A munka helytelen megbeszélése és a "Quality Sign" oldalakon közzétett szövegek és jegyzetek szerzõinek megsértése.
4.4. A fórum résztvevői fenyegetései.
4.5. A tudatosan hamis információk, rágalmazás és egyéb információk elhelyezése, amelyet mind a felhasználók, mind más emberek tiszteletére és méltóságával megzavarnak.
4.6. Pornográfia az avatárokban, üzenetekben és idézetekben, valamint a pornográf képekre és erőforrásokra való hivatkozások.
4.7. Nyissa meg az adminisztráció és a moderátorok cselekedeteit.
4.8. Nyilvános megbeszélés és értékelés meglévő szabályok bármilyen formában.
5.1. Szőnyeg és abnormatív szókincs.
5.2. Provokáció (személyes támadások, személyes diszkreditálás, negatív érzelmi reakció kialakulása) és a megbeszéléseken résztvevők sérülése (egy vagy több résztvevővel kapcsolatos provokációk szisztematikus használata).
5.3. A felhasználóknak egymással ellentétesek.
5.4. Az interlokutorok felé irányuló durvaság és durvaság.
5.5. Áttérés a személyiségre és a személyes kapcsolatok kiderítésére a fórum ágakon.
5.6. Árvíz (azonos vagy nem késleltetett üzenetek).
5.7. Szándékos helytelen írás az álnevek és a többi felhasználó nevét támadó formában.
5.8. Idézett üzenetek szerkesztése, ami torzítja a jelentésüket.
5.9. A személyes levelezés közzététele a tárgyalópartner kifejezett hozzájárulása nélkül.
5.11. A romboló trolling a megbeszélés célzott átalakítása egy átírtak.
6.1. Overclocking (redundáns idézőjel) üzenetek.
6.2. A moderátorok beállítására és megjegyzéseire tervezett piros betűtípus használata.
6.3. Folytatva a moderátor vagy a rendszergazda által lefedett témák megvitatását.
6.4. Olyanok, amelyek nem hordoznak szemantikai töltést, vagy provokatívabb tartalomban.
6.5. A téma vagy az üzenet fejlécének létrehozása teljes egészében vagy részben nagybetűkben vagy idegen nyelven. A kivétel az állandó témák fejlécei és a moderátorok által nyitottak.
6.6. Aláírás létrehozása egy betűtípussal, mint a poszt betűtípusával, és az aláírásnál több színpaletta van.
7. A fórum szabályainak megsértésére alkalmazott szankciók
7.1. Ideiglenes vagy állandó tilalom a fórumhoz való hozzáféréshez.
7.4. Fiók törlése.
7.5. Blokk IP.
8. Megjegyzések
8.1. A moderátorok és az adminisztráció által végzett szankciók megközelítése magyarázat nélkül történhet.
8.2. Ezeket a szabályokat módosítani lehet, amelyet a webhely valamennyi résztvevőjére jelent meg.
8.3. A felhasználók tilosak a klónok használata az időtartam alatt, amikor a fő becenév blokkolva van. Ebben az esetben a klón határozatlan időre blokkolódik, és a fő becenév egy extra napot kap.
8.4 Az obszcén szókincset tartalmazó üzenet szerkeszthető a moderátor vagy a rendszergazda.
9. Administration Az adminisztráció a Site „Minőség Sign” fenntartja a jogot, hogy törölje az üzeneteket, és anélkül, hogy az okokat is. A webhely adminisztrációja fenntartja az üzenetek és a felhasználói profil szerkesztésének jogát, ha az információk csak részben sértik a fórum formanyomtatványát. Ezeket a hatásköröket a moderátoroknak és a rendszergazdáknak osztják el. Az adminisztráció fenntartja magának a jogot, hogy szükség esetén módosítsa vagy kiegészítse ezeket a szabályokat. A szabályok tudatlansága nem engedi fel a felhasználót a felelősségért a jogsértésért. A webhely adminisztrációja nem tudja ellenőrizni a felhasználók által közzétett összes információt. Minden üzenet csak a szerző véleményét jeleníti meg, és nem lehet felhasználni az összes fórum résztvevőinek véleményét általában. A helyszíni alkalmazottak és a moderátorok üzenetei személyes véleményük kifejezése, és nem egyezhetnek meg a szerkesztőség és a webhely irányításának véleményével.
Oxid- A kémiai elem bináris vegyülete oxigénnel az oxidáció mértékéhez -2, amelyben az oxigén maga csak egy kevésbé elektrontegratív elemgel kapcsolódik
Nómenklatúra-oxid
Az oxidok nevei így vannak kialakítva: először az "oxid" szó, majd hívja a formátumot. Ha az elem változó valenciájú, akkor a cím zárójelben lévő római szám jelzi a címet:
Na I 2 O - nátrium-oxid; SA II O - kalcium-oxid;
S IV O 2 - kén-oxid (IV); S VI o 3 - kén-oxid (VI).
Az oxidok osztályozása
Kémiai tulajdonságokkal az oxidok két csoportra oszthatók:
1. Nem formázó (közömbös) - Ne képezzen sókat, például: NO, CO,H 2 o;
2. Eladási formázás, Viszont:
– Karbantartás
- ezek oxidjai tipikus fémek oxidációját + 1, + 2 (I és II csoportok fő alcsoportok, kivéve berillium) és fém-oxidok egy minimális oxidációs, ha a fém változtatható oxidáció mértéke (CRO, MNO);
– savas
- Ezek jellemző nemfémek (CO 2, SO 3, N2O 5) és fémek oxidjai, amelyek a maximális oxidációs fokra vonatkoznak a PSE D.I. Remeeleeveeve (CRO 3, MN 2O 7) csoportjával;
– amfoteroxidok
(Rendelkeznek mind bázikus, mind savas tulajdonságú, attól függően, hogy a reakció körülmények között), ezek oxidjai BEO, Al 2 O 3, ZnO fémek és fémek oldalsó alcsoportok egy közbenső oxidációs fok (CR 2 O 3, MnO 2).
Fő oxidok
Alapvető hívott oxidok.amelyek sókat képeznek savakkal vagy savas oxidokkal való kölcsönhatáskor.A fő oxidok megfelelnek az alapnak.
például , CAO kalcium-oxid megfelel a Ca (OH) 2 kalcium-hidroxid, CDO kadmium-oxid - CD (OH) 2 kadmium-hidroxid.
A fő oxidok kémiai tulajdonságai
1. A fő oxidok kölcsönhatásba lépnek a vízzel.
Reakció állapot: Az oldható bázisokat kell kialakítani!
NA 2O + H 2 O → 2NAOH
Cao + H 2 O → CA (OH) 2
AL 2 O 3 + H 2 O → A reakció nem folytatódik, mint Al (OH) 3, amely oldhatatlan.
2. kölcsönhatás savakkal só és víz képződésével:
Cao + H 2 SO 4 → CASO 4 + H 2 O.
3. Interakció sav-oxidokkal só képződésével:
SAO + SIO 2 → CASIO 3
4. Interakció az amfoteroxidokkal:
Cao + AL 2 O 3 → CA (ALO 2) 2
Sav-oxidok
Savas hívott oxidok.amelyek sókat alkotnak, amikor kölcsönhatásba lépnek a bázisokkal vagy a fő oxidokkal.Megfelelnek a savaknak.
például
, a kén-oxid (IV) a kénsavnak felel megH 2 SO 3.
A savas-oxidok kémiai tulajdonságai
1. kölcsönhatás a vízzel savas képződéssel:A reakció feltételei: oldható savat kell kialakítani.
P 2 O 5 + 3H 2O → 2H 3 PO 4
2. Legyen kölcsönhatás a só és a víz kialakítása érdekében:
A reakció feltételei: a savas oxid kölcsönhatásba lép a lúgokkal, azaz az oldható bázis.
SO 3 + 2NAOH → NA 2 SO 4 + H20
3. Interakció a fő oxidokkal a sók képződéséhez:
SO 3 + NA 2O → NA 2 SO 4
Amfoteroxidok
Oxidek, amelyek hidrátvegyületei mind a savak, mind a bázisok tulajdonságait mutatják be amfoter.Például: Al2O3 alumínium-oxid,mangán-oxid (IV) MNO2.
Néhány referenciaanyag a kémiaban
Az elemi részecskék fő jellemzői
|
Részecske és kijelölése |
Súly |
Díj |
jegyzet |
|
Proton - P + |
Az elem sorszámának megfelelő protonok száma |
||
|
Neutron - p 0 |
A neutronok száma a következő képlet szerint található: n \u003d a-z |
||
|
Elektron - E. |
1:1837 |
Az elektronok száma megegyezik az elem sorszámával. |
Az energiaszintű elektronok maximális (legnagyobb) számát a képlet határozza meg: 2n. 2 ahol n szintszám.
Egyszerű anyagok
|
Fémek |
Nemetalla |
|
1.Szilárd anyagok (Kivéve Mercury - HG) |
1. Szilárd (kén, foszfor vörös és foszforfehér - p4, jód - i2, gyémánt és grafit - c), gáznemű anyagok(Oxigén - O2, ózon - O3, nitrogén - N2, hidrogén - H2, klór - Сl2, fluor-f2, nemesgázok) és folyadék (bróm - br2) |
|
2. Van egy fém ragyog. |
2. Nincs fémcsillapító (a kivétel a jód-i2, grafit-c). |
|
3. Elektro- és hőcsövek |
3. A legtöbb ne végezzen elektromos áramot (a vezetők például szilícium, grafit) |
|
4. le, műanyag, drig |
4. szilárd állapotban - törékeny |
A mutatók színének megváltoztatása a közegtől függően
|
Névjelző |
Festési jelző |
||
|
semleges környezetben |
lúgos környezetben |
savas környezetben |
|
|
Lakmusz |
Lila |
Kék |
Piros |
|
Metil-narancssárga |
narancs |
Sárga |
Vörös rózsaszín |
|
Fenolftalein |
Színtelen |
Malinovaya |
Színtelen |
Feloldódás során kénsav kell öntsük egy vékony sugárral és keverjük össze.
Sók nómenklatúrája
|
Savas név (képlet) |
Só neve |
|
Nitrogén (HNO2) |
Nitrit |
|
Nitrogén (HNO3) |
Nitrát |
|
Herbatry (só) HCl |
Klorida |
|
Sulfur (H2SO3) |
Szulfitok |
|
Sulfur (H2SO4) |
Szulfátok |
|
Hidrogén-szulfid (H2S) |
Szulfida |
|
Foszfor (H3PO4) |
Foszfátok |
|
Szén (H2CO3) |
Karbonátok |
|
Szilícium (H2SIO3) |
Szilikátok |
Kalcium-karbonát Caco3-oldhatatlan só vízben, amelyből tengeri állatok (puhatestűek, rákok, a legegyszerűbb) testhéjának burkolata; A Ca3 (PO4) 2-es kalcium-foszfát vízben oldhatatlan só, foszforiták és apatit ásványi anyagok alapja.
Anyagok S. atomi kristályrács: Kristály tolvaj, szilícium és germánium, valamint összetett anyagok, például azok, amelyek magukban foglalják a szilícium-oxidot (IV) - SiO2: szilícium-dioxid, kvarc, homok, hegyi kristály.
Molekuláris kristályrács: HCL, H2O -poláris kapcsolatok; N2, O3 - nem poláris kapcsolatok; Szilárd víz-jég, szilárd szén-oxid (IV) - "száraz jég", szilárd klorid és hidrogén-szulfid, szilárd egyszerű anyagok, amelyeket egy (nemesgázok), két- (H2, O2, CL2, I2), három- ( o3), négy- (p4), oktátum (S8) molekulák.
Kémiai analízis - A keverékek meghatározása.
Különösen tiszta anyagok- olyan anyagok, amelyekben a specifikus tulajdonságukat érintő szennyeződések tartalma nem haladja meg a százmamát és akár egymillió százalékot.
Egyes fizikai-kémiai értékek és egységük aránya
|
mértékegység |
Tömeg (m) |
Az anyag száma (n) |
Moláris tömeg (m) |
Térfogat (v) |
Moláris térfogat (v) |
Részecske szám (n) |
|
Leggyakrabban a kémia tanulmányozásakor használják |
anyajegy |
g / mol |
l / mol |
Avogadro száma N \u003d 6x10 23 |
||
|
1000-szer nagy |
kg |
colol |
kg / kmol |
m 3. |
m. 3 Kombol |
6x10 26. |
|
1000-szer kevesebb |
mg. |
mmol |
mg / mmol |
ml |
ml / mmol |
6x10 20. |
Savas besorolás
|
A besorolás jelei |
Savcsoportok |
|
Az oxigén jelenléte a savas maradékban |
A) oxigén: foszforsav, nitrogén B) oxigéntő: hidrogén-szulfid, klór, borom |
|
Alaposság |
A) Monosztatikus: klór, nitrogén B) két tengely: kén, szén, hidrogén-szulfid C) Három tengely: foszforsav |
|
vízben oldhatóság |
A) oldható: kén, nitrogén, hidrogén-szulfid B) oldhatatlan: szilícium |
|
Volatilitás |
A) BATs: klór, nitrogén, hidrogén-szulfid B) Nem illékony: kén, szilícium, foszforsav |
|
Az elektrolitikus disszociáció mértéke |
A) erős: kén, klór, nitric B) gyenge: hidrogén-szulfid, kén, szén |
|
Stabilitás |
A) stabil: kén, foszforsav, klór B) instabil: kén, szén, szilícium |
Tipikus savreakciók
1. Acid + bázis \u003d só + víz (Exchange reakció)
2. sav + fém-oxid \u003d só + víz (Exchange reakció)
3. Savas + fém \u003d só + hidrogén (szubsztitúció reakciója)
4. Acid + só \u003d új sav + új só (csere reakció)
Alapítványok osztályozása
|
A besorolás jelei |
Alapok csoportjai |
|
vízben oldhatóság |
A) oldható (alkáli): nátrium-hidroxid, kálium-hidroxid, kalcium-hidroxid, bárium-hidroxid B) Oldhatatlan bázisok: réz-hidroxid (II), vas-hidroxid (II), vas-hidroxid (III) |
|
Savaság (hidroxochrupp száma) |
A) egyosztályú: nátrium-hidroxid (kausztikus), kálium-hidrocide (kálium-kálium) B) Két ülő: vas-hidroxid (II), réz-hidroxid (II) |
Tipikus alapreakciók
1. bázis + sav \u003d só + víz (Exchange reakció)
2. Alap + nem fém-oxid \u003d só + víz (Exchange reakció)
3. Schelli + só \u003d Új alap + új só (csere reakció)
Az oldhatatlan bázist ra melegítve elbomlik a fém-oxid és a víz, ami nem jellemző a lúg, például: Fe (OH) 2 \u003d Feo + víz
A fő oxidok tipikus reakciói
1. Alap-oxid + sav \u003d só + víz (Exchange reakció)
2. Alap-oxid + savas oxid \u003d só (csatlakozási reakció)
3. Alap oxid + víz \u003d alkáli (csatlakozási reakció). Ez a reakció akkor halad, ha oldható bázis van kialakítva - alkáli. Például, Cuo + víz - a reakció nem folytatódik, mert A réz-hidroxid (II) oldhatatlan bázis.
Tipikus sav-oxid reakciók
1. Sav-oxid + bázis \u003d só + víz (Exchange reakció)
2. Sav-oxid + fő oxid \u003d só (csatlakozási reakció)
3. Sav-oxid + víz \u003d sav (csatlakozási reakció). Ez a reakció akkor lehetséges, ha a savas oxid vízben oldódik. Például: szilícium-oxid (IV) gyakorlatilag nem kölcsönhatásba lép a vízzel.
Tipikus sózási reakciók
1. Só + sav \u003d Egyéb só + Egyéb sav (Exchange Reakció)
2. Só + alkáli \u003d Egyéb só + Egyéb bázis (Exchange Reakció)
3. SOL1 + SOL2 \u003d SOL3 + Só 4 (Exchange Reakció: Két só belép a reakcióba, ennek következtében két másik sót kap)
4. Só + fém \u003d Egyéb só + Más fém (szubsztitúció reakciója), meg kell látnia a fém helyzetét a fémek elektrokémiai sorában.
Számos fémfeszültség szabályai
1. A savas oldatokkal a fémek kölcsönhatásosak, amelyek a bal oldali hidrogénnel rendelkeznek. Ez vonatkozik a fémek azon képességére, hogy más fémekből származó fémeket mutatják. Például a sóinak oldataiból származó réz ezeket a fémeket magnézium, alumínium, cink és más fémek lehetnek. De higany, ezüst, arany réz nem tartoznak, mert Ezek a fémek egy sor stresszes helyen helyesen helyezkednek el, mint a réz. De a réz a sóoldatokból kiszorítja őket.
Számos fémfeszültségének első szabálya a savas oldatokkal végzett fémek kölcsönhatásánál nem vonatkozik a kénsav koncentrált és a koncentrációjú salétromsavra: ezek a savak kölcsönhatásba lépnek a fémekkel egy sorban mind a hidrogén, mind utána Kén-oxid (IV), NEM, stb. Például a hígított salétromsav réz, réz (II)-nitrát, nitrogén-oxid (II) és víz kölcsönhatása.
2. Mindegyik fém más fémeket állít ki a megoldásokból a megoldásokból a jobb oldali révén. Ez a szabály megfelel a következő feltételeknek:
Mindkét só (a reakció előtt és után - reagálás és kialakult) oldhatónak kell lennie;
A fémek nem tudják kölcsönhatásba lépniük a vízzel, ezért az I. és II. Csoportok fő alcsoportjai (az utóbbiak esetében a kalcium), a sóoldatokból származó egyéb fémek nem tartoznak.
Redox reakciók
Redukálószer - atomok, ionok, molekulák, adott elektronok.
Alapvető redukálószerek: Fémek; hidrogén; szén; Szén-oxid (II) CO; hidrogén-szulfid; ammónia; sósav, stb.
A recoil elektronatomok, ionok és molekulák - oxidáció folyamata.
Oxidálószer - atomok, ionok, molekulák, fogadó elektronok.
A legfontosabb oxidánsok: halogének; nitric és kénsavak; Permanganát kálium stb.
Az elektronok atomok, ionok és molekulák általi összekapcsolásának folyamata.
Tipikus savreakciók, bázisok, oxidok, sók (magatartás feltételei)
Tipikus savreakciók
1 . Sav + bázis → só + víz
2 . Savas + fém-oxid → só + víz
3 . Sav + fém → só + hidrogén (körülmények: a) A fémnek a hidrogén bal oldalán lévő elektrokémiai feszültségben kell lennie; b) az oldható sót be kell szerezni; c) Az oldhatatlan sav - szilícium nem reagál a fémekkel; d) A koncentrált kénsav és a salétromsavak fémekkel reagálnak a fémekkel, a hidrogén nem kerül elosztásra)
4 . Savas + só → új sav + új só. (Állapot: a reakció, ha csapadék vagy gáz alakul ki)
Tipikus alapreakciók
1 . Alap + sav → só + víz
2 . Bázis + nem fém-oxid → só + víz (állapot: nem fém-oxid-sav-oxid)
3 . Schemochi + só → Új alap + új só (állapot: Csapadék vagy gáz alakul ki)
A fő oxidok tipikus reakciói
1 . Alap-oxid + sav → só + víz
2 . Alap-oxid + sav-oxid → só
3 . Alap-oxid + víz → Pitch (állapot: oldható bázisszög)
Tipikus sav-oxid reakciók
1 . Sav-oxid + bázis → só + víz
2 . Sav-oxid + fő oxid → só
3 . Sav-oxid + víz → sav (állapot: sav oldható)
Tipikus sózási reakciók
1 . Só + sav → Egyéb só + Egyéb sav (állapot: ha az üledék vagy a gáz kialakulása)
2 . Só + pályák → Egyéb só + másik bázis (állapot: ha csapadék vagy gáz alakul ki)
3 . Só 1 + só 2 → só 3 + só 4 (állapot: egy üledék alakul ki)
4 . Só + fém → másik só + másik fém (állapot: Minden fém kiszorítja az összes többi fémet az oldatokból a megoldásokról a jobb oldalán egy feszültség sorában; ugyanakkor mindkét sónak oldhatónak kell lennie)