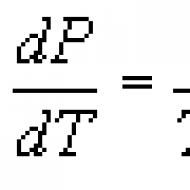Clapeyron-Clausius denklemi. Clapeyron ve Clausius-Clapeyron denklemleri Clapeyron denklemi hangi faz geçişleri için geçerlidir?
Clapeyron-Clausius denklemi Bir maddenin bir fazdan diğerine geçiş süreçleriyle ilgili termodinamik denklem (buharlaşma, erime, süblimleşme, polimorfik dönüşüm vb.). K. - K. u.'ya göre bir denge süreci sırasında faz geçiş ısısı (örneğin buharlaşma ısısı, füzyon ısısı) şu ifadeyle belirlenir: Nerede T - geçiş sıcaklığı (izotermal süreç), dp/dT - Belirli bir geçiş sıcaklığında sıcaklığa göre basınç türevinin değeri, ( V2-V1) - birinci aşamadan ikinciye geçişi sırasında bir maddenin hacmindeki değişiklik. Denklem ilk olarak 1834'te B.P.E. Clapeyron tarafından, buharın bir sıvıyla termal dengede yoğunlaştırılması için Carnot döngüsünün analizinden elde edildi. 1850'de P. Clausius denklemi geliştirdi ve diğer faz geçişlerini de kapsayacak şekilde genişletti. K. - K. u. Isının emilmesi veya salınmasının eşlik ettiği herhangi bir faz geçişine (birinci dereceden faz geçişi denir) uygulanabilir ve faz dengesi koşullarının doğrudan bir sonucudur (bkz. Faz dengesi) ,
nereden türetildiği. K. - K. u. Diğerleri biliniyorsa, denklemde yer alan niceliklerden herhangi birini hesaplamak için kullanılabilir. Özellikle, deneysel olarak belirlenmesi önemli zorluklarla dolu olan buharlaşma ısısını hesaplamak için kullanılır. Genellikle K. - K. u. türevlere göre yazılmış dp/dT veya dT/dp:
Buharlaşma ve süblimleşme işlemleri için dp/dT doymuş buhar basıncındaki değişimi ifade eder R sıcaklık ile T, ve erime ve polimorfik dönüşüm süreçleri için dT/dp Geçiş sıcaklığının basınçla değişimini belirler. Başka bir deyişle K. - K. u. değişkenlerdeki faz denge eğrisinin diferansiyel denklemidir r, T.
K. - K. u'yu çözmek için. miktarların sıcaklık ve basınçla nasıl değiştiğini bilmek gerekir L, V 1 Ve V2, bu zor bir iştir. Genellikle bu bağımlılık ampirik olarak kurulur ve K. - K. u. sayısal olarak. K. - K. u. hem saf maddelere hem de çözeltilere ve çözeltilerin bireysel bileşenlerine uygulanabilir. İkinci durumda, K. - K. u. Belirli bir bileşenin kısmi doymuş buhar basıncını kısmi buharlaşma ısısıyla ilişkilendirir. Yu.I.Polyakov. Büyük Sovyet Ansiklopedisi. - M .: Sovyet Ansiklopedisi.
1969-1978
.
![]()
Diğer sözlüklerde “Clapeyron-Clausius denkleminin” ne olduğuna bakın:
CLAPEYRON MENDELEEV DENKLEMİ, ideal bir gaz için (bkz. İDEAL GAZ) durum denklemi (bkz. DEVLET DENKLEMİ), 1 mol gaza (bkz. MOL) karşılık gelir. 1874'te D.I. Mendeleev (bkz. MENDELEEV Dmitry Ivanovich) Clapeyron denklemine dayanarak ... ... ansiklopedik sözlük
CLAPEYRON-CLAUSIS DENKLEMİ- bir maddenin bir fazdan diğerine geçiş süreçleriyle ilgili termodinamik denklem (buharlaşma, erime, polimorfik dönüşüm vb.). Clapeyron Clausis denklemine göre faz geçiş ısısı (örneğin erime ısısı) Metalurji sözlüğü
İdeal bir gazın durum denklemi, hacmi V. basınç pi abs arasında ilişki kurar. t roy T. Şu formdadır: pV=nRT. burada n, gazın mol sayısıdır, R = 8,31431 J/mol. K) gaz sabiti. 1 mol gaz için pv=RT, burada v molar hacimdir. K.M.u.... ... Kimyasal ansiklopedi
Durum denklemi Bu makale Termodinamik serisinin bir parçasıdır. İdeal bir gazın durum denklemi Van der Waals denklemi Diterici denklemi Termodinamiğin bölümleri Termodinamiğin ilkeleri Denklem ... Wikipedia
- (Clapeyron-Mendeleev denklemi), ideal bir gazın durumunu belirleyen parametreleri (basınç p, hacim V ve mutlak sıcaklık T) arasındaki ilişki: pV=BT, burada katsayı. B orantılılığı M gazının kütlesine ve molüne bağlıdır. kitleler. Kurulmuş… … Fiziksel ansiklopedi
Durum denklemi Stat ... Vikipedi
- (Clapeyron-Mendeleev denklemi), kütlesi M olan ideal bir gazın basıncı p, mutlak sıcaklığı T ve hacmi V arasındaki ilişki: pV=BT, burada B=M/m (m, bir gaz molekülünün atomik kütle cinsinden kütlesidir) birimler). Fransız bilim adamı B.P.E. tarafından kuruldu. Clapeyron... ... Modern ansiklopedi- Clapeyron Mendeleev denklemi, B. P. E. Clapeyron (1834) tarafından ideal bir gazın durumunu belirleyen fiziksel büyüklükler arasındaki ilişki: gaz basıncı p, hacmi V ve mutlak sıcaklık T. K. u.... ... Büyük Sovyet Ansiklopedisi
Clapeyron Mendeleev denklemi [adını Fransızlardan almıştır. fizik B. Clapeyron (V. Clapeyron; 1799 1864) ve Rusça. kimyager D.I. Mendeleev (1834 1907)], ideal bir gazın durum seviyesi: pVm = RT, burada p basınçtır, T gazın termodinamik sıcaklığıdır, Vm ... ... Büyük Ansiklopedik Politeknik Sözlüğü
CLAPEYRON VE CLAUSUS-CLAPEYRON DENKLEMLERİ
Gibbs faz kuralından da anlaşılacağı gibi, iki fazlı tek bileşenli bir sistemde bağımsız yoğun değişkenlerin sayısı bire eşittir. Bu nedenle aşağıdakilerle ilgili bir denklem olmalıdır: R Ve televizyon böyle bir sistem. Bu ilişki faz denge koşulunun bir sonucudur:
burada p(p, T) her fazın kimyasal potansiyelinin bir fonksiyon olduğunu vurgular rT.
Eğer p'nin bağımlılığı R Ve T açıkça biliniyorsa, (3.7) prensipte aşağıdaki denkleme göre çözülebilir: R veya T ve bağımlılığı bul R = p(T) veya T = T(r). Ancak genel durumda bağımlılık p olumsuz ve 7" bilinmiyor ve bu yapılamaz. Ama türevini bulabilirsiniz. Rİle T(veya tersi).
Bir maddenin a ve b iki fazının dengede olduğunu varsayalım. Sıcaklığı d7" değeri kadar değiştirirseniz, denge koşullarını (3.7) ihlal etmeden her iki fazın kimyasal potansiyelleri eşit şekilde değişecek şekilde basınç değişmelidir, yani:
Her iki diferansiyelin değişkenlere ayrıştırılması Tyr, aldık
(2.31) bağıntılarıyla birlikte bu şunu verir:
Buradan şu çıkıyor:
Df P nerede? - faz geçişinin entropisi; A fp U=U^ -- molar
faz geçişi hacmi (molar hacimdeki değişim T= sabit, p = sabit).
Faz geçişinin entropisi ve entalpisi birbiriyle ilişki (3.5) ile ilişkilidir: AS = AN/T. Bu nedenle (3.9) aşağıdaki biçimde yazılabilir: 
Nerede T- faz geçiş sıcaklığı.
Denklemler (3.9) ve (3.10) eşdeğerdir ve ikisinden birine Clapeyron denklemi denir.
Clapeyron denkleminin pratik uygulaması, faz geçişi entalpisinin ve fazların molar hacimlerinin farklı fazlar için sıcaklığa farklı şekilde bağlı olması gerçeğiyle sınırlıdır. Bu, bu denklemi entegre etmenin genel bir yolu olmadığı anlamına gelir. Ancak küçük sıcaklık aralıkları için bu denklemler, belirli yaklaşımlar kabul edilerek birçok amaç için yeterli bir doğrulukla entegre edilebilir.
İlk yaklaşım, dar bir sıcaklık aralığı için faz geçişinin entalpisinin yaklaşık olarak sabit olduğunun varsayılabileceğidir. Aynı şey, zayıf bir şekilde bağlı olduklarından, katı ve sıvı yoğunlaştırılmış fazların molar hacimleri için de yapılabilir. Tyr'den. Daha sonra, katı fazlar arasındaki ve katı ve sıvı fazlar arasındaki faz dengesi için molar hacimdeki değişimin de sabit olduğu varsayılabilir. Bu yaklaşımlarla (3.10) aşağıdaki şekilde entegre edilmiştir (erime için):

Benzer şekilde katı fazlar arasındaki denge için de.
Gaz fazının molar hacmi sabit kabul edilemez. Ancak düşük basınçlar durumunda başka yaklaşımlar da mümkündür. İlk olarak, düşük basınçlarda bir gazın molar hacmi, herhangi bir yoğunlaşmış fazın molar hacminden çok daha büyüktür (cf). Bu nedenle buharlaşma için şunları alabilirsiniz:
İkinci olarak, düşük basınçlarda birçok gaz
tt t^gaz BT D__ yat
İdeale yakın özellikler. Bu nedenle ~-i L isp k t ~-.
Bunu denklem (3.10)'da yerine koyarsak şunu elde ederiz:

Çünkü &r/r= s!1p R, ortaya çıkan ilişkiye Clausius-Clapeyron denklemi denir:
Hem sıvı hem de katı fazların buharlaşmasına (süblimasyon) uygulanabilir.
Faz geçişinin sabit entalpisinin yaklaşımında bu denklem aşağıdaki şekilde entegre edilir:
Bu denklemleri uygulamak için, faz geçişlerinin entalpileri ve normal basınçta faz geçişlerinin sıcaklıkları hakkındaki veriler sıklıkla kullanılır. Fiziksel ve kimyasal miktarlarla ilgili birçok referans kitabında verilmiştir. Normal basınç 101,325 Pa = 101,325 kPa = 1,01325 bar = 1 atm = 760 mm Hg değeridir. Sanat. = 760 Torr. Referans kitaplarından alınan veriler, normalden önemli ölçüde farklı olmayan basınçlarda (3.11) ve (3.13) denklemlerini kullanan yaklaşık hesaplamalar için temel oluşturur.
Denklem (3.11) kullanılarak yapılan hesaplamalar için gerekli olan yoğunlaşmış fazların molar hacimleri genellikle referans kitaplarında verilmez. Ancak bunların yerine nehir yoğunluklarına ilişkin verileri bulabilirsiniz. Tanımları bilerek molar hacimleri hesaplamak için kullanılabilirler. U t = U/n, p = O Ve M = t/p. Onlardan şu şekilde: U t = M/ p, nerede M - molar kütle.
Öte yandan bazı referans kitapları faz geçişlerinin spesifik ısılarını verir. Bu durumda denklem (3.10) aşağıdaki biçimde yazılabilir:

burada Af p/g ve Af P y, bir faz geçişi sırasında sırasıyla spesifik entalpi ve spesifik hacimdeki değişikliklerdir (ve v= 1/r).
Buharlaşma entalpisi bilinmiyorsa, bazen çoğu sıvının buharlaşma molar entropisinin yaklaşık 90 J K -1 mol -1 olduğunu belirten Trouton'un temel kuralı kullanılarak yaklaşık olarak tahmin edilebilir. Dfp^ - AfpR/G olduğundan, L isp R/J mol -1 = 90(G M/K), burada 7^ normal basınçtaki kaynama noktasıdır. Buharlaşma entalpisinin bu değerini (3.13)'te yerine koyarsak ve piksel normal basınç 1 atm'dir ve sıcaklık için T! normal kaynama noktası T sıvının üzerindeki denge buhar basıncını elde ederiz:

Trouton kuralı yüksek polariteye sahip sıvılar ve özellikle de sıvılar için geçerli değildir. birleşmiş su ve alkol gibi sıvılar. (İlişkili sıvılar, molekülleri birbirleriyle etkileşime giren sıvılardır. hidrojen bağları.) Kural yalnızca polar olmayan maddelere uygulandığında ve kaynama noktası yaklaşık 150 ila 1000 K aralığında olduğunda tatmin edicidir.
Clapeyron-Clausius denklemi (diferansiyel).
Ayrıca okuyun:
|
Sıvı-buhar denge eğrisi veya aynı anlama gelen, belirli bir madde için doymuş buhar basıncının sıcaklığa bağımlılığı, Clapeyron-Clausius denklemi olarak adlandırılan denklemin çözülmesiyle bulunabilir.
Termodinamik döngülerin yöntemi bu denklemin formunu oluşturmamızı sağlar. Sıcaklıklara karşılık gelen iki deneysel izoterm olsun ve (Şekil 50).

Başlangıç durumu 1'de, bir mol sıvı sıcaklıkta basınç altındadır ve hacim kaplar (buhar fazı yoktur). Isı ekleyerek bu mol sıvıyı izotermal olarak buharlaştırıyoruz. Bu durumda sıvı her zaman doymuş buharının basıncına eşit basınç altında olacaktır. Sonuç olarak, sıvı gaz haline dönüşecektir 2. Sabit sıcaklık ve basınçta bir mol sıvıyı gaz haline dönüştürmek için gereken ısı miktarı, tanımı gereği, buharlaşmanın gizli ısısıdır. Böylece, geçiş 12'de sıvı, eşit miktarda ısı aldı.
Döngü başına yapılan iş sayısal olarak 1234 dörtgeninin alanına eşittir:
![]() (3.3.1)
(3.3.1)
ve çevrim verimliliği
 .
(3.3.2)
.
(3.3.2)
Öte yandan 1234 çevrimi bir Carnot çevrimi olduğundan verimliliği şu şekildedir:
![]() (3.3.3)
(3.3.3)
(3.3.2) ve (3.3.3) ifadelerini karşılaştırarak şunu elde ederiz:

 .
(3.3.4)
.
(3.3.4)
Denklem (3.3.4) biraz farklı bir biçimde sunulabilir. Bunu yapmak için, bir sıvının 1. durumdan gaz 2. duruma geçişi sırasında entropideki değişimi bulacağız (Şekil 50).
 ,
(3.3.5)
,
(3.3.5)
sırasıyla durum 1'deki sıvının ve durum 2'deki buharın entropileri nerede ve nerededir. Son bağıntıyı kullanarak denklem (3.3.4) şu şekilde yazılabilir:
 .
(3.3.6)
.
(3.3.6)
Diferansiyel denklem (3.3.4) Clapeyron-Clausius denklemidir. Bu denklem, sıcaklık değiştikçe doymuş buhar basıncındaki değişimi temsil eder. Bu denkleme bir çözüm bulmak için, gizli buharlaşma ısısının sıcaklığa bağımlılığının yanı sıra sıvı ve gaz hacimlerinin sıcaklık ve basınca bağımlılığını bilmek gerekir. Genel durumda bu denklem, çözümü sayısal entegrasyonla bulunan doğrusal olmayan bir diferansiyel denklemdir.
Kritik sıcaklıktan çok daha düşük sıcaklıklarda, sıvının kapladığı hacim, sıvının kapladığı hacimden çok daha azdır; Örneğin su buharının hacmi suyun hacminden 1600 kat daha fazladır; sıvı oksijenin -C sıcaklıkta kaynamasına hacimde yaklaşık 300 kat artış eşlik eder. Bu nedenle sıcaklıklarda denklem (3.3.4) formunu alacaktır.
. (3.3.7)
Aynı yaklaşımla doymuş buhar da ideal bir gaz olarak kabul edilebilir. Bu, denklem (3.3.7)'yi şu şekilde yazmamızı sağlar:
. (3.3.8)
Denklemin (3.3.8) sol tarafını ila aralığında ve sağ tarafını - ila aralığında entegre ederek şunu elde ederiz:
 ,
(3.3.9)
,
(3.3.9)
sıcaklıkta deneyden elde edilen doymuş buhar basıncı ve sıcaklık aralığı boyunca buharlaşma ısısının ortalama değeri nerede
Formül (3.3.9)'dan, doymuş buharların basıncının artan sıcaklıkla birlikte üstel olarak arttığı açıktır.
Clapeyron-Clausius denklemi şu şekilde yeniden yazıldı:
 , (3.3.10)
, (3.3.10)
Daha sonra göstereceğimiz gibi, aynı zamanda sıvının kaynama sıcaklığının dış basınca bağımlılığını da belirler. Denklemde (3.3.10)
dış basınç değiştiğinde kaynama noktasındaki değişikliktir. Bu nedenle sıvı-buhar denge eğrisine kaynama eğrisi de denir.
52. Van der Waals denklemi - İdeal olmayan gazların durum denklemi. Van der Waals denklemi sabitlerinin deneysel olarak belirlenmesi.
Daha önce belirtildiği gibi, düşük sıcaklıklarda ve yüksek basınçlarda bir maddenin bir molü için Mendeleev-Clapeyron denklemi
deneysel olarak ölçülen değerlerden önemli sapmalar verir.
Gerçek madde için, maddenin tüm hallerini olmasa da en azından gaz ve sıvı hallerini kapsayabilecek bir hal denklemi bulmak için çok sayıda girişimde bulunulmuştur. Önerilen birçok denklemden en ünlüsü van der Waals denklemidir:
 ,
(3.4.2)
,
(3.4.2)
Bir maddenin bir molü için yazılmıştır. Benler için bu denklem şöyledir:
 .
(3.4.3)
.
(3.4.3)
Sabitler deneysel olarak belirlenir ve farklı molekül türleri için farklı değerlere sahiptir. Denklem (3.4.2) türetilmemiştir; zaten bilinen Mendeleev-Clapeyron denklemine iki düzeltme getirilerek oluşturulmuştur. Bunların tanıtılmasını doğrulamak için, denklem (3.4.2)'de hacmin, bir mol gaz içeren bir kabın hacmi anlamına geldiğini not ediyoruz. Maddi noktalardan oluşan ideal bir gaz durumunda bu hacmin tamamı moleküllerin hareketi için mevcuttur. Gerçek bir gazda moleküllerin kendisi kabın hacminin belirli bir bölümünü kaplar ve bu kısma diğer tüm moleküller erişemez. Hacmin bu kısmı hacimden çıkarılmalıdır. Daha sonra denklem (3.4.2) şu formu alır
. (3.4.4)
Son ifadeden, düzeltmenin gazın sonsuz yüksek basınçta kaplayacağı hacme eşit olduğu açıktır, yani gerçek bir gazın molekülleri sonsuz yüksek basınçta bile birbirlerine sıfıra eşit bir mesafeye yaklaşamazlar. Bu nedenle bir düzeltmenin uygulanması, moleküller arasındaki itici kuvvetlerin yaklaşık olarak hesaba katılması anlamına gelir.
Bildiğimiz gibi moleküller arasında sadece itici kuvvetler değil, çekici kuvvetler de etki eder. Bir damarın duvarının yakınında bulunan herhangi bir molekül, net bir çekim kuvvetine maruz kalır
çekici kuvvetlerin etki alanında bulunan moleküllerin yanından (Şekil 51).

Duvar yüzeyinde bir platform seçelim. Üzerinde moleküller olsun. Daha sonra ortaya çıkan kuvvet gazdan bu alanın moleküllerine etki eder.
 ,
(3.4.6)
,
(3.4.6)
Simetri koşullarından dolayı tüm kuvvetler aynı büyüklük ve yöne sahiptir. Kuvveti alana bölersek, duvarda bulunan moleküllerin gaz kütlesinin geri kalanına etki ettiği sözde moleküler basıncı elde ederiz:
. (3.4.7)
Formül (3.4.7)'deki faktörlerin her biri açıkça gazın yoğunluğuyla orantılıdır, bu da gazın hacmiyle ters orantılıdır, dolayısıyla şunu yazabiliriz:
, (3.4.8)
Nerede A– pozitif sabit katsayı.
Böylece, çekici kuvvetlerin etkisi sonucunda, gaz tarafından duvara uygulanan basınç, moleküller arasında herhangi bir çekici kuvvet olmadığında duvarın maruz kalacağı basınçtan (3.4.4) daha az olacaktır;
![]() .
.
Van der Waals denklemini nerede buluruz:
 .
(3.4.9)
.
(3.4.9)
Ek basıncın görünümünü formül (3.4.9)'da açıklayalım. Gazın ağırlıksız bir pistonun altındaki bir silindirde olmasına izin verin. Dış basınç gazı sıkıştırmaya, yani moleküllerini birbirine yaklaştırmaya eğilimlidir. Gaz molekülleri birbirini çekmeseydi gaz yalnızca dış basınçla karşılaşırdı. Ancak moleküllerin karşılıklı çekiciliği, öğrendiğimiz gibi, aynı zamanda molekülleri birbirine yakınlaştırma eğilimindedir, yani dış basınçla aynı yönde etki eder. Bu nedenle, moleküllerin çekiminin sonucu, sanki piston üzerindeki basınca bir miktar ek basınç eklenmiş gibi, gaz üzerindeki dış basınçta belirgin bir artış olarak yansıtılır.
Van der Waals denklemi sabitlerinin deneysel olarak belirlenmesi
Sabitlerin deneysel olarak belirlenmesi için A ve incelenen gaz, içinde basınç ölçer bulunan kapalı hacimli bir kaba yerleştirilir ve bu gazın basıncı farklı sıcaklıklarda ölçülür. Deneysel olarak elde edilen eğrinin sayısal farklılaşmasıyla kısmi türevi belirleriz. Van der Waals denkleminden bu türevi buluyoruz
 .
(3.5.1)
.
(3.5.1)
Buradan değeri alıyoruz:
. (3.5.2)
İfadeyi (3.5.2) van der Waals denkleminde (3.4.9) yerine koyarak başka bir miktar hesaplarız. A:
![]() .
(3.5.3)
.
(3.5.3)
Deneyimler göstermiştir ki değerler A ve sabit değildirler, zayıf da olsa sıcaklığa bağlıdırlar. Van der Waals denklemini sabit olarak kullanan hesaplamalarda A ve fonksiyonların ortalama değerlerini ve ilgilenilen sıcaklık aralığını alın


53. Van der Waals denkleminin izotermleri ve deneysel izotermlerle karşılaştırılması. Bir maddenin kritik parametrelerinin VdW denkleminden belirlenmesi. Maddenin yarı kararlı halleri aşırı doymuş buhar ve aşırı ısıtılmış sıvıdır. Wilson odası ve kabarcık odası.
İncirde. Şekil 52, van der Waals gaz izotermlerini göstermektedir.
Çok yüksek sıcaklıklarda hiperbollere yakın bir şekle sahiptirler; bu izotermler maddenin gaz halindeki durumunu (neredeyse ideal gaz) karakterize eder. Sıcaklık azaldıkça izotermin şekli değişir ve belirli bir sıcaklıkta (kritik) eğrinin bir dönüm noktasını tespit eder. Daha da düşük sıcaklıklarda (kritik altı), sıvı-buhar faz geçişine karşılık gelen yatay bir bölüm yerine izotermler dalga benzeri bir bölüme sahiptir (Şekil 53).


Pirinç. 52 R ve s. 53
Ölçümler, gerçek maddenin izotermlerinin, (gaz halindeki hal) ve (sıvı hal) bölümlerinde pratik olarak van der Waals izotermiyle örtüştüğünü göstermektedir. Ancak orta kısımda sıvı-buhar faz geçişine karşılık gelen yatay bölüm (51) yerine van der Waals izotermi dalga benzeri bir bölüme sahiptir. Bu dalgalı bölüm aşağıdaki şekilde karakterize edilir. Bölüm 12, buharın yarı kararlı durumuna (aşırı doymuş buhar) karşılık gelir ve bölüm 54, sıvının yarı kararlı durumuna (aşırı ısıtılmış sıvı) karşılık gelir. 1. noktada yalnızca doymuş buhar vardır ve 5. noktada yalnızca kaynayan sıvı vardır. Dalgalı eğrinin 234. bölümüne gelince, bu fiziksel olarak imkansızdır, çünkü doğada sabit bir sıcaklıkta hacimdeki bir artışın basınçta bir artışa yol açacağı hiçbir madde yoktur. İkincisi ancak bu alandaki sıcaklığın sabit olmaması durumunda mümkündür. Aşırı doymuş buhar (bölüm 12), basıncın yüksek olduğu bir maddenin gaz halindeki halidir. P belirli bir sıcaklıkta doymuş buhar basıncından daha büyük - saf bir gazın doymuş buhar basıncından daha yüksek bir basınca sıkıştırılmasıyla deneysel olarak elde edilebilir ve yoğunlaşmaz. Aşırı doymuş buharın durumu, belirli bir stabiliteye sahip olmasına rağmen, bildiğimiz gibi maddenin bir kısmının sıvı formunda olduğu ve bir kısmının da içinde olduğu iki fazlı durumdan (izobar 135) daha az kararlıdır. doymuş buhar formundadır. Bu nedenle, hafif bir dış etki ile aşırı doymuş buhar kısmen sıvıya dönüşür ve geri kalan buhar doymuş hale gelir.
Aşırı ısıtılmış sıvı (bölüm 45) - belirli bir sıcaklıkta doymuş buhar basıncından daha düşük bir basınçta bulunmasıyla karakterize edilen bir durum - saf sıvının uzun süre kaynatılmasıyla elde edilebilir, bunun sonucunda gaz kabarcıkları (çekirdekler) oluşur. buharlaşma) sıvıdan uzaklaştırılır ve sıvı, belirli bir basınçta kaynama noktasının üzerindeki bir sıcaklığa kadar ısıtılır. Aşırı ısıtılmış bir sıvının durumunun, sıvı ve doymuş buhar arasındaki denge durumuna göre daha az kararlı olduğu ortaya çıkar. Böyle aşırı ısıtılmış bir sıvıya yabancı bir maddenin parçacıkları verilirse, hızla iki fazlı bir duruma geçer.
Aşırı doymuş buhar ve aşırı ısıtılmış sıvının durumları, temel parçacıkların parametrelerini kaydetmek ve ölçmek için nükleer fizik cihazlarında (Bulut odası ve kabarcık odası) kullanılır.
Van der Waals izoterminde dalgalı bölümün yerini yatay bir düz çizgi (135) alırsa, bu şekilde elde edilen izoterm, maddenin iki fazlı durumunu niteliksel olarak doğru bir şekilde tanımlayacaktır. Bu çizginin konumu, Clausius gösterimindeki (2.13.7) termodinamiğin ikinci yasası 1234531 kapalı tersinir çevrime uygulanırsa belirlenebilir:
. (3.6.1)
1234531 numaralı yolun tamamı boyunca maddenin sıcaklığı değişmeden kaldığından (bu yol aynı izotermin iki olası varyantının bölümlerinden oluştuğundan), son denklem şu şekilde yazılabilir:
. (3.6.5) deneysel verilerle, bu değerin elde edildiği van der Waals denkleminin yaklaşık olduğunu göstermektedir, ancak maddenin durumundaki değişimin niteliksel resmi denklem tarafından oldukça doğru bir şekilde aktarılmaktadır. Maddenin halinin daha doğru bir denklemini elde etmek için çok sayıda girişimde bulunulmuştur. Ancak bu denklemler van der Waals denkleminde olduğu gibi fiziksel anlamı belirsiz olan çok sayıda düzeltme faktörü içermektedir.
Akademisyen N. N. Bogolyubov, en genel haliyle istatistiksel fizik yöntemlerini kullanarak durum denklemini elde etti.
 ,
(3.6.12)
,
(3.6.12)
yalnızca sıcaklığın fonksiyonu olan sözde viral katsayılar nerede? Bogolyubov denkleminden, molar hacmin değeri ne kadar büyük olursa, oldukça doğru bir sonuç elde etmek için serinin terim sayısının o kadar az dikkate alınması gerektiği sonucu çıkar. Kuvvet serisinin tüm terimleri ortadan kalktığında ve denklem (3.6.12) biçimini aldığında, yani beklendiği gibi, Bogolyubov denklemi Mendeleev-Clapeyron denklemine dönüşür. Virial katsayılar tamamen teorik yöntemlerle hesaplanamaz ve bu nedenle deneysel veriler kullanılarak belirlenmelidir. Ancak bu problem o kadar karmaşıktır ki, durum denklemini basitçe deneysel verileri tanımlayan bir enterpolasyon formülü biçiminde elde etmek daha uygundur.
Bir sıvının buharlaşma ısısının belirlenmesi
Sıvı ve buhar arasındaki denge için Clapeyron-Clausius denklemi aşağıdaki şekilde türetilebilir.
Termodinamiğin ikinci yasasına göre, eğer bir sistem dengedeyse, o zaman verilen koşullar altında ( R, T) hiçbir iş yapılmadı
Ap = 0; G Ve -G P = 0; G Ve = G P (2)
yani saf bir sıvının ve buharının Gibbs serbest enerjileri eşittir (bunlar denge koşullarıdır).
Dengeyi belirleyen koşullardan birini örneğin sıcaklığı değiştirelim (yani sistemi ısıtalım) T), bunun sonucunda yeni bir basınç, yeni bir sıvı-buhar dengesi oluşacaktır:
G " Ve = G " P (3)
veya G Ve = G P (4)
Harici parametrede sonsuz küçük miktarda bir değişiklik meydana gelirse - dT o zaman izobarik-izotermal potansiyeller sonsuz küçük bir değerle değişecektir:
dG Ve =dG P (5)
İzobarik-izotermal potansiyel sistemin serbest enerjisini temsil eder ve basınç ve sıcaklığın bir fonksiyonudur:
dG=VdP–SDT(6)
bu nedenle doymuş buhar basıncı ile sıcaklık arasında niceliksel bir ilişki kurmak için kullanılabilir.
(6)'yı (5)'te değiştirdikten sonra denge durumundayız
V Ve dP-S Ve dT = V P dP-S P dT(7)
nereden (8)
Nerede ( S P -S Ve) Ve ( V P -V Ve) - bir maddenin sıvıdan buhar durumuna geçişi sırasında sırasıyla sistemin entropisinde ve hacminde değişiklik. Termodinamiğin ikinci yasasına göre, buharlaşma sırasında bir sistemin entropisindeki değişiklik, buharlaşma ısısının azalmasına eşittir.
 (9)
(9)
İfadeyi (9) (8)'e değiştirerek şunu elde ederiz:
 (10)
(10)
nerede ∆ H İSS ve ∆ V İSS- sırasıyla buharlaşma sırasında entalpi ve hacimdeki değişim ve T balya- kaynama sıcaklığı.
Denklem (10) Clapeyron-Clausius denklemi denir . (10)'a göre, suyun faz diyagramındaki çizgilerin eğimi (Şekil 1), türevin işareti ile belirlenir. dP/dT veya karşılıklı dT/dP- Artan basınçla sıcaklıktaki değişimin karakterize edilmesi.
Faz geçişlerinden buharlaşma ve erimeyi dikkate alıyoruz. Buharlaşma ısısı (sıvı fazın gaz fazına geçişi) pozitiftir. Molar buharlaşma ısısı Bir mol sıvı maddenin buharlaşması için harcanan ısı miktarıdır. Buharlaşma sırasında gazın hacmi her zaman karşılık gelen sıvı hacminden daha büyüktür, yani denklem (10)'da V P >V Ve. Bu yüzden dP/dT, ve bu nedenle dT/dP ayrıca her zaman pozitiftir ( dT/dP> 0). Sonuç olarak, buharlaşma sıcaklığı artan basınçla birlikte daima artar (eğri TAMAM incirde. 1 veya tabloya bakın. 1 Ek). Sıcaklık arttıkça sıvının üzerindeki doymuş buhar basıncı artar ve kritik sıcaklıkta maksimum değerine ulaşır. İkincisi, bir maddenin sıvı ve buhar fazları arasında dengenin mümkün olduğu sınırlayıcı sıcaklıktır (örneğin su için 374,12 o C'dir). Daha yüksek sıcaklıklarda bir madde yalnızca gaz halinde olabilir ve doymuş buhar kavramı anlamını yitirir.
Füzyon ısısı - katı fazın sıvı faza geçişi de her zaman pozitiftir.

Pirinç. 1. Düşük basınçlarda suyun durumunun diyagramı
Bölgeler: 1 - katı faz (buz); II-sıvı; III - par.
Eğriler: AO - süblimasyon; Tamam - buharlaşma; OV - erime.
O, üç fazın dengesine karşılık gelen üçlü bir noktadır.
Genel durumda sıvı fazın hacmi, aynı miktardaki katı fazın hacminden daha fazla veya daha az olabilir. Buradan denklem (10)'a göre şu değer ortaya çıkar: dP/dT veya ters değeri dT/dP, pozitif veya negatif olabilir. Bu, artan basınçla erime noktasının yükselebileceği veya düşebileceği anlamına gelir. Büyüklük dT/dPçoğu madde için pozitiftir. Yalnızca su, bizmut ve erime noktasındaki sıvının yoğunluğunun katı fazın yoğunluğundan daha büyük olduğu diğer birkaç madde için negatif bir değere sahiptir ( V Ve -V T) < 0. В связи с этим при увеличении давления температура плавления льда понижается (криваяdoğum günü).
Dikkate alınan modellerin düşük basınçlar için geçerli olduğuna dikkat edilmelidir.
Clapeyron-Clausius denklemi (10) aşağıdaki yaklaşımlar alınarak dönüştürülebilir:
1) ∆'dan beri V İSS =(V P -V Ve) >> 0 (örneğin su için, buhar halindeki molar hacim no. V P≈ 22400 cm2 ve sıvı halde V Ve≈ 18 cm3), o zaman büyük bir hata olmadan değeri ihmal edebiliriz V Ve ve bunu kabul et ∆ V İSS ≈ V P .
2) Çok yüksek olmayan basınç ve sıcaklıklarda (kritikten uzak), ideal gazların durum denklemi gerçek sistemlere uygulanabilir. Bu durumda elde edilen hatanın önemsiz olduğu ortaya çıkıyor.
 (11)
(11)
(11)'i (10)'a koyarsak şunu elde ederiz:
 (12)
(12)
hangi dönüşümden sonra
 (13)
(13)
formu alır
 (14)
(14)
Buharlaşma ısısı sıcaklığa bağlıdır : Sıcaklık arttıkça buharlaşma ısısı azalır. Kritik sıcaklıkta buharlaşma ısısı sıfırdır. Ancak kritik sıcaklıktan uzak sıcaklıklarda ∆ değerindeki değişiklikler N İSS sıcaklık çok iyi değil. Çok geniş olmayan bir sıcaklık aralığında∆ N İSS sabit kabul edilebilir.
Clapeyron-Clausius denkleminin (14) sıcaklık aralığında entegrasyonu T 1 ve T 2, basınçlara karşılık gelir R 1 ve R 2 sabit ∆'da N İSS, verir
 (15)
(15)
veya ondalık logaritmalara geçerken
 (16)
(16)
(R- evrensel gaz sabiti 8,314 J/mol K'ye eşittir).
Denklemler (15), (16) buharlaşma ısısını hesaplamamızı sağlar. Bunu yapmak için deneysel verilere dayanarak bir bağımlılık oluşturulur benNP=F(1/T) veya lgP=F(1/T) ve ortaya çıkan düz çizgi üzerinde iki nokta seçin (Şek. 2). Bu noktalara karşılık gelen basınç logaritması ve ters sıcaklık değerlerini denklem (17) ile değiştirin:
 (17)
(17)
∆ değeri N İSS denklem (17)'ye göre alınan sıcaklık aralığına bağlıdır ve gerçeğe ne kadar yakınsa bu aralık o kadar küçüktür. Ancak böyle bir hesaplama, kaynama noktası ve buhar basıncının çok hassas ölçümlerini gerektirir.
∆'yi hesaplamak için N İSS nispeten geniş bir sıcaklık aralığında (50...100 o C), düz çizgiye en doğru şekilde uyan noktaları seçmelisiniz lgP=F(1/T).
Bir sıvının kaynama noktası, belirli bir sıcaklıktaki buhar basıncı ve buharlaşma ısısı maddenin spesifik sabitleridir değerleri birçok teorik ve pratik hesaplama için gerekli olan değerlerdir. Bu verilere dayanarak kimyasalların saflığını belirlemek, karışımların damıtma yoluyla ayrılmasını hesaplamak ve gaz fazındaki reaksiyonu gerçekleştirmek için gereken sıvının buharlaştırılması için enerji maliyetlerini hesaplamak mümkündür.
Moleküler parametreler kullanılarak buharlaşma ısısının hesaplanması her zaman varsayımlar içerir. Bir dizi koşulun karşılanması durumunda yaklaşık ve uygundur. Ancak buharlaşma ısısını sistemin diğer termodinamik özelliklerine bağlayan temel bir Clapeyron-Clausius denklemi vardır ve bu denklem kesinlikle termodinamiğin ikinci yasasına dayanarak elde edilir.
Carnot çevrimini gerçekleştiren çalışma maddesi iki fazlı sıvı-doymuş buhar sistemi olsun. Böyle bir sistemin başlangıç durumunu Şekil 8.17'de 1. nokta olarak gösteriyoruz. Sistemin 1. durumdan 2. duruma kadar bir sıcaklıkta izobarik-izotermal genleşmesini gerçekleştirelim. Bu durumda, belirli bir sıvı kütlesi buharlaşacak ve buna göre sıvının buharlaşma ısısına eşit ısı emilecektir. termostattan. 2 ve 1 noktalarındaki hacim farkı, maddenin buharlaşmış kütlesi için gaz ve sıvı hallerindeki hacim farkına eşittir: Durum 2'den, iki fazlı sistem adyabatik olarak daha düşük bir sıcaklıkla durum 3'e aktarılır. %7. Durum 3'ten, çalışma maddesi izobarik-izotermal olarak durum 4'e aktarılırken, buharların bir kısmı yoğunlaşır ve ısı buzdolabına salınır.Durum 4'ten, iki fazlı sistem, adyabatik sıkıştırma yoluyla başlangıç durumuna aktarılır. Döngü işi:
çevrim verimliliği nerede
![]()
Küçük sıcaklık (basınç) farklarında çevrim işi şuna eşittir:
(83.3) ve (83.2)'yi kullanarak (83.1)'i yeniden yazıyoruz:
![]()
Sınırı değiştirerek ve geçerek şunu elde ederiz:
![]()
Bu ilişki, termodinamiğin birinci yasası ortaya çıkmadan önce Fransız mühendis Clapeyron (1832) tarafından bulunmuştur.

Bu denklemin modern türetilmesi Clausius tarafından verilmiştir, bu yüzden buna Clapeyron-Clausius denklemi adı verilmektedir. Bu denklem, doymuş buhar basıncının sıcaklığa bağımlılığı ve sıvı ve buhar hacimleri (özgül, molar) biliniyorsa, buharlaşma ısısını (özgül, molar) hesaplamanıza olanak tanır.
Türev deneysel olarak bulunan bağımlılıktan (doymuş buhar basıncının sıcaklığa bağlılığı) belirlenir.
Clapeyron-Clausius denklemi sadece sıvı-buhar geçişi için değil, diğer tüm faz geçişleri için de geçerlidir. Fazın sıcaklık değişimi ile dengede olduğu basınç değişimini ifade eder. Böylece erime için denklem (83.4) şu şekli alır:
![]()