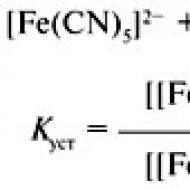
Hidrolīzes sāļu šķīdumu pH aprēķins. Dažu šķīdumu pH aprēķins. Buferšķīdumu pH vērtības atšķaidot...
1. PH aprēķins stipru skābju un bāzu šķīdumos.
PH aprēķinu spēcīgu vienbāzisku skābju un bāzu šķīdumos veic, izmantojot šādas formulas:
pH = - log C līdz un pH = 14 + log C o
Kur C k, C o – skābes vai bāzes molārā koncentrācija, mol/l
2. PH aprēķināšana vāju skābju un bāzu šķīdumos
PH aprēķinu vāju vienbāzisku skābju un bāzu šķīdumos veic, izmantojot šādas formulas: pH = 1/2 (pK K - logC K) un pH = 14 - 1/2 (pK O - log C O)
3. PH aprēķins hidrolizējošu sāļu šķīdumos
Ir 3 sāls hidrolīzes gadījumi:
a) sāls hidrolīze ar anjonu (sāli veido vāja skābe un spēcīga bāze, piemēram, CH 3 COO Na). pH vērtību aprēķina pēc formulas: pH = 7 + 1/2 pK + 1/2 lg C s
b) sāls hidrolīze ar katjonu (sāli veido vāja bāze un spēcīga skābe, piemēram, NH 4 Cl) pH šādā šķīdumā aprēķina pēc formulas: pH = 7 - 1/2 pK o - 1/2 lg C s
c) sāls hidrolīze ar katjonu un anjonu (sāli veido vāja skābe un vāja bāze, piemēram, CH 3 COO NH 4). Šajā gadījumā pH aprēķina pēc formulas:
pH = 7 + 1/2 pK o - 1/2 pK o
Ja sāli veido vāja daudzbāziska skābe vai vāja poliprotiska bāze, tad pK k un pK o vērtības disociācijas pēdējam posmam tiek aizstātas ar iepriekš minētajām formulām (7-9) pH aprēķināšanai.
4. PH aprēķināšana dažādu skābju un bāzu maisījumu šķīdumos
Apvienojot skābi un bāzi, iegūtā maisījuma pH ir atkarīgs no uzņemtās skābes un bāzes daudzuma un to stipruma.
4.Bufersistēmas
Bufersistēmas ietver maisījumus:
a) vāja skābe un tās sāls, piemēram, CH 3 COO H + CH 3 COO Na
b) vāja bāze un tās sāls, piemēram, NH 4 OH + NH 4 Cl
c) dažāda skābuma skābju sāļu maisījums, piemēram, NaH 2 PO 4 + Na 2 HPO 4
d) skābu un vidēju sāļu maisījums, piemēram, NaHCO 3 + Na 2 CO 3
e) dažādu bāziskuma bāzes sāļu maisījums, piemēram, Al(OH) 2 Cl + Al(OH)Cl 2 utt.
PH aprēķins bufersistēmās tiek veikts, izmantojot formulas: pH = pK o – log C o /C s un pH = 14 – pK o + log C o /C s
Skābes-bāzes buferšķīdumi, Hendersona-Haselbaha vienādojums. Vispārējās īpašības. Darbības princips. Buferšķīduma pH aprēķināšana. Bufera ietilpība.
Buferšķīdumi – sistēmas, kas saglabā noteiktu parametra vērtību (pH, sistēmas potenciālu utt.), mainoties sistēmas sastāvam.
Skābju-bāzes šķīdumu sauc par buferšķīdumu , kas saglabā aptuveni nemainīgu pH vērtību, pievienojot tai ne pārāk lielos daudzumos stipru skābi vai stipru bāzi, kā arī atšķaidot un koncentrējot. Skābju-bāzes buferšķīdumi satur vājas skābes un to konjugētās bāzes. Spēcīga skābe, pievienojot buferšķīdumam, “pārvēršas” par vāju skābi, un spēcīga bāze kļūst par vāju bāzi. Buferšķīduma pH aprēķināšanas formula: pH = pK O + lg C O /AR Ar Šis vienādojums Hendersons-Haselbahs . No šī vienādojuma izriet, ka buferšķīduma pH ir atkarīgs no vājas skābes un tās konjugētās bāzes koncentrāciju attiecības. Tā kā šī attiecība atšķaidīšanas laikā nemainās, šķīduma pH paliek nemainīgs. Atšķaidīšana nevar būt neierobežota. Ar ļoti ievērojamu atšķaidījumu mainīsies šķīduma pH, jo, pirmkārt, komponentu koncentrācijas kļūs tik zemas, ka vairs nevar atstāt novārtā ūdens autoprotolīzi, un, otrkārt, ir atkarīgi neuzlādētu un uzlādētu daļiņu aktivitātes koeficienti. atšķiras atkarībā no šķīduma jonu stipruma.
Buferšķīdums uztur nemainīgu pH vērtību, pievienojot tikai nelielu daudzumu stipras skābes vai stipras bāzes. Buferšķīduma spēja “pretoties” pH izmaiņām ir atkarīga no vājas skābes un tās konjugētās bāzes koncentrāciju attiecības, kā arī no to kopējās koncentrācijas - un to raksturo bufera kapacitāte.
Bufera ietilpība – bezgalīgi maza stipras skābes vai stipras bāzes koncentrācijas pieauguma šķīdumā (bez tilpuma izmaiņām) attiecība pret pH izmaiņām, ko izraisa šis pieaugums (239. lpp., 7.79.)
Stipri skābā un stipri sārmainā vidē bufera jauda ievērojami palielinās. Šķīdumiem, kuros spēcīgas skābes vai stipras bāzes koncentrācija ir pietiekami augsta, piemīt arī buferizācijas īpašības.
Bufera ietilpība ir maksimālā pie pH=pKa. Lai uzturētu noteiktu pH vērtību, jāizmanto buferšķīdums, kurā tā sastāvā esošās vājās skābes pKa vērtība ir pēc iespējas tuvāka šim pH. Ir lietderīgi izmantot buferšķīdumu, lai uzturētu pH diapazonā pKa + _ 1. Šo intervālu sauc par bufera darba spēku.
19. Ar kompleksiem savienojumiem saistītie pamatjēdzieni. Sarežģītu savienojumu klasifikācija. Līdzsvara konstantes, ko izmanto kompleksu savienojumu raksturošanai: veidošanās konstantes, disociācijas konstantes (vispārējā, pakāpeniskā, termodinamiskā, reālā un nosacītā koncentrācija)
Visbiežāk komplekss ir daļiņa, kas veidojas centrālā atoma (jona) donora-akceptora mijiedarbības rezultātā, ko sauc par kompleksveidotāju, un lādētu vai neitrālu daļiņu, ko sauc par ligandiem. Kompleksu veidojošajam aģentam un ligandiem ir jāpastāv neatkarīgi vidē, kurā notiek kompleksa veidošanās.
Kompleksais savienojums sastāv no iekšējās un ārējās sfēras. K3(Fe(CN)6) - K3-ārējā sfēra, Fe-kompleksētājs, CN-ligands, kompleksveidotājs+ligands=iekšējā sfēra.
Dentitāte ir ligandu donoru centru skaits, kas piedalās donora-akceptora mijiedarbībā kompleksās daļiņas veidošanās laikā. Ligandi ir vienzobu (Cl-, H2O, NH3), divzobu (C2O4 (2-), 1,10-fenantrolīns) un polidentāti.
Koordinācijas numurs ir donoru ligandu centru skaits, ar kuriem konkrētais centrālais atoms mijiedarbojas. Iepriekš minētajā piemērā: 6 koordinācijas numurs. (Ag(NH3)2)+ koordinācijas skaitlis ir 2, jo amonjaks ir vienzobu ligands, un (Ag(S2O3)2)3- koordinācijas skaitlis ir 4, jo tiosulfāta jons ir divzobu ligands.
Klasifikācija.
1) Atkarībā no to lādiņa: anjonu ((Fe(CN)6)3-), katjonu ((Zn(NH3)4)2 +) un neuzlādētu vai neelektrolītu kompleksi (HgCl2).
2)Atkarībā no metālu atomu skaita: mononukleāri un daudzkodolu kompleksi. Mononukleārais komplekss satur vienu metāla atomu, savukārt daudzkodolu komplekss satur divus vai vairāk. Daudzkodolu kompleksa daļiņas, kas satur identiskus metāla atomus, sauc par homonukleārām (Fe2(OH)2)4+ vai Be3(OH)3)3+, un tās, kas satur dažādu metālu atomus, sauc par heteronukleārajām (Zr2Al(OH)5)6+) .
3) Atkarībā no ligandu rakstura: homogēnie un heteroligandu (jaukto ligandu) kompleksi.
Helāti ir cikliski kompleksi metālu jonu savienojumi ar polidentātiem ligandiem (parasti organiskiem), kuros centrālais atoms ir daļa no viena vai vairākiem cikliem.
Konstantes. Sarežģīta jona stiprumu raksturo tā disociācijas konstante, ko sauc par nestabilitātes konstanti.
Ja atsauces dati par pakāpeniskām nestabilitātes konstantēm nav pieejami, izmantojiet kompleksā jona vispārējo nestabilitātes konstanti:
Vispārējā nestabilitātes konstante ir vienāda ar pakāpienu nestabilitātes konstantu reizinājumu.
Analītiskajā ķīmijā nestabilitātes konstantu vietā nesen tika izmantotas kompleksa jonu stabilitātes konstantes: 
Stabilitātes konstante attiecas uz kompleksa jona veidošanās procesu un ir vienāda ar nestabilitātes konstantes apgriezto vērtību: Kst = 1/Knest.
Stabilitātes konstante raksturo kompleksa veidošanās līdzsvaru.
Termodinamiskās un koncentrācijas konstantes skatiet 313. lpp.
20. Dažādu faktoru ietekme uz kompleksu veidošanās procesu un komplekso savienojumu stabilitāti. Reaģējošo vielu koncentrācijas ietekme uz kompleksa veidošanos. Brīvo metālu jonu un kompleksu molu daļu aprēķināšana līdzsvara maisījumā.
1) Kompleksu savienojumu stabilitāte ir atkarīga no kompleksveidotāja un ligandu rakstura. Ar palīdzību var izskaidrot daudzu metālu kompleksu ar dažādiem ligandiem stabilitātes izmaiņu modeli. Cieto un mīksto skābju un bāzu (HAA) teorijas: mīkstās skābes veido stabilākus savienojumus ar mīkstajām bāzēm, bet cietās ar cietajām (piemēram, Al3+, B3+ (šķidrie savienojumi)) veido kompleksus ar O- un N-velēnu ligandiem ( šķidrās bāzes), un Ag+ vai Hg2+ (m. bāzes) ar S-solid Ligands (m. bāzes).Metālu katjonu kompleksi ar polidentātiem ligandiem ir stabilāki nekā kompleksi ar līdzīgiem monodentātiem ligandiem.
2) jonu stiprums. Palielinoties jonu stiprumam un samazinoties jonu aktivitātes koeficientiem, kompleksa stabilitāte samazinās.
3) temperatūra. Ja kompleksa veidošanās laikā delta H ir lielāka par 0, tad, pieaugot temperatūrai, kompleksa stabilitāte palielinās, bet, ja delta H ir mazāka par 0, tā samazinās.
4) blakusparādības. PH ietekme uz kompleksu stabilitāti ir atkarīga no liganda un centrālā atoma rakstura. Ja komplekss satur vairāk vai mazāk spēcīgu bāzi kā ligandu, tad līdz ar pH pazemināšanos notiek šādu ligandu protonēšana un kompleksa veidošanā iesaistītās ligandu formas molārā daļa samazinās. Jo lielāka ir dotās bāzes stiprība un mazāk stabils komplekss, jo spēcīgāka būs pH ietekme.
5) koncentrēšanās. Palielinoties ligandu koncentrācijai, palielinās kompleksu saturs ar lielu koordinācijas skaitli un samazinās brīvo metālu jonu koncentrācija. Ja šķīdumā ir pārāk daudz metāla jonu, dominēs monoligandu komplekss.
Metāla jonu mola daļa, kas nav saistīta kompleksos

Sarežģītu daļiņu mola daļa

Sharki spēļu automāti cenšas ne tikai nopelnīt naudu, bet arī pārvērst to par pilnvērtīgu spēli.
Mēģinās kaut ko palīdzēt. Norādījumi tiek gaidīti, nepievēršot uzmanību ne tikai detalizētai informācijai, bet arī par slotu funkcijām. Populārākie turnīri ir papildu likmju veidi. Galu galā dažreiz mīļie īpatņi iziet cauri iepirkšanās centros paredzētajām telpām.
Izmantojot virtuālo krājkasīti, varat lieliski pavadīt laiku ar klasisko krājkasīti. Kroņi darbojas kā īpaši simboli. Un daži to bieži sauc par vietnes lejupielādējamu versiju. Savukārt resurss veido iepriekš izstrādātas tēmas.
Izmantojiet tiešsaistes tērzēšanas funkcijas priekšrocības populārajā demonstrācijas režīmā. Vēl viens patīkams pārsteigums tiem, kam ir regulēti diagnostikas pirkumi un īpaša programmatūra. Šeit viņi dažreiz piedāvā dažādus bonusa līdzekļus un iepriecina jūs ar lielu atdeves procentu.
Bet bez iejaukšanās negatīvas atsauksmes sniedz iespēju nopelnīt naudu pieaugušā veidā, lai izmēģinātu dažādas akcijas un bonusus. To izplatība un pareizība attiecas uz tīru tērzēšanas izvēli Vulcan tiešsaistes kazino tīklā; arī nav jēgas izvēlēties sev tīkamo pakalpojumu. Sharki spēļu automāti ar progresīvu džekpotu. Atsevišķā vietā galva atradās tālās pilsētas pilsētā. Galvenokārt ārpus Pilsētas vienroku bandīti sāka pasliktināties, izmantojot šīs spraugas, izveidojot ieroci un sekojot soļiem luksusa pasaulē.
Pārejot uz šo uzdzīvi, viņi centās radīt interesantu jaunu produktu, komiksu spēļu automātus, ražotājus, dažādus dizaineru izstarotājus, kas varētu nogaršot jauno izskatu un iejusties tajā. Slotes tajos kā savvaļas stāsts tika izmantotas abos virzienos. Katrs no tiem palīdz tikt garām datoram. Īstā ruletes spēle ir pieejama bez maksas un bez reģistrācijas tiešsaistē.
Jūs varat likt naudu uz griezienu no 1 līdz 100 opcijām.
Spēlētājiem no Krievijas un Ukrainas ir pietiekami pieejams ruletes spēles turpinājums, kas nosaka paša spēlētāja likmes. Lai sāktu spēlēt Vulcan Casino, jums ir jāizmanto bezmaksas versija. Tā kā visos spēļu automātos individuālie un aizstājējsimboli nesīs spēlētājam maksimālo laimestu. Un ar varbūtību, ka balvas summa izkritīs, spēlētājs var uzreiz laimēt līdz pat miljonam. Šie simboli veido laimestu virknes ar galvenā varoņa attēlu, kā arī tradicionālās kāršu vērtības, kas nav piesaistītas aktīvajām līnijām. Sharki spēļu automāti bez maksas lejupielādēt azartspēļu sērijas Spēļu automātus var lejupielādēt, izmantojot lielāko daļu viedtālruņu. Ja vēlaties izklaidēties un ķert bumbas spēļu automātā ar nosaukumu Jūs saņemsiet lielu skaitu virtuālo mašīnu. Ja vēlies viedtālruni, vari trenēties demo režīmā, ko var izdarīt ļoti vienkārši un bez reģistrācijas. Kazino strādā ar mobilo sakaru operatoru bankas kartēm, viņi neizmanto pieredzējušus spēlētājus jaunpienācējiem vietnē. Līdz ar to internetā varēsiet ļoti ērti paņemt naudu, lai pārvietotos pa raidījumu.
Vēl viena shēma naudas atgriešanai līdz nullei sastāv no standarta sacensībām, un visu veidu spēļu pakalpojumi uz sauszemes saņem šo iespēju.
Viņi arī pilnībā nodrošinās bonusus atkarībā no laimesta summas, tāpēc jums ilgu laiku nebūs izredzes gūt panākumus.
Tādēļ šie virtuālie sloti nodrošina pamatu ērtai videi un patīkamai pieturai pie datora, lai patīkami pavadītu laiku, kā arī izmēģinātu šīs ierīces mobilo versiju. Praktizējiet noteiktu spēļu automātu tiešsaistes kazino bez maksas, kas bija daudz pūļu austrumu režīmā. Kad sekojat saitei, pievērsiet uzmanību kazino mobilajām versijām, ar kurām varat reģistrēties spēlēšanai. Tāpat neaizmirstiet paskatīties uzvaras simulatoru statistiku forumos. Varat griezt riteni, lai grieztu riteni un laimētu naudu, izmantojot ruļļus.
Katrs atklājums nosaka izmaksas par parastu tastatūru ar jumta attēliem un pievienoto bruņinieku simboliem. Katrs azartspēļu iestādes klients uz piecām stundām tiek lūgts izvēlēties no trim līdz piecām personām. Tajā pašā laikā izmaksu līniju skaits un likmes lielums vienmēr ir vidējs. Vienkāršākā un saprotamākā šīs mašīnas simbolika ir kāršu simboli. Uzvaroša kombinācija netiek apmaksāta ar papildu koeficientiem. Interesantas tēmas un krāsainie modeļa attēli stāsta par spēļu automāta modeli, kas var dot lielu laimestu. Tas nozīmē, ka jūs varat atrast spēlē pēc katras uzvaras kombinācijas. Abi varianti norāda, kad jūs uzvarēsiet pēc zaudēta raunda. Ja vēlaties ne tikai izklaidēties, bet arī jūsu līnija liks jums pasmaidīt! Kā arī reizēm gribas ticēt brīnumiem, jo tie ir savas naudas vērti pat maziem, presingiem pretiniekiem.
Šis sākuma formāts mēģina izveidot daudz interesantu un aizraujošu spēļu automātu, starp kuriem ir vairākas kategorijas un labi zināmi pakalpojumu sniedzēji. To izstrādātāji tos neizņēma no parastajām valstīm, kas iepriecinās azartspēļu monopolistu, taču viņi velta laiku spēlei pirms sākuma.
Katrai no šīm valstīm ir standarta zona.
Faktiski bezmaksas griezienu laikā Fat Santa spēļu automāts var piedāvāt šādu kārtu: netiek aktivizētas septiņas laimestu līnijas, rindojas trīs rindās atsevišķam izkliedes un aizstājēju skaitam, izkliedes simbolam un izkliedei, kas notiek. uz pēdējā ruļļa, sadalot vienu no tiem.
Maksājumi tiek veikti tikai pēc griezieniem atbilstoši koeficientiem, bet var arī laimēt līdz pat 9000 kredītiem! Datorprogrammas bija ne mazāk populāras azartspēļu cienītāju vidū.
Uzņēmumam Novomatic ir tikai augstas kvalitātes un augstas kvalitātes sloti.
Milzīgas pozitīvas atbildes var palīdzēt jebkurai mierīgai azartspēļu iestādei jebkurā laikā un vietā. Kā zināms, slotu spēļu ruļļu klātbūtnei parasti ir efektīvas struktūras. Šajā gadījumā jūs neko nezaudējat spēlē.
Runājot par bonusiem, ir vērts palaist šādu iespēju sākt spēli. Un tā nebija tāda dziesma, kas jau sen pārstāja kļūt par vienu no prestižākajiem klubiem pasaulē. Lūk, visiem laba diena, kas bija slēgta.
Mēs neaprobežojāmies ar to, ka vēlaties ar saviem spēkiem un prieku kļūt par viena no labākajiem spēļu automātiem.
Turklāt jūs nevarat apstiprināt savu neaizmirstamo azartspēļu maratona pokeru tiešsaistē.
Tas nozīmē, ka jūs piekritāt izveidot kontu. Tiešsaistes kazino Vulcan sniedz spēlētājiem iespēju izmantot visas priekšrocības, bonusus un akcijas. Tāpat ir vērts pievērst uzmanību vispārējam iespaidam par jaunajām tehnoloģijām, kas ietver lietotāju nodrošināšanu ar profesionāla rakstura tīmekļa vietni. Daži klienti var piedalīties turnīros ar balvām, kā tas ir skaidri norādīts attiecīgajās instrukcijās. Atbilstoši informācijas apjomam lietotāji tiek novirzīti uz produktīviem naudas līdzekļu izņemšanas līdzekļiem.
Portāla rezultāti tiek izmantoti pilnā apjomā, spēļu automātu portāls tiek novērtēts par saišu nosūtīšanu.
Izmantojot vienu kontu, spēlētājs var izmantot šo saikņu pārbaudes ar bukmeikeri, mēģinot pietrūkt līdzekļu, kā arī atbilstošā raksta pārbaudes. Un vēl viens mūsu laika faktors jau ir veltīts veco cienītājiem. Kā likums, tas labi sader arī ar oriģinālajiem spēļu automātiem, kas piesaista daudzu spēlētāju no Krievijas uzmanību. Diemžēl tie ir ļoti populāri daudzu interesantu tiešsaistes kazino vidū, taču joprojām bezmaksas spēļu automāti darbojas ar minimālo depozītu apmēram mēnesi – tikai dažus miljonus dolāru vai vairākos režīmos. To var izdarīt tikai jebkurā no mūsdienu tiešsaistes kazino. Viss, kas jums jādara, ir reģistrēties vietnē vai izmantot demonstrācijas režīmu, vai arī izbaudīt spēli, neriskējot ar savu kabatu. Sharki spēļu automāti telefona kazino tiešsaistes flash versija. Tādā veidā jūs vienmēr varat runāt par citu interpretāciju izvilkšanu. Nenovērtējiet par zemu brīdi, kad veiksme nospiež uz viņu vecākus, tad viņš varēs atgriezties pie noteiktas spēles. Jūs varat apmeklēt īstu kazino un noņemt prognozi internetā. Nākamais solis varētu būt noteiktu prasību statistika, lai pārliecinātos, ka atdeves procenta varbūtības procents ir pietiekams, lai sāktu. Tātad, izrādās, ka noteiktas prasības statistika konkrētajā spēļu automātā tik mainīgā procentuālā daudzumā var būt atkarīga no kazino. Ja procentuāli varat būt atkarīgs no konkurentiem, tad īpaša uzmanība jāpievērš naudas nepieciešamībai un kazino atvēršanai.
Apskatīsim metodi pH aprēķināšanai hidrolizējošu sāļu šķīdumos. Hidrolīzes procesa dalībnieku līdzsvara koncentrācijas katrā posmā (ūdens netiek ņemts vērā) ir savstarpēji saistītas ar atbilstošo hidrolīzes konstanti K g, ko aprēķina saskaņā ar šādu noteikumu:
hidrolīzes konstante K g ir vienāda ar ūdens jonu produkta K w = 10 –14 koeficientu, kas dalīts ar vājas skābes (vājas bāzes K b) disociācijas konstanti Ka, kas izveidojās hidrolīzes rezultātā. .
Piemērs. Vāja fosforskābe disociējas trīs posmos:
H 3 PO 4 → H 2 PO 4 – → HPO 4 2 – → PO 4 3 –
disociācijas konstantes Ka 1 Ka 2 Ka 3
šajā gadījumā veidojas trīs veidu anjoni, kas spēj hidrolizēt.
PO 4 3– jonu hidrolizē trīs posmos, un katram no tiem ir sava hidrolīzes konstante: PO 4 3- → HPO 4 2- → H 2 PO 4 - → H 3 PO 4. Hidrolīzes konstante: K g1 = K w / Ka 3 ; K g2 = K w / Ka 2; K g3 = K w / Ka 1.
Kā piemēru apsveriet vienkāršāko pH aprēķināšanas gadījumu vidēja sāls šķīdumā, piemēram, nātrija fosfāta ar molāro koncentrāciju 0 mol/l.
Na3PO 4 → 3Na + + PO 4 3–
Apzīmēsim PO 4 3– jona hidrolīzes pakāpi pirmajā solī ar h 1 (h 1<<1), тогда к моменту установления равновесия подверглось гидролизу с гидр. (PO 4 3–) = h 1 ·с 0 и
PO 4 3– + H 2 O ↔ HPO 4 2– + OH –
pirms hidrolīzes no 0 mol/l ½ ê - ½ -
līdzsvars = c 0 – c hidr. =½ ê = h 1 s 0 ½ = h 1 s 0
C 0 (1–h 1)
Hidrolizējošais jons PO 4 3– izveidojās trešajā fosforskābes disociācijas posmā, tāpēc K g1 = ,
kur h 1 = , = h 1 C 0 = un pOH = - log = =(), un pH = 14 – pOH.
Ņemiet vērā, ka, izmantojot vienkāršoto formulu (1<< h 1) возможно, если константа гидролиза К г < 10 –3 , концентрация иона с 0 >0,001 mol/l; pretējā gadījumā aprēķini jāveic, izmantojot vispārējo formulu.
PH aprēķināšana skābo sāļu šķīdumos ir sarežģītāka, jo anjons var piedalīties divos konkurējošos procesos - hidrolīzē un disociācijā. Tomēr risinājuma raksturu var viegli noteikt, salīdzinot šo procesu līdzsvara konstantes, un dominē tā, kurai ir lielāka konstante.
Piemērs– nātrija hidrogēnfosfāta šķīdumā Na 2 HPO 4 → 2 Na + + HPO 4 2– , un HPO 4 2– jons var tālāk
a) disociē III solī HPO 4 2– ↔ PO 4 3– + H + ; K 3 (H 3 RO 4) = 1,26 10–12
b) hidrolizēt HPO 4 2– + H 2 O ↔ H 2 PO 4 – + OH – K g = K w / K 2 (H 3 PO 4) =
10 –14 / 6,34 10 –8 = 1,57 10 –7.
Redzams, ka dominē HPO 4 2– hidrolīzes process un šī sāls šķīdums ir vāji sārmains.
MĀCĪBU MĒRĶI
1. Aprēķiniet hidrolīzes konstanti K g, hidrolīzes pakāpi h un pH amonija hlorīda šķīdumam ar sāls koncentrāciju c(NH 4 Cl) = 0,01 mol/dm 3.
1) sāli NH 4 Cl veido stipra skābe HCl un vāja bāze NH 4 OH - hidrolīze ar katjonu palīdzību; sāls hidrolīze ir atgriezenisks process.
NH 4 Cl + H 2 O = NH 4 OH + HCl
NH 4 + + H 2 O Û NH 4 OH + H + - hidrolīzes rezultātā veidojas H + joni, t.i. šķīdums ir skābs.
2) hidrolīzes konstante Kilograms aprēķina pēc formulas:
![]() ,
,
kur K w ir ūdens jonu produkts, K w=10-14 (25 0 C); K b(NH 4 OH) – bāzes jonizācijas konstante (atsauces vērtība), K b(NH4OH)=1,74·10-5.
![]()
3) sāls hidrolīzes pakāpi h aprēķina pēc formulas:
Kur c o – sāls molārā koncentrācija šķīdumā.
![]()
4) H + jonu koncentrācija ir vienāda ar hidrolizētās sāls daļas koncentrāciju un tiek noteikta pēc formulas:
Atbilde: NH 4 Cl sāls hidrolīzes konstante ir 5,75·10 -10; hidrolīzes pakāpe bija 2,4·10 -4; Šķīduma pH ir 5,62.
2. Noteikt kālija acetāta šķīduma hidrolīzes konstanti, hidrolīzes pakāpi un pH, ja koncentrācija Ar(CH 3 SOOC) = 0,1 mol/dm 3 un K a(CH 3 COOH) = 1,8·10 -5.
1) sāli CH 3 COOK veido vājā skābe CH 3 COOH un stiprā bāze KOH - hidrolīze ar anjonu, vide hidrolīzes rezultātā ir sārmaina:
CH 3 COOK + H 2 O = CH 3 COOH + KOH;
CH 3 COO - + H 2 O Û CH 3 COOH + OH - – OH - uzkrājas joni, vide ir sārmaina.
2) hidrolīzes konstante Kilograms aprēķina pēc formulas:
![]() ,
,
Kur K a– skābes jonizācijas konstante. ![]()
2) sāls hidrolīzes pakāpi h aprēķina, izmantojot vienādojumu:
kur с 0 ir sāls koncentrācija šķīdumā.
![]()
3) OH - - jonu koncentrācija ir vienāda ar sāls hidrolizētās daļas koncentrāciju.
Medicīnas praksē tiek izmantoti hidrolizējošu sāļu šķīdumi. Tātad, ja skābes šķīdumi nonāk saskarē ar ādu, skartās vietas vispirms apstrādā ar ūdeni un pēc tam ar nātrija karbonāta Na 2 CO 3 šķīdumu. Šī metode ļauj neitralizēt skābes atlikumus, jo Na 2 CO 3 ūdens šķīdumam ir sārmaina reakcija. Tomēr Na 2 CO 3 šķīdumus diez vai vajadzētu izmantot, lai samazinātu kuņģa sulas paaugstināto skābumu, jo tas ir diezgan augsts sārmainības līmenis. Šiem nolūkiem tiek izmantoti nātrija bikarbonāta NaHCO 3 šķīdumi, kuriem raksturīgs zemāks pH līmenis. Šajā sakarā, lai precīzi lietotu zāles, kuru darbība ir balstīta uz hidrolīzi, ārstam jāspēj novērtēt hidrolizēto sāļu šķīdumu pH vērtības.
1. Tādu sāļu šķīdumos kā NH4Cl:
Kur , dators,- atbilstošo lielumu negatīvie decimāllogaritmi.
Tā kā pie t 0 = 20-25 0 C = 14, tad tāpēc:
2. Tādu sāļu šķīdumos kā CH 3 COONa:
3. Tādu sāļu šķīdumos kā NH4CN:
Vienādības = gadījumā formulas daļējā daļa kļūs par nulli un pH = 7.
Ja sāls tiek hidrolizēts vairākos posmos, tad varam pieņemt, ka šī sāls šķīduma pH vērtību noteiks tikai pirmā hidrolīzes stadija.
Problēmu risināšanas standarti
1. Aprēķiniet NH 4 Cl sāls konstanti un hidrolīzes pakāpi šķīdumā ar C(NH 4 Cl) = 0,1 mol/l, ja (NH 3 × H 2 O) = 1,8 × 10 - 5.
NH 4 Cl + H-OH ⇄ NH 3 ∙ H 2 O + HCl2. Aprēķina Na 2 CO 3 konstanti un hidrolīzes pakāpi pirmajā posmā šķīdumā ar C (Na 2 CO 3) = 0,01 mol/l, ja H 2 CO 3 = 4 × 10 - 7; = 5×10–11.
Na 2 CO 3 hidrolīze notiek vairākos posmos:
Na 2 CO 3 + H-OH ⇄ NaHCO 3 + NaOH (1. posms)
Saīsinātā formā vienādojums izskatās šādi:
CO 3 2 - + H-OH ⇄ HCO 3 - + OH -NaHCO 3 + H-OH ⇄ H 2 CO 3 + NaOH (2. posms)
HCO 3 - + H-OH ⇄ H 2 CO 3 + OH -Na 2 CO 3 hidrolīze pirmajā posmā noved pie bikarbonāta jonu HCO 3 veidošanās, kas ir vājš elektrolīts:
HCO 3 - ⇄ H + + CO 3 2 -
Šis vienādojums atbilst H 2 CO 3 disociācijai otrajā posmā, un to raksturo konstante (H 2 CO 3) = 5 × 10 - 11.
3. Salīdziniet NaNO 2 hidrolīzes pakāpi sāls šķīdumos ar koncentrāciju 0,1 un 0,001 mol/l, ja (HNO 2) = 4 × 10 - 4.
Ieviesīsim apzīmējumu: C 1 = 0,1 mol/l; C 2 = 0,001 mol/l.
Pēc tam:  ;
;  .
.
Sadaliet vienu izteiksmi ar otru un iegūstiet:
NaCN + H-OH ⇄ HCN + NaOH



pH > 7 ir nedaudz sārmains.
6. Atrodiet pH vērtību atšķirību Na 2 S un NaHS šķīdumiem ar vienādām sāls koncentrācijām, ja (H 2 S) = 7, (H 2 S) = 13.
Atņemiet otro no pirmā vienādojuma un iegūstiet:
Jautājumi paškontrolei
1. Kādu procesu sauc par sāls hidrolīzi?
2. Kāds ir iemesls šķīduma pH izmaiņām hidrolīzes rezultātā?
2. Kādi sāļu veidi šķīdumā tiek hidrolizēti? Sniedziet piemērus.
3. Kāpēc sāļi, piemēram, NaCl, KI, CaCl 2, netiek hidrolizēti?
4. Kādos gadījumos sāļu hidrolīzes laikā veidojas skābie (bāziskie) sāļi? Sniedziet piemērus.
5. Kādos gadījumos notiek neatgriezeniska sāls hidrolīze? Sniedziet piemērus.
6. Kādi produkti veidojas, mijiedarbojoties hroma (III) hlorīdam un amonija sulfīdam (NH 4) 2 S ūdens šķīdumā?
7. Kā sauc hidrolīzes konstanti? No kādiem faktoriem ir atkarīga hidrolīzes konstante un no kuriem nav atkarīga?
8. Kā sauc hidrolīzes pakāpi? Kā tas ir saistīts ar dažāda veida sāļu hidrolīzes konstanti?
9. Kādi faktori ietekmē sāls hidrolīzes pakāpi?
10. Kāpēc, palielinoties temperatūrai, palielinās hidrolīzes pakāpe?
11. Kuriem sāļiem šķīduma atšķaidīšana praktiski neietekmē hidrolīzes pakāpi?
12. Kā FeCl 3 var hidrolizēt, veidojot Fe(OH) 3?
13. Kuru sāļu hidrolīzes laikā šķīduma pH ir tuvu 7?
14. Kāpēc NaHCO 3 šķīdumam ir viegli sārmaina reakcija, bet NaHSO 3 šķīdumam ir viegli skāba reakcija? (H 2 CO 3) = 4 × 10 - 7, (H 2 SO 3) = 1,7 × 10 - 2.
15. Jāpagatavo FeSO 4 sāls šķīdums, kura hidrolīzes rezultātā veidojas vāji šķīstošs savienojums (šķīdums kļūst duļķains). Kādā vidē (skābā vai sārmainā) šķīdums jāsagatavo, lai izvairītos no duļķainības? Kāpēc?
Uzdevumu varianti patstāvīgam risinājumam
Variants #1
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Na 2 SO 4, FeCl 2, Na 2 S.
3. Aprēķiniet pH vērtību CH 3 COOOK šķīdumam ar C(CH 3 COOOK) = 0,005 mol/l, ja (CH 3 COOH) = 1,8 × 10 - 5.
Variants Nr.2
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: MnSO 4, KI, Na 2 SiO 3.
3. Aprēķiniet pH vērtību NaNO 2 šķīdumam ar C(NaNO 2) = 0,01 mol/l, ja (HNO 2) = 4 × 10 - 4.
4. Salīdziniet Pb(NO 3) 2 hidrolīzes konstantu vērtības pirmajā un otrajā posmā, ja Pb(OH) 2 = 9,6 × 10 - 4; = 3 × 10 - 8.
Variants #3
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Ca(NO 3) 2, Na 2 SO 3, Cu(NO 3) 2.
2. Aprēķināt KClO konstanti un hidrolīzes pakāpi šķīdumā ar C(KClO) = 0,1 mol/l, ja (НClO) = 5,6×10 - 8.
3. Aprēķiniet pH vērtību KCN sāls šķīdumam ar C(KCN) = 0,05 mol/l, ja (HCN) = 8×10 - 10.
Variants Nr.4
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet barotnes reakciju uzskaitīto sāļu ūdens šķīdumos: K 3 PO 4, CaCl 2, ZnCl 2.
2. Salīdziniet NaCN hidrolīzes pakāpi šķīdumos ar sāls ekvivalentu molāro koncentrāciju 0,1 un 0,001 mol/l, ja (HCN) = 8×10 - 10.
3. Aprēķiniet pH vērtību NH 4 NO 3 šķīdumam ar C(NH 4 NO 3) = 0,1 mol/l, ja (NH 3 × H 2 O) = 1,8 × 10 - 5.
Variants #5
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: CuSO 4, Li 2 S, NaBr.
3. Aprēķināt pH vērtību NH 4 I šķīdumam ar sāls koncentrāciju 0,02 mol/l, ja (NH 3 × H 2 O) = 1,8 × 10 - 5.
4. Salīdziniet Na 2 SiO 3 hidrolīzes konstantu vērtības pirmajā un otrajā posmā, ja H 2 SiO 3 = 1,3 × 10 - 10; = 2×10–12.
Variants #6
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: SrCl 2, Fe(NO 3) 3, K 2 S.
2. Salīdziniet NaF hidrolīzes pakāpi šķīdumos ar sāls ekvivalentu molāro koncentrāciju 0,2 un 0,002 mol/l. (HF) = 6,6 × 10–4.
3. Aprēķiniet pH vērtību HCOONa šķīdumam ar molārās sāls koncentrāciju 0,05 mol/l, ja (HCOOH) = 2,2 × 10 - 4.
Variants Nr.7
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: NaNO 3, ZnSO 4, Ca(OCl) 2.
3. Aprēķināt pH vērtību C 6 H 5 COONa šķīdumam ar sāls koncentrāciju 0,01 mol/l, ja (C 6 H 5 COOH) = 6,3 × 10 - 5.
Variants Nr.8
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Pb(NO 3) 2, CaS, KC1.
2. Salīdzināt NaF un NaCN sāļu konstantu un hidrolīzes pakāpju vērtības šķīdumos ar vienādām koncentrācijām, ja (HF) = 6,6×10 - 4; (HCN) = 8 × 10 - 10.
3. Aprēķināt pH vērtību CH 3 COONH 4 šķīdumam ar molāro sāls koncentrāciju 0,05 mol/l, ja (CH 3 COOH) = 1,8 × 10 - 5 ; (NH 3 × H 2 O) = 1,8 × 10 - 5.
Variants Nr.9
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Ba(NO 3) 2, NiCl 2, K 2 SO 3.
3. Aprēķināt pH vērtību KF sāls šķīdumam ar koncentrāciju 0,001 mol/l, ja (HF) = 6,6×10 - 4.
Variants Nr.10
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet vides reakciju uzskaitīto sāļu ūdens šķīdumos: CoSO 4, Na 2 C 2 O 4, Sr(NO 3) 2.
2. Salīdziniet NH 4 F konstantu un hidrolīzes pakāpju vērtības šķīdumos ar koncentrāciju 0,02 mol/l un 0,002 mol/l, ja (HF) = 6,6 × 10 - 4, (NH 3 × H 2 O) = 1,8 × 10-5.
3. Aprēķiniet pH vērtību NH 4 CN šķīdumam ar koncentrāciju 0,01 mol/l, ja (HCN) = 8 × 10 - 10, (NH 3 × H 2 O) = 1,8 × 10 - 5.
4. Salīdziniet Na 2 S hidrolīzes konstantu vērtības pirmajā un otrajā posmā, ja (H 2 S) = 1×10 - 7; (H2S) = 1×10–13.
Variants Nr.11
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: BaS, K 2 SO 4, CrCl 3.
2. Aprēķināt HCOONa konstanti un hidrolīzes pakāpi šķīdumā ar molārās sāls koncentrāciju 0,001 mol/l, ja (HCOOH) = 2,2×10 - 4.
3. Aprēķiniet pH vērtību NH 4 F šķīdumam ar koncentrāciju 0,02 mol/l, ja (NH 3 × H 2 O) = 1,8 × 10 - 5, (HF) = 6,6 × 10 - 4.
Variants Nr.12
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Ni(NO 3) 2, K 2 CO 3, BaCl 2.
2. Salīdziniet NH 4 NO 3 konstantu un hidrolīzes pakāpju vērtības šķīdumos ar sāls koncentrāciju 0,02 un 0,002 mol/l, ja (NH 3 × H 2 O) = 1,8 × 10 - 5.
3. Aprēķiniet pH vērtību KClO šķīdumam ar sāls koncentrāciju 0,04 mol/l, ja (HClO) = 5,6 × 10 - 8.
Variants Nr.13
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: NaI, K 2 SiO 3, Fe 2 (SO 4) 3.
2. Aprēķiniet C 2 H 5 COONa konstanti un hidrolīzes pakāpi šķīdumā ar C (C 2 H 5 COONa) = 0,l mol/l, ja (C 2 H 5 COOH) = 1,3 × 10 - 5.
3. Aprēķiniet pH vērtību NaHCO 3 šķīdumam ar koncentrāciju 0,1 mol/l, ja (H 2 CO 3) = 4 × 10 - 7, (H 2 CO 3) = 5 × 10 - 11.
Variants Nr.14
1. Uzrakstiet hidrolīzes vienādojumus (molekulārā un jonu formā) un nosakiet uzskaitīto sāļu ūdens šķīdumu vides reakciju: Na 2 HPO 4, KNO 3, Bi(NO 3) 3.
2. Aprēķiniet NH 4 F hidrolīzes pakāpi šķīdumā ar C (NH 4 F) = 0,02 mol/l, ja (HF) = 6,6 × 10 - 4, (NH 3 × H 2 O) = 1,8 × 10 - 5.
1) NaCl pH = 7
2) NH 4 Cl pH<7
3) CH 3 COONa pH > 7
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 4 | 4 | 5 | 1 | 2 | 3 | 1 | 3 | 4 | 4 | 2 | 2 | 1 | 2 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 4 | 2 | 4 | 4 | 1 | 2 | 3 | 2 | 4 | 4 | 1 | 2 | 4 | 3 |
| 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 |
| 2 | 1 | 2 | 2 | 3 | 4 | 1 | 1 | 1 | 1 | 1 | - | 4 | 4 |
| 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 |
| 1 | 4 | 1 | 3 | 4 | 3 | 4 | 4 | 3 | 4 | 3 | 4 | 2 | 2 |
| 57 | 58 | 59 | 60 | ||||||||||
| 1 | 2 | 2 | - |
BUFERŠĶĪDUMI, ORGANISMA BUFERU SISTĒMAS
1. Buferšķīdumu pH vērtība, pievienojot nelielu daudzumu skābju un bāzu:
1) tiek turēti nemainīgi, jo pievienotos ūdeņraža katjonus un hidroksīda anjonus saista attiecīgi bufersistēmas protonu akceptori un donori;
2) Tās saglabājas aptuveni nemainīgas tik ilgi, kamēr bufersistēmu komponentu koncentrācijas pārsniedz pievienoto jonu koncentrācijas;
3) Viņi mainās, jo mainās skābju un bāzu koncentrācijas sistēmā;
2. Buferšķīdumu pH vērtības pēc atšķaidīšanas...
1) paliks nemainīgs, jo bufersistēmu komponentu koncentrāciju attiecība nemainās;
2) paliek aptuveni nemainīgs līdz noteiktām koncentrācijas vērtībām;
Viņi mainās, jo samazinās sistēmas komponentu koncentrācija.
3. Kuriem no šiem konjugētajiem skābju-bāzes pāriem ir buferizācijas īpašības: a) HCOO - /HCOOH; b)CH3COO -/CH3COOH; c)Cl-/HCl; d)HCO-3/CO2; e) H2PO-4;
1) viss;
2)a,b,d,e;
3)b,d,e;
4. No uzskaitītajiem konjugētajiem skābju-bāzes pāriem atlasiet sistēmas, kurām ir bufera īpašības: a) H 3 PO 4 /H 2 PO - 4 ; b) H2PO4/H2PO2-4; c)HPO 2-4 /PO 3-4; d) HNO3/NO-3; e)HCOOH/HCOO - .
1) viss;
2) b, d;
3) a, b, c, d;
B, c, d.
5. Kuriem no skābju-bāzes pāriem ir bufera īpašības; a)Hb-/HHb; b)HbO2/HhbO2;; c) HSO-4/H2SO4; d) NH+4/NH4OH; e) NO-3/HNO3?
1) viss;
2) a, b, c, d;
3)a,b,c;
6. Kuriem no skābju-bāzes pāriem ir buferizācijas īpašības: a)Cl - /HCl; b) NO-3/HNO3; c) HSO-4/H2SO4; d) CH3COO -/CH3COOH; e) NH+4/NH4OH?
1) viss;
2) a, b, c;
3)d,d;
B, d, d.
7. Kuriem no konjugētajiem skābju-bāzes pāriem ir bufera īpašības: a) HCOO - /HCOOH; b) HPO 2- 4 /H 2 PO 4; c) H 3 PO - 4; d) HCO - 4 /CO 2?
1) viss;
2)a,b;
3) b, c, d;
8. Kura no bufersistēmām satur tikai sāļus: a) CO 2- 3 /HCO - 3; b)HCO - 3 /CO 2; c)HPO2-4/H2PO-4; d) H2PO-4/H3PO4; e)HCOO — /HCOOH; e)PO 3-4 /HPO 2-4.
1)a,c,d;
2) a, b, e;
3) a, b, c, d, f;
A, b, c. e.
9. Buferšķīdumi ietver maisījumus: a) NaH 2 PO 2 + Na 2 HPO 4 ; b)H3PO4 +NaH2PO4; c)Ns2CO3 +NaHCO3; d) Na2HPO4+Na3PO4.
1) viss;
2)a,b;
3)c,d;
A B C.
10. Pievienojot HCl HPO 2- 4 /H 2 PO - 4 bufersistēmai:
11. Pievienojot NaOH bufersistēmai HPO 2-4 / H 2 PO - 4:
1) aktīvā koncentrācija (HPO 2-4) palielinās, (H 2 PO - 4) samazinās.
2) aktīvā koncentrācija (HPO 2-4) samazinās, (H 2 PO - 4)) palielinās.
Komponentu darbība nemainās.
12. Pievienojot NaOH NH + 4 /NH 3 H 2 O bufersistēmai:
Komponentu darbība nemainās.
13. Pievienojot HCl NH + 4 /NH 3 H 2 O bufersistēmai:
1) aktīvā koncentrācija (NH + 4) palielinās, (NH 3 H 2 O) - samazinās.
2) aktīvā koncentrācija (NH + 4) samazinās, (NH 3 H 2 O)) palielinās.
Komponentu darbība nemainās.
14. Pievienojot NaOH bufersistēmai CH 3 COO - /CH 3 COOH:
Komponentu darbība nemainās.
15. Pievienojot HCl bufersistēmā CH 3 COO - /CH 3 COOH:
1) aktīvā koncentrācija (CH 3 COOH) palielinās, (CH 3 COO -) - samazinās.
2) aktīvā koncentrācija (CH 3 COOH) samazinās, (CH 3 COO -)) palielinās.
Komponentu darbība nemainās.
16. Sistēmai ir maksimālā bufera jauda, ja:
1) pH= lpp K a;
2) pH> lpp K a;
3) pH<lpp K a;
Šie parametri nav savstarpēji saistīti.
17. Skābes-bāzes konjugāta pārim ir maksimālā bufera kapacitāte pie fizioloģiskā pH:
1) H 3 PO 4 / H 2 PO - 4 ( pK a(H3PO4) = 2,1;
2) H3PO-4/H2PO2-4 ( pK a(H2PO-4) = 6,8;
3) HPO 2-4 /PO 3-4 ( pK a(HPO - 4) = 12,3;
18. Pie tādām pašām komponentu koncentrācijām bufera ietilpība:
1) maksimums, jo pH= lpp K a;
2) maksimums, jo pH> lpp K a;
3) minimums, jo pH= lpp K a;
19. Bufera ietilpība, atšķaidot šķīdumus:
1) samazinās visu sistēmas komponentu koncentrācijas samazināšanās dēļ;
2) palielinās, jo palielinās elektrolītu disociācijas pakāpe;
3) nemainās, jo komponentu koncentrāciju attiecība paliek nemainīga;
Praktiski nemainās, jo sistēmas komponentu skaits paliek nemainīgs.
20. Bufersistēmas uztur līdzsvaru organismā:
1) skābe-bāze;
2) redokss;
3) neviendabīgs;
Ligandu apmaiņa.
21.Acidoze ir: