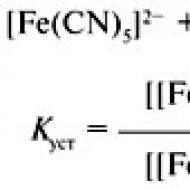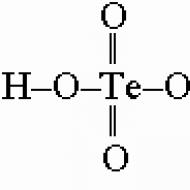
Selēns, telūrs, polonijs un to savienojumi. Sērskābe un sulfāti
2. slaids
Sērs, selēns un telūrs ir VI grupas galvenās apakšgrupas elementi, halkogēnu saimes pārstāvji.
3. slaids
Sērs
Sērs ir viena no vielām, kas cilvēcei zināma kopš neatminamiem laikiem. Pat senie grieķi un romieši tam atrada dažādus praktiskus pielietojumus. Vietējā sēra gabaliņi tika izmantoti, lai veiktu ļauno garu izraidīšanas rituālu.
4. slaids
Telūrs
Vienā no Austrijas reģioniem, ko sauca par Semigoriju, 18. gadsimtā tika atklāta dīvaina zilgani balta rūda.
5. slaids
selēns
Selēns ir viens no elementiem, ko cilvēks zināja pat pirms tā oficiālā atklāšanas. Šo ķīmisko elementu ļoti labi maskēja citi ķīmiskie elementi, kas pēc īpašībām bija līdzīgi selēnam. Galvenie elementi, kas to maskēja, bija sērs un telūrs.
6. slaids
Kvīts
Metode sērūdeņraža oksidēšanai par elementāru sēru pirmo reizi tika izstrādāta Lielbritānijā, kur viņi iemācījās iegūt ievērojamus sēra daudzumus no Na2CO3, kas paliek pēc sodas ražošanas, izmantojot franču ķīmiķa N. Leblanka kalcija sulfīda CaS metodi. Leblanc metodes pamatā ir nātrija sulfāta reducēšana ar akmeņoglēm kaļķakmens CaCO3 klātbūtnē. Na2SO4 + 2C = Na2S + 2CO2; Na2S + CaCO3 = Na2CO3 + CaS
7. slaids
Pēc tam soda tiek izskalota ar ūdeni, un slikti šķīstošā kalcija sulfīda ūdens suspensiju apstrādā ar oglekļa dioksīdu.
CaS + CO2 + H2O = CaCO3 + H2S Iegūtais sērūdeņradis H2S, kas sajaukts ar gaisu, tiek izvadīts krāsnī virs katalizatora slāņa. Šajā gadījumā sērūdeņraža nepilnīgas oksidēšanās dēļ veidojas sērs 2H2S + O2 = 2H2O + 2S
8. slaids
Sildot ar sālsskābi, selēnskābe tiek reducēta par selēnskābi. Pēc tam caur iegūto selēnskābes šķīdumu tiek izvadīts sēra dioksīds SO2 H2SeO3 + 2SO2 + H2O = Se + 2H2SO4. Lai attīrītu, selēnu sadedzina skābeklī, kas piesātināts ar kūpošās slāpekļskābes HNO3 tvaikiem. Šajā gadījumā tīrs selēna dioksīds SeO2 sublimējas. No SeO2 šķīduma ūdenī pēc sālsskābes pievienošanas atkal tiek izgulsnēts selēns, laižot caur šķīdumu sēra dioksīdu.
9. slaids
Lai atdalītu Te no dūņām, tās saķepina ar sodu, kam seko izskalošana. Te nonāk sārmainā šķīdumā, no kura, neitralizējot, izgulsnējas TeO2 Na2TeO3+2HC=TeO2+2NaCl formā. Telūra attīrīšanai no S un Se tiek izmantota tā spēja reducētāja (Al) iedarbībā sārmainā vidē pārveidoties par šķīstošu dinātrija ditelurīdu Na2Te2 6Te+2Al+8NaOH=3Na2Te2+2Na.
10. slaids
Telūra nogulsnēšanai caur šķīdumu tiek izvadīts gaiss vai skābeklis: 2Na2Te2+2H2O+O2=4Te+4NaOH. Īpašas tīrības telūra iegūšanai to hlorē: Te+2Cl2=TeCl4. Iegūto tetrahlorīdu attīra destilējot vai rektificējot. Pēc tam tetrahlorīds tiek hidrolizēts ar ūdeni: TeCl4 + 2H2O = TeO2Ї + 4HCl, un iegūtais TeO2 tiek reducēts ar ūdeņradi: TeO2 + 4H2 = Te + 2H2O.
11. slaids
Fizikālās īpašības
12. slaids
Ķīmiskās īpašības
Gaisā sērs deg, veidojot sēra dioksīdu - bezkrāsainu gāzi ar asu smaku: S + O2 → SO2 Sēra reducējošās īpašības izpaužas sēra reakcijās ar citiem nemetāliem, bet istabas temperatūrā sērs reaģē tikai ar fluoru. : S + 3F2 → SF6
13. slaids
Izkausēts sērs reaģē ar hloru, iespējams, veidojot divus zemākus hlorīdus 2S + Cl2 → S2Cl2 S + Cl2 → SCl2 Sildot, sērs reaģē arī ar fosforu, veidojot fosfora sulfīdu maisījumu, starp kuriem ir augstākais sulfīds P2S5: 5S + 2P → P2S2 Turklāt, karsējot, sērs reaģē ar ūdeņradi, oglekli, silīciju: S + H2 → H2S (sērūdeņradis) C + 2S → CS2 (oglekļa disulfīds)
14. slaids
No kompleksajām vielām pirmām kārtām jāatzīmē sēra reakcija ar izkausētu sārmu, kurā sērs ir disproporcionāls līdzīgi kā hlors: 3S + 6KOH → K2SO3 + 2K2S + 3H2O Ar koncentrētām oksidējošām skābēm sērs reaģē tikai ar ilgstošu karsēšanu: S+ 6HNO3 (konc.) → H2SO4 + 6NO2 + 2H2O S+ 2 H2SO4 (konc.) → 3SO2 + 2H2O
15. slaids
100–160°C to oksidē ūdens: Te+2H2O= TeO2+2H2 Vārot sārmainos šķīdumos, telūrs nesamērīgi veido telurīdu un telurītu: 8Te+6KOH=2K2Te+ K2TeO3+3H2O.
16. slaids
Atšķaidīts HNO3 oksidē Te par telūrskābi H2TeO3: 3Te+4HNO3+H2O=3H2TeO3+4NO. Spēcīgi oksidētāji (HClO3, KMnO4) oksidē Te līdz vājai telūrskābei H6TeO6: Te+HClO3+3H2O=HCl+H6TeO6. Telūra savienojumi (+2) ir nestabili un pakļauti disproporcijai: 2TeCl2=TeCl4+Te.
17. slaids
Karsējot gaisā, tas sadeg, veidojot bezkrāsainu kristālisku SeO2: Se + O2 = SeO2. Karsējot reaģē ar ūdeni: 3Se + 3H2O = 2H2Se + H2SeO3. Selēns reaģē, karsējot ar slāpekļskābi, veidojot selēnskābi H2SeO3: 3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO.
18. slaids
Vārot sārmainos šķīdumos, selēns neproporcionē: 3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O. Ja selēnu vāra sārmainā šķīdumā, caur kuru tiek izvadīts gaiss vai skābeklis, tad veidojas sarkanbrūni šķīdumi, kas satur poliselenīdus: K2Se + 3Se = K2Se4
HALKOĢĒNI
VIA APAKŠGRUPA. HALKOĢĒNI
SKĀBEKLIS
Elements skābeklis O ir elementu periodiskās tabulas astotais elements un VIA apakšgrupas pirmais elements (7.a tabula). Šis elements ir visvairāk sastopams zemes garozā, veidojot apmēram 50% (masas). Gaisā, ko elpojam, HALKOGĒNI satur 20% skābekļa brīvā (nesaistītā) stāvoklī, un 88% skābekļa atrodas hidrosfērā saistītā stāvoklī ūdens H2O veidā.
Visizplatītākais izotops ir 168O. Šāda izotopa kodols satur 8 protonus un 8 neitronus. Izotops ar 10 neitroniem, 188O, ir ievērojami retāk sastopams (0,2%). Vēl retāk sastopams (0,04%) izotops ar 9 neitroniem, 178O. Visu izotopu vidējā svērtā masa ir 16,044. Tā kā oglekļa izotopa ar masas numuru 12 atomu masa ir tieši 12 000 un visas pārējās atomu masas ir balstītas uz šo standartu, tad skābekļa atomu masai pēc šī standarta ir jābūt 15,9994.
Skābeklis ir divatomiskā gāze, tāpat kā ūdeņradis, slāpeklis un halogēni fluors, hlors (broms un jods arī veido diatomu molekulas, bet tās nav gāzes). Lielākā daļa rūpniecībā izmantotā skābekļa tiek iegūta no atmosfēras. Lai to panāktu, ir izstrādātas salīdzinoši lētas metodes ķīmiski attīrīta gaisa sašķidrināšanai, izmantojot kompresijas un dzesēšanas ciklus. Sašķidrinātais gaiss tiek uzkarsēts lēni, izdalot vairāk gaistošus un viegli iztvaikojošus savienojumus, un uzkrājas šķidrais skābeklis. Šo metodi sauc par šķidrā gaisa frakcionētu destilāciju vai rektifikāciju. Šajā gadījumā skābekļa piesārņojums ar slāpekļa piemaisījumiem ir neizbēgams, un, lai iegūtu augstas tīrības pakāpes skābekli, rektifikācijas process tiek atkārtots, līdz slāpeklis ir pilnībā noņemts.
Skatīt arī AIR.
182,96 ° C temperatūrā un 1 atm spiedienā skābeklis no bezkrāsainas gāzes pārvēršas gaiši zilā šķidrumā. Krāsas klātbūtne norāda, ka viela satur molekulas ar nepāra elektroniem. 218,7 ° C temperatūrā skābeklis sacietē. Gāzveida O2 ir 1,105 reizes smagāks par gaisu, un 0° C temperatūrā un 1 atm 1 litra skābekļa masa ir 1,429 g. Gāze nedaudz šķīst ūdenī (HALKOĢĒNI 0,30 cm 3 / l 20 ° C temperatūrā), bet tas ir svarīga dzīvības pastāvēšanai ūdenī. Tērauda rūpniecībā tiek izmantotas lielas skābekļa masas, lai ātri noņemtu nevēlamos piemaisījumus, galvenokārt oglekli, sēru un fosforu, oksīdu veidā pūšanas procesā vai tieši izpūšot skābekli caur kausējumu. Viens no svarīgākajiem šķidrā skābekļa lietojumiem ir kā raķešu degvielas oksidētājs. Balonos uzkrāto skābekli izmanto medicīnā, lai bagātinātu gaisu ar skābekli, kā arī metālu metināšanas un griešanas tehnoloģijās.
Oksīdu veidošanās. Metāli un nemetāli reaģē ar skābekli, veidojot oksīdus. Reakcijas var rasties, atbrīvojot lielu enerģijas daudzumu, un to pavada spēcīgs spīdums, zibspuldze un degšana. Zibspuldze tiek ražota, oksidējot alumīnija vai magnija foliju vai stiepli. Ja oksidēšanās laikā veidojas gāzes, tās reakcijas karstuma rezultātā izplešas un var izraisīt sprādzienu. Ne visi elementi reaģē ar skābekli, izdalot siltumu. Piemēram, slāpekļa oksīdi veidojas, absorbējot siltumu. Skābeklis reaģē ar elementiem, veidojot atbilstošo elementu oksīdus a) normālā vai b) augstā oksidācijas pakāpē. Koksne, papīrs un daudzas dabiskas vielas vai organiskie produkti, kas satur oglekli un ūdeņradi, sadedzina vai nu pēc (a) veida, radot, piemēram, CO, vai pēc (b) veida, radot CO2.
Ozons. Papildus atomu (monatomu) skābeklim O un molekulārajam (diatomiskajam) skābeklim O2 ir ozons, viela, kuras molekulas sastāv no trim skābekļa atomiem O3. Šīs formas ir alotropiskas modifikācijas. Izlaižot klusu elektrisko izlādi caur sausu skābekli, tiek iegūts ozons:
3O2 2O3 Ozonam ir spēcīga, kairinoša smaka, un tas bieži atrodams elektromotoru vai ģeneratoru tuvumā. Tajā pašā temperatūrā ozons ir ķīmiski aktīvāks nekā skābeklis. Tas parasti reaģē, veidojot oksīdus un atbrīvojot brīvo skābekli, piemēram: Hg + O3 -> HgO + O2 Ozons ir efektīvs ūdens attīrīšanai (dezinficēšanai), audumu balināšanai, cietei, eļļu attīrīšanai, koksnes un tējas žāvēšanai un novecošanai un vanilīna un kampara ražošanā. Skatīt SKĀBEKLIS.
SĒRS, SELĒNS, TELŪRS, POLONIJA
Pārejot no skābekļa uz poloniju VIA apakšgrupā, īpašību maiņa no nemetāla uz metālisku ir mazāk izteikta nekā VA apakšgrupas elementiem. Ns2np4 halkogēnu elektroniskā struktūra liecina par elektronu pieņemšanu, nevis elektronu ziedošanu. Daļēja elektronu izņemšana no aktīvā metāla uz halkogēnu ir iespējama, veidojot savienojumu ar daļēji jonu saites raksturu, bet ne līdz tādai joniskuma pakāpei kā līdzīgam savienojumam ar skābekli. Smagie metāli veido halkogenīdus ar kovalentām saitēm; savienojumi ir krāsoti un pilnībā nešķīst.
Molekulārās formas. Elektronu okteta veidošanos ap katru atomu elementārā stāvoklī veic blakus esošo atomu elektroni. Rezultātā, piemēram, sēra gadījumā tiek iegūta cikliska S8 molekula, kas uzbūvēta kā kronis. Starp molekulām nav spēcīgas saites, tāpēc sērs zemā temperatūrā kūst, vārās un iztvaiko. Selēnam, kas veido Se8 molekulu, ir līdzīga struktūra un īpašību kopums; telūrs var veidot Te8 ķēdes, taču šī struktūra nav skaidri noteikta. Arī polonija molekulārā struktūra nav skaidra. Molekulu struktūras sarežģītība nosaka to dažādās pastāvēšanas formas cietā, šķidrā un gāzveida stāvoklī (allotropija), šī īpašība acīmredzami ir halkogēnu atšķirīga iezīme citu elementu grupu vidū. Visstabilākā sēra forma ir a-forma jeb ortorombiskais sērs; otrā ir metastabila b vai monoklīniskā sēra forma, kas uzglabāšanas laikā var pārvērsties par a-sēru. Citas sēra modifikācijas ir parādītas diagrammā:
A-sērs un b-sērs šķīst CS2. Ir zināmi arī citi sēra veidi. M-forma ir viskozs šķidrums, kas, iespējams, veidojas no "vainaga" struktūras, kas izskaidro tā gumijai līdzīgo stāvokli. Kad sēra tvaiki pēkšņi atdziest vai kondensējas, veidojas sēra pulveris, ko sauc par “sēra krāsu”. Tvaiki, kā arī purpursarkanais pulveris, kas iegūts, strauji atdzesējot tvaikus, saskaņā ar pētījumu rezultātiem magnētiskajā laukā satur nepāra elektronus. Se un Te alotropija ir mazāk raksturīga, bet tai ir vispārēja līdzība ar sēru, un selēna modifikācijas ir līdzīgas sēra modifikācijām.
Reaktivitāte. Visi VIA apakšgrupas elementi reaģē ar viena elektrona donoriem (sārmu metāliem, ūdeņradi, metilradikāli HCH3), veidojot RMR sastāva savienojumus, t.i. kuru koordinācijas numurs ir 2, piemēram, HSH, CH3SCH3, NaSNa un ClSCl. Seši valences elektroni ir koordinēti ap halkogēna atomu, divi valences apvalkā un četri valences p apvalkā. Šie elektroni var izveidot saiti ar spēcīgāku elektronu akceptoru (piemēram, skābekli), kas tos atvelk, veidojot molekulas un jonus. Tādējādi šiem halkogēniem ir II, IV, VI oksidācijas pakāpe, veidojot pārsvarā kovalentās saites. Halkogēnu saimē oksidācijas stāvokļa VI izpausme vājina, palielinoties atomu skaitam, jo ns2 elektronu pāris arvien mazāk piedalās saišu veidošanā smagākos elementos (inertā pāra efekts). Savienojumi ar šiem oksidācijas pakāpēm ietver SO un H2SO2 sēram(II); SO2 un H2SO3 sēram(IV); SO3 un H2SO4 sēram(IV). Citu halkogēnu savienojumiem ir līdzīgs sastāvs, lai gan ir dažas atšķirības. Ir salīdzinoši maz nepāra oksidācijas stāvokļu. Metodes brīvo elementu iegūšanai no dabīgām izejvielām dažādiem halkogēniem ir atšķirīgas. Ieži ir zināmi lieli brīvā sēra nogulsnes, atšķirībā no nelieliem citu halkogēnu daudzumiem brīvā stāvoklī. Nogulumu sēru var iegūt ģeotehnoloģiskā veidā (zibspuldzes process): pa iekšējo cauruli tiek sūknēts pārkarsēts ūdens vai tvaiks, lai sērs izkausētu, pēc tam izkausētais sērs ar saspiestu gaisu caur ārējo koncentrisku cauruli tiek nospiests uz virsmas. Tādā veidā tīru, lētu sēru iegūst no atradnēm Luiziānā un zem Meksikas līča pie Teksasas krastiem. Selēns un telūrs tiek iegūti no gāzu emisijām, kas rodas vara, cinka un svina metalurģijā, kā arī no sudraba un svina elektrometalurģijas dūņām. Dažas rūpnīcas, kurās koncentrējas selēns, kļūst par dzīvnieku pasaules saindēšanās avotiem. Brīvo sēru plaši izmanto lauksaimniecībā kā pulverveida fungicīdu. Tikai ASV ik gadu dažādiem procesiem un ķīmiskajām tehnoloģijām tiek izmantots aptuveni 5,1 miljons tonnu sēra. Sērskābes ražošanā tiek patērēts daudz sēra.
Atsevišķas halkogēna savienojumu klases, īpaši halogenīdi, pēc īpašībām ļoti atšķiras.
Ūdeņraža savienojumi.Ūdeņradis lēnām reaģē ar halkogēniem, veidojot hidrīdus H2M. Pastāv liela atšķirība starp ūdeni (skābekļa hidrīdu) un citu halkogēnu hidrīdiem, kas ir slikti smaržojoši un indīgi, un to ūdens šķīdumi ir vājas skābes (stiprākā ir H2Te). Metāli tieši reaģē ar halkogēniem, veidojot halkogenīdus (piemēram, nātrija sulfīdu Na2S, kālija sulfīdu K2S). Sērs šo sulfīdu ūdens šķīdumos veido polisulfīdus (piemēram, Na2Sx). Halkogēna hidrīdus var izspiest no paskābinātiem metālu sulfīdu šķīdumiem. Tādējādi no paskābinātiem Na2Sx šķīdumiem izdalās sulfāni H2Sx (kur x var būt lielāks par 50; tomēr ir pētīti tikai sulfāni ar x Ј 6).
Halogenīdi. Halogēni tieši reaģē ar halogēniem, veidojot dažāda sastāva halogenīdus. Reaģējošo halogēnu diapazons un iegūto savienojumu stabilitāte ir atkarīga no halkogēna un halogēna rādiusu attiecības. Iespēja veidot halogenīdu ar augstu halkogēna oksidācijas pakāpi samazinās, palielinoties halogēna atomu masai, jo halogēnjons tiks oksidēts par halogēnu, bet halkogēns tiks reducēts par brīvu halkogēnu vai halkogēna halogenīdu zemā līmenī. oksidācijas pakāpe, piemēram: TeI6 -> TeI4 + I2 Oksidācijas pakāpe I sēram, to var realizēt savienojumā (SCl)2 vai S2Cl2 (šis sastāvs nav ticami noteikts). Visneparastākais no sēra halogenīdiem ir SF6, kas ir ļoti inerts. Sērs šajā savienojumā ir tik spēcīgi aizsargāts ar fluora atomiem, ka pat visagresīvākās vielas praktiski neietekmē SF6. No galda No 7b izriet, ka sērs un selēns neveido jodīdus.
Ir zināmi kompleksi halkogēna halogenīdi, kas veidojas, mijiedarbojoties halkogēna halogenīdam ar halogenīdu joniem, piemēram,
TeCl4 + 2Cl= TeCl62.
Oksīdi un oksoskābes. Halkogēna oksīdi veidojas tiešā mijiedarbībā ar skābekli. Sērs deg gaisā vai skābeklī, veidojot SO2 un SO3 piemaisījumus. SO3 iegūšanai izmanto citas metodes. Kad SO2 reaģē ar sēru, var veidoties SO. Selēns un telūrs veido līdzīgus oksīdus, taču praksē tiem ir ievērojami mazāka nozīme. Selēna oksīdu un jo īpaši tīra selēna elektriskās īpašības nosaka to praktiskā pielietojuma pieaugumu elektronikas un elektriskajā rūpniecībā. Dzelzs un selēna sakausējumi ir pusvadītāji un tiek izmantoti taisngriežu ražošanai. Tā kā selēna vadītspēja ir atkarīga no apgaismojuma un temperatūras, šī īpašība tiek izmantota fotoelementu un temperatūras sensoru ražošanā. Trioksīdi ir zināmi visiem šīs apakšgrupas elementiem, izņemot poloniju. Sērskābes rūpnieciskās ražošanas pamatā ir SO2 katalītiskā oksidēšana par SO3. Cietajam SO3 ir alotropas modifikācijas: spalvām līdzīgi kristāli, azbesta struktūra, ledus līdzīga struktūra un polimēru ciklisks (SO3)3. Selēns un telūrs izšķīst šķidrā SO3, veidojot starphalkogēnus savienojumus, piemēram, SeSO3 un TeSO3. SeO3 un TeO3 ražošana ir saistīta ar zināmām grūtībām. SeO3 iegūst no Se un O2 gāzu maisījuma izplūdes caurulē, un TeO3 veidojas intensīvi dehidratējot H6TeO6. Minētie oksīdi hidrolizē vai enerģiski reaģē ar ūdeni, veidojot skābes. Sērskābei ir vislielākā praktiskā nozīme. Lai to iegūtu, tiek izmantoti divi procesi: pastāvīgi attīstāmā kontaktu metode un novecojusi slāpekļa torņa metode (sk. arī SĒRA).
Sērskābe ir spēcīga skābe; tas aktīvi mijiedarbojas ar ūdeni, izdalot siltumu atbilstoši reakcijai H2SO4 + H2O H3O+ + HSO4 Tāpēc, atšķaidot koncentrētu sērskābi, jāievēro piesardzība, jo pārkaršana var izraisīt tvaiku izdalīšanos no tvertnes ar skābi (bieži rodas sērskābes apdegumi). saistīta ar neliela daudzuma ūdens pievienošanu). Pateicoties augstajai afinitātei pret ūdeni, H2SO4 (konc.) intensīvi mijiedarbojas ar kokvilnas apģērbu, cukuru un dzīviem cilvēka audiem, izvadot ūdeni. Milzīgu daudzumu skābes izmanto metālu virsmu apstrādei, lauksaimniecībā superfosfāta ražošanai (skatīt arī FOSFORS), jēlnaftas rafinēšanā līdz rektifikācijas stadijai, polimēru tehnoloģijā, krāsvielām, farmācijas rūpniecībā un daudzās citās nozarēs. Sērskābe ir vissvarīgākais neorganiskais savienojums no rūpnieciskā viedokļa. Halkogēnu oksoskābes ir norādītas tabulā. 7. gadsimts Jāņem vērā, ka dažas skābes pastāv tikai šķīdumā, citas tikai sāļu veidā.
Citu sēra oksoskābju vidū nozīmīgu vietu rūpniecībā ieņem sērskābe H2SO3, vāja skābe, kas veidojas, SO2 izšķīdinot ūdenī, eksistē tikai ūdens šķīdumos. Tās sāļi ir diezgan stabili. Skābe un tās sāļi ir reducējoši līdzekļi, un tos izmanto kā "antihlorētājus", lai no balinātāja noņemtu lieko hloru. Tiosērskābi un tās sāļus izmanto fotogrāfijā, lai no fotofilmas noņemtu lieko nereaģējušo AgBr: AgBr + S2O32 []+ Br
Tiosulfurskābes nātrija sāls nosaukums "nātrija hiposulfīts" ir neveiksmīgs; pareizais nosaukums "tiosulfāts" atspoguļo šīs skābes strukturālās attiecības ar sērskābi, kurā viens nehidratēta skābekļa atoms ir aizstāts ar sēra atomu (" tio"). Politionskābes ir interesanta savienojumu klase, kurā veidojas sēra atomu ķēde, kas atrodas starp divām SO3 grupām. Ir daudz datu par H2S2O6 atvasinājumiem, taču arī politionskābes var saturēt lielu skaitu sēra atomu. Peroksoskābes ir svarīgas ne tikai kā oksidētāji, bet arī kā starpprodukti ūdeņraža peroksīda ražošanā. Peroksidisērskābi iegūst, elektrolītiski oksidējot HSO4 jonu aukstumā. Peroksosulfurskābe veidojas peroksodisērskābes hidrolīzē: 2HSO4 -> H2S2O8 + 2e
H2S2O8 + H2O -> H2SO5 + H2SO4 Selēna un telūra skābju klāsts ir ievērojami mazāks. Selēnskābi H2SeO3 iegūst, iztvaicējot ūdeni no SeO2 šķīduma. Tas ir oksidētājs, atšķirībā no sērskābes H2SO3 (reducētājs) un viegli oksidē halogenīdus par halogēniem. Selēna 4s2 elektronu pāris ir neaktīvi iesaistīts saišu veidošanā (inertā pāra efekts; skatīt iepriekš sadaļā par sēra reaktivitāti), un tāpēc selēns viegli pāriet elementārā stāvoklī. Tā paša iemesla dēļ selēnskābe viegli sadalās, veidojot H2SeO3 un Se. Te atomam ir lielāks rādiuss, un tāpēc tas ir neefektīvs divkāršo saišu veidošanā. Tāpēc telūrskābe parastajā formā nepastāv.

un 6 hidroksogrupas koordinē telūrs, veidojot H6TeO6 vai Te(OH)6.
Oksohalīdi. Oksoskābes un halkogēna oksīdi reaģē ar halogēniem un PX5, veidojot oksohalīdus ar sastāvu MOX2 un MO2X2. Piemēram, SO2 reaģē ar PCl5, veidojot SOCl2 (tionilhlorīdu):
PCl5 + SO2 -> POCl3 + SOCl2
Atbilstošais fluorīds SOF2 veidojas, mijiedarbojoties SOCl2 un SbF3, un tionilbromīds SOBr2 veidojas no SOCl2 un HBr. Sulfurilhlorīdu SO2Cl2 iegūst, hlorējot SO2 ar hloru (kampara klātbūtnē); līdzīgi iegūst sulfurilfluorīdu SO2F2. Hlorfluorīds SO2ClF veidojas no SO2Cl2, SbF3 un SbCl3. Hlorsulfonskābi HOSO2Cl iegūst, izlaižot hloru caur kūpošo sērskābi. Fluorsulfonskābe veidojas līdzīgā veidā. Ir zināmi arī selēna oksohalogenīdi SeOCl2, SeOF2, SeOBr2.
Slāpekli un sēru saturoši savienojumi. Sērs ar slāpekli veido dažādus savienojumus, no kuriem daudzi ir maz pētīti. Apstrādājot S2Cl2 ar amonjaku, veidojas N4S4 (tetrasēra tetranitrīds), S7HN (heptasēra imīds) un citi savienojumi. S7HN molekulas ir veidotas kā cikliska S8 molekula, kurā viens sēra atoms ir aizstāts ar slāpekli. N4S4 veidojas arī no sēra un amonjaka. Alvas un sālsskābes ietekmē tas tiek pārveidots par tetrasēra tetraimīdu S4N4H4. Rūpnieciski nozīmīgs ir vēl viens slāpekļa atvasinājums, sulfamīnskābe NH2SO3H, tā ir balta, nehigroskopiska kristāliska viela. To iegūst, reaģējot urīnvielai vai amonjakam ar kūpošu sērskābi. Šī skābe pēc stipruma ir tuvu sērskābei. Tā amonija sāli NH4SO3NH2 izmanto kā ugunsgrēka inhibitoru un sārmu metālu sāļus kā herbicīdus.
Polonijs. Neskatoties uz ierobežoto polonija daudzumu, šī pēdējā VIA apakšgrupas elementa ķīmija ir salīdzinoši labi saprotama, pateicoties tā radioaktīvajai īpašībai (parasti ķīmiskās reakcijās tas tiek sajaukts ar telūru kā nesēju vai pavadošo reaģentu). Stabilākā izotopa 210Po pussabrukšanas periods ir tikai 138,7 dienas, tāpēc tā izpētes grūtības ir saprotamas. Lai iegūtu 1 g Po, nepieciešams pārstrādāt vairāk nekā 11,3 tonnas urāna darvas. 210Po var iegūt ar neitronu bombardēšanu ar 209Bi, kas vispirms pārvēršas par 210Bi un pēc tam izspiež b daļiņu, veidojot 210Po. Acīmredzot polonijs uzrāda tādus pašus oksidācijas stāvokļus kā citiem halkogēniem. Ir sintezēts polonija hidrīds H2Po un oksīds PoO2, zināmi sāļi ar oksidācijas pakāpi II un IV. Acīmredzot PoO3 neeksistē.
Koljēra enciklopēdija. - Atvērtā sabiedrība. 2000 .
Skatiet, kas ir "CHALCOGENS" citās vārdnīcās:
HALKOGĒNI, periodiskās tabulas VI grupas ķīmiskie elementi: skābeklis, sērs, selēns, telūrs. Halkogēnu savienojumi ar elektropozitīvākiem ķīmiskajiem elementiem halkogenīdiem (oksīdiem, sulfīdiem, selenīdiem, telurīdiem) ... Mūsdienu enciklopēdija
Periodiskās sistēmas VI grupas ķīmiskie elementi skābeklis, sērs, selēns, telūrs... Lielā enciklopēdiskā vārdnīca
Grupa → 16 ↓ Periods 2 8 Skābeklis ... Wikipedia
Periodiskās tabulas VI grupas ķīmiskie elementi: skābeklis, sērs, selēns, telūrs. * * * HALKOGĒNI HALKOGĒNI, Periodiskās sistēmas VI grupas ķīmiskie elementi skābeklis, sērs, selēns, telūrs... enciklopēdiskā vārdnīca
halkogēni- chalkogenai statusas T sritis chemija apibrėžtis S, Se, Te, (Po). atitikmenys: engl. chalcogens rus. halkogēni... Chemijos terminų aiškinamasis žodynas
Chem. elementi VIa gr. periodiski sistēmas: skābeklis O, sērs S, selēns Se, telūrs Te, polonijs Po. Ārējais X atomu elektronu apvalkam ir s2p4 konfigurācija. Palielinoties plkst. n. Kovalentais un jonu rādiuss X palielinās, enerģija samazinās... ... Ķīmiskā enciklopēdija
VIA apakšgrupas nemetālu elementu ķīmija
VIA apakšgrupas elementi ir nemetāli, izņemot Po.
Skābeklis ļoti atšķiras no citiem apakšgrupas elementiem, un tam ir īpaša loma ķīmijā. Tāpēc skābekļa ķīmijai tiek dota atsevišķa lekcija.
Starp citiem elementiem vislielākā nozīme ir sēram. Sēra ķīmija ir ļoti plaša, jo sērs veido milzīgu skaitu dažādu savienojumu. Tā savienojumus plaši izmanto ķīmiskajā praksē un dažādās nozarēs. Apspriežot VIA apakšgrupas nemetālus, lielākā uzmanība tiks pievērsta sēra ķīmijai.
Galvenās lekcijā aplūkotās problēmas
VIA apakšgrupas nemetālu vispārīgie raksturojumi. Dabiski savienojumi Sērs
Vienkārša viela Sēra savienojumi
Sērūdeņradis, sulfīdi, polisulfīdi
Sēra dioksīds. Sulfīti
Sēra trioksīds
Sērskābe. Oksidatīvās īpašības. Sulfāti
Citi sēra savienojumi
Selēns, telūrs
Vienkāršas vielas Selēna un telūra savienojumi
Selenīds un telurīdi
Se un Te savienojumi oksidācijas stāvoklī (+4)
Selēns un telūrskābe. Oksidatīvās īpašības.

VIA apakšgrupas elementi |
|||||||||
vispārīgās īpašības |
|||||||||
VIA apakšgrupā ietilpst p-elementi: skābes- |
|||||||||
ģints O, sērs S, selēns Se, telūrs Te, polonijs Po. |
|||||||||
Valences elektronu vispārējā formula ir |
|||||||||
troni – ns 2 np 4. |
|||||||||
skābeklis |
|||||||||
Skābeklis, sērs, selēns un telūrs ir nemetāli. |
|||||||||
Tos bieži apvieno ar parasto nosaukumu "halkogēni". |
|||||||||
kas nozīmē "veidot rūdas". Patiešām daudzi |
|||||||||
metāli dabā ir sastopami oksīdu un sulfīdu veidā; |
|||||||||
sulfīdu rūdās |
nelielos daudzumos plkst. |
||||||||
Ir klāt selenīds un telurīdi. |
|||||||||
Polonijs ir ļoti rets radioaktīvs elements, kas |
|||||||||
kas ir metāls. |
|||||||||
molibdēns |
|||||||||
Lai izveidotu stabilu astoņu elektronu apvalku |
|||||||||
halkogēna atomiem nepieciešami tikai divi elektroni |
|||||||||
jauns Minimālais oksidācijas līmenis (–2) ir |
|||||||||
volframa |
stabils visiem elementiem. Tā ir šī oksidācijas pakāpe |
||||||||
elementi izpaužas dabīgos savienojumos – apm. |
|||||||||
sāni, sulfīdi, selenīdi un telurīdi. |
|||||||||
Eksponēti visi VIA apakšgrupas elementi, izņemot O |
|||||||||
Seaborgium |
pozitīvi oksidācijas pakāpes +6 un +4. Lielākā daļa |
||||||||
Skābekļa oksidācijas pakāpe ir +2, liecina |
|||||||||
tikai kombinācijā ar F. |
|||||||||

Raksturīgākie oksidācijas stāvokļi S, Se, Te ir -
xia: (–2), 0, +4, +6, skābeklim: (–2), (–1), 0.
Dodoties no S uz Te, augstākā oksidācijas pakāpes stabilitāte ir +6
samazinās, un palielinās +4 oksidācijas stāvokļa stabilitāte.
Se, Te, Po, – stabilākais oksidācijas stāvoklis ir +4.
Daži elementu atomu raksturojumi ViB - apakšgrupas
Radinieks |
Pirmā enerģija |
|||
elektronnegatīvs |
jonizācija, |
|||
vērtību |
kJ/mol |
|||
(pēc Paulinga vārdiem) |
||||
elektrisko skaita pieaugums |
||||
troņa slāņi; |
||||
atomu izmēra palielināšanās; |
||||
enerģijas samazināšanās io- |
||||
elektronnegatīva samazināšanās |
||||
vērtību |
Kā redzams no iepriekš minētajiem datiem , skābeklis ļoti atšķiras no citiem apakšgrupas elementiem augsta jonizācijas enerģija, ma-
mazs atoma orbitālais rādiuss un augsta elektronegativitāte, tikai F ir lielāka elektronegativitāte.
Skābeklis, kam ir ļoti īpaša loma ķīmijā, tiek uzskatīts no
efektīvs. Starp citiem VIA grupas elementiem vissvarīgākais ir sērs.

Sērs veido ļoti lielu skaitu dažādu |
|||
dažādi savienojumi. Tās savienojumi ir zināmi gandrīz ar visiem |
|||
elementi, izņemot Au, Pt, I un cēlgāzes. kro- |
|||
grādos plaši izplatīto S savienojumu vietā |
|||
3s2 3p4 |
|||
oksidēšanās (–2), +4, +6, zināms, kā likums, zems uzlabojums |
|||
stabili savienojumi oksidācijas pakāpēs: +1 (S2 O), +2 |
|||
(SF2, SCl2), +3 (S2 O3, H2 S2 O4). Sēra savienojumu daudzveidību apliecina arī tas, ka ir zināmas aptuveni 20 skābekli saturošas skābes S.
Saites stiprums starp S atomiem izrādās samērīgs ar stiprību
S saites ar citiem nemetāliem: O, H, Cl, tāpēc S raksturojas ar
ieskaitot ļoti izplatīto minerālu pirītu FeS2 un politionskābes (piem., H2 S4 O6).Tātad sēra ķīmija ir diezgan plaša.
Nozīmīgākie sēra savienojumi, ko izmanto rūpniecībā
Rūpniecībā un laboratorijās visplašāk izmantotais sēra savienojums ir sērskābe. Pasaules pakalpojumu ražošanas apjoms
nikskābes ir 136 miljoni tonnu. (neviena cita skābe netiek ražota tik lielos daudzumos). Parastie savienojumi ietver ko-
sērskābes sāļi - sulfāti, kā arī sērskābes sāļi - sulfīti.
Dabīgie sulfīdi tiek izmantoti, lai iegūtu svarīgākos krāsainos materiālus
tauki: Cu, Zn, Pb, Ni, Co utt. Citi izplatīti sēra savienojumi ir: hidrosulfīda skābe H2S, sēra di- un trioksīdi: SO2
un SO3, tiosulfāts Na2S2O3; skābes: disērskābe (pirosērskābe) H2 S2 O7, peroc-

nātrija sērs H2S2O8 un peroksodisulfāti (persulfāti): Na2S2O8 un
(NH4)2S2O8.
Sērs dabā
parādās vienkāršas vielas veidā, veidojot lielas pazemes atradnes,
un sulfīdu un sulfātu minerālu veidā , kā arī savienojumu veidā,
kas ir ogļu un naftas piemaisījumi. Rezultātā iegūst ogles un eļļu
organisko vielu sadalīšanās, un sērs ir daļa no dzīvniekiem un augiem
ķermeņa olbaltumvielas. Tāpēc, sadedzinot ogles un eļļu, veidojas sēra oksīdi,
piesārņojot vidi.
Dabiskie sēra savienojumi
Rīsi. Pirīts FeS2 ir galvenais minerāls, ko izmanto sērskābes ražošanai
dabiskais sērs;
sulfīdu minerāli:
FeS2 – pirīts vai dzelzs pirīts
FeCuS2 – halkopirīts (vara sulfīds-
FeAsS – arsenopirīts
PbS – galēna vai svina spīdums
ZnS – sfalerīts vai cinka maisījums
HgS – cinobra
Cu2 S - halkocīta vai vara spīdums
Ag2 S – argentīta vai sudraba spīdums
MoS2 – molibdenīts
Sb2 S3 – stibnīta vai antimona spīdums
As4 S4 – realgar;

sulfāti:
Na2SO4. 10 H2 O – mirabilīts
CaSO4. 2H2 O – ģipsis
CaSO4 - anhidrīts
BaSObarīts jeb smagais špats
SrSO4 – celestīns.
Rīsi. Ģipsis CaSO4. 2H2O
Vienkārša viela
Vienkāršā vielā sēra atomi ar -saiti ir savienoti ar diviem blakus esošajiem atomiem.
Visstabilākā struktūra ir tā, kas sastāv no astoņiem sēra atomiem,
apvienots gofrētā gredzenā, kas atgādina vainagu. Ir vairākas sēra modifikācijas: rombiskais sērs, monoklīniskais un plastmasas sērs. Parastā temperatūrā sērs ir dzeltenu, trauslu kristālu formā.
rombveida tēraudi (-S), formēti-
ko veido S8 molekulas. Vēl viena modifikācija, monoklīniskais sērs (-S), arī sastāv no astoņu locekļu gredzeniem, taču atšķiras pēc atrašanās vietas.
S8 molekulu izvietojums kristālā. Kad dis-
Kad sērs kūst, gredzeni saplīst. Tajā pašā laikā mēs varam
šeit veidosies sapinušies pavedieni, kas
Rīsi. Sērs
padarīt kausējumu viskozu, ar tālāk
Augstākā temperatūrā polimēru ķēdes var sadalīties, un viskozitāte samazināsies. Plastmasas sērs veidojas pēkšņas kausējuma dzesēšanas laikā
sērs un sastāv no sapinušām ķēdēm. Laika gaitā (dažu dienu laikā) tas tiek pārveidots par rombveida sēru.
Sērs vārās 445o C. Sēra tvaikos notiek šādi līdzsvarojumi:
450 o C |
650 o C |
900 o C |
1500 o C |
S 8 S 6 |
S 4 |
S 2 |
S |
S2 molekulām ir līdzīga struktūra kā O2.
Sēru var oksidēt (parasti līdz SO2) un reducēt
atjaunināts uz S(-2). Parastā temperatūrā gandrīz visas reakcijas ar cieto sēru tiek kavētas; notiek tikai reakcijas ar fluoru, hloru un dzīvsudrabu.
Šo reakciju izmanto, lai saistītu sīkus izlijušā dzīvsudraba pilienus.
Šķidrais un tvaika sērs ir ļoti reaģējošs . Zn, Fe, Cu deg sēra tvaikos. Braucot garām H 2 veidojas virs izkausēta sēra
H 2 S. Reakcijās ar ūdeņradi un metāliem sērs darbojas kā oksidētājs
Sērs var diezgan viegli oksidēties halogēnu ietekmē
un skābeklis. Karsējot gaisā, sērs deg ar zilu liesmu, oksidējoties
līdz SO2.
S + O2 = SO2
Sēru oksidē koncentrēta sērskābe un slāpekļskābe:
S + 2H2SO4 (konc.) = 3SO2 + 2H2O,
S + 6HNO3 (konc.) = H2SO4 + 6 NO2 + 2H2O
Karstos sārmu šķīdumos sērs ir nesamērīgs.
3S + 6 NaOH = 2 Na2S + Na2SO3 + 3 H2O.
Kad sērs mijiedarbojas ar amonija sulfīda šķīdumu, dzeltenīgi sarkans polisulfīda joni(–S–S–)n vai Sn 2– .
Karsējot sēru ar sulfīta šķīdumu, iegūst tiosulfātu un
karsējot ar cianīda-tiocianāta šķīdumu:
S + Na 2 SO3 = Na2 S2 O3, S + KCN = KSCN

Kālija tiocianātu vai tiocianātu izmanto Fe3+ jonu analītiskajai noteikšanai:
3+ + SCN – = 2+ + H2O
Iegūtais kompleksais savienojums ir asins sarkanā krāsā,
pat pie nenozīmīgas hidratēto Fe3+ jonu koncentrācijas dis-
Katru gadu pasaulē tiek iegūti ~33 miljoni tonnu vietējā sēra. Galvenais iegūtā sēra daudzums tiek pārstrādāts sērskābē un izmantots
To izmanto gumijas rūpniecībā gumijas vulkanizācijai. Sēra pievienošana
saistās ar gumijas makromolekulu dubultsaitēm, veidojot disulfīdu tiltus
ki –S– S–, tādējādi it kā tās “savienojot”, kas piešķir gumijai izturību un elastību. Kad gumijā tiek ievadīts liels sēra daudzums, izrādās ebo-
nit, kas ir labs izolācijas materiāls, ko izmanto elektrotehnikā. Sēru izmanto arī farmācijā, lai pagatavotu ādas ziedes, un lauksaimniecībā augu kaitēkļu apkarošanai.
Sēra savienojumi
Sērūdeņradis, sulfīdi, polisulfīdi
Sērūdeņradis H2S dabiski sastopams sēra minerālūdeņos,
atrodas vulkāniskajā un dabasgāzē, kas veidojas baltās krāsas sabrukšanas laikā
kovi ķermeņi.
Sērūdeņradis ir bezkrāsaina gāze ar sapuvušu olu smaržu un ir ļoti indīga.
Tas nedaudz šķīst ūdenī, istabas temperatūrā trīs tilpumi gāzveida H2 S ir izšķīdināti vienā tilpumā ūdens. H 2 S koncentrācija piesātinātā ūdenī
parastais šķīdums ir ~ 0,1 mol/l . Izšķīdinot ūdenī, tas veidojas
hidrosulfīda skābe, kas ir viena no vājākajām skābēm:
H2 S H+ + HS – , K1 = 6. 10 –8 , |
|||||||||||||||||||||||||||||||||||||||||||||||
HS – H+ + S 2– , |
K2 = 1. 10 –14 |
||||||||||||||||||||||||||||||||||||||||||||||
Izpildītājs: |
Ir zināmi daudzi dabiskie sulfīdi (skatīt sulfīdu minerālu sarakstu). Daudzu smago krāsaino metālu (Cu, Zn, Pb, Ni, Co, Cd, Mo) sulfīdi ir ir rūpnieciski svarīgas rūdas. Tos pārvērš oksīdos, apdedzinot gaisā, piemēram, 2 ZnS + 3 O2 = 2 ZnO + 2 SO2 tad oksīdus visbiežāk reducē ar akmeņoglēm: ZnO + C = Zn + CO Dažreiz oksīdi tiek izšķīdināti, iedarbojoties ar skābi, un pēc tam šķīdumu pakļauj elektrolīzei, lai reducētu metālu. Sārmu un sārmzemju metālu sulfīdi ir praktiski ķīmiski jonu savienojumi. Citu metālu sulfīdi ir izdevīgi stipri kovalenti savienojumi, parasti ar nestehiometrisku sastāvu. Daudzi nemetāli veido arī kovalentos sulfīdus: B, C, Si, Ge, P, As, Sb. Ir zināmi dabiskie sulfīdi As un Sb. Sārmu un sārmzemju metālu sulfīdi, kā arī sulfīdi amonija fide labi šķīst ūdenī, pārējie sulfīdi nešķīst Romas. Tie izdalās no šķīdumiem raksturīgas krāsas nogulšņu veidā, Piemēram, Pb(NO3)2 + Na2 S = PbS (s.) + 2 NaNO3 Šo reakciju izmanto, lai noteiktu H2S un S2– šķīdumā.
Dažus ūdenī nešķīstošos sulfīdus var izšķīdināt skābes, jo veidojas ļoti vājš un gaistošs sērūdeņradis. piemēram, dabiskā skābe NiS + H2SO4 = H2S + NiSO4 Sulfīdus var izšķīdināt skābēs: FeS, NiS, CoS, MnS, ZnS. Metālu sulfīdi un PR vērtības
Sulfīdi, kam raksturīgs ļoti zems šķīdības produkts, nevar izšķīst skābēs, veidojot H2 S. Skābēs Sulfīdi nešķīst spraugās: CuS, PbS, Ag2 S, HgS, SnS, Bi2 S3, Sb2 S3, Sb2 S5, CdS, As2 S3, As2 S5, SnS2. Ja sulfīda šķīdināšanas reakcija H2S veidošanās dēļ nav iespējama, tad to var pārnest šķīdumā, iedarbojoties koncentrētam slāpekļa dioksīdam slots vai aqua regia. CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O Sulfīda anjons S 2– ir spēcīgs protonu akceptors (os- Brønsted novation). Tāpēc lielā mērā šķīstošie sulfīdi | ||||||||||||||||||||||||||||||||||||||||||||||
1817. gadā Bērzeliuss sērskābes rūpnīcas svina kameru dūņās atklāja telūram līdzīgu elementu. Tas tika nosaukts pēc grieķu mēness nosaukuma - selēns.
Selēns un telūrs ir periodiskās tabulas VI grupas elementi. To ķīmiskās īpašības ir tuvu sēram, taču tās atšķiras no tā, īpaši telūra, ar atšķirīgām metāliskām īpašībām. Tāpat kā sērs, telūrs un sērs veido amorfas un kristāliskas formas.
Ir zināmas divas selēna kristāliskās modifikācijas. Visstabilākais ir pelēkais vai metāliskais selēns, kuram ir sešstūra struktūra (a = 4,354 A, c = 4,949 A). To iegūst, lēni atdzesējot izkausētu selēnu. No šķīdumiem izgulsnējot selēnu vai strauji atdzesējot tvaikus, selēnu iegūst irdena sarkana pulvera veidā.Sarkanajam selēnam ir monokliniska kristāliska struktūra. Sildot līdz 120°, sarkanais selēns kļūst pelēks.
Stiklveida selēnu iegūst, strauji atdzesējot izkausētu selēnu trauslas pelēcīgi svina masas veidā. Apmēram 50° temperatūrā stiklveida selēns sāk mīkstināt, augstākā temperatūrā pārvēršas kristāliski pelēkā selēnā.
Kristālisko telūru iegūst, kondensējot telūra tvaikus. Tam ir sudrabaini balta krāsa. Ir zināmas divas telūra modifikācijas - α- un β-telūrs.Sešstūra α-modifikācija ir izomorfa pelēkajam selēnam (a = 4,445 A, c = 5,91 A). Pārejas punkts α⇔β-telūrs 354°. No ūdens šķīdumiem reducējošie aģenti izgulsnē brūnu amorfā telūra pulveri.
Selēna un telūra fizikālās īpašības
Selēns ir tipisks pusvadītājs. Istabas temperatūrā tas ir slikts elektrības vadītājs. Selēna elektriskā vadītspēja ir ļoti atkarīga no gaismas intensitātes. Gaismā elektriskā vadītspēja ir 1000 reižu lielāka nekā tumsā. Vislielāko efektu rada stari, kuru viļņa garums ir aptuveni 700 ml.
Telūram ir augstāka elektrovadītspēja nekā selēnam, un augstā spiedienā elektriskā pretestība ievērojami palielinās.
Abi elementi normālā temperatūrā ir trausli, bet karsējot tie ir uzņēmīgi pret plastiskām deformācijām.
Parastā temperatūrā selēns un telūrs nereaģē ar skābekli. Karsējot gaisā, tie degot oksidējas, veidojot SeO2 un TeO2. Selēns deg ar zilu liesmu, telūrs ar zilu liesmu ar zaļganu maliņu. Selēna sadegšanu pavada raksturīga smaka (“sapuvušu redīsu smarža”).
Ūdens un neoksidējošās skābes (atšķaidīta sērskābe un sālsskābe) neietekmē selēnu un telūru. Elementi izšķīst koncentrētā sērskābē, slāpekļskābē, kā arī karstos koncentrētos sārmu šķīdumos.
Svarīga selēna un telūra īpašība, kas tiek izmantota to ražošanas tehnoloģijā, ir to spēja izšķīst sēra sārmos, veidojot polisulfīdus, kurus viegli sadalot skābēm, izdalās attiecīgi selēns un telūrs.
Selēns izšķīst nātrija sulfīta šķīdumos, veidojot tiosulfāta tipa savienojumu Na2SeSO3, kas, paskābinot, sadalās, atbrīvojot elementāru selēnu.
Selēns un telūrs parastā temperatūrā reaģē ar visiem halogēniem. Ar metāliem tie veido selenīdus un telurīdus, kas līdzīgi sulfīdiem (piemēram, Na2Se, Ag2Se utt.). Tāpat kā sērs, selēns un telūrs veido ūdeņraža selenīda (H2Se) un ūdeņraža telūra (H2Te) gāzes, kas iegūtas, skābēm iedarbojoties uz selenīdiem un telurīdiem.
Elementārais telūrs nesavienojas tieši ar ūdeņradi, bet selēns reaģē ar ūdeņradi temperatūrā virs 400°.
17.12.2019
Far Cry sērija turpina priecēt savus spēlētājus ar stabilitāti. Pēc tik daudz laika kļūst skaidrs, kas jums jādara šajā spēlē. Medības, izdzīvošana, sagūstīšana...
16.12.2019
Veidojot dzīvojamās telpas dizainu, īpaša uzmanība jāpievērš dzīvojamās istabas interjeram - tas kļūs par jūsu “visuma” centru....
15.12.2019
Nav iespējams iedomāties mājas celtniecību, neizmantojot sastatnes. Šādas struktūras tiek izmantotas arī citās saimnieciskās darbības jomās. AR...
14.12.2019
Metināšana parādījās kā metāla izstrādājumu pastāvīgas savienošanas metode nedaudz vairāk nekā pirms gadsimta. Tajā pašā laikā tā nozīmi šobrīd nav iespējams pārvērtēt. IN...
14.12.2019
Apkārtējās telpas optimizēšana ir ārkārtīgi svarīga gan mazām, gan lielām noliktavām. Tas ievērojami vienkāršo darbu un nodrošina...
13.12.2019
Metāla dakstiņi ir metāla jumta seguma materiāli. Lokšņu virsma ir pārklāta ar polimērmateriāliem un cinku. Dabīgās flīzes imitē materiāls...
13.12.2019
Testēšanas iekārtas ir plaši izmantotas dažādās jomās. Tās kvalitātei jābūt nevainojamai. Lai sasniegtu šo mērķi, ierīces ir aprīkotas...
13.12.2019
Franču stils interjerā pēdējā laikā kļuvis populārs izsmalcinātu un tajā pašā laikā vienkāršu risinājumu cienītāju vidū....
13.12.2019
Mākslinieciskā kalšana ir amats, kas no meistara prasa īpašas prasmes un iemaņas, kā arī neatlaidību un talantu. Visos laikmetos ēku apdares sastāvdaļas...
Skābekļa apakšgrupā ietilpst pieci elementi: skābeklis, sērs, selēns, telūrs un polonijs (radioaktīvs metāls). Tie ir D.I. Mendeļejeva periodiskās sistēmas VI grupas p-elementi. Viņiem ir grupas nosaukums - halkogēni, kas nozīmē "rūdas veidojošs".
Skābekļa apakšgrupu elementu īpašības
|
Īpašības |
Tie |
Ro |
|||
|
1. Sērijas numurs |
|||||
|
2. Valences elektroni |
2 s 2 2 р 4 |
Z s 2 3 р 4 |
4 s 2 4 р 4 |
5s 2 5p 4 |
6s 2 6p 4 |
|
3. Enerģija Atomu jonizācijas ātrums, eV |
13,62 |
10,36 |
9,75 |
9,01 |
8,43 |
|
4. Radinieks elektronegativitāte |
3,50 |
2,48 |
2,01 |
1,76 |
|
|
5. Oksidācijas stāvoklis in savienojumiem |
1, -2, |
2, +2, +4, +6 |
4, +6 |
4, +6 |
2, +2 |
|
6. Atomu rādiuss, nm |
0,066 |
0,104 |
0,117 0,137 |
0,164 |
|
Halkogēna atomiem ir tāda pati ārējā enerģijas līmeņa struktūra - ns 2 nр 4 . Tas izskaidro to ķīmisko īpašību līdzību. Visiem halkogēniem savienojumos ar ūdeņradi un metāliem oksidācijas pakāpe ir -2, bet savienojumos ar skābekli un citiem aktīviem nemetāliem - parasti +4 un +6. Skābeklim, tāpat kā fluoram, oksidācijas pakāpe, kas vienāda ar grupas numuru, nav raksturīga. Tā oksidācijas pakāpe parasti ir -2 un kombinācijā ar fluoru +2. Šādas oksidācijas pakāpes vērtības izriet no halkogēnu elektroniskās struktūras
Skābekļa atomam 2p apakšlīmenī ir divi nepāra elektroni. Tās elektronus nevar atdalīt, jo ārējā (otrajā) līmenī nav d-apakšlīmeņa, t.i., nav brīvu orbitāļu. Tāpēc skābekļa valence vienmēr ir vienāda ar diviem, un oksidācijas pakāpe ir -2 un +2 (piemēram, H 2 O un ОF 2). Tie paši ir sēra tilpuma valences un oksidācijas stāvokļi neuzbudinātā stāvoklī. Pārejot uz ierosināto stāvokli (kas rodas, kad tiek piegādāta enerģija, piemēram, karsēšanas laikā), sēra atomi vispirms tiek atdalīti R- , un pēc tam 3s elektroni (parādīti ar bultiņām). Nesapāroto elektronu skaits un līdz ar to valence pirmajā gadījumā ir četri (piemēram, SO 2), bet otrajā - seši (piemēram, SO 3). Acīmredzot sēra analogiem - selēnam, telūram un polonim ir raksturīgas pat valences 2, 4, 6, un to oksidācijas pakāpes var būt vienādas ar -2, +2, +4 un +6.
Skābekļa apakšgrupas elementu ūdeņraža savienojumi atbilst formula H2R (R - elementa simbols): H 2 O, H 2 S, H2S e, N 2 Te. Viņi zvanījatur ir halkonūdeņraži. Izšķīdinot ūdenī, tie veidojasskābes. Šo skābju stiprums palielinās, palielinoties elementa sērijas numurs, kas izskaidrojams ar enerģijas samazināšanos saites savienojumu virknē H 2 R . Ūdens sadalās H+ un O jonos N - , ir amfoteriskais elektrolīts.
sērs, Selēns un telūrs veido tādas pašas savienojumu formas ar skābekļa tipu R O 2 un R O 3-. Tie atbilst H 2 tipa skābēm R O 3 un H 2 R O 4-. Palielinoties elementa atomu skaitam, šo skābju stiprums samazināsvat. Visām tām piemīt oksidējošas īpašības un līdzīgas skābes H2R O 3 ir arī atjaunojoši.
Vienkāršu vielu īpašības mainās dabiski: pieaugotkodola lādiņš, nemetāliskie vājinās un metāliskie palielinās īpašības. Tādējādi skābeklis un telūrs ir nemetāli, bet pēdējam irmetālisks spīdums un vada elektrību.