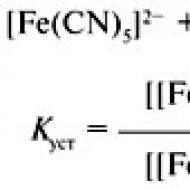
Labās un kreisās rokas hiralitāte. Hirālās molekulas. Hiralitāte farmakoloģijā
Koncepcija hiralitāte– viens no svarīgākajiem mūsdienu stereoķīmijā Modelis ir hirāls, ja tam nav simetrijas elementu (plaknes, centra, spoguļ-rotācijas asis), izņemot vienkāršas rotācijas asis. Molekulu, ko apraksta šāds modelis, mēs saucam par hirālu (no grieķu valodas nozīmē “rokas līdzīga” . hiro- rokas), jo, tāpat kā rokas, molekulas nav savienojamas ar to spoguļattēliem. 1. attēlā parādīta virkne vienkāršu hirālu molekulu. Absolūti acīmredzami ir divi fakti: pirmkārt, doto molekulu pāri attēlo viens otra spoguļattēlus, otrkārt, šos spoguļatspīdumus nevar apvienot savā starpā. Jāatzīmē, ka katrā gadījumā molekula satur oglekļa atomu ar četriem dažādiem aizvietotājiem. Šādus atomus sauc par asimetriskiem. Asimetrisks oglekļa atoms ir hirāls vai stereogēns centrs. Šis ir visizplatītākais hiralitātes veids. Ja molekula ir hirāla, tad tā var pastāvēt divās izomēriskās formās, kas ir saistītas kā objekts un tā spoguļattēls un nav saderīgas telpā. Tādus izomērus (para) sauc enantiomēri.
Termins “hirāls” nepieļauj brīvu interpretāciju. Ja molekula ir hirāla, tad, pēc analoģijas ar roku, tai jābūt vai nu kreisai, vai labajai. Kad mēs saucam vielu vai kādu tās paraugu par hirālu, tas vienkārši nozīmē, ka tā (tā) sastāv no hirālām molekulām; Turklāt nemaz nav nepieciešams, lai visas molekulas būtu identiskas hiralitātes ziņā (pa kreisi vai pa labi, R vai S, skatiet 1.3. sadaļu). Var izdalīt divus ierobežojošus gadījumus. Pirmajā paraugs sastāv no molekulām, kas ir identiskas hiralitātes ziņā (homohirālas, tikai R vai vienkārši S); šādu modeli sauc enantiomēriski tīrs. Otrajā (pretējā) gadījumā paraugs sastāv no tāda paša skaita molekulu, kas atšķiras pēc hiralitātes (heterohirālās, molārās attiecības). R: S=1:1); šāds paraugs ir arī hirāls, bet racēmisks. Ir arī starpgadījums - neekvimolārs enantiomēru maisījums. Šo maisījumu sauc skalēmisks vai neracēmisks. Tādējādi apgalvojums, ka makroskopiskais paraugs (pretēji atsevišķai molekulai) ir hirāls, ir jāuzskata par ne visai skaidru un tāpēc dažos gadījumos nepietiekamu. Var būt nepieciešama papildu norāde, vai paraugs ir racēmisks vai neracēmisks. Precizitātes trūkums to izpratnē rada zināmu nepareizu priekšstatu, piemēram, rakstu nosaukumos, kad tiek pasludināta kāda hirāla savienojuma sintēze, bet paliek neskaidrs, vai autors vienkārši vēlas pievērst uzmanību pašam rakstā aplūkotās struktūras hiralitāte, vai arī produkts patiešām iegūts viena enantiomēra formā (t.i., homohirālu molekulu ansamblis; šo ansambli tomēr nevajadzētu saukt par homohirālu paraugu). Tādējādi hirāla neracēmiska parauga gadījumā ir pareizāk teikt "enantiomēriski bagātināts" vai " enantiomēriski tīrs".
Optisko izomēru attēlošanas metodes
Attēla metodi autors izvēlas tikai informācijas nodošanas ērtības labad. 1. attēlā enantiomēru attēli ir doti, izmantojot perspektīvas attēlus. Šajā gadījumā ir ierasts zīmēt savienojumus, kas atrodas attēla plaknē, ar nepārtrauktu līniju; savienojumi, kas pārsniedz plakni, ir punktēti; un savienojumi, kas vērsti uz novērotāju, ir atzīmēti ar biezu līniju. Šī attēlošanas metode ir diezgan informatīva struktūrām ar vienu hirālu centru. Šīs pašas molekulas var attēlot kā Fišera projekciju. Šo metodi ierosināja E. Fišers sarežģītākām struktūrām (jo īpaši ogļhidrātiem), kurām ir divi vai vairāki hirāli centri.







Spoguļa plakne
Rīsi. 1
Lai izveidotu Fišera projekcijas formulas, tetraedrs tiek pagriezts tā, lai divas saites, kas atrodas horizontālā plaknē, būtu vērstas pret novērotāju, un divas saites, kas atrodas vertikālā plaknē, ir vērstas prom no novērotāja. Attēla plaknē nokrīt tikai asimetriskais atoms. Šajā gadījumā pats asimetriskais atoms parasti tiek izlaists, saglabājot tikai krustojošās līnijas un aizvietotāju simbolus. Lai atcerētos aizvietotāju telpisko izvietojumu, projekcijas formulās bieži tiek saglabāta lauzta vertikāla līnija (augšējais un apakšējais aizvietotājs tiek noņemts ārpus zīmējuma plaknes), taču tas bieži netiek darīts. Tālāk ir sniegti dažādu veidu piemēri, kā attēlot vienu un to pašu struktūru ar noteiktu konfigurāciju (2. att.)
Fišera projekcija

Rīsi. 2
Sniegsim vairākus Fišera projekcijas formulu piemērus (3. att.)

(+)-(L)-alanīns(-)-2-butanols (+)-( D)-gliceraldehīds
Rīsi. 3
Tā kā tetraedru var aplūkot no dažādām pusēm, katru stereoizomēru var attēlot ar divpadsmit (!) dažādām projekcijas formulām. Lai standartizētu projekcijas formulas, ir ieviesti noteikti to rakstīšanas noteikumi. Tādējādi galvenā (nomenklatārā) funkcija, ja tā atrodas ķēdes galā, parasti tiek novietota augšpusē, galvenā ķēde ir attēlota vertikāli.
Lai salīdzinātu “nestandarta” rakstiskās projekcijas formulas, jums jāzina šādi projekcijas formulu pārveidošanas noteikumi.
1. Formulu nevar noņemt no zīmēšanas plaknes un nevar pagriezt par 90 o, lai gan to var pagriezt zīmēšanas plaknē par 180 o, nemainot to stereoķīmisko nozīmi (4. att.)

Rīsi. 4
2. Divi (vai jebkura pāra skaitļa) aizvietotāju pārkārtojumi uz viena asimetriska atoma nemaina formulas stereoķīmisko nozīmi (5. att.)

Rīsi. 5
3. Viena (vai jebkura nepāra skaitļa) aizvietotāju pārkārtošanās asimetriskā centrā noved pie optiskā antipoda formulas (6. att.)

Rīsi. 6
4. Rotācija zīmēšanas plaknē par 90 0 pārvērš formulu par antipodeālu, ja vien vienlaikus netiek mainīts nosacījums aizvietotāju novietojumam attiecībā pret zīmēšanas plakni, t.i. pieņemsim, ka tagad sānu aizvietotāji atrodas aiz zīmēšanas plaknes, bet augšējie un apakšējie ir tās priekšā. Ja izmantojat formulu ar punktētu līniju, tad mainītā punktētās līnijas orientācija jums to tieši atgādinās (7. att.)

Rīsi. 7
5. Permutāciju vietā projekcijas formulas var pārveidot, pagriežot jebkurus trīs aizvietotājus pulksteņrādītāja kustības virzienā vai pretēji tam (8. att.); ceturtais aizvietotājs nemaina savu pozīciju (šī darbība ir līdzvērtīga divām permutācijām):

Rīsi. 8
Fišera projekcijas nevar attiecināt uz molekulām, kuru hiralitāte ir saistīta nevis ar hirālo centru, bet ar citiem elementiem (asi, plakni). Šādos gadījumos ir nepieciešami 3D attēli.
D , L - Fišera nomenklatūra
Mēs apspriedām vienu problēmu - kā attēlot trīsdimensiju struktūru plaknē. Metodes izvēli nosaka tikai stereoinformācijas pasniegšanas un uztveršanas ērtības. Nākamā problēma ir saistīta ar nosaukuma sastādīšanu katram atsevišķam stereoizomēram. Nosaukumam jāatspoguļo informācija par stereogēnā centra konfigurāciju. Vēsturiski pirmā optisko izomēru nomenklatūra bija D, L- Fišera ierosinātā nomenklatūra. Līdz 1960. gadiem hirālo centru konfigurāciju biežāk apzīmēja, pamatojoties uz plakanām projekcijām (Fisher), nevis pamatojoties uz trīsdimensiju 3D formulām, izmantojot deskriptorus. DUnL. Šobrīd D, L– sistēma tiek izmantota ierobežoti – galvenokārt tādiem dabīgiem savienojumiem kā aminoskābes, hidroksiskābes un ogļhidrāti. Piemēri, kas ilustrē tā pielietojumu, ir parādīti 10. attēlā.

Rīsi. 10
α – aminoskābēm konfigurāciju norāda ar simbolu L, ja Fišera projekcijas formulā amino – (vai amonija) grupa atrodas pa kreisi; simbols D izmanto pretējam enantiomēram. Cukuriem konfigurācijas apzīmējums ir balstīts uz lielākās OH grupas orientāciju (vistālāk no karbonilgala). Ja OH grupa ir vērsta pa labi, tad šī ir konfigurācija D; ja HE atrodas pa kreisi – konfigurācija L.
Savulaik Fišera sistēma ļāva izveidot loģisku un konsekventu stereoķīmisko taksonomiju lielam skaitam dabisko savienojumu, kas iegūti no aminoskābēm un cukuriem. Tomēr Fišera sistēmas ierobežojumi, kā arī fakts, ka 1951. gadā parādījās rentgenstaru difrakcijas metode, lai noteiktu patieso grupu izvietojumu ap hirālo centru, noveda pie jaunas, stingrākas un konsekventākas sistēmas izveides 1966. gadā. sistēma stereoizomēru aprakstīšanai, kas pazīstama kā R, S - Kāna-Ingolda-Preloga nomenklatūra (KIP). Instrumentu sistēmā parastajam ķīmiskajam nosaukumam tiek pievienoti īpaši deskriptori R vai S(tekstā slīprakstā), stingri un nepārprotami definējot absolūto konfigurāciju.
NomenklatūraKana-Ingolda-Preloga
Lai definētu rokturi R vai S noteiktam hirālajam centram, tā sauktais hiralitātes noteikums. Apskatīsim četrus aizvietotājus, kas saistīti ar hirālo centru. Tiem jābūt sakārtotiem vienotā stereoķīmiskās prioritātes secībā; Ērtības labad apzīmēsim šos aizvietotājus ar simboliem A, B, D un E un piekritīsim pieņemt, ka vispārējā prioritātes secībā (citiem vārdiem, pēc prioritātes) A ir vecāks par B, B ir vecāks par D, D ir vecāks par E(A>B>D>E) . CIP hiralitātes noteikums paredz, ka modelis ir jāaplūko no pretējās puses tai, ko aizņem aizvietotājs E ar zemāko prioritāti vai stereoķīmiski jaunākais aizvietotājs (11. att.). Tad atlikušie trīs aizvietotāji veido kaut ko līdzīgu statīvam, kura kājas ir vērstas pret skatītāju.

Rīsi. vienpadsmit
Ja aizvietotāju vecums rindā A>B>D krītas pulksteņrādītāja virzienā (kā 11. att.), tad centram tiek piešķirts konfigurācijas deskriptors. R ( no Latīņu vārds rectus - pa labi). Citā izkārtojumā, kad aizvietotāju stereoķīmiskā prioritāte samazinās pretēji pulksteņrādītāja virzienam, centram tiek piešķirts konfigurācijas deskriptors. S (no latīņu valodas draudīgs - pa kreisi).
Attēlojot savienojumus, izmantojot Fišera projekcijas, konfigurāciju var viegli noteikt, neveidojot telpiskos modeļus. Formula jāraksta tā, lai jaunākais aizvietotājs būtu apakšā vai augšā, jo saskaņā ar Fišera projekciju attēlošanas noteikumiem vertikālie savienojumi ir vērsti prom no novērotāja (12. att.). Ja atlikušie aizvietotāji ir sakārtoti pulksteņrādītāja virzienā dilstošā secībā, savienojumu klasificē kā ( R)-rinda un, ja pretēji pulksteņrādītāja virzienam, tad uz ( S)-rinda, piemēram:

Rīsi. 12
Ja junioru grupa nav uz vertikāliem savienojumiem, tad to vajadzētu nomainīt ar apakšējo grupu, taču atcerieties, ka tas maina konfigurāciju. Varat veikt jebkuras divas permutācijas, nemainot konfigurāciju.
Tādējādi noteicošais faktors ir stereoķīmiskā prioritāte . Tagad apspriedīsim prioritātes noteikumi, t.i. noteikumi, pēc kuriem A, B, D un E grupas tiek sarindotas prioritārā secībā.
Priekšroka darba stāža ziņā tiek dota atomiem ar lielāku atomskaitlis. Ja skaitļi ir vienādi (izotopu gadījumā), tad atoms ar lielāko atommasu kļūst vecāks (piemēram, D>H). Jaunākais “aizvietotājs” ir vientuļš elektronu pāris (piemēram, slāpeklī). Tādējādi sērijā palielinās prioritāte: vientuļš pāris
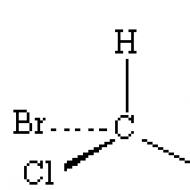
Apsveriet vienkāršu piemēru: bromhlorfluormetānā CHBrCIF (13. att.) ir viens stereogēns centrs, un divus enantiomērus var atšķirt šādi. Pirmkārt, aizvietotājus sarindo pēc to stereoķīmiskā vecuma: jo lielāks ir atomskaitlis, jo vecāks ir aizvietotājs. Tāpēc šajā piemērā Br > C1 > F > H, kur “>” nozīmē “vairāk vēlams” (vai “vecāks”). Nākamais solis ir aplūkot molekulu no tās puses, kas atrodas pretī jaunākajam aizvietotājam, šajā gadījumā ūdeņradim. Var redzēt, ka trīs atlikušie aizvietotāji atrodas trīsstūra stūros un ir vērsti uz novērotāju. Ja šī aizvietotāju trio vecums samazinās pulksteņrādītāja virzienā, tad šis enantiomērs tiek apzīmēts kā R. Citā izkārtojumā, kad aizvietotāju vecums samazinās pretēji pulksteņrādītāja virzienam, enantiomērs tiek apzīmēts kā S. Apzīmējumi R Un S rakstiet slīprakstā un ievieto iekavās pirms struktūras nosaukuma. Tādējādi diviem aplūkotajiem enantiomēriem ir nosaukumi ( S)-bromhlorfluormetāns un ( R)-bromhlorfluormetāns.

Rīsi. 13
2. Ja divi, trīs vai visi četri identiski atomi ir tieši saistīti ar asimetrisku atomu, senioritāti nosaka otrās jostas atomi, kas vairs nav saistīti ar hirālo centru, bet gan ar tiem atomiem, kuriem bija tāds pats vecums.

Rīsi. 14
Piemēram, 2-brom-3-metil-1-butanola molekulā (14. att.) augstākie un jaunākie aizvietotāji ir viegli nosakāmi pēc pirmās jostas - tie ir attiecīgi broms un ūdeņradis. Bet nav iespējams noteikt darba stāžu, pamatojoties uz pirmo CH 2 OH un CH(CH 3) 2 grupu atomu, jo abos gadījumos tas ir oglekļa atoms. Lai noteiktu, kura grupa ir vecāka, atkal tiek piemērots secības noteikums, bet tagad tiek ņemti vērā nākamās jostas atomi. Salīdziniet divas atomu kopas (divus tripletus), kas uzrakstītas secībā, kas samazinās. Darba stāžu tagad nosaka pirmais punkts, kurā tiek konstatēta atšķirība. Grupa AR H 2 OH - skābeklis, ūdeņradis, ūdeņradis AR(PAR NN) vai skaitļos 6( 8 vienpadsmit). Grupa AR H(CH 3) 2 – ogleklis, ogleklis, ūdeņradis AR(AR CH) vai 6( 6 61). Tiek uzsvērts pirmais atšķirības punkts: skābeklis ir vecāks par oglekli (atomskaitlī), tātad CH 2 OH grupa ir vecāka par CH(CH 3) 2. 14. attēlā parādīto enantiomēra konfigurāciju tagad var apzīmēt kā ( R).
Ja šāda procedūra nenoved pie viennozīmīgas hierarhijas izveidošanas, tā tiek turpināta arvien lielākā attālumā no centrālā atoma, līdz beidzot tiek konstatētas atšķirības un visi četri aizvietotāji saņem savu darba stāžu. Šajā gadījumā jebkura priekšroka, ko viens vai otrs deputāts ieguvis kādā no darba stāža saskaņošanas posmiem, tiek uzskatīta par galīgu un turpmākajos posmos netiek pārvērtēta.
3. Ja molekulā ir atzarojuma punkti, atomu senoritātes noteikšanas procedūra jāturpina pa augstākā vecumposma molekulāro ķēdi. Pieņemsim, ka mums ir jānosaka abu 15. attēlā parādīto aizvietotāju prioritātes secība. Ir skaidrs, ka risinājums netiks sasniegts ne pirmajā (C), ne otrajā (C, C, H), ne trešajā (C, H, F, C, H, Br) slānī. Šajā gadījumā jums būs jāpāriet uz ceturto slāni, bet tas jādara pa ceļu, kura priekšrocība ir noteikta trešajā slānī (Br > F). Līdz ar to lēmums par deputāta prioritāti IN pār vietnieku A tiek darīts, pamatojoties uz to, ka ceturtajā slānī Br >CI tam atzaram, uz kuru pāreju nosaka vecums trešajā slānī, nevis pamatojoties uz to, ka I atomam ir lielākais atomskaitlis ceturtajā slānī ( kas ir mazāk vēlamajā un tāpēc nav pētāmā nozare).

Rīsi. 15
4. Vairāki savienojumi tiek attēloti kā atbilstošo vienkāršo savienojumu summa. Saskaņā ar šo noteikumu katram atomam, kas savienots ar daudzkārtēju saiti, tiek piešķirts papildu tāda paša veida "fantoma" atoms (vai atomi), kas atrodas daudzkārtējās saites otrā galā. Komplementārie (papildu vai fantoma) atomi ir ievietoti iekavās un tiek uzskatīti par tādiem, kas nākamajā slānī nesatur aizvietotājus.Kā piemēru ņemiet vērā šādu grupu attēlojumus (16. att.).
Grupas prezentācija

Rīsi. 16
5. Mākslīgi jāpalielina aizvietotāju skaits arī tad, ja aizvietotājs (ligands) ir divzobu (vai tri- vai tetradentāts), kā arī tad, ja aizvietotājs satur ciklisku vai biciklisku fragmentu. Šādos gadījumos katrs cikliskās struktūras zars tiek nogriezts aiz atzarojuma punkta [kur tas sadalās sevī], un atzarojuma punkta atoms tiek novietots (iekavās) ķēdes galā, kas izriet no griezuma. 17. attēlā, izmantojot tetrahidrofurāna (THF) atvasinājuma piemēru, ir apskatīts bidentāta (cikliskā) aizvietotāja gadījums. Piecu locekļu gredzena divas rokas (atsevišķi) tiek sagrieztas saitēs ar hirālu atomu, kas pēc tam tiek pievienots katras no divām jaunizveidotajām ķēdēm. Var redzēt, ka preparēšanas rezultātā A tiek iegūts hipotētisks aizvietotājs -CH 2 OCH 2 CH 2 -(C), kas izrādās vecāks par īsto aciklisko aizvietotāju -CH 2 OCH 2 CH 3 fantoma (C) priekšrocību dēļ, kas atrodas beigās. pirmais aizvietotājs. Gluži pretēji, veidojas preparēšanas rezultātā IN hipotētiskajam ligandam –CH 2 CH 2 OCH 2 – (C) ir zemāks vecums nekā reālajam aizvietotājam – CH 2 CH 2 OCH 2 CH 3, jo tam ir trīs ūdeņraža atomi, kas saistīti ar gala oglekļa atomu, savukārt bijušajam šajā slānī nav neviena. Līdz ar to, ņemot vērā noteikto aizvietotāju prioritātes secību, konkrētā enantiomēra konfigurācijas simbols izrādās S.
Nosakiet darba stāžu Deputāts A
IN>A
Deputāts A

17. att

Rīsi. 18
Līdzīgu cikliskā aizvietotāja izgriešanas gadījumu ilustrē savienojuma piemērs attēlā. 18 kur struktūra IN ilustrē cikloheksila gredzena interpretāciju (struktūrā A). Šajā gadījumā pareizā prioritātes secība ir di- n-hesilmetil> cikloheksils> di- n-pentilmetil> N.
Tagad mēs esam pietiekami gatavi uzskatīt šādu aizvietotāju kā fenilu (19. att. struktūra A). Iepriekš mēs apspriedām katra vairāku savienojumu atvēršanas shēmu. Tā kā (jebkurā Kekules struktūrā) katrs no sešiem oglekļa atomiem ir dubultsaiti ar citu oglekļa atomu, tad (KIP sistēmā) katrs gredzena oglekļa atoms nes papildu oglekli kā “aizvietotāju”. Šādi papildināts gredzens (19. att., uzbūve IN) pēc tam tiek paplašināts saskaņā ar ciklisko sistēmu noteikumiem. Rezultātā sadalīšanu apraksta diagramma, kas parādīta 19. attēlā, struktūra AR.

Rīsi. 19
6. Tagad aplūkosim hirālos savienojumus, kuros atšķirības starp aizvietotājiem nav materiāla vai konstitucionālas, bet ir samazinātas līdz konfigurācijas atšķirībām. Savienojumi, kas satur vairāk nekā vienu hirālo centru, tiks aplūkoti turpmāk (sk. 1.4. sadaļu) Šeit mēs pieskarsimies aizvietotājiem, kas atšķiras cis-trans– izomerisms (olefīna tips). Saskaņā ar Prelog un Helmchen, olefīna ligands, kurā atrodas vecākais aizvietotājs tajā pašā pusē no olefīna dubultsaites, kas ir hirālais centrs, ir priekšrocības salīdzinājumā ar ligandu, kurā atrodas vecākais aizvietotājs. transs– pozīcija pret hirālo centru. Šai pozīcijai nav nekāda sakara ar klasiku cis-trans-, ne arī E–Z–nomenklatūra dubultsaišu konfigurācijai. Piemēri parādīti 20. att.

Rīsi. 20
Savienojumi ar vairākiem hirāliem centriem
Ja molekulai ir divi hirālie centri, tad tā kā katrā centrā var būt (R)- vai ( S)-konfigurācija, ir iespējama četru izomēru esamība - R.R., SS, R.S. Un S.R.:

Rīsi. 21
Tā kā molekulai ir tikai viens spoguļattēls, savienojuma enantiomērs ir (R.R.) var būt tikai izomērs (SS). Līdzīgi cits enantiomēru pāris veido izomērus (R.S.) Un (S.R.). Ja mainās tikai viena asimetriskā centra konfigurācija, tad šādus izomērus sauc diastereomēri. Diastereomēri ir stereoizomēri, kas nav enantiomēri. Tātad, diastereomēru pāri (R.R.)/(R.S.), (R.R.)/(S.R.), (SS)/(R.S.) Un (SS)/(S.R.). Lai gan kopumā divu hirālo centru kombinācija rada četrus izomērus, vienas ķīmiskās struktūras centru kombinācija rada tikai trīs izomērus: (R.R.) Un (SS), kas ir enantiomēri, un (R.S.), diastereomērs abiem enantiomēriem (R.R.) Un (SS). Tipisks piemērs ir vīnskābe (22. att.), kurai ir tikai trīs izomēri: pāris enantiomēru un mezo forma.

Rīsi. 22
mezo-Vīns skābe ir (R, S) izomērs, kas ir optiski neaktīvs, jo divu spoguļsimetrisku fragmentu kombinācija noved pie simetrijas plaknes (a). mezo-Vīns skābe ir mezokonfigurācijas ahirāla savienojuma piemērs, kas ir veidots no vienāda skaita hirālu elementu, kuriem ir identiska struktūra, bet atšķiras absolūtā konfigurācija.
Ja molekulai ir P hirālie centri, maksimālo stereoizomēru skaitu var aprēķināt, izmantojot formulu 2 n; tomēr dažreiz izomēru skaits būs mazāks mezo formu klātbūtnes dēļ.
Molekulu stereoizomēru nosaukumiem, kas satur divus asimetriskus oglekļa atomus, no kuriem divi aizvietotāji ir vienādi, bet trešie ir atšķirīgi, bieži tiek izmantoti prefiksi eritro- Un trio- no cukuru nosaukumiem eritroze un treoze. Šie prefiksi raksturo sistēmu kopumā, nevis katru hirālo centru atsevišķi. Attēlojot šādus savienojumus, izmantojot Fišera projekcijas pa pāriem eritro- izomēri, vienas un tās pašas grupas atrodas vienā pusē, un, ja dažādās grupas (C1 un Br zemāk esošajā piemērā) būtu vienādas, tiktu iegūta mezo forma. Pārī ar trīs- izomēri, vienas un tās pašas grupas atrodas dažādās pusēs, un, ja dažādās grupas būtu vienādas, jaunais pāris paliktu enantiomēru pāris.

Rīsi. 23
Visiem iepriekš apskatītajiem savienojumu piemēriem ir hiralitātes centrs. Šāds centrs ir asimetrisks oglekļa atoms. Taču hiralitātes centrs var būt arī citi atomi (silīcijs, fosfors, sērs), kā, piemēram, metilnaftilfenilsilānā, o-anizilmetilfenilfosfīnā, metil-p-tolilsulfoksīdā (24. att.)

Rīsi. 24
Molekulu, kurām trūkst hirālo centru, hiralitāte
Nepieciešams un pietiekams nosacījums molekulas hiralitātei ir tās nesaderība ar tās spoguļattēlu. Viena (konfigurācijas ziņā stabila) hirāla centra klātbūtne molekulā ir pietiekams, bet nebūt nav nepieciešams nosacījums hiralitātes pastāvēšanai. Apskatīsim hirālās molekulas, kurām trūkst hirālo centru. Daži piemēri ir parādīti 25. un 26. attēlā.

Rīsi. 25

Rīsi. 26
Tie ir savienojumi ar hiralitātes asīm ( aksiālais hiralitātes veids): alēni; alkilīdēcikloalkāni; spirāni; tā sauktie atropoizomēri (bifenili un līdzīgi savienojumi, kuru hiralitāte rodas traucētas rotācijas dēļ ap vienotu saiti). Vēl viens hiralitātes elements ir hiralitātes plakne ( plakanā hiralitāte). Šādu savienojumu piemēri ir ansa savienojumi (kuros alicikliskais gredzens ir pārāk mazs, lai aromātiskais gredzens varētu griezties cauri); paraciklofāni; metallocēni. Visbeidzot, molekulas hiralitāti var saistīt ar molekulārās struktūras spirālveida organizāciju. Molekula var ietīties vai nu kreisās, vai labās puses spirālē. Šajā gadījumā mēs runājam par helicity (spirālveida hiralitātes veids).
Lai noteiktu molekulas konfigurāciju, kam hiralitātes ass, secības noteikumā ir nepieciešams ieviest papildu punktu: novērotājam tuvākās grupas tiek uzskatītas par vecākām nekā grupas, kas atrodas attālināti no novērotāja. Šis papildinājums ir jāveic, jo molekulām ar aksiālu hiralitāti ir pieļaujama identisku aizvietotāju klātbūtne pretējos ass galos. Šī noteikuma piemērošana molekulām, kas parādītas attēlā. 25, parādīts attēlā. 27.

Rīsi. 27
Visos gadījumos molekulas tiek skatītas gar hirālo asi kreisajā pusē. Jāsaprot, ka, ja molekulas aplūko pa labi, tad konfigurācijas deskriptors paliks nemainīgs. Tādējādi četru atbalsta grupu telpiskais izvietojums atbilst virtuālā tetraedra virsotnēm un to var attēlot, izmantojot atbilstošās projekcijas (27. att.). Lai noteiktu atbilstošo deskriptoru, mēs izmantojam standarta noteikumus R, S- nomenklatūra. Bifenilu gadījumā ir svarīgi atzīmēt, ka aizvietotāji gredzenā tiek uzskatīti no centra (caur kuru iet hirālā ass) uz perifēriju, pārkāpjot standarta secības noteikumus. Tātad, attiecībā uz bifenilu attēlā. 25 pareizā aizvietotāju secība labajā gredzenā C-OSH 3 >C-H; hlora atoms ir pārāk tālu, lai to ņemtu vērā. Atbalsta atomi (tie, pēc kuriem nosaka konfigurācijas simbolu) izrādās vienādi, ja molekulu skatās no labās puses. Dažreiz tiek izmantoti deskriptori, lai atšķirtu aksiālo hiralitāti no citiem veidiem aR Un aS (vai R a Un S a), tomēr tiek izmantots prefikss " a» nav obligāta.
Alternatīvi, molekulas ar hiralitātes asīm var uzskatīt par spirālveida, un to konfigurāciju var apzīmēt ar simboliem R Un M. Šajā gadījumā, lai noteiktu konfigurāciju, tiek ņemti vērā tikai aizvietotāji ar augstāko prioritāti gan priekšējā, gan aizmugurējā (attālā no novērotāja) struktūras daļā (aizvietotāji 1 un 3 27. attēlā). Ja pāreja no augstākās prioritātes priekšējā vietnieka 1 uz prioritāro aizmugurējo vietnieku 3 notiek pulksteņrādītāja virzienā, tad šī ir konfigurācija R; ja pretēji pulksteņrādītāja virzienam, šī ir konfigurācija M.
Attēlā 26 parāda molekulas ar hiralitātes plaknes. Hirālās plaknes definīcija nav tik vienkārša un nepārprotama kā hiralitātes centra un ass definīcija. Šī ir plakne, kas satur pēc iespējas vairāk molekulas atomu, bet ne visus. Faktiski hiralitāte rodas tāpēc (un tikai tāpēc), ka vismaz viens aizvietotājs (parasti vairāk) neatrodas hiralitātes plaknē. Tādējādi ansa-savienojuma hirālā plakne A ir benzola gredzena plakne. Paraciklofānā IN visvairāk aizvietotais (apakšējais) gredzens tiek uzskatīts par hirālo plakni. Lai noteiktu plakanu hirālo molekulu deskriptoru, plakne tiek skatīta no atoma puses, kas ir vistuvāk plaknei, bet ne plaknē (ja ir divi vai vairāki kandidāti, tiek atlasīts atomam tuvākais ar augstāko prioritāti saskaņā ar secības noteikumiem). Šis atoms, ko dažkārt sauc par testa vai izmēģinājuma atomu, ir norādīts ar bultiņu 26. attēlā. Tad, ja trīs secīgi atomi (a, b, c) ar augstāko prioritāti veido lauztu līniju hirālajā plaknē, liecoties pulksteņrādītāja virzienā, tad savienojuma konfigurācija pR (vai R lpp), un, ja polilīnija liecas pretēji pulksteņrādītāja virzienam, tad konfigurācijas deskriptors pS(vai S lpp). Plakano hiralitāti, tāpat kā aksiālo hiralitāti, var uzskatīt par hiralitātes veidu. Lai noteiktu spirāles virzienu (konfigurāciju), ir jāņem vērā pilota atoms kopā ar atomiem a, b un c, kā noteikts iepriekš. No tā ir skaidrs, ka pR- savienojumi atbilst R-, A pS- savienojumi - M- heliitāte.
Līdzās strukturālajiem izomēriem alkānu sērijā ir arī telpiskie izomēri. To var ilustrēt, kā piemēru izmantojot 3-metilheksānu.
Oglekļa atoms, kas apzīmēts ar C*, ir saistīts ar četrām dažādām grupām. Šajā ogļūdeņražā ar tādu pašu atomu saišu secību alkilgrupas var atšķirīgi izvietoties telpā ap C* oglekļa atomu. Ir vairāki veidi, kā plaknē attēlot telpiskos izomērus (6.1., 6.2. att.).
Rīsi. 6.1. Trīsdimensiju attēls, izmantojot "ķīļus"
Rīsi. 6.2. Fišera projekcijas formulas
6.2. attēlā C* oglekļa atoms atrodas centrā, horizontālā līnija norāda saiti starp C* oglekli un grupām, kas izvirzītas attēla plaknes priekšā, un vertikālo līniju starp C* atomu un grupām, kas atrodas aiz muguras. attēla plakne. Fišera projekcijas var pagriezt tikai zīmēšanas plaknē un tikai par 180°, bet ne par 90° vai 270°. Šīs formulas attēlo divus dažādus savienojumus. Tie atšķiras viens no otra tāpat kā priekšmets un tā spoguļattēls vai kā kreisā un labā roka. Kreisā un labā roka ir divi viens otram ļoti līdzīgi priekšmeti, taču tos nav iespējams apvienot (neuzlikt kreiso cimdu uz labās rokas), kas nozīmē, ka tie ir divi dažādi priekšmeti.
Divus savienojumus: objektu un tā spoguļattēlu (I un II), kas nav savienojami viens ar otru, sauc par enantiomēriem (no grieķu “enantio” - pretējs).
Savienojuma īpašību eksistēt enantiomēru veidā sauc par hiralitāti (no grieķu “chiros” — roku), un pašu savienojumu sauc par hirālu.
3-metilheksāna molekulai nav simetrijas plaknes, un tāpēc tā var pastāvēt enantiomēru formā (sk. 6.1. att.).
Molekulai ir hiralitāte, ja tai nav simetrijas plaknes. Ir vairāki strukturālie elementi, kas var padarīt molekulu identisku tās spoguļattēlam. Vissvarīgākais no tiem ir hirālais oglekļa atoms.
Hirālais atoms vai hirālais centrs ir oglekļa atoms, kas saistīts ar četrām dažādām grupām un tiek apzīmēts ar C*.
Molekulai, kurā pie oglekļa atoma ir divas vai vairākas identiskas grupas, ir simetrijas plakne, un tāpēc tai nav hiralitātes, jo molekula un tās spoguļattēls ir identiski. Šādas molekulas sauc ahirāls .
Piemēram, izopentāns nevar pastāvēt kā enantiomēri un tam nav hiralitātes.
Enantiomēriem ir tādas pašas fizikālās īpašības, izņemot vienu. Piemēram, 2-brombutāna molekula pastāv kā divi enantiomēri. Viņiem ir vienādi viršanas punkti, kušanas punkti, blīvums, šķīdība un refrakcijas rādītāji. Vienu enantiomēru no cita var atšķirt pēc plaknes polarizētas gaismas rotācijas zīmes. Enantiomēri pagriež polarizētās gaismas plakni ar tādu pašu leņķi, bet dažādos virzienos: viens - pulksteņrādītāja virzienā, otrs - ar tādu pašu leņķi, bet pretēji pulksteņrādītāja virzienam.
Enantiomēriem ir vienādas ķīmiskās īpašības, un to mijiedarbības ātrums ar reaģentiem, kuriem nav hiralitātes, ir vienāds. Reakcijā ar optiski aktīvu reaģentu enantiomēru reakcijas ātrumi ir atšķirīgi. Dažreiz tie atšķiras tik ļoti, ka dotā reaģenta reakcija ar kādu no enantiomēriem nenotiek vispār.
Daudzas dzīvībai svarīgas un nepieciešamas molekulas pastāv divos veidos. Šīs divas formas ir hirālas, jo to attēlus ideālā plakanā spogulī nevar uzklāt. Viņi ir saistīti viens ar otru kā kreisā un labā roka. Tāpēc šo īpašumu sauc hiralitāte(no grieķu cheir — roka).
Abas molekulu formas sauc enantiomēri vai optiskie izomēri. Enantiomēriem ir pretēja hiralitātes sajūta, t.i. pretēja konfigurācija. Viens no enantiomēriem griež plakni polarizētās gaismas polarizācijas plakni pa labi, bet otrs enantiomērs griežas tieši par tādu pašu leņķi pa kreisi.
Kristāla vai molekulas hiralitāti nosaka tā simetrija. Molekula ahirāls (nehirāls), ja un tikai tad, ja tā ir nepareizas rotācijas ass, tas ir, n-kārtīga rotācija (griešanās par 360°/n), kam seko atstarošana plaknē, kas ir perpendikulāra šai asij, atspoguļo molekulu uz sevi. Tātad molekula hirāls, ja tai nav tādas ass, t.i. ja nav simetrijas operāciju, izņemot identitātes transformāciju, kas atspoguļotu molekulu uz sevi. Tā kā hirālajām molekulām nav šāda veida simetrijas, tās sauc asimetrisks. Tiem ne vienmēr ir jābūt asimetriskiem (tas ir, bez simetrijas), jo tiem var būt arī citi veidi simetrija. Tomēr visas aminoskābes (izņemot glicīnu) un daudzi cukuri patiešām ir gan asimetriskas, gan disimetriskas.
Hiralitāte un dzīve
Gandrīz visiem bioloģiskajiem polimēriem ir jābūt homohirāliem, lai tie darbotos (visiem to monomēriem ir vienāda virziena. Vēl viens termins ir optiski tīrs vai 100% optiski aktīvs). Visas proteīnos esošās aminoskābes ir kreisās puses, savukārt visi cukuri DNS, RNS un vielmaiņas ceļos ir labās puses.
Tiek saukts maisījums, kas sastāv no 50% labās un 50% kreisās formas racemāts vai racēmiskais maisījums. Racēmiskie polipeptīdi nevar veidot īpašas formas, kas nepieciešamas fermentiem, jo to sānu ķēdes pēc tam izceļas nejauši. Arī aminoskābe ar nepareizu hiralitāti iznīcina proteīnos stabilizējošo α-spirāli. DNS nevarētu būt stabila spirālveida formā, ja būtu kaut viens monomērs ar nepareizu hiralitāti - tai nebūtu iespējams veidot garas ķēdes. Tas nozīmē, ka DNS nespētu uzglabāt daudz informācijas un uzturēt dzīvību.
Tradicionālā ķīmija ražo racemātus
Cienījamā mācību grāmatā par organisko ķīmiju drosmīgi norādīts universālais ķīmiskais noteikums:
"Hirālo savienojumu sintēze no ahirāliem reaģentiem vienmēr rada racēmisku modifikāciju."
"Optiski neaktīvi reaģenti rada optiski neaktīvus produktus"Tās ir termodinamikas likumu sekas. Labroču un kreiso formu brīvā enerģija (G) ir vienāda, tāpēc brīvās enerģijas starpība (ΔG) ir nulle. Ķīmiskā līdzsvara konstante (K) ir lielums, kas izsaka savstarpējo atkarību starp vielu koncentrācijām sistēmā, kad tiek sasniegts ķīmiskais līdzsvars. Jebkuras reakcijas līdzsvara konstante (K) ir produktu koncentrācijas līdzsvara attiecība pret aktīvo vielu. Reakciju starp šiem diviem elementiem jebkurā Kelvina temperatūrā (T) attēlo, izmantojot standarta formulu:
K = exp (–ΔG/RT)
kur R ir absolūtā gāzes konstante (=Avogadro skaitlis* Bolcmaņa konstante k) = 8,314 J/K.mol
Reakcijā, mainot "kreisās" aminoskābes uz "labās puses" (L → R) vai otrādi (R → L), ΔG = 0, tātad K = 1. Tādējādi reakcija sasniedz līdzsvaru, kad koncentrācija no "kreisajām" formām un "labajām" molekulu formām ir vienādas, t.i. tiek ražots racemāts. Tas izskaidro iepriekš minēto mācību grāmatas noteikumu.
Kreiso formu atdalīšana no labajām
Lai atdalītu racemātu (tas ir, atdalītu divus enantiomērus), jāievada cita homohirāla viela. Procedūra ir izskaidrota organiskās ķīmijas mācību grāmatā. Ideja ir tāda, ka vielas "kreisajām" un "labajām" formām ir vienādas īpašības, izņemot gadījumus, kad runa ir par hirālām parādībām. Analogija: mūsu kreisā un labā roka satver vienu un to pašu ahirālu priekšmetu, piemēram, beisbola nūju, bet atšķirīgi der hirāliem objektiem, piemēram, kreisās rokas cimdu. Tādējādi, lai atrisinātu racemātu, ķīmiķis parasti izmanto gatavu homohirālu vielu no dzīviem organismiem. R un L enantiomēru reakcijas produkti ar tikai labās puses R´ sugām, tas ir, R-R´ un L-R´ (saukti par diastereoizomēriem), nav viens otra spoguļattēli. Tādējādi tiem ir dažādas fizikālās īpašības, piemēram, šķīdība ūdenī, kas nozīmē, ka tās var atdalīt.
Tomēr tas neatrisina dzīvo organismu optiskās aktivitātes sākotnējās izcelsmes noslēpumu. Nesenā starptautiskā konference "Homohiralitātes un dzīvības izcelsme" skaidri parādīja, ka šīs hiralitātes izcelsme evolucionistiem ir pilnīgs noslēpums. Viena homohirāla polimēra nejaušas veidošanās varbūtība no N monomēriem ir 2 –N. Nelielam proteīnam ar 100 aminoskābēm šī varbūtība ir = 2–100 = 10–30. Ņemiet vērā, ka šī ir jebkura homohirāla polipeptīda veidošanās varbūtība. Funkcionāla homohirāla polimēra veidošanās iespējamība ir ārkārtīgi zema, jo daudzviet ir nepieciešama precīza aminoskābju secība. Protams, daudzi homohirālie polimēri ir nepieciešami dzīvībai, tāpēc varbūtības ir jāreizina. Tāpēc iespēja nav alternatīva.
Vēl viena problēma ir tā, ka homohirālās bioloģiskās vielas laika gaitā racemizējas. Tas ir aminoskābju racemizācijas datēšanas metodes pamatā. Kā datēšanas metode tā nav īpaši uzticama, jo racemizācijas pakāpe ir ļoti atkarīga no temperatūras un pH, kā arī no aminoskābes veida. Racemizācija ir arī milzīga problēma peptīdu sintēzē un hidrolīzē. Tas parāda, ka nedzīvās ķīmijas tendence ir vērsta uz nāvi, nevis uz dzīvību.
Talidomīds ir traģisks atgādinājums par hiralitātes nozīmi. 1960. gadu sākumā šīs zāles tika parakstītas grūtniecēm, kuras cieš no rīta nelabuma un vemšanas. Tomēr, lai gan kreisā forma ir spēcīgs trankvilizators, labās puses forma var traucēt augļa attīstību, izraisot nopietnus iedzimtus defektus. Diemžēl zāļu sintēze radīja racemātu, kā varēja gaidīt, un nepareizais enantimomērs netika noņemts pirms zāļu laišanas tirgū.
Manas pašas ķīmijas izglītības laikā viens no nepieciešamajiem eksperimentiem demonstrēja šīs koncepcijas. Mēs sintezējām disimetrisko komplekso jonu 3+ 9 no ahirāliem reaģentiem, lai iegūtu racemātu. Mēs to atrisinājām, reaģējot ar homohirālu skābi no augu avota, veidojot diastereoizomērus, kurus varēja atrisināt ar frakcionētu kristalizāciju. Kad iegūtie homohirālie kristāli tika izšķīdināti un tika pievienota izšķīdināta aktivētā ogle (katalizators), viela ātri racemizējās, jo katalizators paātrināja līdzsvara iestāšanos.
Pētnieki dzīvības rašanās jomā ir mēģinājuši izdomāt citus veidus, kā iegūt nepieciešamo homohiralitāti. Ir bijuši neveiksmīgi mēģinājumi rasemātus atrisināt ar citiem līdzekļiem.
Cirkulāri polarizēta ultravioletā gaisma
Cirkulāri polarizētā gaismā elektriskā lauka virziens griežas gar staru kūli, tāpēc tas ir hirāla parādība. Homohirālajām vielām ir atšķirīga kreisās un labās puses CP gaismas absorbcijas intensitāte - to sauc cirkulārais dihroisms (CD). Līdzīgi kreiso un labo enantiomēri CP gaismu absorbē atšķirīgi. Tā kā fotolīze (iznīcināšana ar gaismu) notiek tikai tad, kad gaismas fotoni tiek absorbēti, CP gaisma iznīcina vienu enantiomēru ātrāk un vieglāk nekā otru. Taču, ņemot vērā to, ka gaisma zināmā mērā iznīcina arī "pareizo" formu, tas neradītu dzīvībai nepieciešamo 100% homohiralitāti. Viens no labākajiem rezultātiem bija iegūt 20% optiski tīra kampara, bet tas notika pēc tam, kad bija iznīcināti 99% izejmateriāla. 35,5% optiskā tīrība iznāktu pēc 99,99% iznīcināšanas. "Gandrīz optiski tīrs maisījums (99,99%) ... tiek sasniegts asimptotiskajā punktā, kur nepaliek absolūti nekāds materiāls."
Vēl viena problēma ir tāda, ka CD lielums un zīme (t.i., priekšroka kreiso vai labo roku formām) ir atkarīga no CP gaismas frekvences. Tas nozīmē, ka izšķirtspēja var rasties tikai ar CP gaismu šaurā frekvenču joslā. Plašā diapazonā enantioselektīvie efekti to iznīcina.
Nesen Austrālijas astronoma Džeremija Beilija dokumentā, kas publicēts 2010. gadā, ideja par cirkulāri polarizētu gaismu kā risinājumu hiralitātes problēmai tika atdzīvināta. Zinātne, un saņēma publicitāti plašsaziņas līdzekļos. Viņa komanda atklāja cirkulāri polarizētu infrasarkano starojumu miglājā. Viņi piekrīt rakstā, ka viņi neatrada ne nepieciešamo cirkulāri polarizēto ultravioleto gaismu, ne pierādījumus, ka miglājā veidojas aminoskābes. Viņi arī apzinās CP gaismas ārkārtīgi ierobežoto enantioselektivitāti un faktu, ka efekts visā spektrā ir nulle. Tomēr viņu ticība ķīmiskajai evolūcijai ietekmē to, kā viņi interpretē datus.
Ne visus evolucionistus pārliecina Beilija komandas priekšlikums. Piemēram, Džefrijs Bada teica: "Tā ir tikai darbību virkne, ko sauc par "varbūt". Manuprāt, tas visu kopējo ainu, iespējams, padara lielu."
Vēl viens ierosinātais cirkulāri polarizēts gaismas avots ir neitronu zvaigznes sinhrotrons, taču tas ir spekulācijas un neatrisina ķīmiskās problēmas.
Beta sabrukšana un vājā kodolspēka spēks
Beta sabrukšana ir radioaktīvās sabrukšanas veids, un to regulē viens no četriem dabas pamatspēkiem - vājā kodolspēka spēks. Šim spēkam ir neliela hiralitāte, ko sauc par paritātes nesaglabāšanu, tāpēc daži teorētiķi ir domājuši, ka β sabrukšana varētu būt atbildīga par hiralitāti dzīvos organismos. Tomēr vājā kodolspēka spēks ir pareizi nosaukts - efekts ir ļoti mazs - ļoti tālu no nepieciešamās 100% homohiralitātes radīšanas. Viens hiralitātes eksperts, organiskais ķīmiķis Viljams Bonnets, Standfosse universitātes emeritētais profesors, teica: "Neviens no šiem pētījumiem nesniedza pārliecinošus secinājumus". Cits pētnieks secināja:
"Nepieciešamie ārkārtas prebioloģiskie apstākļi neatbalsta ideju par β-radiolīzi kā optiskās aktivitātes īpašību atlases faktoru dzīvajā dabā"
Vēl viens paritātes nesaglabāšanas aspekts ir tas, ka L-aminoskābēm un D-cukuriem teorētiskā enerģija ir nedaudz zemāka par to enantiomēriem. Bet enerģijas atšķirība ir neizmērojama - tikai aptuveni 10–17 kT. Tas nozīmē, ka uz katrām 6x10 17 racēmisko aminoskābju maisījuma molekulām būs tikai viens L-enantiomēra pārpalikums!
Optiski aktīvi kvarca pulveri
Kvarcs ir plaši izplatīts minerāls un visizplatītākā silīcija dioksīda (SiO 2) forma uz Zemes. Tās kristāli ir sešstūraini un nesimetriski. Daži pētnieki ir mēģinājuši izmantot optiski aktīvus kvarca pulverus, lai absorbētu vairāk viena enantiomēra nekā otra. Taču viņu mēģinājumi bija nesekmīgi. Turklāt uz Zemes ir vienāds skaits labās un kreisās puses kvarca kristālu.
Pašatlase
Dažas hirālās vielas kristalizējas homohirālos kristālos. Luiss Pastērs bija ne tikai slimības dīgļu teorijas pamatlicējs, bet arī dzīves "spontānas paaudzes" idejas iznīcinātājs un kreacionists. Viņš bija arī pirmais cilvēks vēsturē, kurš atrisināja racemate. Viņš izmantoja pinceti, lai atdalītu šādas vielas - nātrija alumināta tartrāta - kreiso un labo kristālu.
Šis sadalījums notika ārējas iejaukšanās dēļ inteliģentam pētniekam, kurš spēja atpazīt dažādus modeļus. Uz šķietamās primitīvās Zemes šāda pētnieka nebija. Tāpēc abas formas, pat ja tās varētu nejauši atšķirt, atkal izšķīst kopā un atkal veidotu racemātu.
Pasteram arī paveicās izvēlēties vienu no retajām vielām, kas pašizirst kristāliskā formā. Un pat šai vielai šī īpašība piemīt tikai temperatūrā, kas zemāka par 23°C, tāpēc paveicās, ka 19. gadsimtā laboratorijas nebija īpaši labi apsildāmas!
Veiksmīga gruntēšana
Daži teorētiķi ir ierosinājuši, ka veiksmīga šķīduma, kas pārsātināts ar homohirālu kristālu, iesēšana varētu kristalizēt to pašu enantiomēru. Tomēr, kā to atzīmēja daudzi pētnieki, "sākotnējā zupa", ja tāda pastāvētu, būtu ārkārtīgi plāna un ļoti piesārņota. Tāpat neko nevarēja darīt ar augošo homohirālo kristālu, jo tas būtu iegremdēts atlikušā nepareizā enantiomēra šķīdumā. Koncentrējot šķīdumu, nepareizais enantiomērs kristalizētos. Šķīduma atšķaidīšana izšķīdinātu kristālu, tāpēc iecerētais process būtu jāsāk no jauna.
Homohirāls modelis
Daži pētnieki ir ierosinājuši, ka homohirālais polimērs radās nejauši un kalpoja par veidni. Tomēr šis pieņēmums saskaras ar nopietnām problēmām. Tika sintezēta 100% labās policitidilskābes (RNS, kas satur tikai citozīna monomērus) veidne (ar inteliģentu ķīmiķu palīdzību!). Tas varētu virzīt oligomerizāciju (mazu ķēžu veidošanos) no (aktivētiem) G (guanīna) nukleotīdiem. Patiešām, tīri labās rokas G tika oligomerizēti daudz efektīvāk nekā tīri kreiļi G. Taču racēmiskie G nebija oligomerizējušies, jo:
"pretējas hiralitātes monomēri ir iekļauti veidnē kā ķēdes aizbāžņi... Šī apspiešana rada nopietnu problēmu daudzām dzīvības izcelšanās teorijām"
tRNS izvēlējās pareizos enantiomērus
Vienu mēģinājumu atrisināt hiralitātes problēmu veica Rasels Dūlitls, Kalifornijas Universitātes Sandjego bioķīmijas profesors. Viņš paziņoja: "No paša [tRNS sintāzes] pastāvēšanas sākuma viņi, iespējams, saistīja tikai L-aminoskābes" Viņš nekad nepaskaidro, kā šādi sarežģīti enzīmi varētu darboties, ja tie paši nebūtu homohirāli, vai kā tie darbojās, pirms RNS veidojās no homohirālas ribozes. Dolittle "risinājums" nav nekas vairāk kā problēmas atlaišana. Diez vai tas būtu atspēkošanas vērts, ja vien tas nebūtu parādījies pazīstamā anti-radīšanas grāmatā, kas kaut ko saka par to rediģēšanas kvalitāti vai pretradīšanas argumentu kvalitāti.
Šķiet, Dolitls mēģināja izskaidrot savas iepriekšējās televīzijas debates par radīšanas/evolūcijas tēmu ar bioķīmiķi Duanu Gišu, kas notika 5000 cilvēku priekšā Liberty Universitātē 1981. gada 13. oktobrī. Pro-Evolution Magazine Zinātne raksturoja debates kā "sabrukumu" par labu Gišam. Nākamajā dienā pro-evolūcijas Washington Post ziņoja par debatēm ar virsrakstu "Zinātne zaudē vienu nulli pret kreacionismu". Rakstā tika citēts Dolitls, kurš teica: "Kā es satikšu savu sievu?", kas liek domāt, ka pats Dolitls zināja, ka ir cietis neveiksmi.
Magnētiskie lauki
Vairāki vācu ķīmiķi Edharda Brameiera vadībā no Organiskās ķīmijas un bioķīmijas institūta Bonnā ziņoja, ka ļoti spēcīgs magnētiskais lauks (1,2–2,1 T) ražo 98% homohirālu produktu no ahirāliem reaģentiem. Tas ir ļāvis ķīmiķiem, piemēram, Filipam Kosienskim no Sauthemptonas universitātes, spekulēt, ka Zemes magnētiskais lauks var izraisīt homohiralitāti dzīvē. Lai gan Zemes magnētiskais lauks ir gandrīz 10 000 reižu vājāks nekā eksperimentā izmantotais, Kosienski izvirzīja hipotēzi, ka lielais laika daudzums būtu novedis pie homohiralitātes, ko mēs redzam šodien. Viņš droši vien aizmirsa par paleomagnētiskā lauka maiņu!
Citi ķīmiķi, piemēram, Tonijs Barets no Londonas Imperiālās koledžas, uzskatīja, ka vācu eksperiments "šķita pārāk labs, lai būtu patiesība". Šī piesardzība atmaksājās apmēram pirms sešām nedēļām. Neviens cits nespēja reproducēt Vācijas komandas rezultātus. Izrādās, ka viens komandas pētnieks Gvido Zadels, kura disertācijas pamatā bija darbs, sajauca reaģentus ar homohirālu piedevu.
[Magnetohirāls dihroisms — post skripts]
Secinājums
Iepriekš citētajā mācību grāmatā teikts:
“Ēdam optiski aktīvo maizi un gaļu, dzīvojam mājās, valkājam drēbes un lasām grāmatas no optiski aktīvās celulozes. Olbaltumvielas, kas veido mūsu muskuļus, glikogēns mūsu aknās un asinīs, fermenti un hormoni... viss ir optiski aktīvi. Dabiskās vielas ir optiski aktīvas, jo tās veidojošie fermenti ir ... optiski aktīvi. Kas attiecas uz optiski aktīvo enzīmu izcelsmi, mēs varam tikai spekulēt."
Ja mēs varam tikai "spekulēt" par dzīvības izcelsmi, kāpēc tik daudzi cilvēki saka, ka evolūcija ir "fakts"? Atkārtojiet tenkas pietiekami bieži, un cilvēki tās apēdīs.
Saites un piezīmes
Pāreja no nedzīvas uz dzīvo vielu acīmredzot notika pēc tam, kad radās un attīstījās divu fundamentālo dzīvības sistēmu pamati, pamatojoties uz to priekšgājējiem: vielmaiņas sistēmas Un sistēmas dzīvas šūnas materiālās bāzes reproducēšanai. Mūsdienu organismos abas dzīvības sistēmas ir sasniegušas augstāko pilnības līmeni.
Metabolisma mērķis- uzturēt dzīva organisma līdzsvara stāvokli. Šo diezgan sarežģīto uzdevumu risina, izvēloties vielas, no kurām tiek sintezēti organismam nepieciešamie savienojumi. No otras puses, šī sistēma izvada no organisma visu, ko tā nespēj uzņemt vai kas parādās kā dzīvībai svarīgo procesu atkritumi. Metabolisma sistēma nodrošina savstarpēji koordinētas proteīnu sintēzes un sadalīšanās bioķīmiskās reakcijas.
Atskaņošanas sistēma kodētā veidā satur pilnīgu informāciju pašlaik nepieciešamā proteīna konstruēšanai no šūnā uzkrātajām organiskajām vielām. Tas arī kontrolē programmu informācijas iegūšanas un ieviešanas mehānismu. Reprodukcijas sistēma savas funkcijas veic caur polimēru savienojumiem – polinukleotīdiem. Šeit galvenā loma ir dezoksiribonukleīnskābei (DNS) un ribonukleīnskābei (RNS). DNS uzglabā ģenētisko informāciju, un RNS to reproducē un pārnes uz barotni, kurā ir olbaltumvielu sintēzei nepieciešamie izejmateriāli.
Pēdējā laikā ir panākts zināms progress fundamentālo dzīvības sistēmu darbības mehānismu izpētē. Bet joprojām neviens nezina, kā šīs divas sistēmas parādījās.
Turklāt pastāv vēl neizskaidrojama atšķirība dzīvās un nedzīvās matērijas fizikālajās īpašībās, kas atspoguļo dzīvības rašanās procesa īpatnības uz Zemes. Dzīvības radīto organisko savienojumu atšķirīgā iezīme ir to optiskā aktivitāte - spēja pagriezt caur tiem ejošās gaismas polarizācijas plakni vienā virzienā - vai nu pa kreisi, vai pa labi, atkarībā no konkrētā savienojuma veida. Tādējādi visas sauszemes organismu proteīna molekulas pagriež raidītās gaismas polarizācijas plakni pa kreisi, kas norāda uz to kreiso telpisko konfigurāciju (L-konfigurācija), un nukleīnskābju DNS un RNS molekulas griežas tikai pa labi, t.i. tiem ir labās puses vai D veida konfigurācija. Tajā pašā laikā līdzīga ķīmiskā sastāva nedzīva viela ir maisījums ar vienādi iespējamu abu konfigurāciju molekulu saturu, tāpēc caur tām plūstošās gaismas polarizācijas plaknes rotācija nenotiek. Tiek pieņemts, ka dzīvo organismu organisko savienojumu optiskā aktivitāte ir tieši saistīta ar dzīvības izcelsmi.
Organisko molekulu saglabāšanu procesos, kas saistīti ar dzīvību tikai vienā no divām iespējamām telpiskām struktūrām, sauc. hiralitāte, un atbilstošās molekulas ir hirāls. Tiek saukts abu telpisko konfigurāciju organisko molekulu haotisks maisījums racemāts, kas notiek organisko molekulu abiogēnās sintēzes laikā. Bez šaubām, pirmsdzīves periodā, kad uz Zemes veidojās organiskie savienojumi, radās tikai racemāts. Pārejot uz dzīvību organiskajos savienojumos, pēkšņi notika molekulu šķirošana un parādījās hiralitāte. Par izcelsmi pastāv viedoklis: pāreja no racemāta uz hiralitāti notika nevis evolūcijas gaitā, bet gan lēciena rezultātā ar visām matērijas pašorganizācijas raksturīgajām iezīmēm. Ir arī cits viedoklis. To izvirzīja L. Pasters (1822-1895). Tās būtība ir tāda, ka dzīvo sistēmu spoguļu asimetrija seko noteiktai Visuma asimetrijai. Godinot zinātnieka uzskatu plašumu, kurš pagājušajā gadsimtā dzīvi un telpu savienoja vienotā veselumā, mēs atzīmējam: Visuma asimetrija pārkāptu jebkuras organiskās vielas simetriju atkarībā no tās izcelsmes. Viņi mēģināja attīstīt Pastēra viedokli, izvirzot pieņēmumus par dažu aģentu esamību, kam ir asimetriska ietekme uz organismu vielu. Taču šādi aģenti vēl nav atklāti.
Ģenētiskās informācijas nesējs. Nukleīnskābes. DNS un RNS molekulu sastāvs un struktūra. Komplementaritātes princips. Organisma genoms. Ģenētiskā koda īpašības. DNS replikācija. Organisma ģenētiskās īpašības.
Dezoksiribonukleīnskābe (DNS)– materiālais ģenētiskās informācijas nesējs. Tas ir augstas molekulmasas dabisks savienojums, kas atrodas dzīvo organismu šūnu kodolos. DNS molekulas kopā ar histona proteīniem veido hromosomu vielu. Histoni ir daļa no šūnu kodoliem un ir iesaistīti hromosomu struktūras uzturēšanā un mainīšanā dažādos šūnu cikla posmos un gēnu aktivitātes regulēšanā. Atsevišķas DNS molekulu sadaļas atbilst konkrētiem gēniem. DNS molekula sastāv no divas polinukleotīdu ķēdes, kas savītas viena ap otru spirālē. Ķēdes ir veidotas no liela skaita četru veidu monomēru - nukleotīdi, kuras specifiku nosaka viena no četrām slāpekļa bāzēm: adenīns(A), timīns(T), citozīns(C) un guanīns(G). Trīs blakus esošo nukleotīdu kombinācija DNS ķēdē veido ģenētisko kodu. Nukleotīdu secības pārkāpums DNS ķēdē izraisa iedzimtas izmaiņas organismā - mutācijas. Šūnu dalīšanās laikā DNS tiek precīzi reproducēta, kas nodrošina iedzimtu īpašību un specifisku metabolisma formu pārnešanu vairākās šūnu un organismu paaudzēs.
DNS strukturālo modeli dubultās spirāles formā 1953. gadā ierosināja amerikāņu bioķīmiķis Dž. Vatsons un angļu biofiziķis un ģenētiķis F. Kriks. Par ģenētiskā koda atšifrēšanu J. Vatsons, F. Kriks un angļu biofiziķis M. Vilkinss, kurš pirmais ieguva augstas kvalitātes DNS molekulas rentgena attēlu, 1962. gadā tika apbalvoti ar Nobela prēmiju.
DNS ir pārsteidzošs dabisks veidojums ar spirālveida simetriju. DNS ķēdes struktūras garās savītās virknes sastāv no cukura un fosfāta molekulām. Slāpekļa bāzes ir pievienotas cukura molekulām, veidojot šķērssaites starp abām spirālveida pavedieniem. Izstiepta DNS molekula atgādina deformētas spirālveida kāpnes. Tā patiešām ir makromolekula: tās molekulmasa var sasniegt 109. Tādējādi šajos nukleotīdu pāros A vienmēr ir saistīts ar T, bet C ar G. Šis savienojums atbilst komplementaritātes principu.
Slāpekļa bāzu spēja atpazīt savu partneri noved pie cukura fosfāta ķēžu locīšanas dubultspirāles formā, kuras struktūra tika eksperimentāli noteikta rentgena novērojumu rezultātā.
Cukura fosfāta grupu kopā ar vienu no slāpekļa bāzēm A, T, C vai G, kas veido nukleotīdu, var attēlot kā sava veida celtniecības bloku. DNS molekula sastāv no šādiem blokiem. Nukleotīdu secība kodē informāciju DNS molekulā. Tajā ir informācija, kas nepieciešama, piemēram, dzīvam organismam nepieciešamo olbaltumvielu ražošanai.
DNS molekulu var kopēt, izmantojot enzīmu katalizētu replikācijas procesu, kas ietver tās dublēšanu. Process replikācija ietver veco saišu pārraušanu un jaunu ūdeņraža saišu veidošanos. Replikācijas sākumā abas pretējās šķipsnas sāk atraisīties un atdalīties viena no otras. Attīšanas punktā enzīms piestiprina jaunas ķēdes divām vecām pēc komplementaritātes principa, kā rezultātā veidojas divas identiskas dubultspirāles. Ģenētiskās informācijas kodēšana un DNS molekulas replikācija ir savstarpēji saistīti būtiski procesi, kas nepieciešami dzīva organisma attīstībai.
Ģenētisko informāciju kodē DNS nukleotīdu secība. Fundamentāls atšifrēšanas darbs ģenētiskais kods veica amerikāņu bioķīmiķi M. Nirenbergs, X. Korana un R. Hollijs; Nobela prēmijas laureāti 1968. gada Trīs secīgi nukleotīdi veido ģenētiskā koda vienību, ko sauc par kodonu. Katrs kodons kodē vienu vai otru aminoskābi, kuru kopējais skaits ir 20. DNS molekulu var attēlot kā burtu-nukleotīdu secību, kas no liela skaita veido tekstu, piemēram, ASAT-TGGAG... Šāds teksts satur informāciju, kas nosaka katra ķermeņa specifiku. Visu dzīvo būtņu ģenētiskais kods, neatkarīgi no tā, vai tas ir augs, dzīvnieks vai baktērija, ir vienāds. Šī ģenētiskā koda iezīme kopā ar visu olbaltumvielu aminoskābju sastāva līdzību norāda uz dzīvības bioķīmisko vienotību, kas, acīmredzot, atspoguļo visu dzīvo būtņu izcelsmi no viena senča.
) — stingra objekta (telpiskās struktūras) ģeometriskā īpašība būt nesaderīgai ar tā spoguļattēlu ideālā plaknes spogulī.
Apraksts
Hirālajam objektam nav 2. veida simetrijas elementu, piemēram, simetrijas plaknes, simetrijas centri un spoguļa rotācijas asis. Ja ir vismaz viens no šiem simetrijas elementiem, objekts ir ahirāls. Molekulas un kristāli var būt hirāli (piemēram,).
Hirālās molekulas var pastāvēt kā divi optiskie izomēri (enantiomēri), kas ir viens otra spoguļattēli un atšķiras ar spēju pagriezt gaismas polarizācijas plakni pulksteņrādītāja virzienā (D-izomēri) vai pretēji pulksteņrādītāja virzienam (L-izomēri) (att.). Enantiomēriem ir tādas pašas fizikālās īpašības, kā arī tādas pašas ķīmiskās īpašības, mijiedarbojoties ar ahirālām vielām. Tajā pašā laikā enantiomēru atdalīšana, piemēram, hirālā metode, var būt balstīta uz atšķirībām noteiktas vielas enantiomēru mijiedarbībā ar citas vielas specifisku optisko izomēru. Ķīmijā hiralitāte visbiežāk ir saistīta ar asimetriska oglekļa centra klātbūtni, kurā ir četri dažādi aizvietotāji.
Ja molekulā ir vairāki asimetriskie centri, tie runā par diastereoizomerismu. Šajā gadījumā var pastāvēt vairāki enantiomēru pāri (enantiomēru pārim jābūt raksturotam ar visu asimetrisko centru savstarpēji pretējām konfigurācijām), un dažādu enantiomēru pāru diastereomēru īpašības var ievērojami atšķirties.
Gandrīz visas biomolekulas ir hirālas, ieskaitot dabā sastopamās aminoskābes un cukurus. Dabā lielākajai daļai šo vielu ir noteikta telpiskā konfigurācija: piemēram, lielākā daļa aminoskābju pieder telpiskajai konfigurācijai L, bet cukuri - D. Šajā sakarā enantiomēru tīrība ir obligāta prasība bioloģiski aktīvām zālēm.
Ilustrācijas
Autors
- Eremins Vadims Vladimirovičs
Avoti
- Ķīmiskā enciklopēdija. T. 5. - M.: Lielā krievu enciklopēdija, 1998. 538. lpp.
- Ķīmiskās tehnoloģijas apkopojums. IUPAC ieteikumi. - Blekvela, 1997. gads.