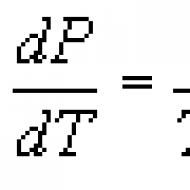Clapeyron-Clausius egyenlet. Clapeyron és Clausius-Clapeyron egyenletek Mely fázisátalakulások esetén alkalmazható a Clapeyron egyenlet?
Clapeyron-Clausius egyenlet termodinamikai egyenlet, amely egy anyag egyik fázisból a másikba való átmenet folyamataira vonatkozik (párolgás, olvadás, szublimáció, polimorf átalakulás stb.). K. - K. u. szerint az egyensúlyi folyamat során a fázisátalakulási hőt (például párolgáshőt, olvadáshőt) a kifejezés határozza meg Ahol T -átmeneti hőmérséklet (izoterm folyamat), dp/dT - a nyomás deriváltjának értéke a hőmérsékletre vonatkoztatva egy adott átmeneti hőmérsékleten, ( V 2 - V 1) - az anyag térfogatának változása az első fázisból a másodikba való átmenet során. Az egyenletet eredetileg 1834-ben B. P. E. Clapeyron állította elő a Carnot-ciklus elemzéséből a gőznek folyadékkal termikus egyensúlyban történő kondenzálására. 1850-ben P. Clausius javította az egyenletet, és kiterjesztette más fázisátmenetekre. K. - K. u. alkalmazható minden hőelnyeléssel vagy -leadással járó fázisátalakulásra (ún. elsőrendű fázisátalakulás), és a fázisegyensúlyi feltételek közvetlen következménye (lásd Fázisegyensúly) ,
amelyből származik. K. - K. u. az egyenletben szereplő mennyiségek bármelyikének kiszámítására használható, ha a többi ismert. Különösen a párolgáshő kiszámítására használják, amelynek kísérleti meghatározása jelentős nehézségekkel jár. Gyakran K. - K. u. származékokhoz viszonyítva írva dp/dT vagy dT/dp:
Párolgási és szublimációs folyamatokhoz dp/dT a telített gőznyomás változását fejezi ki R hőmérséklettel T, valamint olvasztási és polimorf átalakulási folyamatokhoz dT/dp meghatározza az átmeneti hőmérséklet változását a nyomással. Vagyis a K. - K. u. a változók fázisegyensúlyi görbéjének differenciálegyenlete r, T.
Megoldani K. - K. u. tudni kell, hogy a mennyiségek hogyan változnak a hőmérséklettel és a nyomással L, V 1És V 2, ami nehéz feladat. Általában ezt a függőséget empirikusan állapítják meg és oldják meg a K. - K. u. számszerűen. K. - K. u. mind a tiszta anyagokra, mind az oldatokra és az oldatok egyes összetevőire alkalmazható. Ez utóbbi esetben a K. - K. u. egy adott komponens parciális telített gőznyomását a részleges párolgási hőjéhez viszonyítja. Yu. I. Polyakov. Nagy Szovjet Enciklopédia. - M.: Szovjet Enciklopédia.
1969-1978
.
![]()
Nézze meg, mi a „Clapeyron-Clausius egyenlet” más szótárakban:
CLAPEYRON MENDELEEV EGYENLET, állapotegyenlet (lásd ÁLLAPOTEGYENLET) egy ideális gázra (lásd IDEÁLIS GÁZ), 1 mol (lásd MOL) gázra vonatkozik. 1874-ben D. I. Mengyelejev (lásd MENDELEJEV Dmitrij Ivanovics) a Clapeyron-egyenlet alapján ... enciklopédikus szótár
CLAPEYRON-CLAUSIS EGYENLET- termodinamikai egyenlet, amely egy anyag egyik fázisból a másikba való átmenet folyamataihoz kapcsolódik (párolgás, olvadás, polimorf átalakulás stb.). A Clapeyron Clausis egyenlet szerint a fázisátalakulás hője (például az olvadáshő ... Kohászati szótár
Ideális gáz állapotegyenlete, térfogata közötti összefüggés megállapítása V. nyomás pi abs. t roy T. Alakja: pV=nRT. ahol n a gázmolok száma, R = 8,31431 J/mol. K) gázállandó. 1 mol gázra pv=RT, ahol v a moláris térfogat. K.M.u....... Kémiai enciklopédia
Állapotegyenlet Ez a cikk a Termodinamika sorozat része. Ideális gáz állapotegyenlete Van der Waals egyenlet Diterici egyenlet A termodinamika szakaszai A termodinamika elvei Egyenlet ... Wikipédia
- (Clapeyron-Mendeleev egyenlet), az ideális gáz állapotát meghatározó paraméterek (p nyomás, V térfogat és T abszolút hőmérséklet) közötti kapcsolat: pV=BT, ahol együttható. A B arányosság az M gáz tömegétől és móljától függ. tömegek. Telepítve…… Fizikai enciklopédia
Állapotegyenlet Stat ... Wikipédia
- (Clapeyron-Mengyelejev egyenlet), p nyomás, T abszolút hőmérséklet és egy ideális M tömegű gáz V térfogata közötti összefüggés: pV=BT, ahol B=M/m (m a gázmolekula tömege atomtömegben egységek). A francia tudós, B.P.E. Clapeyron...... Modern enciklopédia- Clapeyron Mengyelejev egyenlet, amelyet B. P. E. Clapeyron (1834) talált, az ideális gáz állapotát meghatározó fizikai mennyiségek kapcsolata: p gáznyomás, V térfogata és T. K. u abszolút hőmérséklete.... ... Nagy Szovjet Enciklopédia
Clapeyron Mengyelejev egyenlet [a franciákról nevezték el. fizika B. Clapeyron (V. Clapeyron; 1799 1864) és orosz. vegyész D. I. Mengyelejev (1834, 1907)], ideális gáz állapotszintje: pVm = RT, ahol p a nyomás, T a gáz termodinamikai hőmérséklete, Vm ... ... Nagy enciklopédikus politechnikai szótár
CLAPEYRON ÉS CLAUSIUS-CLAPEYRON EGYENLETEK
Amint a Gibbs-fázisszabályból következik, egy kétfázisú egykomponensű rendszerben a független intenzív változók száma eggyel egyenlő. Ezért kell egy egyenlet RÉs tévé egy ilyen rendszer. Ez az összefüggés a fázisegyensúlyi feltétel következménye:
ahol a p(p, T) hangsúlyozza, hogy az egyes fázisok kémiai potenciálja függvény rT.
Ha p függése az RÉs T explicit módon ismert volt, akkor (3.7) elvileg megoldható volt a vonatkozásában R vagy Tés függőséget találni R = p(T) vagy T = T(r).Általános esetben azonban a függőség p negatívés 7" nem ismert, és ezt nem lehet megtenni. De megtalálhatja a származékot RÁltal T(vagy annak fordítottja).
Tegyük fel, hogy egy anyag két a és b fázisa egyensúlyban van. Ha a hőmérsékletet d7" értékkel változtatja, akkor a nyomásnak úgy kell változnia, hogy mindkét fázis kémiai potenciálja egyformán változzon, anélkül, hogy az egyensúlyi feltételeket (3.7) megsértené, azaz:
Mindkét differenciál változókra bontása Tyr, kapunk
A (2.31) összefüggésekkel együtt ez a következőt adja:
Ebből kiderül:
hol van Df P? - fázisátalakulás entrópiája; A fp U=U^ -- moláris
fázisátalakulás térfogata (a moláris térfogat változása a T= állandó, p = const).
A fázisátalakulás entrópiája és entalpiája a (3.5) összefüggés alapján kapcsolódik egymáshoz: AS = AN/T. Ezért (3.9) a következő formában írható fel: 
Ahol T- fázisátmeneti hőmérséklet.
A (3.9) és (3.10) egyenlet ekvivalens, és bármelyiket Clapeyron-egyenletnek nevezzük.
A Clapeyron-egyenlet gyakorlati alkalmazását korlátozza, hogy a fázisátalakulás entalpiája és a fázisok moláris térfogata fázisonként eltérően függ a hőmérséklettől. Ez azt jelenti, hogy nincs általános módja ennek az egyenletnek az integrálására. De kis hőmérsékleti intervallumok esetén ezek az egyenletek bizonyos közelítések elfogadásával számos célra elegendő pontossággal integrálhatók.
Az első közelítés szerint egy szűk hőmérséklet-tartományban a fázisátalakulás entalpiája megközelítőleg állandónak tekinthető. Ugyanez megtehető a kondenzált fázisok - szilárd és folyékony - moláris térfogatával, mivel ezek gyengén függenek a Tyr. Ekkor a szilárd fázisok közötti, valamint a szilárd és folyékony fázisok közötti fázisegyensúly esetén a moláris térfogat változása is állandónak tekinthető. Ezekkel a közelítésekkel (3.10) a következőképpen van integrálva (olvasztáshoz):

Hasonlóképpen a szilárd fázisok közötti egyensúlyra is.
A gázfázis moláris térfogata nem tekinthető állandónak. De alacsony nyomás esetén más közelítések is lehetségesek. Először is, egy gáz moláris térfogata alacsony nyomáson sokkal nagyobb, mint bármely kondenzált fázis moláris térfogata (vö.). Ezért a párologtatáshoz használhatja:
Másodszor, alacsony nyomáson sok gáz van
tt t^gas CT d__ Yat
az ideálishoz közeli tulajdonságok. Ezért ~-i L isp k t ~-.
Ezt a (3.10) egyenletbe behelyettesítve a következőket kapjuk:

Mert &r/r= s!1p R, a kapott összefüggést Clausius-Clapeyron egyenletnek nevezzük:
Folyékony és szilárd fázisok elpárologtatására egyaránt vonatkozik (szublimáció).
A fázisátalakulás állandó entalpiájának közelítésekor ezt az egyenletet a következőképpen integráljuk:
Ezen egyenletek alkalmazásához gyakran használják a normál nyomáson a fázisátalakulások entalpiájára és a fázisátalakulások hőmérsékletére vonatkozó adatokat. Számos fizikai és kémiai mennyiségi referenciakönyvben szerepelnek. A normál nyomás a 101 325 Pa = 101,325 kPa = 1,01325 bar = 1 atm = 760 Hgmm érték. Művészet. = 760 Torr. A referenciakönyvekből származó adatok alapul szolgálnak hozzávetőleges számításokhoz a (3.11) és (3.13) egyenletekkel a normáltól nem szignifikánsan eltérő nyomáson.
A (3.11) egyenlet segítségével történő számításokhoz szükséges kondenzált fázisok moláris térfogatait általában nem adják meg a referenciakönyvek. De helyettük a folyók sűrűségére vonatkozó adatok találhatók. A definíciók ismeretében használhatók moláris térfogatok kiszámítására U t = ENSZ, p = hogyÉs M = t/p. Ezekből következik: U t = M/ p, hol M - moláris tömeg.
Másrészt egyes referenciakönyvek megadják a fázisátalakulások fajhőit. Ebben az esetben a (3.10) egyenlet a következő formában írható fel:

ahol Af p/g és Af P y a fajlagos entalpia, illetve a fajlagos térfogat változása egy fázisátalakulás során (és v= 1/r).
Ha a párolgás entalpiája nem ismert, néha hozzávetőlegesen megbecsülhető Trouton hüvelykujjszabályával, amely szerint a legtöbb folyadék elpárologtatásának moláris entrópiája megközelítőleg 90 J K -1 mol -1. Mivel Dfp^ - AfpR/G, L isp R/J mol -1 = 90(G M/K), ahol 7^ a forráspont normál nyomáson. A párolgási entalpiának ezt az értékét behelyettesítve (3.13)-ba és felvéve p x normál nyomás 1 atm, és hőmérsékletre T! normál forráspont T a folyadék feletti egyensúlyi gőznyomásra a következőket kapjuk:

Trouton szabálya nem vonatkozik nagy polaritású folyadékokra és különösen azokra társult folyadékok, például víz és alkoholok. (A kapcsolódó folyadékok olyan folyadékok, amelyek molekulái kölcsönhatásba lépnek egymással hidrogénkötések.) A szabály csak akkor kielégítő, ha nem poláris anyagokra alkalmazzák, és a forráspont körülbelül 150 és 1000 K között van.
Clapeyron-Clausius egyenlet (differenciál).
Olvassa el még:
|
A folyadék-gőz egyensúlyi görbe, vagy ami ugyanaz, a telített gőz nyomásának hőmérséklettől való függése adott anyag esetén az ún. Clapeyron-Clausius egyenlet megoldásával kereshető meg.
A termodinamikai ciklusok módszere lehetővé teszi ennek az egyenletnek a formáját. Legyen két kísérleti izoterma, amelyek megfelelnek a hőmérsékleteknek és (50. ábra).

Az 1-es kezdeti állapotban egy mól folyadék hőmérsékleten nyomás alatt van, és térfogatot foglal el (nincs gőzfázis). Hő hozzáadásával ezt a mol folyadékot izoterm módon elpárologtatjuk. Ebben az esetben a folyadék mindig a telített gőzének nyomásával megegyező nyomás alatt lesz. Ennek eredményeként a folyadék 2-es gázhalmazállapotúvá válik. Egy mól folyadék gáz halmazállapotúvá alakításához szükséges hőmennyiség állandó hőmérsékleten és nyomáson értelemszerűen a párolgási hő. Így a 12. átmenetnél a folyadék annyi hőt kapott, mint .
A ciklusonként elvégzett munka számszerűen megegyezik az 1234 négyszög területével:
![]() (3.3.1)
(3.3.1)
és a ciklus hatékonyságát
 .
(3.3.2)
.
(3.3.2)
Másrészt az 1234-es ciklus egy Carnot-ciklus, tehát a hatékonysága az
![]() (3.3.3)
(3.3.3)
A (3.3.2) és (3.3.3) kifejezések összehasonlításával megkapjuk

 .
(3.3.4)
.
(3.3.4)
A (3.3.4) egyenlet kissé eltérő formában is bemutatható. Ehhez meg fogjuk találni az entrópia változását a folyadék 1-es állapotból 2-es gázállapotba való átmenete során (50. ábra).
 ,
(3.3.5)
,
(3.3.5)
ahol és az 1. állapotú folyadék és a 2. állapotú gőz entrópiája. Az utolsó összefüggés felhasználásával a (3.3.4) egyenlet a következőképpen írható fel:
 .
(3.3.6)
.
(3.3.6)
A (3.3.4) differenciálegyenlet a Clapeyron–Clausius egyenlet. Ez az egyenlet a telített gőznyomás változását ábrázolja a hőmérséklet változása esetén. Ennek az egyenletnek a megoldásához ismerni kell a párolgás látens hőjének hőmérséklettől való függését, valamint a folyadék és a gáz térfogatának a hőmérséklettől és nyomástól való függését. Általános esetben ez az egyenlet egy nemlineáris differenciálegyenlet, melynek megoldását numerikus integrálással találjuk meg.
A kritikusnál lényegesen alacsonyabb hőmérsékleten a folyadék által elfoglalt térfogat sokkal kisebb, mint a folyadék által elfoglalt térfogat, azaz. Például a vízgőz térfogata 1600-szor nagyobb, mint a víz térfogata, a folyékony oxigén – C hőmérsékleten történő felforrása körülbelül 300-szoros térfogatnövekedéssel jár. Ezért hőmérsékleten a (3.3.4) egyenlet alakját veszi fel
. (3.3.7)
Ugyanebben a közelítésben a telített gőz is ideális gáznak tekinthető. Ez lehetővé teszi, hogy a (3.3.7) egyenletet a következőképpen írjuk fel:
. (3.3.8)
A (3.3.8) egyenlet bal oldalát a -tól ig tartományba, a jobb oldalát - a -ig terjedő tartományba integrálva kapjuk
 ,
(3.3.9)
,
(3.3.9)
ahol a hőmérsékleti kísérletből kapott telített gőznyomás, és a párolgáshő átlagos értéke a hőmérsékleti tartományban
A (3.3.9) képletből jól látható, hogy a telített gőzök nyomása exponenciálisan növekszik a hőmérséklet emelkedésével.
A Clapeyron–Clausius egyenlet átírva így
 , (3.3.10)
, (3.3.10)
mint a későbbiekben megmutatjuk, a folyadék forráspontjának külső nyomástól való függését is meghatározza. A (3.3.10) egyenletben
a forráspont változása a külső nyomás változása esetén. Ezért a folyadék-gőz egyensúlyi görbét forrási görbének is nevezik.
52. Van der Waals egyenlet - Nem ideális gázok állapotegyenlete. A van der Waals egyenlet állandóinak kísérleti meghatározása.
Mint korábban említettük, alacsony hőmérsékleten és nagy nyomáson a Mengyelejev–Clapeyron egyenlet egy mól anyagra
jelentős eltéréseket ad a kísérletileg mért értékektől.
Számos kísérlet történt a valós anyag állapotegyenletének megtalálására, amely ha nem is minden halmazállapotot, de legalább gáznemű és folyékony halmazállapotot lefedhetne. A sok javasolt egyenlet közül a leghíresebb a van der Waals egyenlet:
 ,
(3.4.2)
,
(3.4.2)
egy mól anyagra írva. A mólokra ez az egyenlet:
 .
(3.4.3)
.
(3.4.3)
Az állandókat kísérleti úton határozzák meg, és különböző típusú molekulákra eltérő értékkel rendelkeznek. A (3.4.2) egyenlet nem származtatott, hanem a már ismert Mengyelejev–Clapeyron egyenlet két korrekciójával jön létre. Bevezetésük igazolására megjegyezzük, hogy a (3.4.2) egyenletben a térfogat egy mól gázt tartalmazó edény térfogatát jelenti. Anyagi pontokból álló ideális gáz esetén ez a teljes térfogat rendelkezésre áll a molekulák mozgására. Valódi gázban maguk a molekulák foglalják el a tartály térfogatának egy bizonyos részét, és ez a rész nem érhető el az összes többi molekula számára. A kötetnek ezt a részét ki kell vonni a térfogatból. Ekkor a (3.4.2) egyenlet felveszi a formát
. (3.4.4)
Az utolsó kifejezésből jól látható, hogy a korrekció megegyezik azzal a térfogattal, amelyet a gáz végtelenül nagy nyomáson elfoglalna, azaz a valódi gáz molekulái még végtelenül nagy nyomáson sem közelíthetik meg egymást nullával egyenlő távolságra. Ezért a korrekció bevezetése azt jelenti, hogy megközelítőleg figyelembe kell venni a molekulák közötti taszító erőket.
Mint tudjuk, a molekulák között nemcsak taszító erők hatnak, hanem vonzó erők is. Az edény falának közelében elhelyezkedő bármely molekula nettó vonzóerőt tapasztal
a vonzóerők hatásszférájában elhelyezkedő molekulák oldaláról (51. ábra).

Válasszunk ki egy platformot a falfelületen. Legyenek rajta molekulák. Ekkor a gázból ennek a területnek a molekuláira ható erő
 ,
(3.4.6)
,
(3.4.6)
mivel a szimmetria feltételeiből minden erőnek azonos a nagysága és iránya. Ha az erőt elosztjuk a területtel, akkor az úgynevezett molekulanyomást kapjuk, amellyel a falon elhelyezkedő molekulák hatnak a gáztömeg többi részére:
. (3.4.7)
A (3.4.7) képletben szereplő tényezők mindegyike nyilvánvalóan arányos a gáz sűrűségével, ami viszont fordítottan arányos a gáz térfogatával, ezért felírhatjuk:
, (3.4.8)
Ahol a– pozitív állandó együttható.
Így a vonzóerők hatására a falra nehezedő nyomás gázoldalról kisebb lesz, mint az a nyomás (3.4.4), amelyet a fal akkor tapasztalna, ha nem lennének vonzó erők a molekulák között, azaz.
![]() .
.
Hol találjuk a van der Waals egyenletet:
 .
(3.4.9)
.
(3.4.9)
Magyarázzuk meg a további nyomás megjelenését a (3.4.9) képletben. Legyen a gáz egy hengerben, súlytalan dugattyú alatt. A külső nyomás összenyomja a gázt, vagyis közelebb hozza egymáshoz molekuláit. Ha a gázmolekulák nem vonzzák egymást, a gáz csak külső nyomást szenvedne. De a molekulák kölcsönös vonzása, mint megtudtuk, hajlamos arra is, hogy közelebb hozza egymáshoz a molekulákat, vagyis a külső nyomással azonos irányba hat. Ezért a molekulák vonzásának eredménye a gázra nehezedő külső nyomás látszólagos növekedésében tükröződik, mintha a dugattyúra nehezedő nyomáshoz hozzáadtak volna némi további nyomást.
A van der Waals egyenlet állandóinak kísérleti meghatározása
Állandók kísérleti meghatározásához aés a vizsgált gázt egy zárt térfogatú, beépített nyomásmérővel ellátott edénybe helyezzük és ennek a gáznak a nyomását különböző hőmérsékleteken mérjük. A kísérleti úton kapott görbe numerikus differenciálásával meghatározzuk a parciális deriváltot. A van der Waals egyenletből ezt a deriváltot találjuk
 .
(3.5.1)
.
(3.5.1)
Innen kapjuk az értéket:
. (3.5.2)
Ha a (3.5.2) kifejezést behelyettesítjük a (3.4.9) van der Waals egyenletbe, egy másik mennyiséget számítunk ki. a:
![]() .
(3.5.3)
.
(3.5.3)
A tapasztalat azt mutatja, hogy az értékek aés nem állandók, hanem a hőmérséklettől függenek, bár gyengén. A van der Waals-egyenletet használó számításokban konstansként aés vegyük a függvények átlagértékeit és a kívánt hőmérsékleti tartományban


53. A van der Waals egyenlet izotermái és összehasonlításuk kísérleti izotermákkal. Anyag kritikus paramétereinek meghatározása a VdW egyenletből. A metastabil halmazállapotok a túltelített gőz és a túlhevített folyadék. Wilson kamra és buborékkamra.
ábrán. Az 52. ábrán van der Waals gázizotermák láthatók.
Nagyon magas hőmérsékleten a hiperbolákhoz közeli alakúak; ezek az izotermák az anyag gázhalmazállapotát (majdnem ideális gáz) jellemzik. A hőmérséklet csökkenésével az izoterma alakja megváltozik, és egy bizonyos hőmérsékleten (kritikus) érzékeli a görbe inflexiós pontját. Még alacsonyabb hőmérsékleten (szubkritikus) a folyadék-gőz fázisátalakulásnak megfelelő vízszintes szakasz helyett az izotermák hullámszerű metszetet kapnak (53. ábra).


Rizs. 52 R és o. 53
A mérések azt mutatják, hogy a valós anyag izotermája gyakorlatilag egybeesik a van der Waals izotermával a (gáz halmazállapotú) és (folyékony halmazállapotú) szakaszokban. A középső részen azonban a folyadék-gőz fázisátalakulásnak megfelelő vízszintes 51 szakasz helyett a van der Waals izotermának hullámszerű szakasza van. Ezt a hullámos szakaszt a következőképpen jellemezzük. A 12. szakasz a gőz metastabil állapotának (túltelített gőz), az 54. szakasz pedig a folyadék metastabil állapotának (túlhevített folyadéknak) felel meg. Az 1. pontban csak telített gőz van, az 5. pontban pedig csak forrásban lévő folyadék. Ami a hullámgörbe 234. szakaszát illeti, ez fizikailag lehetetlen, mivel a természetben nincsenek olyan anyagok, amelyeknél állandó hőmérsékleten a térfogatnövekedés nyomásnövekedéshez vezetne. Ez utóbbi csak akkor lehetséges, ha ezen a területen a hőmérséklet nem állandó. A túltelített gőz (12. szakasz) az anyag gáz halmazállapota, amelyben a nyomás p nagyobb, mint az adott hőmérsékleten a telített gőznyomás - kísérletileg úgy nyerhető, hogy egy tiszta gázt a telített gőznyomásnál nagyobb nyomásra préselünk, és nem fog kicsapódni. A túltelített gőz állapota, bár van bizonyos stabilitása, kevésbé stabil, mint a kétfázisú állapot (izobar 135), amelyben, mint tudjuk, az anyag egy része folyadék formájában van, egy része pedig telített gőz formája. Ezért enyhe külső behatás hatására a túltelített gőz részben folyadékká alakul, a maradék gőz pedig telítetté válik.
Túlhevített folyadék (45. szakasz) - olyan állapot, amelyre jellemző, hogy az adott hőmérsékleten a telített gőznyomásnál alacsonyabb nyomáson van jelen - tiszta folyadék hosszan tartó forralásával érhető el, aminek következtében gázbuborékok (magok) párolgás) eltávolítjuk a folyadékból, és a folyadékot adott nyomáson a forráspontja fölé melegítjük. A túlhevített folyadék állapota is kevésbé stabilnak bizonyul, mint a folyékony és a telített gőz közötti egyensúlyi állapot. Ha egy ilyen túlhevített folyadékba idegen anyag részecskéi kerülnek, az gyorsan kétfázisú állapotba kerül.
A túltelített gőz és a túlhevített folyadék állapotát magfizikai műszerekben (felhőkamra és buborékkamra) használják az elemi részecskék paramétereinek rögzítésére és mérésére.
Ha a van der Waals izotermán a hullámos szakaszt valamilyen vízszintes egyenessel 135 helyettesítjük, akkor az így kapott izoterma minőségileg helyesen írja le az anyag kétfázisú állapotát. Ennek az egyenesnek a helyzete meghatározható, ha a termodinamika második főtételét a Clausius-jelölésben (2.13.7) alkalmazzuk az 1234531 zárt reverzibilis ciklusra:
. (3.6.1)
Mivel a teljes 1234531 út mentén az anyag hőmérséklete változatlan marad (mivel ez az út ugyanazon izoterma két lehetséges változatának szakaszaiból tevődik össze), az utolsó egyenlet a következő alakban írható fel
. (3.6.5) kísérleti adatokkal azt mutatják, hogy a van der Waals-egyenlet, amelyből ezt az értéket kapjuk, közelítő, bár az anyag halmazállapot-változásának kvalitatív képét az egyenlet meglehetősen helyesen adja vissza. Számos próbálkozás létezik pontosabb halmazállapot-egyenlet létrehozására. Ezek az egyenletek azonban nagyszámú korrekciós tényezőt tartalmaznak, amelyek fizikai jelentése nem világos, mint a van der Waals egyenletben.
A legáltalánosabb formában, a statisztikai fizika módszereit használva, N. N. Bogolyubov akadémikus kapta meg az állapotegyenletet.
 ,
(3.6.12)
,
(3.6.12)
hol vannak az úgynevezett viriális együtthatók, amelyek csak a hőmérséklet függvényei. A Bogolyubov-egyenletből az következik, hogy minél nagyobb a moláris térfogat értéke, annál kisebb számú tagot kell figyelembe venni a sorozatban, hogy meglehetősen pontos eredményt kapjunk. Amikor a hatványsor összes tagja eltűnik, és a (3.6.12.) egyenlet alakot ölt, azaz ahogy az várható volt, a Bogolyubov-egyenlet Mengyelejev–Clapeyron egyenletté változik. A vírusegyütthatókat nem lehet pusztán elméleti módszerekkel kiszámítani, ezért kísérleti adatok felhasználásával kell meghatározni. Ez a probléma azonban olyan összetettnek bizonyul, hogy célszerűbb az állapotegyenletet egyszerűen a kísérleti adatokat leíró interpolációs képlet formájában megkapni.
Folyadék párolgáshőjének meghatározása
A folyadék és a gőz közötti egyensúlyra a Clapeyron-Clausius egyenlet a következőképpen származtatható.
A termodinamika második főtétele szerint, ha egy rendszer egyensúlyban van, akkor adott feltételek mellett ( R, T) nem végeznek munkát
Ap = 0; G és -G P = 0; G és = G P (2)
vagyis egy tiszta folyadék és gőzének Gibbs-szabad energiái egyenlőek (ezek egyensúlyi feltételek).
Változtassuk meg az egyensúlyt meghatározó feltételek egyikét, például a hőmérsékletet (azaz felfűtjük a rendszert T), ennek eredményeként új nyomás, új folyadék-gőz egyensúly jön létre:
G " és = G " P (3)
vagy G és = G P (4)
Ha a külső paraméterben végtelenül kicsiny változás következik be - dT, akkor az izobár-izoterm potenciálok végtelenül kicsi értékkel változnak:
dG és =dG P (5)
Az izobár-izoterm potenciál a rendszer szabad energiáját jelenti, és a nyomás és a hőmérséklet függvénye:
dG=VdP–SDT(6)
ezért felhasználható mennyiségi összefüggés megállapítására a telített gőznyomás és a hőmérséklet között.
Miután a (6)-ot behelyettesítettük (5)-be, egyensúlyi állapotba kerültünk
V és dP-S és dT = V P dP-S P dT(7)
honnan (8)
Ahol ( S P -S és) És ( V P -V és) - a rendszer entrópiájának és térfogatának változása az anyag folyadékból gőz állapotba való átmenete során. A termodinamika második főtétele szerint a rendszer entrópiájának változása a párolgás során megegyezik a párolgási hő csökkenésével.
 (9)
(9)
A (9) kifejezést (8)-ra behelyettesítve kapjuk
 (10)
(10)
ahol ∆ H ispés ∆ V isp- az entalpia és térfogat változása a párolgás során, ill T bála- forráspont.
(10) egyenlet Clapeyron-Clausius egyenletnek nevezik . A (10) szerint a víz fázisdiagramján (1. ábra) a vonalak meredekségét a derivált előjele határozza meg. dP/dT vagy annak kölcsönös dT/dP- a hőmérséklet változásának jellemzése a nyomás növekedésével.
A fázisátalakulások közül a párolgást és az olvadást vesszük figyelembe. A párolgáshő - a folyékony fázis gázfázisba való átmenete - pozitív. Moláris párolgási hő egy mól folyékony anyag elpárologtatására fordított hőmennyiség. A gáz térfogata a párolgás során mindig nagyobb, mint a megfelelő folyadék térfogata, vagyis a (10) egyenletben. V P >V és. Ezért dP/dT, és ezért dT/dP mindig pozitívak ( dT/dP> 0). Következésképpen a párolgási hőmérséklet mindig növekszik a nyomás növekedésével (görbe rendbenábrán. 1 vagy lásd a táblázatot. 1 Függelék). A hőmérséklet emelkedésével a folyadék feletti telített gőznyomás nő, és a kritikus hőmérsékleten éri el maximális értékét. Ez utóbbi az a határhőmérséklet (például víznél ez 374,12 o C), amelyen az anyag folyadék- és gőzfázisa közötti egyensúly lehetséges. Magasabb hőmérsékleten egy anyag csak gáz halmazállapotú lehet, és a telített gőz fogalma értelmét veszti.
Az olvadáshő - a szilárd fázis folyékony fázisba való átmenete szintén mindig pozitív.

Rizs. 1. A víz állapotának diagramja alacsony nyomáson
Régiók: 1 - szilárd fázis (jég); II- folyadék; III - par.
Görbék: AO - szublimáció; OK - párolgás; OV - olvadás.
O egy hármaspont, amely három fázis egyensúlyának felel meg.
A folyékony fázis térfogata általában nagyobb vagy kisebb lehet, mint az azonos mennyiségű szilárd fázis térfogata. Innen a (10) egyenletnek megfelelően az következik, hogy az érték dP/dT vagy annak fordított értéke dT/dP, lehet pozitív vagy negatív. Ez azt jelenti, hogy az olvadáspont emelkedhet vagy csökkenhet a nyomás növekedésével. Nagyságrend dT/dP pozitív a legtöbb anyagra. Negatív értéke csak a víz, a bizmut és néhány más olyan anyag esetében van, amelyeknél a folyadék sűrűsége az olvadásponton nagyobb, mint a szilárd fázis sűrűsége ( V és -V T) < 0. В связи с этим при увеличении давления температура плавления льда понижается (криваяOB).
Megjegyzendő, hogy a figyelembe vett minták alacsony nyomásra érvényesek.
A (10) Clapeyron-Clausius egyenlet a következő közelítésekkel transzformálható:
1) Mivel ∆ V isp =(V P -V és) >> 0 (például víznél a moláris térfogat gőzállapotban a sz. V P≈ 22400 cm 2, és folyékony állapotban V és≈ 18 cm 3), akkor nagy hiba nélkül elhanyagolhatjuk az értéket V ésés fogadjuk el, hogy ∆ V isp ≈ V P .
2) Nem túl magas nyomáson és hőmérsékleten (messze a kritikustól) az ideális gázok állapotegyenlete alkalmazható valós rendszerekre. Az ebben az esetben kapott hiba jelentéktelennek bizonyul.
 (11)
(11)
A (11)-et (10)-re behelyettesítve a következőket kapjuk:
 (12)
(12)
amely az átalakulás után
 (13)
(13)
felveszi a formát
 (14)
(14)
A párolgási hő a hőmérséklettől függ : A hőmérséklet emelkedésével a párolgási hő csökken. A kritikus hőmérsékleten a párolgáshő nulla. A kritikustól távol eső hőmérsékleteken azonban a ∆ megváltozik N isp a hőmérséklet nem túl magas. Nem túl széles hőmérsékleti tartományban∆ N ispállandónak tekinthető.
A (14) Clapeyron-Clausius egyenlet integrálása a hőmérsékleti tartományon belül T 1 és T 2, amelyek nyomásoknak felelnek meg R 1 és R 2 állandó ∆-nél N isp, ad
 (15)
(15)
vagy decimális logaritmusra való áttéréskor
 (16)
(16)
(R- univerzális gázállandó 8,314 J/mol K).
A (15), (16) egyenletek lehetővé teszik a párolgáshő kiszámítását. Ehhez a kísérleti adatok alapján függőséget építenek ki lnP=f(1/T) vagy lgP=f(1/T) és válasszon két pontot a kapott egyenesen (2. ábra). Helyettesítsük be az ezeknek a pontoknak megfelelő nyomás és inverz hőmérséklet logaritmusának értékeit a (17) egyenletbe:
 (17)
(17)
∆ érték N isp a (17) egyenlet szerint a felvett hőmérsékleti intervallumtól függ, és minél közelebb van az igazihoz, annál kisebb ez az intervallum. Egy ilyen számítás azonban a forráspont és a gőznyomás nagyon pontos mérését igényli.
∆ kiszámításához N isp viszonylag széles hőmérsékleti tartományban (50...100 o C) olyan pontokat kell kiválasztani, amelyek a legpontosabban illeszkednek az egyeneshez lgP=f(1/T).
A folyadék forráspontja, a gőznyomás egy adott hőmérsékleten és a párolgáshő az anyag specifikus állandói , amelyek értékei számos elméleti és gyakorlati számításhoz szükségesek. Ezen adatok alapján lehetőség nyílik a vegyszerek tisztaságának meghatározására, a keverékek desztillációval történő elválasztásának kiszámítására, valamint a gázfázisú reakció lebonyolításához szükséges folyadék elpárologtatásához szükséges energiaköltségek kiszámítására.
A párolgási hő molekuláris paraméterekkel történő kiszámítása mindig feltételezéseket tartalmaz. Ez hozzávetőleges és megfelelő, ha számos feltétel teljesül. Létezik azonban egy alapvető Clapeyron-Clausius egyenlet, amely a párolgáshőt a rendszer egyéb termodinamikai jellemzőivel köti össze, és amelyet szigorúan a termodinamika második főtétele alapján kapunk.
Legyen a Carnot-ciklust végrehajtó munkaanyag egy kétfázisú folyadékkal telített gőzrendszer. Egy ilyen rendszer kezdeti állapotát a 8.17. ábra 1. pontjaként ábrázoljuk. Végezzük el a rendszer izobár-izoterm expanzióját 1-es állapotból 2-es állapotba. Ebben az esetben a folyadék bizonyos tömege elpárolog, és ennek megfelelően a folyadék párolgási hőjével megegyező hő nyelődik el. a termosztáttól. A 2. és 1. pontban a térfogatkülönbség megegyezik az anyag elpárolgott tömegére vonatkozó gáz- és folyékony halmazállapotú térfogatkülönbséggel: A 2. állapotból a kétfázisú rendszer adiabatikusan átkerül a 3. állapotba, alacsonyabb hőmérsékleten: 7%. A 3-as állapotból a munkaanyag izobár-izotermikusan kerül át a 4-es állapotba, miközben a gőzök egy része lecsapódik és hő kerül a hűtőbe A 4-es állapotból a kétfázisú rendszer adiabatikus kompresszióval kerül a kiindulási állapotba. A ciklus munka a következő:
hol van a ciklus hatékonysága
![]()
Kis hőmérséklet- (nyomás) különbségeknél a ciklus munkája egyenlő:
A (83.3) és (83.2) segítségével átírjuk (83.1):
![]()
Cserélve és a határig átlépve a következőket kapjuk:
![]()
Ezt az összefüggést Clapeyron francia mérnök (1832) találta meg, mielőtt a termodinamika első főtételét megállapították.

Ennek az egyenletnek a modern származtatását Clausius adta meg, ezért nevezik Clapeyron-Clausius egyenletnek. Ez az egyenlet lehetővé teszi a párolgási hő kiszámítását (fajlagos, moláris), ha ismert a telített gőznyomás hőmérséklettől való függése, valamint a folyadék és a gőz térfogata (fajlagos, moláris).
A származékot a kísérletileg megállapított függésből (a telített gőz nyomásának hőmérséklettől való függése) határozzuk meg.
A Clapeyron-Clausius egyenlet nemcsak a folyadék-gőz átmenetre érvényes, hanem az összes többi fázisátalakulásra is. Azt a nyomásváltozást fejezi ki, amelynél a fázis egyensúlyban van a hőmérséklet változásával. Így olvasztáshoz a (83.4) egyenlet veszi fel a formát
![]()