वृषण सेमिनोमा के बारे में विवरण: कारण, लक्षण, चरण और जीवन का पूर्वानुमान। वृषण सेमिनोमा: कारण, लक्षण और उपचार सेमिनोमा वे कितने समय तक जीवित रहते हैं
हिस्टोलॉजिकली, के अनुसार डब्ल्यूएचओ वर्गीकरणद्वारा संपादित एफ.के. मोस्तोफ़ी (1977), भेद:
जर्म सेल ट्यूमर (सेमिनीफेरस एपिथेलियम से विकसित)
ए. समान ऊतकीय संरचना के ट्यूमर:
- सेमिनोमा;
- स्पर्मेटोसाइटिक सेमिनोमा;
- भ्रूण कैंसर;
- जर्दी थैली ट्यूमर;
- बहुभ्रूण;
- कोरियोनिपिथेलियोमा;
- टेराटोमा ए) परिपक्व, बी) अपरिपक्व, सी) घातक परिवर्तन के साथ।
बी. एक से अधिक हिस्टोलॉजिकल प्रकार के ट्यूमर।
सेक्स कॉर्ड स्ट्रोमल ट्यूमर
ए. अच्छी तरह से विभेदित रूप:
- लेडिगोमा;
- सर्टोलियोमा;
- ग्रैनुलोसा सेल ट्यूमर।
बी. मिश्रित रूप;
बी. पूरी तरह से विभेदित ट्यूमर नहीं।
ट्यूमर और ट्यूमर जैसे घाव जिनमें रोगाणु कोशिकाएं और सेक्स कॉर्ड स्ट्रोमल कोशिकाएं होती हैं
ए. गोनैडोब्लास्टोमा;
बी. अन्य.
मिश्रित ट्यूमर
लिम्फोइड और हेमेटोपोएटिक ऊतकों के ट्यूमर
द्वितीयक ट्यूमर
सीधी नलिकाओं के ट्यूमर, वृषण रेटे, एपिडीडिमिस, शुक्राणु कॉर्ड, कैप्सूल, सहायक संरचनाएं, अल्पविकसित संरचनाएं।
अवर्गीकृत ट्यूमर
चिकित्सक के लिए, सबसे महत्वपूर्ण बात सभी वृषण जनन कोशिका ट्यूमर को सेमिनोमा और गैर-सेमिनोमा में विभाजित करना है, जो उपचार रणनीति की पसंद को महत्वपूर्ण रूप से प्रभावित करता है। गैर-सेमिनोमा वृषण ट्यूमर का आगे उपखंड कोई बड़ी भूमिका नहीं निभाता है। 1977 डब्ल्यूएचओ वर्गीकरण, जिसमें वृषण जर्म सेल ट्यूमर के विभिन्न हिस्टोलॉजिकल वेरिएंट की विस्तार से जांच की गई, ने उनके मूल की एकता और कार्सिनोजेनेसिस की प्रक्रिया में अन्य रूपात्मक प्रकारों में आगे भेदभाव की संभावना को ध्यान में नहीं रखा।
1992 में प्रस्तावित नया हिस्टोलॉजिकल वर्गीकरण, कार्सिनोमा इन सीटू से सभी वृषण जर्म सेल ट्यूमर की एकल उत्पत्ति के विचार पर आधारित है। स्पर्मेसीटोमा को छोड़कर सभी जर्म सेल ट्यूमर को गोनोसाइटोमा कहा जाने का प्रस्ताव है। गोनोसाइटोमा को सेमिनोमा (क्लासिक और एनाप्लास्टिक, अधिक आक्रामक पाठ्यक्रम की विशेषता), टेराटोजेनिक गोनोसाइटोमा और एनाप्लास्टिक जर्म सेल ट्यूमर में विभाजित किया गया है, जिसमें सेमिनोमा और टेराटोजेनिक गोनोसाइटोमा दोनों की विशेषताएं हैं। टेराटोजेनिक गोनोसाइटोमा की स्टेम कोशिका प्लुरिपोटेंट है और विभिन्न प्रकार के टेराटोमा (परिपक्व और अपरिपक्व), एपिब्लास्टोमा (पुराने वर्गीकरण में - भ्रूण कैंसर) और एक्स्ट्राएम्ब्रायोनिक तत्वों में अंतर करने में सक्षम है, जिसमें योक सैक ट्यूमर और कोरियोनिक कार्सिनोमा शामिल हैं।
रूस में, कई देशों की तरह, इंटरनेशनल यूनियन अगेंस्ट कैंसर द्वारा प्रस्तावित वर्गीकरण का उपयोग किया जाता है, जो उपचार की रणनीति निर्धारित करने के लिए ट्यूमर प्रक्रिया की सीमा को अधिक विस्तार से कवर करता है। टीएनएम वर्गीकरण का उपयोग करते समय, निदान की हिस्टोलॉजिकल पुष्टि अनिवार्य है। टीएनएम (1997) श्रेणियों का मूल्यांकन करने के लिए, न्यूनतम शोध की आवश्यकता है: टी - नैदानिक परीक्षा और ऑर्किडेक्टोमी; एन - अल्ट्रासाउंड और यूरोग्राफी सहित नैदानिक और रेडियोलॉजिकल परीक्षा; एम- नैदानिक, एक्स-रे परीक्षा और जैव रासायनिक परीक्षण; एस - ट्यूमर मार्कर।
टी - प्राथमिक ट्यूमर
यदि ऑर्किडेक्टोमी नहीं की गई है, तो टीएक्स प्रतीक का उपयोग किया जाना चाहिए।
टी है - इंट्राकैनालिक्यूलर ट्यूमर
टी1 - वृषण और एपिडीडिमिस तक सीमित ट्यूमर, शिरापरक या लसीका वाहिकाओं पर कोई आक्रमण नहीं
टी2 - शिरापरक और लसीका वाहिकाओं पर आक्रमण के साथ, अंडकोष और एपिडीडिमिस तक सीमित ट्यूमर
टी 3 - ट्यूमर शुक्राणु कॉर्ड तक फैला हुआ है
टी4 - ट्यूमर ट्युनिका एल्ब्यूजिनेया पर आक्रमण करता है
एन - क्षेत्रीय और निकटवर्ती लिम्फ नोड्स। अंडकोष के लिए, पैराकावल और पैरा-महाधमनी लिम्फ नोड्स क्षेत्रीय हैं। यदि वंक्षण-अंडकोश क्षेत्र में पहले सर्जरी हुई थी, तो वंक्षण लिम्फ नोड्स को क्षेत्रीय माना जाता है। निकटतम को इंट्रापेल्विक, मीडियास्टिनल और सुप्राक्लेविकुलर माना जाता है।
एनएक्स - क्षेत्रीय लिम्फ नोड्स की स्थिति का आकलन करना असंभव है
N0 - प्रक्रिया में क्षेत्रीय लिम्फ नोड्स की भागीदारी का कोई संकेत नहीं
एन1 - 2 सेमी से कम क्षेत्रीय लिम्फ नोड्स
एन2 - क्षेत्रीय लिम्फ नोड्स 2 सेमी से अधिक और 5 सेमी से कम
एन3 - 5 सेमी से अधिक क्षेत्रीय लिम्फ नोड्स
एम - दूर के मेटास्टेस
एमएक्स - दूर के मेटास्टेस की उपस्थिति निर्धारित करना असंभव है
M0 - दूर के मेटास्टेस का कोई संकेत नहीं
एम1ए - डायाफ्राम और/या फेफड़ों के ऊपर लिम्फ नोड्स में मेटास्टेस
एम1बी - यकृत, हड्डियों, मस्तिष्क में मेटास्टेस
पी - हिस्टोपैथोलॉजिकल श्रेणियां, टी, एन और एम श्रेणियों के अनुरूप हैं
एस - ट्यूमर मार्कर
एसएक्स - ट्यूमर मार्कर निर्धारित नहीं किए गए थे
S0 - सामान्य सीमा के भीतर ट्यूमर मार्कर
एस1 - एलडीएच< 1,5 x верхняя граница нормы, ХГ < 5000 Ед/мл, АФП < 1000 нг/мл.
एस2 - एलडीएच 1.5-10 x सामान्य की ऊपरी सीमा, सीजी5000 - 50000यू/एमएल, एएफपी 1000 - 10000 एनजी/एमएल
एस3 - एलडीएच > 10 x सामान्य की ऊपरी सीमा, सीजी > 50,000 यू/एमएल, एएफपी > 10,000 एनजी/एमएल
रॉयल मार्सडेन अस्पताल का वर्गीकरण चिकित्सकों के बीच व्यापक हो गया है:
मैंअंडकोष के बाहर बीमारी का कोई सबूत नहीं
आईएम टोकन स्तर केवल ऊपर
II डायाफ्राम के नीचे लिम्फ नोड्स का शामिल होना
IIA अधिकतम आकार< 2 см
IIB अधिकतम आकार 2-5 सेमी
आईआईसी
अधिकतम आकार 5-10 सेमी
IIअधिकतम आकार >10 सेमी
III डायाफ्राम के ऊपर और नीचे लिम्फ नोड्स का शामिल होना
मीडियास्टिनल लिम्फ नोड्स एम+
सरवाइकल लिम्फ नोड्स एन+
IVआंत संबंधी मेटास्टेस
रेट्रोपरिटोनियल लिम्फ नोड्स ए, बी, सी (ऊपर के अनुसार)
मीडियास्टिनल लिम्फ नोड्स एम+
सरवाइकल लिम्फ नोड्स एन+
फेफड़े, यकृत और अन्य अंगों में मेटास्टेस
रोगी के पूर्वानुमान की भविष्यवाणी करने और उपचार के दृष्टिकोण को मानकीकृत करने के लिए, रोग के प्रसार की डिग्री के आधार पर कई वर्गीकरण प्रस्तावित किए गए हैं (एमएसकेसीसी, आईयू, एनसीआई, ईओआरटीसी, आदि)।
1995 में, प्रसारित वृषण जर्म सेल ट्यूमर को रोगसूचक समूहों में विभाजित करते हुए एक नया वर्गीकरण प्रस्तावित किया गया था, इंटरनेशनल जर्म सेल कैंसर कोलैबोरेटोव ग्रुप (IGCCCG) वर्गीकरण, जिसे प्रसारित वृषण ट्यूमर का इलाज करने वाले अधिकांश प्रमुख केंद्रों द्वारा स्वीकार किया जाता है। यह ध्यान दिया जाना चाहिए कि IGCCCG वर्गीकरण वृषण जर्म सेल ट्यूमर के पूर्वानुमान कारक के रूप में रक्त सीरम में ट्यूमर मार्करों की एकाग्रता का उपयोग करता है।
नॉनसेमिनोमा जर्म सेल ट्यूमर
यदि सभी लक्षण मौजूद हों तो अच्छा पूर्वानुमान:
- रक्त सीरम में AFP का स्तर होता है<1000 нг/мл;
- सीरम एचसीजी स्तर है<5000 мМе/мл;
- सीरम एलडीएच स्तर है<675 Ед/л;
यदि सभी लक्षण मौजूद हों तो मध्यम पूर्वानुमान:
- रक्त सीरम में एएफपी का स्तर 1000 से 10,000 एनजी/एमएल तक होता है;
- रक्त सीरम में एचसीजी का स्तर 5000 से 50000 mIU/ml तक होता है;
- सीरम एलडीएच स्तर 675 से 4500 यू/एल तक होता है;
- एक्सट्रागोनैडल मीडियास्टिनल ट्यूमर की अनुपस्थिति;
- यकृत, हड्डियों और मस्तिष्क में मेटास्टेस की अनुपस्थिति।
यदि कम से कम एक संकेत मौजूद है तो खराब पूर्वानुमान:
- सीरम एएफपी स्तर >10,000 एनजी/एमएल है;
- सीरम एचसीजी स्तर >50,000 एमआईयू/एमएल है;
- सीरम एलडीएच स्तर >4500 यू/एल है;
- मीडियास्टिनम के एक एक्सट्रागोनैडल ट्यूमर की उपस्थिति;
- यकृत, हड्डियों और मस्तिष्क में मेटास्टेस की उपस्थिति।
सेमिनोमस
अच्छा पूर्वानुमान: यकृत, हड्डियों, मस्तिष्क में मेटास्टेस की अनुपस्थिति;
मध्यम पूर्वानुमान: यकृत, हड्डियों, मस्तिष्क में मेटास्टेस की उपस्थिति।
यूरोलॉजिकल ऑन्कोलॉजी में घातक वृषण ट्यूमर काफी दुर्लभ हैं, लेकिन घटना दर लगातार बढ़ रही है।
के अनुसार, सभी ऑन्कोलॉजिकल पैथोलॉजीज में यह 2% से कम है। इसी तरह की विकृति 35 वर्ष से कम और 60 वर्ष के बाद के पुरुषों में पाई जाती है। हालांकि, ऐसे मामले भी हैं जहां 10 साल से कम उम्र के लड़कों में अंडकोष में कैंसरयुक्त ट्यूमर पाया गया।
ऐसे अधिकांश ट्यूमर (95%) जर्मिनल होते हैं, यानी वे जर्मिनल गोनाड कोशिका संरचनाओं में विकसित होते हैं। इन्हें सेमिनोमा और गैर-सिमिनोमा में विभाजित किया गया है। सबसे आम वृषण कैंसर सेमिनोमस हैं।
अवधारणा
सेमिनोमा एक घातक प्रकृति का वृषण ट्यूमर है, जो अंडकोष की भ्रूण कोशिकाओं से बनता है।
सभी रोगाणु कोशिका ट्यूमर में, सेमिनोमा लगभग 40% होते हैं, यानी, वे दूसरों की तुलना में अधिक आम हैं। आमतौर पर, गठन केवल एक अंडकोष को प्रभावित करता है, जिससे इसका दर्द रहित इज़ाफ़ा होता है, हालांकि द्विपक्षीय वृषण घाव भी होते हैं।
वृषण कैंसर के इस रूप की विशेषता लिम्फोजेनस मार्ग के माध्यम से प्रारंभिक मेटास्टेसिस है।
सेमिनोमस अक्सर नेक्रोटिक क्षेत्रों के गठन को भड़काते हैं, लेकिन अगर शुरुआती चरण में पता चल जाए, तो उनका पूर्वानुमान काफी अनुकूल होता है।
रोग के कारण
सेमिनोमा का विकास विभिन्न कारकों द्वारा निर्धारित होता है।
- अक्सर, अंडकोष में रोगाणु कोशिका संरचनाएं पहले से मौजूद प्रीकैंसर - एक इंट्राट्यूबुलर रोगाणु कोशिका नियोप्लास्टिक प्रक्रिया के प्रभाव में बनती हैं। ऊतकों में परिवर्तन की प्रक्रिया के दौरान, असामान्य उत्परिवर्ती कोशिकाएं बनती हैं, जो कुछ परिस्थितियों में घातक ट्यूमर संरचनाओं को जन्म देती हैं।
- अक्सर, सेमिनोमा एक पुनरावृत्ति होती है जो प्राथमिक ट्यूमर को हटाने के बाद होती है।
- आनुवंशिकता भी एक महत्वपूर्ण भूमिका निभाती है। आँकड़ों के अनुसार, विकृति रक्त संबंधियों में अधिक पाई जाती है, और न केवल करीबी लोगों में, बल्कि दूर के लोगों में भी, यहाँ तक कि कई पीढ़ियों के अंतर के साथ भी।
- हाइपरएस्ट्रोजेनिज्म, जो एस्ट्रोजन हार्मोन के अत्यधिक स्तर और हार्मोनल असंतुलन के अन्य रूपों से प्रकट होता है;
- सेमिनोमा के विकास का एक अन्य कारण क्रिप्टोर्चिडिज्म है, जब अंडकोष अंडकोश में नहीं उतरता है;
- घाव, सर्जरी के दौरान क्षति और आकस्मिक आघात जैसे दर्दनाक कारक भी इस प्रकार के वृषण कैंसर की घटना को प्रभावित कर सकते हैं।
यदि किसी पुरुष में वृषण विकास की जन्मजात या अधिग्रहित विसंगतियाँ हैं, तो वह जोखिम समूह से संबंधित है।
वर्गीकरण
सेमिनोमा को कई प्रकारों में विभाजित किया गया है:
- स्पर्मेटोसाइट- सभी सेमिनोमा के 5-10% में पाया जाता है, मुख्यतः बुजुर्ग रोगियों में। ट्यूमर में एक पीली श्लेष्मा झिल्ली होती है और इसके अंदर सिस्टिक समावेशन, परिगलन और रक्तस्राव होता है;
- स्वास्थ्य-संधान संबंधी– सेमिनोमा वाले 5-10% पुरुषों में होता है। यह एक आक्रामक पाठ्यक्रम, खराब परिभाषित स्ट्रोमा और विभिन्न आकृतियों की कोशिकाओं की उपस्थिति की विशेषता है;
- ठेठ- 85% मामलों में पता चला। क्रिप्टोर्चिडिज़म वाले 20-35 वर्ष के पुरुषों के लिए विशिष्ट। आमतौर पर एकल नोड के रूप में बनता है, हालांकि एक बहु-नोड संरचना भी होती है। यह सफेद सतह के साथ चमकदार दिखाई देता है। इसमें ट्यूबरकल जैसे ग्रैनुलोमा हो सकते हैं।
सेमिनोमस को कई चरणों में विभाजित किया गया है:
- स्टेज I - गठन स्थानीयकृत है और केवल अंडकोष के भीतर स्थित है;
- चरण II में, सेमिनोमा भी अंडकोष के भीतर स्थानीयकृत होता है, हालांकि, इसके आकार में परिवर्तन और झिल्ली में ट्यूमर का विकास देखा जाता है;
- चरण III - लिम्फ नोड मेटास्टेसिस प्रकट होता है;
- चरण IV में, ट्यूमर प्रक्रिया का प्रसार दूर के अंगों तक पहुँच जाता है।
वृषण सेमिनोमा के लक्षण
सबसे पहले, वृषण कैंसर स्वयं प्रकट नहीं होता है। सबसे चौकस पुरुषों को गलती से पल्पेशन के दौरान अंडकोष में एक गांठ का पता चल सकता है, जो मूत्र रोग विशेषज्ञ के पास जाने का कारण बन जाता है। ये संकुचन ही सेमिनोमा की पहली अभिव्यक्ति हैं।
ट्यूमर के आगे विकास के साथ, प्रभावित अंडकोष बड़ा होना शुरू हो जाता है, जो दर्दनाक संवेदनाओं के साथ होता है, विशेष रूप से भारी वस्तुओं को उठाने या उठाने पर गंभीर होता है।
अंडकोष को सहारा देने वाली नाल की क्षति के कारण दर्दनाक अभिव्यक्तियाँ होती हैं। धीरे-धीरे, वृषण ऊतक सघन हो जाता है और विकृत हो जाता है।
दर्द और असुविधा केवल तभी हो सकती है जब ट्यूमर प्रक्रिया प्रभावित अंडकोष की सीमाओं से परे फैलती है। जब लिम्फ नोड मेटास्टेस दिखाई देते हैं, तो नैदानिक तस्वीर अधिक स्पष्ट हो जाती है।
अंडकोष में ट्यूमर की प्रक्रिया समय से पहले यौवन, स्तंभन दोष, गाइनेकोमेस्टिया और हार्मोनल विकारों के साथ हो सकती है। पेट के लिम्फ नोड्स में मेटास्टेसिस के साथ, समय-समय पर काठ का दर्द होता है। यदि मेटास्टेसिस फुफ्फुसीय तंत्र में प्रवेश कर गया है, तो आदमी को खूनी निर्वहन के साथ खांसी होती है।
पैरा-महाधमनी लिम्फ नोड्स में मेटास्टेसिस की पृष्ठभूमि के खिलाफ, पेट क्षेत्र में दर्द और पैरों में सूजन दिखाई देती है (यदि वेना कावा संकुचित होता है)। जब मूत्रवाहिनी संकुचित होती है, तो मूत्र संबंधी विकार उत्पन्न होते हैं, और इंट्रा-पेट के लिम्फ नोड्स में मेटास्टेसिस आंतों में रुकावट के साथ होता है।
ट्यूमर का निदान
 पैथोलॉजी की पहचान करने की प्रक्रिया पारंपरिक चिकित्सा परीक्षण से शुरू होती है। फिर प्रयोगशाला और हार्डवेयर विधियों का उपयोग करके एक अतिरिक्त परीक्षा निर्धारित की जाती है।
पैथोलॉजी की पहचान करने की प्रक्रिया पारंपरिक चिकित्सा परीक्षण से शुरू होती है। फिर प्रयोगशाला और हार्डवेयर विधियों का उपयोग करके एक अतिरिक्त परीक्षा निर्धारित की जाती है।
आमतौर पर, एक आदमी पहले अल्ट्रासाउंड डायग्नोस्टिक्स से गुजरता है, जो उसे ट्यूमर के आकार और इसके प्रसार की सीमा का आकलन करने की अनुमति देता है।
मेटास्टेटिक प्रक्रियाओं की पहचान करने के लिए चुंबकीय अनुनाद या कंप्यूटेड टोमोग्राफी का संकेत दिया जाता है।
एचसीजी, सीरम न्यूरॉन-विशिष्ट एनोलेज़, α-भ्रूणप्रोटीन और प्लेसेंटल क्षारीय फॉस्फेट जैसे ट्यूमर मार्करों का विश्लेषण महान नैदानिक महत्व का है।
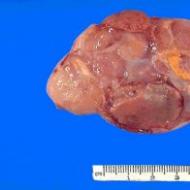
आमतौर पर, सेमिनोमा 5-10 सेमी से अधिक नहीं होता है और इसमें वृषण ऊतक से अलग एक या कई लोब्यूलर नोड्यूल होते हैं।
सेमिनोमा का उपचार
इस प्रकार के वृषण कैंसर के लिए थेरेपी सावधानीपूर्वक निदान और ट्यूमर के हिस्टोलॉजिकल वेरिएंट को ध्यान में रखने पर आधारित है।
आमतौर पर, पहला कदम सेमिनोमा (ऑर्किएक्टोमी) से प्रभावित अंडकोष को शल्य चिकित्सा द्वारा हटाना है, जिसमें गर्भनाल और कभी-कभी रेट्रोपेरिटोनियल लिम्फ नोड संरचनाओं (लिम्फैडेनेक्टॉमी) को हटा दिया जाता है।
आगे के चिकित्सीय उपाय गठन की हिस्टोलॉजिकल प्रकृति द्वारा निर्धारित किए जाते हैं।
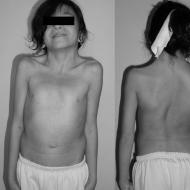
हटाए गए वृषण सेमिनोमा का फोटो

सेमिनोमस को कीमोथेराप्यूटिक प्रभावों के प्रति सबसे अधिक संवेदनशील माना जाता है, जो सरकोलिसिन और साइक्लोफॉस्फेमाइड जैसी ट्यूमररोधी दवाओं द्वारा किया जाता है।
यदि चिकित्सीय प्रभाव अपर्याप्त है, तो सिस्प्लैटिन, ब्लेमाइसिन और विन्ब्लास्टाइन दवाओं के संयोजन का उपयोग किया जाता है।
पूर्वानुमान और रोकथाम
यदि वृषण कैंसर के पहले चरण में वृषण सेमिनोमा का उपचार शुरू किया जाता है, तो रोगियों की जीवित रहने की दर 93.6% तक होती है, दूसरे चरण में - लगभग 90%, तीसरे पर - 57.8%।
चरण 1-2 सेमिनोमा का इलाज पूरा करने के बाद, 80% मरीज़ 10 साल तक जीवित रहते हैं। लगभग 16-20% रोगियों को पांच साल की अवधि में दोबारा बीमारी का अनुभव होता है, जिनमें से लगभग 70% उपचार के बाद पहले 2 वर्षों में होते हैं।
सबसे अधिक बार, सबफ़्रेनिक स्थानीयकरण के घातक लिम्फ नोड ट्यूमर के रूप में रिलैप्स का पता लगाया जाता है।
अंडकोष में सेमिनोमा के गठन से बचना लगभग असंभव है, क्योंकि वे अक्सर आनुवंशिकता या आनुवांशिक कारकों के कारण होते हैं। आप निम्न तरीकों से वृषण कैंसर के विकास के जोखिम को कम कर सकते हैं:
- गांठों की उपस्थिति के लिए अंडकोष की मासिक पल्पेशन द्वारा नियमित स्व-परीक्षा के माध्यम से। यदि कोई पता चलता है, तो आपको तुरंत मूत्र रोग विशेषज्ञ से संपर्क करना चाहिए;
- इसके अलावा, क्रिप्टोर्चिडिज्म का तुरंत इलाज करने, हार्मोनल असंतुलन को खत्म करने, अस्वास्थ्यकर व्यसनों (निकोटीन, शराब, ड्रग्स) आदि को खत्म करने की सिफारिश की जाती है।
सेमिनोमा की पुनरावृत्ति की रोकथाम के लिए, चिकित्सा के बाद पहले 12 महीनों के दौरान, हर दो महीने में जांच, ट्यूमर मार्करों के लिए रक्त परीक्षण और रेडियोग्राफी की जाती है। चिकित्सा की समाप्ति के बाद दूसरे वर्ष के लिए, रोगी को हर तीन महीने में एक बार और तीसरे वर्ष के दौरान - तिमाही में एक बार उपरोक्त निवारक उपायों से गुजरना चाहिए।
सामान्य तौर पर, ऐसे कैंसर रोगियों की चिकित्सा समाप्त होने के बाद पांच साल तक निगरानी की जानी चाहिए, क्योंकि इस प्रकार के कैंसर में मेटास्टेसिस अक्सर देर से होता है।
उपचार के बाद 4-5वें वर्ष के दौरान, डॉक्टर के पास जाने की आवृत्ति और निवारक परीक्षाओं की आवृत्ति डॉक्टर द्वारा व्यक्तिगत रूप से निर्धारित की जाती है।
सेमिनोमा लगभग 40% प्राथमिक वृषण जनन कोशिका ट्यूमर के लिए जिम्मेदार होता है। यह 20-40 वर्ष की आयु में अधिक बार होता है, और बच्चों में बहुत कम देखा जाता है। कभी-कभी सेमिनोमा अंडकोष (एक्स्ट्रागोनैडल सेमिनोमा) के बाहर स्थित हो सकता है, उदाहरण के लिए, पूर्वकाल मीडियास्टिनम या रेट्रोपेरिटोनियम में, जिसे भ्रूण के विकास के दौरान जर्मिनल एपिथेलियम की देरी से समझाया जाता है (ज्ञान का पूरा शरीर देखें: टेराटोमा)।
डब्ल्यूएचओ वर्गीकरण के अनुसार, विशिष्ट, एनाप्लास्टिक और स्पर्मेटोसाइटिक सेमिनोमा को प्रतिष्ठित किया जाता है
विशिष्ट सेमिनोमा मुख्यतः 20-40 वर्ष की आयु के पुरुषों में होता है। यह अक्सर अंडकोष में होता है जो अंडकोश में नहीं उतरा होता है। अंडकोष बड़ा हो जाता है, अक्सर सामान्य आकार से कम। ट्यूमर में एक, शायद ही कभी कई नोड्स होते हैं। इसके कट की सतह चमकदार, सफेद, लोबदार होती है। सूक्ष्मदर्शी रूप से, एक विशिष्ट सेमिनोमा में स्पष्ट सीमाओं के साथ बहुभुज या गोल आकार की एक ही प्रकार की बड़ी कोशिकाएं होती हैं, हल्के साइटोप्लाज्म में ग्लाइकोजन और कभी-कभी लिपिड होते हैं। ट्यूमर स्ट्रोमा को लिम्फोइड कोशिकाओं द्वारा घुसपैठ की गई संयोजी ऊतक परतों द्वारा दर्शाया जाता है, कभी-कभी एक ग्रैनुलोमेटस प्रतिक्रिया व्यक्त की जाती है (विशाल बहुकेंद्रीय कोशिकाओं के साथ तपेदिक-जैसे ग्रैनुलोमा)।
एनाप्लास्टिक सेमिनोमा को चिकित्सकीय रूप से अधिक घातक माना जाता है; यह कोशिकाओं और नाभिक के स्पष्ट बहुरूपता, बड़ी संख्या में माइटोज़, कम लिम्फोइड घुसपैठ के साथ एक खराब परिभाषित स्ट्रोमा और ग्रैनुलोमेटस प्रतिक्रिया की अनुपस्थिति की विशेषता है। एनाप्लास्टिक सेमिनोमा के क्षेत्र विशिष्ट सेमिनोमा और उनके मेटास्टेस में पाए जा सकते हैं।
स्पर्मेटोसाइटिक सेमिनोमा सभी सेमिनोमा का लगभग 9% होता है और मुख्य रूप से 50 वर्ष से अधिक उम्र के लोगों में होता है; महत्वपूर्ण आकार तक पहुंच सकता है। ट्यूमर का रंग पीला, दिखने में श्लेष्मा, थोड़ा स्पंजी, कभी-कभी सिस्ट, चीरे पर परिगलन के छोटे क्षेत्र और रक्तस्राव के साथ होता है। सूक्ष्मदर्शी रूप से, इसमें तीन प्रकार की कोशिकाएँ होती हैं: स्पष्ट सीमाओं के साथ लिम्फोसाइट-जैसी, एक गोल बेसोफिलिक नाभिक और ईोसिनोफिलिक साइटोप्लाज्म; विशाल - 1-3 नाभिक के साथ 100 माइक्रोमीटर व्यास तक; तथाकथित मध्यवर्ती - गोल नाभिक और प्रचुर साइटोप्लाज्म वाली मध्यम आकार की कोशिकाएँ। विशिष्ट सेमिनोमा के विपरीत, स्पर्मेटोसाइटिक सेमिनोमा कोशिकाओं में ग्लाइकोजन नहीं होता है, और ट्यूमर स्ट्रोमा में कोई लिम्फोइड घुसपैठ नहीं होती है।
सेमिनोमा का मेटास्टेसिस लिम्फोजेनस और हेमेटोजेनस मार्ग के माध्यम से होता है: इलियाक और पैराओर्टिक लिम्फेटिक्स, नोड्स, फेफड़े, यकृत और कम अक्सर अन्य अंगों तक। लगभग 65% मामलों में विशिष्ट और एनाप्लास्टिक सेमिनोमा के मेटास्टेसिस में सेमिनोमा की संरचना होती है, 26% में - भ्रूण कैंसर (ज्ञान का पूरा शरीर देखें) और 4% में - टेराटोमा (ज्ञान का पूरा शरीर देखें)। स्पर्मेटोसाइटिक सेमिनोमा शायद ही कभी मेटास्टेसिस करता है।
चिकित्सकीय रूप से, रोग की शुरुआत की तस्वीर अंडकोष के बढ़ने और सख्त होने की विशेषता है; यह कभी-कभी असुविधा और दर्द के साथ होता है। अंडकोष (ज्ञान का पूरा भाग देखें) बड़े आकार (व्यास में 20-30 सेंटीमीटर तक) तक पहुंच सकता है, जो अन्य ट्यूमर के साथ शायद ही कभी देखा जाता है। लगभग 10% मामलों में, पहली नैदानिक अभिव्यक्तियाँ रेट्रोपेरिटोनियल लिम्फ नोड्स, नोड्स और फेफड़ों में मेटास्टेस के कारण होती हैं। जब पैराओर्टिक लिम्फ नोड्स क्षतिग्रस्त हो जाते हैं, तो पेट और पीठ के निचले हिस्से में दर्द होता है, निचले वेना कावा के संपीड़न से जुड़े निचले छोरों की सूजन होती है; जब मूत्रवाहिनी संकुचित होती है, तो ओलिगुरिया के बाद औरिया होता है। गंभीर दर्द और आंतों में रुकावट का विकास संभव है (पूरी जानकारी देखें: आंतों में रुकावट)।
यूएसएसआर में अपनाए गए सेमिनोमा के वर्गीकरण के अनुसार, चार नैदानिक चरण प्रतिष्ठित हैं: - एक छोटा ट्यूमर जो ट्यूनिका अल्ब्यूजिना पर आक्रमण नहीं करता है और अंडकोष के आकार का उल्लंघन नहीं करता है; II - मेटास्टेसिस के बिना एक ट्यूमर, ट्यूनिका अल्ब्यूजिना से आगे तक फैला हुआ, अंडकोष के आकार को बाधित करता है; III - क्षेत्रीय लिम्फ नोड्स में मेटास्टेस के साथ बड़े ट्यूबरस ट्यूमर; IV - चरण I-II में प्राथमिक ट्यूमर, लेकिन क्षेत्रीय लिम्फ नोड्स, नोड्स और दूर के अंगों में मेटास्टेस के साथ।
अन्य वृषण ट्यूमर की तरह, सेमिनोमा का अनुमानित निदान, अंडकोष के क्रमिक विस्तार और सख्त होने के साक्ष्य के आधार पर किया जा सकता है। एक नियम के रूप में, इसे वृषण पंचर के बाद साइटोलॉजिकल परीक्षा द्वारा स्थापित किया जा सकता है, जिसके दौरान कुछ मामलों में ट्यूमर की प्रकृति निर्धारित की जा सकती है।
मूत्र में मानव कोरियोनिक गोनाडोट्रोपिन (ज्ञान का पूरा भाग देखें) और ए-भ्रूणप्रोटीन की सामग्री का निर्धारण करने का विभेदक निदान महत्व है। मानव कोरियोनिक गोनाडोट्रोपिन और ए-भ्रूणप्रोटीन का एक उच्च अनुमापांक कोरियोनिपिथेलियोमा (ज्ञान का पूरा शरीर देखें: ट्रोफोब्लास्टिक रोग) और भ्रूण कैंसर की विशेषता है। सेमिनोमा के रोगियों में, इसकी सामग्री के साथ-साथ ए-भ्रूणप्रोटीन के स्तर में वृद्धि शायद ही कभी देखी जाती है। फेफड़ों और क्षेत्रीय मेटास्टेसिस के क्षेत्रों की एक्स-रे परीक्षा द्वारा एक महत्वपूर्ण भूमिका निभाई जाती है, जिसमें इंटरनेशनल यूनियन अगेंस्ट कैंसर द्वारा प्रस्तावित वर्गीकरण के अनुसार, लिम्फ नोड्स, महाधमनी और अवर वेना कावा के साथ स्थित नोड्स, वंक्षण लिम्फ नोड्स शामिल हैं। , नोड्स (ऐसे मामलों में जहां अंडकोश या कमर के क्षेत्र में सर्जरी हुई हो), साथ ही इंट्रापेल्विक, मीडियास्टिनल और सुप्राक्लेविकुलर लिम्फ नोड्स। यदि सुप्राक्लेविक्युलर लिम्फ नोड्स बढ़े हुए हैं, तो उन्हें छिद्रित किया जाता है, इसके बाद साइटोलॉजिकल परीक्षण किया जाता है। रेट्रोपेरिटोनियल लिम्फ नोड्स की जांच अधिक कठिन है, जो आमतौर पर उत्सर्जन यूरोग्राफी से शुरू होती है (ज्ञान का पूरा हिस्सा देखें)। पेरिटोनियल लिम्फ नोड्स में बड़े मेटास्टेस के साथ, यूरोग्राम से मूत्रवाहिनी के विस्थापन का पता चलता है, कभी-कभी इसका संपीड़न होता है, जिससे मूत्र पथ का फैलाव होता है, कभी-कभी गुर्दे के कार्य को बंद करने की स्थिति तक भी। कैवोग्राफी (ज्ञान का संपूर्ण भाग देखें) का उपयोग करके बहुत अधिक जानकारी प्राप्त की जा सकती है, विशेष रूप से दाएं अंडकोष के सेमिनोमा के साथ: अवर वेना कावा के विस्थापन और संपीड़न का पता लगाया जाता है, इसके पूर्ण नाकाबंदी तक। पार्श्व प्रक्षेपण में की गई कैवोग्राफी लिम्फ नोड्स के पूर्वकाल या पीछे के समूह के मेटास्टेटिक घावों को अलग करना संभव बनाती है। इसके अलावा, कुछ मामलों में, मेटास्टेस का पता लगाया जाता है जो अवर वेना कावा की छाया पर परत के कारण प्रत्यक्ष प्रक्षेपण में पता लगाने योग्य नहीं होते हैं। छोटे मेटास्टेस के लिए, प्रत्यक्ष लिम्फोग्राफी रेट्रोपेरिटोनियल लिम्फ नोड्स, भारी नोड्स (ज्ञान का पूरा शरीर देखें) की स्थिति के बारे में बहुमूल्य जानकारी प्रदान करती है, लेकिन लिम्फ नोड मेटास्टेस द्वारा पूरी तरह से प्रतिस्थापित नोड्स का लिम्फोग्राम पर पता नहीं लगाया जाता है।
वर्तमान में, कंप्यूटेड टोमोग्राफी (ज्ञान का पूरा हिस्सा देखें: कंप्यूटेड टोमोग्राफी) रेट्रोपेरिटोनियल मेटास्टेसिस के निदान में महत्वपूर्ण होती जा रही है, जिससे बढ़े हुए लिम्फ नोड्स, मुख्य रक्त वाहिकाओं (महाधमनी, अवर वेना कावा, गुर्दे की वाहिकाएं) और पड़ोसी अंगों के साथ उनके संबंधों का पता चलता है। और ऊतक. यह विधि आपको एक साथ यकृत, गुर्दे, अधिवृक्क ग्रंथियों, अग्न्याशय की परत-दर-परत छवि प्राप्त करने की अनुमति देती है, जिसमें सेमिनोमा मेटास्टेसिस का अक्सर पता लगाया जा सकता है
उपचार जटिल है; वे ऑर्किडेक्टोमी से शुरू करते हैं। केवल ऑर्किएक्टोमी करना अस्वीकार्य है (ज्ञान का पूरा शरीर देखें: कैस्ट्रेशन), शुक्राणु कॉर्ड को हटाना आवश्यक है (ज्ञान का पूरा शरीर देखें)। आगे के उपचार की प्रकृति ट्यूमर के हिस्टोलॉजिकल परीक्षण के परिणाम प्राप्त करने के बाद निर्धारित की जाती है।
एक विशिष्ट सेमिनोमा के चरण I और II में, ऑर्किडेक्टोमी के बाद, क्षेत्रीय मेटास्टेसिस के क्षेत्रों में विकिरण चिकित्सा या निवारक कीमोथेरेपी के पाठ्यक्रम किए जाते हैं। लसीका और बहिर्वाह मार्गों के अलावा, शुक्राणु कॉर्ड का स्टंप विकिरण के अधीन है।
रोग के चरण III और IV में, संयुक्त उपचार (कीमोथेरेपी और विकिरण चिकित्सा) का सबसे अधिक उपयोग किया जाता है। एकल विशाल मेटास्टेस की उपस्थिति में विकिरण चिकित्सा को प्राथमिकता दी जाती है। कीमोथेरेपी मुख्य रूप से कई मेटास्टेस वाले रोगियों के लिए या ऐसे मामलों में निर्धारित की जाती है जहां त्वरित प्रभाव प्राप्त करना आवश्यक होता है, उदाहरण के लिए, रेट्रोपेरिटोनियल मेटास्टेस द्वारा मूत्रवाहिनी के संपीड़न के कारण होने वाले ओलिगुरिया और औरिया के साथ। ऐसे मामलों में, सार्कोलिसिन की तथाकथित लोडिंग खुराक (एक समय में 100-120 मिलीग्राम) देने की अनुमति है। एक नियम के रूप में, रेट्रोपेरिटोनियल लिम्फैडेनेक्टॉमी (ज्ञान का पूरा भाग देखें: चेवासस-ग्रेगोइरे ऑपरेशन) विशिष्ट सेमिनोमा के लिए नहीं किया जाता है, क्योंकि विकिरण चिकित्सा और एंटीट्यूमर दवाओं के साथ उपचार काफी प्रभावी होते हैं।
प्राथमिक ट्यूमर की विकिरण चिकित्सा इसकी निष्क्रियता या रोगी द्वारा सर्जरी कराने से इनकार करने की स्थिति में की जाती है।
व्यापक ट्यूमर प्रसार, कैचेक्सिया, गंभीर रक्ताल्पता और ल्यूकोपेनिया के कारण रोगी की गंभीर सामान्य स्थिति विकिरण चिकित्सा के लिए विरोधाभास है।
बड़ी मात्रा में ऊतक को विकिरणित करने की आवश्यकता आयनकारी विकिरण के मेगावोल्ट स्रोतों का उपयोग करके बाहरी बीम विकिरण चिकित्सा (ज्ञान का पूरा शरीर देखें) के उपयोग को निर्धारित करती है। रेडिकल विकिरण चिकित्सा के साथ, कुल फोकल खुराक 3000-4000 रेड (30-40 Gy) है; विकिरण 4-5 सप्ताह के लिए किया जाता है। उपशामक उद्देश्यों के लिए विकिरण चिकित्सा के साथ, कुल फोकल खुराक 2000-3000 रेड (20-30 Gy) है। विकिरण क्षेत्रों के क्षेत्र में त्वचा का हाइपरिमिया, ल्यूकोपेनिया, साथ ही पेट और आंतों की शिथिलता संभव है। गुर्दे के विकिरण के दौरान देर से विकिरण चोटों (ज्ञान का पूरा शरीर देखें) में क्रोनिक गैस्ट्रोएन्टेरोकोलाइटिस (ज्ञान का पूरा शरीर देखें) और विकिरण नेफ्रोस्क्लेरोसिस (ज्ञान का पूरा शरीर देखें) शामिल हैं।
सेमिनोमा के उपचार में सबसे प्रभावी एंटीट्यूमर एजेंट सार्कोलिसिन और साइक्लोफॉस्फेमाइड हैं। सरकोलिसिन को आमतौर पर 200-250 मिलीग्राम की कुल खुराक के लिए सप्ताह में एक बार 50 मिलीग्राम अंतःशिरा में निर्धारित किया जाता है; साइक्लोफॉस्फ़ामाइड को 6-8 साल की कुल खुराक तक हर दूसरे दिन 0.4 ग्राम अंतःशिरा में दिया जाता है। कीमोथेरेपी पाठ्यक्रम 2 साल के लिए हर 3-4 महीने में एक बार किया जाता है।
स्पर्मेटोसाइट और एनाप्लास्टिक सेमिनोमा सामान्य सेमिनोमा की तुलना में उपचार के प्रति कम प्रतिक्रियाशील होते हैं, और एनाप्लास्टिक सेमिनोमा विकिरण चिकित्सा और एंटीनोप्लास्टिक एजेंटों के प्रति प्रतिरोधी होते हैं। यदि ट्यूमर उपचार के लिए प्रतिरोधी है या यदि प्रभाव अधूरा है, तो किसी को अन्य घातक वृषण ट्यूमर के लिए उपयोग किए जाने वाले उपचार के नियमों और तरीकों पर स्विच करना चाहिए, उदाहरण के लिए, डिस्गर्मिनोमा (ज्ञान का पूरा शरीर देखें)। यह सेमिनोमा के तत्वों वाले एक से अधिक हिस्टोलॉजिकल प्रकार के वृषण ट्यूमर पर भी लागू होता है
पूर्वानुमान। डी. ई. जॉनसन और सह-लेखकों (1976) के अनुसार, विशिष्ट सेमिनोमा चरण 1.11 और III के लिए पांच साल की जीवित रहने की दर क्रमशः 93.7%, 90% और 57.9% है। पेरकार्पियो (बी. पेरकार्पियो) एट अल (1979) के अनुसार, एनाप्लास्टिक सेमिनोमा चरण I और II के साथ, 5- और 10 साल की जीवित रहने की दर क्रमशः 96 और 87% है। यह स्थापित किया गया है कि विकिरण चिकित्सा या कीमोथेरेपी के दौरान मानव कोरियोनिक गोनाडोट्रोपिन की सामग्री में कमी उपचार की प्रभावशीलता को इंगित करती है, और उपचार के दौरान और अनुवर्ती कार्रवाई के दौरान इसकी सामग्री में वृद्धि एक प्रतिकूल पूर्वानुमान संकेत है।
क्या आप इस दुनिया से हमेशा के लिए गायब हो जाने की संभावना से स्पष्ट रूप से नाखुश हैं? क्या आप अपने जीवन का अंत उस घृणित सड़ते जैविक द्रव्यमान के रूप में नहीं करना चाहते जिसे उसमें रेंगने वाले गंभीर कीड़ों ने निगल लिया है? क्या आप अपनी युवावस्था में लौटना चाहते हैं और दूसरा जीवन जीना चाहते हैं? फिर से सब जगह प्रारंभ करें? की गई गलतियों को सुधारें? अधूरे सपनों को साकार करें? इस लिंक पर जाओ:
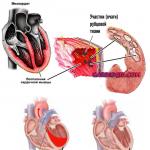
वृषण सेमिनोमा पुरुष जननांग अंगों (अंडकोष) के घातक ट्यूमर के प्रकारों में से एक है। यह भ्रूणीय कोशिकाओं से विकसित होता है जो वृषण ऊतक बनाती हैं और इसे वृषण कैंसर भी कहा जाता है।
टेस्टिकुलर सेमिनोमा एक प्रकार का टेस्टिकुलर कैंसर है।
 आत्मरक्षा के आधुनिक साधन उन वस्तुओं की एक प्रभावशाली सूची हैं जो उनके संचालन सिद्धांतों में भिन्न हैं। सबसे लोकप्रिय वे हैं जिन्हें खरीदने और उपयोग करने के लिए लाइसेंस या अनुमति की आवश्यकता नहीं होती है। में ऑनलाइन स्टोर Tesakov.com, आप बिना लाइसेंस के आत्मरक्षा उत्पाद खरीद सकते हैं।
आत्मरक्षा के आधुनिक साधन उन वस्तुओं की एक प्रभावशाली सूची हैं जो उनके संचालन सिद्धांतों में भिन्न हैं। सबसे लोकप्रिय वे हैं जिन्हें खरीदने और उपयोग करने के लिए लाइसेंस या अनुमति की आवश्यकता नहीं होती है। में ऑनलाइन स्टोर Tesakov.com, आप बिना लाइसेंस के आत्मरक्षा उत्पाद खरीद सकते हैं।
यह रोग दुर्लभ है। पुरुषों को प्रभावित करने वाले लगभग 2% घातक ट्यूमर वृषण कैंसर के होते हैं। हालाँकि, पिछले दशकों में यह चलन बढ़ रहा है, जो डॉक्टरों के बीच गंभीर चिंता का कारण बनता है।
अधिकतर 20-40 वर्ष की आयु के पुरुष प्रभावित होते हैं। 60 वर्ष से अधिक उम्र के मरीजों में सेमिनोमा से पीड़ित होने की संभावना कम होती है, लेकिन कभी-कभी यह बच्चों में भी होता है।
किसी भी घातक ट्यूमर की तरह, वृषण सेमिनोमा के विकास के कारण पूरी तरह से अज्ञात हैं। पूर्वगामी कारकों में, सबसे महत्वपूर्ण हैं आनुवंशिकता और (भ्रूण के विकास के दौरान अंडकोश में अंडकोष का न उतरना)। कई रोगियों में जननांग आघात और अंतःस्रावी विकृति का इतिहास था।
लक्षण और पाठ्यक्रम

सेमिनोमा में दर्द, सूजन और अंडकोष के आकार में वृद्धि होती है।
वृषण सेमिनोमा की नैदानिक अभिव्यक्तियाँ रोग की अवस्था पर निर्भर करती हैं।
प्रारंभिक अवधि में, मरीज़ स्वतंत्र रूप से अंडकोष के संकुचन और उस पर एक कठोर गठन की उपस्थिति का पता लगाते हैं। इसके बाद, अंडकोष में सूजन और आकार में वृद्धि दिखाई देती है।
जैसे-जैसे बीमारी बढ़ती है, पीठ में दर्द होने लगता है। यह मेटास्टेसिस के क्षेत्रीय लिम्फ नोड्स में फैलने के कारण होता है। वे नसों के संपीड़न के कारण विकसित हो सकते हैं। कमर में महत्वपूर्ण रूप से बढ़े हुए मेटास्टैटिक समूह कभी-कभी मूत्रवाहिनी को संकुचित कर सकते हैं, जिससे। दूर के मेटास्टेस आमतौर पर फेफड़ों को प्रभावित करते हैं। इसके साथ खांसी में खून आना और सांस लेने में तकलीफ होती है। यदि मेटास्टेसिस यकृत में फैल गया है, तो पीलिया, दाहिने हाइपोकॉन्ड्रिअम में दर्द और जलोदर (पेट की गुहा में तरल पदार्थ) विकसित हो जाता है। जब मेटास्टेस हड्डियों में स्थानीयकृत हो जाते हैं, तो उनमें तीव्र दर्द प्रकट होता है।
कैंसर के नशे के विशिष्ट लक्षण, किसी भी प्रकार के ऑन्कोलॉजी की विशेषता - सामान्य कमजोरी, वजन में कमी, अस्टेनिया, सुस्ती, वृषण सेमिनोमा के लिए भी विशिष्ट हैं, खासकर जब यह बढ़ता है।
रोग चरणों के आधार पर वृषण सेमिनोमा का वर्गीकरण
- स्टेज 1 - ट्यूमर स्थानीयकृत है, अंडकोष बड़ा नहीं है, कोई संघनन या सूजन नहीं है।
- स्टेज 2 - वृषण ऊतकों की क्षति ट्यूमर से जुड़ती है, जिसमें एडिमा का विकास, सख्त होना और अंडकोष के आकार में परिवर्तन होता है।
- चरण 3 - उपरोक्त परिवर्तन स्थानीय लिम्फ नोड्स को नुकसान के साथ होते हैं।
- चरण 4 - शरीर के दूर के अंगों और प्रणालियों को मेटास्टेसिस क्षति।
निदान

अंडकोष को टटोलने पर, सेमिनोमा को घने गठन के रूप में परिभाषित किया जाता है।
सेमिनोमा का निदान रोगी की शिकायतों की सही व्याख्या और डॉक्टर द्वारा जांच से शुरू होता है। टटोलने पर, वृषण ऊतक के साथ जुड़ा हुआ एक सघन गठन निर्धारित होता है।
आमतौर पर, सेमिनोमा का आकार 5-8 सेमी होता है, और अल्ट्रासाउंड का उपयोग करके ट्यूमर को अच्छी तरह से देखा जाता है। ट्यूमर के रूपात्मक घटक की पुष्टि करता है।
एक विशेष रक्त परीक्षण में, विशिष्ट ट्यूमर मार्कर पाए जाते हैं - अल्फा-भ्रूणप्रोटीन और बीटा-कोरियोनिक गोनाडोट्रोपिन, आदि। यह बहुत छोटे ट्यूमर के लिए महत्वपूर्ण है, जब ट्यूमर लगभग अदृश्य होता है।
यह समझने के लिए कि क्या कैंसर क्षेत्रीय लिम्फ नोड्स और आगे महत्वपूर्ण अंगों तक फैल गया है, कई अतिरिक्त अध्ययन करना आवश्यक है। सबसे अधिक जानकारीपूर्ण गणना टोमोग्राफी है, जो मेटास्टेस से प्रभावित कमर, पेरिटोनियम और मीडियास्टिनम के लिम्फ नोड्स को दिखाती है। पेट और वक्ष गुहा की सादे रेडियोग्राफी द्वारा भी निदान किया जा सकता है। उत्तरार्द्ध फेफड़ों में मेटास्टेस को देखने में मदद करता है।
सबसे संवेदनशील निदान पद्धति पॉज़िट्रॉन एमिशन टोमोग्राफी है, जो रोग की अवस्था को सटीक रूप से निर्धारित करती है।
इलाज
वृषण सेमिनोमा के उपचार में, ऑन्कोलॉजिकल रोगों के उपचार में उपयोग किए जाने वाले बुनियादी सिद्धांतों का पालन किया जाता है।
ट्यूमर को हटाने के लिए पहला कदम सर्जरी है। अक्सर, शुक्राणु कॉर्ड के साथ-साथ पूरे अंडकोष को भी काट दिया जाता है। यदि क्षेत्रीय और रेट्रोपरिटोनियल लिम्फ नोड्स प्रभावित होते हैं, तो उन्हें भी एक्साइज किया जाता है। इसके बाद, ट्यूमर कोशिकाओं के विकास को अंततः दबाने के लिए विकिरण और कीमोथेरेपी की जाती है। पोस्टऑपरेटिव थेरेपी का चुनाव प्रक्रिया की सीमा और अंगों और प्रणालियों को हुए नुकसान की गहराई पर निर्भर करता है।

रोग के प्रारंभिक चरण में, वंक्षण और रेट्रोपेरिटोनियल क्षेत्र में विकिरण चिकित्सा पूरी तरह से सीमित हो सकती है। कैंसर के व्यापक विकास के मामले में और उपचार की अप्रभावीता (मेटास्टेसिस के आगे विकास का खतरा) के मामले में, कीमोथेरेपी के कई पाठ्यक्रमों का उपयोग किया जाता है।
कभी-कभी ट्यूमर दूसरे अंडकोष तक फैल जाता है। इस मामले में, सर्जन उपयोग करते हैं। नतीजतन, रोगी में टेस्टोस्टेरोन के स्तर में कमी हो जाती है, जो अंडकोष में उत्पन्न होता है, जिसके लिए निरंतर आवश्यकता होती है।
वृषण सेमिनोमा, जैसा कि पहले ही उल्लेख किया गया है, अक्सर उन युवा रोगियों में होता है जिनके अभी तक अपने बच्चे नहीं हुए हैं। इसके अलावा, सेमिनोमा बचपन में भी हो सकता है। ऐसे मामलों में, यदि बीमारी का प्रारंभिक चरण में पता चल जाता है और ट्यूमर स्पष्ट रूप से स्थानीयकृत है, तो एक अंग-संरक्षण ऑपरेशन किया जाता है, यानी, अंडकोष को संरक्षित करते हुए ट्यूमर को बाहर निकाला जाता है। इस मामले में, पुनरावृत्ति की संभावना के लिए रोगी की निगरानी करते समय अधिक सतर्कता आवश्यक है।
यह ध्यान दिया जाना चाहिए कि अंडकोष निकलवाने से डरने की कोई जरूरत नहीं है। शेष अंडकोष, एक नियम के रूप में, का कार्य करता है। अधिकांश रोगियों का सर्जरी के बाद सामान्य यौन जीवन होता है और उनके शुक्राणु उपजाऊ बने रहते हैं।
रोकथाम

क्रिप्टोर्चिडिज़्म का समय पर उपचार कैंसर के विकास की रोकथाम है।
प्राथमिक वृषण सेमिनोमा की रोकथाम के बारे में बोलते हुए, आपको क्रिप्टोर्चिडिज़्म के समय पर उपचार पर ध्यान देना चाहिए। जिन मरीजों ने अंडकोष को अंडकोश में उतारने के लिए सर्जरी करवाई है, उन्हें जीवन भर करीबी निगरानी की आवश्यकता होती है, क्योंकि, आंकड़ों के अनुसार, सबसे अधिक बार उनमें ही ट्यूमर विकसित होता है। आपको जननांग अंगों की चोटों से भी बचना चाहिए और जननांग क्षेत्र की सूजन संबंधी बीमारियों का समय पर इलाज करना चाहिए।
जिन मरीजों की सेमिनोमा को हटाने के लिए सर्जरी हुई है, उन्हें निरंतर निगरानी की आवश्यकता होती है। डिस्चार्ज के बाद पहले वर्ष में, हर 2 महीने में एक बार सामान्य जांच की आवश्यकता होती है, जिसमें ट्यूमर मार्करों के लिए रक्त परीक्षण भी शामिल है। दूसरे वर्ष में, रोगियों को हर तीन महीने में कम से कम एक बार देखा जाता है। अगले वर्ष - तिमाही में एक बार। भविष्य में, रोगी की स्थिति के आधार पर, परीक्षा हर छह महीने में एक बार या उससे कम बार की जाती है।
पूर्वानुमान
प्रथम चरण।शीघ्र निदान और समय पर व्यापक उपचार के साथ, पूर्वानुमान काफी अनुकूल है। सर्जरी के बाद बीमारी के पहले चरण वाले मरीज़, एक नियम के रूप में, पूरी तरह से ठीक हो जाते हैं (95% तक) और बच्चे पैदा करने सहित पूर्ण जीवन जीते हैं।
चरण 2।बीमारी के दूसरे चरण में, आम तौर पर अनुकूल परिणाम के बावजूद, पुनरावृत्ति का खतरा अधिक रहता है (15-20% रोगियों को अगले पांच वर्षों में फिर से बीमार होने का खतरा होता है)। ऐसे रोगियों को इस अवधि के दौरान कड़ी निगरानी की आवश्यकता होती है।
चरण 3-4.तीसरे और चौथे चरण के लिए पूर्वानुमान ट्यूमर के आकार, मेटास्टेसिस की व्यापकता और महत्वपूर्ण अंगों और शरीर प्रणालियों को नुकसान की डिग्री पर निर्भर करता है।
इस प्रकार, रोगी के ठीक होने की कुंजी रोग का जल्द से जल्द निदान और समय पर सही उपचार है।
एक टिप्पणी जोड़ने