Ester butanske kiseline. Esteri - nomenklatura, priprema, hemijska svojstva. Masti. Sapun. Primena estera
Nomenklatura
Nazivi estera izvedeni su iz naziva ugljikovodični radikal a i naziva kiseline, u kojem se umjesto završetka "-oic acid" koristi sufiks "at" (kao u nazivima anorganskih soli: natrijev karbonat, krom nitrat), na primjer:

(Fragmenti molekula i odgovarajući fragmenti imena istaknuti su istom bojom.)
Esteri se obično smatraju produktima reakcije između kiseline i alkohola; na primjer, butil propionat se može smatrati rezultatom reakcije između propionske kiseline i butanola.
Ako se koristi trivijalni naziv početne kiseline, tada je riječ "ester" uključena u naziv spoja, na primjer, C 3 H 7 COOC 5 H 11 - amil ester maslačne kiseline.
Homologna serija

Izomerizam
Estere karakteriziraju tri tipa izomerizma:
1. Izomerija ugljičnog lanca, počinje od ostatka kiseline sa butanskom kiselinom, kod ostatka alkohola - sa propil alkoholom, na primjer:
2. Izomerizam položaja estarske grupe -CO-O-. Ova vrsta izomerizma počinje sa esterima čije molekule sadrže najmanje 4 atoma ugljika, na primjer:
3. Međuklasni izomerizam, estri (alkil alkanoati) su izomerni prema zasićenim monokarboksilnim kiselinama; Na primjer:
Za estre koji sadrže nezasićenu kiselinu ili nezasićeni alkohol moguća su još dva tipa izomerizma: izomerija položaja višestruke veze; cis-trans izomerizam.
Fizička svojstva
Esteri nižih homologa kiselina i alkohola su bezbojne tečnosti sa niskim ključanjem prijatnog mirisa; koristi se kao aromatični aditivi za prehrambene proizvode i u parfimeriji. Esteri se ne rastvaraju dobro u vodi.
Metode dobijanja
1. Ekstrahovan iz prirodnih proizvoda
2. Interakcija kiselina sa alkoholima (reakcije esterifikacije); Na primjer:

Hemijska svojstva
1. Najtipičnije reakcije za estere su kisela ili alkalna hidroliza (saponifikacija). To su reakcije koje su obrnute od reakcija esterifikacije. Na primjer:

2. Redukcija (hidrogenacija) kompleksnih etera, usled čega nastaju alkoholi (jedan ili dva); Na primjer:

Esteri– funkcionalni derivati karboksilnih kiselina,
u molekulama u kojima je hidroksilna grupa (-OH) zamijenjena ostatkom alkohola (-OR)
Esteri karboksilnih kiselina – jedinjenja sa opštom formulom
R-COOR",gdje su R i R" ugljikovodični radikali.
Esteri zasićenih jednobaznih karboksilnih kiselina imaju opštu formulu:
Fizička svojstva:
Isparljive, bezbojne tečnosti
· Slabo rastvorljivo u vodi
· Najčešće prijatnog mirisa
Lakši od vode
Esteri se nalaze u cvijeću, voću i bobicama. Oni određuju njihov specifičan miris.
Sastojci su eteričnih ulja (poznato je oko 3000 e.m. - narandže, lavande, ruže itd.)
Esteri nižih karboksilnih kiselina i nižih monohidratnih alkohola imaju prijatan miris cveća, bobica i voća. Esteri viših jednobaznih kiselina i viših monohidričnih alkohola osnova su prirodnih voskova. Na primjer, pčelinji vosak sadrži estar palmitinske kiseline i miricil alkohola (miricil palmitat):
CH 3 (CH 2) 14 –CO–O–(CH 2) 29 CH 3
|
Aroma. Strukturna formula. |
Ime Ester |
|
Apple
|
Etil eter 2-metilbutanska kiselina |
|
Trešnja
|
Ester amil mravlje kiseline |
|
Kruška
|
Izoamil ester sirćetne kiseline |
|
Ananas |
Etil ester butirne kiseline (etil butirat) |
|
Banana
|
Izobutil ester sirćetne kiseline (g izoamil acetat također podsjeća na miris banane) |
|
Jasmine
|
benzil eter acetat (benzil acetat) |
Kratki nazivi estera zasnivaju se na nazivu radikala (R") u ostatku alkohola i nazivu RCOO grupe u kiselinskom ostatku. Na primjer, etil octena kiselina CH 3 COO C 2 H 5 pozvao etil acetat.
Aplikacija
· Kao pojačivači mirisa i mirisa u prehrambenoj i parfimerijskoj (proizvodnja sapuna, parfema, krema) industriji;
· U proizvodnji plastike i gume kao plastifikatora.
Plastifikatori - tvari koje se unose u sastav polimernih materijala kako bi dale (ili povećale) elastičnost i (ili) plastičnost tijekom obrade i rada.
Primjena u medicini
Krajem 19. i početkom 20. stoljeća, kada je organska sinteza napravila svoje prve korake, mnogi esteri su sintetizirani i testirani od strane farmakologa. Oni su postali osnova za takve lijekove kao što su salol, validol itd. Metil salicilat se široko koristio kao lokalni iritans i analgetik, koji je sada praktično zamijenjen učinkovitijim lijekovima.
Priprema estera
Esteri se mogu dobiti reakcijom karboksilnih kiselina sa alkoholima ( reakcija esterifikacije). Katalizatori su mineralne kiseline.
Video “Priprema etil acetil etera”
Video “Priprema boronetil etera”
Reakcija esterifikacije pod kiselom katalizom je reverzibilna. Obrnuti proces - cijepanje estera pod djelovanjem vode da nastane karboksilna kiselina i alkohol - naziva se hidroliza estera.
RCOOR" + H2O (H+)↔ RCOOH + R"OH
Hidroliza u prisustvu alkalija je ireverzibilna (pošto nastali negativno nabijeni karboksilat anion RCOO ne reaguje sa nukleofilnim reagensom - alkoholom).
Ova reakcija se zove saponifikacija estera(po analogiji sa alkalnom hidrolizom esterskih veza u mastima pri proizvodnji sapuna).
Najvažniji predstavnici estera su masti.
Masti, ulja
Masti- to su estri glicerola i viši jednoatomni . Opšti naziv takvih spojeva je trigliceridi ili triacilgliceroli, gdje je acil ostatak karboksilne kiseline -C(O)R. Sastav prirodnih triglicerida uključuje ostatke zasićenih kiselina (palmitinska C 15 H 31 COOH, stearinska C 17 H 35 COOH) i nezasićenih (oleinska C 17 H 33 COOH, linolna C 17 H 31 COOH). Više karboksilne kiseline koje su dio masti uvijek imaju paran broj atoma ugljika (C 8 - C 18) i nerazgranati ugljikovodični ostatak. Prirodne masti i ulja su mješavine glicerida viših karboksilnih kiselina.
Sastav i struktura masti može se odraziti općom formulom:

Esterifikacija- reakcija stvaranja estera.

Sastav masti može uključivati ostatke i zasićenih i nezasićenih karboksilnih kiselina u različitim kombinacijama.
U normalnim uslovima, masti koje sadrže ostatke nezasićenih kiselina su najčešće tečne. Oni se nazivaju ulja. U osnovi, to su masti biljnog porijekla - laneno, konopljino, suncokretovo i druga ulja (sa izuzetkom palminog i kokosovog ulja - čvrsta u normalnim uvjetima). Manje uobičajene su tečne masti životinjskog porekla, poput ribljeg ulja. Većina prirodnih masti životinjskog porijekla u normalnim uvjetima su čvrste (nisko topljive) tvari i sadrže uglavnom ostatke zasićenih karboksilnih kiselina, na primjer, jagnjeće masti.
Sastav masti određuje njihova fizička i hemijska svojstva.
Fizička svojstva masti
Masti su nerastvorljive u vodi, nemaju jasnu tačku topljenja i značajno povećavaju zapreminu kada se otape.
Agregatno stanje masti je čvrsto, to je zbog činjenice da masti sadrže ostatke zasićenih kiselina i molekule masti su sposobne za gusto pakovanje. Sastav ulja uključuje ostatke nezasićenih kiselina u cis konfiguraciji, stoga je gusto pakovanje molekula nemoguće, a agregacijsko stanje je tekuće.
Hemijska svojstva masti
Masti (ulja) su estri i karakteriziraju ih esterske reakcije.
Jasno je da su za masti koje sadrže ostatke nezasićenih karboksilnih kiselina karakteristične sve reakcije nezasićenih spojeva. Oni obezbojavaju bromsku vodu i ulaze u druge reakcije adicije. Najvažnija reakcija u praktičnom smislu je hidrogenacija masti. Čvrsti estri se dobijaju hidrogenacijom tečnih masti. Upravo ta reakcija je u osnovi proizvodnje margarina - čvrste masti iz biljnih ulja. Uobičajeno, ovaj proces se može opisati jednadžbom reakcije:

Sve masti, kao i drugi estri, prolaze kroz hidrolizu:

Hidroliza estera je reverzibilna reakcija. Kako bi se osiguralo stvaranje produkata hidrolize, ona se provodi u alkalnoj sredini (u prisustvu alkalija ili Na 2 CO 3). U tim uslovima hidroliza masti se odvija reverzibilno i dovodi do stvaranja soli karboksilnih kiselina, koje se tzv. masti u alkalnoj sredini se nazivaju saponifikacija masti.
Kada se masti saponificiraju, formiraju se glicerin i sapuni - natrijeve i kalijeve soli viših karboksilnih kiselina:
Saponifikacija– alkalna hidroliza masti, proizvodnja sapuna.

Sapun– mješavine natrijum (kalijum) soli viših zasićenih karboksilnih kiselina (natrijum sapun - čvrst, kalijum sapun - tečni).
Sapuni su tenzidi (skraćeno surfaktanti, deterdženti). Detergentni učinak sapuna je zbog činjenice da sapun emulgira masti. Sapuni formiraju micele sa zagađivačima (relativno, to su masti sa različitim inkluzijama).
Lipofilni dio molekule sapuna otapa se u kontaminantu, a hidrofilni dio završava na površini micele. Micele su nabijene na isti način, pa se odbijaju, a zagađivač i voda se pretvaraju u emulziju (praktično, to je prljava voda).

Sapun se također nalazi u vodi, što stvara alkalno okruženje.
Sapuni se ne mogu koristiti u tvrdoj ili morskoj vodi, jer su nastali kalcijum (magnezijum) stearati nerastvorljivi u vodi.

Estri sadrže funkcionalnu grupu:
gdje su R i R" isti ili različiti radikali.
Estri se također mogu smatrati derivatima kiselina u kojima je atom vodika u karboksilnoj grupi zamijenjen ugljikovodičnim radikalom (R"):
Fizička svojstva
Esteri nižih karboksilnih kiselina i alkohola su hlapljive tekućine nerastvorljive u vodi. Mnogi od njih imaju ugodan miris. Na primjer, butil butirat miriše na ananas, izoamil acetat miriše na krušku, itd.
Esteri viših masnih kiselina i alkohola su voštane supstance, bez mirisa i nerastvorljive u vodi. Ugodna aroma cvijeća i bobičastog voća je u velikoj mjeri posljedica prisustva određenih estera u njima.
Masti su široko rasprostranjene u prirodi. Uz ugljovodonike i proteine, oni su dio svih biljnih i životinjskih organizama i jedan su od glavnih dijelova naše hrane.
Prema stanju agregacije na sobnoj temperaturi masti se dijele na tekuće i čvrste. Čvrste masti, po pravilu, formiraju zasićene kiseline, dok tečne masti (koje se često nazivaju i ulja) formiraju nezasićene kiseline. Masti su rastvorljive u organskim rastvaračima i nerastvorljive u vodi.
Osnovne metode za dobijanje estera:
Esterifikacija - interakcija karboksilnih kiselina i alkohola, na primjer, proizvodnja etil acetata iz octene kiseline i etil alkohola:
CH 3 COOH + C 2 H 5 OH = CH 3 COOC 2 H 5 + H 2 O
Hemijska svojstva
1. Hidroliza ili reakcija saponifikacije.
Kao što je gore spomenuto, reakcija esterifikacije je reverzibilna, stoga će se u prisutnosti kiselina dogoditi reverzna reakcija koja se naziva hidroliza, što rezultira stvaranjem izvornih masnih kiselina i alkohola:
Reakciju hidrolize također kataliziraju alkalije; u ovom slučaju, hidroliza je nepovratna:
budući da rezultirajuća karboksilna kiselina formira sol s alkalijom:
CH 3 – COOH + NaOH → CH 3 – COONa + H 2 O
2. Reakcija sabiranja.
Esteri koji sadrže nezasićenu kiselinu ili alkohol su sposobni za reakcije adicije. Na primjer, tokom katalitičke hidrogenacije dodaju vodonik.
3. Reakcija oporavka.
Redukcija estera vodonikom dovodi do stvaranja dva alkohola:
4. Reakcija stvaranja amida.
Pod uticajem amonijaka, estri se pretvaraju u amide kiselina i alkohole:
CH 3 -CO-O C 2 H 5 + NH 3 → CH 3 -CO-NH 2 + C 2 H 5 OH.
56) Masti- to su mješavine estera formiranih od trihidričnog alkohola glicerola i viših masnih kiselina. Opća formula masti, gdje su R radikali viših masnih kiselina:
U sastavu masti najčešće su zasićene kiseline: palmitinska kiselina C 15 H 31 COOH i stearinska kiselina C 17 H 35 COOH, te nezasićene kiseline: oleinska kiselina C 17 H 33 COOH i linolna kiselina C 17 H 31 COOH.
Opšti naziv za spojeve karboksilnih kiselina sa glicerolom je trigliceridi.
Hidroliza masti u tehnologiji (saponifikacija masti). Masti su od velike tehničke važnosti: služe kao neophodni materijali za proizvodnju sapuna i glicerina. Sapuni su soli viših masnih kiselina, čije otopine imaju učinak čišćenja. Najrasprostranjeniji su natrijevi sapuni, koji se koriste u tehnici i svakodnevnom životu kao deterdženti. Suština izrade sapuna je saponifikacija masti sa rastvorom natrijum hidroksida kada se zagreje. U ovom slučaju, masti se razgrađuju na glicerin i sapun.
Hidroliza, ili saponifikacija, masti nastaje pod uticajem vode (reverzibilno) ili lužine (ireverzibilno):
Dakle: sapuni su soli viših karboksilnih kiselina. Konvencionalni sapuni se prvenstveno sastoje od mješavine soli palmitinske, stearinske i oleinske kiseline. Natrijumove soli formiraju čvrste sapune, kalijeve soli formiraju tečne sapune.
Da bi se odvojila nastala mješavina glicerina i sapuna, dodaje se vodena otopina natrijevog klorida, u kojoj se, kao u elektrolitu s istim natrijevim jonom, sapun vrlo slabo otapa. Kao rezultat toga, dolazi do delaminacije: na vrhu je sloj otopine sapuna, a ispod je otopina glicerina i natrijevog klorida. Otopina sapuna se sipa u kalupe gdje se stvrdne. Vodeni rastvor glicerola se ispari, odvoji od natrijum hlorida i prečisti destilacijom.
Za izradu sapuna koriste se razne masti: mast, puter itd. Trenutno se za proizvodnju sapuna koriste neprehrambene sirovine. Kiseline potrebne za to proizvode se u industrijskom obimu oksidacijom ugljikovodika koji čine parafin.
Hemijska svojstva
1. Hidroliza u kiseloj sredini
Primena masti
Masti se koriste za ishranu. Neka ulja se koriste za pravljenje kozmetike (kreme, maske, masti).
Brojne masti imaju lekovitu vrednost: ricinusovo ulje, ulje morske krkavine, riblje ulje, guščja mast.
Ulja iz ribe haringe i ulje tuljana koriste se za ishranu domaćih životinja.
Za proizvodnju ulja za sušenje koriste se sušeća biljna ulja.
Sirovine za proizvodnju margarina su mnoga biljna ulja i kitovo ulje.
Životinjske masti se koriste za proizvodnju sapuna i stearinskih svijeća.
Masti se koriste za proizvodnju glicerina i maziva.
klasa spojeva na bazi mineralnih (anorganskih) ili organskih karboksilnih kiselina, u kojima je atom vodika u HO grupi zamijenjen organskom grupom R . Pridjev "složeni" u nazivu estera pomaže da se razlikuju od spojeva zvanih eteri.Ako je početna kiselina polibazna, tada se formiraju ili puni esteri, sve HO grupe su supstituirane, ili je moguća djelomična supstitucija kiselih estera. Za jednobazne kiseline mogući su samo puni estri (slika 1).
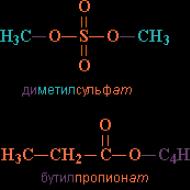
Rice. 1. PRIMJERI ESTRA na bazi anorganske i karboksilne kiseline
Nomenklatura estera. Ime se kreira na sljedeći način: prvo je naznačena grupa R , vezan uz kiselinu, zatim naziv kiseline sa sufiksom "at" (kao u nazivima anorganskih soli: ugljik at natrijum, nitrat at hrom). Primjeri na sl.2
Ako koristite trivijalno ( cm. TRIVIJALNI NAZIVI SUPSTANCI) je naziv početne kiseline, zatim naziv spoja uključuje riječ “ester”, na primjer, C 3 H 7 COOC 5 H 11 amil estar butirne kiseline.
Klasifikacija i sastav estera. Među proučavanim i široko korištenim esterima, većina su spojevi dobiveni iz karboksilnih kiselina. Esteri na bazi mineralnih (anorganskih) kiselina nisu toliko raznoliki, jer klasa mineralnih kiselina je manje brojna od karboksilnih kiselina (raznolikost jedinjenja je jedna od karakterističnih osobina organska hemija).Kada broj C atoma u izvornoj karboksilnoj kiselini i alkoholu ne prelazi 68, odgovarajući estri su bezbojne uljne tekućine, najčešće voćnog mirisa. Oni čine grupu voćnih estera. Ako je aromatični alkohol (koji sadrži aromatično jezgro) uključen u stvaranje estera, tada takvi spojevi u pravilu imaju cvjetni, a ne voćni miris. Sva jedinjenja iz ove grupe su praktično nerastvorljiva u vodi, ali su lako rastvorljiva u većini organskih rastvarača. Ovi spojevi su zanimljivi zbog svog širokog spektra ugodnih aroma (tablica 1), neki od njih su prvo izolirani iz biljaka, a kasnije umjetno sintetizirani.
| Table 1. NEKI ESTRI, voćne ili cvjetne arome (fragmenti originalnih alkohola u formuli spoja i u nazivu su istaknuti podebljanim slovima) | ||
| Ester Formula | Ime | Aroma |
| CH 3 COO C 4 H 9 | Butyl acetat | kruška |
| C 3 H 7 COO CH 3 | Metil Ester butirne kiseline | jabuka |
| C 3 H 7 COO C 2 H 5 | Etil Ester butirne kiseline | ananas |
| C 4 H 9 COO C 2 H 5 | Etil | grimizno |
| C 4 H 9 COO C 5 H 11 | Isoamil ester izovalerinske kiseline | banana |
| CH 3 COO CH 2 C 6 H 5 | Benzyl acetat | jasmin |
| C 6 H 5 COO CH 2 C 6 H 5 | Benzyl benzoat | cvjetni |
Treća grupa su masti. Za razliku od prethodne dvije grupe na bazi monohidričnih alkohola
ROH , sve masti su estri glicerol alkohola HOCH 2 CH(OH)CH 2 OH. Karboksilne kiseline koje čine masti u pravilu imaju ugljikovodični lanac sa 919 atoma ugljika. Životinjske masti (kravi puter, jagnjeća, svinjska mast) plastične, topljive materije. Biljne masti (masline, seme pamuka, suncokretovo ulje) viskozne tečnosti. Životinjske masti se uglavnom sastoje od mješavine glicerida stearinske i palmitinske kiseline (slika 3A, B). Biljna ulja sadrže gliceride kiselina sa nešto kraćom dužinom ugljičnog lanca: laurinska C 11 H 23 COOH i miristična C 13 H 27 COOH. (kao stearinska i palmitinska ovo su zasićene kiseline). Takva ulja mogu se dugo čuvati na zraku bez promjene konzistencije, pa se stoga nazivaju nesušećim. Nasuprot tome, laneno ulje sadrži nezasićeni glicerid linolne kiseline (slika 3B). Kada se nanese u tankom sloju na površinu, takvo ulje se suši pod utjecajem atmosferskog kisika tokom polimerizacije duž dvostrukih veza, te se formira elastični film koji je netopiv u vodi i organskim otapalima. Prirodno ulje za sušenje proizvodi se od lanenog ulja.
Rice. 3. GLICERIDI STEARINSKE I PALMITIČNE KISELINE (A I B) komponente životinjske masti. Glicerid linolne kiseline (B) komponenta lanenog ulja.
Estri mineralnih kiselina (alkil sulfati, alkil borati koji sadrže fragmente nižih alkohola C 18) uljne tečnosti, estri viših alkohola (počev od C 9) čvrsta jedinjenja.
Hemijska svojstva estera. Najkarakterističnije za estere karboksilnih kiselina je hidrolitičko (pod uticajem vode) cepanje estarske veze; u neutralnom okruženju se odvija sporo i primetno ubrzava u prisustvu kiselina ili baza, jer H+ i HO joni kataliziraju ovaj proces (slika 4A), pri čemu hidroksilni joni djeluju efikasnije. Hidroliza u prisustvu alkalija naziva se saponifikacija. Ako uzmete količinu alkalije dovoljnu da neutrališe svu formiranu kiselinu, tada dolazi do potpunog saponifikacije estera. Ovaj proces se provodi u industrijskom obimu, a glicerin i više karboksilne kiseline (C 1519) se dobijaju u obliku soli alkalnih metala, koje su sapun (slika 4B). Fragmenti nezasićenih kiselina sadržanih u biljnim uljima, kao i bilo koja nezasićena jedinjenja, mogu se hidrogenisati, vodik se vezuje za dvostruke veze i formiraju se jedinjenja slična životinjskim mastima (slika 4B). Ovom metodom, čvrste masti se industrijski proizvode na bazi suncokretovog, sojinog ili kukuruznog ulja. Margarin se proizvodi od proizvoda hidrogenacije biljnih ulja pomiješanih s prirodnim životinjskim mastima i raznim prehrambenim aditivima.Glavna metoda sinteze je interakcija karboksilne kiseline i alkohola, katalizirana kiselinom i praćena oslobađanjem vode. Ova reakcija je suprotna onoj prikazanoj na sl. 3A. Da bi se proces odvijao u željenom smjeru (sinteza estera), iz reakcione smjese se destilira (destilira) voda. Posebnim istraživanjima korišćenjem obeleženih atoma bilo je moguće utvrditi da se tokom procesa sinteze O atom, koji je deo nastale vode, odvaja od kiseline (označeno crvenim tačkastim okvirom), a ne od alkohola ( nerealizirana opcija je istaknuta plavim tačkastim okvirom).
Koristeći istu shemu, dobijaju se estri neorganskih kiselina, na primjer, nitroglicerin (slika 5B). Umjesto kiselina mogu se koristiti kiseli hloridi, metoda je primjenjiva i za karboksilne (slika 5C) i za neorganske kiseline (slika 5D).
Interakcija soli karboksilne kiseline sa alkil halogenidima
RCl takođe dovodi do estera (slika 5D), reakcija je pogodna po tome što je ireverzibilna; oslobođena anorganska so se odmah uklanja iz organskog reakcionog medija u obliku taloga.Upotreba estera. Etil format HCOOC 2 H 5 i etil acetat H 3 COOC 2 H 5 koriste se kao rastvarači za celulozne lakove (na bazi nitroceluloze i celuloznog acetata).Esteri na bazi nižih alkohola i kiselina (Tabela 1) koriste se u prehrambenoj industriji za stvaranje voćnih esencija, a esteri na bazi aromatičnih alkohola u industriji parfema.
Od voskova se izrađuju sredstva za poliranje, maziva, impregnirajuće kompozicije za papir (voštani papir) i kožu, a takođe se nalaze u kozmetičkim kremama i lekovitim mastima.
Masti, zajedno s ugljikohidratima i proteinima, čine skup namirnica neophodnih za ishranu, dio su svih biljnih i životinjskih stanica, osim toga, kada se akumuliraju u tijelu, igraju ulogu energetske rezerve. Zbog niske toplotne provodljivosti, sloj masti dobro štiti životinje (posebno morske kitove ili morževe) od hipotermije.
Životinjske i biljne masti su sirovine za proizvodnju viših karboksilnih kiselina, deterdženata i glicerola (Sl. 4), koje se koriste u kozmetičkoj industriji i kao komponenta raznih maziva.
Nitroglicerin (slika 4) je dobro poznata droga i eksploziv, osnova dinamita.
Ulja za sušenje proizvode se od biljnih ulja (slika 3), koja čine osnovu uljanih boja.
Esteri sumporne kiseline (slika 2) koriste se u organskoj sintezi kao alkilirajući (uvođenje alkil grupe u jedinjenje) reagensi, a estri fosforne kiseline (slika 5) se koriste kao insekticidi, kao i aditivi za ulja za podmazivanje.
Mikhail Levitsky
LITERATURA Kartsova A.A. Osvajanje materije. Organska hemija. Izdavačka kuća Khimizdat, 1999Pustovalova L.M. Organska hemija. Feniks, 2003