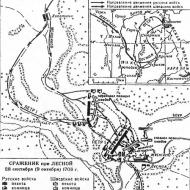
Kimyasal devrim. Fransız burjuva devrimi ve bilim. A. L. Lavoisier. Oksijen yanma teorisi. Lavoisier'in Temel Kimya Kursu. Lavoisier'den "Kimyada Devrim" "Element" Kavramını Yeniden Düşünmek
Antik çağın kimyası.
Maddelerin bileşimini ve dönüşümlerini inceleyen bilim olan kimya, insanın ateşin doğal malzemeleri değiştirme yeteneğini keşfetmesiyle başlar. Görünüşe göre insanlar bakır ve bronzun nasıl eritileceğini, kil ürünlerini nasıl yakacaklarını ve cam yapmayı MÖ 4000 gibi erken bir tarihte biliyorlardı. 7. yüzyıla gelindiğinde. M.Ö. Mısır ve Mezopotamya boya üretiminin merkezleri haline geldi; Orada saf haliyle altın, gümüş ve diğer metaller de elde edildi. MÖ 1500'den 350'ye kadar. Boya üretmek için damıtma kullanıldı ve cevherlerden metaller, kömürle karıştırılarak ve yanan karışıma hava üflenerek eritildi. Doğal malzemeleri dönüştürme prosedürlerine mistik bir anlam verildi.
Yunan doğa felsefesi.
Bu mitolojik fikirler, tüm fenomen ve eşya çeşitliliğini tek bir elementte, yani suda toplayan Miletoslu Thales aracılığıyla Yunanistan'a nüfuz etti. Ancak Yunan filozofları, madde elde etme yöntemleri ve bunların pratik kullanımıyla değil, esas olarak dünyada meydana gelen süreçlerin özüyle ilgileniyorlardı. Böylece, antik Yunan filozofu Anaximenes, Evrenin temel ilkesinin hava olduğunu savundu: Hava, seyreldiğinde ateşe dönüşür ve yoğunlaştıkça suya, sonra toprağa ve en sonunda taşa dönüşür. Efesli Herakleitos, ateşi birincil unsur olarak varsayarak doğa olaylarını açıklamaya çalıştı.
Dört temel unsur.
Bu fikirler, evrenin dört ilkesi teorisinin yaratıcısı Agrigentumlu Empedokles'in doğa felsefesinde birleştirildi. Çeşitli versiyonlarda teorisi iki bin yıldan fazla bir süre insanların zihnine hakim oldu. Empedokles'e göre tüm maddi nesneler, kozmik sevgi (çekim) ve nefret (itme) güçlerinin etkisi altında ebedi ve değişmeyen unsurların (su, hava, toprak ve ateş) birleşimiyle oluşur. Empedokles'in elementler teorisi ilk olarak iyinin ve kötünün maddi olmayan güçlerinin bu elementleri birbirine dönüştürebileceğini belirten Platon, daha sonra da Aristoteles tarafından kabul edilmiş ve geliştirilmiştir.
Aristoteles'e göre elementel unsurlar maddi maddeler değil, belirli niteliklerin taşıyıcılarıdır - ısı, soğuk, kuruluk ve nem. Bu görüş Galenos'un dört "meyve suyu" fikrine dönüşerek 17. yüzyıla kadar bilime egemen oldu. Yunan doğa filozoflarını meşgul eden bir diğer önemli soru da maddenin bölünebilirliği sorunuydu. Daha sonra atomistik adını alan kavramın kurucuları Leukippos, öğrencisi Demokritos ve Epikuros'tur. Öğretilerine göre, yalnızca boşluk ve atomlar vardır - bölünmez maddi unsurlar, ebedi, yok edilemez, aşılmaz, şekil, boşluk ve boyut bakımından farklı konumlar; onların “girdabından” tüm bedenler oluşur. Atom teorisi Demokritos'tan sonra iki bin yıl boyunca popülerliğini korudu ancak tamamen ortadan kaybolmadı. Taraftarlarından biri, şiirinde Demokritos ve Epikuros'un görüşlerini özetleyen antik Yunan şairi Titus Lucretius Carus'du. Şeylerin doğası hakkında (De Rerum Natura).
Simya.
Simya, metalleri altına dönüştürerek maddeyi iyileştirme ve yaşam iksirini yaratarak insanı iyileştirme sanatıdır. Onlar için en çekici hedefe - hesaplanamaz zenginlik yaratmak - ulaşmaya çalışan simyacılar birçok pratik sorunu çözdüler, birçok yeni süreç keşfettiler, çeşitli reaksiyonları gözlemlediler ve yeni bir bilim olan kimyanın oluşumuna katkıda bulundular.
Helenistik dönem.
Mısır simyanın beşiğiydi. Mısırlılar uygulamalı kimyada mükemmeldiler; ancak bu, bağımsız bir bilgi alanı olarak izole edilmemiş, rahiplerin "kutsal gizli sanatının" bir parçasıydı. Simya, 2. ve 3. yüzyılların başında ayrı bir bilgi alanı olarak ortaya çıktı. reklam Büyük İskender'in ölümünden sonra imparatorluğu çöktü, ancak Yunanlıların etkisi Yakın ve Orta Doğu'nun geniş topraklarına yayıldı. Simya MS 100-300 yıllarında özellikle hızlı bir çiçeklenmeye ulaştı. İskenderiye'de.
MS 300 civarında. Mısırlı Zosima bir ansiklopedi yazdı - önceki 5-6 yüzyıl boyunca simyaya ilişkin tüm bilgileri, özellikle de maddelerin karşılıklı dönüşümleri (dönüşümleri) hakkındaki bilgileri kapsayan 28 kitap.
Arap dünyasında simya.
7. yüzyılda Mısır'ı fetheden Araplar, İskenderiye ekolü tarafından yüzyıllarca korunan Greko-Doğu kültürünü benimsediler. Eski hükümdarları taklit eden halifeler, 7.-9. yüzyıllarda bilimleri himaye etmeye başladılar. ilk kimyagerler ortaya çıktı.
En yetenekli ve ünlü Arap simyacısı, daha sonra Avrupa'da Geber adıyla tanınan Jabir ibn Hayyan'dı (8. yüzyılın sonları). Jabir, kükürt ve cıvanın, diğer yedi metalin oluştuğu iki zıt prensip olduğuna inanıyordu; Altın, oluşturulması en zor olanıdır: Bunun için Yunanlıların xerion - "kuru" dediği ve Arapların al-iksir olarak değiştirdiği özel bir maddeye ihtiyacınız vardır ("iksir" kelimesi bu şekilde ortaya çıktı). İksirin başka harika özelliklere de sahip olması gerekiyordu: tüm hastalıkları iyileştirmek ve ölümsüzlük vermek. Başka bir Arap simyacı olan al-Razi (c. 865–925) (Avrupa'da Rhazes olarak bilinir) da tıpla uğraştı. Böylece alçı hazırlama yöntemini ve kırık bölgesine bandaj uygulama yöntemini anlattı. Ancak en ünlü doktor İbn Sina olarak da bilinen Buharlı İbn Sina'dır. Yazıları yüzyıllar boyunca doktorlara yol gösterici olmuştur.
Batı Avrupa'da simya.
Arapların bilimsel görüşleri 12. yüzyılda Orta Çağ Avrupa'sına nüfuz etti. Kuzey Afrika, Sicilya ve İspanya üzerinden. Arap simyacıların eserleri Latince'ye, ardından diğer Avrupa dillerine çevrildi. İlk başta Avrupa'da simya, Cabir gibi aydınların çalışmalarına dayanıyordu, ancak üç yüzyıl sonra Aristoteles'in öğretilerine, özellikle de daha sonra piskopos ve profesör olan Alman filozof ve Dominikli ilahiyatçının eserlerine yeniden ilgi duyuldu. Paris Üniversitesi'nde Albertus Magnus ve öğrencisi Thomas Aquinas. Yunan ve Arap biliminin Hıristiyan doktrini ile uyumluluğuna inanan Albertus Magnus, bunların skolastik eğitim kurslarına girişini teşvik etti. 1250'de Aristoteles'in felsefesi Paris Üniversitesi'nde öğretime tanıtıldı. Daha sonraki birçok keşfi öngören İngiliz filozof ve doğa bilimci Fransisken keşiş Roger Bacon da simya sorunlarıyla ilgileniyordu; güherçile ve diğer birçok maddenin özelliklerini inceledi ve kara barut yapmanın bir yöntemini buldu. Diğer Avrupalı simyacılar arasında Arnaldo da Villanova (1235–1313), Raymond Lull (1235–1313) ve Basil Valentinus (15.–16. yüzyıl Alman keşiş) bulunmaktadır.
Simyanın başarıları.
Zanaat ve ticaretin gelişimi, 12.-13. yüzyıllarda Batı Avrupa'da şehirlerin yükselişi. bilimin gelişmesi ve sanayinin ortaya çıkışı eşlik etti. Metal işleme gibi teknolojik işlemlerde simyacı tarifleri kullanıldı. Bu yıllarda yeni maddelerin elde edilmesi ve tanımlanmasına yönelik sistematik bir arayış başladı. Alkol üretmeye ve damıtma sürecini iyileştirmeye yönelik tarifler ortaya çıkıyor. En önemli başarı, güçlü asitlerin (sülfürik ve nitrik) keşfiydi. Artık Avrupalı kimyagerler birçok yeni reaksiyon gerçekleştirebildiler ve nitrik asit tuzları, vitriol, şap, sülfürik ve hidroklorik asit tuzları gibi maddeler elde edebildiler. Çoğu zaman yetenekli doktorlar olan simyacıların hizmetleri en yüksek soylular tarafından kullanılıyordu. Ayrıca simyacıların sıradan metalleri altına dönüştürme sırrına sahip olduklarına inanılıyordu.

14. yüzyılın sonunda. Simyacıların bazı maddeleri diğerlerine dönüştürmeye olan ilgisi yerini bakır, pirinç, sirke, zeytinyağı ve çeşitli ilaçların üretimine olan ilgiye bıraktı. 15. – 16. yüzyıllarda. Simyacıların deneyimi madencilik ve tıpta giderek daha fazla kullanıldı.
MODERN KİMYANIN BAŞLANGICI
Orta Çağ'ın sonu, okültlerden kademeli bir geri çekilme, simyaya olan ilginin azalması ve doğanın yapısına mekanik bir bakış açısının yayılmasıyla işaretlendi.
Iatrokimya.
Paracelsus (1493–1541) simyanın amaçları konusunda tamamen farklı görüşlere sahipti. Kendi seçtiği bu isimle (“Celsus'tan üstün”) İsviçreli hekim Philip von Hohenheim tarihe geçti. İbn Sina gibi Paracelsus da simyanın asıl görevinin altın elde etmenin yollarını aramak değil, ilaç üretimi olduğuna inanıyordu. Simya geleneğinden, uçuculuk, yanıcılık ve sertlik özelliklerine karşılık gelen maddenin üç ana bölümünün (cıva, kükürt, tuz) olduğu doktrinini ödünç aldı. Bu üç unsur makrokozmosun (Evren) temelini oluşturur ve ruh, ruh ve bedenin oluşturduğu mikrokozmosla (insan) ilişkilidir. Hastalıkların nedenlerini belirlemeye devam eden Paracelsus, ateş ve vebanın vücutta aşırı kükürt nedeniyle meydana geldiğini, aşırı cıva felcinin meydana geldiğini vb. Tüm iatrokimyacıların bağlı olduğu prensip, tıbbın bir kimya meselesi olduğu ve her şeyin, doktorun saf prensipleri saf olmayan maddelerden ayırma yeteneğine bağlı olduğuydu. Bu şema dahilinde tüm vücut fonksiyonları kimyasal işlemlere indirgenmişti ve simyacının görevi kimyasal maddeleri tıbbi amaçlar için bulmak ve hazırlamaktı.
İyatrokimyasal yönün ana temsilcileri, mesleği doktor olan Jan Helmont (1577-1644); Bir doktor olarak büyük üne sahip olan ve iyatrokimya öğretisinden "ruhsal" ilkeleri çıkaran Francis Sylvius (1614-1672); Andreas Liebavius (c. 1550–1616), Rothenburg'lu doktor. Araştırmaları kimyanın bağımsız bir bilim olarak oluşmasına büyük katkı sağladı.
Mekanik felsefe.
İatrokimyanın etkisinin azalmasıyla birlikte doğa filozofları yeniden eskilerin doğa hakkındaki öğretilerine yöneldiler. 17. yüzyılda öne çıktı. atomistik (parçacık) görüşler ortaya çıktı. Parçacık teorisinin yazarları olan en önde gelen bilim adamlarından biri filozof ve matematikçi Rene Descartes'tı.Görüşlerini 1637'de yazdığı makalede özetledi. Yöntem hakkında muhakeme. Descartes, tüm cisimlerin "çeşitli şekil ve boyutlarda çok sayıda küçük parçacıktan oluştuğuna ... bunların etraflarında hiçbir boşluk kalmayacak şekilde birbirine tam olarak uymadığına" inanıyordu; bu boşluklar boş değil, fakat... seyrekleşmiş maddeyle dolu." Descartes "küçük parçacıklarının" atom olduğunu düşünmüyordu. bölünmez; maddenin sonsuz bölünebilirliği görüşünü savundu ve boşluğun varlığını reddetti. Descartes'ın en önemli rakiplerinden biri Fransız fizikçi ve filozof Pierre Gassendi'ydi. Gassendi'nin atomizmi esasen Epikuros'un öğretilerinin yeniden anlatımıydı; ancak ikincisinden farklı olarak Gassendi, atomların Tanrı tarafından yaratıldığını kabul etti; Tanrı'nın, tüm cisimleri oluşturan belirli sayıda bölünmez ve nüfuz edilemez atom yarattığına inanıyordu; Atomlar arasında mutlak boşluk olmalıdır. 17. yüzyılda kimyanın gelişiminde. İrlandalı bilim adamı Robert Boyle'un özel bir rolü var. Boyle, evrenin unsurlarının spekülatif olarak belirlenebileceğine inanan eski filozofların açıklamalarını kabul etmedi; bu, kitabının başlığına da yansıyor Şüpheci kimyager. Kimyasal elementlerin belirlenmesine yönelik deneysel yaklaşımın destekçisi olarak (nihayetinde benimsendi), gerçek elementlerin varlığını bilmiyordu, ancak neredeyse bunlardan birini - fosforu - kendisi keşfetti. Boyle genellikle "analiz" terimini kimyaya kazandıran kişi olarak kabul edilir. Nitel analiz üzerine yaptığı deneylerde çeşitli göstergeler kullanmış ve kimyasal afinite kavramını ortaya atmıştır. Boyle, Galileo Galilei Evangelista Torricelli'nin yanı sıra 1654 yılında "Magdeburg yarımkürelerini" gösteren Otto Guericke'nin çalışmalarına dayanarak tasarladığı hava pompasını anlattı ve U şeklinde bir tüp kullanarak havanın elastikiyetini belirlemek için deneyler yaptı. Bu deneylerin sonucunda, hava hacmi ile basınç arasındaki iyi bilinen ters orantı kanunu formüle edildi. 1668'de Boyle, yeni düzenlenen Londra Kraliyet Cemiyeti'nin aktif bir üyesi oldu ve 1680'de başkanı seçildi.
Teknik kimya.
Bilimsel ilerlemeler ve keşifler, unsurları 15. ve 17. yüzyıllarda bulunabilen teknik kimyayı etkilemekten başka bir şey yapamazdı. 15. yüzyılın ortalarında. üfleyici dövme teknolojisi geliştirildi. Askeri sanayinin ihtiyaçları barut üretim teknolojisini geliştirmeye yönelik çalışmaları teşvik etti. 16. yüzyılda. Altın üretimi iki katına, gümüş üretimi ise dokuz katına çıktı. İnşaatta kullanılan metal ve çeşitli malzemelerin üretimi, cam yapımı, kumaş boyama, gıda muhafazası, deri tabaklama konularında temel eserler yayınlanıyor. Alkollü içecek tüketiminin yaygınlaşmasıyla birlikte damıtma yöntemleri geliştirilmekte ve yeni damıtma aparatları tasarlanmaktadır. Başta metalurji olmak üzere çok sayıda üretim laboratuvarı ortaya çıktı. O zamanın kimya teknolojistleri arasında klasik eseri olan Vannoccio Biringuccio'yu (1480-1539) sayabiliriz. HAKKINDA piroteknik 1540 yılında Venedik'te basıldı ve madenler, minerallerin test edilmesi, metallerin hazırlanması, damıtma, savaş sanatı ve havai fişeklerle ilgili 10 kitap içeriyordu. Bir başka ünlü eser Madencilik ve metalurji hakkında, Georg Agricola (1494–1555) tarafından yazılmıştır. Glauber tuzunu yaratan Hollandalı kimyager Johann Glauber'den (1604-1670) de bahsetmek gerekir.
ONSEKİZİNCİ YÜZYIL
Bilimsel bir disiplin olarak kimya.
1670'den 1800'e kadar kimya, doğa felsefesi ve tıpla birlikte önde gelen üniversitelerin müfredatında resmi statü kazandı. 1675'te Nicolas Lemery'nin (1645–1715) ders kitabı çıktı. Kimya kursu Büyük bir popülerlik kazanan eserin Fransızca 13 baskısı yayımlandı, ayrıca Latince ve birçok Avrupa diline çevrildi. 18. yüzyılda Avrupa'da bilimsel kimya toplulukları ve çok sayıda bilimsel enstitü oluşturuluyor; Yaptıkları araştırmalar toplumun sosyal ve ekonomik ihtiyaçları ile yakından ilgilidir. Alet imalatı ve sanayi için madde üretimi ile uğraşan kimyagerler ortaya çıktı.
Flojiston teorisi.
17. yüzyılın ikinci yarısının kimyagerlerinin eserlerinde. Yanma sürecinin yorumlanmasına çok dikkat edildi. Eski Yunanlılara göre yanabilen her şey, uygun koşullar altında açığa çıkan ateş elementini içerir. 1669'da Alman kimyager Johann Joachim Becher yanıcılığın akılcı bir açıklamasını yapmaya çalıştı. Katıların üç tür “toprak”tan oluştuğunu ve bu türlerden “yağlı toprak” olarak adlandırdığı birinin “yanabilirlik ilkesi” olarak kabul edildiğini öne sürdü.
Becher'in takipçisi Alman kimyager ve doktor Georg Ernst Stahl, "yağlı toprak" kavramını genelleştirilmiş flojiston doktrini - "yanmanın başlangıcı" - haline dönüştürdü. Stahl'a göre filojiston, tüm yanıcı maddelerde bulunan ve yanma sırasında açığa çıkan belirli bir maddedir. Stahl, metallerin paslanmasının ahşabın yanmasına benzer olduğunu savundu. Metaller flojiston içerir, ancak pas (pul) artık flojiston içermez. Bu aynı zamanda cevherleri metallere dönüştürme süreci için de kabul edilebilir bir açıklama sağladı: flojiston içeriği önemsiz olan cevher, flojiston açısından zengin kömür üzerinde ısıtılır ve ikincisi cevhere dönüşür. Kömür küle, cevher ise flojiston açısından zengin metale dönüşür. 1780'e gelindiğinde, flojiston teorisi hemen hemen her yerde kimyagerler tarafından kabul edildi, ancak çok önemli bir soruyu cevaplamıyordu: Flojiston ondan buharlaşmasına rağmen neden demir paslandığında ağırlaşıyor? 18. yüzyılın kimyagerleri. bu çelişki o kadar da önemli görünmüyordu; Onlara göre asıl mesele, maddelerin görünümündeki değişikliğin nedenlerini açıklamaktı.
18. yüzyılda Bilimsel faaliyetleri, bilimin gelişiminin aşamalarını ve yönlerini dikkate alan olağan şemalara uymayan birçok kimyager vardı ve bunların arasında Rus ansiklopedist bilim adamı, şair ve aydınlanma savunucusu Mikhail Vasilyevich Lomonosov'un (1711-1711) özel bir yeri var. 1765). Lomonosov, keşifleriyle neredeyse tüm bilgi alanlarını zenginleştirdi ve fikirlerinin çoğu, o zamanın biliminin yüz yıldan fazla ilerisindeydi. 1756'da Lomonosov, kapalı bir kapta metallerin yakılması üzerine ünlü deneyler gerçekleştirdi; bu deneyler, kimyasal reaksiyonlar sırasında maddenin korunmasına ve yanma süreçlerinde havanın rolüne dair tartışılmaz kanıtlar sağladı: Lavoisier'den önce bile, metalleri yakarken gözlenen ağırlık artışını açıkladı. bunları havayla birleştirerek. Kalori konusunda hakim olan fikirlerin aksine, termal olayların maddi parçacıkların mekanik hareketinden kaynaklandığını savundu. Gazların esnekliğini parçacıkların hareketiyle açıkladı. Lomonosov, yalnızca 19. yüzyılın ortalarında genel olarak tanınan “parçacık” (molekül) ve “element” (atom) kavramlarını birbirinden ayırdı. Lomonosov, maddenin ve hareketin korunması ilkesini formüle etti, flojistonu kimyasal maddeler listesinden çıkardı, fiziksel kimyanın temellerini attı ve 1748'de St. Petersburg Bilimler Akademisi'nde yalnızca bilimsel çalışmaların değil, bir kimya laboratuvarı kurdu. gerçekleştirilmesinin yanı sıra öğrencilere yönelik uygulamalı dersler de verilmektedir. Kimya - fizik, jeoloji vb. ile ilgili bilgi alanlarında kapsamlı araştırmalar yaptı.
Pnömatik kimya.
Flojiston teorisinin eksiklikleri, sözde gelişimi sırasında en açık şekilde ortaya çıktı. pnömatik kimya. Bu eğilimin en büyük temsilcisi R. Boyle'du: Artık kendi adını taşıyan gaz yasasını keşfetmekle kalmadı, aynı zamanda hava toplamaya yönelik cihazlar da tasarladı. Kimyagerler artık çeşitli "havaları" izole etmek, tanımlamak ve incelemek için hayati bir araca sahip. Önemli bir adım, 18. yüzyılın başlarında İngiliz kimyager Stephen Hales'in (1677-1761) "pnömatik banyo"yu icat etmesiydi. - Bir madde su dolu bir kapta ısıtılıp baş aşağı bir su banyosuna indirildiğinde açığa çıkan gazları yakalamak için bir cihaz. Daha sonra Hales ve Henry Cavendish, özellikleri bakımından sıradan havadan farklı olan belirli gazların (“hava”) varlığını tespit ettiler. 1766'da Cavendish, asitlerin belirli metallerle reaksiyonundan oluşan, daha sonra hidrojen olarak adlandırılan gazı sistematik olarak inceledi. Gazların incelenmesine büyük katkı İskoç kimyager Joseph Black tarafından yapıldı ve asitler alkalilerle reaksiyona girdiğinde açığa çıkan gazları incelemeye başladı. Black, mineral kalsiyum karbonatın ısıtıldığında ayrışarak gaz çıkardığını ve kireç (kalsiyum oksit) oluşturduğunu keşfetti. Açığa çıkan gaz (karbon dioksit - Black buna "bağlı hava" diyordu) kalsiyum karbonat oluşturmak üzere kireçle yeniden birleştirilebilir. Bu keşif, diğer şeylerin yanı sıra, katı ve gaz halindeki maddeler arasındaki bağların ayrılmazlığını ortaya koydu.
Kimyasal devrim.
Kimya tutkunu Protestan rahip Joseph Priestley, gazları izole etme ve özelliklerini inceleme konusunda büyük başarı elde etti. Hizmet verdiği Leeds (İngiltere) yakınında, deneyler için büyük miktarlarda "bağlı hava" (artık bunun karbondioksit olduğunu biliyoruz) elde edilebilecek bir bira fabrikası vardı. Priestley, gazların suda çözünebileceğini keşfetti ve onları su üzerinde değil, cıva üzerinde toplamaya çalıştı. Böylece nitrik oksit, amonyak, hidrojen klorür, kükürt dioksit (tabii ki bunlar modern isimleri) toplayıp inceleyebildi. 1774'te Priestley en önemli keşfini yaptı: İçinde maddelerin özellikle parlak bir şekilde yandığı bir gazı izole etti. Flojiston teorisinin bir savunucusu olarak bu gazı "flojistondan arındırılmış hava" olarak adlandırdı. Priestley tarafından keşfedilen gaz, 1772'de İngiliz kimyager Daniel Rutherford (1749-1819) tarafından izole edilen "flojistikleştirilmiş havanın" (nitrojen) antitezi gibi görünüyordu. "Flojistikleştirilmiş havada" fareler öldü, ancak "flojistikten arınmış" havada çok aktiftiler. (Priestley tarafından izole edilen gazın özelliklerinin İsveçli kimyager Karl Wilhelm Scheele tarafından 1771'de tanımlandığı, ancak yayıncının ihmali nedeniyle mesajının ancak 1777'de basıldığı unutulmamalıdır.) Büyük Fransız kimyager Antoine Laurent Lavoisier, Priestley'in keşfinin önemini hemen takdir etti. 1775 yılında havanın basit bir madde olmadığını, iki gazın karışımı olduğunu, bunlardan birinin Priestley'in yanan veya paslanan nesnelerle birleşerek cevherlerden odun kömürüne ve yaşam için gereklidir. Lavoisier onu aradı oksijen, oksijen, yani. "asit üreten" Elementel elementler teorisine ikinci darbe, suyun da basit bir madde olmadığı, iki gazın (oksijen ve hidrojen) birleşiminin bir ürünü olduğu anlaşıldıktan sonra geldi. Tüm bu keşifler ve teoriler, gizemli "unsurları" ortadan kaldırarak kimyanın rasyonelleşmesine yol açtı. Sadece tartılabilen veya başka bir şekilde miktarı ölçülebilen maddeler ön plana çıkmıştır. 18. yüzyılın 80'li yıllarında. Lavoisier, diğer Fransız kimyagerler Antoine François de Fourcroy (1755–1809), Guiton de Morveau (1737–1816) ve Claude Louis Berthollet ile işbirliği içinde mantıksal bir kimyasal isimlendirme sistemi geliştirdi; özelliklerini belirten 30'dan fazla basit maddeyi tanımladı. Bu iş Kimyasal isimlendirme yöntemi 1787'de yayımlandı.
18. yüzyılın sonunda kimyagerlerin teorik görüşlerinde bir devrim meydana geldi. Flojiston teorisinin (bu teoriden bağımsız da olsa) egemenliği altında deneysel malzemenin hızla birikmesi sonucu ortaya çıkan buna genellikle “kimyasal devrim” adı verilmektedir.
ON DOKUZUNCU YÜZYIL
Maddelerin bileşimi ve sınıflandırılması.
Lavoisier'in başarıları, niceliksel yöntemlerin kullanımının, maddelerin kimyasal bileşiminin belirlenmesinde ve bunların birliktelik yasalarının aydınlatılmasında yardımcı olabileceğini gösterdi.
Atomik teori.
Fiziksel kimyanın doğuşu.
19. yüzyılın sonunda. Çeşitli maddelerin fiziksel özelliklerinin (kaynama ve erime noktaları, çözünürlük, moleküler ağırlık) sistematik olarak incelendiği ilk çalışmalar ortaya çıktı. Bu tür araştırmalar, tuzların çözünürlüğünün sıcaklığa ve basınca bağlı olduğunu gösteren Gay-Lussac ve Van't Hoff tarafından başlatıldı. 1867'de Norveçli kimyagerler Peter Waage (1833–1900) ve Kato Maximilian Guldberg (1836–1902), reaksiyon hızının reaktanların konsantrasyonlarına bağlı olduğunu belirten kütle etki yasasını formüle ettiler. Kullandıkları matematiksel aparat, herhangi bir kimyasal reaksiyonu karakterize eden çok önemli bir miktarın (hız sabiti) bulunmasını mümkün kıldı.
Kimyasal termodinamik.
Bu arada kimyagerler fiziksel kimyanın temel sorusuna, ısının kimyasal reaksiyonlar üzerindeki etkisine yöneldiler. 19. yüzyılın ortalarında. fizikçiler William Thomson (Lord Kelvin), Ludwig Boltzmann ve James Maxwell ısının doğası hakkında yeni görüşler geliştirdiler. Lavoisier'in kalori teorisini reddederek ısıyı hareketin sonucu olarak temsil ettiler. Fikirleri Rudolf Clausius tarafından geliştirildi. Moleküllerin sürekli hareketi ve çarpışmaları fikrine dayanarak hacim, basınç, sıcaklık, viskozite ve reaksiyon hızları gibi niceliklerin dikkate alınabileceği bir kinetik teori geliştirdi. Clasius, Thomson (1850) ile eşzamanlı olarak termodinamiğin ikinci yasasının ilk formülasyonunu verdi ve entropi (1865), ideal gaz ve moleküllerin ortalama serbest yolu kavramlarını tanıttı.
Kimyasal reaksiyonlara termodinamik yaklaşım, Clausius'un fikirlerine dayanarak çözeltideki tuzların ayrışmasını açıklamaya çalışan August Friedrich Gorstmann'ın (1842–1929) çalışmalarında kullanıldı. 1874-1878'de Amerikalı kimyager Josiah Willard Gibbs, kimyasal reaksiyonların termodinamiği üzerine sistematik bir çalışma başlattı. Kütle hareketi yasasının özünü açıklayarak serbest enerji ve kimyasal potansiyel kavramını tanıttı ve farklı sıcaklık, basınç ve konsantrasyonlarda (faz kuralı) farklı fazlar arasındaki dengenin incelenmesinde termodinamik ilkeleri uyguladı. Gibbs'in çalışması modern kimyasal termodinamiğin temelini attı. İsveçli kimyager Svante August Arrhenius, birçok elektrokimyasal olayı açıklayan iyonik ayrışma teorisini yarattı ve aktivasyon enerjisi kavramını ortaya attı. Ayrıca çözünen maddelerin moleküler ağırlığını ölçmek için elektrokimyasal bir yöntem geliştirdi.
Fiziksel kimyanın bağımsız bir bilgi alanı olarak tanınmasını sağlayan önemli bilim adamlarından biri, Gibbs'in kavramlarını kataliz çalışmalarında uygulayan Alman kimyager Wilhelm Ostwald'dı. 1886'da fiziksel kimya üzerine ilk ders kitabını yazdı ve 1887'de (Van't Hoff ile birlikte) Fiziksel Kimya (Zeitschrift fürphysikalische Chemie) dergisini kurdu.
YİRMİNCİ YÜZYIL
Yeni yapısal teori.
Atom ve moleküllerin yapısına ilişkin fiziksel teorilerin gelişmesiyle birlikte kimyasal ilgi ve dönüşüm gibi eski kavramlar yeniden düşünüldü. Maddenin yapısına ilişkin yeni fikirler ortaya çıktı.
Atom modeli.
1896'da Antoine Henri Becquerel (1852–1908), uranyum tuzlarından atom altı parçacıkların kendiliğinden emisyonunu keşfederek radyoaktivite olgusunu keşfetti ve iki yıl sonra Pierre Curie ve Marie Sklodowska-Curie eşleri iki radyoaktif elementi izole etti: polonyum ve radyum . Sonraki yıllarda radyoaktif maddelerin üç tür radyasyon yaydığı keşfedildi: A-partiküller, B-partiküller ve G-ışınlar. Radyoaktif bozunma sırasında bazı maddelerin diğerlerine dönüştüğünü gösteren Frederick Soddy'nin keşfiyle birlikte tüm bunlar eskilerin dönüşüm dediği şeye yeni bir anlam kazandırdı.
1897 yılında Joseph John Thomson, 1909 yılında Robert Millikan tarafından yükü yüksek doğrulukla ölçülen elektronu keşfetti. 1911'de Ernst Rutherford, Thomson'un elektron kavramına dayanarak bir atom modeli önerdi: Atomun merkezinde pozitif yüklü bir çekirdek var ve negatif yüklü elektronlar onun etrafında dönüyor. 1913'te Niels Bohr, kuantum mekaniği ilkelerini kullanarak elektronların herhangi bir yörüngeye değil, kesin olarak tanımlanmış yörüngelere yerleştirilebileceğini gösterdi. Rutherford-Bohr atomunun gezegensel kuantum modeli, bilim adamlarını kimyasal bileşiklerin yapısını ve özelliklerini açıklamada yeni bir yaklaşım benimsemeye zorladı. Alman fizikçi Walter Kossel (1888–1956), bir atomun kimyasal özelliklerinin dış kabuğundaki elektron sayısı tarafından belirlendiğini ve kimyasal bağların oluşumunun esas olarak elektrostatik etkileşim kuvvetleri tarafından belirlendiğini öne sürdü. Amerikalı bilim adamları Gilbert Newton Lewis ve Irving Langmuir, kimyasal bağların elektronik teorisini formüle ettiler. Bu fikirlere uygun olarak, inorganik tuz molekülleri, elektronların bir elementten diğerine (iyonik bağ) aktarılması sırasında oluşan kurucu iyonları ile elektronların paylaşılmasından dolayı organik bileşik molekülleri arasındaki elektrostatik etkileşimler ile stabilize edilir. (kovalent bağ). Bu fikirler modern kimyasal bağ kavramlarının temelini oluşturur.
Yeni araştırma yöntemleri.
Maddenin yapısına ilişkin tüm yeni fikirler ancak 20. yüzyıldaki gelişmeler sonucunda oluşabilmiştir. deneysel teknikler ve yeni araştırma yöntemlerinin ortaya çıkışı. X-ışınlarının 1895 yılında Wilhelm Conrad Roentgen tarafından keşfedilmesi, daha sonra X-ışını kristalografisi yönteminin oluşturulmasına temel oluşturdu; bu, X-ışınlarının kristaller üzerindeki kırınım modelinden moleküllerin yapısını belirlemeyi mümkün kıldı. Bu yöntemi kullanarak karmaşık organik bileşiklerin yapısı deşifre edildi - insülin, deoksiribonükleik asit (DNA), hemoglobin vb. Atom teorisinin yaratılmasıyla birlikte, atomların ve moleküllerin yapısı hakkında bilgi sağlayan yeni güçlü spektroskopik yöntemler ortaya çıktı. Çeşitli biyolojik süreçlerin yanı sıra kimyasal reaksiyonların mekanizması da radyoizotop izleyiciler kullanılarak incelenir; Radyasyon yöntemleri tıpta da yaygın olarak kullanılmaktadır.
Biyokimya.
Biyolojik maddelerin kimyasal özelliklerini inceleyen bu bilimsel disiplin, ilk olarak organik kimyanın dallarından biriydi. 19. yüzyılın son on yılında bağımsız bir bölge haline geldi. Bitki ve hayvan kökenli maddelerin kimyasal özellikleri üzerine yapılan çalışmalar sonucunda. İlk biyokimyacılardan biri Alman bilim adamı Emil Fischer'dı. Kafein, fenobarbital, glikoz ve birçok hidrokarbon gibi maddeleri sentezledi ve ilk kez 1878'de izole edilen enzimler - protein katalizörleri bilimine büyük katkılarda bulundu. Biyokimyanın bir bilim olarak oluşumu, yeni analitik yöntemlerin yaratılmasıyla kolaylaştırıldı. . 1923'te İsveçli kimyager Theodor Svedberg bir ultrasantrifüj tasarladı ve başta proteinler olmak üzere makromoleküllerin moleküler ağırlığını belirlemek için bir sedimantasyon yöntemi geliştirdi. Aynı yıl Svedberg'in asistanı Arne Tiselius (1902–1971), yüklü moleküllerin bir elektrik alanındaki göç hızlarındaki farka dayalı olarak dev molekülleri ayırmak için daha gelişmiş bir yöntem olan elektroforez yöntemini yarattı. 20. yüzyılın başında. Rus kimyager Mikhail Semenovich Tsvet (1872–1919), bitki pigmentlerini, karışımlarını adsorbanla dolu bir tüpten geçirerek ayırmak için bir yöntem tanımladı. Yönteme kromatografi adı verildi. 1944'te İngiliz kimyagerler Archer Martin ve Richard Singh, yöntemin yeni bir versiyonunu önerdiler: tüpü adsorban ve filtre kağıdıyla değiştirdiler. Kimya, biyoloji ve tıpta en yaygın analitik yöntemlerden biri olan kağıt kromatografisi bu şekilde ortaya çıktı; bunun yardımıyla 1940'ların sonlarında ve 1950'lerin başlarında farklı proteinlerin parçalanmasından kaynaklanan amino asit karışımlarını analiz etmek mümkün oldu. Proteinlerin bileşimini belirler. Özenli araştırmalar sonucunda insülin molekülündeki amino asitlerin sırası belirlendi (Frederick Sanger) ve 1964 yılına kadar bu protein sentezlendi. Günümüzde pek çok hormon, ilaç ve vitamin biyokimyasal sentez yöntemleri kullanılarak elde edilmektedir.

Endüstriyel kimya.
Modern kimyanın gelişiminde muhtemelen en önemli aşama 19. yüzyıldaki yaratımdı. Temel araştırmaların yanı sıra uygulamalı araştırmalar da yapan çeşitli araştırma merkezleri. 20. yüzyılın başında. bir dizi sanayi şirketi ilk endüstriyel araştırma laboratuvarlarını kurdu. ABD'de DuPont kimya laboratuvarı 1903'te, Bell laboratuvarı ise 1925'te kuruldu. 1940'larda penisilinin ve ardından diğer antibiyotiklerin keşfi ve sentezinden sonra, profesyonel kimyagerlerden oluşan büyük ilaç şirketleri ortaya çıktı. Makromoleküler bileşiklerin kimyası alanındaki çalışmalar büyük pratik öneme sahipti. Kurucularından biri, polimerlerin yapısı teorisini geliştiren Alman kimyager Hermann Staudinger'di (1881–1965). Doğrusal polimerlerin üretimine yönelik yöntemlere yönelik yoğun araştırmalar, 1953'te polietilenin (Karl Ziegler) ve ardından istenen özelliklere sahip diğer polimerlerin sentezine yol açtı. Günümüzde polimer üretimi kimya sanayinin en büyük dalıdır.
Kimyadaki tüm gelişmeler insanlara faydalı olmamıştır. 19. yüzyılda Boya, sabun ve tekstil üretiminde çevreye büyük tehlike oluşturan hidroklorik asit ve kükürt kullanıldı. 20. yüzyılda İnsan sağlığı ve çevre açısından risk oluşturan kimyasal atıkların işlenmesinin yanı sıra, kullanılmış maddelerin geri dönüştürülmesi nedeniyle birçok organik ve inorganik malzemenin üretimi artmıştır.
Edebiyat:
Figurovsky N.A. Kimyanın genel tarihi üzerine bir deneme. M., 1969
Jua M. Kimya tarihi. M., 1975
Azimov A. Kimyanın Kısa Tarihi. M., 1983
Lavoisier'in yöntemi Oksijen yanma teorisi Element kavramının yeniden düşünülmesi Fransız bilim adamı A.L.'nin çalışmalarından kaynaklanan kimyasal olaylara ilişkin görüşlerdeki küresel değişiklikler. Lavoisier'e geleneksel olarak kimyasal devrim denir. 1. Flojiston teorisinin oksijen yanma konseptiyle değiştirilmesi; 2. Kimyasal maddelerin kabul edilen bileşim sisteminin revizyonu; 3. Kimyasal element kavramının yeniden düşünülmesi; 4. Maddelerin özelliklerinin niteliksel ve niceliksel bileşimlerine bağımlılığı hakkında fikirlerin oluşturulması. A. Lavoisier araştırmasını, o zamanın deneysel yöntemlerinin ve teorik fizik kavramlarının tutarlı bir şekilde uygulanmasıyla ayırt edilen fizikokimyasal bir yaklaşıma dayandırdı. O dönemde teorik fizik görüşleri arasında merkezi rol, I. Newton'un yerçekimi kuvveti doktrini tarafından oynandı. Bu çekimin ölçüsü, I. Newton'un ağırlığın kütleye oranı konusundaki tutumuna göre vücudun ağırlığıdır, fiziksel yöntemlerle (tartım) belirlenebilir. Bu görüşlerin sonucu, ağırlığın maddi parçacıkların en temel özelliği olarak algılanmasıydı. Antoine Laurent Lavoisier 1743-1794 A. Lavoisier, kimyasal reaksiyonlardaki madde miktarlarını belirlemek için sistematik olarak hassas tartımı kullanmaya başladı. Seleflerinin çoğunun aksine, A. Lavoisier, etkileşime giren maddelerin toplam ağırlığını koruma genel ilkesine dayanarak, kimyasal süreçte yer alan tüm maddeleri (gaz halinde olanlar dahil) tarttı. Yani onun niceliksel yöntemi, eski zamanlarda ifade edilen klasik doğa biliminin temel konumu olan maddenin korunumu aksiyomuna dayanıyordu. A. Lavoisier, başlangıç maddelerinin ve reaksiyon ürünlerinin yalnızca ağırlığını değil aynı zamanda diğer fiziksel özelliklerini de (yoğunluk, sıcaklık vb.) belirledi. Gelecekte niceliksel parametrelerin ölçülmesi, daha önce niteliksel olarak çalışılmış olan kimyasal dönüşümlerin ayrıntılı mekanizmasının aydınlatılmasını mümkün kıldı. Uzun kavisli boynu sıvı cıvanın üzerine ters çevrilmiş bir çan ile iletişim kuran bir imbik içine tartılmış bir miktar cıva yerleştirdi. Deneyden önce, imbik ve çan içindeki cıvanın üzerindeki havanın hacminin yanı sıra tüm aparatın ağırlığı da ölçülmüştür. Daha sonra imbik 12 gün boyunca neredeyse cıvanın kaynama noktasına kadar ısıtıldı. İmbikteki cıvanın yüzeyi yavaş yavaş kırmızı pullarla kaplandı. Bu pulların (cıva oksit) sayısı artmayı bıraktığında deney durduruldu. Cihaz soğutulduktan sonra oluşan ürün miktarının doğru sayımı yapıldı. Tüm cihazın toplam ağırlığının değişmediği, hava hacminin azaldığı, civanın ağırlığı arttıkça (oksit oluşumu nedeniyle) alınan havanın ağırlığının azaldığı keşfedildi. Priestley yöntemini kullanarak cıva oksitten oksijen elde etmek (imbik a). Cıva küresel bir kapta (b) birikir ve oksijen gaz çıkış tüpünden (c) silindir d'ye geçer ve burada sıvı cıvanın üzerinde toplanır. Resmi tamamlamak için yalnızca ortaya çıkan cıva oksidi toplamak, Priestley yöntemine göre ayrıştırmak ve elde edilen oksijen miktarını ölçmek gerekiyordu. Tahmin edilebileceği gibi, böyle bir deneyin yeniden üretilmesi Lavoisier'e cıva tarafından havadan emilen oksijen miktarının aynısını (olası hata payı dahilinde) verdi. A. Lavoisier, fosfor içeren tabağı suda yüzen bir mantar standının üzerine yerleştirdi, fosforu sıcak tel ile ateşe verdi ve üzerini hızla bir cam çan ile kapattı. İçerideki alanı kalın beyaz duman doldurdu. Kısa süre sonra fosfor söndü ve su yükselip çanı doldurmaya başladı. Bir süre sonra yükselen sular durdu. - Görünüşe göre yeterince fosfor almamışım. Tüm hava onunla bağlantı kuramadı. Deneyi tekrarlamamız gerekiyor. Ancak iki kat daha fazla fosfor içeren ikinci bir deney de benzer bir sonuç verdi: Su aynı seviyeye yükseldi. Onuncu kez yapılan deney bile aynı sonucu gösterdi. - Fosfor havanın yalnızca beşte biriyle birleşir. Hava gerçekten karmaşık bir karışım mıdır? Lavoisier ayrıca kükürtün yanmasını da inceledi. Yanarken havanın yalnızca beşte biriyle birleşiyordu. Bundan sonra bilim adamı metallerin yanmasını incelemeye başladı. Lavoisier'in kullandığı cihazlar uzun süreli kalsinasyona tabi tutulduğunda metaller metal külüne dönüşüyordu, ancak kömürle karıştırılıp yüksek sıcaklıkta ısıtıldığında kül yeniden metale dönüşüyordu. Ancak bu işlem, kimyacıların "bağlayıcı hava" (karbon dioksit) adını verdiği bir gazı açığa çıkardı. Lavoisier yanmanın gazlarla ilişkili olduğunu çok iyi anlamış ancak yine de kesin bir sonuca varamamıştır. Böylece gazları inceleme ihtiyacı doğdu. "Bağlayıcı hava" nedir? Kireç taşının içinde mi bulunuyor? Kireç taşının ısıtılıp sönmemiş kirecin haline getirilmesiyle nasıl elde edilir? Metalik cıva ve cıva(II) oksit Metalik bakır ve bakır(II) oksit Yanma her zaman havayı mı içerir? Eğer öyleyse, bu durumda hangi madde daha karmaşıktır; metal mi yoksa metal külü mü? A. Lavoisier, havanın iki parçadan oluştuğu konusunda açıktı; bunlardan biri yanmayı destekliyor (kalsine edildiğinde metallerle birleşiyor), diğeri yanmayı desteklemiyor ve içinde canlı organizmalar ölüyor. Yanma sırasında cisimler havanın "iyi hava" adını verdiği bu aktif kısmını emer. Bu aynı zamanda ortaya çıkan ürünün orijinalinden daha ağır olduğunu da açıklamaktadır. Bilim adamı, yanmanın bir ayrışma süreci değil, havanın bir kısmıyla bağlantı olduğu sonucuna vardı. Üstelik havanın bu kısmı, bir flojiston çözücünün mekanik işlevini yerine getirmez, ancak yanma sürecinin kimyasına katılarak yeni bileşiklerin ortaya çıkmasına neden olur. Bir imbikte cıva oksidin ayrışmasının gözlemlenmesi 1775 yılının başında A. Lavoisier, Barut ve Nitrat Dairesi'nin müdürü oldu. Bu bağlamda barut yapımında kullanılan malzemeleri araştırmaya başladı. Lavoisier güherçile ve nitrik asidin "iyi hava" içerdiğini kanıtladı; kükürt ve fosfor yanma sırasında bu tip hava ile birleşir ve ortaya çıkan maddeler asit özelliklerine sahiptir. - Belki de tüm asitler bu gazı içerir? - kendine defalarca sordu. Lavoisier yeni gaza oksijen adını verdi. Oksijen yanma teorisinin temel prensipleri 1777'de formüle edildi. 1. Bu teoriye göre yanma ancak oksijen varlığında gerçekleşebilir ve ışık ve ateş açığa çıkar. 2. Yanan maddenin ağırlığı, emilen hava miktarı kadar artar. 3. Metaller yandığında oksijenle birleşmesi sonucu metalik kireçler oluşur. 4. Metalik olmayan maddeleri ateşlerken - asitler (o zamanlar asit anhidritleri bu şekilde adlandırılıyordu). A. Lavoisier, kömürün yanması sırasında karbondioksitin oluştuğunu ve aynı zamanda birçok doğal (organik) cismin yanması sırasında da açığa çıktığını gösterdi. Bu, A. Lavoisier'e organik maddelerin niteliksel ve niceliksel bileşimini belirlemek için uygun bir yöntem önerme fırsatı verdi. Karbondioksitin bileşiminin belirlenmesi, A. Lavoisier'in, yanma süreçleriyle yakın benzerliği defalarca not edilmiş olan solunum kimyasının (oksijen emilimi ve karbon dioksit salınımı) doğru bir şekilde anlaşılmasını özetlemesine izin verdi (J'nin çalışmaları) Mayow, G. Boerhaave, J. Priestley, vb.) Gazlarla deneyler için kimyasal cihaz. A.L. Lavoisier'in "Antiflojiston kimyasının temelleri" kitabından. Baskı 1792 Kırmızı demir cevheri (hematit) Fe2Oz Karbondioksitin oluşum yöntemleri ve özelliklerinin incelenmesi, A. Lavoisier'in oksijen yanma teorisini genişletmesine ve birçok kimyasal süreci maddelerin oksidasyonu-indirgenmesi açısından açıklamasına olanak sağladı. Yani, bilim adamı yanma süreçlerini inceleyerek genel olarak oksidasyon reaksiyonlarını incelemeye geçti. Örneğin A. Lavoisier reaksiyonları inceledi: 2Fe2O3 + 3C = 3CO2 + 4Fe 2Fe + 3H2O = Fe2O3 + 3H2 kömür Ve yine de bir soruya cevap bulamadı; bu, metallerin asit içinde çözülmesiyle elde edilen ve kolayca yanabilen "yanıcı havanın" yanmasıyla ilgiliydi. Yeni teoriye göre ürünlerin daha ağır olması gerekiyordu; Lavoisier'e göre onları tamamen yakalamak mümkün değildi ve ağırlık her zaman daha azdı. Burada başka bir zorluk daha vardı. Asit teorisine göre "yanıcı hava" (hidrojen) oksijenle birleştikten sonra bir asit oluşturmalı, ancak bunu elde etmek mümkün değildi. Lavoisier, bu karmaşık sorunu, İngiltere'den gelen ve başarısız deneylerini ayrıntılı olarak anlattığı fizikçi ve kimyager Charles Blagden ile tartışmaya karar verdi. - Arkadaşım Henry Cavendish, kapalı bir kapta normal havayı "yanıcı hava" ile karıştırıp ateşe verirseniz, kabın duvarlarında "yanıcı havanın" yanmasının ürünü olan küçük damlacıklar oluşacağını kanıtladı. Cavendish bunların su damlaları olduğunu belirledi. - İnanılmaz bir keşif. Bu, suyun bir element değil, karmaşık bir madde olduğu anlamına gelir. Bu deneyleri hemen tekrarlamak ve kendi gözlerimle görmek istiyorum. G. Cavendish'in hidrojen üretme ve toplama cihazı A. Lavoisier, G. Cavendish ve J. Watt'ın benzer deneylerinden sonra yanıcı hava ve oksijenden su sentezi üzerine bir deney gerçekleştirdi (A. Lavoisier ile eşzamanlı olarak, benzer deneyler G tarafından gerçekleştirildi) . Monge), ancak Bu bilim adamlarından farklı olarak A. Lavoisier, bu sentezi oksijen teorisi açısından yorumladı ve "yanıcı hava" ("hidrojen" adını vermeyi önerdiği) ve oksijenin elementler olduğunu ve suyun da onların olduğunu gösterdi. birleştirmek. (bir hidrojen ve oksijen karışımını elektrik kıvılcımıyla ateşleyerek suyun bileşimini belirlemeye yönelik bir deney sırasında) Deneyler sonucunda A. Lavoisier, maddelerin ağırlığının korunumu yasasının evrensel olduğu sonucuna vardı. kanun. Oksidasyon teorisi de geneldir ve istisnası yoktur. Su, asitler ve metal oksitler karmaşık maddelerdir; metaller, kükürt ve fosfor ise basit maddelerdir. Bu, kimyasal bileşiklerin bileşimlerinin tüm sistemi hakkındaki görüşleri tamamen değiştirdi. Filojiston diye bir şey yoktur ve hava bir gaz karışımıdır. A. Lavoisier bu düşüncelerini, deneylerini gösterdiği akademisyenlere aktardı. Ancak çoğu Lavoisier'in çalışmalarını tanımak istemedi; fikirlerini Priestley ve Cavendish'in çalışmalarından ödünç almakla suçlandı. Akademisyenler, Gaspard Monge'a atıfta bulunarak suyun ayrışması konusunda benzer deneylerin olduğunu bildiklerini defalarca dile getirdiler. Lavoisier'in önceliği tanınmadı. Bilim adamları araştırmada güçlerini birleştirmek yerine bu fenomeni kimin keşfettiğini tartıştılar. Bilim dünyasında destek bulamayan Lavoisier yine de çalışmalarına devam etti. Şimdi ünlü fizikçi ve matematikçi Pierre Simon Laplace ile işbirliği yaptı. Maddelerin yanması sonucu açığa çıkan ısıyı ölçmenin mümkün olduğu özel bir aparat yapmayı başardılar. Sözde buz kalorimetresiydi. Araştırmacılar ayrıca canlı organizmaların yaydığı ısı konusunda da detaylı bir çalışma yürüttüler. Nefesle verilen karbondioksit miktarını ve vücut tarafından üretilen ısıyı ölçerek gıdanın vücutta özel bir şekilde "yandığını" kanıtladılar. Bu yanmanın ürettiği ısı, normal vücut sıcaklığının korunmasına hizmet eder. Lavoisier-Laplace buz kalorimetresi, 18. yüzyılda birçok katı ve sıvının ısı kapasitelerinin yanı sıra çeşitli yakıtların yanma ısısını ve canlı organizmalar tarafından salınan ısıyı ölçmeyi mümkün kıldı. Örneğin, iç bölmedeki bir hayvanın (veya başka bir nesnenin) verdiği ısı, iç “buz ceketi”ndeki buzun eritilmesi için harcanıyordu. Dış kısım, iç kısmın sıcaklığının sabit tutulmasına hizmet ediyordu. Açığa çıkan ısı, kaba akan eriyik suyun tartılmasıyla ölçülmüştür. Laplace, Lavoisier'in görüşlerinin doğruluğuna ikna olmuştu ve teorisini ilk kabul eden kişi oldu. 1785 yılında o dönemde çok ünlü olan Claude Louis Berthollet, Lavoisier'in teorisini desteklemek için ortaya çıktı. Bir süre sonra Lavoisier, o zamanın en önde gelen kimyagerleri Antoine Fourcroix ve Guiton de Morveau tarafından desteklendi. Laplace Pierre-Simon 1749 -1827 Fransız matematikçi, mekanikçi, fizikçi ve astronom Fourcroix Antoine-Francois (1755-1809) Fransız kimyager ve politikacı Metodolojik açıdan, kimya devriminin önemli bir sonucu A.L. Lavoisier'e göre “kimyasal element” kavramının içeriğinde bir değişiklik oldu. Elementler, bir nesnede önceden var olan ayrışmanın ürünleri olarak değil, prensipte maddelerin ayrışmasının son sınırı olarak görülmeye başlandı. Elementler, niteliksel olarak yeni oluşumlara ayrıştırılamayan ve oluşturdukları karmaşık cisimlerin herhangi bir kimyasal dönüşümü sürecinde korunan, analitik olarak belirlenmiş bileşim parçaları olarak düşünülmeye başlandı. A. Lavoisier'in çalışmalarında ağırlık analiz yönteminin kullanılması sayesinde, sınırlı sayıda unsur ve bunların niteliksel heterojenliği hakkında fikirler oluşmuştur. Bu, çeşitli niteliksel ve niceliksel elementel bileşimin bir sonucu olarak kimyasal maddelerin çeşitliliğini açıklamaya yönelik bir yaklaşıma yol açtı. Niteliksel olarak tanımlanan her maddenin her zaman kesin olarak tanımlanmış ve benzersiz bir niceliksel bileşime sahip olduğu varsayılmıştır. Değişken bileşime sahip bileşikler (berthollidler) ve izomerizm olgusu o zamanlar bilinmiyordu. A. Lavoisier'in organik maddelerin elementel analizi için cihazı 18. yüzyılda kimyagerler yanma probleminden daha az olmamak üzere asitlik problemine ilgi gösterdiler, çünkü bu problemlerin her ikisi de o zamanın analitik araştırmalarının iki ana yönüne karşılık geliyordu ( “kuru” ayrışma - ateş yardımıyla ve “ıslak yol” - asitler kullanılarak). A. Lavoisier'in eserlerinin yayınlanmasından önce, tüm asitlerin bileşimlerinde, tüm bileşiğe asitlik niteliği veren belirli bir tek birincil asit içerdiğine inanılıyordu. A. Lavoisier, sülfürik, fosforik ve nitrik asitlerin (modern kavramlarda - SO3, P2O5, N2O5) ayrışmasına ilişkin deneylere dayanarak, asitlik özelliğini bu bileşiklerdeki oksijenin varlığıyla ilişkilendirdi (bu nedenle oksijen - oksigenyum adı - asit üreten, asidik prensip). A. Lavoisier'e göre asitler, bir asit radikali olan oksijenle ilişkili oldukları için birbirlerinden farklıdırlar. Oksijen, asitlerin temel bir elementi olarak kabul edildi ve bir süre için mürik (hidroklorik) asit bile, murik radikalinin oksijenle bir bileşiği olarak temsil edildi ve klor, murik asidin oksidi olarak kabul edildi. Guiton De Morveau Louis Bernard (1737-1816) Fransız kimyager ve politikacı Guiton de Morveau, Lavoisier ile ilk kez yanma teorisi hakkında tanışmadı: “Ne kadar ilgilendiğinizi bilmiyorum ama kimyasal bileşiklerin adlarında tam bir kaos var. . - Sana tamamen katılıyorum. - Metodolojik Ansiklopedi'nin kimya bölümü şu anda yayına hazırlanmaktadır. Ve hala var olan isimleri kullanarak tüm sorulara kapsamlı cevaplar vermek imkansız olduğundan, kimyasal bileşiklerin yeni bir isimlendirmesini derlemeye başladım. Elbette önde gelen kimyagerlerin yardımına ihtiyacım var. - Yanma teorisine ve oksijenin bu süreçteki rolüne dayanarak bazı varsayımlarda bulunabilirim. Metal külünü ele alalım - metalin oksijenle birleşimi. Elementlerin oksijen oksitlerle kombinasyonunu diyelim. Daha sonra çinko külü çinko oksit, demir külü demir oksit vb. olacaktır. “Bağlayıcı hava” nedir? Bunun bir karbon ve oksijen bileşiği olduğunu zaten kanıtladım. Bu nedenle karbon monoksit olarak adlandırılmalıdır. 1787'de Guiton de Morveau, Lavoisier, Fourcroix ve Berthollet'in yer aldığı "Kimyasal İsimlendirme Yöntemi" ni yayınladı. Basit cisimler tablosu Lavoisier A.L. Lavoisier Kimyasal dilin dönüşümü, kimyadaki küresel değişimlerin bir sonucuydu ve her maddeye, bileşimini ve kimyasal özelliklerini karakterize edecek bir isim verme amacını taşıyordu (bu noktaya kadar, bir maddenin birçok ismi olabiliyordu; bunlar genellikle şans). Yeni terminolojide her madde genel (örneğin asit) ve spesifik özellikleri (örneğin sülfürik, nitrik, fosforik asit) açısından değerlendirildi. Spesifik özellikler, element bileşimi verilerine dayanarak belirlendi. İsimlendirme, kimyasal bilgi alışverişini büyük ölçüde kolaylaştırdı; genel olarak temel ilkeleri bugüne kadar korunmuştur. Lavoisier o sıralarda en büyük eserlerinden biri üzerinde çalışıyordu; derleme ihtiyacı çoktan gecikmiş bir kimya ders kitabı. Doğadaki olguları yeni bir şekilde açıklamak, modern teorilerin temellerini açıkça ortaya koymak gerekiyordu. Kimyadaki yeni başarılar Christophe Glaser ve Nicolas Lemery'nin eski ders kitaplarına yansımadı. 1788'in sonunda ders kitabı hazırdı. Taslağın hazırlanmasında büyük itibar, ders kitabının üçüncü bölümünü sanatsal olarak tasarlayan Madame Lavoisier'e aitti. A. Lavoisier'in ders kitabının başlık sayfası A. Lavoisier'in ders kitabının ilk bölümü, oksijen yanma teorisinin bir sunumunu, gazların oluşumu ve ayrışması üzerine deneylerin bir tanımını, basit maddelerin yanmasını, asitlerin oluşumunu, bir açıklamayı içeriyordu. atmosfer ve suyun bileşimi ve yeni isimlendirme. İkinci bölüm, kimyasal elementlerin pratikte ilk sınıflandırması olan “Basit Cisimler Tablosu”nu içeriyordu (toplam 33 element sunuldu). Tablo hem gerçek elementleri hem de o sırada ayrıştırılamayan (ancak A. Lavoisier'in belirttiği gibi daha sonra ayrıştırılabilen) bazı bileşikleri (örneğin alkali metal oksitler) içeriyordu. Tabloda elementler olarak iki prensip görünmektedir - ağırlığı olmayan kalorik ve hidrojen, ancak görünümleri sürekli olarak kimyasal işlemlerle ilişkilidir. Isı ve ışığın elementlere atfedilmesi, o zamanın fiziğinde kalori teorisinin yayılmasının bir sonucuydu. Bu teoride ısı, tüm cisimlerin parçacıklarını çevreleyen ve parçacıkların birbirlerinden itilmesine neden olan bir tür atmosfer olarak düşünülüyordu. Lavoisier, kalorinin madde ile kombinasyonunun bir sonucu olarak kimyasal reaksiyonlarda ve ayrıca maddelerin katıdan sıvıya ve sıvıdan gaz haline geçişi sırasında ısı emilimi olgusunu açıklamaya meyilliydi. Sıvılarda kesinlikle yoğunlaşmayan gazlar, "buharlaşmayan" sıvılar ve kalıcı katılar hakkındaki önceki fikirlerin aksine, bir maddenin katı, sıvı ve gaz halinin, içinde bulunan ısı miktarına bağlı olduğuna inanıyordu. Lavoisier, katı halde, vücudu oluşturan parçacıklar arasındaki çekim kuvvetlerinin itme kuvvetlerini aştığını, sıvı halde düzleştirildiklerini ve gaz halinde kalorinin etkisi altında itme kuvvetlerinin hakim olduğunu yazdı. çekim kuvvetlerinin üzerinde. Tüm maddi makro maddelerin çeşitli toplanma durumlarında var olma yeteneği fikri, kimyasal devrimin bir başka önemli yönü haline geldi. Kimyasal reaksiyonlarda elementlerin korunumu yasasının ve maddelerin kütlesinin korunumu yasasının deneysel olarak doğrulanması, A. Lavoisier'in kimyasal denklemlerin derlenmesini sunmasına izin verdi, yani. Kimyasal dönüşümlerin maddi dengeleri. A. Lavoisier şunu yazdı: "İncelenen cisimlerin ilkeleri (unsurları) ile analiz yoluyla ikincisinden elde edilenler arasında bir eşitliğin veya denklemin varlığını varsaymak gerekir." Kağıdın (a) ve bakırın (b) oksijenle reaksiyonları A. Lavoisier'in çalışmalarından çok önce, maddenin yapısına ilişkin orijinal görüşlerin Rus bilim adamı M.V. Lomonosov. “Matematiksel Kimyanın Elemanları” kitabında tüm cisimlerin parçacıklardan oluştuğunu ve bunların da belirli sayıda element içerdiğini yazdı. Parçacıklar, birbirine aynı şekilde bağlanan aynı sayıda aynı elementten oluşuyorsa homojendir. Öğeleri aynı değilse ve farklı şekillerde veya farklı sayılarda birbirine bağlıysa parçacıklar heterojendir. Bedenlerin sonsuz çeşitliliği buna bağlıdır. Cisimler homojen parçacıklardan oluştuğunda basit, birkaç farklı parçacıktan oluştuğunda ise karışıktır. Cisimlerin özellikleri rastgele değildir; onları oluşturan taneciklerin özelliklerine bağlıdırlar. İlkini ele alalım - ısı. Neyi temsil ediyor? Bir vücuttan diğerine akabilen ağırlıksız bir sıvı mı? HAYIR. Galileo ayrıca cisimciklerin hareket halinde olduğuna inanıyordu. Bana göre bu, cisimciklerin ilk ve ana özelliğidir. Ancak hareket ısı yaratır. Herkes bir tekerlek döndüğünde aksının ısındığını bilir. Vücudun parçacıkları hareket eder, kendi ekseni etrafında döner, birbirine sürtünür ve ısı yaratır... Mikhail Vasilyevich, Euler'e yazdığı bir mektupta doğadaki dönüşümlerle ilgili görüşlerini şöyle özetledi: “Doğada meydana gelen tüm değişiklikler şu şekilde gerçekleşir: Bir şeye bir şey eklenirse, o şey başka bir şeyden çıkarılır. Yani bir bedene ne kadar madde eklenirse, diğerinden de o kadar madde kayboluyor, kaç saatimi uykuda geçiriyorum, uyanıkken aynı miktarı alıyorum vs. Bu evrensel bir doğa kanunu olduğu için de geçerlidir. hareket kurallarına göre: itmesiyle bir başkasını hareket etmeye teşvik eden, bir başkasıyla iletişim kurduğu kadar hareketinden de kaybeden, onun tarafından hareket ettirilen bir beden...” - Lomonosov'dan önce kimsenin ifade etmediği düşünceler. Boyle kapları neden ısıttıktan sonra açtı? Böyle bir durumda kaplardan bir şeyler buharlaşabilir ve ağırlıkları değişebilir. Deneylerin tekrarlanması gerekir ancak tüm gözlem ve ölçümlerin kapalı bir kapta yapılması gerekir. İçinde hava var. Lomonosov özel bir kap hazırladı, içine kurşun talaşı döktü, ardından körükle ateşi körükledi ve kabın boynunu cam yumuşayana kadar ısıttı. Bir kelepçe kullanarak camı kapattı ve kabı hemen ateşe verdi. Artık hiçbir şeyin gemiye girmeyeceğinden ve hiçbir şeyin oradan kaçmayacağından tamamen emindi. Körükler son kez şişti ve şimdi mavi alevler kızgın bir kömür yığınına dönüşerek kayboldu. Lomonosov kabı dikkatlice masanın üzerine koydu ve bir sonrakini hazırlamaya başladı. Sadece kurşunu değil diğer metalleri de kalsine ederek deneyin defalarca tekrarlanması gerekiyordu: demir, bakır... Lomonosov soğutulmuş kapları tarttı, onları büyük bir fırında kömürlerin üzerine koydu ve ateşi körüklemeye başladı. İlk başta körük yavaş çalıştı, ancak yavaş yavaş hava akışı yoğunlaştı ve onunla birlikte mavimsi alevler ortaya çıktı. Geminin duvarları kırmızıya döndü ve kurşun talaşları eridi. Parlak gümüş-beyaz damlalar hızla grimsi-sarı bir kaplamayla kaplandı. Kırmızı bakır talaşları siyah-kahverengi toza dönüştü. Demir talaşları siyaha döndü. Acaba “kalori” gemilere girdi mi? Metallerle birleşti mi? Eğer öyleyse, o zaman geminin ağırlığı artmalıdır. Ancak teraziler tüm kapların ağırlığının değişmediğini gösterdi! Catherine II'nin Lomonosov'un laboratuvarını ziyareti Peki ya metal külü? Ağırlığını metalin ağırlığıyla karşılaştırmamız gerekiyor. Ertesi gün araştırmacı deneyleri tekrarladı. Kabı kapatmadan önce metal tozlarını tarttı. Kalsinasyondan sonra kapları tekrar tarttı, ardından açtı ve ortaya çıkan metal külü tarttı. Kül önceden alınan metalden daha ağırdı! - Bu deneyler Robert Boyle'un görüşünü çürütüyor. Metaller "kalori" ile birleşmez: sonuçta kabın ağırlığı değişmez. Bu inkar edilemez. Ama yine de kül daha ağırdır. - Lomonosov tekrar düşündü. Ancak kapta belli bir miktar hava vardı... Belki de metaller hava tanecikleriyle birleşiyordu? Kaptaki metal külü ağırlaştığı için kaptaki havanın ağırlığı da aynı oranda azalmış demektir. Dışarıdan hava beslemesi olmadan metalin ağırlığı değişmeden kalacaktır! Kimyanın bir bilim olarak yeni ortaya çıktığı bir çağda yaşayan Lomonosov, flojiston teorisinin yanlış fikirlerine rağmen, bugün hala fizik ve kimya biliminin temelini oluşturan bu tür genellemelere ulaşmayı başardı. Maddenin ve enerjinin korunumu yasasını ilk formüle eden, birçok bilim adamının izlediği yolu gösteren ilk kişi oydu.
İnsanlık bu gezegende ortaya çıktığından beri nispeten sakin ve istikrarlı bir yaşam tarzı sürdürmüş, aynı yiyecekleri tüketmiş, aynı kaynaklardan su çekmiş ve aynı havayı solumuştur. Yakın zamana kadar doğanın geri kalanıyla aramızda hassas bir denge vardı ve her türlü çevresel veya iklim değişikliğiyle birlikte evrimin kesintisiz akışı sayesinde güç dengesi yeniden eşitlendi.
Biyolojik bir tür olan insan, zihinsel yeteneklerin ve belli bir oranda dayanıklılığın vücudumuzda bulunması nedeniyle, doğaya müdahale etme ve çevreyi değiştirme yeteneğini geliştirmiştir. Aletlerin yaratılması, ateşin keşfi, hayvanların evcilleştirilmesi, yabani bitkilerin yetiştirilmesi, ilk yerleşimlerin oluşumu - bunların hepsi ilerleme ve medeniyet yolundaki ilk adımlardı.
Bu insanlar için önemliydi, ancak bunların hepsi zayıf girişimlerdi, çünkü küçük insan nüfusu hala tamamen doğa güçlerine bağımlı olduğundan ve en ufak kaprislerinden titrediğinden bir kişi büyük zarar veremezdi. Zamanla, artan insan yoğunlaşması, istilaları sadece daha kalıcı olmakla kalmadı, aynı zamanda daha da sürekli hale geldi, bu istilaların doğası daha da hedefli hale geldi. Bu, sonunda, geçen yüzyılın ikinci yarısında, insanların süreçleri hızlandırma yeteneğinin o kadar değişmesine neden oldu ki, “kendi gelişimimizin hızı” bizi tehdit etmeye başladı.
Aklıma Wachowski kardeşlerin buluşu geliyor: ironik bir şekilde, insanlar tarafından yaratılan makinelerin insanları biyolojik açıdan yararlı yakıt olarak kullanmaya başladığı Matrix. Mevcut gerçeklik, yukarıda bahsedilen gişe rekorları kıran filmde çok renkli bir şekilde tasvir edilen düşünceleri harekete geçiriyor: İnsanlar uzun zamandır birçok mekanizma, makine ve madde icat etme konusunda bilgili ve tüm bunları kendi yaşamlarını "iyileştirme", yani uygarlaşma arzusuyla meşrulaştırıyorlar.

Daha fazla netlik sağlamak için, kimyasal "icatların" tarihine dönelim ve daha önce de söylediğimiz gibi, geçen yüzyılın ikinci yarısına rakamlarla bakalım. Grafik, yirminci yüzyılın ikinci yarısında kimyasal maddelerin icatlarının sayısındaki artışı açıkça göstermektedir. Gördüğünüz gibi, geçen yüzyılın 50'li yıllarında kimya endüstrisinde gerçek bir patlama başladı ve 1975'e gelindiğinde istatistikler 1.000.000 sentetik kimyasal madde kaydetti. Çeşitli ülkelerdeki kimyagerlerin daha sonraki “başarıları”, her yıl yaklaşık 1000 yeni kimyasalın eklenmesiyle karakterize edildi. Geçen binyılın sonuna gelindiğinde insanlık “kullanımdaydı”, yani. Yaygın kullanımda 60.000'den fazla yapay olarak üretilmiş kimyasal vardı.

Bu türden en fazla sayıda "icat", insanlığın yaşam destek zincirindeki en zayıf halkalarla ilgilidir:
yaygın olarak kullanılan malzemelerin üretimi
- kumaşlar
- izolatörler
- kaplamalar
En çok tüketilen ürünlerin üretimi ve tüketimi
- besin takviyeleri
- işleme ve depolamada kullanılan maddeler
- ilaçlarda kullanılan maddeler
Ortak ve erişilebilir enerji kaynaklarının ve medyanın kullanımı
- kara
- hava

Yarattığımız bu kimyasal döngüsü zaten hayatımızın bir parçası; ve her tür gibi biz de hayatta kalabilmek için onu kullanmalı, ona uyum sağlamalı veya en azından ondan kaçınmalıyız. Bu kavram, sürekli devam eden bu sürece kendi katılımımızın, evet katılımımızın olduğu gerçeğini kabul edersek anlaşılabilir; bir yandan üreticiyiz, diğer yandan bu döngünün bir ürünüyüz. Bu nedenle, kendi gelişimimizdeki veya bilgimizdeki herhangi bir değişiklik bize yönelir.
Savaşlarda ve barış zamanlarında bir milyondan fazla hayat kurtaran penisilinde olduğu gibi, deneylerimiz zaman zaman bize fayda sağladı. Ve onları keşfedenlerin bile unutmak istedikleri şeyler var; en güçlü kitle imha silahlarından biri olan Sarin gazını (pestisitleri daha etkili hale getirmeye çalışan Alman kimyagerler tarafından kaçınılmaz bir kaza sonucu keşfedilen) hatırlamak yerinde olacaktır. , İkinci Dünya Savaşı'nın hemen arifesinde). Üçüncü keşiflerin doğası bizim için olduğu kadar bizim için de açık değil, çünkü bunlar sadece kendimizi değiştiriyor: Narkotik ilaçların insan vücudu üzerindeki etkisine dair örnekler vermeye muhtemelen gerek yok. Her ne kadar Eski Dünya'da ve daha sonra dünyanın diğer yerlerinde eczacılığın şafağında, insanların ihtiyaç duyduğu ilaçlar olarak sunuldular.
Öyle görünüyor ki, eğer bazı maddeler insanların yararı düşünülerek icat edildiyse, o zaman neden varlığından şüphelenmediğimiz bazı gerçekler ortaya çıkıyor? Pratikte her şey oldukça basittir - yapay maddelerin tehlikesi, kontrolsüz varoluşları boyunca temas ettikleri şeyler üzerindeki etkileri hakkında güvenilir bir doğrulukla hiçbir şey bilmememizde yatmaktadır.
Bu basit bir örnekle gösterilebilir: Bize göründüğü gibi, oksijenle ilgili her şeyi uzun zamandır biliyoruz. Oksijen vücudumuz için son derece kritiktir ancak saf oksijen bizi öldürebilir. Oksijen doğada safsızlıklar olmadan bulunmadığından onu bu haliyle tüketemeyiz. Gördüğünüz gibi biz de hayatın zincirlerine tam olarak Doğa'nın bize öğrettiği gibi katılıyoruz; ve herhangi bir sapmanın (ve burada ihtiyacımız olan maddeyi geliştirmeye çalıştık) ölümcül olduğu ortaya çıkıyor. Burada tek bir sonuç var: Herhangi bir maddeyle ilgili olarak kesinlikle emin olabileceğimiz şey, onun potansiyel olarak zararlı etkilerinin ne kadar süreyle kendini göstermeyeceğini bilmediğimizdir.
Bugün de giderek artan bir endişeyle gözlemlediğimiz devrimin temel özelliklerinden biri, icat edilen ürünler, içerikler, bileşimler ve bunların etiketleri hakkında bilgi edinme özgürlüğünün dile getirilmeyen yasağıdır. Her ne kadar giderek daha fazla ülke gıda, ilaç, giysi vb. bileşimleri hakkında bilgi sağlamak için zorunlu gereksinimler getirse de, günlük yaşamda örneğin çamaşır tozu, boya, plastik ürün vb.'nin ne olduğunu belirlemek neredeyse imkansızdır. herhangi bir şeyden oluşur! Bu konuda en provokatif olan ise bu gizlilik rejiminin kurulmasında doğrudan payı olan kişilerin gizlenmesidir.
Gereksiz kimyasalların fazlalığı o kadar bariz hale geldi ki, hiç kimse yeni bir malzemenin, polimerin veya ikamesinin icadı konusunda heyecan duymuyor. Bunun ana teyidi, insanların çevre dostu ürünlere olan artan arzusudur. "Kimyasal devrimin zaferini" önlemek için tüm insanların geçmesi gereken yol hakkında "Cehenneme giden yol iyi niyetlerle döşenmiştir" denilebilir.
Bilimsel ilerlemelerdeki son trendler biyolojiye, genetiğe ve yeşil olan her şeye doğru daha büyük bir kaymaya işaret ediyor. Büyük olasılıkla, insanların gözleri kimya ve nükleer enerjinin ötesinde doğanın sonsuz olanaklarına "açılacak" ve eğer bir şeyin tedariki yenilenemiyorsa, o zaman uzun süre beklemenin muhtemelen bir anlamı olmadığı sonucuna varacaklar. Bu sonlu eleman için dönem planları.
Lavoisier'in çalışmaları belki de kimyada, Kopernik'in astronomide keşfinden iki buçuk yüzyıl önce meydana gelen devrimin aynısını yarattı. Lavoisier'in gösterdiği gibi, daha önce element olarak kabul edilen maddelerin, sırasıyla karmaşık "elementler" içeren bileşikler olduğu ortaya çıktı. Lavoisier'in keşifleri ve görüşleri yalnızca kimya teorisinin gelişmesinde değil, aynı zamanda tüm kimyasal bilgi sistemi üzerinde de büyük bir etkiye sahipti. Kimya bilgisinin ve dilinin temelini o kadar dönüştürdüler ki, sonraki nesil kimyagerler Lavoisier'den önce kullanılan terminolojiyi bile anlayamadılar. Bu temelde, Lavoisier'in keşiflerine kadar "gerçek" kimyanın tartışılamayacağına inanıldı. Kimyasal araştırmaların sürekliliği unutuldu. Kimyanın gerçekte var olan gelişim kalıplarını yalnızca kimya tarihçileri yeniden yaratmaya başladılar. Aynı zamanda, Lavoisier'in "kimyasal devriminin", kendisinden belli düzeyde kimya bilgisi olmasaydı imkansız olacağı da ortaya çıktı.
Lavoisier, kimya bilgisinin gelişimini, kimyanın geçmiş yüzyılların en önemli başarılarını içeren yeni bir sistemin yaratılmasıyla taçlandırdı. Ancak bu sistem önemli ölçüde genişletilmiş ve düzeltilmiş bir biçimde bilimsel kimyanın temeli haline geldi.
Her şeyden önce Lavoisier, elementin modası geçmiş kavramlarını yenileriyle değiştirdi. Lavoisier'in zamanında deneysel ve pratik kimyadaki ilerlemeler, Aristoteles'in ve simyacıların varsayımsal unsurlarının terk edilmesini mümkün kılmıştı. Lavoisier'in çalışmalarından sonra, herhangi bir kimyasal yolla daha fazla ayrıştırılamayan bir elemente madde denilmeye başlandı. Bu tanım çok katı olmamalıdır. Sonuçta Lavoisier, özel yöntem ve yöntemlerin yardımıyla o zamanlar "ayrılmaz" olan maddelerin daha sonra ayrıştırılmasının mümkün olacağını henüz bilemezdi. Lavoisier tarafından önerilen bir elementin tanımı ilericiydi: kimyacılara net kriterler veriyordu, ancak elementleri incelemek için çeşitli yöntemlerin kullanımına katı sınırlamalar getirmiyordu. Kimyanın gelişimi açısından Lavoisier'in tanımı son derece verimliydi. Maddeleri mümkün olan tüm yollarla ayrıştırma girişimlerini teşvik etti. 19. yüzyılın ilk yarısında çoğu kimyasal element bu şekilde keşfedildi.
Yeni kimyasal sistem, temel kavramı olan kimyasal elementteki değişiklikle birlikte, madde adlarının daha basit ve anlaşılır olacağı yeni terminolojiyi de gerektirdi. Ayrıca çeşitli maddelerin kimyasal özlerini yansıtmadan önceden var olan isimleri o kadar karmaşık ve anlaşılması zordu ki hızla unutuldular. 1787'de Lavoisier, yeni bir kimyasal terminoloji oluşturmak üzere başkanlığını yaptığı özel komisyonun çalışmalarının sonuçlarını Paris'teki Bilimler Akademisi'ne duyurdu. Komisyon üyeleri - Fransa'nın önde gelen kimyagerleri - Guiton de Morveau, Berthollet ve Fourcroix, kimyasal elementlere yeni isimler verdiler ve bileşimlerinde yer alan elementlerin adlarını dikkate alarak karmaşık cisimlerin adlarını oluşturmayı önerdiler. O zamandan beri elementler, örneğin metaller, fosfor, kükürt, oksijen ve hidrojen gibi kimyasal analizle parçalara ayrılamayan maddeler olarak adlandırılmaya başlandı. İki veya daha fazla elementten oluşan tüm maddeler bileşik olarak kabul edildi.
Elementlerin isimleri, belirli bir maddenin reaksiyonunun özelliklerini yansıtacak şekilde seçilmiştir. Yani eleman John Priestley"Flojistondan arındırılmış hava" olarak kabul edilen Scheele - "ateşli hava" ve Lavoisier - "hayati hava", yeni terminolojiye göre oksijen (ohudepe) olarak adlandırılmaya başlandı, çünkü bu gaz yandığında birçok maddeyi "asitlere" dönüştürdü. “Yanıcı hava”ya hidrojen adı verildi çünkü oksijen içinde yandığında su oluştu. Komisyonun kararına göre "boğucu hava", bu gazın yanmayı ve solunumu "boğması" nedeniyle nitrojen ("boğucu madde") olarak adlandırılmaya başlandı.
Asitler, isimlerini oluştukları elementlerden alırlar. Bu nedenle, kükürt içeren asitlerden birine artık "vitriol yağı" değil, sülfürik asit deniyordu. Komisyon, fosforlu fosforik asit içeren asitleri çağırmaya karar verdi; karbon içeren asit - karbonik asit.
Yeni terminoloji ilericiydi çünkü bileşiklerin adları bileşimlerini yansıtıyordu. Bu, en son deneysel araştırma verilerini dikkate alarak maddelerin sistemleştirilmesini büyük ölçüde kolaylaştırdı.
Lavoisier kimyada devrim niteliğinde bir devrim yaptı. Ancak 18. yüzyılın tüm kimyagerleri bunu anlayamamıştı. John Priestley Bu "devrimci darbenin" hazırlanmasına kendileri de bu kadar önemli katkılarda bulunan Scheele ve Cavendish, flojiston teorisinin taraftarları olarak kaldılar. Keşiflerini modası geçmiş teorilerin ışığında açıklamaya çalıştılar. Yalnızca Lavoisier bu fenomeni tamamen farklı konumlardan değerlendirmeyi başardı. Gren gibi bazı kimyagerler iki sistemi birbirine bağlamaya çalıştı. Ancak yaklaşık yirmi yıl sonra Lavoisier'in oksijen teorisi genel kabul gördü. 19. yüzyılın başında. çalışmalarında filojiston teorisinin “dili”ni ve kavramlarını kullanacak kimyager bulmak zordu.
Yeni teori hükümlerinin, yeni kavramların ve bunları ifade eden terimlerin yaygın kullanımı, Wenzel ve Richter'in (flojiston teorisi döneminde yürütülen) deneysel çalışmalarının sonuçlarının kimyacılar tarafından açıklanmasını ve anlaşılmasını kolaylaştırdı.
Aynı sıralarda kimyadaki bir başka önemli problem çözüldü: Elementlerin birbirleriyle nasıl ve hangi niceliksel ilişkilerle birleştirildiği gösterildi. Proust, maddelerin bileşiminin sabitliği yasasını keşfetti: kimyasal elementler belirli (sabit) ağırlık oranlarında birbirleriyle birleşir. Aynı zamanda, John Dalton çoklu oranlar yasasını keşfetti: farklı bileşikler oluşturan iki elementin ağırlık oranları (örneğin, C ve O'nun CO veya CO2 yapması gibi) 1: 1, 1 gibi basit tam sayılar biçimindedir. : 2, 1: 3 vb. Bu yasadan elde edilen sonuçları uygulamada yaygın olarak kullanan Dalton, 19. yüzyılın başında. yeni bir atom teorisi (kimyasal atomizm) oluşturdu ve Jacob Berzelius kısa bir süre sonra göreceli atom ağırlıklarını [atom kütleleri] belirledi ve günümüze kadar neredeyse tamamen korunmuş olan elementler ve bileşikleri için tanımlamalar önerdi. Böylece klasik kimyanın en önemli prensipleri oluşturulmuş oldu.
Sonuç olarak, 19. yüzyılın başında. Kimyanın diğer bilgi ve üretim faaliyet alanları arasındaki yeri de değişti. Kimya, 19.-20. yüzyıllardaki sanayi devriminde giderek daha önemli bir rol oynayan, tamamen bağımsız bir bilimsel disiplin haline geldi.
KİMYASAL DEVRİM
FRANSIZ BURJEVİ DEVRİMİ VE BİLİM
Flojiston teorisinin devrilmesiyle bağlantılı kimya devrimi, Fransız burjuva devrimiyle aynı zamana denk geldi. Bu gerçek elbette tesadüf olarak kabul edilemez. Kimyasal devrim büyük ölçüde sosyo-ekonomik değişikliklerin ve toplumun zihinsel yaşamındaki değişimlerin bir sonucuydu. F. Engels bu olguyu şu sözlerle tanımladı: “Fransa'da yaklaşan devrime kafalarını aydınlatan büyük insanların kendileri son derece devrimci davrandılar. Herhangi bir dış otoriteyi tanımadılar. Din, doğa anlayışı, toplum, siyasi sistem - bunların hepsi en acımasız eleştirilere maruz kaldı; her şey mantık mahkemesinin önüne çıkmalı ve ya varlığını haklı çıkarmalı ya da ondan vazgeçmeliydi... Önceki tüm toplum ve devlet biçimleri, tüm geleneksel fikirler mantıksız olarak kabul edildi ve eski çöpler gibi bir kenara atıldı; dünyaya şimdiye kadar yalnızca önyargılar rehberlik etti ve tüm geçmiş yalnızca pişmanlık ve küçümsemeye değer.”1
Kimyasal devrim aynı zamanda bilimdeki, özellikle kimya ve fizikteki derin değişimlerin bir parçasıydı.
Birçok Fransız bilim adamı, devrim sırasında sosyal ve politik faaliyetlerde doğrudan rol aldı (G. Monge, L. Carnot, F. Fourcroix vb.). Önerilerine göre ülkede tam bir eğitim reformu gerçekleştirildi. Devrim öncesi Fransa'nın üniversiteleri tamamen Katolik din adamlarının etkisi altındaydı; modası geçmiş bir sisteme göre ders veriyorlardı. Üniversitelerle ülke sanayisi arasında hiçbir bağlantı yoktu. Paris Bilimler Akademisi ve diğer bilimsel kurumlar da adeta hayattan kopmuştu. Bilim adamlarının önerilerinin bir sonucu olarak, 1793'teki Sözleşme, yüksek öğrenimi organize etmek için yeni bir sistemi onayladı. 1794 yılında öğretmenlik sanatını öğretmek için Normal Mektep kurulmuş, inşaat mühendisleri yetiştirmek için Politeknik Mektebi açılmıştır. Başka özel eğitim kurumları da ortaya çıktı. Eski Kraliyet Botanik Bahçeleri Doğa Tarihi Müzesi'ne dönüştürüldü. Bilim ve zanaat Ulusal Konservatuarı (depo) kuruldu. Tüm bu önlemler, bilimi ve eğitimi yaşamın ve üretimin taleplerine yaklaştırmayı amaçlıyordu.
Burjuva devrimi çağı, Fransa'da bilimin gelişmesiyle damgasını vurdu. 18. yüzyılın sonunda. Fransa'da ilerlemiş
birçok yetenekli bilim adamı (J. Lagrange, G. Monge, N. Carnot, P. Laplace) ve seçkin kimyagerler ve biyologlardan oluşan bir galaksi.
A. L. LAVOISIER
Fransız burjuva devrimi döneminde kimyanın gelişmesinde en önemli rol A. L. Lavoisier'e aitti. Bu bilim adamının olağanüstü bilimsel faaliyeti, büyük burjuvazinin tipik şaibeli mali işlemleriyle birleştirildi. A. Lavoisier'in sosyo-politik görüşlerinin ileri düzeyde olduğu ve yenilikçi bilimsel çalışmalarıyla tutarlı olduğu söylenemez.
Antoine Laurent Lavoisier 26 Ağustos 1743'te doğdu. Hukuk diploması aldı ancak doğa bilimlerine, özellikle kimyaya ilgi duyuyordu ve aynı zamanda edebiyat okudu. A. Lavoisier, üniversiteden mezun olduktan sonra hukuk kariyerini bıraktı ve dikkatini doğa bilimleri alanındaki çalışmalara odakladı. Çeşitli minerallerin ve içme sularının kimyasal bileşimiyle ilgilendiği mineralojik geziler yaptı.
1764 yılında A. Lavoisier, Paris Akademisi'nin sokak aydınlatmasının en iyi yöntemi için duyurduğu yarışmaya katıldı. Yeni lamba türleri geliştirirken büyük bir azim gösterdi ve altın madalya aldı. 1768 yılında A. Lavoisier, Bilimler Akademisi'ne üye seçildi ve aynı zamanda halktan alınan vergilerin toplanmasında hissedar oldu. Büyük karlar elde eden çiftliğin hissedarları, genel olarak halkın nefretiyle kuşatılmıştı. 1771'de zengin bir iltizamcı olan Anna Maria Polz'un kızıyla evlendi.
1775 yılında A. Lavoisier, Fransa'daki barut ve güherçile işinin müdürü olarak atandı. Arsenal'e taşındı ve masrafları kendisine ait olmak üzere iyi donanımlı bir laboratuvar kurdu. Burada 15 yıl boyunca yoğun deneysel araştırmalar yürüttü ve sürekli olarak çeşitli bilimsel komisyonlara katıldı.
1789'da başlayan devrim A. Lavoisier'i
kimyada bilimsel çalışma. Devrimin ilk yıllarında ekonomik sorunlarla uğraştı, Ağırlıklar ve Ölçüler Komisyonu üyesi, milli hazine komiseri vb. görevlerde bulundu. Kısa süre sonra devrime karşı olumsuz bir tavır takınmaya başladı.
1792'de kralcılarla olan bağlantıları nedeniyle barut işinin müdürlüğü görevinden alındı. Mart 1792'de Millet Meclisi kararıyla çiftçilik kaldırıldı. Ağustos 1793'te Bilimler Akademisi kapatıldı ve aynı yılın Ekim ayında Konvansiyon eski iltizamcıların tutuklanmasına karar verdi. Soruşturmanın ardından aralarında A. Lavoisier'in de bulunduğu 28 eski iltizamcı, devrim mahkemesi tarafından ölüm cezasına çarptırıldı. 8 Mayıs 1794'te Lavoisier giyotinle idam edildi.
Bazı bilim adamları (J. Priestley, S. Blagden, J. Watt, vb.) onun bazı büyük keşiflerinin önceliğine karşı çıktılar. Ancak Lavoisier'in adı etrafında süregelen tartışmanın burjuva-milliyetçi imalara sahip olduğunu da belirtmek gerekiyor.
OKSİJEN YANMA TEORİSİ
A. Lavoisier'in ilk yayınlarından biri “Suyun Doğası Üzerine” (1769) anı kitabıydı. Çalışma, suyu karaya dönüştürme olasılığı sorusuna ayrıldı. A. Lavoisier, 101 gün boyunca cam pelikan kapta suyu ısıttı ve (K. Scheele gibi) suda grimsi toprak yapraklarının oluşumunu keşfetti. A. Lavoisier, K. Scheele'den farklı olarak bu toprağın kimyasal analizini yapmamış, ancak kabı ve kurutulmuş yaprakları tartarak bunların camın çözünmesi sonucu elde edildiğini tespit etmiştir.
O dönemde bilim adamlarını meşgul eden soruyu böylece çözen A. Lavoisier, "Havanın Doğası Üzerine" çalışmasının ana hatlarını çizdi. Çeşitli kimyasal işlemlerde havanın emilmesine ilişkin verileri inceledikten ve analiz ettikten sonra kapsamlı bir araştırma planı hazırladı: "Havanın bağlanmasını sağlamanın mümkün olduğu işlemler" diye yazdı: bitki büyümesi, hayvan solunum, bazı koşullar altında - kavurma ve son olarak bazı (diğer) kimyasal reaksiyonlar. Bu deneylere başlamam gerektiğini kabul ettim."
1772'nin ikinci yarısında A. Lavoisier, başta fosfor olmak üzere çeşitli maddelerin yanması üzerine deneylerle meşguldü. Fosforun tamamen yanması için büyük miktarda hava gerektiğini buldu. Bu gerçek için yaptığı açıklama da flojistikti. Ancak kısa süre sonra Bilimler Akademisi'ne şöyle yazdığı bir anı sundu: “... Yanma sırasında kükürtün hiç kilo vermediğini, aksine arttığını keşfettim, yani. 1 pound kükürtten yapabilirsin 1 pound'dan önemli ölçüde daha fazla vitriol elde edin... aynı şey fosfor için de söylenebilir;
bu artış, yanma sırasında bağlanan havanın çok büyük miktarda olmasından kaynaklanmaktadır”1. Ayrıca A. Lavoisier, kalsinasyon sırasında metal kütlesindeki artışın havanın emilmesiyle de açıklandığını öne sürüyor.
Ertesi yıl A. Lavoisier metallerin kalsinasyonu üzerine araştırmalar yaptı. Ayrıca yanma süreçlerinde havanın emilmesiyle ilgili başka deneyler de rapor ediyor ve havada bulunan ve yanma işlemi sırasında yanan maddelerle ilişkili olan madde hakkında (henüz kategorik bir biçimde değil) konuşuyor. Metallerin kalsinasyonuna ilişkin deneyleri anlatan A. Lavoisier, bu işlem sırasında havanın emildiğini doğruladı.
Yanma süreçleri ve yüksek sıcaklıkların çeşitli maddeler üzerindeki etkisi üzerine kapsamlı bir çalışma için A. Lavoisier, elmasları yaktığı iki büyük merceğe sahip büyük bir yangın çıkarma makinesi yaptı. Tüm bu çalışmaların sonuçları, flojiston teorisiyle tamamen çelişiyordu. A. Lavoisier'in vardığı sonuçları formüle ederken son derece dikkatli olması gerekiyordu. Ancak plana göre çalışmaya devam etti ve flojiston teorisinin tamamen asılsız olduğuna giderek daha fazla ikna oldu. 1774 yılında A. Lavoisier bu teoriye doğrudan bir saldırı başlattı. Çeşitli maddelerin yakılmasıyla ilgili deneylerinin sonuçlarını inceleyerek, kısa sürede havanın, 18. yüzyıl bilim adamlarının düşündüğü gibi basit bir cisim olmadığı, farklı özelliklere sahip gazların bir karışımı olduğu sonucuna vardı. Karışımın bir kısmı yanmayı destekledi. A. Lavoisier ampirik olarak bunun Black'in "sabit havası" olduğu varsayımını reddetti, tam tersine bu kısmın "nefes almaya en uygun" kısım olduğunu savundu.
Bu dönemde (70'li yıllar) oksijenin keşfi "havadaydı" ve kaçınılmaz hale geldi. Nitekim K. Scheele 1772'de oksijeni, J. Priestley ise 1774'te keşfetti. A. Lavoisier oksijeni hemen keşfetmedi. Metallerin "kireç" oluşumuyla kalsinasyonunu inceleyerek, havanın "en nefes alabilen" kısmının metalik "kireçten", yani herhangi bir metalin oksitlerinden elde edilebileceğine inanıyordu. Ancak girişimleri başarısız oldu ve ancak Kasım 1774'te (J. Priestley ile görüştükten sonra) cıva oksit ile deneylere geçti.
A. Lavoisier bu deneyleri iki şekilde gerçekleştirdi. Cıva oksidi kömürle kalsine ederek Black'in "sabit havasını" elde etti ve ayrıca cıva oksidi basitçe ısıttı. Ortaya çıkan gaz ona göre havanın en saf kısmıydı. A. Lavoisier ayrıca "sabit havanın" "temiz" hava ile kömürün birleşimi olduğu sonucuna vardı. Akademiye sunduğu raporda “en saf
"Havanın bir kısmı" aynı zamanda "çok nefes alan" veya "hayat veren hava"dır.
A. Lavoisier tarafından "Hayvan Nefesi Deneyleri" adlı anı kitabında önemli sonuçlar formüle edilmiştir: 1. Nefes alırken, etkileşim yalnızca atmosferik havanın saf "nefes almaya en uygun" kısmı ile gerçekleşir. Havanın geri kalanı sadece nefes alma sırasında değişmeyen inert bir ortamdır. 2. Metallerin kalsinasyonundan sonra imbikte kalan bozulmuş havanın özellikleri, hayvanın bir süredir içinde bulunduğu havanın özelliklerinden farklı değildir.
1777'den itibaren A. Lavoisier, flojiston teorisine açıkça karşı çıktı. Anılarından birinde şunları yazdı: “Kimyacılar flojistonu, kesin olarak tanımlanmamış ve bu nedenle onu dahil etmek istedikleri her türlü açıklamaya uygun, belirsiz bir prensip haline getirdiler. Bazen bu başlangıç önemlidir, bazen değildir; bazen serbest ateştir, bazen ateşin toprak elementiyle birleşimidir; bazen damarların gözeneklerinden geçer, bazen de geçilmez. Alkaliliği ve nötrlüğü, şeffaflığı ve opaklığı, rengi ve renksizliği aynı anda açıklıyor; bu, her an görünüşünü değiştiren gerçek bir Proteus."
A. Lavoisier'in bu sözlerinin, 1744'te bedenlerin gözeneklerine giren "ateşli madde" hakkında yazan M.V. Lomonosov'un formülasyonlarını anımsatması ilginçtir, "... sanki bir tür aşk iksirinden etkilenmiş gibi." sonra sanki dehşete kapılmış gibi şiddetle onları terk eder"1 2.
A. Lavoisier, “Genel Olarak Yanma Üzerine” (1777) adlı anı kitabında yanma olayını şu şekilde tanımladı: “1. Herhangi bir yanma ile “ateşli madde” veya ışık açığa çıkar. 2. Cisimler ancak çok az sayıda hava türünde yanabilir, daha doğrusu yanma yalnızca Priestley'in flojistonsuz, benim ise "saf" hava diyeceğim tek tür havada gerçekleşebilir. Yanıcı dediğimiz cisimler, boşlukta veya başka bir havada yanmadıkları gibi, sanki suya daldırılmış gibi hızla orada sönerler... 3. Herhangi bir yanma, yıkım veya “saf”ın ayrışması meydana gelir. » hava emilir ve yanmış bedenin ağırlığı tam olarak emilen hava miktarı kadar artar. 4. Herhangi bir yanmada, yanan cisim aside dönüşür... yani, eğer kükürtü bir çanın altında yakarsanız, o zaman yanma ürünü sülfürik asit olur... "3.
İkinci pozisyona dayanarak, A. Lavoisier, asitler birleştiğinde oluşan bir asit teorisi yaratır.
yanıcı maddelerden başlayarak. Bununla bağlantılı olarak asit oluşturan prensibe "oksijen" (asit veya oksijen üreten) adını verdi. A. Lavoisier'in asit teorisinin bilinen birçok gerçekle tutarsız olduğu ortaya çıktı. Böylece oksijenin katılımı olmadan hidroklorik asit oluşur. A. Lavoisier bu durumda bu asidin bileşimini açıklamak için fanteziye başvurmak zorunda kaldı. Hidroklorik asidin, asitte oksitlenmiş halde bulunan özel bir basit cisim - muriyum - içerdiğini itiraf etti. Bu nedenle yakın zamana kadar eczacılar tarafından hidroklorik asit murik asit olarak adlandırılıyordu.
Hidrojenin yanması sırasında suyun oluşması gerçeği de Lavoisier'in asit teorisiyle çelişiyordu. Birkaç yıl boyunca Lavoisier sudaki asit izlerini tespit etmeye çalıştı ancak başarısız oldu. Aynı zamanda sudaki hidrojen ve oksijenin hacimsel oranını da belirledi (12:22,9, yani neredeyse 1:2). Ancak kendisi bu sonuca hiç önem vermedi. Suyun ayrışması sırasında demir talaşlarıyla suya etki ederek hidrojen elde etti. Bu çalışmalar, flojiston teorisini yıkmak için tasarlanmış planlı bir dizi deneyin sonuncusuydu.
Bazı bilim adamlarının A. Lavoisier'in buluşlarının önceliğine ilişkin iddialarının asılsız çıktığını da belirtelim. Gerçekten de, oksijenin keşfi esasen A. Lavoisier'e aittir, F. Engels'in deyimiyle "flojistik kategorilerin esiri" olan ve tam olarak ne keşfettiklerini anlamayan K. Scheele ve J. Priestley'e değil. . Engels ayrıca şunu yazdı: "A. Lavoisier daha sonra iddia ettiği gibi oksijenin tanımını yapmamış olsa bile, diğerleriyle eşzamanlı ve onlardan bağımsız olarak yine de özünde oksijeni keşfetti, o ikisi değil, tam olarak neyi tanımladıklarını bile bilmeden sadece tanımladılar"
KİMYA LAVOISIER İLKÖĞRETİM DERSLERİ
A. Lavoisier, yanma ve solunumla ilgili antiflojistik oksijen teorisinin temellerini geliştirme sürecinde, yeni görüşlerine yönelik eleştiriler konusunda hiçbir sıkıntı yaşamadı. Bu eleştiriyle bağlantılı olarak yeni deneyler yapmak, yeni genellemeler yapmak, ileri sürülen itirazların tutarsızlığını adım adım kanıtlamak zorundaydı. Aynı zamanda amaçlanan araştırma planıyla doğrudan ilgili olmayan çeşitli sorunları da çözdü. Bu nedenle, G. Cavendish'in seyreltik asitlerin metal üzerindeki etkisi altında hidrojen oluşumunun mekanizması sorusuna ilişkin açıklamasını çürütmek zorunda kaldı. A. Lavoisier, bu durumda hidrojenin metalin ayrışması sonucu değil, asidi seyrelten suyun ayrışması sonucu açığa çıktığını belirtti (o zamanlar asit oksitler asit olarak kabul ediliyordu).
Yanma olayını açıklamada tartışmalara neden olan konular arasında ısının doğası sorusu da vardı. A. Lavoisier, ısının kinetik teorisinin çok iyi farkındaydı, ancak bir atomist değildi ve bu nedenle M.V. Lomonosov'un aksine kalorifik madde konumunda kaldı. Aynı zamanda kaloriyi temel akışkanlardan biri olarak görüyordu ve bu nedenle bu konudaki konumu ortodoks flojistiklerin konumuyla örtüşüyordu.
A. Lavoisier, reaksiyonların termal etkilerinin öncüsü olarak kabul edilir. P. Laplace ile birlikte bir kalorimetre tasarladı ve 15 yıl boyunca termal etkilerin belirlenmesi üzerinde çalıştı ve böylece termokimyanın temelini attı. A. Lavoisier ayrıca organik maddelerin bileşiminin özelliklerini belirleme konusunda da övgüyü hak ediyor. Analizlere dayanarak organik maddelerin karbon, hidrojen ve oksijenden oluştuğunu buldu. Daha sonra bu basit cisimlere nitrojen ve fosfor eklendi.
Lavoisier, kimyanın en önemli ilkelerinden birinin maddenin yok edilemezliği ilkesi olduğunu düşünüyordu. Filozistlerin, örneğin metallerin npnf kalsifikasyon kütlesindeki artışı açıklarken bu prensibi göz ardı ettikleri bilinmektedir. Bu prensibi formüle eden A. Lavoisier, üzüm suyunun fermantasyonu sonucu alkol oluşumu örneğiyle bunu açıkladı:
üzüm suyu = karbonik asit + alkol.
1785 civarında, A. Lavoisier'in aklına, keşfettiği yeni gerçekleri ve çeşitli olayların açıklamalarını oksijen teorisi açısından sistematik olarak kısa bir "Temel Kimya Kursu" ile sunma fikri geldi. Bu dersi hazırlarken, özellikle ilkeler veya basit maddeler doktrininin geliştirilmesi, kimyasal terminolojinin oluşturulması ve kimyada yeni problemlerin formülasyonu ile ilgili çeşitli temel konuları daha fazla araştırmak ve çözmek zorundaydı. oksijen teorisine dayanarak ortaya çıktı.
A. Lavoisier, dersin “Giriş Konuşması”nda basit cisimler hakkında şunları söylüyor: “Böylece kimya, cisimleri bölerek, alt bölümlere ayırarak ve daha da alt bölümlere ayırarak amacına, mükemmelliğine doğru ilerliyor ve başarısının sınırının ne olduğunu bilmiyoruz. olacak. Bu nedenle bugün basit olarak kabul edilen şeyin gerçekten basit olduğunu iddia edemeyiz. Sadece şu veya bu maddenin kimyasal analizle bölünebilme sınırı olduğunu ve bilgimizin mevcut haliyle daha fazla bölünemeyeceğini söyleyebiliriz.
Elementler hakkında daha fazla konuşan A. Lavoisier, bu kavramın net bir tanımını vermiyor: “Öyleyse, elementlerin adı cisimleri oluşturan basit veya bölünmez molekülleri ifade ediyorsa, o zaman muhtemelen onları bilmiyoruz; tam tersine, analizin ulaştığı son sınır fikrini element veya prensip adı ile ilişkilendirirsek, henüz hiçbir şekilde ayrıştıramadığımız tüm maddeler bizim için elementtir.”2
Bu tanım aslında Boyle'unkiyle örtüşmektedir.
A. Lavoisier'in “İlköğretim Kimya Kursu” üzerinde çalışırken ortaya çıkan bir diğer soru da kimyasal isimlendirmenin gelişimiydi. Sembolizmin ve maddelerin olağan isimlerini şifreleme arzusunun yaygın olduğu simya döneminde, birçok maddeye farklı yazarlardan rastgele ve çoğu zaman farklı isimler verildi. Yeni keşfedilen maddelere rastgele isim verme geleneği gelecekte de devam etti. Bu koşullar altında hiçbir kimyasal isimlendirme sistemi oluşturulamaz.
18. yüzyılda Yüzyılın ikinci yarısında bilinen maddelerin sayısı hızla arttığından, kimyagerler ve lojistikçiler bile acilen bir kimyasal isimlendirme sistemi oluşturmaya ihtiyaç duydular. Önde gelen flojistik kimyacılardan biri olan Giton de Morveau (s. 68), 1782 yılında flojiston teorisine dayanan bir kimyasal isimlendirme sistemi geliştirmeye başladı. Aynı problemle meşgul olan A. Lavoisier, de Morveau'yu kendi tarafına çekmek için çaba harcadı ve 1786'da bunu başardı. Biraz önce, o zamanın en önde gelen kimyagerlerinden C. L. Berthollet, A. Lavoisier'e katıldı (s. 68). ) ve ondan sonra - A. Fourcroix.
A. Lavoisier, bu bilim adamlarıyla birlikte, 1786'da çalışmaya başlayan Paris Akademisi'nin isimlendirme komisyonunu düzenledi. Bir yıl sonra geliştirilen isimlendirme yayınlandı. Listesi (ve sınıflandırması) A. Lavoisier'in kendisi tarafından derlenen basit cisimlerin adlarına dayanıyordu. Komisyon, yeni isimler arasında oksijen (oksijen), hidrojen (hidrojen) ve nitrojen isimlerini onayladı. Uluslararası “nitrojenyum”dan farklı olan soyadı A. Lavoisier tarafından önerilmiş ve kabul edilmesine rağmen
A. Lavoisier, “İlköğretim Kimya Kursu” girişinde şunları yazdı: “Kimyanın ilk dersinde, cisimlerin kurucu ve temel kısımları hakkında bir bölümün bulunmaması, kaçınılmaz olarak şaşkınlığa neden olacaktır, ancak burada şunu belirtmeme izin vereceğim: Doğadaki tüm cisimlerin yalnızca üç veya dört elementten oluştuğunu düşünme arzusu, Yunan filozoflarından bize aktarılan bir önyargıdan kaynaklanmaktadır."
A. Lavoisier, vücudun temel bileşenleri sorununu çözmek için gerekli gerçek verilere sahip değildi ve esas olarak kendi araştırmasının sonuçlarına güvenmek zorunda kaldı. Muhtemelen görüşlerinin belirsiz ve tutarsız olmasının nedeni budur.
komisyon üyeleri bunun başarısız olduğunu düşündü ve "nitrojen" adını önerdi. "azot", "alkalijen". A. Lavoisier'in teklifine göre "nitrojen" kelimesi "cansız" kelimesiyle çevrilmiştir. Ancak bu çeviri hatalıdır. Aslında Yunanca'da bulunmayan "nitrojen" kelimesi simya sözlüğünden alınmıştır ve burada "felsefi cıva" anlamına gelmektedir.
Karmaşık maddelerin adları (asitler, alkaliler, tuzlar vb.) basit cisimlerin türevleri olarak belirlenmiştir. Asitlerin ve tuzların adları, asit oluşturan elementin (sülfat, sülfit, sülfit vb.) oksidasyon derecesine bağlı olarak (sonlarda) değiştirildi. Elementin adının aksine nitrik asit tuzlarına nitrat adı verildi.
Yeni terminolojiyle bağlantılı olarak, A. Lavoisier'in "Temel Kurs"unda asit oluşturan elementlerin oksidasyon durumlarına göre asitlerin, tuzların ve diğer bileşiklerin sınıflandırma tabloları yer almaktadır. “Kimyasal İsimlendirme” eki, kimyagerler P. A. Ade (1763-1834) ve J. A. Gassenfratz (1755-1827) tarafından önerilen, ancak tanınmayan basit cisimlerin sembollerini içerir.
En basit bedenlere gelince, A. Lavoisier “İlköğretim Kursu”nda aşağıdaki dört grubu vurgulayarak bunların bir listesini verdi: ,
1. Doğanın üç krallığında da temsil edilen ve cisimlerin unsurları olarak kabul edilebilecek basit maddeler: ışık, kalori, oksijen, nitrojen ve hidrojen.
2. Asitleri oksitleyen ve üreten basit metalik olmayan maddeler: kükürt, fosfor, kömür, mürik asit radikali, hidroflorik asit radikali, borik asit radikali.
3. Oksitlenen ve asit üreten basit metalik maddeler: antimon, gümüş, arsenik, bizmut, kobalt, bakır, kalay, demir, manganez, cıva, molibden, nikel, altın, platin, kurşun, tungsten, çinko.
4. Basit maddeler, tuz oluşturan ve topraksı: kireç, magnezya, barit, alümina, silis.
Bu tabloya ilişkin bir notta A. Lavoisier, "kalıcı" (kostik) alkalileri basit maddeler listesine dahil etmediğini, çünkü bu maddelerin görünüşte karmaşık bir bileşime sahip olduğunu belirtti.
A. Lavoisier'in tablosu 23 basit cisim, 3 radikal, 2 asit, 5 toprak ve 2 ağırlıksız sıvı içerir. Tablo adında
Açıkça tutarsızlıklar var. Ağırlıksız sıvıların eklenmesine ek olarak, içinde "topraklar" basit maddeler olarak görünür ve son olarak metaller, asitlerin genel teorisine göre asit oluşturan elementler olarak sınıflandırılır. Bu tablo, bilim tarihinde basit cisimleri sınıflandırmaya yönelik ilk girişimdi.
A. Lavoisier'in "Temel Kimya Kursu", eşinin (M. Lavoisier) güzelce hazırlanmış çizimleriyle birlikte 1789'da, Fransız burjuva devriminin başlangıcıyla neredeyse aynı anda ortaya çıktı. Bu kursun ortaya çıkışı, A. Lavoisier'in kursta belirttiği gibi, aslında kimyasal devrime işaret ediyordu. Doğru, flojiston teorisini aktif olarak savunan J. Priestley gibi yeni kimyanın hâlâ birçok muhalifi vardı. Ancak rakiplerin sayısı hızla azaldı. Böylece İngiliz flojistikçi R. Kirwan (1733-1812) 1787 yılında “Flojiston Üzerine Deneme ve Asitlerin Oluşumu” kitabını yayımladı. A. Lavoisier ve arkadaşları bu kitabın yayımlanmasına şu şekilde karşılık verdiler: R. Kirwan Fransızcaya çevrilmiş ve her bölüm için A. Lavoisier, C. Berthollet, G. de Morveau, A. Fourque-foy ve G. Monge tarafından yazılan yorumlarla birlikte yayınlanmıştır. Bu yorumlarda R. Yıkıcı eleştirilere maruz kalan Kirwan, sonunda görüşünün hatasını kabul etmek zorunda kaldı ve 1796 yılında oksijen teorisine katıldı. /: Bununla birlikte, eski nesil filojiston teorisinin temsilcilerinin itirazlarına rağmen, kimyacılar, oksijen teorisi ve onun temelinde inşa edilen yeni kimya büyük bir zafer kazandı, ancak yine de A. Lavoisier'in kendisinin düşündüğü gibi "Temel Kimya Dersi" nin yayınlanmasıyla "kimyasal devrimin" tamamlandığı söylenemez. Yeni görüşler bölündü ve ancak atomizmin kimyaya girmesinden sonra sonraki 4. nesil kimyagerler tarafından oldukça eksiksiz bir şekilde tamamlandı.