Fosforilācijas veidi organismā. ATP sintēze oksidatīvās fosforilēšanas ceļā. Oksidatīvās fosforilācijas inhibitori
Enerģijas vadošā loma vielmaiņas ceļā ir atkarīga no procesa, kura būtība ir oksidatīvā fosforilēšanās. Uzturvielas tiek oksidētas, ražojot enerģiju, ko organisms uzglabā šūnu mitohondrijās kā ATP. Katrai zemes dzīvības formai ir savas iecienītākās uzturvielas, taču ATP ir universāls savienojums, un oksidatīvās fosforilēšanās radītā enerģija tiek uzkrāta, lai to izmantotu vielmaiņas procesos.
Baktērijas
Pirms vairāk nekā trīsarpus miljardiem gadu uz mūsu planētas parādījās pirmie dzīvie organismi. Dzīvība uz Zemes radās tāpēc, ka topošās baktērijas - prokariotiskie organismi (bez kodola) tika sadalīti divos veidos pēc elpošanas un uztura principa. Ar elpošanu - aerobos un anaerobos, un ar uzturu - heterotrofos un autotrofos prokariotos. Šis atgādinājums, visticamāk, nebūs lieks, jo oksidatīvo fosforilāciju nevar izskaidrot bez pamatjēdzieniem.
Tātad attiecībā uz skābekli (fizioloģiskā klasifikācija) prokariotus iedala aerobos mikroorganismos, kuriem nerūp brīvais skābeklis, un aerobos mikroorganismos, kuru dzīvībai svarīgā aktivitāte ir pilnībā atkarīga no tā klātbūtnes. Tieši viņi veic oksidatīvo fosforilāciju, atrodoties vidē, kas piesātināta ar brīvu skābekli. Šis ir visizplatītākais vielmaiņas ceļš ar augstu energoefektivitāti salīdzinājumā ar anaerobo fermentāciju.

Mitohondriji
Vēl viens pamatjēdziens: tas ir šūnas enerģijas akumulators. Mitohondriji atrodas citoplazmā un tur to ir neticami daudz - cilvēka muskuļos vai viņa aknās, piemēram, šūnas satur līdz pusotram tūkstotim mitohondriju (tieši tur, kur notiek visintensīvākā vielmaiņa). Un, kad oksidatīvā fosforilācija notiek mitohondriju rokās, tie arī uzglabā un izplata enerģiju.
Mitohondriji pat nav atkarīgi no šūnu dalīšanās, tie ir ļoti kustīgi, brīvi pārvietojas citoplazmā, kad tas ir nepieciešams. Viņiem ir sava DNS, un tāpēc viņi dzimst un mirst neatkarīgi. Neskatoties uz to, šūnas dzīve ir pilnībā atkarīga no tām, bez mitohondrijiem tā nedarbojas, tas ir, dzīvība patiešām nav iespējama. Tauki, ogļhidrāti un olbaltumvielas tiek oksidēti, kā rezultātā veidojas ūdeņraža atomi un elektroni - reducējošie ekvivalenti, kas virzās tālāk gar elpošanas ķēdi. Tādā veidā notiek oksidatīvā fosforilēšanās; tās mehānisms ir šķietami vienkāršs.

Nav tik viegli
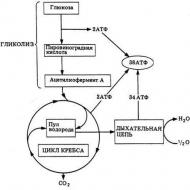
Mitohondriju radītā enerģija tiek pārvērsta citā, kas ir elektroķīmiskā gradienta enerģija tikai protoniem, kas atrodas uz mitohondriju iekšējās membrānas. Tieši šī enerģija ir nepieciešama ATP sintēzei. Un tieši tā ir oksidatīvā fosforilēšana. Bioķīmija ir diezgan jauna zinātne, tikai deviņpadsmitā gadsimta vidū šūnās tika atklātas mitohondriju granulas, un enerģijas iegūšanas process tika aprakstīts daudz vēlāk. Tika uzraudzīts, kā glikolīzes rezultātā izveidotās triozes (un vissvarīgāk pirovīnskābe) rada turpmāku oksidāciju mitohondrijās.
Triozes izmanto šķelšanās enerģiju, no kuras izdalās CO 2, tiek patērēts skābeklis un tiek sintezēts milzīgs daudzums ATP (adenozīntrifosforskābe, un kas tā ir – īpaši labi zina kultūrisma cienītāji). Visi iepriekš minētie procesi ir cieši saistīti ar oksidācijas cikliem, kā arī ar elpošanas ķēdi, kas transportē elektronus. Tādējādi šūnās notiek oksidatīvā fosforilēšanās, sintezējot tām “degvielu” - ATP molekulas.

Oksidācijas cikli un elpošanas ķēde
Oksidācijas ciklā trikarbonskābes atbrīvo elektronus, kas sāk savu ceļojumu pa elektronu transporta ķēdi: vispirms uz koenzīmu molekulām, šeit NAD ir galvenā (nikotīnamīda adenīna dinukleotīds), un pēc tam elektroni tiek pārnesti uz ETC (elektrotransporta ķēdi), līdz tie savienojas ar molekulāro skābekli un neveido ūdens molekulu. Oksidatīvā fosforilācija, kuras mehānisms ir īsi aprakstīts iepriekš, tiek pārnesta uz citu darbības vietu. Tie ir proteīnu kompleksi, kas iestrādāti mitohondriju iekšējā membrānā.
Šeit notiek kulminācija - enerģijas pārvēršana, izmantojot elementu oksidācijas un reducēšanas secību. Šeit interesanti ir trīs galvenie punkti elektriskā transporta ķēdē, kur notiek oksidatīvā fosforilēšanās. Bioķīmija šo procesu pārbauda ļoti dziļi un rūpīgi. Iespējams, no šejienes kādu dienu radīsies jauns līdzeklis pret novecošanos. Tātad trīs punktos šajā ķēdē ATP veidojas no fosfāta un ADP (adenozīna difosfāts - kas sastāv no ribozes, adenīna un divām fosforskābes daļām). Tāpēc process saņēma šādu nosaukumu.

Šūnu elpošana
Šūnu (citādi pazīstama kā audu) elpošana un oksidatīvā fosforilācija ir viena un tā paša procesa kolektīvās stadijas. Gaiss tiek izmantots katrā audu un orgānu šūnā, kur sadalās sabrukšanas produkti (tauki, ogļhidrāti, olbaltumvielas), un šī reakcija rada enerģiju, kas tiek uzkrāta veidā. Normāla plaušu elpošana atšķiras no audu elpošanas ar to, ka organismā nonāk skābeklis un ogleklis. no tā tiek noņemts dioksīds.
Organisms vienmēr ir aktīvs, tā enerģija tiek tērēta kustībām un augšanai, pašatvairošanai, aizkaitināmībai un daudziem citiem procesiem. Tieši tāpēc mitohondrijās notiek oksidatīvā fosforilācija. var iedalīt trīs līmeņos: oksidatīvā ATP veidošanās no pirovīnskābes, kā arī aminoskābēm un taukskābēm; acetil atlikumus iznīcina trikarbonskābes, pēc tam izdalās divas oglekļa dioksīda molekulas un četri ūdeņraža atomu pāri; elektroni un protoni tiek pārnesti uz molekulāro skābekli.
Papildu mehānismi
Elpošana šūnu līmenī nodrošina ADP veidošanos un papildināšanu tieši šūnās. Lai gan ķermenis var papildināt sevi citā veidā. Šim nolūkam pastāv papildu mehānismi, kas, ja nepieciešams, tiek aktivizēti, lai gan ne tik efektīvi.
Tās ir sistēmas, kurās notiek bezskābekļa ogļhidrātu sadalīšanās - glikogenolīze un glikolīze. Tā vairs nav oksidatīvā fosforilēšana; reakcijas ir nedaudz atšķirīgas. Bet šūnu elpošana nevar apstāties, jo tās procesā veidojas ļoti nepieciešamas būtisku savienojumu molekulas, ko izmanto dažādām biosintēzēm.

Enerģijas formas
Kad elektroni tiek pārnesti mitohondriju membrānā, kur notiek oksidatīvā fosforilēšanās, elpošanas ķēde no katra tā kompleksa novirza atbrīvoto enerģiju, lai pārvietotu protonus caur membrānu, tas ir, no matricas uz telpu starp membrānām. Tad veidojas potenciālu starpība. Protoni ir pozitīvi uzlādēti un atrodas starpmembrānu telpā, savukārt negatīvi lādētie darbojas no mitohondriju matricas.
Sasniedzot noteiktu potenciālu starpību, proteīnu komplekss atgriež protonus atpakaļ matricā, pārvēršot iegūto enerģiju pavisam citā, kur oksidatīvie procesi tiek savienoti ar sintētiskiem procesiem - ADP fosforilēšanos. Visā vielu oksidēšanās un protonu sūknēšanas laikā caur mitohondriju membrānu ATP sintēze neapstājas, tas ir, oksidatīvā fosforilēšanās.
Divu veidu
Oksidatīvā un substrāta fosforilēšana būtiski atšķiras viena no otras. Saskaņā ar mūsdienu koncepcijām senākās dzīvības formas varēja izmantot tikai substrāta fosforilēšanas reakcijas. Šim nolūkam ārējā vidē esošie organiskie savienojumi tika izmantoti pa diviem kanāliem - kā enerģijas avots un kā oglekļa avots. Taču šādi savienojumi vidē pamazām izžuva, un jau parādījušies organismi sāka pielāgoties, meklēt jaunus enerģijas avotus un jaunus oglekļa avotus.
Tāpēc viņi iemācījās izmantot gaismas un oglekļa dioksīda enerģiju. Bet līdz tas notika, organismi atbrīvoja enerģiju no fermentācijas oksidatīvajiem procesiem un arī uzglabāja to ATP molekulās. To sauc par substrāta fosforilēšanu, ja izmanto šķīstošo enzīmu katalīzes metodi. Raudzētais substrāts veido reducētāju, kas pārnes elektronus uz vēlamo endogēno akceptoru - acetonu, acetalhīdu, piruvātu un tamlīdzīgi, vai arī izdalās H2 - ūdeņraža gāze.
Salīdzinošās īpašības
Salīdzinot ar fermentāciju, oksidatīvajai fosforilēšanai ir daudz lielāka enerģijas izvade. Glikolīze nodrošina divu ATP kopējo izlaidi, un procesa laikā tiek sintezētas no trīsdesmit līdz trīsdesmit sešām molekulām. Elektroni pāriet uz akceptorsavienojumiem no donorsavienojumiem, izmantojot oksidācijas un reducēšanas reakcijas, radot enerģiju, kas tiek uzglabāta kā ATP.
Eikarioti šīs reakcijas veic ar proteīnu kompleksiem, kas atrodas šūnas mitohondriju membrānas iekšpusē, bet prokarioti strādā ārpusē - tās starpmembrānu telpā. Tieši šis saistīto proteīnu komplekss veido ETC (elektronu transporta ķēdi). Eikariotiem ir tikai pieci proteīnu kompleksi, savukārt prokariotiem ir daudz, un tie visi strādā ar dažādiem elektronu donoriem un to akceptoriem.

Savienojumi pārī un atvienojumi
Oksidācijas process rada elektroķīmisko potenciālu, un ar fosforilēšanas procesu šis potenciāls tiek izmantots. Tas nozīmē, ka tiek nodrošināta konjugācija, pretējā gadījumā tiek nodrošināta fosforilēšanās un oksidācijas procesu saistīšanās. No šejienes arī nosaukums – oksidatīvā fosforilācija. Savienojumam nepieciešamo elektroķīmisko potenciālu rada trīs elpošanas ķēdes kompleksi - pirmais, trešais un ceturtais, ko sauc par savienojuma punktiem.
Ja mitohondriju iekšējā membrāna ir bojāta vai tās caurlaidība ir palielinājusies atvienotāju darbības dēļ, tas noteikti izraisīs elektroķīmiskā potenciāla izzušanu vai samazināšanos, kam sekos fosforilēšanās un oksidācijas procesu atvienošana, t.i. ATP sintēzes pārtraukšana. Šo parādību, kad elektroķīmiskais potenciāls pazūd, sauc par fosforilācijas un elpošanas atsaisti.
Atvienotāji
Stāvoklis, kad substrātu oksidēšanās turpinās, bet fosforilēšanās nenotiek (tas ir, ATP neveidojas no P un ADP), ir fosforilēšanās un oksidēšanās atvienošana. Tas notiek, kad atvienotāji iejaucas procesā. Kas tie ir un uz kādiem rezultātiem viņi tiecas? Pieņemsim, ka ATP sintēze ir ievērojami samazināta, tas ir, tas tiek sintezēts mazākā daudzumā, kamēr darbojas elpošanas ķēde. Kas notiek ar enerģiju? Tas izdalās siltuma veidā. Ikviens to jūt slimības laikā ar paaugstinātu ķermeņa temperatūru.
Vai jums ir drudzis? Tas nozīmē, ka atvienotāji ir nostrādājuši. Piemēram, antibiotikas. Tās ir vājas skābes, kas izšķīst taukos. Iekļūstot šūnas starpmembrānu telpā, tie izkliedējas matricā, velkot sev līdzi saistītos protonus. Piemēram, vairogdziedzera izdalītajiem hormoniem, kas satur jodu (trijodtironīnu un tiroksīnu), ir atvienošanas efekts. Ja vairogdziedzeris hiperfunkcionē, pacientu stāvoklis ir šausmīgs: viņiem trūkst ATP enerģijas, viņi patērē daudz pārtikas, jo ķermenim ir nepieciešams daudz substrātu oksidācijai, bet viņi zaudē svaru, jo lielākā daļa saņemtās enerģijas ir zaudēts siltuma veidā.
Oksidāzes ceļš skābekļa izmantošanai šūnās
Mitohondriju bojājumu cēloņi un sekas
Mitohondriju vielmaiņas un homeostatiskās funkcijas
Mitohondriju enzīmu lokalizācija
1). Ārējā membrāna satur: a). elongāzes, fermenti, kas pagarina piesātināto taukskābju molekulas; b). kinurenīna hidroksilāze; V). monoamīnoksidāze (marķieris) utt.
2). Starpmembrānu telpa satur: a). adenilāta ciklāze; b). nukleozīdu difosfāta kināze.
3). Iekšējā membrāna satur: a). oksidatīvās fosforilēšanas ķēdes enzīmi, kuru marķieris ir citohroma oksidāze; b). SDH c). β-hidroksibutirāts DG; G). karnitīna aciltransferāze.
4). Matrica satur: a). TCA cikla fermenti; b). taukskābju β-oksidācijas enzīmi; V). aminotransferāzes AST, ALT; G). glutamāts DG d). fosfoenolpiruvāta karboksilāze e). piruvāta ĢD.
Šūnā ir no simtiem līdz tūkstošiem mitohondriju, to izmērs ir 2-3 mikroni garumā un 1 mikronu platumā.
Mitohondrijās notiek: ATP sintēze un siltuma veidošanās oksidatīvās fosforilēšanās reakcijā; taukskābju β-oksidēšana; TCA cikla reakcijas; dažas glikoneoģenēzes, transaminācijas, deaminācijas, lipoģenēzes un hema sintēzes reakcijas notiek TCA ciklā; notiek olbaltumvielu, lipīdu un ogļhidrātu metabolisma integrācija.
Iekšējās mitohondriju membrānas bojājumi ķīmisko un fizikālo faktoru ietekmē izraisa ATP sintēzes procesa traucējumus, anabolisko reakciju kavēšanu, starpmembrānu transportu un visa veida vielmaiņu.
- oksidatīvā fosforilēšana
Skābekļa izmantošanas oksidāzes ceļš sastāv no oksidācijas un fosforilēšanās procesiem, kas ir savstarpēji saistīti. Tas ietver apmēram 40 dažādus proteīnus. Oksidāzes ceļš patērē 90% O 2 un ir galvenais ATP avots aerobās šūnās.
Oksidatīvā fosforilēšana sauc par ATP sintēzi no ADP un H 3 PO 4 elektronu pārneses enerģijas dēļ gar CPE. Oksidēšanās rezultātā atbrīvo 220 kJ/mol brīvās enerģijas. 3 ATP sintēzei nepieciešams: 30,5 * 3 = 91,5 kJ/mol. Izdalās kā siltums: 220-91,5 = 128,5 kJ/mol. Efektivitāte = 40%. NADH 2 + ½O 2 → NAD + + H 2 O + 220 kJ/molADP + H 3 PO 4 + 30,5 kJ/mol = ATP + H 2 O 1). Oksidācijas ķēde (elpošanas ķēde) sastāv no 4 proteīnu kompleksiem, kas noteiktā veidā ir iebūvēti mitohondriju iekšējā membrānā un mazās mobilās ubikinona un citohroma C molekulas, kas cirkulē membrānas lipīdu slānī starp proteīnu kompleksiem. Komplekss I – NADH 2 dehidrogenāzes komplekss– lielākais no elpošanas enzīmu kompleksiem - tā molekulmasa pārsniedz 800 KDa, sastāv no vairāk nekā 22 polipeptīdu ķēdēm, satur FMN un 5 dzelzs-sēra (Fe 2 S 2 un Fe 4 S 4) proteīnus kā koenzīmus. II komplekss – SDH . Satur FAD un dzelzs-sēra proteīnu kā koenzīmus. Komplekss III — komplekss b-c 1 (enzīms QH 2 DG) , tā molekulmasa ir 500 kDa, sastāv no 8 polipeptīdu ķēdēm un, iespējams, pastāv kā dimērs. Katrs monomērs satur 3 hēmas, kas saistītas ar citohromiem b 562, b 566, c 1 un dzelzs sēra proteīnu. IV komplekss – citohromoksidāzes komplekss ir 300 KDa molekulmasa, sastāv no 8 polipeptīdu ķēdēm, eksistē dimēra formā. Katrs monomērs satur 2 citohromus (a un 3) un 2 vara atomus. Koenzīms Q (ubihinons). Lipīds, kura radikāli zīdītājiem veido 10 izoprenoīdu vienības (Q 10). Ubihinons pārnes 2H + un 2e -. ubihinons ↔ semihinons ↔ hidrohinons Citohroms c. Perifērijas ūdenī šķīstošs membrānas proteīns ar masu 12,5 KDa, satur 1 polipeptīdu ķēdi ar 100 AA un hēma molekulu.Molekulārās attiecības starp elpošanas ķēdes komponentiem dažādos audos atšķiras. Piemēram, miokardā uz 1 NADH 2 dehidrogenāzes kompleksa molekulas ir 3 b-c 1 kompleksa molekulas, 7 citohroma oksidāzes kompleksa molekulas, 9 citohroma C molekulas un 50 ubihinona molekulas. 2). Fosforilēšana ko veic ATP sintetāze (H + -ATPāze) - mitohondriju iekšējās membrānas neatņemama olbaltumviela. ATP sintāze sastāv no 2 proteīnu kompleksiem, kas apzīmēti ar F0 un F1. Hidrofobais komplekss F0 ir iegremdēts membrānā.Skābekļa patēriņa oksidāzes ceļš notiek mitohondrijās, patērē 90% O2 un nodrošina oksidatīvās fosforilēšanās procesu.
Oksidatīvā fosforilēšana To sauc par ATP sintēzi no ADP un H 3 PO 4 elektronu kustības enerģijas dēļ gar elpošanas ķēdi.
Oksidatīvā fosforilācija ir galvenais ATP avots aerobās šūnās.
Mičela ķīmijmotiskā teorija
Lai izskaidrotu oksidatīvās fosforilācijas mehānismu 1961. gadā, Mičels ierosināja ķīmijmotisko teoriju, kas ietvēra četrus neatkarīgus postulātus attiecībā uz mitohondriju funkciju:
Mitohondriju iekšējā membrāna ir necaurlaidīga visiem joniem.
Tas satur vairākus nesējproteīnus, kas transportē būtiskos metabolītus un neorganiskos jonus.
Elektroniem izejot cauri iekšējās membrānas elpošanas ķēdei, H+ pārvietojas no matricas starpmembrānu telpā.
Kad protonu gradients ir pietiekami liels, protoni sāk “plūst” caur ATP sintetāzi, ko pavada ATP sintēze.
Mūsdienu idejas par oksidatīvās fosforilācijas mehānismu
Šobrīd ir atklātas visas galvenās oksidatīvās fosforilēšanas sastāvdaļas, izpētīta to struktūra un īpašības. Atklāti oksidatīvās fosforilēšanas pamatprincipi, regulēšana un dažu posmu mehānismi.
Oksidatīvās fosforilēšanās mehānisms
Oksidatīvā fosforilēšana sastāv no procesiem oksidēšanās Un fosforilēšana , kas ir savstarpēji saistīti.
Oksidācijas process
Oksidācijas process notiek, kad elektroni pārvietojas pa elpošanas ķēdi no audu elpošanas substrātiem uz skābekli. Oksidatīvās fosforilācijas elpošanas ķēde sastāv no 4 proteīnu kompleksiem, kas iestrādāti mitohondriju iekšējā membrānā, un mazām mobilām ubikinona un citohroma C molekulām, kas cirkulē membrānas lipīdu slānī starp olbaltumvielu kompleksiem.
Komplekss es - NADH 2 dehidrogenāzes komplekss – lielākais no elpošanas enzīmu kompleksiem - tā molekulmasa pārsniedz 800 KDa, sastāv no vairāk nekā 22 polipeptīdu ķēdēm, satur FMN un 5 dzelzs-sēra (Fe 2 S 2 un Fe 4 S 4) proteīnus kā koenzīmus.
Komplekss II - SDH . Satur FAD un dzelzs-sēra proteīnu kā koenzīmus.
Komplekss III – Komplekss b - c 1 (enzīms ĀP 2 ĢD) , tā molekulmasa ir 500 kDa, sastāv no 8 polipeptīdu ķēdēm un, iespējams, pastāv kā dimērs. Katrs monomērs satur 3 hēmas, kas saistītas ar citohromiem b 562, b 566, c 1 un dzelzs sēra proteīnu.
Komplekss IV - Citohroma oksidāzes komplekss ir 300 KDa molekulmasa, sastāv no 8 polipeptīdu ķēdēm, eksistē dimēra formā. Katrs monomērs satur 2 citohromus (a un 3) un 2 vara atomus.
Koenzīms J (ubikinons). Lipīds, kura radikāli zīdītājiem veido 10 izoprenoīdu vienības (Q 10). Ubihinons pārnes 2H + un 2e -.
ubihinons ↔ semihinons ↔ hidrohinons
Citohroms c. Perifērijas ūdenī šķīstošs membrānas proteīns ar masu 12,5 kDa satur 1 polipeptīda ķēdi ar 100 AA un hēma molekulu.
Molekulārās attiecības starp elpošanas ķēdes sastāvdaļām atšķiras dažādos audos. Piemēram, miokardā uz 1 NADH 2 dehidrogenāzes kompleksa molekulas ir 3 b-c 1 kompleksa molekulas, 7 citohroma oksidāzes kompleksa molekulas, 9 citohroma C molekulas un 50 ubihinona molekulas.
Elektroķīmiskais potenciāls. Elpošanas ķēdes sastāvdaļas atrodas membrānā, lai palielinātu to redokspotenciālu. Kad e - no kompleksa ar zemu redokspotenciālu uz kompleksu ar lielāku redokspotenciālu, atbrīvojas brīvā enerģija. 1 NADH 2 oksidēšanās atbrīvo 220 kJ/mol brīvās enerģijas.
Elpošanas ķēdes I, III un IV kompleksi izmanto 65-70% šīs brīvās enerģijas, lai pārnestu H + no mitohondriju matricas uz starpmembrānu telpu, 30-35% no brīvās enerģijas izkliedējas siltuma veidā.
 Kustības posmi e
-
gar elpošanas ķēdi
Kustības posmi e
-
gar elpošanas ķēdi
2e - no NADH 2, iziet cauri kompleksam I (FMN→SFe proteīns) uz CoQ, atbrīvotā enerģija šajā gadījumā nodrošina H + sūknēšanu (H + pārneses mehānisms nav zināms).
CoQ ar 2е - paņem 2H+ no ūdens no matricas un pārvēršas par CoQH 2 (CoQ samazināšana notiek arī ar kompleksa II piedalīšanos).
CoQH 2 pārnes 2e - uz kompleksu III un 2H + starpmembrānu telpā.
Citohroms C pārnes kompleksa III e - c uz IV kompleksu.
Komplekss IV izgāž e - uz O 2 , šajā gadījumā izdalītā enerģija nodrošina H + sūknēšanu (H + pārneses mehānisms nav zināms).
Kad H + tiek pārnests no matricas uz starpmembrānu telpu, a protonu osmotiskais gradients ∆рН = 60 mV (pie ∆рН = 1) (matricā pH ir augstāks nekā citozolā). Tā kā katram H+ ir pozitīvs lādiņš, tas parādās arī uz iekšējās membrānas iespējamā atšķirība ∆V=160mV, membrānas iekšējā puse lādēta negatīvi, ārējā puse – pozitīvi.
Kopumā veidojas protonu osmotiskais gradients un potenciālu starpība elektroķīmiskais potenciāls , kas tipiskā šūnā ir aptuveni 60+160=220 mV.
H+ pārneses mehānisms cauri membrānai nav pilnībā izprotams. Iespējams, ka dažādām elpošanas ķēdes sastāvdaļām ir dažādi mehānismi e transportēšanas savienošanai ar H + kustību.
Elektroķīmisko potenciālu, kas veidojas uz iekšējās mitohondriju membrānas, izmanto:
- Katabolisma reakcijās izveidotie NADH un FADH 2 pārnes ūdeņraža atomus (t.i., ūdeņraža protonus un elektronus) uz elpošanas ķēdes enzīmiem.
- Elektroni pārvietojas caur elpošanas ķēdes enzīmiem un zaudē enerģiju.
- Šo enerģiju izmanto, lai sūknētu H+ protonus no matricas starpmembrānu telpā.
- Elpošanas ķēdes beigās elektroni ietriecas skābekli un pārvērš to ūdenī.
- H+ protoni steidzas atpakaļ matricā un iziet cauri ATP sintāzei.
- Tajā pašā laikā tie zaudē enerģiju, kas tiek izmantota ATP sintēzei.
ADP fosforilēšana par ATP;
vielu transportēšana pa mitohondriju membrānu;
Spēlē vadošo lomu enerģijas veidošanā. Ogļhidrātu, tauku un olbaltumvielu oksidēšanās rezultātā veidojas reducējošie ekvivalenti (elektroni un ūdeņraža atomi), kas tiek pārnesti pa elpošanas ķēdi. Šajā gadījumā atbrīvotā enerģija tiek pārvērsta iekšējās mitohondriju membrānas protonu elektroķīmiskā gradienta enerģijā, kas savukārt tiek izmantota ATP sintēzei. Šo procesu sauc par oksidatīvo fosforilāciju.
Triozes, kas veidojas glikolīzes rezultātā, un galvenokārt pirovīnskābe, ir iesaistītas tālākā oksidācijā, kas notiek mitohondrijās.
Tas izmanto visu ķīmisko saišu šķelšanās enerģiju, kas noved pie CO2 izdalīšanās, skābekļa patēriņa un liela ATP daudzuma sintēzes. Šie procesi ir saistīti ar trikarbonskābju oksidatīvo ciklu un elpceļu elektronu transportēšanas ķēdi, kur notiek ADP fosforilēšanās un šūnu “degvielas” – ATP molekulu – sintēze. Trikarbonskābes ciklā oksidācijas laikā atbrīvotie elektroni tiek pārnesti uz koenzīmu akceptormolekulām (NAD - nikotīnamīda adenīna dinukleotīds), kas tos iesaista tālāk elektronu transportēšanas ķēdē (ETC - elektronu transportēšanas ķēde). Šie notikumi mitohondrijās notiek to matricā. Atlikušās reakcijas, kas saistītas ar turpmāku elektronu pārnesi un ATP sintēzi, ir saistītas ar iekšējo mitohondriju membrānu, ar mitohondriju kristām. Oksidācijas procesā trikarbonskābes ciklā atbrīvotie elektroni, kas pieņemti uz koenzīmiem, pēc tam tiek pārnesti uz elpošanas ķēdi (elektronu transporta ķēde), kur tie savienojas ar molekulāro skābekli, veidojot ūdens molekulas. Elpošanas ķēde ir proteīnu kompleksu sērija, kas iestrādāta iekšējā mitohondriju membrānā, un tā ir galvenā enerģijas pārveides sistēma mitohondrijās. Šeit notiek secīga elpošanas ķēdes elementu oksidēšanās un reducēšana, kā rezultātā enerģija tiek atbrīvota nelielās porcijās. Pateicoties šai enerģijai, ATP veidojas trīs ķēdes punktos no ADP un fosfāta. Tāpēc viņi saka, ka oksidēšana (elektronu pārnese) ir saistīta ar fosforilēšanos (ADP + Phn = ATP), tas ir, notiek oksidatīvās fosforilēšanās process.
Elektronu pārneses laikā mitohondriju membrānā katrs elpošanas ķēdes komplekss virza oksidācijas brīvo enerģiju uz protonu (pozitīvo lādiņu) kustību caur membrānu, no matricas uz starpmembrānu telpu, kas noved pie potenciāla atšķirība visā membrānā: starpmembrānu telpā dominē pozitīvie lādiņi, bet starpmembrānu telpā dominē negatīvie lādiņi.mitohondriju matricas malas. Sasniedzot noteiktu potenciālu starpību (220 mV), ATP sintetāzes proteīna komplekss sāk transportēt protonus atpakaļ matricā, vienlaikus pārvēršot vienu enerģijas veidu citā: tas veido ATP no ADP un neorganiskā fosfāta. Tādā veidā oksidatīvie procesi tiek savienoti ar sintētiskajiem – ar ADP fosforilēšanos. Kamēr notiek substrātu oksidēšanās, kamēr protoni tiek sūknēti caur iekšējo mitohondriju membrānu, notiek saistītā ATP sintēze, tas ir, oksidatīvā fosforilēšanās (
NADH un FADH 2 molekulas, kas veidojas ogļhidrātu, taukskābju, spirtu un aminoskābju oksidācijas reakcijās, pēc tam nonāk mitohondrijās, kur fermenti elpošanas ķēde process tiek veikts oksidatīvā fosforilēšana.
Oksidatīvā fosforilēšana
Oksidatīvā fosforilēšana ir daudzpakāpju process, kas notiek laikā mitohondriju iekšējā membrāna un kas sastāv no reducētu ekvivalentu (NADH un FADH 2) oksidēšanas ar elpošanas ķēdes enzīmiem, un to pavada ATP sintēze.
Oksidatīvās fosforilācijas mehānismu pirmais ierosināja Pīters Mičels. Saskaņā ar šo hipotēzi elektronu pārnese, kas rodas iekšējā mitohondriju membrānā, izraisa izsūknējot H+ jonus no mitohondriju matricas uz starpmembrānu telpu. Tas rada H+ jonu koncentrācijas gradients starp citozolu un slēgto intramitohondriālo telpu. Ūdeņraža joni parasti spēj atgriezties mitohondriju matricā tikai vienā veidā - caur īpašu enzīmu, kas veido ATP. ATP sintāze.
Saskaņā ar mūsdienu koncepcijām iekšējā mitohondriju membrāna satur vairākus multienzīmu kompleksus, tostarp daudzus fermentus. Šos fermentus sauc elpošanas enzīmi, un to atrašanās vietas secība membrānā ir elpošanas ķēde vai elektronu transportēšanas ķēde(Angļu) elektronu transportēšanas ķēde).
Kopumā elpošanas ķēdes darbs ir šāds: