Hipertermija vēža ārstēšanā. Hipertermija kā viena no vēža ārstēšanas metodēm
- tieši iznīcina audzēja šūnas un metastāzes karsējot 42,5–43 °C temperatūras diapazonā visefektīvākajai vēža ārstēšanai;
- samazināt ķīmijterapijas devas līdz pat 50% ar vienlaicīgu pretvēža efekta palielināšanos un toksiskās iedarbības samazināšanos;
- pārvarēt nejutīgumu audzēji ķīmijterapijai .
- stimulēt imūnsistēmuķermenim, lai tas būtu saistīts ar cīņu pret vēzi;
- padarīt operāciju iespējamu. Krūts vēža, sarkomu, olnīcu vēža, nieru vēža un citu gadījumā 1-2 hipertermijas seansu veikšana ļauj samazināt audzēja izmēru un veikt ķirurģisku ārstēšanu, tai skaitā orgānu saglabāšanu.
- samazināt recidīvu un metastāžu risku.
Hipertermijas vēža ārstēšanas plāns:
Tūlītēji rezultāti vēža ārstēšanai ar hipertermiju:
| Diagnoze | Pacientu skaits izlasē | Pilnīga regresija | Daļēja regresija | stabilizējās zāciju | Dzīves kvalitātes uzlabošana |
| Piena vēzis T 3-4 N 0-3 M 0-1 | 855 | 14,2 % | 38,1 % | 26,4 % | 81,3 % |
| Lokāli progresējošs krūts vēzis T 4 N 2-3 M 0-1 | 121 | - | 47,6 % | 28,6 % | 76,2 % |
| Kuņģa vēzis T2-4 N0-2 M 1 | 270 | - | 22,9 % | 51,4 % | 64,3 % |
| resnās zarnas vēzis T2-4 N0-2 M 1 | 245 | - | 11,1 % | 71,1 % | 48,9 % |
| Taisnās zarnas vēzis T2-4 N0-2 M 1 | 245 | 4,4 % | 26,7 % | 53,3 % | 64,4 % |
| mīksto audu sarkomas T2bN0M 1 | 155 | 3,6 % | 36,4 % | 47,3 % | 83,6 % |
| nieru vēzis T1-3a N0-2 M 1 | 211 | - | 36,4 % | 54,5 % | 90,9 % |
| Olnīcu, dzemdes kakla, dzemdes ķermeņa vēzis T3a-3cN1M0-1 | 140 | 12,5 % | 35,0 % | 37,5 % | 65,0 % |
| Balsenes vēzis T3-4aN0-2M0-1 | 42 | - | 41,7 % | 50,0 % | 91,7 % |
| vairogdziedzera vēzis T4a-4bN1M0 | 10 | 10,0 % | 30,0 % | 30,0 % | 80,0 % |
Novērtējums tika veikts vienu mēnesi pēc procedūras. Tika ņemti vērā pacienti ar progresējošu vēzi un plašām metastāzēm, kuriem tika novērota progresēšana uz ārstēšanas fona citās slimnīcās. Iepriekš pacienti saņēma līdz 17 ķīmijterapijas kursiem.
PILNĪGA REGRESIJA
- visu bojājumu pilnīga izzušana ir labākā vēža ārstēšana.
DAĻĒJĀ REGRESIJA
- visu vai atsevišķu perēkļu lieluma samazināšanās par vairāk nekā 50%.
STABILIZĀCIJA
- perēkļu samazināšanās par mazāk nekā 50%, ja nav jaunu bojājumu, vai pieaugums ne vairāk kā par 25%.
Rezultātu izvērtēšanā ņemti vērā kontroles pētījumi: radiogrāfija un fluoroskopija; datortomogrāfija vai magnētiskās rezonanses attēlveidošana; PET CT; ultraskaņa utt.
Mirstība veicot vispārējas hipertermijas seansus ar ķīmijterapiju, tas bija 0,6% no hipertermijas seansu skaita (t.i., no 100 hipertermijas seansiem var nomirt 0,6 cilvēki). Pēdējo 12 gadu laikā klīnikā nav bijuši letāli gadījumi hipertermijas laikā.
Cik ilgi cilvēki dzīvo pēc vēža ārstēšanas ar vispārēju hipertermiju?
Aprēķins tika veikts no pirmās vispārējās hipertermijas sesijas datuma pacientiem, kuriem klīniskais efekts tika iegūts ārstēšanas rezultātā (pilnīga regresija, daļēja regresija, stabilizācija). Izdzīvošanas rādītāju aprēķins tika veikts pēc Kaplan-Meier metodes. Rezultāti ir nozīmīgi (P<0,01).
Kontrindikācijas vēža ārstēšanai ar vispārēju hipertermiju:
- smadzeņu un muguras smadzeņu audzēji, kā arī vēža metastāzes smadzenēs;
- smags vispārējais stāvoklis: smaga vēža intoksikācija, kaheksija, elpošanas mazspēja III-IV pakāpe, aknu mazspēja, nieru mazspēja, sirds un asinsvadu mazspēja, smagas sirds aritmijas;
- anēmija, leikopēnija, trombocitopēnija III-IV smaguma pakāpe.
Vairāk par metodi:
Lielākā daļa ekspertu neapšauba faktu, ka temperatūra kaitē audzēja šūnām.
Galvenais jautājums ir, kāpēc šī metode vēl nav izplatīta: kā sasildīt cilvēka ķermeni līdz tādai temperatūrai, lai audzējs nomirst, bet pacients ne?
Zinātnieki no dažādām valstīm vairāk nekā pusgadsimtu eksperimentēt ar vēža ārstēšanas metodēm ar temperatūru un karsēšanas laika periodiem. Padomju zinātnieki ar profesora piedalīšanos 80. gados slēgtajā zinātnes pilsētā Gorkijā (tagad Ņižņijnovgoroda) atrisināja šo problēmu. Tika izstrādāta vispārējas elektromagnētiskās hipertermijas metode (RF patents "Ļaundabīgo audzēju hipertermiskās elektromagnētiskās terapijas veikšanas metode"Nr. 082458, datēts ar 1994. gada 27. jūniju). Patenta īpašnieks ir kopā ar līdzautoriem.
Hipertermijas temperatūras zonas vēža ārstēšanā:
1) audzējam sasilstot līdz 38–40 °C, tā augšana var palielināties;
2) sasniedzot 40–42 °C, audzējs kļūst jutīgs pret ķīmijterapijas zālēm un jonizējošo starojumu;
3) karsējot virs 42,5 °C, tiek novērota audzēja šūnu nāve - svarīgākais efekts vēža ārstēšanā.
Temperatūras režīmi normāliem audiem ir divreiz lielāki, jo tiem ir lielāka termiskā stabilitāte. Tāpēc hipertermija ir letāla tikai slimām, nepareizi funkcionējošām vēža šūnām.
Vispārējā hipertermija ar ķīmijterapiju K-testa klīnikā tiek veikta saskaņā ar profesora I. D. Kareva metodi (RF patents Nr. 2077348, datēts ar 20.04.1997.) un tiek veikta, izmantojot sadzīves instalāciju "YUG-VCHG", kas izstrādāta ar klīnikas speciālistu piedalīšanos.
Vispārējās hipertermijas procedūras gaita:
Vēža ārstēšanas laikā pacients tiek novietots uz elektromagnētiskās instalācijas uz ūdens spilvena guļus stāvoklī.
Vispārējā hipertermija tiek veikta vispārējā anestēzijā ar mehānisko ventilāciju. Temperatūras kontrole tiek veikta, izmantojot sensorus, kas uzstādīti taisnajā zarnā, barības vadā, uz ādas, ārējā dzirdes kanālā.
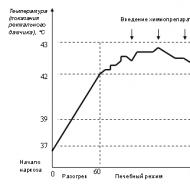
Pacienta ķermeņa temperatūra paaugstinās līdz 42,5-43 ° C un tiek uzturēta 80 minūtes; šis temperatūras intervāls ir pamata ārstēšanas režīms.
Temperatūras režīms tiek izvēlēts, ņemot vērā pacienta sākotnējo stāvokli, novērtējot komplikāciju risku, novērtējot iepriekšējo vispārējās hipertermijas sesiju rezultātus ar ķīmijterapiju.
Seansa laikā tiek kontrolēts sirds, aknu, smadzeņu dziļo struktūru sasilšanas līmenis. Lai novērstu smadzeņu tūsku, to atdzesē. Ja seansa laikā iespējams sasildīt pacienta ķermeni līdz 43 °C, tad smadzeņu temperatūru var paaugstināt tikai līdz 41 °C.

Rīsi. 2. Vispārējās hipertermijas sesijas temperatūras režīms
Uz maksimālās iesildīšanās fona mēs ieviešam ķīmijterapijas zāles, un tas ir iespējams samazinot zāļu devu par 50%, vienlaikus palielinot efektu.
Procedūras laikā tiek veikta pastāvīga ūdens un elektrolītu līdzsvara regulēšana.
Sesijas beigās iekārta tiek izslēgta, un pacients atdziest 40–80 minūtes atkarībā no ķermeņa svara. Izņemšana no anestēzijas tiek veikta 39 ° C temperatūrā.
Pēc vispārējās procedūrashipertermija :
Pirmajās stundās pēc seansa beigām pacients tiek pārvietots uz intensīvās terapijas nodaļu, kur tiek veikta infūzijas terapija, kuras mērķis ir kompensēt ūdens un elektrolītu zudumu. Dažu stundu laikā pēc procedūras pacienta ķermeņa temperatūra normalizējas.
Nākamo 1-7 dienu laikā pacientiem tiek veikta detoksikācijas infūzijas terapija, laboratoriska asins parametru kontrole.
Veicot vairākas vispārējās hipertermijas sesijas ar ķīmijterapiju, intervāls starp ārstēšanas kursiem ir trīs nedēļas.
Ārstēšanas rezultātus spēcīgi ietekmē vispārējās hipertermijas un temperatūras režīma sesiju skaits. Temperatūras režīma 42,5-43 °C izmantošana ļauj uzlabot ārstēšanas rezultātus par 17-20% un samazināt cilvēku skaitu ar slimības progresēšanu nekā ar temperatūras režīmu 42,3-42,5 °C. Temperatūras režīma izvēli katram pacientam nosaka vispārējais stāvoklis, vienlaicīgu slimību klātbūtne utt.
Vēža ārstēšanā optimālais vispārējās hipertermijas skaits ir 4 procedūras 42,5–43 °C temperatūrā. Tas ir pietiekami, lai sasniegtu vairumam audzēju regresiju, iegūstot subjektīvu efektu un uzlabojot pacientu dzīves kvalitāti.
Dzīves kvalitātes un labklājības novērtējums pēc hipertermijas:
- sāpju sindroma izzušana vai intensitātes samazināšanās;
- fiziskās aktivitātes palielināšanās;
- elpas trūkuma samazināšanās utt.
Pacienti piedzīvo ievērojamu sāpju intensitātes samazināšanos jau otrajā dienā pēc hipertermijas. Vājuma samazināšanās, elpas trūkums, svara pieaugums parasti tiek novērots 7–14 dienas pēc hipertermijas. Diseminētā krūts vēža gadījumā hipertermijas subjektīvā ietekme 42,5–43 °C temperatūrā dzīves kvalitātes uzlabošanās tika novērota vairāk nekā 95% pacientu.
Jāņem vērā, ka temperatūras ietekme uz netipiskiem audiem neietilpst radiofrekvences ablācijas grupā, tā ir pavisam cita tehnika. Kombinācijā ar staru terapiju termiskās iedarbības metodi sauc par termoradioterapiju.
Hipertermija onkoloģijā: kas tas ir?
Starptautiskajā onkoloģijā vēl nav izveidots vienots viedoklis par to, kuri temperatūras rādītāji ir visdrošākie un vienlaikus arī efektīvākie. Ārstēšanas laikā ķermeņa temperatūra parasti sasniedz līmeni no 39,5 līdz 40,5 ° C. Tomēr citi pētnieki definē hipertermiju no 41,8 līdz 42 ° C, kas ir izplatīta Eiropā un Amerikas Savienotajās Valstīs. Japānā un Krievijā ir visaugstākie temperatūras rādītāji ° C.
Temperatūra un ekspozīcijas laiks ir savstarpēji saistīti. Ilgāks ilgums un augstākas temperatūras ir ļoti efektīvas vēža šūnu nogalināšanā, taču tās arī diezgan nopietni palielina toksicitātes risku. Audzēja šūnām ar neorganizētu un kompaktu asinsvadu struktūru ir ļoti grūti noņemt siltumu, kas veicina apoptozes (fizioloģiski ieprogrammētas šūnu nāves veida) stimulāciju to attiecībās vai normālu nāvi. Tā kā veseliem audiem ir labāka siltumvadītspēja, un tāpēc tie labāk iztur augstu temperatūru.
Pat ja vēža šūnas nekavējoties nemirst, vēža terapijā vai ķīmijterapijā tās var kļūt jutīgākas pret jonizējošo starojumu. Siltums lokālas hipertermijas laikā paplašina audzēja asinsvadus, palīdzot palielināt audzēja piesātinājumu ar skābekli (skābekļa piesātinājumu), tādējādi padarot vēža staru terapiju efektīvāku. Skābeklis ir spēcīgs radiosensibilizators, kas, veidojot DNS bojājumus, būtiski palielina noteiktās starojuma devas efektivitāti. Audzēja šūnas ar skābekļa trūkumu var būt 2-3 reizes izturīgākas pret radiācijas bojājumiem nekā parastā skābekļa vidē.
Ir pierādīts, ka hipertermija ir ļoti efektīva, ja to kombinē ar ķīmijterapiju. Publicētie pētījumi liecina par 10 gadu recidīvu un bezmetastāzēm dzīvildzes uzlabošanos pacientiem ar urīnpūšļa vēzi, kuri saņēma kombinētu ārstēšanu ar hipertermiju un ķīmijterapiju. 53% pacientu dzīvoja 10 turpmākos gadus, savukārt ķīmijterapija vien nodrošināja izdzīvošanu tikai 15% pacientu.
Intensīva karsēšana izraisa šūnu proteīnu denaturāciju un koagulāciju, kas ātri iznīcina audzēja šūnas. Ilgāka, mērena karsēšana līdz tikai dažiem grādiem virs normas var izraisīt smalkākas strukturālas izmaiņas šūnās. Viegla termiskā apstrāde kombinācijā ar citām metodēm var izraisīt šūnu nāvi bioloģiskās iznīcināšanas stimulēšanas dēļ.
No mīnusiem eksperti atzīmē daudzas siltuma šoka bioķīmiskās sekas normālās šūnās, tostarp augšanas aizkavēšanos un paaugstinātu jutību pret turpmāko jonizējošo radioaktīvo terapiju.
Hipertermija palielina asins plūsmu apsildāmajā zonā, kas var dubultot asins plūsmu audzējos. Šī parādība palielina ķīmijterapijas līdzekļu pozitīvo ietekmi patoloģiskajās zonās.
Viegla hipertermija, kas nodrošina dabiski siltu temperatūru daudzu infekcijas slimību gadījumā, var stimulēt dabiskus imunoloģiskos uzbrukumus audzējiem. Tomēr tas arī izraisa dabisku fizioloģisku reakciju, ko sauc par termotoleranci, kas mēdz aizsargāt patoloģiskas šūnas.
Ļoti augsta temperatūra, virs 50°C, tiek izmantota ablācijai – noteiktu audzēju tiešai iznīcināšanai. Tehnika izmanto ieliktņus metāla caurules veidā tieši audzējā, kura gals tiek uzkarsēts, kas izraisa šūnu nāvi gar tā perimetru.
Ir vērts uzsvērt, ka hipertermiskās ablācijas tehnika Krievijā joprojām tiek pētīta, un to reti izmanto praktiskajā medicīnā. Taču pārbaužu efektivitāte šai metodei paredz ļoti labas izredzes, arī mūsu valstī.
Vietējās, reģionālās un vispārējās hipertermijas metožu atšķirības un iezīmes
Tos, kā likums, izmanto trīs versijās atkarībā no indikācijām un terapeitiskajām iespējām.
Ļoti maza platība tiek uzkarsēta, parasti pašā audzējā. Dažos gadījumos metodes mērķis ir iznīcināt patoloģiskas šūnas, karsējot, nesabojājot apkārtējos audus. Siltumu var stimulēt ar:
- ultraīsie viļņi;
- augstas radio frekvences;
- ultraskaņas enerģija;
- izmantojot magnētisko hipertermiju.
Atkarībā no audzēja atrašanās vietas, izmantojot adatas vai zondes, siltumu var pielietot ķermeņa virsmai, audos vai dziļāk. Viens salīdzinoši izplatīts veids ir mazu audzēju radiofrekvences ablācija. Terapeitiskais mērķis ir visvieglāk sasniedzams, ja audzējs atrodas uz ķermeņa virsmas (virspusēja hipertermija), vai arī ir iespējams ievietot adatas vai zondes tieši audzējā (intersticiāla hipertermija).
- Reģionālā hipertermija
Tiek uzkarsēta liela ķermeņa daļa, piemēram, viss orgāns vai ekstremitāte. Parasti metodes mērķis ir novājināt vēža šūnas tā, lai panāktu to nāvi ar sekojošu starojumu vai ķīmijterapijas līdzekļu iedarbību. Tāpat kā iepriekšējā metodē, reģionālā hipertermija var izmantot tās pašas virspusējas vai intersticiālas metodes vai paļauties uz asins perfūziju. Perfūzijas procesā pacienta asinis tiek izņemtas no ķermeņa, uzkarsētas un atgrieztas asinsvados, kas ved tieši uz vēlamo ķermeņa daļu. Parasti ķīmijterapijas zāles lieto vienlaikus.
Viens no šīs pieejas specializētajiem veidiem ir nepārtraukta peritoneālā perfūzija, ko izmanto, lai ārstētu sarežģītas intraabdominālas neoplazmas, tostarp primāro vēdera mezoteliomu un kuņģa vēzi. Karstās ķīmijterapijas zāles injicē tieši vēderā, lai iznīcinātu vēža šūnas.
Viss ķermenis uzsilst līdz temperatūrai no 39 līdz 43 ° C un augstāk. Šo metodi parasti izmanto metastātiska vēža ārstēšanai. Tas ietver infrasarkano hipertermisko kupolu izmantošanu, zem kuriem tiek novietots viss pacienta ķermenis, izņemot galvu. Citas metodes ietver pacienta ievietošanu ļoti karstā kamerā vai ietīšanu apsildāmās, mitrās segās. No retajām metodēm tiek izmantoti speciāli hidrotērpi ar pastāvīgu karsēšanu vai iegremdēšanu karstā vaskā.
Kādus vēža veidus var ārstēt ar hipertermiju?
Viena pati hipertermija ir pierādījusi unikālu spēju ārstēt ļaundabīgus audzējus. Ir arī zināms, ka šī tehnika ievērojami palielina citu ārstēšanas metožu efektivitāti.
Kombinācijā ar radioaktīvo starojumu hipertermija ir īpaši efektīva liela skābekļa daudzuma klātbūtnē, ja vienlaicīga iedarbība ir vismaz stundu.
Pēdējo desmit gadu laikā hipertermija kombinācijā ar starojumu ārstnieciskos nolūkos izmantota pacientiem ar šādām diagnozēm:
- krūts vēzis agrīnā stadijā;
- ar vēža lokalizāciju uz galvas un kakla;
- prostatas vēzis.
Slavenās zinātniskās publikācijas liecina par uzlabošanos 38% pacientu ar urīnpūšļa vēzi kombinācijā ar ķīmijterapiju, salīdzinot ar ķīmijterapiju atsevišķi. Krūts vēža pacientiem rezultāts uzlaboja atbildes reakciju 18% pacientu.
Kādi citi vēža veidi uzrāda ievērojamus uzlabojumus, ārstējot hipertermiju?
- Melanoma un ādas vēzis.
- Mīksto audu sarkoma.
- Urīnpūšļa vēzis.
- Dzemdes kakla vēzis.
- Taisnās zarnas vēzis.
- Ļaundabīgi audzēji paduses un krūškurvja sieniņās.
- Metastāzes limfmezglos.
Pētījumi Krievijā ir parādījuši interesantus rezultātus ar augstu hipertermiju 43,5-44 ° C temperatūrā, ja šī metode ir piemērota:
- barības vada vēzis;
- balsenes vēzis;
- aknu vēzis;
- ar HIV infekciju un imūnsistēmas traucējumiem.
Audzēju ablācija ir viena no hipertermijas šķirnēm.
Radiofrekvenču ablācija (RFA), iespējams, ir visbiežāk izmantotais lokalizētas hipertermijas veids. Augstas frekvences radioviļņus izmanto, lai paaugstinātu temperatūru.
- Plāna adatas zonde tiek ievietota audzējā uz īsu laiku, parasti 10 līdz 30 minūtes.
- Zondes novietojums tiek pielāgots, izmantojot ultraskaņu, MRI vai CT.
- Zondes gals nodrošina augstfrekvences strāvu, kas spēj radīt siltumu no 40 līdz 60°C, kas izraisa šūnu nāvi noteiktā apgabalā.
- Atmirušās šūnas netiek noņemtas, kļūst par rētaudi un laika gaitā izšķīst.
RFA visbiežāk izmanto, lai ārstētu audzējus, kurus nevar ķirurģiski noņemt, vai pacientiem, kuri dažādu iemeslu dēļ nav izoperējami. Procedūru var veikt ambulatorā veidā. Ablācijas atkārtojumi ir iespējami audzējiem, kas var atkārtoties. RFA var pievienot arī citiem terapeitiskiem pasākumiem, tostarp audzēja ķirurģiskai noņemšanai, staru terapijai, ķīmijterapijai, infūzijas terapijai, alkohola ablācijai vai ķīmijembolizācijai.
Ar RFA var ārstēt audzējus ar diametru līdz 5 cm.Paņēmiens ir visefektīvākais aknu, nieru un plaušu bojājumu ārstēšanā. Pašlaik tiek pētīta tā izmantošana citās ķermeņa zonās. Ilgtermiņa efektivitāte pēc hipertermiskās ablācijas ārstēšanas vēl nav zināma, taču agrīnie rezultāti ir iepriecinoši.
Iespējamās hipertermijas komplikācijas un blakusparādības
Augstas temperatūras lietošana var izraisīt audu apdegumus, mērķorgāna bojājumus, īpaši reģionālās ārstēšanas gadījumos. Bojājuma pakāpe mainīsies atkarībā no iedarbības laika, temperatūras un audu veida. Visjutīgākie pret šo metodi ir smadzeņu un plaušu audi.
- Tūska.
- Trombu veidošanās.
- Iekšējā asiņošana.
- Sirds un asinsvadu sistēmas traucējumi.
Saderībai ar radioaktīvo apstarošanu vai ķīmijterapiju ir diezgan spēcīga toksicitāte, kas parasti izpaužas vairākas stundas pēc procedūras un dažkārt var izraisīt diezgan smagus traucējumus.
Izmantojot un pārdrukājot materiālu, nepieciešama aktīva saite uz vietni!
Normālos fizioloģiskos apstākļos hipotalāms uztur aptuveni 37ºС temperatūru, kas var mainīties atkarībā no diennakts laika. Viszemākie rādītāji tiek novēroti agrās rīta stundās, un ķermeņa temperatūra maksimumu sasniedz dienas vidū. Līdz vakaram ķermeņa termiskais stāvoklis ir 36,5 - 37 ºС.
Temperatūra vēža gadījumā - simptomi, cēloņi
- Hipertermija virs 38 ºС.
- Hronisks nogurums.
- Pulsējošas galvassāpes.
- Akūts, mitrs klepus.
- Audzējs sāp.
Vai vēža gadījumā ir temperatūra? Onkoloģisko slimību gadījumā hipertermijas rādītāji galvenokārt tiek novēroti līdz subfebrīla rādītājiem (37 ºС - 38 ºС). Šādi temperatūras rādītāji norāda uz tā saukto "zemas pakāpes drudzi". Šim ķermeņa stāvoklim dažos gadījumos nav nepieciešama īpaša ārstēšana, īpaši, ja subfebrīla rādītāji tiek saglabāti īsu laiku.
Kādai jābūt temperatūrai?
Terapeitiskās hipertermijas metodes
- Intrakavitāra vai intralumināla pieeja. Šīs metodes izmanto barības vada vēža bojājumiem un "taisnās zarnas vēža" diagnostikai. Tehnika tiek veikta, izmantojot īpašu apsildāmu zondi, kas tiek ievietota attiecīgajā orgānā.
Visa ķermeņa hipertermija
- Vai tu esi šeit:
- mājas
- VĒŽA ĀRSTĒŠANA
- Kādai jābūt temperatūrai vēža gadījumā?
Onkoloģija 2018. Visi vietnes materiāli ir ievietoti tikai informatīvos nolūkos un nevar būt par pamatu nekādu lēmumu pieņemšanai par pašapstrādi, tostarp. Visas autortiesības uz materiāliem pieder to attiecīgajiem īpašniekiem
temperatūra vēža gadījumā
Vēža drudžains stāvoklis var nozīmēt organisma inficēšanos ar baktēriju mikroorganismiem vai vīrusiem. Tāpat nereti temperatūra vēža gadījumā tiek novērota 3-4 onkoloģiskā procesa stadijās.
Normālos fizioloģiskos apstākļos hipotalāms uztur aptuveni 37ºC temperatūru, kas var mainīties atkarībā no diennakts laika. Viszemākie rādītāji tiek novēroti agrās rīta stundās, un ķermeņa temperatūra maksimumu sasniedz dienas vidū. Līdz vakaram ķermeņa termiskais stāvoklis ir 36,5 - 37 ºС.
Augsts drudzis vēža gadījumā ir saistīts ar ķermeņa temperatūras paaugstināšanos virs 38ºC, kas nozīmē iekšēja patoloģiska procesa klātbūtni. Šis stāvoklis tiek uzskatīts par diezgan izplatītu simptomu daudziem vēža veidiem.
Temperatūra vēža gadījumā - simptomi, cēloņi
Infekcijas drudzi vēža gadījumā parasti pavada šādi simptomi:
- Hipertermija virs 38 ºС.
- Palpējot, pacientiem bieži ir karsta āda.
- Aukstuma sajūta un trīce visā ķermenī.
- Sāpes augšējās un apakšējās ekstremitātēs.
- Hronisks nogurums.
- Dedzinošas sāpes urinēšanas laikā.
- Gremošanas sistēmas traucējumi caurejas veidā.
- Pulsējošas galvassāpes.
- Biežas reiboņa lēkmes.
- Sāpes nazofarneksā un mutes dobumā.
- Akūts, mitrs klepus.
- Lokalizētu sāpju parādīšanās vienā ķermeņa daļā.
- Audzējs sāp.
Vai vēža gadījumā ir temperatūra? Onkoloģisko slimību gadījumā hipertermijas rādītāji galvenokārt tiek novēroti līdz subfebrīla rādītājiem (37 ºС - 38 ºС). Šādi temperatūras rādītāji norāda uz tā saukto "zemas pakāpes drudzi". Šim ķermeņa stāvoklim dažos gadījumos nav nepieciešama īpaša ārstēšana, īpaši, ja subfebrīla rādītāji tiek saglabāti īsu laiku.
Ar vēzi specifiskas pretvēža terapijas periodā ir arī temperatūra.
Kādai jābūt temperatūrai vēža gadījumā?
Kādai jābūt temperatūrai vēža gadījumā? Drudža stāvoklis onkoloģijā iziet trīs secīgas fāzes:
- Paaugstināt ķermeņa temperatūru. Reaģējot uz bakteriālas un vīrusu infekcijas iekļūšanu vai patoloģiska procesa veidošanos, cilvēka organisms ražo palielinātu leikocītu skaitu, kuru masa pakāpeniski palielinās asinsrites un limfātiskajā sistēmā. Liels skaits balto asins šūnu ietekmē hipotalāmu, kas izraisa hipertermiju. Agrīnās drudža stadijās pacients ļoti bieži jūt aukstumu un drebuļus. Tā ir ādas un muskuļu virsmas slāņu reakcija uz ķermeņa temperatūras paaugstināšanos. Šīs parādības būtība ir epidermas asinsvadu sašaurināšanās, kas veicina maksimālu iekšējās termijas saglabāšanu. Arī atbildes reakcija tiek uzskatīta par periodisku muskuļu kontrakciju asinsvadu sistēmas stenozes rezultātā.
- Hipertermijas otrajā fāzē tiek līdzsvaroti siltuma pārneses procesi, kas klīniski izpaužas ar hipertermiskā stāvokļa stabilizēšanos. Tā, piemēram, temperatūra plaušu vēža gadījumā mēnešiem var būt robežās no 37 ºС - 37,5 ºС, neradot vēža pacientam īpaši neērtas sajūtas.
- Ķermeņa dzesēšana. Hipertermijas beigu fāzē notiek virspusējo asinsvadu atvēršanās, kas izraisa stipru svīšanu un līdz ar to arī ķermeņa temperatūras pazemināšanos. Šāds process parasti tiek stimulēts ar farmaceitisko līdzekļu palīdzību, lai gan dažos klīniskos gadījumos tiek novērota paštermoregulācija.
Hipertermijas izmantošana vēža terapijā
Kāda temperatūra vēža gadījumā ar ļaundabīgu bojājumu ir nepieciešama, lai sasniegtu maksimālos terapeitiskos rezultātus? Dažos klīniskos gadījumos ķermeņa termoregulācijas rādītāji 37,5 ºС - 38,0 ºС veicina patoloģisko šūnu jutības palielināšanos pret ļoti aktīvā rentgena starojuma iedarbību. Ķermeņa hipertermiskais stāvoklis kombinācijā ar staru terapiju nodrošina ātrāku pretvēža iedarbību liela skaita mutācijas audu iznīcināšanas veidā.
Terapeitiskās hipertermijas metodes
Līdz šim tiek izstrādātas dažas metodes mākslīgai ķermeņa temperatūras paaugstināšanai.
Šis paņēmiens ietver lokālu termisku iedarbību uz ķermeņa daļu, kur vēzis jau ir izveidojies. Atkarībā no audzēja lokalizācijas pastāv šādi lokālās hipertermijas veidi:
- Ārēja pieeja, kurā siltumenerģija tiek pielietota vai nu ādas virsmai, vai zemādas slānim. Šīs darbības galvenokārt ir lietojumprogrammas.
- Intrakavitāra vai intralumināla pieeja. Šīs metodes izmanto barības vada vēža bojājumiem un "taisnās zarnas vēža" diagnostikai. Tehnika tiek veikta, izmantojot īpašu apsildāmu zondi, kas tiek ievietota attiecīgajā orgānā.
- Starpposma metodes ir indicētas dziļi lokalizētu orgānu, piemēram, galvas un muguras smadzeņu, onkoloģiskām slimībām. Speciāls radiofrekvences sensors vietējā anestēzijā tiek nogādāts primārajā patoloģijas fokusā, izraisot tajā hipertermiskas izmaiņas.
Tas sastāv no lielu ķermeņa vai ekstremitāšu zonu apsildīšanas.
Visa ķermeņa hipertermija
Šo metodi izmanto vairākiem metastātiskiem bojājumiem. Sistēmiskā ķermeņa temperatūras paaugstināšanās parasti tiek panākta īpašās termiskās kamerās.
Ir svarīgi zināt:
Pievienot komentāru Atcelt atbildi
Kategorijas:
Informācija šajā vietnē ir sniegta tikai informatīviem nolūkiem! Aprakstītās metodes un receptes vēža ārstēšanai nav ieteicams lietot patstāvīgi un bez konsultēšanās ar ārstu!
Pirts pret vēzi
Šis gadījums mani saveda kopā ar sievieti, kura tika izārstēta no dzemdes vēža, burtiski guļot uz plīts. Slimība bija ārkārtīgi novārtā, ceturtajā stadijā. Ārsti uzskatīja, ka viņa dzīvos ne vairāk kā gadu. Pacients atteicās no ķīmijterapijas un devās mājās uz ciematu. Lielāko daļu laika viņa pavadīja, sēžot pie krievu plīts vai guļot uz tās. Vairākas stundas pēc kārtas viņa izturēja maksimālo temperatūru un pat ietina muguru segās. Pēc četriem gadiem, kad mēs atkal satikāmies, viņa jutās vesela. Šis gadījums mani ļoti ieinteresēja. Galu galā ir labi zināms, ka oficiālajā onkoloģijā jebkuras termiskās procedūras tiek uzskatītas par nepieņemamām.
Tomēr ideja par vēža ārstēšanu ar karstumu nav jauna, tā jau sen ir apspriesta literatūrā. Šīs idejas atbalstītāji balstās uz faktu, ka vēža šūnas ir ļoti jutīgas pret paaugstinātu temperatūru - 40 ° temperatūrā tās pārtrauc attīstīties. Dziednieks Aleksandrs Vinokurovs apgalvo, ka, pakļaujot šādu temperatūru uz ķermeņa 10 dienas, vēža šūnas iet bojā, savukārt normālas šūnas nemainās, pilnībā saglabājot savas funkcijas.
Vislabākie rezultāti ar hipertermisko procedūru palīdzību tika iegūti ar krūts audzējiem, ļaundabīgām limfomām, resnās zarnas, prostatas, balsenes, vairogdziedzera, nieru, kuņģa un zarnu vēzi, sarkomām. Saskaņā ar veiktajiem pētījumiem no 1400 pacientiem, kas piecus gadus tika ārstēti ar šādām procedūrām, aptuveni 80% bija manāms uzlabojums - primāro un metastātisku audzēju augšanas pārtraukšana. Visas sāpes apstājās pēc pirmās sesijas. Vairāk nekā 60% pacientu slimības IV stadijā pēc vairākām ārstēšanas sesijām metastāzes un intoksikācijas simptomi pazuda. Vispārējās hipertermijas iekļaušana terapeitisko pasākumu kompleksā pēc radikālas operācijas ievērojami samazina recidīvu skaitu un samazina vēža recidīvu risku.
Mēģināsim izprast augstas temperatūras ietekmes mehānismu uz vēža šūnām.
Saskaņā ar vienu teoriju onkoloģiskās slimības ir saistītas ar vīrusa RNS ievadīšanu šūnas genomā vai citoplazmā. Ir pamats uzskatīt, ka hipertermiskās procedūras noved pie vīrusa un svešās RNS atdalīšanas no mātes šūnas. Piespiesti doties ārā, viņi kļūst par imūnšūnu laupījumu. Viņu tālākais liktenis ir atkarīgs no imunitātes līmeņa. Tāpēc viena no svarīgākajām jomām vēža ārstēšanā ir imūnsistēmas stiprināšana.
Bet atpakaļ pie augstas temperatūras ietekmes uz šūnām. Tika konstatēts, ka 43,5 ° temperatūrā vēža šūnas mirst. Tomēr šo kritisko temperatūru var uzturēt tikai īsu laiku. Tāpēc, manuprāt, pieņemamākas ir metodes, kas vērstas uz 40-42 °, bet ar ilgstošu efektu.
Zinātnieki, kuri izstrādāja hipertermisku ārstēšanu, ņēma vērā arī audzēja šūnu spēju enerģiski patērēt glikozi. Pastāvīgs glikozes deficīts ir dabisks ierobežojošs faktors vēža šūnu augšanā un dalīšanā. Ir ierosināts, ka, ja jūs īpaši piesātināsiet asinis ar glikozi, vēža šūnas sāks to absorbēt bez jebkādiem ierobežojumiem, nonākot enerģijas pārpilnības stāvoklī.
Šis process tiek pastiprināts, palielinoties temperatūrai. Šūnas, kas aktīvi patērē glikozi pēc termiskās stimulācijas, sāk piedzīvot glikozes enerģijas ražošanas atkritumu pārstrādes krīzi. Tajās uzkrājošās organisko skābju molekulas izraisa strauju barotnes skābuma maiņu, kas nav savienojama ar šūnu membrānu pretestības robežām. Tas darbojas kā detonators – notiek aktīvo vēža šūnu spontāna aizdegšanās. Tāpēc termisko procedūru laikā pacientam vēlams dot glikozi (piemēram, medus veidā).
Tomēr teorētiskās prognozes pilnībā nesaskanēja ar praktisko pētījumu rezultātiem. Izrādījās, ka vēža audzējs pēc struktūras ir neviendabīgs. Ne visas tajā esošās šūnas atrodas aktīvas dalīšanas un bagātīgas glikozes uzsūkšanās stāvoklī. Katrā audzējā ir priviliģēti aktīvi augošu šūnu un perifēro šūnu kopumi, kas ir nobīdīti malā no limfātiskajiem un asinsvadiem. Pagaidām audzēja perifērie slāņi atrodas relatīvā miera stāvoklī.
Eksperimentālā prakse ir apstiprinājusi, ka hipertermija kombinācijā ar hiperglikēmiju (cukura pārpalikumu) patiešām nodrošina audzēja audu iznīcināšanu. Bet tajā pašā laikā izrādījās, ka neliela daļa no audzēja šūnām joprojām nemirst, neskatoties uz plašo tās lielākās daļas nekrozi. Šī iemesla dēļ drīz parādījās slimības recidīvs. Atkārtošanās avots izrādījās atstumtas vēža šūnas, kas iepriekš bija pasīvās. Pēc bagāto kaimiņu iznīcināšanas šīs šūnas pamodās un sāka augt.
Tādējādi hipertermiskā iedarbība, kas pārsniedz optimālo (43 °C vai vairāk), kas izraisa aktīvo onkošūnu nekrozi, vispār neietekmē miera stāvoklī esošos audzēja slāņus. Temperatūra optimālā robežās (līdz 42 °) pārnes tos no miera stāvokļa uz aktīvāku un līdz ar to termojutīgāku. Atliek tikai izvēlēties vēlamo ekspozīcijas ciklu režīmu, lai audzējs sāktu izzust ne tikai tā aktīvi augošajā centrā, bet arī gar perifēriju.
Daudzi dziednieki uzskata, ka audzējam nevajadzētu nekrotēties (nomirt), bet lēnām izzust. Lai to izdarītu, ir jāievēro ļoti šauras optimālās temperatūras efekta robežas. Pārsniedzot augšējo robežu, sākas audzēja nekroze. Optimālās robežās audzējs lēnām izzūd, ko veicina imunitātes nostiprināšanās. Tāpēc hipertermiskās terapijas periodā ļoti vēlams lietot tādus efektīvus imūnmodulatorus kā T-aktivīns vai diucifons – zāles, kas stiprina imūno formulu, palielina limfocītu skaitu asinīs un limfā, kā arī T-šūnas, killer šūnas, kas iznīcina onkošūnas un mikroorganismus organisma iekšējā vidē. Temperatūra, kas zemāka par šīm robežām, nenomāc vēža šūnas un, iespējams, pat stimulē tās. Tieši šīs temperatūras oficiālajā medicīnā tiek uzskatītas par kontrindicētām onkoloģiskām slimībām. Kad onkologi saka, ka karsēšana var palielināt audzēju progresēšanu un metastāzes, viņi neņem vērā īpaši augstas temperatūras ietekmi.
Tomēr īpaši augsta temperatūra, kā jau minēts, neizslēdz slimības atkārtošanos. Šķiet, ka dažu pētnieku neveiksmes skaidrojamas ar to, ka viņi ārstēšanas laikā noteica ierobežojošo temperatūru un nepievērsa pietiekamu uzmanību audzēja šūnu iedarbības ilgumam. Man šķiet, ka visefektīvākā onkoloģisko slimību ārstēšanā ir maigāka temperatūra (40 -42°) ar ilgāku, līdz ar to dziļāku un viendabīgāku efektu.
Šim nolūkam lieliski noder Aleksandra Vinokurova piedāvātā mājas pirts (skat. attēlu).
Mājas pirtī temperatūru uztur elektriskā sildītājs (piemēram, parasta sadzīves krāsns ar jaudu 1,5 kW), kas uzsilda 2-3 ar akmeņiem izklātas ūdens burkas. Ūdens vārās un iztvaiko, veidojot mīkstus tvaikus. Visa šī vienkāršā ierīce ir novietota uz koka plaukta, kas piestiprināts pie krēsla atzveltnes. Plaukta iekšējās sienas ir izolētas ar alumīnija loksnēm. Varat arī izmantot alumīnija saldētavu no vecā ledusskapja. Elektriskā sildītāja sānos jābūt izklātam ar akmeņiem. Ir svarīgi, lai viņš nepieskartos plaukta sienām.
Pacients tiek iesēdināts krēslā un kopā ar krēslu ietīts segā. Vēlams, lai šī "kokona" iekšpusē būtu elektriskais termostats, kas nodrošinātu nemainīgu temperatūru. Temperatūras kontrolei tiek izmantots īpašs termometrs.
Ja pirtī tiek izmantots krēsls ar roku balstiem, tad virs tiem jāuzstāda speciāli loki, lai “kokona” iekšpusē paliktu neliela vieta gaisa cirkulācijai. Krēsla atzveltnei nav jābūt cietai.
Rokas, ja vēlas, var iznest ārā, kurām segas vietā pacientam virsū uzvelk mēteli un aiztaisa ar pogām, bet zem vidukļa ietin segā. Galva hipertermisko procedūru laikā paliek ārpusē. Viena no svarīgām mājas tvaika istabas priekšrocībām ir tā, ka viss ķermenis sasilst (pusstundas vai stundas laikā ķermeņa temperatūra sasniedz 40 °), bet tajā pašā laikā cilvēks elpo gaisu istabas temperatūrā. Starp citu, atsevišķu ķermeņa daļu vai orgānu lokālā sildīšana, manuprāt, ir neefektīva. Acīmredzot tas ir saistīts ar apgrieztām asinsvadu reakcijām uz vietējo sasilšanu.
Hipertermiskās procedūras laikā ieteicams dzert karstu tēju (zāļu vai zaļo) ar medu – lai pastiprinātu svīšanu. Lai sviedri viegli uzsūktos, uzvelc kokvilnas apakšveļu. Pēc procedūras beigām tiek veikta kontrastduša, lai atdzesētu ķermeni līdz normālai temperatūrai.
Onkoloģisko slimību gadījumā tiek veiktas divas hipertermiskās sesijas dienā (no rīta un pēcpusdienā), kas ilgst no divām līdz četrām stundām. Optimālā gaisa temperatūra ir 40-42°. Ārstēšanas kurss ir 10 dienas. To atkārto 6-10 reizes ar pārtraukumiem dienās.
Papildus ieteicami pasākumi asiņu attīrīšanai no šūnu sairšanas produktiem: ārstnieciskā badošanās, sulu terapija (piemēram, sulas ņemšana no dārzeņiem, augļiem un ogām sarkanā, dzeltenā un melnā krāsā), adsorbentu uzņemšana, veģetārie ēdieni, mālu terapija u.c.
Vēl labāk mājas pirtij izmantot speciālu krāsni ar infrasarkano starojumu. Tās stari ir mīkstāki, tie vienmērīgāk un dziļāk iekļūst audos. Šādas krāsnis ir komerciāli pieejamas arī lietošanai mājās.
Infrasarkanajai termiskajai iedarbībai ir vairākas priekšrocības. Pirmkārt, to ir vieglāk nēsāt. Tas ir īpaši svarīgi smagi slimiem un novājinātiem cilvēkiem. Otrkārt, tas ir efektīvāks dziļu audzēju un metastāžu gadījumos. Diemžēl neesmu saskāries ar informāciju par īpašiem pētījumiem par infrasarkanās apkures izmantošanu. Esmu pārliecināts, ka tā ir nākotne.
Neskatoties uz to, ka oficiālajā medicīnā ķermeņa uzsildīšana onkoloģisko slimību gadījumā tiek uzskatīta par kontrindicētu, Krievijā un ārzemēs ir klīnikas, kur šo slimību ārstē ar karstumu. Ir tāda klīnika, piemēram, Gorkijā, kur tiek izmantota termokamera sarkofāga veidā (tāpat kā šeit aprakstītajā metodē, galva paliek ārpusē). Procedūras tiek veiktas ierīču kontrolē.
Nobeigumā es gribu teikt, ka ilgstoša ķermeņa hipertermija ir ļoti fizioloģiska metode. Tas atgādina drudzi – dabisku organisma reakciju uz slimības izraisītāju, kad organisms cīnās ar slimību ar temperatūras paaugstināšanās palīdzību.
Populāras saites
Jaunākie raksti
Populāri raksti
Esam sociālajos tīklos
Rakstu masveida kopēšana (vairāk nekā 5 vienā vietnē) ir aizliegta.
Kopēšana atļauta tikai ar aktīvo, nav slēgts no
. Uztraucieties par nekontrolējamām blakusparādībām (piemēram, aizcietējumiem, sliktu dūšu vai apziņas aptumšošanos. Bažas par atkarību no pretsāpju līdzekļiem. Izrakstīto pretsāpju zāļu režīma neievērošana. Finansiālie šķēršļi. Ar veselības sistēmu saistītas problēmas: zema prioritāte vēža sāpju mazināšanai. Vispiemērotākā ārstēšana var būt pārāk dārga pacientiem un viņu ģimenēm. Stingrs regulējums par vēža F stadijas atbildes reakciju uz diagnozi, pieejamās sāpju zāles. sāpes un personīgās izvēles, ir jāvadās pēc šīm pazīmēm. 6 izārstēt vai vismaz stabilizēt vēža attīstību. Tāpat kā citas terapijas, staru terapijas izvēle konkrēta vēža ārstēšanai ir atkarīga no vairākiem faktoriem. Tie ietver, bet ne tikai, vēža veidu, pacienta fizisko stāvokli, vēža stadiju un audzēja atrašanās vietu. Staru terapija (jeb staru terapija ir svarīga audzēju mazināšanas tehnoloģija. Augstas enerģijas viļņi tiek vērsti uz vēža audzēju. Viļņi izraisa šūnu bojājumus, izjaucot šūnu procesus, novēršot šūnu dalīšanos un galu galā novedot pie ļaundabīgo šūnu nāves. Pat daļai ļaundabīgo šūnu nāve izraisa audzēja šūnu saraušanos. Viens būtisks staru terapijas trūkums ir ne tikai tiešā staru terapija, bet arī tas, ka var kaitēt arī veselām šūnām Normālu un vēža audu reakcija uz terapiju Audzēju un normālu audu reakcija uz starojumu ir atkarīga no to augšanas veida pirms ārstēšanas un tās laikā.Radiācija nogalina šūnas, mijiedarbojoties ar DNS un citām mērķa molekulām.Nāve nenotiek uzreiz, bet notiek, kad šūnas mēģina dalīties, bet radiācijas iedarbības rezultātā rodas neveiksme, ko sauc par sadalīšanās procesu. Šī iemesla dēļ radiācijas bojājumi ātrāk parādās audos, kas satur šūnas, kas ātri dalās, un vēža šūnas ātri dalās. Normāli audi kompensē staru terapijas laikā zaudētās šūnas, paātrinot pārējo šūnu dalīšanos. Turpretim audzēja šūnas pēc staru terapijas sāk dalīties lēnāk, un audzējs var samazināties. Audzēja saraušanās pakāpe ir atkarīga no līdzsvara starp šūnu veidošanos un šūnu nāvi. Karcinoma ir tāda veida vēža piemērs, kuram bieži ir augsts dalīšanās ātrums. Šie vēža veidi parasti labi reaģē uz staru terapiju. Atkarībā no izmantotās starojuma devas un individuālā audzēja, audzējs var atsākt augt pēc terapijas pārtraukšanas, bet bieži vien lēnāk nekā iepriekš. Radiāciju bieži kombinē ar operāciju un/vai ķīmijterapiju, lai novērstu audzēja atkārtotu augšanu. Radiācijas terapijas ārstnieciskie mērķi: ārstnieciskos nolūkos iedarbība parasti tiek palielināta. Reakcija uz starojumu, sākot no vieglas līdz smagai. Simptomu mazināšana: šīs procedūras mērķis ir mazināt vēža simptomus un pagarināt dzīvildzi, radot ērtāku dzīves vidi. Šāda veida ārstēšana ne vienmēr tiek veikta ar nolūku izārstēt pacientu. Bieži vien šāda veida ārstēšanu veic, lai novērstu vai likvidētu sāpes, ko izraisa vēzis, kas metastāzē kaulos. Radiācija operācijas vietā: starojums operācijas vietā ir efektīvs līdzeklis pret ierobežotu skaitu vēža veidu. Ārstēšana ir visefektīvākā, ja vēzis tiek atklāts agri, kamēr tas vēl ir mazs un nav metastātisks. Operācijas vietā var izmantot staru terapiju, ja vēža atrašanās vietas dēļ operācija ir sarežģīta vai neiespējama, neradot nopietnu risku pacientam. Ķirurģija ir izvēles ārstēšana bojājumiem, kas atrodas zonā, kur staru terapija var nodarīt lielāku kaitējumu nekā operācija. Arī laiks, kas nepieciešams abām procedūrām, ir ļoti atšķirīgs. Pēc diagnozes noteikšanas operāciju var ātri veikt; staru terapija var ilgt nedēļas, lai tā būtu pilnībā efektīva. Abām procedūrām ir plusi un mīnusi. Staru terapiju var izmantot, lai glābtu orgānus un/vai izvairītos no operācijas un ar to saistītajiem riskiem. Radiācija iznīcina ātri dalošās šūnas audzējos, savukārt ķirurģiskas procedūras var izlaist dažas ļaundabīgās šūnas. Tomēr lielās audzēju masās centrā bieži ir ar skābekli nabadzīgas šūnas, kas nedalās tik ātri kā šūnas, kas atrodas netālu no audzēja virsmas. Tā kā šīs šūnas ātri nedalās, tās nav tik jutīgas pret staru terapiju. Šī iemesla dēļ lielus audzējus nevar iznīcināt tikai ar starojumu. Ārstēšanas laikā bieži tiek apvienota staru terapija un operācija. Noderīgi raksti labākai staru terapijas izpratnei: "> Staru terapija 5 Ādas reakcijas ar mērķtiecīgu terapiju Ādas problēmas Aizdusa Neitropēnija Nervu sistēmas traucējumi Slikta dūša un vemšana Mukozīts Menopauzes simptomi Infekcijas Hiperkalciēmija Vīriešu dzimumhormons Galvassāpes Roku un pēdu sindroms Matu izkrišana (alopēcija) Limfedēma Ascīts Pleirīts Tūska B Depresija Depresija Kognitīvas problēmas riums Apgrūtināta rīšana Disfāgija Sausums mutē Kserostomijas neiropātija Lai uzzinātu par konkrētām blakusparādībām, izlasiet šos rakstus: "> Blakus efekti36 izraisīt šūnu nāvi dažādos virzienos. Dažas no zālēm ir dabiski savienojumi, kas identificēti dažādos augos, bet citas ir laboratorijā radītas ķīmiskas vielas. Tālāk ir īsi aprakstīti vairāki dažādi ķīmijterapijas zāļu veidi. Antimetabolīti: zāles, kas var traucēt galveno biomolekulu veidošanos šūnā, tostarp nukleotīdus, kas ir DNS celtniecības bloki. Šie ķīmijterapijas līdzekļi galu galā traucē replikācijas procesu (DNS meitas molekulas veidošanos un līdz ar to šūnu dalīšanos. Antimetabolītu piemēri ietver šādas zāles: fludarabīns, 5-fluoruracils, 6-tioguanīns, fluorofurs, citarabīns. genotoksiskas zāles: zāles, kas var izraisīt DNS sadalīšanās procesu un DNS bojājumus, piemēram, DNS. zāles: busulfāns, karmustīns, epirubicīns, idarubicīns. Vārpstas inhibitori (vai mitozes inhibitori: šo ķīmijterapijas līdzekļu mērķis ir novērst pareizu šūnu dalīšanos, mijiedarbojoties ar citoskeleta komponentiem, kas ļauj vienai šūnai sadalīties divās daļās. Piemērs ir zāles paklitaksels, ko iegūst no Pacific mizas Pacificy. Abas zāles ievada kā vairākas intravenozas injekcijas. Citi ķīmijterapijas līdzekļi: šie līdzekļi inhibē (palēnina šūnu dalīšanos ar mehānismiem, kas nav iekļauti trīs iepriekš uzskaitītajās kategorijās. Normālas šūnas ir izturīgākas (rezistentas pret zālēm, jo tās bieži pārstāj dalīties nelabvēlīgos apstākļos. Tomēr ne visas normāli dalās šūnas izvairās no ķīmijterapijas zāļu iedarbības, kas liecina par šo zāļu toksicitāti. Šūnu tipi, kuriem ir tendence ātri dalīties, piemēram, kaulu smadzenēs un zarnu oderējumā, mēdz ciest visvairāk. Parasta šūnu nāve ir viena no ķīmijterapijas biežākajām blakusparādībām. šādi raksti: "> Ķīmijterapija 6
- un nesīkšūnu plaušu vēzis. Šie veidi tiek diagnosticēti, pamatojoties uz to, kā šūnas izskatās zem mikroskopa. Pamatojoties uz noteikto veidu, tiek izvēlētas ārstēšanas iespējas. Lai izprastu slimības prognozi un izdzīvošanu, šeit ir sniegta ASV atklātā pirmkoda statistika par 2014. gadu par abiem plaušu vēža veidiem kopā: Jauni gadījumi (prognoze: 224 210 paredzamie nāves gadījumi: 159 260) Sīkāk apskatīsim abus veidus, specifiku un ārstēšanas iespējas. "> Plaušu vēzis 4
- ASV 2014. gadā: jauni gadījumi: 232 670 nāves gadījumu: 40 000 Krūts vēzis ir visizplatītākais ne-ādas vēzis starp sievietēm ASV (atklātie avoti lēš, ka 62 570 pirmsinvazīvās slimības gadījumi (in situ, 232 670 jauni invazīvās slimības gadījumi, līdz ar to sagaidāms, ka viens no 40, 200 nāves gadījumiem ir mazāks nekā 4 ASV). no sešām sievietēm, kurām diagnosticēts krūts vēzis, no šīs slimības mirst. Salīdzinājumam tiek lēsts, ka 2014. gadā no plaušu vēža mirs aptuveni 72 330 amerikāņu sieviešu. Vīriešu krūts vēzis (jā, jā, ir 1% no visiem krūts vēža gadījumiem un nāves gadījumiem no šīs slimības. Plaši izplatītais skrīnings ir palielinājis krūts vēža sastopamību un UK izmeklējumus ir mainījis raksturīgās iezīmes. DCIS un invazīvā krūts vēža sastopamības pieaugums kopš 1970. gada, tas ir saistīts ar plašo pēcmenopauzes hormonterapijas un mammogrāfijas izmantošanu. Pēdējās desmitgades laikā sievietes ir atturējušās no pēcmenopauzes hormonu lietošanas, un saslimstība ar krūts vēzi ir samazinājusies, taču ne līdz līmenim, ko var sasniegt, plaši izmantojot mamogrāfiju. Riska un aizsardzības faktori Vecuma palielināšanās ir vissvarīgākais krūts vēža riska faktors. Citi krūts vēža riska faktori ir šādi: Ģimenes anamnēze o Pamatā esošā ģenētiskā uzņēmība Dzimuma mutācijas BRCA1 un BRCA2 gēnos un citos uzņēmības pret krūts vēzi gēnos Alkohola patēriņš Krūts audu blīvums (mamogrāfiskais) Estrogēns (endogēns: o Menstruāciju anamnēze (menstruāciju rašanās/vēlīna dzemdību anamnēze pirmajās dzemdībās, menopauze) bination estrogēnu un progestīnu (HAT Orālā kontracepcija Aptaukošanās Vingrojumu trūkums Personīgā krūts vēža anamnēze Personīgā anamnēzē labdabīgas krūts slimības proliferatīvās formas. Radiācijas iedarbība uz krūtīm No visām sievietēm, kurām ir krūts vēzis, 5% līdz 10% var būt dzimumšūnu mutācijas BRCA1 un BRCA2 gēnos. Pētījumi liecina, ka JewBR2 sieviešu vidū ir specifiskākas BRCA2 mutācijas. Vīriešiem, kuriem ir BRCA2 mutācija, ir arī paaugstināts krūts vēža attīstības risks. Mutācijas gan BRCA1 gēnā, gan BRCA2 arī palielina olnīcu vēža vai citu primāru vēža attīstības risku. Kad BRCA1 vai BRCA2 mutācijas ir identificētas, citiem ģimenes locekļiem ir vēlams saņemt ģenētiskas konsultācijas un testus. Aizsardzības faktori un pasākumi krūts vēža attīstības riska samazināšanai ir šādi: Estrogēnu lietošana (īpaši pēc histerektomijas) Vingrošanas paraduma izveidošana Agrīna grūtniecība Zīdīšana Selektīvie estrogēnu receptoru modulatori (SERM) Aromatāzes inhibitori vai inaktivatori Samazināts mastektomijas risks Samazināts oophorektomijas risks sievietēm, kas konstatēta oophorektomija, skrīnings vai maktopiskā skrīnings. mmogrāfija, ar vai bez klīniskas izmeklēšanas Diagnoze Ja ir aizdomas par krūts vēzi, pacientei parasti jāveic šādas darbības: Diagnozes apstiprināšana Slimības stadijas izvērtēšana Terapijas izvēle Krūts vēža diagnosticēšanai tiek izmantoti šādi testi un procedūras: Mammogrāfija Ultraskaņa Krūšu magnētiskās rezonanses attēlveidošana (MRI, ja klīniski indicēts) Biopsija Kontralateral krūts vēzis Divpusēja slimība ir nedaudz biežāka pacientiem ar infiltrējošu fokusa karcinomu. 10 gadus pēc diagnozes primārā krūts vēža risks kontralaterālajā krūtīs svārstās no 3% līdz 10%, lai gan endokrīnā terapija var samazināt šo risku. Otrā krūts vēža attīstība ir saistīta ar paaugstinātu ilgtermiņa atkārtošanās risku. Gadījumā, ja BRCA1 / BRCA2 gēna mutācija tika diagnosticēta pirms 40 gadu vecuma, risks saslimt ar otro krūts vēzi nākamo 25 gadu laikā sasniedz gandrīz 50%. Pacientēm, kurām diagnosticēts krūts vēzis, diagnozes laikā jāveic abpusēja mammogrāfija, lai izslēgtu sinhrono slimību. MRI loma kontralaterālā krūts vēža skrīningā un sieviešu uzraudzībā, kuras tiek ārstētas ar krūšu saglabāšanas terapiju, turpina attīstīties. Tā kā mammogrāfijā ir pierādīts, ka iespējamas slimības tiek atklātas biežāk, MRI selektīva izmantošana papildu skrīningam notiek biežāk, neskatoties uz to, ka trūkst randomizētu kontrolētu datu. Tā kā tikai 25% no MRI pozitīviem atklājumiem ir ļaundabīgi audzēji, pirms ārstēšanas uzsākšanas ieteicams veikt patoloģisku apstiprinājumu. Nav zināms, vai šis slimības atklāšanas ātruma pieaugums uzlabos ārstēšanas rezultātus. Prognozes faktori Krūts vēzi parasti ārstē ar dažādām operāciju, staru terapijas, ķīmijterapijas un hormonterapijas kombinācijām. Secinājumus un terapijas izvēli var ietekmēt šādas klīniskās un patoloģiskās pazīmes (balstoties uz konvencionālo histoloģiju un imūnhistoķīmiju): Pacienta klimatiskais stāvoklis, slimības stadija, primārā audzēja pakāpe. Audzēja statuss atkarībā no estrogēnu receptoru stāvokļa (ER un progesterona receptori (dažādi lietojuma veidi, PR. Histoloģiskās pielietošanas veidi). Krūts vēža prognostiskā vērtība tiek klasificēta. ekulārā profilēšana krūts vēža gadījumā ietver sekojošo: ER un PR statusa testēšana HER2/Neu receptoru stāvokļa pārbaude Pamatojoties uz šiem rezultātiem, krūts vēzis ir klasificēts kā: Hormonu receptoru pozitīvs HER2 pozitīvs Trīskārši negatīvs (ER, PR un HER2/Neu negatīvs Lai gan dažas retas iedzimtas mutācijas, piemēram, BRCA1 un BRCA2, predisponē krūts vēža mutāciju BR, mutācijas mutācijas BR datu nesējus1. joni ir pretrunīgi; šīm sievietēm vienkārši ir lielāks risks saslimt ar otro krūts vēzi. Bet nav droši, ka tas var notikt. Hormonu aizstājterapija Pēc rūpīgas apsvēršanas pacienti ar smagiem simptomiem var tikt ārstēti ar hormonu aizstājterapiju. Pēcpārbaude Novērošanas biežums un skrīninga piemērotība pēc I, II vai III stadijas krūts vēža primārās ārstēšanas pabeigšanas joprojām ir pretrunīga. Pierādījumi no randomizētiem pētījumiem liecina, ka periodiska novērošana ar kaulu skenēšanu, aknu ultraskaņu, krūškurvja rentgena stariem un asins analīzēm aknu darbības noteikšanai nemaz neuzlabo izdzīvošanu vai dzīves kvalitāti, salīdzinot ar parastajiem fiziskajiem izmeklējumiem. Pat tad, ja šie testi ļauj savlaicīgi atklāt slimības recidīvu, tas neietekmē pacientu izdzīvošanu. Pamatojoties uz šiem datiem, ierobežota novērošana un ikgadēja mammogrāfija asimptomātiskām pacientēm, kuras tiek ārstētas no I līdz III stadijas krūts vēža, var būt pieņemama novērošana. Vairāk informācijas rakstos: "> Piena vēzis5
- , urīnvadi un proksimālais urīnizvadkanāls ir izklāta ar specializētu gļotādu, ko sauc par pārejas epitēliju (sauktu arī par urotēlija. Lielākā daļa vēža veidu, kas veidojas urīnpūslī, nieru iegurnī, urīnvados un proksimālajā urīnizvadkanālā, ir pārejas šūnu karcinomas (sauktas arī par urotēlija karcinomām, kas iegūtas no transmisīvās pakāpes pārejas epitēlijas vai augstas pakāpes karcinomas. : Zemas pakāpes urīnpūšļa vēzis bieži atkārtojas urīnpūslī pēc ārstēšanas, bet reti iebrūk urīnpūšļa muskuļainās sienās vai izplatās uz citām ķermeņa daļām. Pacienti reti mirst no zemas pakāpes urīnpūšļa vēža. Smalkas urīnpūšļa vēzis parasti atkārtojas urīnpūslī, un tam ir arī spēcīga tendence iebrukt urīnpūšļa ķermeņa daļās ar augstas pakāpes urīnpūšļa sieniņām. agresīvāks nekā zemas pakāpes urīnpūšļa vēzis un daudz lielāka iespējamība izraisīt nāvi. Gandrīz visi nāves gadījumi no urīnpūšļa vēža ir ļoti ļaundabīgu vēža rezultāts. Urīnpūšļa vēzi iedala arī muskuļos invazīvās un neinvazīvās slimībās, kuru pamatā ir muskuļu oderes invāzija (saukta arī par detrusoru, kas atrodas dziļi urīnpūšļa muskuļu sieniņā. Muskuļu invazīvā slimība daudz biežāk izplatās uz citām ķermeņa daļām, un to parasti ārstē vai nu ar urīnpūšļa izņemšanu, vai ar augstu vēža pakāpi, ārstējot ar augstāku asinsspiediena ķīmijterapiju. Slimība, visticamāk, ir muskuļu invazīvs vēzis nekā zemas pakāpes vēzis. Tādējādi parasti tiek uzskatīts, ka muskuļu invazīvs vēzis ir agresīvāks nekā neinvazīvs vēzis. Nemuskuļu invazīvo slimību bieži var ārstēt, noņemot audzēju, izmantojot transuretrālu pieeju, un dažreiz ķīmijterapiju vai citas procedūras, kurās zāles injicē caur urīnpūšļa dobumu, lai palīdzētu cīnīties ar vēzi. Vēzis urīnpūslī var rasties hroniska iekaisuma apstākļos, piemēram, urīnpūšļa infekcija, ko izraisa parazīts hematobium Schistosoma, vai plakanšūnu metaplāzijas rezultātā; Plakanšūnu urīnpūšļa vēža sastopamība ir lielāka hroniska iekaisuma apstākļos nekā citos gadījumos. Papildus pārejas karcinomai un plakanšūnu karcinomai urīnpūslī var veidoties adenokarcinoma, sīkšūnu karcinoma un sarkoma. Amerikas Savienotajās Valstīs pārejas šūnu karcinomas veido lielāko daļu (vairāk nekā 90% urīnpūšļa vēža). Tomēr ievērojamam skaitam pārejas karcinomu ir plakanšūnu vai cita veida diferenciācijas apgabali. Kanceroģenēze un riska faktori Ir pārliecinoši pierādījumi par kancerogēnu ietekmi uz urīnpūšļa vēža rašanos un progresēšanu. Cigarešu smēķēšana ir visizplatītākais pūšļa vēža riska faktors. smēķēšana un ka smēķēšana palielina risku saslimt ar urīnceļu vēzi.smēķētājiem ar mazāk funkcionālu N-acetiltransferāzes-2 polimorfismu (pazīstams kā lēns acetilators) ir lielāks risks saslimt ar urīnpūšļa vēzi, salīdzinot ar citiem smēķētājiem, acīmredzot sakarā ar samazinātu spēju detoksicēt kancerogēnus.un gumija riepu rūpniecībā; mākslinieku vidū; ādas apstrādes rūpniecības strādnieki; kurpnieki; un alumīnija, dzelzs un tērauda apstrādātājiem. Īpašas ķīmiskas vielas, kas saistītas ar urīnpūšļa kanceroģenēzi, ir beta-naftilamīns, 4-aminobifenils un benzidīns. Lai gan šīs ķīmiskās vielas tagad parasti ir aizliegtas Rietumu valstīs, tiek uzskatīts, ka daudzas citas ķīmiskas vielas, kas joprojām tiek izmantotas, var izraisīt urīnpūšļa vēzi. Ķīmijterapijas līdzekļa ciklofosfamīda iedarbība ir saistīta arī ar paaugstinātu urīnpūšļa vēža risku. Hroniskas urīnceļu infekcijas un infekcijas, ko izraisa parazīts S. haematobium, ir saistītas arī ar paaugstinātu urīnpūšļa vēža un bieži vien plakanšūnu karcinomas risku. Tiek uzskatīts, ka šādos apstākļos hroniskam iekaisumam ir galvenā loma kanceroģenēzes procesā. Klīniskās pazīmes Urīnpūšļa vēzis parasti izpaužas ar vienkāršu vai mikroskopisku hematūriju. Retāk pacienti var sūdzēties par biežu urinēšanu, niktūriju un dizūriju, simptomiem, kas biežāk sastopami pacientiem ar karcinomu. Pacientiem ar augšējo urīnceļu urotēlija vēzi var rasties sāpes audzēja obstrukcijas dēļ. Ir svarīgi atzīmēt, ka urotēlija karcinoma bieži ir multifokāla, tādēļ, ja tiek konstatēts audzējs, ir nepieciešams izmeklēt visu urotēliju. Pacientiem ar urīnpūšļa vēzi augšējo urīnceļu attēlveidošana ir būtiska diagnozei un novērošanai. To var panākt ar uretroskopiju, retrogrādu pielogrammu cistoskopijā, intravenozo pielogrammu vai datortomogrāfiju (CT urogramma).Turklāt pacientiem ar TCC ir augsts urīnpūšļa vēža attīstības risks, šiem pacientiem nepieciešama periodiska cistoskopija un pretējā augšējā urīnceļa novērošana.Diagnoze ir radiologiskā testēšana, kā visnoderīgākais urīnpūšļa, iscytosspect izmeklējums. datortomogrāfijai vai ultraskaņai nav pietiekamas jutības, lai tās būtu noderīgas urīnpūšļa vēža noteikšanā Cistoskopiju var veikt uroloģijas klīnikā Ja cistoskopijas laikā tiek atklāts vēzis, pacientam parasti tiek nozīmēta bimanuāla izmeklēšana anestēzijā un atkārtota cistoskopija operāciju zālē, lai gandrīz vienmēr varētu veikt audzēja transuretrālu/vai biopsiju rezekciju no pacientiem. nokļūst no urīnpūšļa uz citiem orgāniem. Zemas pakāpes urīnpūšļa vēzis reti ieaug urīnpūšļa muskuļu sieniņā un reti dod metastāzes, tāpēc pacienti ar zemas pakāpes urīnpūšļa vēzi (I stadijas urīnpūšļa vēzis) ļoti reti mirst no vēža. Tomēr viņiem var rasties vairāki recidīvi, kas ir jārezekcija. Gandrīz visi urīnpūšļa vēža izraisītie nāves gadījumi notiek pacientiem ar augstas pakāpes muskuļu slimību, kuras potenciāls ir aptuveni70% dziļās sieniņās. % pacientu ar nesen diagnosticētu urīnpūšļa vēzi ir virspusēji urīnpūšļa audzēji (t.i., Ta, TIS vai T1 stadija). Šo pacientu prognoze lielā mērā ir atkarīga no audzēja pakāpes. Invazīvajam urīnpūšļa vēzim vairumā gadījumu ir liela iespēja tikt izārstētam, un pat ar muskuļu invazīvu slimību dažreiz pacientu var izārstēt. Pētījumi liecina, ka dažiem pacientiem ar attālām metastāzēm onkologi ir sasnieguši ilgstošu pilnīgu atbildes reakciju pēc ārstēšanas ar kombinēto ķīmijterapijas shēmu, lai gan lielākajai daļai šo pacientu metastāzes ir ierobežotas limfmezglos. Sekundārais urīnpūšļa vēzis Urīnpūšļa vēzim ir tendence atkārtoties, pat ja tas diagnozes laikā nav invazīvs. Tāpēc pēc urīnpūšļa vēža diagnozes noteikšanas parastā prakse ir veikt urīnceļu uzraudzību. Tomēr pētījumi vēl nav veikti, lai novērtētu, vai novērošana ietekmē progresēšanas rādītājus, izdzīvošanu vai dzīves kvalitāti; lai gan ir klīniskie pētījumi, lai noteiktu optimālo novērošanas grafiku. Tiek uzskatīts, ka urotēlija karcinoma atspoguļo tā saukto lauka defektu, kurā vēzis ir saistīts ar ģenētiskām mutācijām, kas plaši atrodas pacienta urīnpūslī vai visā urotēlijā. Tādējādi cilvēkiem, kuriem ir izdalīts urīnpūšļa audzējs, bieži pēc tam urīnpūslī ir audzēji, bieži vien citās vietās, nevis primārajā audzējā. Līdzīgi, bet retāk, tiem var attīstīties audzēji augšējos urīnceļos (t.i., nieru iegurnī vai urīnvados. Alternatīvs izskaidrojums šiem atkārtošanās modeļiem ir tāds, ka vēža šūnas, kas tiek iznīcinātas, audzēja rezekcijas laikā, var tikt reimplantētas citur urotēlija daļā. Atbalstot šo otro teoriju, ir tāda, ka audzēji, visticamāk, atkārtojas no sākotnējā urīnceļa, nevis aizmugures vēzis uz urīnceļu. urīnpūšļa vēzis vairojas augšējos urīnceļos. Pārējie raksti: "> urīnpūšļa vēzis4
- un palielināts metastātisku slimību risks. Diferenciācijas pakāpe (audzēja attīstības stadijas noteikšana būtiski ietekmē šīs slimības dabisko vēsturi un ārstēšanas izvēli. Endometrija vēža biežuma palielināšanās ir konstatēta ilgstošas, vienlaicīgas estrogēna iedarbības dēļ (paaugstināts līmenis. Turpretim kombinētā terapija (estrogēns + progesterons)) novērš riska palielināšanos ar endometrija vēža specifisko rezistenci, bet ne pretvēža diagnozi. Jums jāzina, ka endometrija vēzis ir ārstējama slimība.simptomi un viss būs labi!Dažiem pacientiem iepriekšēja kompleksa hiperplāzija ar atipiju anamnēzē var būt endometrija vēža “aktivatora” loma. Saslimstības ar endometrija vēzi palielināšanās konstatēta arī saistībā ar krūts vēža ārstēšanu ar tamoksifēnu.Pēc pētnieku domām, tas ir saistīts ar tamometra terapijas paaugstināšanos, tamometroksifēna terapijai vajadzētu palielināties tamometra oksifēna iedarbībai. obligāti jāveic regulāras iegurņa izmeklēšanas un jābūt uzmanīgiem pret jebkādu patoloģisku dzemdes asiņošanu. Histopatoloģija Ļaundabīgo endometrija vēža šūnu izplatība daļēji ir atkarīga no šūnu diferenciācijas pakāpes. Labi diferencēti audzēji mēdz ierobežot to izplatīšanos uz dzemdes gļotādas virsmu; miometrija paplašināšanās notiek retāk. Pacientiem ar slikti diferencētiem audzējiem miometrija invāzija ir daudz biežāka. Miometrija invāzija bieži ir limfmezglu iesaistīšanās un attālu metastāžu priekštecis, un tas bieži ir atkarīgs no diferenciācijas pakāpes. Metastāzes notiek parastajā veidā. Izplatīšanās uz iegurņa un paraaortas mezgliem ir izplatīta. Kad rodas attālās metastāzes, tas visbiežāk rodas: Plaušās. Cirkšņa un supraclavicular mezgli. Aknas. Kauli. Smadzenes. Maksts. Prognozējošie faktori Vēl viens faktors, kas ir saistīts ar ārpusdzemdes un mezglu audzēja izplatīšanos, ir kapilārā-limfātiskās telpas iesaistīšanās histoloģiskajā izmeklēšanā. Trīs I klīniskās stadijas prognostiskās grupas bija iespējamas, rūpīgi nosakot operatīvo stadiju. Pacientiem ar 1. stadijas audzēju, kas skar tikai endometriju un nav pazīmju par intraperitoneālu slimību (t.i., adnexal paplašinājums), ir zems risks (">endometrija vēzis). 4
Mūsdienu trakajā dzīves ritmā ne katrs var atvēlēt dažas brīvas stundas, lai apmeklētu ārstu, pat ja jūtas slikti. Mūsu vietne ir piepildīta ar visaptverošu un uzticamu informāciju par daudzu slimību cēloņiem, to klīniskajām izpausmēm, diagnostikas un ārstēšanas metodēm.
Ērts alfabētiskais rādītājs galvenajā lapā palīdzēs ātri atrast pilnīgu informāciju par interesējošo slimību, tās attīstības cēloņiem un kursa iezīmēm.
- Diagnostika
Šajā sadaļā tiks pastāstīts par izplatītākajām diagnostikas iespējām, kas tiek izmantotas pacientu pārbaudēs. Papildus procedūru aprakstam šajā sadaļā sniegtie raksti palīdzēs jums iepazīties ar iegūto rezultātu atšifrējumiem, uzzināt, kāda informācija ir šajos vai citos rādītājos.
Rubrika noderēs arī tiem, kam tikai gatavojas noteikta diagnostikas procedūra, jo tā palīdzēs sagatavoties pētījumam, tādējādi izvairoties no iespējamām kļūdām.
- Ārstēšanas metodes
Ārstēšanas metožu sadaļa palīdzēs detalizēti iepazīties ar inovatīvās terapijas iespējām, ko izmanto, lai ārstētu onkoloģiskā rakstura slimības, iedzimtu noslieci uz dzemdes vēža attīstību, dzirdes zudumu, kā arī daudzām citām patoloģijām, kurām raksturīga smaga norise un nopietnas sekas.
- Pirmā palīdzība
Šī ir īpaši noderīga rubrika katram cilvēkam. Šajā sadaļā ir sīki aprakstītas iespējas nestandarta situācijām, ar kurām var saskarties ikviens. Kā rīkoties apsaldējuma gadījumā, kā palīdzēt slīkstot, samaņas zudumu vai lūzumu gadījumā, kādas darbības jāveic čūskas koduma gadījumā pirms kvalificētas medicīniskās palīdzības sniegšanas cietušajam, tiek apsvērtas daudzas citas ārkārtas situācijas. Zināšanas par pirmās palīdzības sniegšanas prasmēm palīdzēs rīkoties ātri un mērķtiecīgi, un novērsīs iespējamo apjukumu un kavēšanos.
- Slimības
Visplašākā un ikvienam noderīgākā ir sadaļa par slimībām. Pārskatot šo sadaļu, jūs uzzināsit par pirmajām klīniskajām izpausmēm visdažādākajām slimībām, diagnostikas metodēm, standarta un unikālajām ārstēšanas metodēm. Arī šeit jūs varat atrast noderīgus padomus, kā novērst daudzas zināmas slimības.
- Dažādi
Arī šī sadaļa daudziem noderēs. Šī sadaļa palīdzēs jums iegūt atbildes uz bieži uzdotajiem jautājumiem. Piemēram: kā doties ceļojumā pie kāda, kas cieš no alerģijām? Kā dzīst lūzumi, vai šos procesus var paātrināt? Vai mūsdienās tik populārie vapes ir kaitīgi veselībai? Raksti no šīs mūsu sadaļas var sniegt pilnīgas un detalizētas atbildes uz šiem, kā arī daudziem citiem jautājumiem.
Mūsu vietne noderēs arī jaunajām māmiņām, jo sniedz informāciju par vakcinācijas ieguvumiem un kaitējumu, ar kādām metodēm var stiprināt imūnsistēmu un norūdīt mazuli, kādas pazīmes liecina par izmaiņām bērna uzvedībā, var liecināt par slimību un patoloģiju attīstības sākumposmiem? Vārdu sakot, mūsu daudzpusīgajā resursā katram apmeklētājam ir atbilde uz viņu meklēto jautājumu.
Protams, tik ērta asistenta kā mūsu vietne klātbūtne nevar aizstāt pilnvērtīgu ārsta apmeklējumu. Ir svarīgi atcerēties, ka, ja jūtaties slikti, pašārstēšanās var izraisīt ievērojamu stāvokļa pasliktināšanos un esošo slimību progresēšanu.
Mūsu portāls ir paredzēts tikai izglītojošiem un informatīviem nolūkiem, taču tas nav darbības ceļvedis.
Pirms pašam izmēģināt piedāvātās ārstēšanas metodes, ir svarīgi saņemt kvalificēta speciālista padomu.Hipertermija tagad ir iekļauta NCCN klīniskās prakses vadlīnijās recidivējoša krūts vēža ārstēšanai. Dr. Arkādijs Besantins (Izraēla, Telaviva) veiksmīgi izmanto šo moderno tehniku krūts vēža pacientu ārstēšanā.
Šī pārskata mērķis— iepazīstināt ar klīniskajiem pētījumiem, kas veikti pēdējās desmitgadēs par hipertermijas lietošanu kombinācijā ar staru terapiju un/vai ķīmijterapiju krūts vēža ārstēšanai. Šajā rakstā ir detalizēti aprakstīti NCCN pamatprincipi, kas tagad ietver hipertermijas izmantošanu atkārtotu ādas bojājumu klīniskai ārstēšanai krūts vēža gadījumā, atbalstot hipertermijas iespējamo pozitīvo lomu audzēja atkārtošanās vietējā kontrolē.
Hipertermija - pārkaršana, liekā siltuma uzkrāšanās cilvēku un dzīvnieku ķermenī ar ķermeņa temperatūras paaugstināšanos, ko izraisa ārēji faktori, kas kavē siltuma pārnesi uz ārējo vidi vai palielina siltuma plūsmu no ārpuses. (Wikipedia)
Ievads
Tas ir viens no izplatītākajiem vēža veidiem un ir nopietna problēma, jo ar katru gadu palielinās saslimšanas gadījumu skaits. Lai gan pašlaik ir iespējams agrīni atklāt krūts vēzi, 30% pacientu agrīnā slimības stadijā, iespējams, turpmāk atkārtosies. Ārstēšana pacientiem ar lokāli progresējošu krūts vēzi sastāv no ķīmijterapijas, kam seko radikāla mastektomija (šī ir operācija, kas ietver pilnīgu vai daļēju krūts amputāciju) un staru terapiju un dažos gadījumos hormonālo terapiju. Lai gan šī kombinētā terapija joprojām ir optimālā izvēle vietējās audzēja kontroles ziņā, labākam klīniskajam rezultātam joprojām ir jāizvēlas jaunas terapijas.
Saskaņā ar Nacionālā antioksidantu tīkla 2013 (NCCN) principiem hipertermija ir iekļauta klīniskajā praksē recidivējoša krūts vēža ārstēšanā. Hipertermijas mērķis ir paaugstināt audzēja temperatūru līdz 42-45 ° C. Atkarībā no audzēja atrašanās vietas ir dažādas hipertermijas pielietošanas metodes. Krūts vēža audzējiem, kuru dziļums ir mazāks par 5 cm, galvenokārt tiek izmantota virspusēja hipertermija. Virspusēja hipertermija kombinācijā ar staru terapiju un/vai ķīmijterapiju izrādījās efektīvāka nekā staru terapija vai ķīmijterapija atsevišķi, jo staru terapijas un hipertermijas darbības mehānismi papildina viens otru. Turklāt liela nozīme ir pareizai hipertermijas klīniskai pielietošanai, jo termiskie parametri, piemēram, minimālā vai maksimālā audzēja temperatūra termoterapijas laikā, ietekmē ārstēšanas klīnisko iznākumu.
Visi šajā pārskatā iekļautie izmēģinājumi tika iegūti no Medline (saīsinājums no MEDlars onLINE MEDLARS (MEDical Literature Analysis and Retrieval System), kas ir lielākā publicētās medicīniskās informācijas datubāze pasaulē, kas aptver aptuveni 75 procentus no visām pasaules publikācijām.) un ir publicēti no 1987. gada līdz mūsdienām.
Šie pētījumi parāda, kā hipertermija kopā ar staru terapiju un/vai ķīmijterapiju ietekmē pacientus, kuri cieš no krūts vēža, un pēta šīs kombinētās ārstēšanas priekšrocības. Katrā pētījumā iegūtie dati parāda pacientu skaitu ar primāru slimību vai krūts vēža recidīvu un to ārstēšanā izmantotās terapeitiskās metodes. Galvenie novērtētie parametri ir reakcijas uz terapiju ātrums, pilnīgas un daļējas atbildes reakcijas rādītāji, lokālā audzēja kontrole un izdzīvošanas rādītāji. Visbeidzot, tiek ņemta vērā hipertermijas izraisīta toksicitāte.
rezultāti un diskusija
Pirmie klīniskie rezultāti salīdzinošajiem pētījumiem par termostaroterapijas (RTHT) un staru terapiju virspusēju audzēju gadījumā tika publicēti pirms 1990. gada. 1987. gadā tika publicēti pētījuma rezultāti, kurā pacienti ar virspusēji recidivējošiem ļaundabīgiem audzējiem saņēma zemu staru terapijas devu ar lokālu hipertermiju vai bez tās (915 vai 2450 MHz). Lielākā daļa audzēju (53%) bija krūts adenokarcinomas. Pilnīgas, kā arī daļējas atbildes reakcijas rādītāji bija augstāki kombinētajā grupā, kas liecina, ka hipertermija kombinācijā ar zemas devas starojumu var būt noderīga virspusēja audzēja recidīva ārstēšanā, īpaši gadījumos, kad iepriekš ir lietotas lielākas staru terapijas devas. Ārstēšanas laikā 3. klases toksicitāte (t.i., šūnu atslāņošanās no virsmas) ar burbuļiem/slapja atslāņošanās) bija attiecīgi 21,2 un 4,2%, 4. klases toksicitāte (maza nekroze (izmiršana) vai čūla / masīva čūla, attiecīgi 24,3%). Par subkutānu taukaudu nekrozi (4. pakāpe) ziņots attiecīgi 3 pacientiem un 1 pacientam.
Tika veikts pētījums, kas arī pierādīja kombinētās ārstēšanas efektivitāti: 35 pacienti ar recidivējošu krūts karcinomu papildus staru terapijai saņēma hipertermiju, kas tika veikta 30 minūšu laikā pēc apstarošanas. Salīdzinot 9 pacientus, kuri saņēma tikai staru terapiju, un 9 pacientus, kuri saņēma RTT, atklājās, ka atbildes reakcija uz ārstēšanu bija attiecīgi 33,3% (3/9) un 77,7% (7/9). Hipertermiju organisms panesa bez nopietnām komplikācijām.
Radiācijas onkoloģijas terapijas grupa (RTOG), lai novērtētu virspusēju audzēju (tostarp krūts vēža) hipertermijas ārstēšanu, randomizētā pētījumā konstatēja korelāciju ( savstarpējā atkarība)starp audzēja diametru un reakcijas ātrumu: pētījuma rezultāti uzrādīja atbildes reakcijas uzlabošanos, īpaši bojājumos, kuru diametrs ir mazāks par 3 cm, saņemot vairāk nekā 2 hipertermiskas procedūras (42,5 °C). Ilgstošas atbildes reakcijas rādītājs pēc 12 mēnešiem bija augstāks pacientiem, kuri tika ārstēti ar RTHT, nekā tiem, kas tika ārstēti tikai ar staru terapiju. Šie dati liecina, ka hipertermijas pievienošana nodrošina ilgāku un pilnīgāku atbildes reakciju uz ārstēšanu.
Hipertermija kombinācijā ar staru terapiju progresējošas vai lokāli recidivējošas krūts karcinomas gadījumā: pētījumi tika veikti ar 40 pacientēm (10 primārie gadījumi un 30 recidīvi). Tika nolemts, ka pacienti ar mazākiem bojājumiem saņems tikai staru terapiju, bet pacienti ar lielākiem bojājumiem saņems RTT. Audzēji, kas tika ārstēti ar hipertermiju, labāk reaģēja uz terapiju nekā jaunveidojumi, kas saņēma tikai staru terapiju. Ir arī ziņots, ka pacientiem ar primāriem audzējiem, kuri saņēma starojumu, bija zems pilnīgas un daļējas atbildes reakcijas un lokālas audzēja kontroles līmenis, savukārt šie rādītāji palielinājās, pievienojoties hipertermijai. Atkārtotu audzēju gadījumā pēc operācijas vietējās atbildes reakcijas ātrums uz ārstēšanu pēc staru terapijas arī palielinājās, pievienojot hipertermiju. Secināts, ka kombinētā terapija nodrošina labāku klīnisko iznākumu pacientēm ar lokalizētu primāru un recidivējošu krūts vēzi, kā arī konstatēts, ka nozīme ir arī audzēja lielumam. Hipertermija virspusējos audzējos ir efektīvāka, ja bojājuma diametrs ir mazāks par 3 cm.
Viens no lielākajiem pētījumiem, lai novērtētu hipertermijas efektivitāti, tika publicēts 1996.šajā analīzē kopumā tika iekļauti 306 bojājumi. Rezultāti iegūti 5 dažādos randomizētos pētījumos krūts vēža ārstēšanā ar RTHT (III fāze) Pētījumi liecina, ka hipertermija ir priekšrocība, ja to pievieno staru terapijai, galvenokārt recidivējoša krūts vēža gadījumā, kur iepriekšējās staru terapijas dēļ ir ieteicams lietot mazākas staru devas. Kopējais kopējais ārstēšanas atbildes reakcijas rādītājs bija 59% RTHT un 41% staru terapijas gadījumā.
Pētījums, lai noteiktu saistību starp hipertermijas termiskajiem parametriem un ārstēšanas iznākumu pacientiem, kuri cieš no recidivējoša krūts vēža: tika salīdzināta reakcija uz ārstēšanu pacientiem, kuri saņēma RTTT, un pacientiem, kuri saņēma tikai staru terapiju. Kopējais atbildes reakcijas rādītājs bija attiecīgi 61 un 41%. Randomizētā pētījumā tika novērtēta siltuma devas nozīme virspusēju bojājumu, tostarp krūts vēža, ārstēšanā. Pētniekus interesēja reakcija uz ārstēšanu un vietējās kontroles ilgums. Pacienti tika sadalīti 2 grupās. Pirmā grupa tika ārstēta tikai ar staru terapiju, bet otrā grupa tika ārstēta ar RTT. Kopējais atbildes reakcijas līmenis uz terapiju un lokālais kontroles rādītājs uzlabojās, pievienojot hipertermiju. Vislielākais vietējās kontroles uzlabojums tika novērots pacientiem, kuri jau bija saņēmuši staru terapiju iepriekšējā ārstēšanā.
2008. gada pētījums: Šajā pētījumā tika iekļauti pacienti no 8 dažādām medicīnas iestādēm. Visām viņām bija recidivējoša krūts karcinoma, un pēc lokālas recidīva viņi saņēma atkārtotu krūts apstarošanu. Daži pacienti papildus staru terapijai saņēma hipotermiju. Kopējā atbildes reakcija uz ārstēšanu bija 67% ar hipotermiju un 39% bez tās.
Hipertermijas kā lokāli recidivējošas krūts vēža paliatīvās ārstēšanas efektivitātes pārbaude: 30 pacientes ar krūts vēzi pēc ārstēšanas ar citām tradicionālām metodēm saņēma zemu starojuma devu + 1 stundu hipertermiju. Rezultāti apstiprināja hipertermijas ietekmi uz krūts vēža recidīvu samazināšanu. Turklāt bojājumi, kuru diametrs bija mazāks par 5 cm, labāk reaģēja uz kombinēto ārstēšanu.
Ir pierādīts, ka RTHT nodrošinaVietējo audzēju kontroles uzlabošana recidivējoša krūts vēža ārstēšanā: 34 pacienti saņēma RTT, 4 pacienti saņēma ķīmijterapiju un hipertermiju, un 4 pacientiem bija tikai hipertermija. Tika atzīmēts, ka tikai tās pacientes, kuras saņēma RTTT, pilnībā reaģēja uz terapiju un uzlaboja lokālu slimību kontroli.. RTHT saņēma 44 pacientes ar lokāli recidivējošu krūts adenokarcinomu. Ārstēšanas atbildes reakcijas rādītāji tika analizēti 1 mēnesi pēc terapijas pabeigšanas. Pēc 12 mēnešiem 67% pacientu, kuri sasniedza pilnīgu atbildes reakciju, joprojām bija pozitīvi. Ir konstatēts, ka audzēja lielums būtiski ietekmē klīnisko iznākumu.
Hipertermijas lietošana kombinācijā ar staru terapiju recidivējošas krūts karcinomas ar metastāzēm ārstēšanai: Lai novērtētu ārstēšanas efektivitāti, tika veikts pētījums, kurā piedalījās 20 pacienti. Lielākā daļa pacientu (95%) pilnībā reaģēja uz kombinēto ārstēšanu, kas bija efektīva plašu difūzu krūts vēža bojājumu gadījumā. Tomēr šo pacientu vidējā dzīvildze bija neapmierinoša, jo ārpus apstrādātajām zonām bija metastāzes.
Virsmas RTHT lietošana pacientēm ar recidivējošu krūts karcinomu: Maksimālās regresijas laikā kopējais atbildes reakcijas rādītājs bija 63%. Izdzīvošana pēc 2,5 gadiem bija 21%, bet pēc 5 gadiem - 8%. Nīderlandē RTHT ir standarta ārstēšana iepriekš pakļautām pacientēm, kurām ir recidīvs krūts vēzis. Pētījumi liecina, ka vienlaicīga hipertermijas un starojuma lietošana dod labāku klīnisko rezultātu nekā secīga lietošana. Šo metodi izmantoja pacientiem ar virspusējiem audzējiem. Galvenokārt aplūkojām galvas un kakla onkoloģisko saslimšanu gadījumus, kā arī krūšu adenokarcinomu. Atbilde uz terapiju krūts adenokarcinomas gadījumā bija 79% pilnīga atbildes reakcija, 14% daļēja atbildes reakcija un 7% atbildes reakcija uz ārstēšanu nebija.
Pētījums par ķīmijterapijas un RTHT apvienošanas efektivitāti pacientiem ar neoperējamu recidivējošu krūts vēzi: pacienti saņēma ķīmijterapiju un hipertermiju reizi nedēļā, 30 minūtes pēc apstarošanas. Ādas reakcija bija pieņemama, bet trīskāršā modalitāte izraisīja ievērojamu sistēmisku toksicitāti. Lai gan atbildes reakcija uz terapiju bija augsta, vietējā kontrole tika saglabāta tikai dažus mēnešus.
Pētījumi par lokāli recidivējošu krūts vēzi: Šajā gadījumā lokālā kontrole tiek sasniegta atkarībā no daudziem kombinētās ārstēšanas parametriem, tostarp audzēja reakcijas uz RTHT. Trīsdesmit deviņas sievietes ar recidivējošu krūts vēzi pirms staru terapijas saņēma RTHT ar hipertermiju. Viena gada dzīvildze bija 71%, bet 2 gadu dzīvildze bija 54%. 2001. gadā tika publicēta Atēnu Universitātes Medicīnas skolas pieredze, kurā RTHT kombinētā terapija tika izmantota virspusējo audzēju ārstēšanai. Šajā pētījumā piedalījās 88 pacienti ar recidivējošu krūts vēzi pēc mastektomijas un 27 pacienti ar recidivējošiem supraclavicular limfmezgliem. Kopējais ārstēšanas atbildes reakcijas rādītājs bija attiecīgi 85,2% un 70,4%. Tā pati zinātnieku komanda 1 gadu vēlāk publicēja pirmo pētījumu par liposomālā doksorubicīna efektivitāti kombinācijā ar RTHT. Bija 15 sievietes, kas cieta no lokāli progresējoša recidivējoša krūts vēža. Visi pacienti reaģēja uz terapiju. Pilnīgas atbildes reakcijas rādītājs bija 20%, bet daļējas atbildes rādītājs bija 80%. Ben-Yosef un citi atzina hipertermijas priekšrocības, pievienojot to staru terapijai, un aprakstīja savu pieredzi ar RTHT lokāli recidivējoša krūts vēža ārstēšanā. 15 sievietes saņēma staru terapiju kopā ar 45 minūšu hipertermiju (45 0C). 6 no 15 pacientiem pilnībā reaģēja uz terapiju, 4 pacienti reaģēja daļēji un 3 pacienti nereaģēja uz terapiju.
RTHT lietošana pacientēm ar lokāli recidivējošu krūts karcinomu: 41 no 75 bojājumiem iepriekš tika apstarots. Ir pierādīts, ka hipertermijai kombinācijā ar staru terapiju ir izteiktāks klīniskais efekts. Ādas čūlas tika novērotas 14% pacientu.
Pielietojums lokāli progresējoša vai recidivējoša krūts vēža ārstēšanai ar marginālu rezekciju(margināla izgriešana): Šajā pētījumā 15 pacienti tika sadalīti 2 grupās. Pirmā grupa saņēma RTHT pēc rezekcijas kā primāro terapiju, bet otrā grupa sastāvēja no pacientiem ar recidivējošiem audzējiem, kuriem arī tika veikta tā pati ārstēšanas procedūra - hipertermija kombinācijā ar staru terapiju. Kopējā dzīvildze pirmajā grupā bija 90%, bet otrajā grupā - 89%, vietējās kontroles rādītāji bija attiecīgi 75 un 81%, savukārt dzīvildze bez slimībām bija attiecīgi 9%, 4 un 6. Visiem pacientiem dzīvildze, vietējā kontrole un dzīvildze bez slimībām bija attiecīgi 89%, 80% un 68%.
Pieredze ar hipertermiju kombinācijā ar staru terapiju virspusēju audzēju recidīvu gadījumā:Šajā pētījumā RTHT efektivitāte tika novērtēta pacientiem ar slimības recidīvu, kuri iepriekš bija saņēmuši starojumu. Pēc 18 mēnešu novērošanas vietējā kontrole bija 72,7%, slimības stabilizācija bija 20,5%, un nekontrole bija 6,8%.
Atkārtotas apstarošanas efektivitāte kopā ar hipertermiju - 2010. gada pētījums: 78 pacientes ar recidivējošu krūts vēzi reaģēja uz kombinēto terapiju. 3 gadu etalons bija 78%, bet 5 gadu etalons bija 65%. 3 un 5 gadu pacientu izdzīvošanas rādītāji bija attiecīgi 66% un 49. Tika izskatīts gadījums, kad 66 gadus veca sieviete ar recidivējošu krūts vēzi saņēma staru terapiju un ķīmijterapiju, bet nereaģēja uz ārstēšanu. Tomēr, ja terapijai tika pievienota hipertermija, pacients pilnībā reaģēja uz ārstēšanu.Visbeidzot, kombinētā RTHT terapija var dot labu rezultātu bez nopietnas toksicitātes. RTHT tika lietots 198 pacientēm, kas cieš no recidivējoša krūts vēža. 3 gadu etalons bija 83%, bet 5 gadu etalons bija 78%.
Rezultāti un secinājumi
Rezultāti liecina, ka hipertermijas lietošana kombinācijā ar staru terapiju un/vai ķīmijterapiju krūts vēža ārstēšanai palielina ārstēšanas efektivitāti.
Hipertermijas izmantošana kombinācijā ar citām terapeitiskām metodēm ir daudzsološs virziens recidivējoša krūts vēža ārstēšanā. Reģistrētie atbildes reakcijas rādītāji uz terapiju ir augsti, un staru terapijas salīdzinājums ar vai bez hipertermijas pievienošanas kā ārstēšanas iespēju liecina, ka hipertermija piedāvā priekšrocības augstāka atbildes reakcijas līmeņa, vietējās kontroles līmeņa un izdzīvošanas rādītāja ziņā, izmantojot kombinēto terapiju. Ir vajadzīgi vairāk pētījumu, lai novērtētu hipertermijas lomu primāro krūts audzēju ārstēšanā, jo pašlaik pieejamie rezultāti ir iepriecinoši. Visbeidzot, ņemot vērā apmierinošos rezultātus daudzos pētījumos par hipertermijas izmantošanu galvas un kakla vēža ārstēšanā un ļaundabīgas melanomas ārstēšanā, jāapsver hipertermijas integrēšana citu veidu virspusēju bojājumu klīniskajā pārvaldībā. Papildus hipertermijas iekļaušanai jaunākajās NCCN vadlīnijās par recidivējoša krūts vēža ārstēšanu mēs iesakām izmantot RTHT citu ādas bojājumu un primāro krūts vēža bojājumu ārstēšanai.