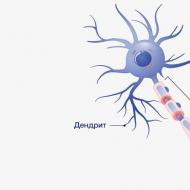
Hogyan lehet nátrium-nitrátot előállítani az ammóniából. Miben különböznek a nitritek a nitrátoktól? A párologtatási módszer jellemzői
A kémia lenyűgöző tudomány. Akit nemcsak az elmélet érdekel, hanem a gyakorlatban is kipróbálja tudását, az pontosan tudja, mi a tét. Minden tanuló ismeri a periódusos rendszer legtöbb elemét. De vajon mindenkinek sikerült a saját tapasztalata alapján kipróbálnia a reagensek keverését és a kémiai tesztek elvégzését? Még ma sem minden modern iskola rendelkezik a szükséges felszerelésekkel és reagensekkel, így a kémia továbbra is nyitott tudomány az önálló tanulás számára. Sokan otthoni kutatással igyekeznek mélyebben megismerni.
Egyetlen barkácsoló sem tud meglenni salétromsav nélkül – ez rendkívül fontos dolog a háztartásban. Nehéz az anyag beszerzése: csak szaküzletben lehet megvásárolni, ahol a vásárlás az anyag békés felhasználását igazoló dokumentumok szerint történik. Ezért, ha Ön házi készítésű mester, valószínűleg nem fogja tudni beszerezni ezt az összetevőt. Itt felmerül a kérdés, hogyan készítsünk salétromsavat otthon. Az eljárás nem tűnik bonyolultnak, azonban a kibocsátásnak megfelelő tisztaságú és szükséges koncentrációjú anyagnak kell lennie. Itt nem nélkülözheti a kísérleti vegyész képességeit.
Hol használják az anyagot?
A salétromsav használata biztonságos célokra ésszerű. Az anyagot az emberi tevékenység ilyen területein használják:
- színező pigmentek létrehozása;
- Fotófilmek fejlesztése;
- gyógyszerek készítése;
- műanyag termékek újrahasznosítása;
- felhasználás a kémiában;
- műtrágya kertészeti és kertészeti növényekhez;
- dinamit előállítása.

A tiszta salétromsav változatlan formában folyékony anyagnak tűnik, amely levegővel érintkezve fehér gőzöket kezd kibocsátani. Már -42 o C-on megfagy, és +80 o C-on forr. Hogyan távolíthatunk el egy ilyen anyagot, például salétromsavat, saját kezűleg otthon?
1. módszer
Füstös anyagot kapunk, ha a koncentrátumot nátrium (kálium) nitráttal (nátrium (kálium) nitráttal) tesszük ki. A reakció eredményeként a kívánt anyagot és nátrium- (kálium)-hidroszulfátot kapjuk. A reakcióséma így néz ki: NaNO 3 + H 2 ÍGY 4 => HNO 3 + NaHSO 4. Ne feledje, hogy a kapott anyag koncentrációja a reakcióba lépés előtt függ.
2. módszer
A salétromsav otthoni beszerzése alacsonyabb anyagkoncentráció mellett ugyanúgy történik, csak a nátrium-nitrátot szükséges ammónium-nitráttal helyettesíteni. A kémiai egyenlet így néz ki: NH 4 NEM 3 + H 2 ÍGY 4 =>(NH4) 2 ÍGY 4 + HNO 3 . Ne feledje, hogy az ammónium-nitrát megfizethetőbb, mint a kálium- vagy nátrium-nitrát, mivel a legtöbb kutató ennek alapján végez reakciókat.

Minél nagyobb a H 2 SO 4 koncentráció, annál töményebb lesz a salétromsav. A kiegyensúlyozott anyag eléréséhez növelni kell a reakcióhoz szükséges elektrolit térfogatát. A kívánt eredmény elérése érdekében a gyakorlatban a párologtatási módszert alkalmazzák, amely az elektrolit térfogatának fokozatos csökkentéséből áll, körülbelül 4-szeresére az eredetihez képest.
A párologtatási módszer jellemzői
Szitált homokot öntünk az edények aljára, és egy elektrolitos tartályt helyezünk el. Ebben az esetben a gáztűzhely felforralásának, a tűz elengedésének vagy csökkentésének folyamata. A folyamat hosszadalmas, ezért a türelem fontos ebben a kérdésben. A szakértők javasolják a forrásban lévő víz használatát - üveg- vagy kerámia csöveket, amelyeket kémiai kísérletekhez terveztek, beleértve a párologtatást is. Semlegesítik a buborékok képződését és csökkentik a forralás erejét, megakadályozva az anyag fröccsenését. Ilyen körülmények között megengedett a salétromsav otthoni beszerzése körülbelül 93% -os koncentrációban.
Eszközök és reagensek egy anyag gyakorlati elkészítéséhez
A reakcióhoz a következőkre lesz szüksége:
- tömény H 2SO 4 (> 95%) - 50 ml;
- ammónium-nitrát, kálium, nátrium;
- 100 ml űrtartalom;
- 1000 ml-es tartály;
- üvegtölcsér;
- gumi;
- vízfürdő;
- zúzott jég (cserélhető hóval vagy hideg vízzel);
- hőmérő.

A salétromsav otthoni beszerzése, mint bármely más kémiai reakció, óvintézkedéseket igényel:
- A salétromsav otthoni beszerzésének folyamatában a hőmérsékletet 60-70 ° C-on belül kell tartani. Ha ezeket a határokat túllépik, a sav elkezd bomlani.
- A reakció során gőzök és gázok szabadulhatnak fel, ezért savakkal történő munkavégzéskor védőmaszkot kell viselni. A kezet óvni kell a bőrrel való hirtelen érintkezéstől, ezért a vegyészek gumikesztyűben dolgoznak. A nagy vegyiparban, ahol az ember egészségre veszélyes anyagokkal érintkezik, a dolgozók általában speciális védőruházatban dolgoznak.
Most már tudja, hogyan juthat salétromsavat egy egyszerű reakcióval. Legyen óvatos, amikor ilyen anyagot használ, és csak békés célokra használja.
A salétromsav erős sav. A sói nitrátok- HNO 3 fémeken, oxidokon, hidroxidokon vagy karbonátokon történő hatására keletkezik. Minden nitrát jól oldódik vízben. A nitrát ion vízben nem hidrolizál.
A salétromsav sói hevítés hatására visszafordíthatatlanul lebomlanak, és a bomlástermékek összetételét a kation határozza meg:
a) a magnéziumtól balra lévő feszültségsorokban álló fémek nitrátjai:
b) a magnézium és a réz közötti feszültségsorozatban elhelyezkedő fémek nitrátjai:
c) fémek nitrátjai, amelyek egy feszültségsorozatban a higanytól jobbra helyezkednek el:
d) ammónium-nitrát:
A vizes oldatokban lévő nitrátok gyakorlatilag nem mutatnak oxidáló tulajdonságokat, de magas hőmérsékleten szilárd állapotban erős oxidálószerek, például szilárd anyagok olvasztásakor:
A cink és az alumínium lúgos oldatban a nitrátokat NH 3 -dá redukálja:
A nitrátokat széles körben használják műtrágyaként. Ugyanakkor szinte minden nitrát jól oldódik vízben, ezért ásványi anyagok formájában rendkívül kicsi a természetben; a kivétel a chilei (nátrium) nitrát és az indiai nitrát (kálium-nitrát). A legtöbb nitrátot mesterségesen állítják elő.
A folyékony nitrogént hűtőközegként és krioterápiában használják. A petrolkémiai iparban nitrogént használnak a tartályok és csővezetékek öblítésére, a csővezetékek nyomás alatti működésének tesztelésére és a lerakódások termelésének növelésére. A bányászatban a nitrogén segítségével robbanásbiztos környezetet lehet kialakítani a bányákban, felrobbantani a kőzetrétegeket.
A nitrogén egyik fontos felhasználási területe számos nitrogéntartalmú vegyület, például ammónia, nitrogénműtrágyák, robbanóanyagok, színezékek stb. további szintézisére való felhasználása. A kokszgyártásban nagy mennyiségű nitrogént használnak fel ("dry coke kvencsing"). ”) a koksznak a kokszolókemence akkumulátoraiból történő kiürítése során, valamint a rakétákban lévő üzemanyag „kipréselésére” a tartályokból a szivattyúkba vagy a hajtóművekbe.
Az élelmiszeriparban a nitrogént élelmiszer-adalékanyagként tartják nyilván. E941, mint gázközeg a csomagoláshoz és tároláshoz, hűtőközeget és folyékony nitrogént használnak olajok és szénsavmentes italok palackozásakor, hogy túlnyomást és inert atmoszférát hozzon létre a lágy edényekben.
Nitrogéngáz tölti meg a repülőgépek futóműveinek abroncskamráit.
31. Foszfor - kinyerés, tulajdonságai, felhasználás. Allotrópia. Foszfin, foszfóniumsók - előállítása és tulajdonságai. Fémfoszfidok, előállítása és tulajdonságai.
Foszfor- D. I. Mengyelejev periodikus rendszerének harmadik periódusának 15. csoportjának kémiai eleme; atomszáma 15. Az elem a pniktogének csoportjába tartozik.
A foszfort apatitból vagy foszforitból nyerik koksszal és szilícium-dioxiddal való kölcsönhatás eredményeként, körülbelül 1600 ° C hőmérsékleten:
A keletkező foszforgőz a vevőben egy vízréteg alatt kondenzálódik allotróp módosulattá fehér foszfor formájában. A foszforitok helyett az elemi foszfor előállításához más szervetlen foszforvegyületeket is redukálhatunk szénnel, például metafoszforsavat:
A foszfor kémiai tulajdonságait nagymértékben meghatározza allotróp módosulása. A fehér foszfor nagyon aktív, a vörös és fekete foszforra való áttérés folyamatában a kémiai aktivitás csökken. A levegőben lévő fehér foszfor szobahőmérsékleten légköri oxigénnel oxidálva látható fényt bocsát ki, az izzás a foszfor oxidációjának fotoemissziós reakciójából adódik.
A foszfor oxigén hatására könnyen oxidálódik:
(többlet oxigénnel)
(lassú oxidációval vagy oxigénhiánnyal)
Kölcsönhatásba lép sok egyszerű anyaggal - halogének, kén, néhány fém, oxidáló és redukáló tulajdonságokat mutatva: fémekkel - oxidálószer, foszfidokat képez; nem fémekkel – redukálószerrel.
A foszfor gyakorlatilag nem egyesül hidrogénnel.
Hideg tömény lúgos oldatokban az aránytalanítási reakció is lassan megy végbe:
Az erős oxidálószerek a foszfort foszforsavvá alakítják:
A foszfor oxidációs reakciója gyufa meggyújtásakor megy végbe, a Berthollet-só oxidálószerként működik:
A fehér ("sárga") foszfor a kémiailag legaktívabb, legmérgezőbb és gyúlékonyabb, ezért nagyon gyakran használják (gyújtóbombákban stb.).
A vörösfoszfor az ipar által előállított és felhasznált fő módosulat. Gyufák, robbanóanyagok, gyújtóanyagok, különféle tüzelőanyagok, valamint extrém nyomású kenőanyagok gyártásához használják, mint gettert az izzólámpák gyártásában.
Az elemi foszfor normál körülmények között számos stabil allotróp módosulat formájában létezik. A foszfor összes lehetséges allotróp módosulását még nem vizsgálták teljes mértékben (2016). Hagyományosan négy változatát különböztetik meg: fehér, vörös, fekete és fémfoszfor. Néha úgy is hívják fő- allotróp módosítások, ami azt jelenti, hogy az összes többi leírt módosítás ennek a négynek a keveréke. Normál körülmények között a foszfornak csak három allotróp módosulata stabil (például a fehér foszfor termodinamikailag instabil (kvázi-stacionárius állapot), és normál körülmények között idővel vörösfoszforrá alakul). Ultramagas nyomás mellett az elem fémes formája termodinamikailag stabil. Minden módosítás különbözik színben, sűrűségben és egyéb fizikai és kémiai jellemzőkben, különösen a kémiai aktivitásban. Amikor egy anyag állapota termodinamikailag stabilabb módosulásba megy át, a kémiai aktivitás csökken, például a fehér foszfor szekvenciális átalakulása során vörössé, majd a vörös feketévé (fémessé).
Foszfin (hidrogén-foszfid, hidrogén-foszfid, foszfor-hidrid, foszfán pH 3) színtelen, mérgező gáz (normál körülmények között), sajátos rothadt halszaggal.
A foszfint fehér foszfor forró lúggal való reagáltatásával nyerik, például:
Víz vagy savak foszfidokon történő hatására is előállítható:
A hidrogén-klorid hevítéskor kölcsönhatásba lép a fehér foszforral:
A foszfónium-jodid bomlása:
A foszfonsav bomlása:
vagy állítsa vissza:
Kémiai tulajdonságok.
A foszfin nagyon különbözik megfelelőjétől, az ammóniától. Kémiai aktivitása nagyobb, mint az ammóniáé, vízben rosszul oldódik, mivel a bázis sokkal gyengébb, mint az ammónia. Ez utóbbi azzal magyarázható, hogy a H–P kötések gyengén polarizáltak, és a foszfor (3s 2) egyedüli páros aktivitása alacsonyabb, mint az ammóniában lévő nitrogéné (2s 2).
Oxigén hiányában melegítéskor elemekre bomlik:
levegőn spontán meggyullad (difoszfingőz jelenlétében vagy 100 °C feletti hőmérsékleten):
Erős helyreállító tulajdonságokat mutat:
Erős protondonorokkal való kölcsönhatás során a foszfin PH 4 + iont tartalmazó foszfóniumsókat képezhet (hasonlóan az ammóniumhoz). A foszfóniumsók, színtelen kristályos anyagok rendkívül instabilak, könnyen hidrolizálódnak.
A foszfóniumsók, akárcsak maga a foszfin, erős redukálószerek.
Foszfidok- bináris foszforvegyületek más kevésbé elektronegatív kémiai elemekkel, amelyekben a foszfor negatív oxidációs állapotot mutat.
A legtöbb foszfid foszfor és tipikus fém vegyülete, amelyeket egyszerű anyagok közvetlen kölcsönhatásával kapnak:
Na + P (piros) → Na 3 P + Na 2 P 5 (200 °C)
A bór-foszfid előállítható mind az anyagok közvetlen kölcsönhatásával körülbelül 1000 ° C-on, mind a bór-triklorid alumínium-foszfiddal való reakciójával:
BCl 3 + AlP → BP + AlCl 3 (950 °C)
A fém-foszfidok instabil vegyületek, amelyek vízzel és híg savakkal bomlanak. Ebben az esetben foszfint, hidrolízis esetén fém-hidroxidot, savakkal való kölcsönhatás esetén sókat kapunk.
Ca 3 P 2 + 6H 2 O → 3Ca(OH) 2 + 2PH 3
Ca 3 P 2 + 6HCl → 3CaCl 2 + 2PH 3
Mérsékelt melegítés mellett a legtöbb foszfid lebomlik. Foszforgőz túlnyomása alatt megolvadt.
A bór-foszfid BP ezzel szemben tűzálló (t pl. 2000 °C, bomlás közben), nagyon inert anyag. Csak tömény oxidáló savakkal bomlik, szinterezés közben oxigénnel, kénnel, lúgokkal hevítve reagál.
32. Foszfor-oxidok - molekulaszerkezet, előállítás, tulajdonságok, alkalmazás.
A foszfor számos oxidot képez. Ezek közül a legfontosabbak a foszfor-oxid (V) P 4 O 10 és a foszfor-oxid (III) P 4 O 6 . Képleteiket gyakran egyszerűsített formában írják - P 2 O 5 és P 2 O 3. Ezen oxidok szerkezete megtartja a foszforatomok tetraéderes elrendezését.
Foszfor(III)-oxid P 4 O 6- viaszos kristályos massza, amely 22,5 ° C-on olvad és színtelen folyadékká alakul. Mérgező.
Hideg vízben oldva foszforsavat képez:
P 4 O 6 + 6H 2 O \u003d 4H 3 PO 3,
lúgokkal reagálva pedig a megfelelő sókat (foszfitokat).
Erős redukálószer. Ha oxigénnel kölcsönhatásba lép, P 4 O 10-vé oxidálódik.
A foszfor(III)-oxidot a fehér foszfor oxigén hiányában történő oxidációjával állítják elő.
Foszfor (V)-oxid P 4 O 10- fehér kristályos por. A szublimációs hőmérséklet 36°C. Számos módosítása van, amelyek közül az egyik (az úgynevezett illékony) P 4 O 10 összetételű. Ennek a módosításnak a kristályrácsát gyenge intermolekuláris erők által összekapcsolt P 4 O 10 molekulák alkotják, amelyek melegítés hatására könnyen feltörnek. Innen ered ennek a fajtának a volatilitása. Más módosítások polimerek. Ezeket a PO 4 tetraéderek végtelen rétegei alkotják.
Amikor a P 4 O 10 kölcsönhatásba lép a vízzel, foszforsav képződik:
P 4 O 10 + 6H 2 O \u003d 4H 3 PO 4.
Mivel savas oxid, a P 4 O 10 reakcióba lép bázikus oxidokkal és hidroxidokkal.
A foszfor magas hőmérsékletű oxidációja során keletkezik oxigénfeleslegben (száraz levegő).
Kivételes higroszkópossága miatt a foszfor (V)-oxidot laboratóriumi és ipari technológiában használják szárító és víztelenítő szerként. Szárító hatásában minden más anyagot felülmúl. A kémiailag megkötött vizet a vízmentes perklórsavból eltávolítják, annak anhidridjével:
4HClO 4 + P 4 O 10 \u003d (HPO 3) 4 + 2Cl 2 O 7.
A P 4 O 10-et gázok és folyadékok szárítására használják.
Széles körben használják szerves szintézisben dehidratációs és kondenzációs reakciókban.
A nitritek és a nitrátok nemcsak elnevezésükben különböznek egymástól, hanem a képletükben is különböző elemeket tartalmaznak. Van azonban valami közös bennük. Ezeknek az anyagoknak a hatálya meglehetősen széles. Az emberi szervezetben is jelen vannak, és ha túl sok halmozódik fel, az ember súlyos mérgezést kap, ami akár halálhoz is vezethet.
Mik azok a nitrátok
Egyszerűen fogalmazva, a nitrátok a salétromsav sói. Képletükben egy számjegyű aniont tartalmaznak. Régen nitrátnak hívták. Most ez a neve az ásványoknak, valamint a mezőgazdaságban használt műtrágyáknak.
A nitrátokat salétromsav segítségével állítják elő, amely a fémekre, oxidokra, sókra és hidroxidokra hat. Minden nitrát vízzel hígítható. Szilárd állapotban erős oxidálószerek, de tulajdonságaik megszűnnek, ha salétromsavat adunk az oldathoz.
A nitrátok normál hőmérsékleten megőrzik tulajdonságaikat, de alacsony hőmérsékleten megolvadnak és egészen a teljes lebomlásig. Ezeknek az anyagoknak a beszerzési folyamata nagyon összetett, ezért talán csak a vegyészek számára lesz érdekes.
A nitrátok a robbanóanyagok alapja - ezek az ammonitok és más anyagok. Főleg ásványi műtrágyaként használják. Ma már nem titok, hogy a növények sóból származó nitrogént használnak sejtjeik felépítéséhez. A növény klorofillt hoz létre, amelyben él. De az emberi testben a nitrátok nitritté válnak, ami az embert a sírba juttathatja.
A nitritek is sók
A nitritek szintén a salétromsav sói, de kémiai összetételükben eltérő a képlet. Nátrium-, kalcium-nitritek ismertek. Ismeretesek az ólom, ezüst, alkáli, alkáliföldfém, 3D fémek nitritjei is.
Ezek olyan kristályos anyagok, amelyek a káliumban vagy a báriumban is megtalálhatók. Egyes anyagok jól oldódnak vízben, míg mások, mint például az ezüst, a higany vagy a réz-nitrit, rosszul oldódnak benne. Figyelemre méltó, hogy a nitritek gyakorlatilag nem oldódnak szerves oldószerekben. De ha növeli a hőmérsékletet, a nitritek oldhatósága javul.
Az emberiség nitriteket használ nitrogénfestékek előállítására, kaprolaktám előállítására, valamint oxidáló és redukáló reagensként a gumi-, textil- és fémmegmunkáló iparban. Például a nátrium-nitrit jó konzerválószer, és betonkeverékek gyártásánál használják keményedésgyorsítóként és fagyálló adalékként.
A nitritek mérgek az emberi hemoglobinra, ezért naponta el kell távolítani őket a szervezetből. Közvetlenül vagy más anyagokkal együtt bejutnak az emberi szervezetbe. Ha az emberi szervezet normálisan működik, a szükséges mennyiségű anyag megmarad, a felesleges pedig eltávolítódik. De ha egy személy beteg, akkor probléma van a nitritmérgezéssel.
(A) Nitritek
A megfelelőség függvényében kivételek az erre az alcsoportra vonatkozó általános rendelkezésekben meghatározottak szerint ide tartoznak a nitritek, a salétromsav fémsói (HNO 2) (vtsz.).
- Nátrium-nitrit(NaNO2). A nátrium-nitrát ólommal történő redukálásával és az ólomlitar előállítása során nyerik. Színtelen kristályok, higroszkóposak, vízben jól oldódnak. Oxidálószerként használják kádfestésnél; szerves szintézisben; hús feldolgozásához; a fotózásban; mint a patkányméreg stb.
- Kálium-nitrit(KNO 2). Ugyanazokkal a módszerekkel nyerik, mint a nátrium-nitritet, vagy kén-dioxiddal kalcium-oxid és kálium-nitrát keverékén. Fehér kristályos por vagy sárgás rudak; gyakran más sókat is tartalmaz szennyeződésként. Vízben oldódik, levegőn erősen elmosódik a tulajdonságok romlásával. Ugyanarra a célra használják, mint a nátrium-nitritet.
- bárium-nitrit(Ba(NO 2) 2). Pirotechnikában használt kristályok.
- Egyéb nitritek. Ezek közé tartozik az ammónium-nitrit, instabil és robbanásveszélyes termék; oldatként használják a nitrogén laboratóriumi előállításához.
(B) Nitrátok
A megfelelőség függvényében kivételek az erre az alszámra vonatkozó általános rendelkezésekben meghatározottak, ide tartoznak a nitrátok, a fémsók és a salétromsav (a vámtarifaszám), kivéve ammónium-nitrát és nátrium-nitrát, tisztán és tisztítatlanul ( cím vagy ). (A többi kivételt lásd alább.)
Ide tartoznak a bázikus nitrátok is.
- kálium-nitrát(KNO 3) (más néven salétrom). Nátrium-nitrátból és kálium-kloridból nyerik. Színtelen kristály vagy üvegszerű massza, vagy fehér kristályos por, amely vízben oldódik és nyers állapotban higroszkópos. Használják a nátrium-nitráthoz hasonlóan, valamint lőpor, vegyi detonátorok, pirotechnikai eszközök, gyufa és kohászati folyasztószerek gyártásához.
- Bizmut-nitrátok:
(A) semleges bizmut-nitrát(Bi(NO3)35H2O). Salétromsav bizmut hatására nyerik; nagy színtelen, elfolyósodó kristályok. Bizmut-oxidok vagy -sók és egyes lakkok előállítására használják;
b) bázikus bizmut-nitrát(BiNO 3 (OH) 2). Semleges bizmut-nitrátból nyerik; gyöngyházfehér por, vízben nem oldódik. Az orvostudományban használják (emésztőrendszeri betegségek kezelésére); kerámiagyártásban (szivárványszínek), kozmetikában, biztosítékok gyártásában stb.
- magnézium-nitrát(Mg (NO 3) 2 6H 2O). Színtelen kristályok, vízben oldódnak. Pirotechnikában használják, tűzálló termékek (magnézium-oxiddal), izzórácsok stb. előállítására.
- kalcium-nitrát(Ca(NO 3) 2). A zúzott mészkő salétromsavval történő kezelésével nyerik. Fehér, szétterülő massza, vízben, alkoholban és acetonban oldódik. Pirotechnikában, robbanóanyag, gyufa, műtrágya stb. gyártásában használják.
- vas-nitrát(Fe(NO3)36H2O vagy 9H2O). Kék kristályok. Festésnél és nyomtatásnál maróanyagként használják (tiszta formában vagy acetáttal keverve). A gyógyászatban tiszta vizes oldatot használnak.
- kobalt-nitrát(Co(NO3)26H20). Lila, vöröses vagy barnás kristályok, vízben oldódnak és elfolyósodnak. Kobaltkék vagy kobaltsárga és szimpatikus tinták előállításához használják; kerámiák díszítésére; kobalt elektromos leválasztásához stb.
- Nikkel-nitrát(Ni(NO 3) 2 6H 2O). Vízben oldódó, elfolyósodó zöld kristályok. Kerámiák (barna pigmentek) gyártásához használják; festéskor (maradóként); nikkel galvanizálása során; nikkel-oxid vagy tiszta nikkel katalizátorok előállítására.
- Réz-nitrát(Cu(NO 3) 2). Réz salétromsavban való feloldásával és ezt követő kristályosítással nyerik (3 vagy 6 vízmolekulát tartalmaz, a hőmérséklettől függően). Kék vagy zöld kristályok, vízben oldódnak, higroszkóposak; mérgező. Pirotechnikában használják; színezékek gyártása során; textilanyagok festése vagy nyomtatása során (maradó); kétértékű réz-oxid előállításához és fényképészeti papír gyártásához; galvanizálás alkalmazásakor a fémek mesterséges patinázása stb.
- Stroncium-nitrát(Sg(NO 3) 2). Stroncium-oxid vagy stroncium-szulfid salétromsavra gyakorolt hatására nyerik, vízmentes sóként vagy hidratált sóként (4 vízmolekulával) csökkentett hőmérsékleten. Színtelen kristályos por, elfolyósodik, vízben oldódik, hevítésre bomlik. Pirotechnikában (piros fény), gyufagyártásban használják.
- kadmium-nitrát(Cd(NO3)24H20). Oxidból nyerték. Színtelen tűk, elfolyósodó, vízben oldódik. A kerámia- vagy üvegiparban színezőanyagként használják.
- bárium-nitrát(Ba(NO 3) 2). Természetes karbonátból (witerit) nyert (Vtsz.). Színtelen vagy fehér kristályok vagy kristályos por; vízben oldódik, mérgező. Pirotechnikában használják (zöld fény); robbanóanyagok, optikai üvegek, kerámia mázak, báriumsók vagy nitrátok stb. gyártásánál.
- ólom-nitrát(Рb(NO 3) 2). Az ólom-nitrát melléktermékként képződik az ólom-dioxid előállításánál salétromsav vörös ólom hatására. Színtelen kristályok, vízben oldódnak; mérgező. Pirotechnikában (sárga fény), gyufák, robbanóanyagok és egyes színezékek gyártásához használják; barnulásban, fényképezésben és litográfiában; ólomsók előállítása, mint oxidálószer a szerves szintézisben.
A fentieken kívül kivételek, Is nem tartalmazza a következő termékeket.
Bevezetés
Nem valószínű, hogy Önök közül bárki is hallott a nátrium-nitrátról. Nevét gyakran emlegetik az iskolában, nem csak az iparban. De csak a név! Mit lehet még tudni a nátrium-nitrátról? Erről fogunk beszélni a mai cikkben.
MeghatározásA nátrium-nitrát (NaNO 3 képlet) a salétromsav nátriumsója. Nevezhetjük „nátrium-nitrátnak” vagy „nátrium/nátrium/chilei nitrátnak”.
Tulajdonságok
A nátrium-nitrátot színtelen hosszú kristályok képviselik, amelyek romboéderes vagy trigonális kristályrácsosak. Nagyon sós ízűek. Különböző anyagokban eltérően oldódnak, de a nátrium-nitrát vízben "olvad" a legjobban. 380 ° C hőmérsékleten ez a vegyület nátrium-nitritre és oxigénre bomlik. A reakció a következőképpen néz ki: 2NaNO 3 => 2NaNO 2 + O 2. A nátrium-nitrát szintén cserereakciókba léphet, melynek második reagense az alkálifém-sók. Az egyik termék mindig nitrát lesz, amelynek oldhatósága sokkal kisebb, mint a most tárgyalt anyagé. Például, amikor a nátrium-nitrát reagál kálium-kloriddal, kálium-nitrát és konyhasó (nátrium-klorid) képződik. Az olvadékban a tárgyalt nitrát erős oxidáló, oldatban pedig redukáló tulajdonságokat mutat. Lebomlása során oxigén szabadul fel, és ennek köszönhetően ez a vegyület reakcióba léphet nem fémekkel.

Ezt a nitrátot többféle módon lehet előállítani:
Salétromsav reakciója fémmel vagy nátrium-oxiddal
Ha tiszta nátriumot adunk a salétromsavhoz, semlegesítési reakció megy végbe. Termékei a kívánt anyag, a víz, valamint a gáznemű nitrogén és annak oxidjai (I, II) lesznek. Ha ugyanahhoz a savhoz nátrium-oxidot adunk, az eredmény a most tárgyalt vegyület és víz.
Salétromsav reakciója savas sókkal vagy nátrium-hidroxiddal
Ha a HNO 3-hoz savas nátriumsót (például annak bikarbonátját) adunk, akkor a kívánt anyag, víz és szén-dioxid keletkezik, amely gyorsan elpárolog. Ha a nátrium-hidroxid lesz a második reagens, akkor az oxidjához és a salétromsavhoz hasonlóan csak nátrium-nitrátot és H 2 O-t kapunk.
Az ammónium-nitrát reakciója savas sókkal vagy nátrium-hidroxiddal
A salétromsav sikeresen helyettesíthető ammónium-nitráttal. A nátrium-hidroxiddal való kölcsönhatás során a kívánt anyag, víz és gázhalmazállapotú ammónia keletkezik, amelyek nátrium-hidrogén-karbonáttal reagálva ezek a vegyületek és a szén-dioxid termékekké válnak.
A konyhasó reakciója ezüst-nitráttal
Ebben az esetben cserereakció megy végbe, amelynek termékei a nátrium-nitrát és az ezüst-klorid.
Alkalmazás

Ezt az anyagot értékes nitrogénműtrágyaként használják. A pirotechnikai, élelmiszer-, üveg- és fémfeldolgozó ipar nem nélkülözheti a nátrium-nitrátot. A nátrium-nitrátot többféle módon vonják ki a természetes lerakódásokból:
Ennek az anyagnak a kimosódása forró vízzel és kristályosítás;
Nitrogén-oxidok abszorpciója szódabikarbóna oldattal;
Szulfát/klorid/nátrium-karbonát és kalcium/ammónium-nitrát cseréje.
Következtetés
Ez a nátrium-nitrát fontos szerepe. Vannak más anyagok is, amelyek nélkül az ember nem tud nélkülözni, de ezekről máskor beszélünk.