A HIV vírus szerkezete. A HIV sejt szerkezete. A HIV, AIDS terjedésének módjai
A humán immundeficiencia vírus (HIV) morfológiája és szerkezete
A humán immundeficiencia vírus HIV-fertőzést okozó limfotróp vírus, amely AIDS kialakulásával végződik, amelyet az immunrendszer domináns elváltozása, hosszú lefolyás, a klinikai megnyilvánulások polimorfizmusa, magas mortalitás, sokféle természetes terjedési útvonal jellemez. (pl. szexuális és parenterális), a járvány gyors terjedésének tendenciája.
A HIV-t 1983-ban fedezte fel L. Montagnier és R. Gallo.
Család: Retroviridae, Nemzet: Lentivirus.
A HIV morfológiája és szerkezete.
HIV RNS vírus. A HIV-virionok gömb alakúak, átmérőjük 100 nm. A virionok külső héját kettős lipidréteg alkotja, amelyet glikoproteinek - "tövis" - átjárnak. A lipidburok a gazdasejt plazmamembránjából származik, amelyben a vírus szaporodik. A glikoprotein molekula 2 alegységből áll - a gp 120 - a virion felszínén található, a gp 41 - behatol a lipidrétegbe. Mindkét fehérje képződése nem kovalens kötéssel történik közöttük, amikor a HIV-gp-161 külső héjának fehérjéjét elvágják. A virion külső héja alatt található a mag. Kúpos vagy hengeres alakja van, és p24 és p25 kapszidfehérjékből, számos mátrixfehérjéből (p6 és p11), valamint proteázfehérjékből (p11 és p11) áll. A szaporodáshoz a HIV-nek van reverz transzkriptáza vagy revirtase. A HIV genom a következőkből áll: 1) 3 fő szerkezeti gén: gag- kódolja a mátrixot, kapszidot, nukleokapszid fehérjéket és proteáz fehérjéket; pol- kódolja a reverz transzkriptázt; env - a gp120-at és a gp41-et kódolja. 2) 7 szabályozó és funkcionális gén: tat és rev - növeli a fehérje transzkripció sebességét, nef - szabályozza a HIV-szaporodás leállását, vif - egy fehérjét kódol, amely felelős azért, hogy az egyik sejtből bimbózik és megfertőzze a másikat. Ide tartoznak még a vpr, vpu, vpx - biztosítják a szaporodási és fertőzési folyamatok végrehajtását.
A magfehérjék és a burokglikoproteinek (p161), amelyeket nagyfokú antigénvariabilitás jellemez, antigén tulajdonságokkal rendelkeznek.
A vírusnak 2 típusa van - a HIV-1 és a HIV-2, amelyek szerkezeti és antigén tulajdonságaikban különböznek egymástól, ami különbségeket okoz a betegség lefolyásában.
A HIV életciklusa 4 szakaszból áll (adszorpció, RNS felszabadulás, RNS szintézis, összeállítás), amely 1-2 nap alatt fejeződik be. A vírus elsősorban a limfocitákra, esetenként makrofágokra, leukocitákra, dendritikus sejtekre, az idegrendszer sejtjeire hat, mert. tartalmazzák a CD 4 receptort, amellyel a vírus p120 specifikusan kölcsönhatásba lép.
A HIV-nek van egy gömb alakú szuperkapszidja, amelyet kettős lipidréteg alkot, glikoproteincsúcsokkal. A "tüskéket" a gp 160 glikoprotein (gp - glikoprotein; 160 - a fehérje molekulatömege kilodaltonban) képezi, amely 2 alegységből áll.
A gp 120 egy erősen immunogén fehérje, amely konzervált és hipervariábilis régiókat tartalmaz, valamint egy olyan régiót, amely megköti a T-limfociták CD4 molekuláját (T-helper receptor). A gp 120 fehérje a vírus felszínén található.
gp 41 - áthatol a lipid kettős rétegen, és nem kovalensen kapcsolódik a gp 120-hoz. Ez a vírus összeolvadását okozza a T-limfocitával (miután a gp 120 érintkezésbe került a CD4-gyel). Ezenkívül a gp41 közvetítheti a vírus bejutását a CD4-receptorok hiányos sejtjébe.
A szuperkapszid mátrix fehérje alatt p 17 (p - protein) található. A legmélyebb a mag, amely csonka henger alakú - ez a nukleokapszid. A kapszid alkotja a p 24 fehérjét. A kapszid belsejében található a vírusgenom, amelyet két azonos nem-fragmentáris RNS+ szál képvisel, amelyek 5"-os végük közelében kapcsolódnak egymáshoz.
A HIV összetétele a következő enzimeket tartalmazza: reverz transzkriptáz, amely 3 doménből áll - reverz transzkriptáz, RNáz és DNS-függő DNS polimeráz és endonukleáz. Maga a vírusgenom 9 génből áll, amelyek egy része átfedésben van és exon-intron szerkezetű.9 vírusgén 9 szerkezeti és 6 szabályozó fehérje szintézisét szabályozza.
1. ábra.
A HIV-fertőzés kórokozójának életciklusa
I. A vírus a T-limfocita (CD4 sejt) felszínén lévő specifikus receptormolekulákhoz kötődik, és bejut a sejtbe, felszabadítva annak burkát.
II. Vírusos RNS mátrixon használva
A reverz transzkriptáz enzim egy DNS-másolatot szintetizál, amely azután kétszálú DNS-kópiává válik.
III. A DNS-másolat a sejtmagba kerül (az aktív enzim ebben a szakaszban az integráz). Ott gyűrűs szerkezetet alkot, és beépül a sejt DNS-ébe.
IV. A DNS-másolat több évig is megmaradhat a sejtben. Jelenlétét a vérben specifikus antitestekkel mutatják ki.
V. A szervezet másodlagos fertőzése serkenti egy DNS-másolat átírását - a vírus hírvivő RNS szintézisét.
VI. A vírus hírvivő RNS-én a sejtes riboszómák végzik a vírusfehérjék szintézisét.
VII. Az újonnan szintetizált vírusfehérjékből és a vírus RNS-ből új vírusrészecskéket állítanak össze; a sejtből való kilépésük gyakran sejthalálban végződik.
A sejttel való kölcsönhatás mechanizmusa. A HIV-fertőzés patogenezise
A vírusok intracelluláris kórokozók, mindegyik vírus egy adott sejttípushoz tropizmussal rendelkezik. Tropisztikusságát az határozza meg, hogy egy adott vírus receptora jelen van a célsejtben, és hogy a vírusgenom képes-e beépülni a sejtgenomba. A receptorok különféle típusú sejteken lehetnek. A receptor funkciót ligandumok látják el: fehérjék, lipidek, fehérjék szénhidrát komponensei és lipidek. A plazmamembránon lokalizálódnak, és biztosítják a hormonok, tápanyagok, növekedési és szabályozó faktorok stb. bejutását a sejtbe.
A receptorok közös szerkezeti jellemzőkkel rendelkeznek, vagyis egy sejten kívüli helyből, egy intramembrán helyből és egy, a citoplazmába merített helyből állnak.
A HIV receptorai a CD4 differenciálódási antigén és a CD4-től független komponensek. A CD4 egy 55 000 molekulatömegű glikoprotein, amely szerkezetében homológiát mutat az immunglobulinok bizonyos szakaszaival. A vírusnak a HIV-1 gp120-on keresztül történő rögzítése a CD4 gazdasejt membránreceptorhoz blokkolja az antigénprezentáló sejtekből érkező jelek észlelését. A vírus további replikációja sejthalálhoz, működésük megzavarásához és ezt követő immunhiány kialakulásához vezet.
Az emberi szervezetben számos olyan sejt található, amelyek HIV-receptorral rendelkeznek (CD4+ limfociták, CD8+ limfociták, dendritikus sejtek, monociták, eozinofilek, mega-kariociták, neuronok, mikroglia, spermiumok), és ha a vírus bejut, citopátiás hatás lép fel. sokuknál megfigyelhető.
A fő receptoron, a CD4-en kívül számos társreceptor van, különösen a kemokin receptorok, amelyek szükségesek ahhoz, hogy a HIV bejusson a sejtbe. A kemokinek olyan polipeptidek, amelyek a sejteket egy bizonyos irányba mozgatják. Emberben körülbelül 40 különálló hasonló fehérjét izoláltak, ezeket alfa és béta kemokinekre osztották. R. Gallo laboratóriumában 1995-ben kemokineket izoláltak CD8-limfocitákból és két fehérjét makrofágokból. Megakadályozzák a CD+ mononukleáris sejtek fertőzését a HIV-1 makrofagotrop, de nem limfotróp változataival.
Így izoláltak fehérjéket - kemokinek, amelyek blokkolják a HIV makrofágokba való behatolását a CD4 antigénnel, és fehérjéket - a fertőzést elősegítő társreceptorokat. Ugyanakkor a koreceptorok a kemokinek receptorai, de a HIV receptorként használja őket, amelyek segítségével behatol a sejtbe.
A CD4+ sejtekbe való behatolás után a HIV azonnal replikációba kezd, és minél aktívabbak a CD4+ sejtek, annál nagyobb a vírusszaporodási folyamat. Minden szabályozó, amely aktiválja a CD4+ sejteket, fokozza a vírus replikációját. Ilyen szabályozók közé tartozik a tumor nekrózis faktor (TNF), a granulocita/makrofág kolónia stimuláló faktor, az interleukin-6 (IL-6). A vírus replikációját gátló negatív szabályozók közé tartozik az interferon (IF) és a transzformáló növekedési faktor.
A vírus többirányú hatást fejt ki nemcsak a T-limfocitákra, hanem a gyilkos sejtekre is. Ez utóbbi aktivitása a betegség előrehaladtával folyamatosan csökken; a szervezet a betegség előrehaladtával kevésbé ellenáll a gyulladásos folyamatoknak. Az IL-2 és a g-interferon hiánya még normál számú NK-sejtek esetén is funkcionális aktivitásuk csökkenéséhez vezet HIV-fertőzött betegeknél (Kovalchuk L.V., Cheredeev A.N., 1991).
A CD4+ sejteknek két típusát azonosították: T-helper-1 (Th1) és T-helper-2 (Th2). A Th1 citokineket termel, amelyek stimulálják a sejtes immunitást, a Th2 pedig olyan citokineket termel, amelyek fokozzák az antitestek keletkezését. A Th1 és Th2 aránya kiegyensúlyozott és kompetitív; az egyik sejttípus citokinjeinek túlzott expressziója egy másik sejttípus elnyomásához vezet. HIV-fertőzött betegeknél a Th1 szuppresszált, ami biztosítja mind a víruspatológiát, mind az onkogenezist.
A gp120 vírus membránglikoproteinjének (HIV-2 esetén gp105) affinitása a CD4 sejtreceptorhoz nagymértékben meghatározza a sejtszerkezetek szelektív károsodását, ezért CD4+ limfociták, vérmonociták, szöveti makrofágok és dendrites sejtek vesznek részt benne. a kóros folyamatban mindenekelőtt és nagyobb mértékben vér, nyirokcsomók, lép, bőr, alveoláris és intersticiális tüdőmakrofágok, mikrogliák és az idegrendszer egyéb sejtjei, amelyek CD4 receptorokkal rendelkeznek. B - és O-limfociták, retikuláris sejtek, bélhámsejtek, Langerhans sejtek is érintettek, ez utóbbiak még könnyebben fertőződnek, mint a CD4 + limfociták. Éppen a Langerhans-sejteknek van nagy jelentősége a HIV-fertőzés szervezetben való terjedésében, mert a vírus hosszú ideig, esetenként évekig megmarad bennük.
A CD4 receptor jelenléte számos és nem csak immunkompetens sejten, az e receptorral nem rendelkező sejtek megfertőzésének képessége meghatározza a HIV politrópiáját és a klinikai kép polimorfizmusát. A CD4 receptorokat tartalmazó egyes sejtek károsodásának mértéke a sejtmembránon lévő receptorok sűrűségétől függ. A legnagyobb sűrűség a limfociták T-helper alpopulációján van, amely nagymértékben meghatározza a betegség patogenezisét. De a célsejtek vírus általi károsodásának mértéke attól is függ, hogy a vírus képes-e replikálódni egy vagy másik típusú sejtben. Nyilvánvalóan a replikáció főként CD4+ fenotípusú limfocitákban és monocitákban/makrofágokban fordul elő.
Ha a vírus citopátiás hatást fejt ki a CD4+ limfocitákra sejtlízissel vagy szinciciumba fúzióval, akkor a monocitákban/makrofágokban a HIV közepes intenzitással replikálódik; a virionok még a sejt citoplazmájában is lekerekített részecskékké alakulnak, és onnan kilépve nem fejtenek ki citonekrotikus hatást. A TNF-a, IL-1b és IL-6 hiperprodukciójával láz, vérszegénység, hasmenés, cachexia, Kaposi-szarkómában a bőr és a nyálkahártya kóros elváltozásai, valamint az agyi tünetek kialakulása a HIV-fertőzéssel jár együtt. A TNFa ugyanakkor közvetlen citopátiás hatást fejt ki a HIV-fertőzött T-helperekre. Ugyanakkor azt találták, hogy a HIV gátolja az első típusú T-helperek által szintetizált IL-2 és g-IF termelését, és nem gátolja a második típusú T-helperek működését. Ezért a citokinszintézis szabályozásában fontos szerepet játszó HIV azáltal, hogy az immunválaszt az első típusú T-helperekről a második típusú T-helperekre váltja, serkenti az immunitás humorális kapcsolatát.
Miután egy sejt vírussal megfertőződött, a vírusburok a gp41 fehérje segítségével kapcsolódik a sejtmembránhoz. Ezenkívül a gp41 vírusfehérje biztosítja a szomszédos sejtek membránjainak fúzióját egymással egy többmagvú sejt - syncytium - képződésével. Ebben az esetben a fúzió lehet egymással fertőzött sejtek és nem fertőzött sejtekkel is fertőzött. A syncytiumot azonban főként a HIV-fertőzés klinikai megnyilvánulásaiban szenvedő betegektől izolált vírusok indukálják, és nem olyan fertőzött emberektől izolálják, akiknek nincs klinikai megnyilvánulása.
Amikor a vírusgenom beépül a sejtgenomba, megkezdődik a látens fertőzés szakasza. Ebben az időben a vírus egy integrált DNS-genom - provírus - formájában van a sejtben. A legújabb tanulmányok kimutatták, hogy közvetlenül a vírus sejtbe jutását követően mind a transzláció, mind a transzkripció megindul.
A látens fertőzés állapota a betegség klinikai tünetei nélkül 2-11 évig tarthat. A hosszú terminális ismétlődések aktiválása és a vírusfehérjéket kódoló HIV gének expressziója jelzi a betegség megnyilvánulását.
Számos olyan tényezőt azonosítottak, amelyek aktiválják a HIV gének expresszióját. Ide tartoznak a T-limfocitákat aktiváló faktorok: specifikus antigének (pl. Herpes-csoport vírusai), nem specifikus antigének (pl. mitogének, például fitohemagglutinin), citokinek (pl. tumornekrózis faktor, egyes interleukinek, gamma-interferon), bakteriális immunmodulátorok ( például szalmonellából származó lipid-monofoszfát). A HIV-expresszió aktivátorai közé tartoznak a glükokortikoszteroid hormonok, például a dexametazon és a hidrokortizon, az ultraibolya besugárzás, a hidrogén-peroxid és a szabad oxigéngyökök. A terhesség a fertőző folyamatot is aktiválja; A HIV progresszívebben fejlődik ki azoknál az embereknél, akik lelkileg kiegyensúlyozatlanok, rosszul alkalmazkodnak, mint azoknál, akiknek kiegyensúlyozott pszichéjük van.
A vírus újratelepedésének mechanizmusa a sejtben még mindig nem teljesen ismert. Csak annyit tudunk, hogy a citoplazmában a virális RNS-ből származó információ reverz reversease segítségével átíródik DNS-be, kezdetben egyszálú szerkezet alakul ki; majd ugyanaz a reverz transzkriptáz biztosítja a második szál képződését, és a vírus DNS-transzkriptázának lineáris intermedier formája a sejtmagba kerül, ahol az integráz enzim segítségével beépül a sejtkromoszómába, provírussá alakulva. .
A betegség patogenezisének rendkívül fontos állomása a vírusrészecskék összerakása és a vírus új utódainak kiszabadulása a fertőzött sejtből. Az összeszerelés a limfocita plazmamembránján történik, ahová a vírusrészecske összes komponense, beleértve a prekurzor fehérjéket is, belép. A vírusok a sejt felszínén rügyeznek. A HIV megkülönböztető jellemzője a transzkripció aktiválásának, a prekurzor fehérjék szintézisének, a virionok összeállításának és bimbózásának folyamatainak robbanékonysága: 5 perc alatt egy limfocita sejt akár 5000 vírusrészecskét is képes létrehozni.
A HIV-fertőzés patogenezisének kulcskérdése az immunkárosodás mechanizmusa. A gp120 fehérjék, a fő hisztokompatibilitási komplex (HLA) II. osztálya és a CD4 receptorok hasonló régiókat tartalmaznak, amelyek meghatározzák a HIV elleni antitestek és ezekkel a szerkezetekkel való keresztreakcióját. Minden sejtmaggal rendelkező sejt rendelkezik HLA I antigénekkel; a vírus megzavarja ezen antigének szintézisét is, amelyek részt vesznek a vírussal fertőzött sejtek CD8+ limfociták általi felismerésében, ami gátolja a fertőzött sejtek lízisének folyamatát.
Immunpatogenetikailag a HIV-fertőzés az immunrendszer T- és B-kapcsolatainak hiányában, a komplement, a fagociták hiányában és a nem specifikus védekező faktorok működésének csökkenésében nyilvánul meg. Ennek eredményeként anergia képződik allergiás, autoallergiás és immunkomplex kóros folyamat megnyilvánulásaival. A HIV-fertőzést már a II. stádiumban a leukociták abszolút számának csökkenése jellemzi a CD3+, CD4+, p24+ és gp120+ limfociták miatt, a természetes gyilkosok (NK-sejtek) szintjének emelkedése, a gátlási reakció fokozódása. limfocita migráció concavalin A-val és fitohemagglutininnel. Az immunitás humorális kapcsolatának változásai az IgG + B-limfociták növekedésében és a szérum IgE szintjének 4-5-szörös növekedésében nyilvánulnak meg.
Az immunitás B-kapcsolatának változásait a B-limfociták aktiválása jellemzi. Az anyagcseréjükben bekövetkezett változás az immunglobulinreceptorok cseréjének felezési idejének csökkenésével jár együtt a sejtreceptorok (P-fehérjék) koncentrációjának növekedésével a vérben. A szérum immunglobulinok összkoncentrációja nő, de az immunglobulin alosztályok szintjében aránytalanság derül ki. Így a betegek IgG1 és IgG3 tartalma nő, az IgG2 és IgG4 koncentrációja pedig jelentősen csökken. Nyilvánvaló, hogy az IgG2 szintjének növekedése a betegek staphylococcusokra, pneumococcusokra és influenza bacilusokra való nagy érzékenységével jár. A hipergammaglobulinémia, a vérben keringő B-limfociták számának növekedése ellenére a mitogénekkel szembeni funkcionális aktivitásuk viszonylag csökkent, ami lehetővé teszi, hogy a HIV-betegek B-immunrendszerét elnyomottnak tekintsük. Ezenkívül az AIDS-betegek perifériás vérében a B-sejtek száma háromszor vagy több alkalommal is csökkenthető.
Számos tanulmány kimutatta, hogy a HIV-1 gp120 kölcsönhatása a CD4+ limfociták membránjával nemcsak a fertőzött sejtek negatív reakcióit határozza meg, hanem programozott sejthalálhoz is vezet – az érett CD4+ limfociták vagy a CD34+ hematopoietikus prekurzor sejtek apoptózisához még hiányában is. vírussal való fertőzésükről.
Az immuncitában lokalizálva a vírus behatol a szervekbe és szövetekbe, így az immunrendszer nem éri el. A fertőző folyamat aktiválása humorális immunválaszhoz vezet antitestek képződésével. De a gp120 vírusfehérje, a II. osztályú HLA és a limfocita CD4 receptor hasonló szakaszok összetételében való jelenléte miatt a képződött antitestek keresztreakcióba lépnek velük, ami az immunrendszer működésében a kooperatív kölcsönhatások megsértését okozza. Mindez meghatározza az autoallergiás reakciók kialakulását. Ezért a fertőző folyamat kialakulása során késleltetett és azonnali típusú túlérzékenység alakul ki, elsősorban a HIV antigénekkel, különösen a gp41-el és a gp120-al szemben. A betegek felénél az allergia manifeszt formái alakulnak ki, főleg nátha, gyógyszerallergia, csalánkiütés, atópiás dermatitis, angioödéma formájában, a háztartási, epidermális, pollen- és élelmiszer-allergénekkel szembeni specifikus IgE szintjének növekedésével, ami pozitív korrelációt mutat az IgE teljes szintje és a CD8+ limfociták tartalma (Yu.A. Mitin, 1997).
Az immunhiány kialakulása HIV-fertőzésben nem korlátozódik a CD4 fenotípusú limfociták legyőzésére. A HLA I fehérjék szintézisének megsértése a CD8 fenotípusú limfociták, azaz a T-szuppresszorok működésének gátlásához vezet. A p15 vírusfehérje elnyomja a T-sejtek IL-2 és g-interferon termelését. Ismeretes, hogy a T-effektorok és a T-prekurzorok megkülönböztetéséhez IL-2, g-interferon és IL-6 szükséges. Az IL-2 és más citokinek termelése pedig szorosan összefügg a citotoxikus T-limfociták működésével, amelyek a szervezet vírus- és daganatellenes védelméért felelősek.
Az immunrendszer vereségével együtt a hematopoietikus szövet is részt vesz a kóros folyamatban. A betegséget leukopenia, vérszegénység, thrombocytopenia jellemzi. A granulociták funkcionális aktivitása gátolt. A csontvelőben HIV-fertőzött betegeknél a granulociták, makrofágok, megakariociták kolóniaképző egységeinek tartalma élesen csökken. Jelenleg nincs egyértelmű vélemény az őssejtek proliferációs aktivitásának gátlásának okairól, bár megállapították, hogy a különböző HIV-izolátumok, amelyek CD34+ sejtekre hatnak, gátolják funkcionális aktivitásukat. Azt is megállapították, hogy a vérképzés elnyomása a HIV hatására összefügg a csontvelő monociták/makrofágok tumornekrózis faktor termelésének fokozódásával.
Így az immunrendszer veresége a HIV-fertőzésben szisztémás, amely a sejtes immunitás T- és B-kapcsolatainak mély elnyomásában nyilvánul meg. A HIV-fertőzés kialakulása során rendszeres változások lépnek fel az azonnali és késleltetett típusú túlérzékenységben, a humorális immunitásban és a nem specifikus védőfaktorokban, a limfociták és a monociták/makrofágok funkcionális aktivitásában. Növeli a szérum immunglobulinok, keringő immunkomplexek szintjét. A CD4+ limfociták hiányával együtt a CD8+ limfociták, az NK-sejtek és a neutrofilek funkcionális hiánya fokozódik a betegség során. Az immunstátusz megsértése klinikailag fertőző, allergiás, autoimmun és limfoproliferatív immunhiányos szindrómákkal nyilvánul meg, amely az immunkomplex betegségre jellemző szindróma. Mindez meghatározza a HIV-fertőzés általános klinikai képét.

A HIV sejtbe való behatolásának és szaporodásának sémája
Biofizikai Tanszék.
"AIDS"
Elkészült: Art. gr. MID-195
Predein A.E.
Pugacsov O.A.
Ellenőrizte: Kuznetsov A.A.
Vlagyimir 1997
Az AIDS az egyik legfontosabb és legtragikusabb probléma, amellyel az egész emberiség szembesült a 20. század végén. A szerzett immunhiányos szindróma (AIDS) egy vírusos etiológiájú betegség, amely az immun- és idegrendszer károsodásával jár, és súlyos fertőző elváltozások és rosszindulatú daganatok kialakulásában nyilvánul meg. Az AIDS összetett tudományos probléma. Az AIDS elleni küzdelmet nagymértékben nehezíti a hatékony terápiás gyógyszerek hiánya, valamint az oltás hiánya. Éppen ezért az AIDS-járvány elleni küzdelemben meghatározó jelentőségű az egészségnevelés, a lakosság teljes és tárgyilagos tájékoztatása az AIDS-probléma aktualitásáról és a fertőzés megelőzésének hatékony módjairól. Az Egészségügyi Világszervezet is nagy hangsúlyt fektet az egészségnevelésre.
Az első fertőzéses eseteket Afrikában már 1959-ben, az Egyesült Államokban - 1977 óta - figyelték meg. 1987 óta egy új fertőző betegség terjedése járvány jelleget öltött. A betegséget jelenleg a világ 152 országában regisztrálták. Jelenleg az Egészségügyi Világszervezet mintegy 2 millió AIDS-es esetet regisztrált. A HIV-fertőzöttek számára vonatkozó adatok forrástól függően 13 és 20 millió között mozognak, de közülük legalább 8 millió csak Afrikában található. A mérvadó előrejelzések szerint 2000-ben 40-110 millió HIV-fertőzött lesz a világon. Az AIDS-betegséget nehéz ellenőrizni, ami a következőkkel magyarázható:
1) a hatékony kezelési eszközök hiánya;
2) az elsődleges prevenció (védőoltás) eszközeinek hiánya;
3) az AIDS által leginkább érintett lakossági csoportokkal való kapcsolattartás nehézségei. A szakértők úgy vélik, hogy egy vakcina elkészítése 8-20 évig tart. A betegséget magas - 40-90% -os halálozási arány jellemzi. Az AIDS első eseteinek leírása óta eltelt idő alatt egyetlen gyógyulási vagy gyógyulási tény sem történt ebből a betegségből. Az AIDS kórokozójának minden hordozója potenciálisan beteg. Virológiai vizsgálatok, amelyeket Luc Montagnier tudományos csoportjai végeztek az Institut Pasteur-ben
(Franciaország) és Robert Gallo, a National Cancer Institute (USA) munkatársai 1983-ban lehetővé tették az AIDS valódi okának felfedezését - egy T-limfotrop retrovírust, amelyet később HIV-nek neveztek - hyman immundeficiency virus (HIV - humán immundeficiencia vírus).
Az orvosoknak már körülbelül kétszázezer kórtörténetük van, így az AIDS klinikai jellemzőit mára elég jól tanulmányozták. A betegség legnehezebb felismerése a legelején. Amikor a betegség folyamata messzire megy, a betegnek három fő rendellenessége van (sajnos ezek egyidejűleg, különböző kombinációkban lehetnek jelen, különösen súlyos betegséglefolyást okozva). Először is, a betegek több mint fele különböző másodlagos fertőzésekben szenved, melyeket baktériumok, gombák, vírusok vagy akár protozoonok okoznak. Ezek a szájüreg nyálkahártyájának ("rigó") vagy a nyelőcső candidiasisa, pneumocystis vagy herpetikus tüdőgyulladás, cryptosporidiosis vagy citomegalovírus-elváltozások a vékony- vagy vastagbélben, különböző szervek és rendszerek tuberkulózisa. A betegek több mint fele a központi és perifériás idegrendszer károsodása által okozott neurológiai és mentális zavarokkal is rendelkezik (az elváltozások oka maga a HIV és annak „szövetségesei” - kriptokokkuszok, toxoplazma, herpes simplex és övsömör stb. ) . Végül minden harmadik AIDS-betegnél különböző daganatok – szarkómák, gliomák, limfómák, melanómák és egyéb „...omák” – alakulnak ki.
Epidemiológiai szempontból az AIDS egy antroponotikus fertőző betegség, kontaktus és vertikális átviteli mechanizmusokkal. A fertőzés forrása egy fertőzött személy, aki a betegség bármely szakaszában van, azaz függetlenül a betegség klinikai tüneteitől. A vírus legintenzívebb átvitele a betegekkel és vírushordozókkal való szexuális érintkezés útján történik. A fertőzés kockázata a homoszexuális kapcsolatok során különösen magas, ami három okkal magyarázható:
1) A homoszexuális érintkezés során a kórokozó az ondófolyadékkal közvetlenül behatol a szexuális partner ágyába a bélnyálkahártyán és az anális csatornán lévő mikrotraumákon keresztül. Tekintettel a végbél bőséges vénás vérellátására, a passzív partner fertőzésének kockázata magas. Az aktív partner fertőzésének kockázata a pénisz bőrének eróziója és repedései révén meglehetősen magas.
2) A végbél hámja a sejtjei felszínén található CD 4 receptor fehérje miatt, amellyel a vírus gp 120-ja közvetlenül kölcsönhatásba lép, képes az AIDS vírus tárolójaként szolgálni, és ezáltal biztosítja a hematogén a kórokozó elterjedése egy passzív partner testében, még a végbél nyálkahártyájának mikrotraumáinak hiányában is, valamint a fent jelzett mechanizmus aktív partnerének fertőzése.
3) Langergas sejtek - a végbél nyálkahártyájának makrofágjai, amelyek a CD 4 receptor fehérjét a felszínen hordozzák, és ennek eredményeként képesek kölcsönhatásba lépni a HIV-vel, fertőzés és a regtális nyálkahártyából való migráció után kolonizálják a nyirok stromáját különböző lokalizációjú csomópontok, amelyek a mikrofág sorozat más sejtelemeivé alakulnak át. A nyirokcsomókban lévő T4-limfocitákkal érintkezve a transzformált mikrofágok megfertőzik azokat, és hozzájárulnak az AIDS kórokozójának elterjedéséhez a szervezetben (1. ábra).
A HIV átvitelének másik alapvető tényezője a fertőzött vér és összetevői, amelyek vér, plazma, véralvadási rendszer VIII-as vagy IX-es faktorainak készítményeinek transzfúziója során lépnek fel. A HIV fertőzött injekciós tűkkel, fecskendőkkel és egyéb eszközökkel továbbítható.
A kórokozó függőleges átviteli mechanizmusa (az anyáról a magzatra) transzplacetálisan vagy szülés közben történik.
A kórokozó átvitelének leírt útvonalaival és tényezőivel összhangban az epidemiológiai elemzés lehetővé teszi számos olyan csoport azonosítását, amelyeknél fokozott az AIDS kockázata:
1. Homoszexuálisok és biszexuálisok. Az Egyesült Államokban, ahol a világ más országaihoz képest ma a legnagyobb az AIDS-betegek száma, a betegek 73,6%-a tartozik ebbe a csoportba.
2. Intravénás kábítószer-kezelést alkalmazó kábítószer-függők. Az USA-ban nyilvántartott AIDS-betegek körében 17% az ebbe a kategóriába tartozó betegek aránya.
3. Prostituáltak. A fertőzés ebben a csoportban eléri a 40% -ot, az afrikai országokban pedig a 90% -ot.
4. Vérhemofíliás betegek és olyan személyek, akik alkalmanként vérátömlesztésen vagy vérátömlesztésen esnek át. Francia szakemberek tanulmányai (Sultan Y., 1987) azt mutatják, hogy Franciaországban a hemofíliás betegek HIV-fertőzöttsége eléri a 48%-ot, míg az USA-ban a betegek több mint 2/3-a AIDS-vírussal fertőzött (Levine P. H., 1987).
5. Elhúzódó és krónikus lefolyású szifiliszben és vírusos hepatitis B-ben szenvedő betegek. A szifilisz és az AIDS epidemiológiai és részben patogenetikai kapcsolata olyan jelentős, hogy számos kutató az AIDS-et a szifiliszben szenvedő betegek opportunista fertőzésének tekinti.
A vírusos hepatitis és az AIDS epidemiológiai kapcsolatát illetően a következőket állapították meg:
a) a Center for Disease Control (USA) által regisztrált vírusos hepatitis B-ben szenvedő betegek mintegy 90%-a a fenti AIDS kockázati csoportokba tartozik;
b) a vírusos hepatitis B és az AIDS terjedésének exponenciális jellege nagyon hasonló;
c) az AIDS-betegek körülbelül 80%-a rendelkezik a hepatitis B vírus fertőzésének szerológiai markereivel.
Az elmúlt években megállapították, hogy a vírusos hepatitis B és az AIDS között összefüggés van, nemcsak a kórokozó átvitelének közös útvonalai és tényezői, hanem sokkal alapvetőbb mechanizmusok is. Kiderült (Noonan C., 1985; Jerom B., 1986), hogy mindkét kórokozó genomjában vannak olyan régiók, amelyeket a nukleotid összetétel jelentős hasonlósága jellemez.
6. HIV-fertőzött anyák gyermekei. A szeropozitív anyák gyermekei az esetek 75-90%-ában transzplacentálisan vagy szülés közben fertőződnek meg.
Figyelembe véve az AIDS vírus terjedésének módjait és tényezőit, hangsúlyozni kell, hogy a HIV átvitel kontakt és háztartás útján történik: kézfogással, öleléssel, csókkal, háztartási cikkeken, edényeken stb. - lehetetlen. Nincsenek megbízható adatok a HIV fertőző úton - vérszívó ízeltlábúakon (szúnyogok, szúnyogok, kullancsok stb.) keresztül történő átviteléről.
A HIV a retrovírusok családjába tartozik, azaz olyan vírusokhoz, amelyek genomja (HIV RNS-sel) integrálható emberi génekhez, például a vérsejtek - limfociták - vagy agysejtek genomjába.
A retrovírusok nevüket egy szokatlan enzimnek köszönhetik - a reverz transzkriptáznak, amely a genomjukban van kódolva, és lehetővé teszi a DNS szintetizálását egy RNS-templáton. Így a HIV képes a gazdasejtekben, például a „segítő” T4 humán limfocitákban genomjának DNS-másolatát előállítani. A vírus DNS a limfociták genomjában szerepel, ahol expressziója feltételeket teremt a krónikus fertőzés kialakulásához. A DNS beépül a sejt genetikai apparátusába, és megváltoztatja annak létfontosságú aktivitását, aminek következtében vírusfehérjék kezdenek képződni ebben a sejtben. Ezeket a „téglákat” aztán egész vírusrészecskékké hajtogatják, amelyek kijutnak a szabadba, és behatolnak más, még meg nem született sejtekbe. A szülősejt hamarosan meghal. Az a tény, hogy a HIV beépül a gazdasejt genomjába, nagyon nehéz akadálynak bizonyul majd olyan vírusellenes szerek kifejlesztésében, amelyek nemcsak elnyomják, hanem el is pusztítják a fertőzést.
Az immunhiányos vírusok nagyon kicsik - 70-100 ezer vírusrészecske is elfér egy 1 cm hosszú vonalon. A HIV-nek minden retrovírusra jellemző felszíni membránja van, és jellegzetes, rúd alakú vagy kúpos alakú nukleoidot (magrészt) tartalmaz (2. ábra). A virion magjában háromféle fehérjét azonosítottak: p24, p18 és p15 24, 18 és 15 kilodalton molekulatömegű fehérjéket, amelyek kifejezett antigén tulajdonságokkal rendelkeznek. Az immunelektronmikroszkópos vizsgálat kimutatta, hogy a p18 fehérje belülről szomszédos a vírusburokkal, a p24 a magstruktúrákat közvetlenül fedő réteget képez, a p15 pedig az RNS molekulákhoz kötődik. A virion magja két RNS-molekulát és reverz transzkripciót tartalmaz (3. ábra). A vírus borítéka tartalmazza a gp 160 glikoproteint, amely az epimembrán részből (gp 120) és a transzmembrán részből (gp 41) áll. A gp 120 aminosav összetétele meglehetősen változó. Ez magyarázza azt a tényt, hogy az elmúlt években a HIV antigén tulajdonságai 30%-kal változtak (4. ábra).
Az AIDS vírus genomja körülbelül 9200 nukleotidot tartalmaz, amelyek 9 gént alkotnak, amelyeket a fél nukleotid lánc mindkét oldalán hosszú körkörös ismétlődések határolnak. A HIV genetikai szerkezetét három szerkezeti gén és hat szabályozógén jelenléte jellemzi. A fertőzés idején az emberi testbe bejutva ez a vírus kezdetben nem nyilvánul meg, hanem csak „alkalmazkodik” és átterjed a különböző szervekre és szövetekre. A HIV-fertőzés úgynevezett inkubációs (látens) időszaka több hétig tart. Ekkor az ember már fertőzött, de szinte lehetetlen kimutatni a fertőzést. Ekkor a fertőzöttnél gyakran (de nem mindig) alakul ki a HIV-fertőzés akut stádiuma, amely „influenzaszerű betegségként” folytatódik.
A HIV életciklusa számos egymást követő szakaszból áll (5. ábra). Az első szakaszban a gp 120 vírus burokfehérjéinek specifikus kölcsönhatása van a célsejt receptorfehérjéivel. Ezután a vírusrészecskéket a sejt endocitózissal befogja, és a citoplazmában szabadul fel a membránból (a „levetkőzés” szakasz). Valószínűleg a HIV-fehérjék sejtprotein-kinázok általi aktiválása alapvető szerepet játszik abban, hogy a vírus behatoljon a sejtbe. Ezt a lépést követően a DNS-t a vírus RNS-templátán reverz transzkripció segítségével szintetizálják. Az újonnan képződött vírusspecifikus DNS molekulái gyűrű alakú formát vesznek fel (circularizáció), és a citoplazmából a sejtmagba vándorolnak, ahol integrálódnak (integrálódnak) az érintett sejt genomjába. A vírusspecifikus DNS egy része hosszú ideig a citoplazmában marad anélkül, hogy integrálódna a gazdasejt DNS-ével. A vírusgének expressziója végső soron vírusspecifikus RNS és fehérjék termelődéséhez vezet, ami meghatározza a későbbi új virionok összeállítását, amelyek „kibimbóznak” a fertőzött sejt felszínéről.
Jelenleg három ismert kórokozója van az AIDS-nek: HIV-1, HIV-2, HIV-3. A HIV-1 (a fentebb leírt) főként Észak-Afrikában és Európában okozza a betegséget. 1986-ban a Pasteur Intézet alkalmazottai izolálták az AIDS kórokozójának egy másik változatát, a HIV 2-t nyugat-afrikai betegektől. Sokkal jobban hasonlít a majom immunhiányos vírushoz. Ma a HIV 2 prevalenciája az AIDS-betegek és a vírushordozók körében 0,2%. 1988-ban HIV-3-at azonosítottak Dél-Afrikában élő AIDS-betegek közül.
A HIV 2 antigén összetétele eltér a HIV 1-étől. A felszíni epimembrán glikoprotein molekulatömege valamivel kisebb, mint a gp 120, és gp 105-nek nevezzük. Azonban a gp 105 ugyanolyan kifejezett affinitást mutat a célsejt kreceptor fehérjéihez. A HIV 2 magfehérjéi közül a p 26 és p 16 fehérjék antigén tulajdonságaival azonosítottak.
A HIV 2 genomja valamivel nagyobb, mint a HIV 1, és 9671 nukleotidból áll. A 2 megjelenített AIDS kórokozó genomjának szerkezete az általános elv szerint épül fel azzal az eltéréssel, hogy a HIV 2 szabályozó vpx gén jellemzőiben eltér a HIV 1 RNS közel hasonló régiójában található vif géntől. Úgy gondolják, hogy a HIV 2-t kevésbé kifejezett fertőző tulajdonság jellemzi, és a vírus által okozott folyamat hosszabb ideig tart tünetmentesen, mint a HIV 1 fertőzés. Mind a HIV 2-t, mind a HIV 1-et a fizikai környezeti tényezőkkel szembeni viszonylag alacsony ellenállás és a leggyakoribb fertőtlenítőszerek hatása jellemzi. 0,5%-os kalcium-hipoklorit-oldat, 50-70%-os etil-alkohol-oldat hatására a vírus néhány másodpercen belül inaktiválódik. A HIV azonban viszonylag ellenálló az ultraibolya és a röntgensugárzás hatásával szemben.
Abszolút egyértelműnek tűnik az a tény, hogy a HIV kórokozó hatása és a vírus burokstruktúráinak az immunkompetens sejtek receptor-apparátusának összetevőihez való nagy affinitása között van a legszorosabb kapcsolat. A gp120 vírus membránglikoproteinjének (HIV-2 esetén gp105-) affinitása a CD4 sejtreceptorhoz teszi lehetővé, hogy a HIV megfertőzze a célsejteket, figyelembe véve, hogy mely sejttípusok hordozzák a CD4 receptort A citoplazmatikus membránon nyilvánvalóvá válik, hogy az AIDS kórokozójának célsejtek: T-limfociták-helperek, makrofágok és monociták. A nem immunkompetens sejtelemek közül a központi idegrendszer asztrocita-glia sejtjei, a végbél nyálkahártyájának hámsejtjei és a vaszkuláris endotélium tekinthetők a CD4 hordozóinak és így a HIV-rezervoároknak (Ward J. M. et al., 1987). Ugyanakkor a HIV-fertőzés kialakulásának legkorábbi szakasza a T-limfociták-helperek/induktorok (CD4+-limfociták) veresége. Eddig az az egyértelmű vélemény, hogy a gp120 burokfehérjének a T-helper/induktor membránon lévő CD4-hez való tapadását (adhézióját) követően a vírusrészecske passzív endocitózisa következik be, ma már kiegészíthető és korrigálható. Kimutatták (Weber J. N., Weiss R. A., 1988), hogy a korábban leírt gp41 glikoproteinek rendkívül jelentős szerepet játszanak a HIV célsejtbe való behatolásában. A kutatók úgy vélik, hogy a vírus adhéziója után a létrejövő szupramolekuláris komplex (gp120 (gp105)-CD4) kiszorul, felszabadítva egy zónát a T-helper/induktor membránon a gp41-gyel való érintkezéshez. Ez utóbbi, „becsavarva” az érintett sejt plazmamembránjába, oly módon módosítja annak tulajdonságait, hogy a virion későbbi behatolása a sejtbe nagymértékben megkönnyíthető. Ezt megerősítik a gp41 elleni monoklonális antitestek hatásának vizsgálata a HIV és a célsejtek közötti kölcsönhatási folyamatokra in vitro, amelyek szerint ezek az antitestek szinte teljesen megakadályozták a vírus fúzióját a sejttel. A megszerzett adatokat valószínűleg az AIDS-vírus elleni vakcina elkészítéséhez fogják használni.
Meggyőzően kimutatták (Kulberg A. Ya., 1988), hogy a gp120 molekula szerkezetében olyan régiók találhatók, amelyek összetételükben és ezáltal antigén tulajdonságaikban nagyon hasonlóak a fehérje- és fehérjereceptorok extracelluláris részeinek bizonyos zónáihoz. polipeptid hormonok. A gp120 és a megnevezett receptorfehérjék aminosav-összetételének homológiája eléri a 40-45%-ot. A II. osztályú HLA antigének (leukocita hisztokompatibilitási antigének) konzervált zónáiban található aminosavszekvenciák elemzése 13 HIV izolátum burokfehérjéiben a HLA-DR és HLA-DQ antigének (19. aminosavak) N-terminális doménjének homológiáját tárta fel. -25) és a gp41 fehérje C-terminális doménje (838-844. aminosavak) (Golding H. et al., 1988). Így mindkét felszíni HIV glikoprotein gp120 és gp41 autoimmun reakciókat indukál AIDS-betegekben.
A HIV-fertőzés hátterében lezajló autoimmun folyamatok mechanizmusainak jellemzéséhez jelentős adalékot jelentenek Stricker R. B. és munkatársai (1987) tanulmányainak eredményei, amelyek szerint az ilyen körülmények között zajló perverz antitesttermelés a HLA ellen is irányul. -DR polimorf antigének, amelyek a nyálkahártyák Langerhans sejtjeinek felszínén találhatók.
Összegezve az autoagresszív mechanizmusok szerepének elemzését a HIV-fertőzött betegek immunhiány kialakulásában, érdemes idézni Luc Montagnier professzornak, az AIDS-vírus egyik felfedezőjének következtetését: az AIDS egy autoimmun folyamaton alapul. a T-limfociták segítőire gyakorolt hatások középpontjában a HIV közvetlen citopátiás hatása áll (Montagnier L., 1987).
A vírus közvetlen citopátiás hatása azonban egyre jelentősebbé válik a CD4+ sejtszubpopuláció progresszív depléciójával, amely hosszú ideig autoimmun eredetű jelenség (6. ábra).
Amellett, hogy felgyorsítja a CD4+ limfociták pusztulását, a HIV megzavarja a fertőzött T-helperek/induktorok felismerésének folyamatát olyan sejtek által, amelyek szabályozzák a vírusokkal fertőzött sejtpopuláció méretét. A T-szuppresszorok / citotoxikus limfociták azon frakciójáról beszélünk, amelyek a plazmamembránjukon hordozzák a CD8 receptort. Ezek a CD8+ limfociták úgy ismerik fel a vírussal fertőzött sejteket, hogy „felismerik” a vírus által indukált antigéneket a felületükön. Az ilyen felismerés elengedhetetlen feltétele azonban az, hogy a fertőzött sejt felszínén a vírus által indukált antigénekkel együtt az úgynevezett fő hisztokompatibilitási komplex I. osztályába (MHC I) tartozó fehérjék is jelen legyenek. Ezek a fehérjék minden sejtmaggal rendelkező sejt citoplazmatikus membránján megtalálhatók. Miután azonosították ezeket a membránantigéneket, a CD8+ - limfociták elpusztítják a vírus által érintett sejteket (7. ábra).
Más vírusfertőzések kórokozóitól eltérően a HIV láthatóan olyan megváltozott szerkezetű MHC I fehérjék szintézisét kódolja, amelyet a CD8+ limfociták nem képesek felismerni. Ennek eredményeként a fertőzött CD4+ sejtek T-citotoxikus limfociták általi lízise nem megy végbe, annak ellenére, hogy vírus által indukált antigének vannak jelen a plazmamembránjukon.
A fertőzött CD4+ limfociták pusztulása bizonyos mértékig még megtörténik, de ez valószínűleg más módon valósul meg. Ha a CD4+ sejtek felszínén tapadó virionok vannak, és ha HIV-ellenes antitestek vannak jelen a véráramban, akkor ezeket a sejteket a limfociták – az antitest-függő sejtes citotoxicitás effektorai – elpusztítják. Ezt a hipotézist igazolták hemofíliás betegek – HIV-hordozók – klinikai megfigyelései (Ekert H., 1987).
Mindazonáltal a fertőzött sejtek eliminációs mechanizmusa kompenzációs jellege és szanogén orientációja ellenére negatívan járul hozzá a CD4+ limfociták szubpopulációjának kimerüléséhez, amely központi szerepet játszik a sejtes immunitás funkcióinak biztosításában. Valóban, a CD4+ limfociták egyrészt felismerik az antigéneket az antigénprezentáló sejtek felszínén; másrészt közvetlen intercelluláris kontaktusokon és limfokinek (interleukin-2, gamma-interferon) szekréción keresztül biztosítják az immunkompetens sejtek együttműködését az immunválasz dinamikájában. A fentiek alapján világossá válik, hogy a CD4+ sejtek számának csökkenése és funkcionális inferioritásuk kialakulása miért vezet ilyen sokrétű egyensúlyhiányhoz, végső soron pedig az immunválasz hiányához.
Hangsúlyozni kell, hogy a HIV-fertőzés lefolyásának korai szakaszában, amikor még nem tapasztalható kifejezett CD4+ sejtek számának csökkenése, a T-helperek/induktorok regulációs funkcióinak zavarai különösen fontosak a kórkép kialakulásában. egyensúlyhiány az immunrendszerben. A fentieket megerősítik Harper ME (1986) vizsgálati eredményei, amelyek szerint a fertőzött CD4 + - limfociták aránya nem haladja meg a számuk 0,01%-át. A fertőzött limfociták rendkívül kis száma és az immunhiány markáns képe közötti látszólagos ellentmondás másik magyarázata a fertőzött sejtek fehérje jellegű „oldható szuppressziós faktor” szekréciójára vonatkozó adatok, amelyek valószínűleg a HIV-burok egyik összetevője. Az oldható szupresszor faktor jelentősen megzavarja a CD4+ sejtek koordinációs kölcsönhatásait más limfocita szubpopulációkkal.
Cheynier R. et al. (1988) szerint a HIV-1 képes aktívan szaporodni CD8+ limfocitákban is (T-szuppresszor/citotoxikus sejtek) in vitro. Ha a HIV-replikáció a CD8+ sejtekben in vivo megy végbe, akkor azt gondolnánk, hogy a T-szuppresszor alpopuláció vírus általi ezt követő inaktiválása jelentős további tényező, amely hozzájárul az autoimmun válasz kialakulásához HIV-fertőzött egyénekben. Másrészt ez a jelenség magyarázatot adhat arra a meglepőnek tűnő tényre, hogy egyes AIDS-betegeknél mind a T-helperek, mind a T-szuppresszorok perifériás készlete kimerül.
A CD4+ sejtek és más alosztályok limfocitái közötti funkcionális kapcsolatok megszakításának másik fontos mechanizmusa az, hogy a CD4+ limfociták nem ismerik fel a speciális sejtek által biztosított HIV antigéneket. Emlékeztetni kell arra, hogy az antigénprezentáló sejtek (például makrofágok) felszínén megjelenő antigének CD4+ limfociták általi azonosítása csak akkor lehetséges, ha az utóbbiak plazmamembránja egy másik típusú fő hisztokompatibilitási komplex osztályt tartalmaz. II (MHC II) antigének-fehérjék. Az MHC II fehérjék receptoraival rendelkező antigén-felismerő CD4+ limfociták egyidejűleg azonosítják az idegen antigént és az MHC II fehérjéket, és csak ebben az esetben következik be reaktív proliferációjuk és immunválasz alakul ki (8. ábra).
A makrofágok AIDS-vírussal való fertőzését a HIV-antigének CD4 + -függő felismerésének megsértése kíséri: egyrészt a makrofág nem fejezi ki az MHC II fehérjéket a felületén, másrészt a CD4 + receptor - a. A HIV-vel fertőzött limfocita úgy módosul, hogy még a II. makrofág plazmamembránján megjelenő MHC fehérjéket sem ismeri fel. A CD4+ - limfociták mindkét esetben nem érzékelik az antigénprezentáló makrofágok információit.
Azt is hangsúlyozni kell, hogy a makrofág MHC II fehérjék affinitása a T-helperek/induktorok felszínén lévő CD4 receptorokhoz, ami a makrofágok által a T-helperek/induktorok felé mutatott antigénprezentációs folyamatok hátterében áll, olyan közeli, mint a gp120 affinitása. a nevezett receptorképződéshez. Ezért a fertőzött sejtek által expresszált gp120 verseng az MHC II fehérjékkel a CD4 receptorokért, és így megzavarja a makrofág-limfocita együttműködési folyamatokat.
A fentiek nem merítik ki a mononukleáris magocita rendszer működési zavarainak teljes spektrumát AIDS-ben. A betegek monocitáit és makrofágjait a csökkent baktericid és fungicid aktivitás, valamint a kemotaxis képessége, valamint az immunglobulinok Fc-fragmensei receptorainak funkcióinak csökkenése jellemzi. Az Fc-receptorok hiányossága annak tudható be, hogy jelentős részüket a keringő immunkomplexek blokkolják, valamint a receptorok újrahasznosításának intenzitása csökken. Ezek a jogsértések nagyrészt megmagyarázzák az AIDS-betegek gyulladásos reakcióinak aktivitásának csökkenésének okát.
A természetes gyilkosok, gyilkosok, T-citotoxikus sejtek citotoxikus tulajdonságokkal rendelkező immunkompetens sejtek alosztályainak funkcionális életképessége egyértelműen csökken. Ennek a jelenségnek a mechanizmusai még nem tisztázottak véglegesen (9. ábra).
A HIV-fertőzés hátterében álló immunitás B-rendszere is érintett. A B-sejtek működési zavarának egyik legjellemzőbb jele ebben az esetben a poliklonális aktiváció, ami hipergammaglobulinémia (poliklonális gammopathia) kialakulásához vezet. A vérszérumban minden osztály immunglobulintartalma nő, de különösen az A és G osztályok. a szérum immunglobulinszintje a HIV-fertőzés előrehaladtával, a látens időszaktól kezdve emelkedik, és az AIDS-hez kapcsolódó tünetegyüttes stádiumában éri el a maximumot. Az előrehaladott AIDS stádiumában az immunglobulinok tartalma jelentősen csökken, kivéve az IgA-t, amelynek szintje folyamatosan emelkedik. Számos tanulmány arra utal, hogy ez a látens B-limfotróp vírusok, például az Epstein-Barr vírus reaktivációjának köszönhető, amelynek biológiai aktivitását a T-limfociták szabályozzák.
Annak ellenére, hogy a szérum immunglobulinok összkoncentrációja HIV-fertőzés esetén megnövekszik, a betegeknél jellemző az aránytalanság az immunglobulin-alosztályok szintjében, például az IgG és az IgG 4 jelentősen csökken. Az IgG 2 szint progresszív csökkenése magyarázatot adhat a HIV-fertőzött betegek növekvő fogékonyságára olyan mikroorganizmusok patogén hatására, mint a Haemophilus, Pneumococcus és Staphylococcus aureus. Sőt, a keringő B-limfociták számának növekedése ellenére, amelyek spontán antitesteket választanak ki, ezek a sejtek viszonylag ellenállóak maradnak a mitogének hatásával szemben (például a pokeweed mitogénje), és rendkívül gyenge válaszreakció jellemzi őket a neoantigénekkel szemben. . Így a hipergammaglobulinémia ellenére a HIV-fertőzött betegek immunrendszerének B-rendszerének funkcionális állapota hasonló a súlyos hipogammaglobulinémia hátteréhez.
Az AIDS egy olyan betegség, amely az immunrendszer elégtelenségében nyilvánul meg. Ez utóbbi kifejezés olyan mechanizmusokra utal, amelyek megvédik a szervezetet a baktériumoktól, vírusoktól, kórokozó gombáktól és más idegen anyagoktól. Az emberi szervezetben védő funkció ellátására van egy immunrendszer, amely magában foglalja a csecsemőmirigyet (csecsemőmirigyet), a csontvelőt, a nyirokcsomókat, a lépet és más szöveteket.
Az immunrendszer legfontosabb sejtjei a limfociták, makrofágok és monociták. HIV-receptorokkal rendelkeznek. A limfociták - az immunrendszer fő sejtjei - T-limfocitákra és B-limfocitákra oszlanak. A T-limfociták pedig T-helperekre és T-szuppresszorokra oszlanak. A HIV túlnyomórészt a T-segítőket érinti, és kisebb mértékben
makrofág foka. A neuroglia (idegrendszer) sejtjei szintén nagyon érzékenyek az AIDS kórokozójára. A HIV közvetlenül megfertőzheti a hepatocitákat (májsejteket), a szívsejteket (szívsejteket), más sejteket és még a csontszövetet is.
A vírus és az emberi test sejtjeinek kölcsönhatása a bennük lévő speciális fehérjeszerkezetek - az úgynevezett receptorok - jelenlétének köszönhető. A vírusreceptor a vírus egy része, amely meghatározza a vírus és egy adott sejt „affinitását”. A sejtreceptor a sejtmembrán egy szakasza, amelynek molekuláris szerkezetét bizonyos molekulák (vírusreceptorok) iránti szelektív affinitás és a velük való kölcsönhatás képessége jellemzi. Az emberi test számos sejtje (T-limfociták, makrofágok, neurogliasejtek és mások) rendelkezik egy speciális CD 4 burokfehérjével, amely kölcsönhatásba lép a gp 120 által megkerült vírusburok antigénnel. A gp 120 virális glikoprotein „illeszkedik” a CD 4-hez. mint egy kulcs a zárhoz. A CD 4 és a gp 120 kölcsönhatása a HIV sejthez való kötődéséhez, majd a vírus behatolásához vezet.
A makrofágok fagociták, azaz. sejtek, amelyek megragadják a mikrobákat és más idegen antigéneket. Vannak mobil makrofágok (vérsejtek monociták) és mozdulatlanok, különböző szövetekben rögzítve. A makrofágok szinte minden szövetben megtalálhatók, még az agyban is. Ezért a makrofágokat "mindenütt jelenlévő" sejteknek nevezik. A makrofágok az elsők, amelyek felismerik a szervezetbe bejutott idegen ágenseket, köztük a HIV-t is. A makrofágoknak, mint a T-limfocitáknak – segítőknek – CD4 receptorai vannak, amelyek lehetővé teszik, hogy a HIV a makrofágokhoz kapcsolódjon és bejusson a sejtbe. A „mindenütt jelenlévő” makrofágok hozzájárulnak a HIV legyőzéséhez az egész szervezetben. Igaz, a makrofágok felületén nem sok molekula található a CD4 markerből, ellentétben a T-heperekkel. Ráadásul a HIV, bár károsítja a makrofágokat, nem pusztítja el azokat. Az AIDS-vírus által károsított makrofágok sokkal rosszabbul ismerik fel az idegen ágenseket, és rosszul „emésztik” azokat.
A CD 4-et hordozó T-helpereket/induktorokat összefoglalóan az "immunológiai zenekar karmesterének" nevezik – központi szerepet játszanak az immunválasz kialakulásában. Egy antigénnel érintkezve ezek a gének osztódással és limfokinek, például interleukin-2, interferonok és B-limfocita növekedési és differenciálódási faktorok termelésével reagálnak. Ezek a limfokinek helyi hormonként működnek, amelyek szabályozzák más típusú limfociták növekedését és érését, különösen a citotoxikus/szuppresszor (CD 8) T-limfociták és az antitest-termelő B-limfociták. Ezenkívül a limfokinek befolyásolják a monociták és a szöveti makrofágok érését és működését.
A fertőzés után az antitestek termelése kezdetben nem zavart; a vírus burok- és magfehérjéi elleni antitestek megjelenése ekkor még a fertőzés fő jeleként is szolgál. Ezt követően az összes osztály immunglobulinjainak szérumkoncentrációja növekszik, ami a B-limfocita poliklonális aktivációját jelzi. Ennek oka nem teljesen világos, de azt gondolhatnánk, hogy a vírus közvetlenül aktiválja a B-limfocitákat. A betegség későbbi szakaszában az immunglobulinok koncentrációja csökken.
A HIV-nek van a legerősebb hatása a T-sejtek által közvetített immunválaszra. Más vírusfertőzésekhez hasonlóan a citotoxikus CD 8 szupresszor sejtek száma megnőhet a fertőzést követő első napokban vagy hetekben. Ugyanakkor egészséges szeropozitív betegekben a limfociták szintje és a T-sejtek különböző szubpopulációi normálisak maradhatnak. A tesztek azonban még ebben a szakaszban is a kontrollantigénekre (pl. tetanusz-toxoidra vagy tisztított fehérjeszármazékokra) adott proliferatív válasz csökkenését jelzik. Nyilvánvalóan ez az interleukin 2 alacsony termelésének köszönhető. Egy személyben hosszú ideig lehetnek HIV-ellenes antitestek (azaz szeropozitívak), és közben egészségesek maradhatnak. Ennek ellenére a CD 4-helperek/induktorok száma folyamatosan csökken, ami az új klinikai tünetek megjelenésével együtt a betegség előrehaladását jelzi. Később, kifejezett klinikai képpel, a CD 8 - limfociták száma is csökken.
A nyirokcsomó-biopszia számos megnagyobbodott tüszőt tár fel lymphadenopathiában szenvedő betegeknél, gyakran CD 8 limfociták beszűrődésével és sejtfogyással. A későbbi szakaszokban, amikor a nyirokcsomók mérete normalizálódik, a tüszők „kiégnek”, normális szerkezetük elveszik, a sejtek kisebbek lesznek.
A legegyszerűbb feltevés szerint az immunhiány oka a T-segítők/induktorok, valamint valószínűleg a monociták és makrofágok vírus általi elpusztítása lehet. Egy másik lehetőség az, hogy a CD 4-hez kötődő virális burok glikoprotein részt vesz a segítők/induktorok más típusú sejtekkel való kölcsönhatásában, ez blokkolná normál aktivitásukat. Azt is felvetették, hogy az autoimmun válasz szerepet játszhat az immunszuppresszióban. A betegeknél a limfopénia mellett néha neutropéniát, vérszegénységet vagy thrombocytopeniát is megfigyeltek, és ezeket a jelenségeket az autoimmun antitestek termelődése magyarázza. Az ilyen antitestek képződéséről még nem állnak rendelkezésre meggyőző adatok, bár a betegek szérumában immunkomplexeket találtak. Ezek azonban vírusantigének és ellenanyagok.
Lehetséges, hogy a fertőzött CD 4+ - limfociták célpontként szolgálnak az immun citotoxikus CD 4 + - T sejtek számára. De ha ez így van, akkor valószínűleg nem autoimmun reakcióról, hanem védőreakcióról beszélünk, hiszen a vírussal fertőzött sejtek elpusztítása a citotoxikus T-limfociták normális működése. Ha azonban ebben az esetben a citotoxikus T-sejtek valóban elpusztítják a CD 4+ sejteket, ennek a legrosszabb hatással kell lennie az immunrendszerre.
AIDS - indikátor betegségek az 1. csoportba:
A nyelőcső, a légcső, a hörgők és a tüdő candidiasisa.
Extrapulmonalis cryptococcosis (európai blastomikózis)
Cryptospiridosis több mint egy hónapig tartó hasmenéssel.
Bármely szerv citomegalovírusos elváltozásai (a máj, a lép és a nyirokcsomók mellett a lila kivételével) egy hónaposnál idősebb betegeknél.
Herpes simplex vírusfertőzés fekélyes elváltozásokkal a bőrön (vagy a nyálkahártyákon, amelyek több mint egy hónapig fennállnak, vagy egy hónaposnál idősebb betegeknél bármilyen időtartamú herpeszes hörghurut, tüdőgyulladás vagy nyelőcsőgyulladás).
Kaposi-szarkóma 60 év alatti betegeknél.
Az agy limfómája (elsődleges) 60 évnél fiatalabb betegeknél.
Limfocitás intersticiális tüdőgyulladás vagy pulmonalis lymphoid hyperplasia (LI/LH komplex) 13 év alatti gyermekeknél.
Disszeminált fertőzés, amelyet egy csoportba tartozó baktériumok okoznak különböző szervek elváltozásaival (a tüdő, bőr, nyaki vagy hilar nyirokcsomók kivételével vagy azokon kívül).
Pneumocystis tüdőgyulladás.
Progresszív multifokális leukoencephalopathia.
A központi idegrendszer toxoplazmózisa egy hónaposnál idősebb embereknél.
Az AIDS diagnózisa kétes immunblottal is felállítható az AIDS - marker betegségek jelenléte alapján, megbízhatóan csak abban az esetben igazolható, ha a betegnek nincs más oka az immunhiányra:
Szisztémás kortikoszteroid terápia nagy dózisban vagy hosszú ideig, valamint egyéb immunszuppresszánsokkal vagy citosztatikumokkal végzett kezelés az AIDS marker betegség megjelenése előtt három hónappal vagy kevesebbel.
Az AIDS diagnosztizálását követő 3 hónapon belül észlelt betegségek bármelyike - markerfertőzés, Hodgkin-kór, non-Hodgkin-limfóma (kivéve az elsődleges agyi limfómát), limfocitás leukémia, myeloma multiplex, egyéb rosszindulatú limforetikuláris daganatok, ill. hisztiocitikus szövetek, antiimmunoblasztikus lymphadenopathia.
3. Veleszületett vagy szerzett immunhiány, nem hasonlít a HIV-fertőzéshez (például hipogammaglobulinémia kíséretében).
Megbízhatóan laboratóriumilag igazolt HIV-fertőzés esetén számos fertőzés és daganat szerepel az AIDS-indikátoros betegségek listáján:
1) Bakteriális fertőzések, kombinált vagy visszatérő 13 év alatti gyermekeknél (két évnél több eset megfigyelés alatt), vérmérgezés, tüdőgyulladás, agyhártyagyulladás, csont- vagy ízületi elváltozások, Haemophilus influenzae okozta tályogok, streptococcusok.
2) Disszeminált kokcidioidomikózis (extrapulmonalis lokalizáció).
3) HIV encephalopathia („HIV demencia”, „AIDS demencia”).
4) Disszeminált hypoplasmosis extrapulmonalis lokalizációval.
5) Isosporiasis több mint 1 hónapig tartó hasmenéssel.
6) Kaposi-szarkóma bármely életkorban.
7) Agyi limfóma (elsődleges) bármely életkorú személyeknél.
8) Egyéb B-sejtes limfómák (a Hodgkin-kórok kivételével) vagy ismeretlen immunfonotípusú limfómák:
a) kissejtes limfómák (például Burkitt limfóma stb.)
b) immunoblasztos szarkómák (immunoblaszt limfómák, nagysejtes limfómák, diffúz hiszticocitás, diffúz differenciálatlan).
9) Disszeminált mycobacteriosis (nem tuberkulózis), amely a tüdőn kívül, a nyaki vagy a bazális nyirokcsomók bőrén is elváltozásokkal jár.
10) Extrapulmonalis tuberkulózis (a tüdőtől eltérő szerv károsodásával).
11) Salmonella septicaemia, visszatérő, nem Salmonella „Tiffi” miatt
12) HIV-dystrophia.
A tudományos tények gyorsan növekvő száma
virológiai, immunológiai és molekuláris biológiai területek a HIV-fertőzés természetéről a különböző betegcsoportokban lehetővé teszik
három fő kérdés megfogalmazása, amelyekre adott válaszok jelentősen elősegítenék a HIV patogenezisének megértését:
1. Milyen tényezők szabályozzák sikeresen a kezdeti akut virémiát és gátolják a HIV replikációt a nyirokcsomók csíraközpontjában?
2. Milyen tényezők okozzák a vírusreplikáció és az immunrendszer szabályozása közötti labilis egyensúly megzavarását?
3. Mi különbözteti meg a hosszú lappangási idővel rendelkező betegeket a HIV-fertőzöttek többségétől, akiknél több éven át AIDS alakul ki?
A humán immunhiányos vírus megkülönböztető jellemzője a vírus különböző változatainak nagy változatossága, amely a fertőzés során fordul elő. A HIV replikációjában kulcsenzim, a reverz transzkriptáz okozza, amely milliószor gyakrabban hibázik, mint a vírusgenom replikációja során, mint a sejtenzimek a sejtgenom átírása során (ezer bázispáronként egy hiba, tehát vírusgenomonként tíz hiba ).
Mivel az immunrendszer elsősorban az uralkodó víruspopulációra reagál, ráadásul némi késéssel, a vírus újonnan megjelenő változatai bizonyos sejtekben egy ideig akadálytalanul szaporodhatnak. A betegség lefolyása során a vírus új változatai jelennek meg, amelyek a beteg immunrendszerének szelektív hatására jönnek létre. A vírus ezen változatait számos biológiai tulajdonság különbözteti meg. A legújabb osztályozás szerint a vírus jelenlegi tudásszintjének megfelelően a vírusváltozatokat sejttenyészetekben gyorsan szaporodó és magas titerű (R / H) és csak lassan és kis mennyiségben szaporodó vírusokra osztják.
Egy másik kritérium a vírus különböző változatainak citopatogenitásának tulajdonsága, amely bizonyos esetekben óriássejtek megjelenésében, másokban pedig a fertőzött sejtek és nem fertőzött sejtek fúziójában nyilvánul meg funkcionálisan inkompetens syncytium képződésével. A vírus ezen változatait SI-vel jelöltük. A vírus azon változatait, amelyek nem mutatnak citopatogenitást, NSI-nek nevezzük. A legújabb vizsgálatok megerősítik, hogy a virulens és agresszív változatok (R/H/SI) csak az immunrendszer szelektív működése által okozott HIV-fertőzés folyamatában keletkeznek a kevésbé agresszív változatokból. Ezeknek a nagy patogenitású változatoknak a megjelenése összefüggésben áll a HIV robbanásszerű felszaporodásával a nyirokszövetekben és a vérben, valamint a betegség klinikai képének romlásával.
A HIV-fertőzés és az AIDS jelenlétét csak úgy lehet megbízhatóan bizonyítani, ha magát a kórokozót azonosítjuk a beteg szervezetében. Ezt azonban meglehetősen nehéz megtenni. Az AIDS diagnosztizálásának elterjedtebb módszere a specifikus antivirális antitestek kimutatásán alapul különféle immunológiai reakciók segítségével (enzim immunoassay, fluoreszcens antitest módszer, latex agglutinációs teszt, immunoblot).
HIV-ANTESTEK VIZSGÁLATA (anti-HIV-AT).
Az elmúlt három évben a HIV-ellenanyag-tesztelés drámaian megváltoztatta a vírus epidemiológiájával kapcsolatos ismereteinket. A HIV-ellenes antitestek a vírusfertőzés után három héttől három hónapig jelennek meg, és ezt követően szinte mindig kimutathatók, még akkor is, ha a vírus bizonyos mértékig elnyomja a limfociták működését és az antitestek termelését. A kimutatott semlegesítő antitestek titere azonban alacsony, a hatás pedig jelentéktelen – nem akadályozzák meg észrevehetően a fertőzések és betegségek kialakulását.
Diagnosztikai célból a HIV nagy mennyiségben izolálható sejtvonalakból, tisztítható és antigénként használható minden szerológiai tesztben. A HIV-AT-ellenes teszteknek többféle típusa létezik. A legtöbb teszt antigén-enzim konjugátumot használ, és a jel színreakció egy specifikusan kötött enzim és szubsztrátja között. Más tesztek radioizotópokat, antigén-fluoreszcein konjugátum kötést vagy vírussal bevont latex vagy zselatin részecskék agglutinációját alkalmazzák.
Az anti-HIV-AT tesztek 1985-ös kereskedelmi forgalomba hozatala óta széles körben alkalmazzák őket a diagnosztikai és vértranszfúziós laboratóriumokban. A tesztek pontossága – mind az érzékenységük, mind a specifikusságuk – folyamatosan javult, a hamis pozitív és negatív eredmények egyre ritkábbak.
A HIV-ellenanyagokat „összefoglalóan” kimutató teszteken kívül vannak finomabb tesztek is az immunválasz bizonyos összetevőinek kimutatására. Az egyes HIV-fehérjékre adott választ immunoblottal és radioimmunprecipitációval részletesen tanulmányozták. Ezzel együtt lehetőség van az immunglobulinok egyedi osztályainak meghatározására a vérben és más folyadékokban. Különösen érdekesek az anti-HIV - M osztályú immunglobulinok (IgM), mivel a fertőzés kezdetén valamivel korábban jelennek meg, mint az IgG antitestek. Ebben az esetben tehát először az IgM antitestek képződnek.
A tesztek egyszerűsített változatait fejlesztik az anti-HIV-AT tömeges szűrésére szuboptimális laboratóriumi körülmények között. Akkor is kényelmesek, ha az eredményt sürgősen meg kell szerezni, például az átültetés előtt. A nyál diagnosztikai anyagként való felhasználásának lehetőségét is mérlegelik.
Az antitesteken kívül a szérum vírusantigéneket is tartalmaz, különösen a virionmag fő fehérjét (p24). Kimutatható, amikor még túl sok ellene termelt antitest van, általában a fertőzés legelején. A HIV-antigénteszteket jelenleg az antitest-tesztek kiegészítéseként tartják számon. Segítenek a fertőzés korai szakaszának diagnosztizálásában, valamint gyermekeknél a fertőzés felismerésében. A későbbi szakaszokban a HIV-antigén jelenléte a szérumban az immunrendszer kimerülését jelzi, és vírusellenes terápia indikációja lehet, amelyet azután ismételt antigéntesztekkel követnek.
A virémia, amelyet a HIV limfocitákból történő izolálásának képessége jelez, kimutatható az anti-p24 és a vírus más fehérjéi elleni antitestek magas titerének hátterében. A vírusizolálás azonban időigényes eljárás, és a HIV sikeres laboratóriumi diagnosztizálásához olyan embereknél, akiknél kevés vagy nincs antitest, sokkal fontosabb a rendszeres nyomon követési minták vétele. A fertőzés óta a fertőzés kialakulásának megfigyelései azt mutatják, hogy általában mind a HIV-ellenes antitestek titere, mind pedig készlete nő. A több hónappal ezelőtt vagy korábban fertőzött egyének szinte mindig erős vírusellenes választ mutatnak. Így az anti-HIV-AT-re adott tartósan rossz válaszokat egy szem sóval kell kezelni.
A jövőben a HIV-AT-ellenes tesztelés valószínűleg gyorsabbá és gyakorlatiasabbá válik. Valószínűleg szintetikus antigéneket és más újításokat fognak használni. A legújabb anti-HIV-AT tesztkészletek a rokon retrovírusok, például a HIV-2 elleni antitesteket is kimutatják. Talán lesznek készletek a vírus összetevőinek - antigénjeinek vagy genomjának - tesztelésére, valamint önállóan használható készletek.
VAKCINA FEJLESZTÉSI LEHETŐSÉGEK.
Az AIDS-oltás létrehozása összetett, sokrétű probléma. Az ilyen vakcinának először meg kell felelnie a következő követelményeknek:
a) a HIV semlegesítését okozza, mielőtt behatolna a központi idegrendszer (központi idegrendszer) struktúráiba, ahol a vírus elérhetősége az immunkompetens sejtek számára minimális;
b) biztosítja a HIV valamennyi antigén variánsának immunrendszerének felismerését;
c) garantálni minden beoltottak védelmét, kortól és nemtől, valamint a szervezetben lévő HIV mennyiségétől függetlenül;
d) kizárja annak kockázatát, hogy maga a vakcina AIDS kialakulását okozhatja.
Elvileg lehetséges a következő típusú vakcinák létrehozása: elölt alegység és szintetikus. J. Salk (USA) laboratóriumában jelenleg is folynak kísérletek inaktivált HIV-törzsekkel, mint vakcinával. Az oltás során előforduló AIDS kockázata miatt azonban ennek a biológiai készítménynek a hatálya jelentősen korlátozott. Az ilyen vakcina csak HIV-fertőzöttek immunválaszának serkentésére használható (ún. expozíció utáni profilaxis), A J. Salk által végzett oltás klinikai eredményeiről egyelőre nincsenek konkrét adatok.
Az immunrendszer egy fontos összetevőjét károsító kórokozó elleni immunizálás különösen nehéz. Ráadásul kiderült, hogy a HIV rendkívül változatos vírus, és a nemrég izolált HIV-2 feltűnően különbözik az összes HIV-1 izolátortól. Eddig minden vírus elleni immunizálási kísérlet tisztított vagy klónozott burokglikoproteint használt. Kísérleti állatokban a vírus ellen semlegesítő antitestek képződését idézi elő, de sajnos csak az immunizálásra használt törzs ellen (típusspecifikus immunitás).
Végül, az AIDS-szel összefüggő daganatok (Kaposi-szarkóma, limfómák, melanómák stb.) általában nagyon rosszindulatúak, szinte nem reagálnak még a modern terápiára sem, és nagyon gyorsan tragikus véghez vezetik a betegeket.
2) Lehet-e AIDS-et kapni közterületen A fertőzés terjedése szempontjából nem jelent veszélyt a tömeges összejövetelekkel járó nyilvános helyek látogatása, akik között lehetnek AIDS-betegek vagy immunhiányos vírussal fertőzöttek. Tüntetésen vagy gyűlésen több ezres tömegben, színházba vagy moziba látogatva, könyvtári könyvet olvasva vagy üzleti telefonon beszélve nem lehet AIDS-et kapni.
Félelem nélkül használhat bármilyen tömegközlekedési eszközt (metró, busz, villamos stb., csúcsidőben is), úszhat a medencében és edzhet az edzőteremben, látogathat nyilvános WC-ket, fodrászhat a fodrásznál és csinálj manikűrt. Anélkül, hogy az AIDS miatt aggódna, elfoglalhat egy szállodai szobát, még akkor is, ha korábban beteg ember lakott benne, és olyan kempingben lakhat, amelynek lakóinak fele tüsszent vagy köhög. Ilyen életkörülmények között elkaphat influenzát vagy akut légúti megbetegedéseket, szélsőséges esetekben kanyarót vagy mumpszot (ha gyermekkorában nem szenvedett ezektől a fertőzésektől, és valamilyen okból nem kapta meg az oltást), de az AIDS-et nem.
3) Kaphat AIDS-t a csókolózástól? Ez a kérdés nagyon összetett, és úgy tűnik, még mindig nincs egyértelmű válasz. Természetesen a fertőzött ember nyálában kis mennyiségű vírusrészecskék mindig jelen vannak, és az úgynevezett „nedves” („szexuális”) csókokkal bejuthatnak egy egészséges ember szervezetébe. Ezért elméletileg csókolózáskor megfertőződhet az immunhiányos vírussal, főleg ha gyakran, hosszan és mindenkivel egymás után csókol. És ha egyidejűleg intim kapcsolatba kerül egy véletlenszerű partnerrel, akkor az AIDS nem kerülhető el. De „száraz” csókkal, bajtársi puszival az arcára, úri csókokkal hölgy ujjaira, kezére stb. a HIV átvitel gyakorlatilag megszűnt. És azoknak a lányoknak-menyasszonyoknak vagy fiatal férfiaknak-vőlegényeknek, akik törvényes házasságot kötnek, majd hűséges házastársakká válnak, kölcsönös csókokkal az esküvő előtt és után sem, nincs ok az AIDS miatti aggódásra.
4) Véd az óvszer az AIDS ellen? Az óvszer használata csökkenti az immunhiányos fertőzések valószínűségét. Például az Egyesült Államokban 526 prostituált bevonásával végzett felmérés során a nők 11%-ánál találtak antitesteket az AIDS kórokozója ellen. Ugyanakkor mind a 22 prostituált, akiknek ügyfelei mindig óvszert használtak, HIV szerológiai tesztje negatív volt. Mindazonáltal emlékezni kell arra, hogy a mechanikus fogamzásgátlók még helyes használat esetén sem adnak 100% -os garanciát az AIDS megelőzésére (a fertőzés valószínűsége egy fertőzött szexuális partnerrel való folyamatos érintkezés révén egy évig körülbelül 10-15%). Végezetül még egyszer hangsúlyozni kell, hogy az AIDS elleni leghatékonyabb megelőző intézkedés továbbra is az alkalmi szex megelőzése.
5) Hogyan nem terjedhet át az AIDS? Az AIDS kórokozóit nagy mennyiségben tartalmazza a beteg vére, egyéb biológiai folyadékai és különféle váladékai. Az otthoni környezetben élő egészséges emberek számára azonban a HIV-fertőzött vagy AIDS-fertőzött személy fertőzésforrásként gyakorlatilag nem jelent veszélyt. Ennek számos oka lehet (az életképes vírusrészecskék számának gyors csökkenése; képtelenek bejutni az emberi szervezetbe ép bőrön vagy nyálkahártyán keresztül; alacsony a valószínűsége annak, hogy egy egészséges személy közvetlen és hosszan tartó érintkezésbe kerül a külső környezetben lévő fertőző anyaggal, stb.).
Több tízezer AIDS-beteg hosszú távú megfigyelésének eredményei egyértelműen bizonyították, hogy az AIDS kórokozói nem terjednek kézfogással vagy öleléssel, edényekkel vagy háztartási cikkekkel, ágyon vagy fehérneműn, pénzérmével vagy papírpénzzel. Még az a legkisebb lehetőség is kizárt, hogy étellel, ivóvízzel, gyümölcs- és zöldséglevekkel, beltéri levegővel vagy légköri levegővel megfertőződjön az AIDS. Egyetlen AIDS-es esetet sem regisztráltak, amikor a fertőzés játékokon vagy tanszereken keresztül történt volna, bár a gyerekek gyakrabban és közvetlenebb háztartásban érintkeznek egymással, mint a felnőttek. Tehát a következtetés egyértelműen levonható: az AIDS kórokozói fertőzött vagy beteg emberektől nem terjednek át egészséges emberekre háztartási úton!
6) Mi az előrejelzés az AIDS-járvány kialakulására vonatkozóan? Az Egészségügyi Világszervezet becslése szerint 1997 végére az AIDS-betegek összlétszáma meghaladja a 2 milliót, 2000-re pedig már több milliót. Valószínűleg mintegy 500 ezer újszülött fertőződik meg AIDS-szel, és többségük az első 3-5 évben meghal. Az előrejelzések szerint 1989-ben Európában az AIDS-betegek számának meg kellett volna haladnia a 20 ezret (ez az előrejelzés beigazolódott), 1990-ben pedig a 100 ezret. Észak-Amerikában és Európa nagy részén tovább fog növekedni az AIDS-vírussal fertőzöttek száma a kockázati csoportokban, különösen a kábítószer-függők körében. A kockázati csoportokba nem tartozó hétköznapi emberek körében azonban az előfordulás jelentős növekedése várható. Ennek oka a HIV széles körben elterjedt heteroszexuális átvitele.
7) Vannak-e eredmények az AIDS elleni küzdelemben? Kétségtelenül. Először is, ez a WHO égisze alatt létrejött az AIDS elleni globális program – egy speciális tudóscsoport, amely az AIDS és a HIV-fertőzés elleni küzdelmet szervezi. Ez a csoport mintegy kétszáz magasan kvalifikált szakembert foglal magában.
Kialakult és sikeresen működik egy AIDS-megfigyelő rendszer, amelyben a világ 177 országa vesz részt (1989. január 1-jén kb. 133 000 AIDS-es esetet regisztráltak 143 országban). Tudományos epidemiológiai adatok alapján szakértői értékelést végeztek a HIV-fertőzés előfordulásáról a világon (Afrika - 2,5 millió, Amerika - 2 millió, Európa - 500 ezer, Ázsia és Óceánia - 100 ezer). Különböző laboratóriumi állatokon (egereken, nyulakon stb.) megfelelő kísérleti modelleket dolgoztak ki az AIDS és a HIV fertőzésre.
Az elmúlt években olyan új diagnosztikai tesztrendszereket hoztak létre, amelyek lehetővé teszik a HIV elleni antitestek 1-5 percen belüli kimutatását, és minőségükben (elsősorban érzékenységben és specificitásban) nem rosszabbak, mint a standard enzimes immunoassay. Négy, géntechnológiai módszerekkel létrehozott vakcina már az embereken végzett klinikai vizsgálatok első fázisán megy keresztül. Több mint 50 új, HIV elleni nagy aktivitású kemoterápiás gyógyszert tesztelnek.
Nemrég a World Health magazin (1989, 1-2. sz., 30. o.) közzétette a „10 parancsolatot” az AIDS-ről.
1) Az AIDS egy teljesen új betegség, amely az egész világon elterjedt.
2) Az AIDS-vírus útjai és terjedése már jól ismertek.
3) Az AIDS kórokozójának terjedési módjainak ismerete azt jelenti, hogy tudjuk, hogyan lehet megelőzni.
4) Az AIDS-vírus szexuális átvitele megelőzhető.
5) Számos megbízható módszer létezik a fertőzés véren keresztüli átvitelének megelőzésére.
6) Nagyon fontos tudni, hogyan nem terjed az AIDS kórokozója.
7) Nem kell félnie az AIDS-vírussal fertőzött emberekkel való kommunikációtól a mindennapi életben.
8) Mivel az AIDS ellen nincs védőoltás és abszolút megbízható gyógyszerek, az igaz információk és az egészségügyi oktatás döntő szerepet játszik a fertőzések megelőzésében.
9) Jelenleg a világ minden országa felemelkedik az AIDS globális fenyegetés elleni küzdelemre.
10) Együtt megállíthatjuk az AIDS terjedését!
Az olvasónak kínált tudományos munkában hozzáférhető és szórakoztató formában bemutatják az AIDS természetéről és kórokozója terjedésének jellemzőiről szóló főbb modern információkat, ismertetik a vírus átvitelének módjait és tényezőit. Rövid leírást adunk a betegség különböző megnyilvánulásairól, közöljük a legfrissebb statisztikai anyagokat. Minden kritikai észrevételt köszönettel fogadunk!
A humán immundeficiencia vírus a lentivírus nemzetség retrovírusa. Külsőleg gömb alakú, amelynek átmérője 120-150 nm. A külső héj részeként, amelynek segítségével a HIV az immunrendszer sejtjeihez kötődik, számos fehérje - glikoprotein (gp41-transzmembrán és gp120-felület) található. A felszíni glikoproteinek sajátos kinövéseket képeznek a vírus membránján, megjelenésükben (elektronmikroszkópban) a gomba "sapkájához", a gp41 pedig a "lábához". A vírus alapját - a genomot - egyszálú RNS (két molekula) képviseli. Minden molekulát kilenc vírusgén képvisel: strukturális, szabályozó és kiegészítő. Ennek megfelelően információkat hordoznak a vírus szerkezetéről, a sejtek fertőzésének módszereiről, a virionok szaporodásáról.
 A vírus genomot mátrix és kapszid fehérjék (p17, illetve p24) veszik körül, zárt kúp alakú szerkezetet alkotva. A HIV képes olyan enzimeket termelni, mint a reverz transzkriptáz, proteáz és integráz, emellett a humán immundeficiencia vírus rendkívül gyorsan képes megváltozni a genomjában bekövetkező mutációk hatására. A vírus legtöbb változata nagyon kis mértékben különbözik egymástól, de számos fajt izoláltak, amelyek jelentős különbségeket mutatnak: HIV-1 (1983-ban fedezték fel), HIV-2 (1986-ban), HIV-3 (1988-ban) és HIV- 4 (először 1986-ban fedezték fel, de valamivel később külön fajként azonosították). A HIV-1 főként Európa és Amerika lakosságát érinti, a HIV-2 - Nyugat-Afrika, a vírus egyéb fajtái nem annyira elterjedtek.
A vírus genomot mátrix és kapszid fehérjék (p17, illetve p24) veszik körül, zárt kúp alakú szerkezetet alkotva. A HIV képes olyan enzimeket termelni, mint a reverz transzkriptáz, proteáz és integráz, emellett a humán immundeficiencia vírus rendkívül gyorsan képes megváltozni a genomjában bekövetkező mutációk hatására. A vírus legtöbb változata nagyon kis mértékben különbözik egymástól, de számos fajt izoláltak, amelyek jelentős különbségeket mutatnak: HIV-1 (1983-ban fedezték fel), HIV-2 (1986-ban), HIV-3 (1988-ban) és HIV- 4 (először 1986-ban fedezték fel, de valamivel később külön fajként azonosították). A HIV-1 főként Európa és Amerika lakosságát érinti, a HIV-2 - Nyugat-Afrika, a vírus egyéb fajtái nem annyira elterjedtek.
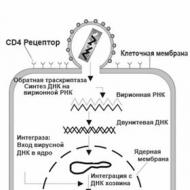
A HIV kölcsönhatása egy sejttel
 A HIV csak olyan sejtekkel tud kölcsönhatásba lépni, amelyek felületükön CD4 receptorokat hordoznak. E sejtek többsége makrofág és T-limfocita. A vírus membránján található felszíni glikoprotein (g120) érintkezésbe lép a limfocita sejt CD4 receptorával, melynek eredményeként ezek egyesülnek egymással, és a HIV genetikai anyag behatol a citoplazmába. A vírus reverz transzkriptáza ebben a pillanatban elindítja a DNS-szintézis folyamatát, amely saját RNS-ének egy szálán alapul, azaz. közvetlenül aktiválja a reverz transzkripciót. Az integráz enzim ezután elindítja a gazdaszervezet és az újonnan szintetizált vírus DNS összekapcsolásának folyamatát. Ezenkívül a sejt átrendeződik, hogy sajátja helyett vírus RNS-t szintetizáljon, aminek következtében a sejt riboszómái a saját fehérjék és enzimek helyett nagy mennyiségű vírusenzimet és annak szerkezeti fehérjéit kezdik el termelni. A sejten belül beindul a virionok termelődésének folyamata, amelyet a proteáz katalizál. Amint számuk túlzottan megnő, a sejtmembrán elpusztítása után kijutnak - a vérbe, ahol új limfocitákat és makrofágokat fertőznek meg.
A HIV csak olyan sejtekkel tud kölcsönhatásba lépni, amelyek felületükön CD4 receptorokat hordoznak. E sejtek többsége makrofág és T-limfocita. A vírus membránján található felszíni glikoprotein (g120) érintkezésbe lép a limfocita sejt CD4 receptorával, melynek eredményeként ezek egyesülnek egymással, és a HIV genetikai anyag behatol a citoplazmába. A vírus reverz transzkriptáza ebben a pillanatban elindítja a DNS-szintézis folyamatát, amely saját RNS-ének egy szálán alapul, azaz. közvetlenül aktiválja a reverz transzkripciót. Az integráz enzim ezután elindítja a gazdaszervezet és az újonnan szintetizált vírus DNS összekapcsolásának folyamatát. Ezenkívül a sejt átrendeződik, hogy sajátja helyett vírus RNS-t szintetizáljon, aminek következtében a sejt riboszómái a saját fehérjék és enzimek helyett nagy mennyiségű vírusenzimet és annak szerkezeti fehérjéit kezdik el termelni. A sejten belül beindul a virionok termelődésének folyamata, amelyet a proteáz katalizál. Amint számuk túlzottan megnő, a sejtmembrán elpusztítása után kijutnak - a vérbe, ahol új limfocitákat és makrofágokat fertőznek meg.