モルヒネ中毒。 モルヒネ麻酔: 使用説明書。 免疫システムへの影響
モルヒネ (5a,6a) -ジデヒドロ-4,5-エポキシ-17-メチルモルフィナン-3,6-ジオール)- 主要なアルカロイドの 1 つ アヘン。 この言葉は古代ギリシャ語に由来しています 神モーフィアス、 文字通り 夢を生み出す人。 古い名前 - モルヒネ。 ポピー睡眠薬、ステファニア、シノメニウム、ムーンシードに含まれています。 クロトン属、コクルス属、トリクリシア属、オコテア属ではあまり一般的ではありません。 実際には、アヘンケシの乾燥した乳状の汁からのみ得られます。 生のアヘン中のモルヒネの含有量は10〜20%に達し、最小濃度は約3%です。
アヘンケシには立体異性体 (-)-モルヒネが 1 つだけ含まれていると言わなければなりません。 (+)-モルヒネは合成されたものであり、(-)-モルヒネの薬理学的特性を持ちません。
モルヒネの化学式はC17H19NO3です。.
純粋な形では、モルヒネは白色の結晶性粉末であり、長期間保存すると黄色または灰色がかった色合いになります。 主に注射用の溶液の形で製造されます。
モルヒネの医療使用十分な広さ。 モルヒネ誘導体、特に鎮痛剤(鎮痛剤、軽度の麻酔剤、鎮静剤)としての塩酸塩(注射剤)および硫酸塩(経口剤)。 モルヒネは、重度の肉体的痛みや心因性の痛みの感覚を効果的に抑制することができます。 鎮静作用もあり、咳反射を抑えます。 痛み中枢の興奮を抑え、怪我の際の抗ショック効果もあります。 急性心筋梗塞に使用されます。
モルヒネは、胃、十二指腸、胆嚢の研究における放射線医学の現場で使用されることがあります。 モルヒネの導入により、胃の筋肉の緊張が高まり、蠕動運動が増加し、胃の排出が加速され、造影剤による十二指腸の伸張が引き起こされます。 これは、胃の潰瘍や腫瘍、十二指腸潰瘍を特定するのに役立ちます。 モルヒネによるオッディ筋括約筋の収縮は、胆嚢のX線検査に好ましい条件を作り出します。
モルヒネは人体に麻薬作用があるため、麻薬中毒者もモルヒネを回避できません。 薬物の作用は、静脈内または筋肉内注射後5〜10分で始まります。 血液中のモルヒネ濃度のピークは 20 分後に観察されます。 人体に対する薬の影響は、多幸感、暖かさ、眠気、意識レベルの低下を伴います。 投与量に応じて、モルヒネの効果は 2 ~ 8 時間持続します。
モルヒネ使用の兆候:
瞳孔は大きく収縮しており、目はわずかに赤みを帯びており、非常に輝いています。 目の下のあざ、表面的な断続的なゆっくりとした呼吸。 皮膚のかゆみ(特に鼻)。 無気力で眠い。 ろれつが回らない話し方。 受動性と全体的なリラックス。 自分以外のすべてに対する無関心。 多幸感と不注意。 過剰な「勇気」と決意。 緊張感; 皮膚と粘膜(唇、舌)の乾燥。 表面的な睡眠。 尿量の減少。 頻繁な便秘。 風邪の場合、咳はありません。 わずかな体温の低下。 モルヒネの作用の特徴は、呼吸中枢の抑制です。 有毒な用量を摂取すると、周期的な呼吸が出現し、呼吸停止の結果として死亡します。
モルヒネの使用による影響:
モルヒネは強力な麻薬であり、すぐに依存性が高まり、その結果、持続的な身体依存が生じますが、これはモルヒネ分子の一部がエンドルフィンの断片と非常によく似ているためです。 通常の生活では、エンドルフィンは神経系によって生成され、人の感情的および知的活動を調節します。 すでに2〜3週間定期的に薬物を使用した後、人は自分で依存症を取り除くことが事実上不可能になります。 薬物に対する耐性はかなり早く現れます。、そして用量が絶えず増加すると、過剰摂取と死につながる可能性があります。 離脱症候群は、モルヒネを最後に投与してから 10 ~ 12 時間後に発生します。 それは、過敏症、攻撃性、筋肉の衰弱、吐き気、嘔吐の形で現れます。 急性離脱症候群の期間は5〜14日です。 さらに、モルヒネは腸の運動性の低下(便秘)に伴う副作用を引き起こします。
モーフィンの話から:
モルヒネは、ドイツの薬学者フリードリッヒ・セルチューナーによってアヘンから最初に分離されました。 1804
年。 モルヒネに、ギリシャ神話の夢の神、睡眠の神ヒュプノスの息子モルフェウスにちなんでその名前を付けたのは、F. セルチューナーでした。
トム・デ・クインシーは「英国オピオマンの告白」というエッセイを残しました( 1822 )、その中で彼はモルヒネ薬物中毒がどのように発症するかを詳細に説明しました。 モルヒネは精製された最初のアルカロイドでした。。 しかし、モルヒネが普及したのは、注射針が発明されてからです。 1853 年。 痛みを和らげるために使用されてきました。 さらに、アヘンやアルコール中毒の「治療」としても使用されました。 アメリカ南北戦争中にモルヒネが広範に使用されたため、40万人以上に「軍隊病」(モルヒネ中毒)が発生しました。
で 1874 モルヒネは、モルヒネ ジアセチルモルヒネから合成されました。 ヘロイン。 ヘロインが合成される前は、モルヒネが世界で最も広く使用されていた麻薬性鎮痛薬でした。
19世紀末、1870年から1871年の普仏戦争から帰還したドイツの兵士や将校のほぼ半数がモルヒネ中毒者であることが判明した。 戦闘状態にある多くの兵士はモルヒネを自分自身に注射しましたが、これは当時手頃な価格で流行の鎮静剤となりました。 1879年、作品の1つに「兵士の」と呼ばれる病気の説明が登場しました。 当時、アメリカ軍ではほとんどすべての病気がアヘンで治療されていました。 1880年、国際会議で、麻薬の乱用によって引き起こされる新たな病気「薬物中毒」の出現が発表された。
20世紀初頭、多くの医師がモルヒネ中毒者になりました。 医療現場では、モルヒネ中毒の有害性を理解している医師であれば、必要に応じて自分自身にモルヒネを投与することができ、自覚による依存症を回避できるという意見があった。 実際にやってみると、この意見は誤りであることが分かりました。
モルヒネの完全な合成は 1952 年になって初めて行われました。しかし、その長さと複雑さ(当初は 17 のステージが含まれていた)により、商品化するのは非現実的です。 現在、いくつかの異なる合成方法が提案されていますが、天然モルヒネは合成モルヒネよりも依然として安価です。
20 世紀初頭、多くの医師がモルヒネ中毒になりました。 医療現場では、モルヒネ中毒の有害性を理解している医師であれば、必要に応じて自分自身にモルヒネを投与することができ、自覚による依存症を回避できるという意見があった。 実際にやってみると、この意見は誤りであることが分かりました。 物語「モルヒネ」の著者ミハイル・ブルガーコフは、しばらくの間モルヒネ中毒だったが、最初の妻の無私な助けのおかげで薬物中毒から完全に治った。 レフ・トルストイの『アンナ・カレーニナ』では、主人公が二度目の出産の痛みを和らげるために初めてモルヒネを投与された後、その中毒になった様子が描かれている。 有名なモルヒネ中毒者はヘルマン・ゲーリングですが、彼はこの中毒を治しました。 多くのクリエイティブな人々がモーフィニズムの罠に陥っています。 そのため、エディット・ピアフは人生の終わりに、公演中であっても注射に頼らざるを得ませんでした。 モルヒネの被害者の中にはウラジミール・ヴィソツキーも含まれていると考えられます。
体系的 (IUPAC) 名: (5α,6α)-7,8-ジデヒドロ-4,5-エポキシ-17-メチルモルフィナン-3,6-ジオール
商号:MSコンチン、オラモルフ、セブレドールなど
妊娠中の申請
合法性
オーストラリア: 規制物質 (S8)
カナダ: リスト I
ニュージーランド:クラスB
英国: クラス A
米国: リスト II
国連: 規制薬物スケジュール I および III
℞ (処方箋のみ)
依存症のリスク:
体力:高い
心理的: 中~高
慣れのリスク:高い
応用吸入(吸入、喫煙)、吸入(鼻から)、経口、直腸、皮下、筋肉内、静脈内、硬膜外およびくも膜下腔内
バイオアベイラビリティ 20~40% (経口)、36~71% (直腸)、100% (IV/IM)
タンパク質の結合 30–40%
代謝肝臓、90%
人生の半分 2~3時間
排泄腎臓 90%、胆汁 10%
モルヒネ (国際一般名) は、何百もの商品名で販売されているオピオイド鎮痛薬です。 それはアヘンに含まれる主要な精神活性物質です。 モルヒネおよび他のオピオイド (オキシコドン、ヒドロモルホン、ヘロインなど) の鎮痛作用は、中枢神経系に対する直接作用に基づいています。 モルヒネの使用は中毒、耐性、心理的依存の急速な発症に関連していますが、身体的依存の場合は発症するまでに数か月の継続使用が必要です。 呼吸抑制や多幸感などの影響に対する耐性は、鎮痛作用に対する耐性よりも早く発達します。 慢性的な痛みに苦しむ多くの患者は、処方された用量を何年も飲み続けることができます。 ただし、その影響は非常に早く回復し、痛みの閾値が上昇する可能性があります。 モルヒネは、アヘンに豊富に含まれるアヘン剤で、アヘン、ケシの未熟な莢の粉ミルクです。 モルヒネは植物源から分離された最初の有効成分です。 これは、アヘン、ケシわら濃縮物、およびその他の誘導体に含まれるいくつかのグループに属する (少なくとも) 50 種類のアルカロイドのうちの 1 つです。 モルヒネの主な供給源はアヘンからの化学抽出です。 モルヒネは米国ではスケジュール II、英国ではクラス A、カナダではスケジュール I です。モルヒネは 1804 年にフリードリヒ セルチュルナーによって初めて分離されました。 モルヒネは人類の歴史上、植物から初めて単離されたアルカロイドであると考えられています。 1027 年、メルク社はモルヒネの商業販売を開始しました。 当時、メルクは小さな薬局のひとつにすぎませんでした。 モルヒネは、1857 年に注射器が発明されてからより広く使用されるようになりました。 サーターナーは、この物質が睡眠を誘発する性質を持っていたため、ギリシャの睡眠の神モルフェウスにちなんでこの物質を「モルフィウム」と名付けました。 モルヒネは、WHO の必須医薬品モデル リスト (最も重要な医薬品のリスト) に含まれています。
医療での使用
モルヒネは主に、短期または長期の激しい痛み、心筋梗塞や陣痛に伴う痛みの軽減に使用されます。 ただし、ST セグメントの上昇がない心筋梗塞の場合にモルヒネを使用すると、死亡リスクが増加します。 伝統的に、モルヒネは急性肺水腫の治療にも使用されてきました。 しかし、2006 年の報告書では、この慣行を裏付ける証拠はほとんど示されていませんでした。 即時放出型モルヒネは、(がんやその他のさまざまな原因による)短期的な息切れの症状を軽減するために使用されます。 安静時の呼吸不全、または進行がんや進行心肺疾患における最小限の努力での呼吸不全では、徐放性モルヒネを低用量で一貫して使用すると呼吸不全が大幅に軽減され、その有益な効果は時間が経っても持続します。 モルヒネの鎮痛効果の持続時間は、静脈内、皮下、または筋肉内に投与した場合は約 3 ~ 4 時間、経口摂取した場合は 3 ~ 6 時間です。 オーストリア、ブルガリア、スロベニアでは、徐放性モルヒネがアヘン剤代替療法(メサドンやブプレノルフィンの副作用に耐えられない中毒者、またはこれらの薬が適さない中毒者向け)にも使用されています。
禁忌
モルヒネは以下の状況では使用すべきではありません。
急性呼吸抑制
腎不全(モルヒネ-3-グルクロニドおよびモルヒネ-6-グルクロニド代謝物の蓄積による)
化学中毒(耐性の低い人にとっては致命的になる可能性があります)
頭部外傷を含む頭蓋内圧の上昇(呼吸抑制が悪化するリスク)
肝疝痛。
以前はモルヒネは急性膵炎に使用すべきではないと考えられていましたが、文献をレビューしたところ、この主張を裏付ける証拠は見つかりませんでした。
副作用
便秘
モルヒネは、ロペラミドなどの他のオピオイドと同様、胃腸管の腸管神経叢(腸の運動を調節する神経細胞叢)に作用し、腸の運動を低下させ、便秘を引き起こします。 モルヒネの胃腸への影響は、主に腸内のミューオピオイド受容体に対するモルヒネの作用によって媒介されます。 モルヒネは、胃排出を阻害し、腸の蠕動運動を減少させることにより、腸内通過を減少させます。 これは、腸の分泌物の減少と腸による体液の吸収の増加によっても促進されます。 オピオイドは間接的に腸に影響を及ぼし、一酸化窒素生成の阻害の結果として腸の強直性けいれんを引き起こす可能性もあります。 この効果は、一酸化窒素前駆体がモルヒネの運動関連の副作用を逆転させる動物実験で実証されています。
ホルモンバランスの乱れ
臨床研究によると、モルヒネは他のオピオイドと同様、性腺機能低下症(性腺のホルモン活性の低下によって引き起こされる症候群、血中テストステロン濃度の低下と特徴的な臨床症状を伴う精巣の機能不全)およびホルモンの不均衡を常用者に引き起こすことが多い。男女。 この副作用は用量依存性であり、モルヒネを治療目的で使用する場合と娯楽目的で使用する場合の両方で観察されています。 モルヒネは黄体形成ホルモンのレベルを抑制するため、女性の月経に影響を与える可能性があります。 多くの研究では、オピオイド常用者の大多数 (約 90%) がオピオイドによる性腺機能低下症を患っていることが示されています。 これにより、モルヒネの慢性使用者では骨粗鬆症や骨折のリスクが高まる可能性があります。 研究によると、この効果は一時的なものです。 2013 年の時点では、モルヒネが低用量または短期間で内分泌系にどのような影響を与えるかは不明です。
テストのスコアへの影響
ほとんどの証拠は、オピオイドが感覚、運動、注意を測定するテストのパフォーマンスに最小限の影響を与えることを示しています。 しかし、モルヒネがパフォーマンスに影響を与えることが最近の証拠で示されており、モルヒネが中枢神経系の抑制剤であることを考えると、これは驚くべきことではありません。 モルヒネは、中枢神経系全体の興奮の指標である臨界フリッカー周波数(臨界フリッカー周波数とは、継続的に光っている感覚が得られる光の点滅の最小周波数です)に違反し、マドックス テストの成績も悪化させます。斜視の性質と程度を判定する方法。被験者の片方の目にマドックスの杖を置き、この目に見える光の帯のマドックススケール上のゼロからの偏差を評価します。これが偏差の指標となります。目の光軸のこと。 モルヒネが運動能力に及ぼす影響については、いくつかの研究が行われています。 高用量のモルヒネは、フィンガータッピングテストのパフォーマンスの低下を引き起こす可能性があります(フィンガータッピングテストは、運動制御のテストです。患者は、キーボード上の4つのボタン(通常は数字)を一定の順序でしばらく押すように求められます)。たとえば、4-3-1-2 -4、その後に犯したエラーの数)、および一定の低レベルの等尺性筋力を維持する能力(つまり、細かい運動能力の障害)も考慮されていますが、研究はありません。粗大運動能力に対するモルヒネの影響について。 認知に対するモルヒネの影響に関して、ある研究では、モルヒネが順行性および逆行性健忘の一因となる可能性があるが、これらの影響は最小限で一時的なものであることが判明しました。 さらに、オピオイド不耐症の人におけるオピオイドの短期使用は、一部の感覚能力および運動能力のわずかな低下と関連しており、おそらく注意力と認知力の尺度の低下にも関連していると考えられています。 このような影響は、モルヒネに対する耐性が形成されていないユーザー (いわゆる「ナイーブ」ユーザー) にのみ観察される可能性が非常に高くなります。 定期的にモルヒネを使用している人(例、慢性鎮痛オピオイド療法を受けている人)では、行動検査の結果、ほとんどの場合、知覚、認知、調整、行動などの尺度に関して正常に機能していることが示されました。 このような患者に関する最新の研究の1つでは、科学者たちはモルヒネの常用者が安全に車を運転できるかどうかを確立しようと試みた。 この研究のデータは、モルヒネの慢性使用者は車の運転に必要な能力(身体的、認知的、知覚的を含む)に重大な低下を経験していないことを示しました。 患者は、速度や反応を必要とするタスク(たとえば、被験者に複雑な図形を再描画してから記憶から描くように求められるレイ複雑図形テストなど)では比較的早く実行できましたが、間違いの数は患者よりも多かったです。対照群のもの。 慢性鎮痛オピオイド療法を受けている患者は、(ウェクスラーテストで示されるように)視覚空間認識と組織化の欠陥を示さないが、(レイテストで示されるように、絵を描く必要があった)即時および短期の視覚記憶が悪化する。記憶からの複雑な数字)。 これらの患者には高次の認知能力(計画能力など)に障害はありませんでした。 患者は指示に従うことが困難であり、衝動的な行動をする傾向を示しましたが、この指標は統計的有意性には達しませんでした。 重要なことに、この研究は、オピオイド療法を受けている患者には特定の領域が欠乏していないことを示しており、オピオイド療法が精神運動機能、認知機能、または神経心理機能に与える影響はわずかであることを示唆しています。 人がモルヒネを使用する理由が分からない限り、パフォーマンスに対するモルヒネの影響を研究することは困難です。 オピオイド未使用の被験者は、ほとんどの通常のモルヒネ使用者とは異なり、痛みを経験しないボランティアです。 痛みはストレス要因となるため、パフォーマンステスト、特に高度な集中力を必要とするテストに支障をきたす可能性があります。 痛みは時間の経過とともに変化し、人によって異なります。 痛みによって引き起こされるストレスがどの程度障害を引き起こす可能性があるのか、またモルヒネがこれらの障害にどのような影響を与えるのかは明らかではありません。
中毒性のある
モルヒネは潜在的に依存症のリスクが高い物質です。 精神的依存と身体的依存、そして耐性が生じる可能性があります。 重度の痛みに対してモルヒネを使用している場合、耐性の発達を防ぐために心理的要因と身体的要因が組み合わされて使用されることがありますが、長期にわたる治療では、必然的に身体的依存と耐性が生じます。 アヘン剤中毒者におけるヘロインとモルヒネの生理学的効果と主観的効果を比較した対照研究では、患者はどちらの薬物も好みませんでした。 これらの薬剤の同等に有効な注射用量は同様の作用機序を有し、多幸感、野心、神経過敏、弛緩、無気力、眠気などの主観的に知覚される効果に違いはありません。 依存症に焦点を当てた短期研究では、ヘロインとモルヒネに対する耐性がほぼ同じ速度で発現することが示されています。 ヒドロモルホン、フェンタニル、オキシコドン、ペチジン/メペリジンなどのオピオイドと比較して、元中毒者はヘロインとモルヒネを明らかに好むことがわかりました。 ヘロインとモルヒネは、特に乱用や依存のリスクが高いと考えられています。 これらの物質は、他のオピオイドよりも多幸感やその他の肯定的な主観的効果などの効果とより関連しています。 元中毒者がこれら 2 つの薬物を選択するのは、ヘロイン (二酢酸モルヒネ、ジアモルヒネ、またはジアセチルモルヒネとも呼ばれる) がモルヒネのエステルであり、モルヒネの不活性型 (活性型に変換される) であるという事実によるものと考えられます。体内の形状)。 したがって、これらの物質は生体内では同一です。 ヘロインは脳や脊髄のオピオイド受容体に結合する前にモルヒネに変換され、その後モルヒネは中毒者が魅了される主観的な効果を発揮します。 ラット・パーク(「ラット・パーク」)と呼ばれる実験などの他の研究もある。実験の本質は、大きな檻、豊富な餌と遊びという、完全な生涯を送るためのすべての条件を備えたマウスが、何も示さないということであった。より過酷な条件下で飼育されたマウスとは対照的に、モルヒネを自分で食べる傾向は、モルヒネが身体依存を発症する可能性が一般に考えられているよりも低いことを示しています。 モルヒネ中毒に関するほとんどの研究は、「人間のようなストレスの大きい動物は薬物に慰めを求める」ことを示しています。 つまり、十分な居住空間、十分な食事と娯楽、仲間、運動場所、個人の空間を備えた好ましい環境に置かれたマウスは、モルヒネ中毒になる可能性が低いということです。 より最近の研究では、生活環境の改善がマウスのモルヒネ渇望の減少と関連していることも示しています。
許容範囲
モルヒネの鎮痛効果に対する耐性はかなり急速に発達します。 耐性の発現メカニズムに関しては、次のようないくつかの仮説があります。 リン酸化(オピオイド受容体のリン酸残基(H2PO3-)の分子への組み込み(受容体の構造を変化させる)) G からの受容体の機能的分離-タンパク質(受容体感受性の喪失につながる)、ミューオピオイド受容体の内部移行(リガンド結合後、多くの受容体はエンドサイトーシスによって細胞内に引き戻される)および/または受容体の枯渇(モルヒネが作用できる利用可能な受容体の数の減少)これらのプロセスの詳細な議論については、Koch と Holt の論文「コレシストキニン (十二指腸粘膜および近位空腸の I 細胞によって産生される神経ペプチド ホルモン) は、オピオイド耐性に影響を与えることによっていくつかの拮抗経路を媒介する可能性がある」を参照してください。 コレシストキニンの拮抗薬(すなわち、プログルミド)は、モルヒネに対する耐性の発現を遅らせることができます。
依存症の発症と離脱症候群
モルヒネの使用中止は、オピオイドの離脱を伴う古典的な離脱症候群の発症と関連していますが、バルビツール酸系薬剤、ベンゾジアゼピン、アルコール、睡眠薬の離脱を伴う離脱症候群とは異なり、それ自体は致命的ではありません(患者について話している場合)。健康な神経系を持ち、心臓や肺に問題がないこと)。 モルヒネや他のオピオイドの離脱後の離脱症候群は、いくつかの段階を経ます。 他のオピオイドの離脱後の離脱症状は、強さと期間が異なります。 弱オピオイドおよび混合アゴニスト-アンタゴニスト薬は、短期的かつ軽度の離脱症状を引き起こす可能性があります。 したがって、離脱症候群の段階は次のとおりです。
ステージ I、最後の服用から 6 ~ 14 時間後: 再びハイになりたいという欲求、落ち着きのなさ、イライラ、発汗、不快感
ステージ II、最後の投与から 14 ~ 18 時間後: あくび、ひどい発汗、軽度の憂鬱、流涙、泣き声、うめき声、鼻漏 (鼻からの水っぽい粘液の大量の排出)、不快感、上記の症状の激化、トランス状態覚醒状態
ステージ III、投与後 16 ~ 24 時間: 鼻漏、上記症状の悪化、瞳孔散大、立毛 (「鳥肌」)、筋肉のけいれん、ほてり、寒さ、骨と筋肉の痛み、食欲不振、側臥位の発症胃腸管の痛み
ステージ IV、投与後 24 ~ 36 時間:上記の症状すべての悪化(重度のけいれんや脚の不随意運動、むずむず脚症候群など)、軟便、不眠症、血圧上昇、体温のわずかな上昇、呼吸数の増加吸気量、頻脈(心拍数の増加)、落ち着きのなさ、吐き気
ステージ V、投与後 36 ~ 72 時間: 上記症状の悪化、胎児の姿勢で横たわる、嘔吐、頻繁な軟便、体重減少 (24 時間で 2 ~ 5 kg)、白血球の増加、その他の血液の変化
ステージ VI、上記の症状の後: 食欲の回復と腸機能の正常化、初期症状および慢性症状への移行の始まり。これらの症状は主に精神的なものですが、痛みに対する過敏性の増加、血圧の上昇、大腸炎またはその他の問題が含まれる場合もあります。胃腸管の可動性と体重管理の問題
離脱症候群の後期段階で、一部の患者は膵炎を患っていることが判明しましたが、これはおそらくオッディ括約筋のけいれんによるものと考えられます。 モルヒネ中毒者に見られる離脱症候群は、通常、投与と投与の間の一定期間(6~12時間)続きます。 初期症状としては、涙目、不眠症、下痢、鼻漏、あくび、気分不快、発汗などがあり、場合によっては服用を繰り返したいという抑えがたい衝動に駆られることもあります。 この症候群が進行するにつれて、重度の頭痛、落ち着きのなさ、神経過敏、食欲不振、体の痛み、腹部の激しい痛み、吐き気と嘔吐、震え、そして薬物に対するさらに強い渇望が観察されます。 重度のうつ病や嘔吐がよく見られます。 急性離脱症候群では、収縮期および拡張期の血圧と脈拍が上昇し、心臓発作、血液凝固、脳卒中のリスクと関連している可能性があります。 その他の特徴的な症状には、鳥肌を伴う悪寒、発熱、脚の制御不能な動き、過度の発汗などがあります。 背中や手足の骨や筋肉に激しい痛みや筋肉のけいれんが起こることもあります。 離脱症状がある間は、症状を軽減するために適切な薬を服用するのが合理的かもしれません。 離脱症状は最後の服用から 48 ~ 96 時間後に最も重くなり、8 ~ 12 日間かけて徐々に治まります。 強い依存症を発症した使用者がモルヒネを突然中止すると、非常にまれなケースですが、死に至る可能性があります。 モルヒネ離脱後の禁欲症候群は、アルコール、バルビツール酸塩、またはベンゾジアゼピン離脱後よりも危険性が低いと考えられています。 モルヒネへの心理的依存は、複雑かつ段階的に進行します。 モルヒネへの身体的必要性がなくなった後も長い間、中毒者はモルヒネや他の物質を使った経験について考えたり話し続けたり、シラフの間も奇妙に感じたりします。 モルヒネ離脱後の精神的離脱は通常、非常に長く苦痛を伴うプロセスです。 多くの場合、被害者はうつ病、不安、不眠症、気分の変動、健忘症、混乱、被害妄想、その他の症状を経験します。 介入がなければ、心理的依存を含む重度の身体症状のほとんどは 7 ~ 10 日以内に消えます。 しかし、虐待に関連する物理的環境や行動要因を変えなければ、再発の危険性が高くなります。 モルヒネの強力な相加的性質を示す指標は再発率です。 モルヒネ (ヘロイン) 中毒者の再発率は、薬物使用者の中で最も高い (約 98%)。
過剰摂取
重度の過剰摂取は、直ちに医師の診察を受けないと、呼吸抑制の結果、窒息や死亡を引き起こす可能性があります。 過剰摂取の治療にはナロキソンの使用が含まれます。 この薬はモルヒネの作用を完全にブロックしますが、アヘン依存症の人に禁欲症候群の即時発症を引き起こします。 複数回の投与が必要な場合があります。 モルヒネの最小致死量は 200 mg ですが、60 mg の物質が突然死に関連した過敏症の症例が報告されています。 依存性(および耐性)が強いと、1 日あたり 2000 ~ 3000 mg のような高用量でも耐えることができます。
薬力学
内因性オピオイドには、エンドルフィン、エンケファリン、ダイノルフィン、およびモルヒネ自体が含まれます。 モルヒネはエンドルフィンの作用を模倣します。 エンドルフィン(正式名 - 内因性モルヒネ)は、鎮痛(痛みの軽減)、入眠、快感などの作用を担っています。 これらは、痛み、激しい運動、オーガズム、興奮などの刺激に反応して放出されます。 モルヒネはプロトタイプの薬剤であり、他のすべてのオピオイドと比較される標準的な薬剤です。 それは主にオピオイド受容体のμ-δヘテロマーと相互作用します。 μ結合部位はヒトの脳内に点在しており、後小脳扁桃、視床下部、視床、尾状核、被殻、および一部の皮質野に最も密度が高くなります。 それらは、脊髄のプレート I および II (ゼラチン状物質) および第 5 脳神経の椎骨核の一次求心性神経の末端軸索にも見られます。 モルヒネはフェナントレンオピオイド受容体アゴニストです。 その主な作用は、中枢神経系のμ-オピオイド受容体に結合して活性化することです。 臨床研究では、モルヒネは中枢神経系と胃腸管で主な薬理活性を発揮します。 その主な有益な治療作用は、鎮痛と鎮静に関連しています。 ミューオピオイド受容体の活性化は、鎮痛、鎮静、多幸感、身体依存、呼吸抑制と関連しています。 モルヒネは、ミューオピオイド受容体に非常に強く結合する速効性の薬であり、このため、同等の用量の他のオピオイドと比較した場合、多幸感/不快感、呼吸抑制、鎮静、かゆみ、耐性、身体的および心理的依存を引き起こします。 モルヒネは、κ-オピオイドおよびδ-オピオイド受容体アゴニストでもあります。 κ-オピオイド受容体に対する影響は、脊髄鎮痛、瞳孔収縮、および精神異常作用に関連しています。 δ-オピオイド効果は鎮痛に役割を果たします。 モルヒネはσ受容体に結合しませんが、(+)-ペンタゾシンなどのσアゴニストはモルヒネ誘発性鎮痛を阻害し、σアンタゴニストは鎮痛を増強することが示されており、σオピオイド受容体がモルヒネの作用に関与していることが示唆されています。 モルヒネの効果は、ナロキソンやナルトレキソンなどのオピオイド拮抗薬によって阻害されることがあります。 モルヒネ耐性の発現は、ケタミンやデキストロメトルファンなどの NMDA アンタゴニストによって抑制できます。 モルヒネと化学的に異なるオピオイドを長期間交互に使用すると、耐性の発現を長期間にわたって軽減できます。 これは、レボルファノール、ケトベミドン、ピリトラミド、メサドンなどのモルヒネとの交差耐性が不完全な物質とその誘導体に特に当てはまります。 これらの物質はすべて NMDA アンタゴニストでもあります。 モルヒネとの交差耐性が最も不完全であるが、最も強力なオピオイドは、メサドンまたはデキストロモラミドであると考えられています。
遺伝子発現
研究では、モルヒネが多くの遺伝子の発現を変化させる可能性があることが示されています。 モルヒネを 1 回注射すると、ミトコンドリア呼吸に関与するタンパク質と細胞骨格に関連するタンパク質という 2 つの主要な遺伝子グループの発現が変化します。
免疫システムへの影響
モルヒネがCNSの細胞上に発現する受容体に作用し、鎮痛と鎮痛をもたらすことが長い間知られていました。 1970 年代と 80 年代に、オピオイドに依存している人は感染症 (肺炎、結核、HIV/AIDS など) を発症するリスクが高いという証拠が明らかになり、モルヒネが免疫系に影響を与えるという理論の発展につながりました。 これにより、モルヒネへの長期曝露が免疫系に及ぼす影響に関する研究が増加しました。 この方向への最初のステップは、CNS の細胞で発現されるオピオイド受容体が免疫系の細胞でも発現されるという確立でした。 ある研究では、自然免疫系の一部である樹状細胞がオピオイド受容体を持っていることが示されました。 樹状細胞はサイトカインの生成を担当し、サイトカインは免疫系のメッセージを担当します。 同じ研究では、分化中にモルヒネで長時間処理された樹状細胞は、T細胞(適応細胞の別の細胞)の増殖、成長、分化に関与するサイトカインであるインターロイキン-12(IL-12)をより多く産生することを示しました。 B 細胞の免疫応答の駆動に関与するサイトカインであるインターロイキン 10 (IL-10) が減少します (B 細胞は感染と戦うために抗体を産生します)。 このサイトカインの制御は、p38 MAPK (マイトジェン活性化プロテインキナーゼ) 依存性経路を介して媒介されます。 通常、p38 は樹状細胞内で TLR 4 (Toll 様受容体 4) を発現し、LPS (リポ多糖) リガンドを介して活性化されます。 これにより、p38 MAPK のリン酸化が誘導されます。 このリン酸化により p38 MAPK が活性化され、IL-10 および IL-12 の産生が促進されます。 樹状細胞の分化中およびその後の LPS 処理中に樹状細胞がモルヒネに長期間曝露されると、サイトカインの産生が変化します。 モルヒネに曝露されると、p38 MAPK は IL-10 を生成せず、代わりに IL-12 を優先します。 あるサイトカインが好まれる正確なメカニズムは不明です。 モルヒネが p38 MAPK のリン酸化を増加させる可能性が高くなります。 IL-10とIL-12の間の転写レベルでの相互作用は、IL-10が生成されない間にIL-12の生成をさらに増加させる可能性があります。 IL-12 の産生の増加は、T 細胞の免疫応答の増加を引き起こします。 免疫系に対するモルヒネの影響に関するさらなる研究により、モルヒネが好中球とサイトカインの産生を誘導することが示されました。 サイトカインは部分的には即時免疫反応(炎症)として生成されるため、サイトカインが痛みを引き起こす可能性があるという仮説が立てられています。 したがって、サイトカインは鎮痛薬開発の論理的な標的となる可能性があります。 最近の研究では、動物の短期免疫反応に対するモルヒネの影響が評価されました。 後足を解剖した後、疼痛閾値とサイトカイン産生を測定した。 通常、負傷すると、感染を抑制し、治癒(および場合によっては痛み)を制御するために、患部およびその周囲のサイトカイン産生が増加しますが、後肢の切開前に0.1〜10.0 mg/kgのモルヒネを投与すると、傷の周囲のサイトカインが減少しました。用量依存的な方法です。 著者らは、受傷後のモルヒネ使用は感染症に対する抵抗力を低下させ、創傷治癒に悪影響を与える可能性があると仮説を立てた。
薬物動態
吸収と代謝
モルヒネは、経口、舌下(舌の下)、頬(頬の後ろ)、直腸、皮下、静脈内、鼻腔、くも膜下腔内(脊髄のくも膜下腔)、硬膜外(脊椎の硬膜外腔)に使用できます。カテーテルを通して)、または吸入器を通して吸入します。 街中では吸入することがほとんどですが、医療機関ではモルヒネを静脈内投与します。 モルヒネは広範な初回通過代謝を受けるため(ほとんどが肝臓で分解される)、経口摂取した場合、CNS に到達するのは用量の 40 ~ 50% のみです。 皮下、筋肉内および静脈内投与後に観察される血漿レベルはほぼ同じです。 筋肉内または皮下投与後、モルヒネの血漿レベルは約20分後にピーク値に達し、経口投与後は30分後にピーク値に達します。 モルヒネは主に肝臓で代謝され、モルヒネ用量の約 87% が投与後 72 時間以内に尿中に排泄されます。 モルヒネは、第二相酵素 UDP-グルクロノシルトランスフェラーゼ -2B7 (UGT2B7) によるグルクロン酸抱合を介して、モルヒネ-3-グルクロニド (M3G) およびモルヒネ-6-グルクロニド (M6G) に代謝されます。 モルヒネの約 60% が M3G に変換され、6 ~ 10% が M6G に変換されます。 代謝は肝臓だけでなく、脳や腎臓でも起こります。 M3G はオピオイド受容体に結合しないため、鎮痛効果はありません。 M6G は、μ 受容体に結合し、モルヒネの半分の強力な鎮痛剤 (ヒトの場合) です。 モルヒネは、少量のノルモルヒネ、コデイン、ヒドロモルホンに代謝されることもあります。 代謝率は、年齢、食事、遺伝子構造、病気の有無、他の薬剤の使用によって異なります。 モルヒネの半減期は約120分ですが、男性と女性で若干の違いがある場合があります。 モルヒネは脂肪組織に貯蔵されるため、死後も体内で検出可能です。 モルヒネは血液脳関門を通過できますが、その低い脂溶性、タンパク質結合、急速なグルクロン酸結合、およびイオン化のため、この関門を通過するのは容易ではありません。 モルヒネの誘導体であるジアセチルモルヒネは、血液脳関門をより容易に通過できるため、より強力な薬になります。 モルヒネよりも実質的に持続時間が長く、1 日 1 回だけ使用できる、モルヒネの徐放性経口製剤もあります。
体液中の検出
モルヒネとその主要な代謝産物であるモルヒネ-2-グルクロニドおよびモルヒネ-6-グルクロニドは、免疫測定法によって血液、血漿、毛髪、尿から検出できます。 クロマトグラフィーを使用すると、各物質を個別に検査できます。 一部の試験手順では、イムノアッセイの前に代謝物がモルヒネに加水分解されます。これは、別に公表された結果でモルヒネのレベルを比較するときに考慮する必要があります。 モルヒネは固相抽出を使用して全血から単離でき、液体クロマトグラフィー質量分析技術を使用して検出できます。 コデインまたはケシの実を含む食品を摂取すると、偽陽性の結果が生じる可能性があります。 1999 年の分析では、比較的少量のヘロイン (すぐにモルヒネに代謝される) は、使用後 1 ~ 1.5 日以内の標準尿検査で検出可能であることが示されました。 2009 年の分析では、分析対象物がモルヒネで検出限界が 1 ng/mL の場合、静脈内投与量 20 mg のモルヒネが 12 ~ 24 時間以内に検出可能であることが示されました。 検出限界は 0.6 ng/ml で、同様の性能を示します。
天然資源
モルヒネは、アヘンに含まれる最も豊富なアヘン剤であり、アヘン用ケシ (Papaver somniferum) の未熟な莢がわずかに切られたときに放出される乾燥した乳状の樹液です。 モルヒネは植物で発見された最初の活性麻薬であり、アヘン、ケシわら濃縮物、およびその他のケシ誘導体に含まれる少なくとも 50 種類のアルカロイドのうちの 1 つです。 モルヒネはアヘンの乾燥重量の 8 ~ 14% を占めますが、特別に栽培されたいくつかの品種には最大 26% のモルヒネが含まれるか、逆に最小限の量 (1% 未満、つまり約 0.04%) が含まれます。 モルヒネに乏しい品種(Przemko および Norman)は、テバインやオリパビンなどの他のアルカロイドの生産に使用され、それらはさらに、オキシコドンやエトルフィンなどの半合成および合成オピオイドやその他の物質の生産に使用されます。 P. bracteatum には、モルヒネ、コデイン、その他のフェナントレン型麻薬性アルカロイドは含まれません。 この種はテバインの優れた供給源です。 モルヒネの含有量は、他の種(キンポウゲ科、ケシ科)、および一部の種類のホップや桑では確認されていません。 モルヒネは主に植物のライフサイクルの初期に生成されます。 植物内のさまざまなプロセスは、コデイン、テバイン、そして場合によっては少量のヒドロモルホン、ジヒドロモルヒネ、ジヒドロコデイン、テトラヒドロテバイン、およびヒドロコドンの生成に寄与します (これらの化合物は多くの場合、テバインとオリパビンから合成されます)。 人体はエンドルフィンを生成します。エンドルフィンは、神経伝達物質として作用し、モルヒネ様の効果を示す内因性オピオイドペプチドです。
化学
モルヒネは、さらに 2 つの閉環を持つベンジルイソキノリン アルカロイドです。 彼は次のことを持っています:
違法モルヒネの多くは、メチル化によってコデインを生成するために使用されます。 また、ヘロイン (3,6-ジアセチルモルヒネ)、ヒドロモルホン (ジヒドロモルヒノン)、オキシモルホン (14-ヒドロキシジヒドロモルヒノン) など、多くの薬物の製造の前駆体でもあります。 多くのモルヒネ誘導体は、出発物質としてテバインおよび/またはコデインを使用して製造できます。 モルヒネの N-メチル基を N-フェニルエチル基に置き換えると、モルヒネより 18 倍強力な物質が生成されます (アヘン剤作動作用に関して)。 この修飾と 6-ヒドロキシル基の 6-メチレン基への置換を組み合わせると、モルヒネの 1.443 倍強力であり、いくつかの測定ではエトルフィン (Immobileon® 精神安定剤 M99) などのベントレーのオピオイドよりも強力な化合物が作成されます。 )。 モルヒネの構造と活性の関係はよく研究されています。 この分子の研究と使用の結果、19 世紀後半以降、250 を超えるモルヒネ誘導体 (コデインを含む) が発見されました。 これらの薬物は、コデインの約 25% (またはモルヒネの 2% をわずかに上回る) からモルヒネの数千倍のレベルの鎮痛能力を示します。 最も強力なオピオイド拮抗薬は、ナロキソン (Narcan®)、ナルトレキソン (Trexan®)、ジプレノルフィン (M5050、Immobileon® の効果を逆転させる薬)、およびナロルフィン (Nalline®) です。 いくつかのオピオイドアゴニスト-アンタゴニスト、部分アゴニスト、および逆アゴニストもモルヒネから生成されています。 これらの半合成モルヒネ誘導体の受容体活性化プロファイルは大幅に異なります。 アポモルヒネなどの誘導体の中には、麻薬効果をまったく示さないものもあります。 モルヒネ化合物 (レボルファノール、デキストルファン、ラセミ体の「親」化合物であるドロモラン) など、より遠い誘導体の一部とは異なり、モルヒネとその誘導体のほとんどは光学異性を示しません。 アゴニスト-アンタゴニスト物質もモルヒネから合成されています。 モルヒネの構造要素は、モルヒネファミリーの薬物 (レボルファノール、デキストロメトルファンなど) などの完全合成薬物の作成に使用されています。 他のグループの薬物には、モルヒネのような性質を持つ多くの物質が含まれています。 モルヒネと上記の合成物質の修飾により、催吐剤、興奮剤、鎮咳剤、咳止め剤、筋弛緩剤、局所麻酔剤、全身麻酔剤、その他の薬物など、異なる作用機序を持つ非麻薬性薬物の合成が可能になりました。 モルヒネとコデインの両方のほとんどの半合成オピオイドは、上記の要素の 1 つ以上を変更することによって作成されます。
モルヒネの炭素骨格の 1 位および/または 2 位でのハロゲン化またはその他の修飾。
モルヒネをコデインに変換するメチル基の除去または復帰、またはメチル基を別の官能基(エチルまたはその他)で置換してモルヒネ由来薬物からコデイン類似体を生成する、またはその逆。 モルヒネベースのコデイン類似体は、コデインとモルヒネ、ヒドロコドンとヒドロモルホン、オキシコドンとオキシモルホン、ニココデインとニコモルヒネ、ジヒドロコデインとジヒドロモルヒネなど、より強力な薬物のプロドラッグとしてよく使用されます。
7 位と 8 位の間の関係における飽和、開口、またはその他の変化、ならびにこれらの位置での官能基の追加、除去、または修飾。 結合7-8の飽和、還元、除去または他の修飾、およびヒドロモルフィノールへの官能基の付加; ヒドロキシル基がカルボニル基に酸化され、7-8 二重結合が単一結合に変化すると、コデインがオキシコドンに変換されます。
3 位および/または 6 位の官能基の追加、除去、または修飾 (ジヒドロコデインおよび関連物質、ならびにヒドロコドンおよびニコモルヒネ); メチル官能基が 3 位から 6 位に移動すると、コデインは 72 倍強力なヘテロコデインになり、したがってモルヒネの 6 倍強力になります。
14位での官能基の追加またはその他の修飾(オキシモルホン、オキシコドン、ナロキソン)
2、4、5、または 17 位の修飾。通常はモルヒネ分子の他の変更を伴います。 これは通常、触媒還元、水素化、酸化、および同様の反応によって生成される薬物を使用して行われ、強力なモルヒネおよびコデイン誘導体が生成されます。
モルヒネとその水和物である C17H19NO3H2O はどちらも水に溶けにくいです。 5リットルの水に1グラムの水和物しか溶けません。 このため、製薬会社はこの薬剤から硫酸塩と塩酸塩を製造しますが、これは親分子よりも水に 300 倍溶けます。 飽和モルヒネの pH は 8.5 ですが、塩は酸性です。 これらは強酸ではあるが弱塩基の誘導体であるため、どちらも pH は 5 です。 その結果、注射用としてモルヒネ塩は少量の NaOH と混合されます。 多数のモルヒネ塩が使用されており、塩酸塩、硫酸塩、酒石酸塩、クエン酸塩が臨床で最も一般的に使用されています。 あまり一般的ではありませんが、メト臭化物、臭化水素酸塩、ヨウ化水素酸塩、乳酸塩、塩化物、酒石酸水素塩、および以下に挙げるその他の物質は使用されません。 ヘロインとしても知られる二酢酸モルヒネは、米国ではスケジュール I 規制物質であり、このため医療には使用されていません。 英国、カナダおよび一部のヨーロッパ諸国では、この物質は認可されています。 英国では、ヘロインが広く使用されています(塩酸塩の使用に匹敵します)。 メコン酸モルヒネはケシに含まれるアルカロイドの主な形態であり、これに加えてペクチン酸モルヒネ、硝酸塩、硫酸塩などの物質が含まれています。 コデイン、ジヒドロコデイン、その他のオピオイド、特に古いオピオイドと同様に、一部の製造業者は、他の物質と容易に混合するサリチル酸エステルとしてモルヒネを使用し、オピオイドや NSAID の治療効果を活用できるようにしています。 吉草酸モルヒネ(この酸の塩はバレリアンの有効成分です)など、モルヒネのさまざまなバルビュレート塩も過去に使用されてきました。 モルヒネ酸カルシウムはモルヒネ製造の中間体ですが、モルヒネ酸ナトリウムはあまり一般的には使用されません。 アスコルビン酸モルヒネ、およびタンニン酸塩、クエン酸塩、酢酸塩、リン酸塩、吉草酸塩などの他の塩が、製造方法に応じてマカ中に存在する可能性があります。 商業的に生産された吉草酸モルヒネは、何年も前にヨーロッパや他の国々で普及した経口および非経口薬であるトリバリン(同名の漢方薬と混同しないでください)の成分として使用されていましたが、これには吉草酸カフェインやコカインも含まれていました。 4番目の成分として吉草酸コデインを含むバージョンは、ブランド名テトラバリンで販売されています。 モルヒネと密接に関係しているのは、現在は使用されていない医薬品物質であるオピオイドのモルヒネ-N-オキシド(ゲノモルヒネ)と、モルヒネの分解生成物として形成されるアヘンアルカロイドであるシュードモルヒネです。
モルヒネの合成
生合成
モルヒネはテトラヒドロイソキノリンレチクリンから生合成されます。 サルタリジン、テバイン、オピバリンに変換されます。 このプロセスに関与する酵素には、サルタリジンシンターゼ、サルタリジン:NADP 7-オキシドレダクターゼ、およびコデイノンレダクターゼが含まれます。
化学合成
マーシャル D. ゲイツ ジュニアによって開発されたモルヒネの最初の完全な合成。 1952 年に使用され、今日広く使用されています。 他のいくつかの合成方法は、Rice、Evans、Fook、Parker、Overman、Mulser-Trauner、White、Taber、Trost、Fukiyama、Gillow、および Stork の研究グループによって開発されました。
生産
アヘンケシアルカロイドはメコン酸に関連しています。 製造方法は、メコン酸よりも強い酸ですが、アルカロイド分子と反応するほど強力ではない希硫酸を使用して、破砕された植物から抽出されます。 抽出は数段階で行われます(粉砕された植物の一部を6〜10回抽出するため、ほぼすべてのアルカロイドが溶液中に存在します)。 抽出の最終段階で得られた溶液から、水酸化アンモニウムまたは炭酸ナトリウムを使用してアルカロイドを沈殿させます。 最後のステップは、モルヒネを精製し、他のアヘンアルカロイドから分離することです。 第二次世界大戦中のイギリスでは、グレゴリー法と呼ばれる同様の合成法が開発されました。この方法では、植物全体(ほとんどの場合根と葉は保存したまま)を弱酸性の水で煮込むことから始まり、次に濃縮の段階が続きます。 、アルカロイドの抽出と精製。 ケシわら(生のさやや茎)を処理する他の方法では、1 つ以上の種類のアルコールまたはその他の有機溶媒を使用した蒸発が使用されます。 ケシのわらは主にヨーロッパ大陸とイギリス連邦の州で使用され、ケシの乳白色のジュースはインドで最もよく使用されます。 乳白色の樹液法を使用する場合、この目的のために特別に設計されたリミッターを備えた 2 ~ 5 枚刃のナイフを使用して、未熟なさやに垂直または水平の切り込みが行われ、1 mm の深さまで切ることができます。 切開は5回まで可能です。 過去には、乳白色のジュースを使用する代替方法が中国で使用されていました。 これらの方法には、ケシの頭を切り落とし、そこに大きな針を通し、24〜48時間後に乾燥したジュースを収集することが含まれていました。 インドでは、アヘンは認可を受けた農家によって農場で栽培されています。 政府の特別センターで一定レベルまで乾燥させた後、アヘンからモルヒネを抽出する製薬会社に販売する。 トルコとタスマニアでは、「アヘンストロー」と呼ばれる、丸ごと乾燥させた成熟した茎のあるさやを栽培し、加工することによってモルヒネが生産されます。 トルコでは水抽出プロセスが使用され、タスマニアでは溶媒抽出プロセスが使用されます。 アヘン用ケシには少なくとも 50 種類のアルカロイドが含まれていますが、そのほとんどは非常に低濃度で存在します。 モルヒネは生のアヘンに含まれる主要なアルカロイドで、アヘンの乾燥重量の約 8 ~ 19% を占めます (生育条件によって異なります)。 特別に栽培されたケシの中には、重量比で最大 26% のアヘンが含まれているものもあります。 砕いたケシわらのモルヒネ含有量の非常に大まかな推定値は、乳状樹液法の製造で予想されるパーセンテージを 8 で割るか、または経験的に決定された 5 ~ 15 の数値で割ることによって得られます。 ノルマン品種 P. somniferum同じくタスマニアで開発され、0.04%未満のモルヒネを生成しますが、より多量のテバインとオリパビンを生成します。これらは、半合成オピオイドや、興奮剤、催吐剤、オピオイド拮抗薬、抗コリン薬、平滑筋薬などの他の薬物の合成にも使用できます。 。 1950 年代から 1960 年代にかけて、ハンガリーは医療で使用されるすべてのモルヒネ製品のほぼ 60% を供給しました。 現在、ハンガリーではケシ栽培が合法ですが、ケシ畑の面積は法律で 2 エーカー (8,100 平方メートル) に制限されています。 乾燥したケシを装飾目的で花屋で販売することは合法です。 1973年、米国国立衛生研究所のチームがコールタールを出発原料としてモルヒネ、コデイン、テバインを完全合成する方法を開発したと発表された。 研究の最初の目的は、コデイン-ヒドロコドンクラスの咳止め薬の発明でした(これは、コデインやテバインだけでなく、モルヒネからもいくつかの段階で製造できます)。 世界中で医薬品用途に生産されているモルヒネの多くは、生のアヘンやケシわらに含まれるコデインの濃度がモルヒネの濃度よりもはるかに低いため、コデインに変換できます。 世界のほとんどの地域では、コデインの使用 (最終生成物および前駆体としての両方) がモルヒネの使用と同じくらい広く普及しています。
他のオピオイド生成の前駆体
医薬品
モルヒネは、ジヒドロモルヒネ、ヒドロモルホン、ヒドロコドン、オキシコドンなどの多くのオピオイドや、それ自体に多数の半合成誘導体を持つコデインの生成の前駆体です。 モルヒネは無水アセチルで処理され、燃やされてヘロインが製造されることがよくあります。 ヨーロッパの医師らは、メサドンとブプレノルフィンの副作用に耐えられない患者に対する代替療法として、徐放性モルヒネの経口使用の必要性をますます認識しつつある。 徐放性経口モルヒネは、オーストリア、ブルガリア、スロバキアでアヘン剤維持療法として長年にわたって広く使用されてきました。 英国を含む他の国でも使用されていますが、規模は小さいです。 徐放性モルヒネは、ブプレノルフィンの効果を模倣するのに十分な時間作用し、一定の血中濃度を維持し、ピークや知覚できる高値はありませんが、離脱症状はありません。 さらに、徐放性経口投与モルヒネは、ブプレノルフィンやメサドンの不自然な薬理作用により副作用に敏感なアヘン剤依存患者にとって有望な治療法です。 ヘロインとモルヒネの薬理はほぼ同じですが、ヘロイン分子には 2 つのアセチル基があるため、脂溶性が高まり、注射時に血液脳関門を通過して脳に到達する可能性が高くなります。 脳に到達すると、これらのアセチル基が除去され、物質はモルヒネに変換されます。 したがって、ヘロインはモルヒネの即効性のある形態と見なすことができます。
違法な製造および使用
モルヒネはいくつかの方法で違法に製造されています。 ごくまれに、咳止め薬や処方鎮痛剤に含まれるコデインがこのプロセスで使用されます。 このジメチル化反応は、多くの場合、ピリジンと塩酸を使用して進行します。 違法に製造されたモルヒネのもう 1 つの供給源は、MS-コンチンなどの徐放性モルヒネです。 簡単な抽出によってこれらの製品からモルヒネを分離することができ、注射用途に適したモルヒネ溶液が得られます。 この投与経路の代替として、モルヒネ錠剤を粉末に砕いて鼻から吸入したり、水と混合して注射したり、単に飲み込んだりすることができます。 ただし、この使用法では、ユーザーは完全な幸福感を体験することはできませんが、効果はより長く持続します。 MS-コンチン製剤は、徐放性があるため、一部の国では、メサドン、ジヒドロコデイン、ブプレノルフィン、ジヒドロエトルフィン、ピリトラミド、レボ-アルファ-アセチルメタドール (LAAM) および特別なヒドロモルホン製剤とともに使用されており、維持療法として 24 時間作用し、オピオイドに身体的に依存している患者の解毒。 さらに、さまざまな化学反応を通じて、モルヒネはヘロインまたは別のより強力なオピオイドに変換されます。 特殊な技術 (元の前駆体がコデインである場合) を使用すると、モルヒネは、モルヒネ、ヘロイン、3-モノアセチルモルヒネ、6-モノアセチルモルヒネ、およびアセチルコデインなどのコデイン誘導体の混合物に変換できます。 ヘロインは一連のモルヒネ 3,6 ジエステルの 1 つであるため、モルヒネは、適切な酸無水物を使用して、無水ニコチン酸、無水プロピオン酸を使用したジプロパノイルモルヒネ、ジブタノイルモルヒネ、およびジサリチロイルモルホンを使用してニコモルヒネ (ビラン) に変換できます。 6-モノアセチルモルヒネ、ナイアシン(ビタミンB3)を多く含む物質を得るには、結晶酢酸を使用できます。
話
アヘンをベースにしたエリクサーの作成はビザンチン時代の錬金術師によるものと考えられていますが、オスマン帝国のコンスタンティノープル (イスタンブール) の征服中に、正確な処方は失われてしまいました。 1522年頃、パラケルススはアヘンをベースにした万能薬について書き、それをアヘンチンキ(ラテン語で「賞賛」を意味するlaudareから)と呼んだ。 同氏はこの治療法を鎮痛剤の可能性があると説明したが、適度に使用することを推奨した。 18 世紀後半、東インド会社がインド全土でアヘンの取引を開始すると、アヘンチンキと呼ばれる別のアヘン剤が医師と患者の間で人気を集めました。 フリードリヒ・セルトゥルナーは、1804 年 12 月にドイツのパーダーボルンでアヘンから分離された最初の活性アルカロイドとしてモルヒネを発見しました。 1817 年、サーターナー アンド カンパニーはこの薬を鎮痛剤として、またアルコールとアヘン中毒の治療薬として販売しました。 1827 年、ドイツのダルムシュタットの薬局でモルヒネの商業販売が始まりました。 この薬局は、主にモルヒネの販売のおかげで、後に製薬大手メルクに発展しました。 モルヒネはアルコールやアヘンよりもはるかに依存性が高いことが後に判明しました。 アメリカ南北戦争中にモルヒネが大量に使用されたため、いわゆる「兵士の病気」、つまりモルヒネ中毒が40万人以上発生しました。 このような病気の存在自体が捏造されたものであるという仮定があったため、この考えは論争の対象となった。 「兵士の病気」という言葉が初めて文書に記録されたのは 1915 年です。 ジアセチルモルヒネ(ヘロインとしても知られる)は、1874 年にモルヒネから合成されました。 1898 年にバイエルによって市場に導入されました。 ヘロインは、重量ベースでモルヒネの約 1.5 ~ 2 倍の効力を持っています。 ヘロインは脂溶性の性質があるため、モルヒネよりも早く血液脳関門を通過する可能性があり、中毒の可能性が大幅に高まります。 ある研究では、さまざまな主観的および客観的な方法を使用して、モルヒネに対するヘロインの相対効力(元中毒者に静脈内投与した場合)は、塩酸ジアモルヒネ(ヘロイン)1 mgあたり硫酸モルヒネ1.80~2.66 mgでした。 1914年に米国でハリソン麻薬税法が可決され、モルヒネが規制薬物となり、処方箋なしで所持することは犯罪となる。 ヘロインが初めて合成されるまでは、モルヒネが世界で最も人気のある麻薬性鎮痛剤でした。 一般的に言えば、ジヒドロモルヒネ (1900 年頃)、オピオイドのジヒドロモルヒノン クラス (1920 年代)、オキシコドン (1916 年) および類似の薬物が合成されるまでは、アヘン、モルヒネと有効性において比較できる薬物は世界中に存在しませんでした。そしてヘロイン(1937年にドイツで合成されたペチジンなどの最初の合成オピオイドは、数年後まで発明されなかった)。 ジヒドロコデイン (パラコディン)、エチルモルヒネ (ジオニン)、ベンジルモルヒネ (ペロニン) などのコデイン類似体および誘導体は、半合成オピオイドアゴニストでした。 今日でも、ヘロイン中毒者は他のすべてのオピオイドよりもモルヒネを好みます(ヘロインを入手できない場合)。 特定の条件下(利用可能なモルヒネが不足している場合)では、ヒドロモルホン、オキシモルホン、高用量のオキシコドンまたはメタドン(オーストラリアの 1970 年代のように)が手のひらを共有します。 ヘロイン中毒者が離脱症状を緩和するために最も一般的に使用されている「暫定措置」は、コデインのほか、ジヒドロコデイン、ケシの実やケシの実茶などのケシわら誘導体、プロポキシフェン、トラマドールなどである。 モルヒネの構造式は、1925 年にロバート ロビンソンによって決定されました。 コールタールや石油留出物などの材料からモルヒネを完全に合成する方法は少なくとも 3 つ特許を取得しており、最初の方法は 1952 年にマーシャル D. ゲイツ ジュニア博士によって記載されました。 ロチェスター大学で。 それにもかかわらず、ほとんどのモルヒネは依然としてアヘン用ケシから、伝統的な方法(未熟なケシの果実から乳状の汁を採取する)、またはケシのわら、乾燥した種子、植物の茎を使用する方法(最も一般的な方法は 1925 年に発明された)によって得られています。 1930 年にハンガリーの化学者ヤノス・カバイによって記載されました)。 2003年、人体内で生成される内因性モルヒネが発見されました。 このために、科学者たちは 30 年間の論争と推測を費やしました。 人体にはモルヒネのみに反応する受容体、μ3-オピオイド受容体が存在することが知られていました。 微量の内因性モルヒネが、神経芽腫癌細胞に反応して形成されるヒト細胞で発見されています。
社会と文化
法的地位
不正使用
多幸感、ストレスと痛みのあらゆる側面(「苦しみ」)の完全な抑制、共感性と饒舌の増加、身体の快感、不安症状の緩和(抗不安)は、心理的依存を引き起こすことが最も多い効果であり、したがって主な効果です。アヘン剤の過剰摂取の原因であり、投与量がない場合は重度の離脱症候群になります。 モルヒネは、あらゆる種類の薬物の原型として、その特性をすべて備えており、乱用の可能性が高くなります。 薬物に対する社会の態度は、主にモルヒネ中毒に対する社会の態度によって決まります。 動物と人間の研究および臨床データは、モルヒネは地球上で最も多幸感をもたらす物質の 1 つであり、ヘロインはモルヒネを体内に送達するためのプロドラッグであるため、いかなる投与経路 (静脈内以外) によってもモルヒネとヘロインを区別できないという主張を裏付けています。本体。 モルヒネ分子の構造を化学的に修飾すると、ジヒドロモルヒネ、ヒドロモルホン (ディラウディッド、ハイダル)、オキシモルホン (ヌモルファン、オパナ) などの他の多幸感物質、および後者の 3 つのメチル化等価物 (ジヒドロコデイン、ヒドロコドン、オキシコドン) の生成が可能になります。 。 ヘロインに加えて、3,6 モルヒネ エステルのカテゴリには、ジプロパノイルモルヒネ、ジアセチルジヒドロモルヒネ、ニコモルヒネ、デソモルヒネ、ヒドロモルヒノールなどの他の半合成オピオイドなどの他の物質が含まれます。 一般的に、モルヒネの乱用には、医師が処方した量を超える量を摂取すること、または処方箋や医師の監督なしにモルヒネを使用すること、モルヒネ錠剤から注射剤を作成して使用すること、モルヒネをアルコールやコカインなどの物質と混合することなどが含まれます。効果を高める、および/または錠剤を噛んだり粉末に砕いて吸入したり注射したりするなど、徐放性モルヒネの作用機序を破壊する方法の使用。 後者の方法は非常に時間がかかり、伝統的なアヘン喫煙方法と併用されています。 モルヒネは、入手可能な場合には注射用アンプル、純粋な医薬品粉末、溶解可能な錠剤の形で使用されていますが、街頭麻薬として見かけることはほとんどありません。 モルヒネはヘロインの製造に使用されるペーストとしても入手可能で、燻製するか、可溶性塩に変換して注射することができます。 アヘンと同様、ケシのわらにもモルヒネが含まれている可能性があり、その純度はケシ茶の純度から医薬品に近いレベルまであります(最終物質にはモルヒネだけでなく、アヘンに含まれる他の50種類のアルカロイドも含まれています)。
俗語の指定
巷ではモルヒネのことを「M」「シスターモルヒネ」「ビタミンM」「モルフォ」などと呼んでいます。 MS コンチン錠剤は「ミスティー」錠剤と呼ばれ、100 mg の徐放性錠剤は「グレー」錠剤または「ブロックバスター」錠剤と呼ばれます。 「スピードボール」は、いくつかの要素が他の要素を補う物質の混合物です。たとえば、モルヒネは、コカイン、アンフェタミン、メチルフェニデート、または同様の薬物と混合できます。 注射可能な配合薬であるブルーベルベットは、モルヒネと抗ヒスタミン薬トリペレナミド(ピラベンザミン、PBZ、ペラミン)の混合物であり、浣腸として使用されることはあまりありません。 同じ用語は、トリペレナミンとジヒドロコデインの混合物、または経口摂取されるコデイン錠剤またはシロップを指します。 「モーフィア」はモルヒネの古い正式名で、俗語としても使用されます。 運転中のミス・エマはモルヒネを経口投与されている。 ヒドロモルホンの一部の商品名と同様に、汎用錠剤 (経口投与、舌下投与、口腔投与も可能な速溶性皮下注射錠剤) は、「シェイク アンド ベイク」または「シェイク アンド シュート」とも呼ばれます。 モルヒネ(特にジアセチルモルヒネ、つまりヘロイン)は喫煙することができ、この方法は「Chasing The Dragon」(「ドラゴンを追う」)とも呼ばれます。 使用直前にモルヒネをヘロインおよび関連物質に変換する比較的大まかなアセチル化のプロセスは、「AAing」(無水酢酸)または「ホームベーク」(「ホームメイド」)と呼ばれ、最終製品は「ホーム」とも呼ばれます。 「ベイク」または「ブルー ヘロイン」(「マジック ブルー ヘロイン」(ブルー マジック - 100% 純粋なヘロイン)、ブルー モルヒネまたはブルー モルフォンと呼ばれる咳止め薬、または「ブルー ベルベット」と混同しないでください)。
発展途上国におけるモルヒネの入手可能性
モルヒネは安いにもかかわらず、貧しい国の人々はモルヒネを買う余裕がないことがよくあります。 国際麻薬管理委員会(1961 年の条約に基づいて 1964 年に設立され、ECOSOC によって 5 年間選出され個人の資格で活動する 13 人の委員で構成される)によって提供された 2005 年のデータによると、モルヒネの 79% が世界の 6 か国で消費されています。 - オーストラリア、カナダ、フランス、ドイツ、英国、米国。 世界人口の 80% が住むそれほど裕福ではない国々では、モルヒネの消費量はわずか約 6% です。 一部の国ではモルヒネの輸入が事実上禁止されているが、他の国ではこの物質は死に際の激しい痛みを和らげるためにも事実上入手できない。 専門家は、モルヒネが入手できないのは依存症の可能性があるためであると考えています。 しかし、モルヒネのこれらの特性にもかかわらず、多くの西洋の医師は、治療の最後に徐々に用量を減らしてモルヒネを使用できると信じています。
:タグ
使用済み文献のリスト:
硫酸モルヒネ。 米国医療システム薬剤師協会。 $1 $2 を取得しました。 次の日付値を確認します: |accessdate= (ヘルプ)
" 「悲惨な状態」ではありませんが、モルヒネ中毒者は、1 ~ 2 時間モルヒネを絶つとすぐにゆっくりとした死を迎えます。 空気は満足できない、飲み込むことは不可能です。渇望しない細胞は体内にありません...何ですか? それを定義したり説明したりすることはできません。 一言で言えば人間がいない。 彼は休みだ。 死体は動き、憧れ、苦しみます。 彼は何も望まず、モルヒネのことだけを考えています。 モルヒネ! "
モルヒネとは何ですか?
 モルヒネアヘンケシの汁から抽出される物質。 錠剤、アンプル入り溶液、または白色粉末の形で入手可能です。 強力な鎮痛剤として医療目的で使用されます。 その特性のおかげで、それは世界中の麻薬中毒者のお気に入りの物質の1つになっています。 薬物中毒者による物質の使用は、身体に危険な、時には取り返しのつかない結果をもたらす持続的な中毒の発症を引き起こします。
モルヒネアヘンケシの汁から抽出される物質。 錠剤、アンプル入り溶液、または白色粉末の形で入手可能です。 強力な鎮痛剤として医療目的で使用されます。 その特性のおかげで、それは世界中の麻薬中毒者のお気に入りの物質の1つになっています。 薬物中毒者による物質の使用は、身体に危険な、時には取り返しのつかない結果をもたらす持続的な中毒の発症を引き起こします。
 モルヒネの化学式: C 17 H 19 NO 3
モルヒネの化学式: C 17 H 19 NO 3
モルヒネモルヒネの塩酸塩です。 しばしば誤ってモルヒネと呼ばれます。
放出の形態に応じて、モルヒネの使用方法も異なります。経口、筋肉注射、静脈内です。
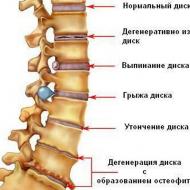
この強力な物質の天然源について話すと、モルヒネおよび他のモルヒネアルカロイドがケシ属、ステファニア属、シノメニウム属、ムーンシード属の植物に含まれていることがわかります。 それほど一般的ではありませんが、クロトン属、コクルス属、トリクリシア属、オコテア属にも見られます。
モルヒネは、ほぼ独占的に、未熟な箱を切断したときに放出される冷凍の乳状のジュース(アヘン)から得られます。 アヘンケシ。 生のアヘン中のモルヒネの含有量は20%、平均で10%に達し、最小濃度は約3%です。 他の種類のケシにはモルヒネがあまり含まれていません。
体への影響:医療におけるモルヒネの使用と使用
 モルヒネを純粋な形で購入するのは非常に困難です。 最も一般的な誘導体は塩酸塩と硫酸塩です。 これらは鎮痛剤および軽度の麻酔薬であり、鎮痛効果と鎮静効果があり、医療で広く使用されています。
モルヒネを純粋な形で購入するのは非常に困難です。 最も一般的な誘導体は塩酸塩と硫酸塩です。 これらは鎮痛剤および軽度の麻酔薬であり、鎮痛効果と鎮静効果があり、医療で広く使用されています。
モルヒネは身体的および心因性の痛みを効果的かつ迅速に軽減するため、さまざまな性質の傷害や、急性および長期の痛みを伴う疾患(心筋梗塞を含む)に対する抗ショック療法として使用されます。
最近では、胃の腫瘍や潰瘍を検査するためにモルヒネが使用されています。 この物質の導入により胃の筋肉の緊張が高まり、粘膜腔へのアクセスが可能になります。
さまざまな症状の激しい痛みを背景に発生する不眠症には、少量のモルヒネが処方されます。 この物質は、神経症、精神障害、アルコール依存症などの他の病気にも効果があります。 この物質は便秘と闘い、腸の運動を正常化するのに役立ちます。 しかし急速に発展している 麻薬中毒これらの目的でのモルヒネの使用は不可能になります。
モルヒネは、他のアヘン類の薬物 (ヘロインなど) と同様、咳反射を抑える鎮咳作用があり、強力な鎮静剤でもあります。
 モルヒネの使用の主な原則は、使用期間が短いことです。 医療目的の場合、この物質は重傷を負った術後の期間に処方されます。
モルヒネの使用の主な原則は、使用期間が短いことです。 医療目的の場合、この物質は重傷を負った術後の期間に処方されます。
使用による影響、副作用、薬物中毒を発症するリスクにもかかわらず、薬局や公の場では、モルヒネをベースにした薬、またはその作用においてその類似薬が販売されています。
- パパベリン;
- コデイン;
- ディオニン;
- オムノポムとか。
錠剤では、モルヒネの含有量は最小限ですが、頻繁かつ制御されていない使用により依存症が発症するのには十分です。 驚くべきことに、人々は自分の意志に反して薬物中毒になることがよくあります。 たとえば、頭痛を和らげるためにモルヒネ錠を毎日服用すると、依存症になる可能性があります。 その後、安定した依存症が形成された後、薬を服用した後にのみ幸福感を改善することが可能になります。
薬物としてのモルヒネの効果
" アンナ(残念)。 何があなたを生き返らせることができますか? もしかして、あなたのこのアムネリスがあなたの妻ですか?
I. - ああ、違うよ。 落ち着け。 モルヒネのおかげで、この状態から抜け出せました。 代わりにモルヒネ。 "ミハイル・アファナシェヴィチ・ブルガーコフ。 若い医師のメモ。 モルヒネ。
モルヒネを麻薬または鎮痛剤として投与すると、人は体が温かくなり、リラックスした気分になります。 陶酔感が始まり、手足のわずかなうずき、舞い上がるような心地よいめまいの感覚を伴います。 モルヒネの作用は投与後5〜10分で起こり、30〜60分後に終わります。 血中のモルヒネ濃度は投与後約 20 分で最大になります。
 モルヒネは強力な麻薬物質であり、中毒は非常に早く起こります。 たとえ医療目的であっても、薬物を約 2 ~ 3 週間定期的に使用すると、身体依存が発症するのに十分です。 これは、モルヒネがあらゆる人の神経系によって生成されるエンドルフィンに部分的に似ているという事実によって説明されます。 いわゆる幸福ホルモンが必要ですが、それがないと憂鬱が始まり、否定的な考えが現れます。 逆に、過剰なエンドルフィンは人の知的レベルを高め、精神状態を改善するのに役立ちます。
モルヒネは強力な麻薬物質であり、中毒は非常に早く起こります。 たとえ医療目的であっても、薬物を約 2 ~ 3 週間定期的に使用すると、身体依存が発症するのに十分です。 これは、モルヒネがあらゆる人の神経系によって生成されるエンドルフィンに部分的に似ているという事実によって説明されます。 いわゆる幸福ホルモンが必要ですが、それがないと憂鬱が始まり、否定的な考えが現れます。 逆に、過剰なエンドルフィンは人の知的レベルを高め、精神状態を改善するのに役立ちます。
薬物としてのモルヒネの特徴は、長い休憩の後に少量を投与する必要があることです。 中毒者が自分の欲望を満たすために、すぐに大量の物質を摂取すると、吐き気、嘔吐、頭痛などの対応する症状を伴う中毒が発生します。 モルヒネの過剰摂取内臓の全体的な損傷と死の脅威にさらされます。
モルヒネ中毒
 ただし、モルヒネによる急性中毒の原因は、他の麻薬性鎮痛薬と同様に、次のとおりです。
ただし、モルヒネによる急性中毒の原因は、他の麻薬性鎮痛薬と同様に、次のとおりです。
- モルヒネ含有薬物の誤使用、
- 医療従事者や薬局職員が投薬量を処方する際の間違い、
- 自殺を目的として意図的に薬物を投与すること
- 過剰摂取、薬物使用
急性モルヒネ中毒は、健康な成人が0.06gの用量で物質を摂取した後に発生し、その投与経路や剤形(経口、座薬や溶液の形での直腸経由、皮下、筋肉内または静脈内投与)には依存しません。 )。
慢性的なモルヒネ使用者の場合、毒性量はこの薬を最初に使用した人よりもはるかに高くなります。
急性モルヒネ中毒の臨床像は、バルビツール酸塩、アルコール、睡眠薬の臨床像に似ています。 嘔吐中枢と動眼神経を除く中枢神経系のほとんどの部分の阻害は、中毒の臨床像において決定的です。 動眼神経の中枢が興奮した結果、薬物中毒時には瞳孔が急激に収縮します。 この症状に加えて、脊髄反射の亢進もモルヒネ中毒の特徴です。
酩酊の初期段階は、口渇、多幸感、および落ち着きのない行動によって特徴付けられます。
将来的には、頭痛が現れ、徐々に激化し、頻繁な排尿衝動、熱感、めまい、耳の詰まりが発生します。
中毒の主な症状は呼吸不全です。 多くの場合、中毒の重症度とその結果を決定するのは、呼吸中枢への影響の程度です。 呼吸は非常にゆっくりで表面的です(1 分間に 2 ~ 6 回の呼吸)。 呼吸運動の数の減少は、完全に息を止める期間に置き換えることができます。 気管支けいれんおよび気管支分泌物の増加は、呼吸不全の一因となります。 呼吸中枢の麻痺の結果として死に至ります。
モルヒネおよびモルヒネ含有薬物は禁止されていますか?

- 国際的に流通しているモルヒネは、麻薬に関する単一条約の最初のリストに含まれています。
- ロシアでは、モルヒネとその誘導体(塩酸モルヒネ、硫酸モルヒネ)は麻薬および向精神薬のスケジュール II に含まれており、ロシア連邦内での流通量は限られており、規制措置が確立されつつあります。 多くのモルヒネ誘導体 (ベンジルモルヒネ、ヒドロモルヒノール、デソモルヒネ、ジヒドロモルヒネ、ジアセチルモルヒネ、3-モノアセチルモルヒネ、6-モノアセチルモルヒネ、臭化モルヒネメチル、モルヒネ-N-オキシド、ニコモルヒネ、ノルモルヒネなど) が麻薬スケジュール I に含まれています。ロシア連邦では流通が禁止されています。
モルヒネ中毒の兆候
 モルヒネ中毒は、次の生理学的および身体的兆候によって識別されます。
モルヒネ中毒は、次の生理学的および身体的兆候によって識別されます。
- 瞳孔の収縮。
- 目の赤みと不健康な輝き。
- 顔の打撲傷。
- ゆっくりとした呼吸。
- 皮膚のかゆみ。
- 乾燥した粘膜。
- 眠気。
- 発汗;
- 便秘;
- 排尿頻度が低い。
- 手足の震え(震え)
依存症の精神的および心理的兆候には次のようなものがあります。
- 不注意、絶え間ない多幸感。
- 決意、勇気。
慢性的なモルヒネ中毒者は、目の下に大きなあざがあり、腫れあがった不愉快な顔をしています。 瞳孔は開き、視線は不安定で、一度に数秒間続くこともあります。 髪の毛はまばらで、薄く、乾燥しており、爪は欠けています。 歯が悪い、口臭がある。 肌は灰色がかった色になります。 長期にわたる依存では、打撲傷やただれが人の体に伝わりません。
モルヒネ中毒を視覚的に判断することは非常に困難です。 彼女には特別な症状はありません。 主な兆候と副次的な兆候は、他の薬物の使用にも現れます。
モルヒネ中毒の影響
 モルヒネを 1 回投与すると、心拍数の上昇、血圧の低下、生殖能力の低下、反射の抑制が引き起こされます。 多幸感は長くは続かない。 アヘン薬物に対する個人の不耐性や精神疾患の場合、医療目的でのモルヒネの使用は禁忌です。 一般に、患者の年齢と体重に応じて投与量が調整されていれば、身体はその物質によく耐えます。 ただし、これは治療中のモルヒネの単回投与にのみ適用されます。 モルヒネの組織的な麻薬使用により、すべてがより深刻で恐ろしいものになります。
モルヒネを 1 回投与すると、心拍数の上昇、血圧の低下、生殖能力の低下、反射の抑制が引き起こされます。 多幸感は長くは続かない。 アヘン薬物に対する個人の不耐性や精神疾患の場合、医療目的でのモルヒネの使用は禁忌です。 一般に、患者の年齢と体重に応じて投与量が調整されていれば、身体はその物質によく耐えます。 ただし、これは治療中のモルヒネの単回投与にのみ適用されます。 モルヒネの組織的な麻薬使用により、すべてがより深刻で恐ろしいものになります。
モルヒネの非医療的使用への依存は深刻です。 この薬は体に重大な害を及ぼし、さまざまな病気の発症につながります。
- 脳細胞の破壊。
- 中枢神経系の機能の違反。
- 肝臓、腎臓、消化器系器官の機能の違反。
- 精神の劣化、人格の変化。
- 神経症、うつ病、自殺願望。
- 肌の色の変化。
- 目の損傷、失明。
- インポテンス、不妊症;
- 女性の月経周期の違反。
- 体のすべての内部システムに損傷を与えます。
モルヒネへの長期依存は、ほとんどの場合、重篤な病気や悲しい結果をもたらします。
- 敗血症;
- 肝炎;
- HIVエイズ;
- 腫瘍学;
- 死。
モルヒネを含むハードドラッグへの依存は決して見過ごされません。 そして最大の危険は過剰摂取です。 最高の快楽を求めて、麻薬中毒者は通常の薬物摂取量を増やします。 過剰摂取は重度の脳損傷、昏睡、死につながります。
そして、モルヒネへの持続的な依存は、一度使用した後でも発症する可能性があることを覚えておいてください。 決して薬物の使用を始めないでください!
モルヒネ離脱
注射後、中毒者は1時間その感覚を楽しみます。 次の数時間、人生は独自のコースで流れます。 10〜12時間後、禁欲または離脱症候群(禁断症状)が現れます。 中毒者は次のような症状を経験します。
- 気分の悪化。
- 明らかな理由もなく発汗する。
- 手足の震え。
- 唾液分泌;
- 瞳孔拡張。
- 衰弱;
- 不眠症;
- 環境や人々に対する無関心。
- 食欲不振。
 依存症が長く続くほど、離脱症候群は重篤になります。 最初は、麻薬中毒者は 1 日に 1 回の投与だけで済みます。 その後、薬を服用する間隔が短くなり、4〜5時間に達します。 症状の軽減は注射後にのみ起こり、長くは続きません。 麻薬中毒者の人生はただ一つ、薬物を摂取するという新たな意味を獲得する。 モルヒネは通常の薬局では購入できません。 麻薬売人や地下組織が助けに来ます。 注射用の粉末は、物質のコストを削減するために低品質の材料で希釈されています。 これにより身体への負担が増大し、すべての内部システムや器官に修復不可能な損傷を与えます。
依存症が長く続くほど、離脱症候群は重篤になります。 最初は、麻薬中毒者は 1 日に 1 回の投与だけで済みます。 その後、薬を服用する間隔が短くなり、4〜5時間に達します。 症状の軽減は注射後にのみ起こり、長くは続きません。 麻薬中毒者の人生はただ一つ、薬物を摂取するという新たな意味を獲得する。 モルヒネは通常の薬局では購入できません。 麻薬売人や地下組織が助けに来ます。 注射用の粉末は、物質のコストを削減するために低品質の材料で希釈されています。 これにより身体への負担が増大し、すべての内部システムや器官に修復不可能な損傷を与えます。
モルヒネ中毒者が 1 日以上モルヒネの投与を受けないと、最も重度の離脱段階が起こります。 重度の吐き気、嘔吐、頭痛によって現れます。 依存症者はうつ病に悩まされ、自殺願望が訪れます。
薬物を止めることが意識的な願望であれば、この段階で薬物から抜け出すのは非常に簡単です。 ただし、これは一時的なものであることを忘れないでください。 そして、残りの人生で苦しみ続けるよりも、一度自分自身を克服する方が良いです。 しかし、薬物中毒者の寿命はかなり短いです。
P オムニ患者の状態を緩和するために、モルヒネをベースにした鎮痛薬を投与することは不可能です。
モルヒネ中毒の治療
 モルヒネ中毒の治療は、患者が自分の中毒を否定し、使用する薬物の「軽さ」を主張することが多いため、複雑でかなり長いプロセスになります。
モルヒネ中毒の治療は、患者が自分の中毒を否定し、使用する薬物の「軽さ」を主張することが多いため、複雑でかなり長いプロセスになります。
薬物中毒の治療には主に 2 つのルールがあります。
- 解毒を行い、禁断症状を和らげます。
- リハビリテーションコースを実施し、薬物のない生活を示します。
自分でモルヒネを拒否することは可能ですが、それは初期段階に限ります。 数年間使用すると、専門家の助けなしに通常の生活に戻るのは非常に困難です。 しかし、依存症者の同意がなければ治療は不可能です。 私たちの国では、アルコール依存症と薬物中毒からの自主的な解放のみが認められています。
したがって、あなたが薬物中毒者である場合は、必ず適切なリハビリテーションセンターまたは薬物中毒者のための診療所に連絡してください。 専門家が薬物使用をやめ、完全で健康的な生活に戻るようお手伝いします。
モルヒネの歴史
 ドイツの薬学者フリードリッヒ・セルトゥルナーは 1804 年に初めてアヘンから物質を導き出し、それを彼は モルフィウム(モルフィウム)。
この強力な麻薬は、夢と夢を司る古代ギリシャの神モルフェウスにちなんでその名前が付けられました。
ドイツの薬学者フリードリッヒ・セルトゥルナーは 1804 年に初めてアヘンから物質を導き出し、それを彼は モルフィウム(モルフィウム)。
この強力な麻薬は、夢と夢を司る古代ギリシャの神モルフェウスにちなんでその名前が付けられました。
モルヒネはもともと痛みを和らげるために使われていましたが、 "処理"アヘンとアルコール中毒。 しかし、モルヒネは1853年に注射針が発明されてから広く普及しました。
アメリカ南北戦争 (1861 年から 1865 年) の間、この薬のせいで 40 万人以上がモルヒネ中毒になりました。
1874 年、一般にヘロインとして知られるジアセチルモルヒネがモルヒネから合成されました。 ヘロインが合成される前は、モルヒネが世界で最も一般的な麻薬性鎮痛薬(痛みを和らげることを目的とした薬、鎮痛薬)であったことは注目に値します。
 驚くべき事実: ヘロインの発明は、モルヒネ中毒の治療薬を作成し、より強力な鎮痛剤を得ることが期待されていました。 しかし、物質が合成された後、世界は最も人気があり、強力で致命的な新薬の1つとなりました。
驚くべき事実: ヘロインの発明は、モルヒネ中毒の治療薬を作成し、より強力な鎮痛剤を得ることが期待されていました。 しかし、物質が合成された後、世界は最も人気があり、強力で致命的な新薬の1つとなりました。
歴史や文学を研究すると、前世紀の人々に対するモルヒネの影響がわかります。 医師、兵士、作家のほとんどはモルヒネを服用して「座っていた」。 この物質は痛みや苦痛を和らげるだけでなく、恐怖、憂鬱、疲労を克服するのにも役立つと信じられていました。 同時に、その使用による有害な影響は大幅に過小評価されていました。
モルヒネ中毒は今日まで蔓延しています。 若い少年少女は、自分の自由意志だけでなく、この物質を使用した不適切な治療の後にも薬物中毒になります。 したがって、患者の病歴を詳細に調査し、年齢、体重、健康状態、その他多くの要因を考慮して処方できるのは専門家だけです。
モルヒネとは何ですか?どこで使用されますか? 生の形では、薬物「モルヒネ」は白い結晶性の粉末のように見えます。 「モルヒネ」は薬物の時代遅れの名前です。 この物質の名前は、伝説によれば夢を司るギリシャの神モルフェウスにちなんでいます。 アヘンアルカロイドの一種である麻薬です。 アヘン用ケシの搾り汁を加工して作られます。 さらに、ステファニア、シノメニウム、ムーンシードなどのハーブの組成中に少量のモルヒネが含まれています。 モルヒネとは何か、以下で考えてみましょう。
歴史的参照
モルヒネは、鎮静、鎮痛、鎮静、催眠効果のある薬です。 モルヒネベースの薬物は、1805 年以来医療現場で使用されてきました。 南北戦争中のすべての病院にはこの薬が供給されました。 それは、外科手術後に負傷した兵士に麻酔薬として筋肉内または静脈内に投与され、患者の運命を大幅に促進しました。 それがモルヒネです。 この概念の内容は多くの人にとって興味深いものです。
主な欠点
この薬の主な欠点は、その麻薬性でした。 これにより、使用中に急速な依存症が発生しました。 すぐに、患者が薬物の長期使用によってもたらされた状態は兵士の病気と呼ばれるようになりました。 よく知られている事実は、20世紀初頭、この薬が軍事目的だけでなく、疲労感を止める目的で医師によっても使用されたということです。 モルヒネとは何なのか、その物質の性質は何なのか、誰もが知っているわけではありません。

フォームとプロパティ
この薬はいくつかの形態で入手可能です。 モルヒネは、筋肉内または静脈内投与用の錠剤および溶液として使用できます。 薬の特性に関しては、いくつかの特徴があります。
1. モルヒネは針状の結晶または白い粉末の形で生成されます。 長期間保管すると黄色や灰色に変色する傾向があります。
2. 薬物は水中ではゆっくりと希釈され、アルコール溶液に溶解することはほとんど不可能です。
3. アルカリとの非相溶性。
4. モルヒネ溶液は摂氏 100 度で 30 分間の滅菌が必要です。
5. 溶液を安定させるために、塩酸を加えます。
6. 粉末は摂氏 254 度で溶けます。
7. 溶液の回転の具体的な値は 2% です。
8. 261 度で発火します。
9. 349℃で自己発火する火薬。
モルヒネの指示を簡単に考えてみましょう。

薬力学
モルヒネは麻薬のカテゴリーに属します。 オピオイド鎮痛薬のグループに含まれます。 たとえ実際の状況が望ましくないままであっても、この薬は多幸感を引き起こし、安心感を生み出し、痛みを軽減し、気分を改善し、明るい見通しを示すことができます。
依存症を引き起こす
モルヒネの同様の性質は、薬物に対する精神的依存、さらには身体的依存の発症を引き起こします。 用量を超えると強力な催眠術となります。 さらに、この物質は条件反射の速度を遅くし、咳中枢の興奮性を低下させ、縮瞳を引き起こす可能性があります。 また、この薬は内臓の筋肉の緊張を高め、胆道だけでなくオッディ括約筋のけいれんを引き起こす可能性があります。 この薬のもう1つの特性は、腸の蠕動運動を弱めることです。 この場合、排出が加速され、胃の蠕動運動が増加します。
モルヒネとは何ですか?なぜ必要ですか?
麻酔薬として、皮下、静脈内、または筋肉内に処方されます。 しかしながら、他の使用方法、例えば、経口、直腸、硬膜外、またはくも膜下腔内、すなわち脊髄膜下での使用も可能である。

薬は非常に早く吸収されます。 活性物質の最大 40% が血漿タンパク質に結合します。 モルヒネは胎盤を通過し、胎児の呼吸機能を阻害することができます。 母乳も同様です。 つまり、妊娠中や授乳中は絶対に使用できません。 筋肉内に投与すると、薬の効果は 15 分後にピークに達します。 血流を介した分布は 35 分後に起こり、効果は最大 5 時間持続します。
使用上の適応
モルヒネは、重大な痛みを伴う怪我や病気の麻酔薬として処方されます。 手術前後の準備処置にも使用されます。 場合によっては、重度の咳、息切れ、不眠症、および急性心不全に伴うその他の症状に対してこの薬が処方されることがあります。
X線検査中
場合によっては、胆嚢、胃、十二指腸の X 線検査中にモルヒネの使用が許可されます。 この薬は胃の筋肉の緊張を高め、蠕動運動を強化し、排出のプロセスを加速するのに役立ちます。 これらすべてにより、専門家は内臓や潰瘍の腫瘍学的疾患を診断することが容易になります。
腫瘍学およびその他のアプリケーション
モルヒネの主な応用分野は腫瘍学です。 この薬はすぐに痛みを和らげ、患者の状態を緩和することができます。 したがって、この薬には次のような特性があります。

1. 腫瘍性疾患、外傷、不安定狭心症および心筋梗塞における疼痛の抑制。
2. 麻酔学の分野で手術中に追加ツールとして使用されます。
3. 他の薬が効果がない場合は、出産時の咳や肺水腫の治療にモルヒネが使用されます。
4. 胆嚢、胃、十二指腸の X 線検査の前に退院した。 モルヒネとは何か、説明しました。
禁忌
モルヒネの服用に対する禁忌は次のとおりです。
1. 薬物の成分に対する過敏症。
2. アルコールや薬物中毒などによる呼吸抑制。
3. 中枢神経系の抑うつ状態。
4. 麻痺型の腸閉塞。
5. 硬膜外麻酔または脊椎麻酔を実施します。
気をつけて
これらは絶対的な禁忌です。 モルヒネの使用には細心の注意が必要な状況もあります。 かもね:
1.原因不明の腹部の痛み。
2. 感情的な計画の不安定さ。
3. 気管支喘息の発作。
4. 不整脈。
5. 発作。
6. 薬物依存の存在。
7. アルコール依存症。
8. 自殺傾向。
9. 胆石症。
10. 消化管および泌尿器系の臓器の手術を行う。

また、脳損傷、肝不全または腎不全、前立腺肥大症、甲状腺機能低下症、尿道狭窄、重度の炎症性腸疾患、てんかん症候群、胆道の手術後の場合にも、この薬の使用には注意が必要です。
それが医学におけるモルヒネです。
投与量
モルヒネとその誘導体は、リスト I および II の麻薬に含まれます。 このため、一部の薬物は入手が厳しく制限されており、ロシアでは販売が禁止されているものもあります。 しかし、モルヒネをベースにした薬は今でも病院で使用されています。 医師の処方に従い、専門家が指示した用量でのみ使用できます。 後者は、患者の状態の重症度と薬に対する体の感受性によって異なります。
モルヒネとは何ですか、何のためにあるのかと患者はよく尋ねます。
成人患者の1回の投与量は10〜20 mgですが、カプセルについて話している場合、1回の投与量は最大100 mgです。 筋肉内および静脈内投与の場合、投与量は 10 mg ですが、1 日あたり 50 mg を超えてはなりません。
副作用
医師が処方した用量を超えた場合、患者は次のような多くの副作用を経験する可能性があります。
1. 意識の混乱。
2. 冷たくベタベタした大量の汗。
3. 疲労。
4. 眠気。
6.徐脈。
7. 頭蓋内圧亢進症。
8. 緊張。
9. 低体温症。

10. 呼吸が遅くなり、呼吸が困難になります。
11. 不安。
12. 口が渇く。
13. せん妄精神病。
14. 血圧を下げる。
15. めまい。
16. 発作。
17. 幻覚。
18. 筋肉の硬直。
モルヒネとは何かを知るだけでなく、以下のことを理解することが重要です。 これに依存すると、適切な専門家の即時介入が必要となる重篤な病気になる可能性があります。 これは、依存症が重度の過剰摂取を引き起こす可能性があり、その結果が致命的な結果を招く可能性があるという事実によるものです。
R N001645/02-170909商標名:モルヒネ
INN またはグループ名:モルヒネ&
化学的合理名:(7,8-デヒドロ-4,5α-エポキシ-17-メチルモルフィン-3,6-α-ジオール)塩酸塩
剤形:
皮下液化合物:
1 ml の溶液には次のものが含まれます。活性物質- 塩酸モルヒネ 無水物換算 - 8.56 mg
賦形剤- エデト酸二ナトリウム (エチレンジアミン四酢酸の二ナトリウム塩)、グリセロール (蒸留グリセロール)、0.1 M 塩酸溶液、注射用水。
説明:無色透明または黄色がかった液体。
薬物療法グループ:
鎮痛剤ATCコード:
ロシア連邦で管理されている麻薬、向精神薬およびそれらの前駆物質のリストのリスト II を指します。
薬理学的特性
オピオイド受容体アゴニスト(ミュー、カッパ、デルタ)です。 それは内因性の抗侵害受容系を活性化し、中枢神経系のさまざまなレベルでの痛みのインパルスのニューロン間伝達を妨害し、また、痛みの感情的な色を変化させ、脳の高次部分に影響を与えます。
薬力学
モルヒネは、さまざまな様式の刺激によって痛みに対する感受性の閾値を高め、条件反射を抑制し、多幸感と適度な催眠効果をもたらし、迷走神経中枢の緊張を高め、嘔吐中枢を抑制し、開始領域の化学受容体を刺激します。嘔吐中枢の機能を低下させ、呼吸中枢を低下させ、動眼神経中枢の活性化により瞳孔の収縮を引き起こし、気管支および内臓(腸、胆道、膀胱)の平滑筋括約筋の緊張を高め、収縮を増強します。子宮筋層の活動を低下させ、腸の運動性を弱め、胃腸管の腺の分泌活動を阻害します。 基礎代謝と体温をわずかに低下させ、抗利尿ホルモンの分泌を促進します。 末梢血管の拡張とヒスタミンの放出を引き起こし、血圧の低下、皮膚の発赤、発汗の増加、白目の赤みを引き起こす可能性があります。 皮下投与すると10~20分後に効果が現れ、3~5時間持続します。
中毒および薬物(オピオイド)依存(モルヒネ症)を引き起こします。
薬物動態
分配量は4リットル/kgです。 薬物の 30 ~ 35% が血漿タンパク質に結合します。 C最大50〜90分。 半減期は2~4時間です。
非経口投与された薬物の約10%は24時間以内に変化せずに尿中に排泄され、80%はグルクロニド代謝物の形で、残りは胆汁中に排泄され、腸から排泄されます。 血液脳関門と胎盤関門を通過し、母乳中に含まれています。
使用上の適応
モルヒネは、外傷性激痛症候群の麻酔薬として、術前、手術中、術後、心筋梗塞、重度の狭心症発作、悪性腫瘍の痛み、および激痛を伴うその他の症状に使用されます。
禁忌
アヘン剤に対する過敏症。
呼吸抑制または中枢神経系の重度の抑制を伴う症状。 けいれん状態。 頭蓋内圧の上昇。 頭部外傷。 急性アルコール状態およびアルコール性精神病。 気管支ぜんそく。 麻痺性腸閉塞。 慢性肺疾患による心不全。 心不整脈。 診断前の腹部臓器の急性外科疾患。 胆道に対する外科的介入後の状態。 モノアミンオキシダーゼ阻害剤(MAOI)による治療中およびその中止後さらに 14 日間は、モルヒネを使用すべきではありません。
慎重に使用してください
慢性閉塞性肺疾患、薬物依存症(病歴を含む)、アルコール依存症、自殺傾向、情緒不安定、胆石症、胃腸管、泌尿器系、肝不全または腎不全の外科的介入、甲状腺機能低下症、重度の炎症性腸疾患、前立腺肥大症、尿道狭窄、てんかん症候群。
患者の一般的な重篤な状態、高齢者、小児期。
妊娠中および授乳中の使用
妊娠中、出産中、授乳期間中は、健康上の理由でのみモルヒネの使用が許可されています(胎児や新生児に薬物依存が発生する可能性があります)。
投薬と管理
モルヒネは皮下投与されます。 投与量は患者の年齢や状態に応じて個別に選択されます。
大人:成人の皮下投与の通常用量は、10 mg / ml 溶液 1 ml です。 鎮痛効果は10~15分後に現れ、1~2時間後に最大に達し、8~12時間以上持続します。
成人の皮下への最高用量:一回0.02g、毎日-0.05g。
誕生から2歳までのお子様
総用量が15 mgを超えないように、必要に応じて4~6時間ごとに100~200 mcg / kg体重(0.1~0.2 mg / kg)を皮下投与します。
2歳以上のお子様
総用量が1.5 mg / kg体重を超えないように、必要に応じて4~6時間ごとに100~200 mcg / kg体重(0.1~0.2 mg / kg)を皮下投与します。
副作用
消化器系から:より頻繁に-吐き気と嘔吐(治療の開始時により頻繁に)、便秘。 頻度は低いですが、口渇、食欲不振、胆道のけいれん、胆汁うっ滞(主胆管内)、胃痛、胃けいれん。 まれに - 肝毒性(濃い尿、淡い便、強膜と皮膚のヒステリー)、重度の炎症性腸疾患 - 腸アトニー、麻痺性イレウス、中毒性巨大結腸症(便秘、鼓腸、吐き気、胃けいれん、嘔吐)。
心臓血管系の側から見ると:より多くの場合-血圧の低下、頻脈、それほど頻繁ではありません-徐脈、頻度は不明です-血圧の上昇。
呼吸器系から:より多くの場合-呼吸中枢の低下、それほど頻繁ではありません-気管支けいれん、無気肺。
神経系から:より頻繁には、めまい、失神、眠気、異常な疲労感、全身の脱力感。 頻度は低いですが、頭痛、震え、不随意な筋肉のけいれん、筋肉の動きの不調和、感覚異常、神経過敏、うつ病、錯乱(幻覚、離人症)、その後の脳血管障害の可能性を伴う頭蓋内圧の上昇、不眠症。 まれに - 落ち着きのない睡眠、中枢神経系の抑制、大量摂取を背景に - 筋肉の硬直(特に呼吸器系)、子供の場合 - 逆説的な興奮、不安; 頻度は不明です - けいれん、悪夢、鎮静作用または興奮作用(特に高齢患者の場合)、せん妄、集中力の低下。
泌尿生殖器系から:それほど頻繁ではありません - 利尿の減少、尿管のけいれん(排尿時の困難と痛み、頻繁な排尿衝動)、性欲の低下、効力の低下。 頻度は不明です - 膀胱括約筋のけいれん、尿の流出の違反、または前立腺肥大症と尿道の狭窄を伴うこの状態の悪化。
アレルギー反応:より頻繁に - 喘鳴、顔の紅潮、顔の皮膚の発疹。 それほど頻繁ではありません - 皮膚の発疹、蕁麻疹、そう痒症、顔の腫れ、気管の腫れ、喉頭けいれん、悪寒。
地元の反応:注射部位の充血、腫れ、灼熱感。
その他:より頻繁に - 発汗の増加、発声障害。 それほど頻繁ではありません - 視覚知覚の明瞭さの侵害(複視を含む)、縮瞳、眼振、想像上の幸福感、不快感。 頻度不明 - 耳鳴り、薬物依存、耐性、「離脱」症候群(筋肉痛、下痢、頻脈、散瞳、高熱、鼻炎、くしゃみ、発汗、あくび、食欲不振、吐き気、嘔吐、神経過敏、疲労、過敏症、振戦) 、胃けいれん、全身衰弱、低酸素、筋肉収縮、頭痛、血圧上昇、その他の自律神経症状)。
モルヒネを 1 ~ 2 週間(場合によっては 2 ~ 3 日以内)繰り返し使用すると、中毒(鎮痛効果の減弱)およびオピオイド薬物依存が発症する可能性があります。
過剰摂取
中毒または過剰摂取の場合、昏迷または昏睡が発生し、低体温、血圧の低下、呼吸抑制が観察されます。 特徴的な特徴は、瞳孔の顕著な収縮です(重度の低酸素症では、瞳孔が開く可能性があります)。
中毒の応急処置 - 適切な肺換気の維持 特定のオピオイド拮抗薬であるナロキソンを 0.4 ~ 2 mg の用量で静脈内投与すると、すぐに呼吸が回復します。 2〜3分経っても効果が見られない場合は、ナロキソンの投与を繰り返します。 小児に対するナロキソンの初回用量は0.01 mg/kgです。 ナロルフィンを使用することが可能です: 15 分ごとに 5 ~ 10 mg を筋肉内または静脈内に、合計 40 mg まで投与します。 モルヒネ依存症の患者にナロキソンとナロルフィンを導入すると離脱症候群を発症する可能性を考慮する必要があり、そのような場合にはアンタゴニストの用量を徐々に増やす必要があります。
交流
睡眠薬、鎮静薬、局所麻酔薬、全身麻酔薬、抗不安薬の効果を増強します。
エタノール、筋弛緩剤、および中枢系を抑制する薬物は、デプライミング効果と呼吸抑制を増大させます。
ブプレノルフィン(以前の治療を含む)は、他のオピオイド鎮痛薬の効果を軽減します。 高用量のμ-オピオイド受容体のアゴニストの使用を背景に呼吸抑制が減少し、低用量のμ-またはκ-オピオイド受容体のアゴニストの使用を背景に呼吸抑制が増加します。 薬物依存を背景にミューオピオイド受容体作動薬を中止すると「離脱症候群」の症状の発症が加速され、突然の中止によりこれらの症状の重症度が部分的に軽減されます。 バルビツール酸塩、特にフェノバルビタールを体系的に使用すると、麻薬性鎮痛薬の鎮痛効果の重症度が低下し、交差耐性の発達が促進される可能性があります。
ベータ遮断薬と同時に服用すると、中枢神経系の抑制効果が増加する可能性があり、ドーパミンではモルヒネの鎮痛効果が減少し、シメチジンでは呼吸抑制が増加し、他のオピオイド鎮痛薬では中枢神経系の抑制が起こります。神経系、呼吸、血圧低下。
クロルプロマジンは、モルヒネの縮瞳作用、鎮静作用、鎮痛作用を強化します。
フェノチアジンおよびバルビツレートの誘導体は降圧効果を高め、呼吸抑制のリスクを高めます。
ナロキソンは、オピオイド鎮痛薬の効果と、それによって引き起こされる呼吸器系および中枢神経系の抑制を軽減します。 他のオピオイドの望ましくない作用を排除するために処方されているブトルファノール、ナルブフィン、ペンタゾシンの作用を逆転させるには高用量が必要な場合があります。 薬物依存を背景とした「離脱症候群」の症状の発症を加速させる可能性があります。
ナルトレキソンは、薬物依存を背景に「離脱症候群」の症状の発症を加速します(症状は薬物投与後5分以内に現れ、48時間持続し、持続性と除去の困難を特徴とします)。 オピオイド鎮痛薬(鎮痛、下痢止め、鎮咳)の効果を軽減します。 ヒスタミン反応による症状には影響しません。 ナロルフィンは、モルヒネによって引き起こされる呼吸抑制を解消します。
血圧を下げる薬(神経節遮断薬、利尿薬など)の降圧効果を高めます。
ジドブジンの肝臓代謝を競合的に阻害し、そのクリアランスを低下させます(相互中毒のリスクが増加します)。
抗コリン作用のある薬剤、下痢止め薬(ロペラシドを含む)は、腸閉塞、尿閉、中枢神経系の抑制に至るまで、便秘のリスクを高めます。 メトクロプラミドの効果を軽減します。
特別な指示
モルヒネは、全身疲労、肝臓や腎臓の疾患、副腎の皮質層の機能不全を伴う高齢の患者には慎重に使用されます。 モルヒネは、過度のうつ病を避けるために、中枢神経系に作用する薬物(麻酔薬、睡眠薬、抗不安薬、抗うつ薬、抗精神病薬、抗ヒスタミン薬、その他の非麻薬性鎮痛薬)の作用を背景にして、厳重な監督の下、用量を減らして使用する必要があります。中枢神経系と呼吸中枢の活動の抑制。
この薬剤は、鎮痛作用を弱める危険性と、次の症状を持つ患者に離脱症候群を引き起こす可能性があるため、オピオイド受容体の部分作動薬(ブプレノルフィン)および作動薬 - 拮抗薬(ナルブフィン、ブトルファノール、トラマドール)のグループに属する麻薬性鎮痛薬と併用すべきではありません。オピオイド依存症。 治療用量範囲におけるオピオイドアゴニスト(トリメペリジン、フェンタニル)の鎮痛効果と望ましくない効果は、モルヒネの効果でまとめられます。 治療期間中は、車の運転や、注意力の集中と精神運動反応の速度の向上が必要なその他の潜在的に危険な活動に従事する際には注意し、エタノールの使用を避ける必要があります。
麻痺性イレウスが発生する可能性がある状況では使用しないでください。 麻痺性イレウスの危険がある場合は、モルヒネの使用を直ちに中止する必要があります。
心臓手術やその他の重度の痛みの手術を受ける患者では、手術の 24 時間前にモルヒネの使用を中止する必要があります。 その後治療が必要な場合は、手術の重症度を考慮して投与量が選択されます。
場合によっては、薬物に対する耐性や依存が発生する可能性があります。 吐き気や嘔吐が発生した場合は、フェノチアジンと組み合わせて使用できます。 腸に対するモルヒネ薬の副作用を軽減するには、下剤を使用する必要があります。
2 歳未満の子供はオピオイド鎮痛薬の影響により敏感であり、逆説的な反応を経験する可能性があることに留意する必要があります。
リリースフォーム
皮下注射用溶液 1 ml シリンジ チューブ (1 cm3) 入り 10 mg/ml 20、50、または 100 本のシリンジ チューブと使用説明書が段ボール箱に入っています。
保管条件
光を避け、温度が15℃を超えない場所で。 ロシア連邦で規制の対象となる麻薬、向精神薬およびそれらの前駆物質のリスト II。 子供の手の届かないところに保管してください。
薬局での調剤規約
他の麻薬性鎮痛薬と同じ制限のある処方箋に従って薬局から発売されます。
賞味期限
2年。 パッケージに記載されている日付を過ぎて薬を使用することは禁止されています。
メーカー
連邦国家統一企業「モスクワ内分泌工場」、109052、モスクワ、ノヴォホクロフスカヤ通り、25。
消費者の苦情は製造業者に提出されるべきです。