HIV ウイルスの構造。 HIV 細胞の構造。 hiv、エイズの感染経路
ヒト免疫不全ウイルス(HIV)の形態と構造
ヒト免疫不全ウイルスは、HIV 感染を引き起こし、最終的にはエイズの発症に至るリンパ向性ウイルスであり、免疫系の主な病変、長期経過、臨床症状の多型、高い死亡率、多様な自然感染経路を特徴としています。 (性的および非経口的)、流行が急速に広がる傾向があります。
HIV は 1983 年に L. モンタニエと R. ガロによって発見されました。
科:レトロウイルス科、属:レンチウイルス。
HIV の形態と構造。
HIV RNA ウイルス。 HIV ビリオンは球形で、直径は 100 nm です。 ビリオンの外殻は、糖タンパク質「とげ」が浸透した脂質の二重層で形成されています。 脂質エンベロープは、ウイルスが複製する宿主細胞の原形質膜に由来します。 糖タンパク質分子は2つのサブユニットで構成されています - gp 120 - はビリオンの表面に位置し、gp 41 - は脂質層に浸透します。 両方のタンパク質の形成は、HIV-gp-161 の外殻のタンパク質が切断されるときに発生する、それらの間の非共有結合によって起こります。 ビリオンの外殻の下にはコアがあります。 それは円錐形または円筒形をしており、p24 および p25 キャプシドタンパク質、多数のマトリックスタンパク質 (p6 および p11)、およびプロテアーゼタンパク質 (p11 および p11) で構成されています。 生殖を行うために、HIV は逆転写酵素またはリビルターゼを持っています。 HIV ゲノムは以下から構成されます: 1) 3 つの主要な構造遺伝子: gag はマトリックス、キャプシド、ヌクレオカプシドタンパク質およびプロテアーゼタンパク質をコードします。 pol-は逆転写酵素をコードします。 env - gp120 および gp41 をエンコードします。 2) 7 つの調節遺伝子および機能遺伝子: tat および rev - タンパク質の転写速度を増加させ、nef - HIV 複製の停止を制御し、vif - ウイルスが 1 つの細胞から出芽して別の細胞に感染する原因となるタンパク質をコードします。 これらには vpr、vpu、vpx も含まれており、複製と感染のプロセスを確実に実行します。
コアタンパク質とエンベロープ糖タンパク質 (p161) は、高レベルの抗原変異性を特徴とし、抗原性を持っています。
ウイルスには HIV-1 と HIV-2 の 2 種類があり、構造と抗原の特徴が異なり、それが病気の経過に違いをもたらします。
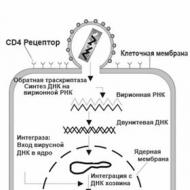
HIV のライフサイクルは 4 段階 (吸着、RNA 放出、RNA 合成、集合) で構成され、1 ~ 2 日で完了します。 このウイルスは主にリンパ球に影響を与えますが、場合によってはマクロファージ、白血球、樹状細胞、神経系の細胞にも影響を及ぼします。 これらには、ウイルスの p120 が特異的に相互作用する CD 4 受容体が含まれています。
HIV は、糖タンパク質のスパイクを備えた二重脂質層によって形成された球状のスーパーキャプシドを持っています。 「スパイク」は、2 つのサブユニットからなる糖タンパク質 gp 160 (gp - 糖タンパク質、160 - キロダルトン単位のタンパク質の分子量) によって形成されます。
gp 120 は、保存された超可変領域と、T リンパ球の CD4 分子 (T ヘルパー受容体) に結合する領域を含む免疫原性の高いタンパク質です。 gp 120 タンパク質はウイルスの表面にあります。
gp 41 - 脂質二重層を貫通し、gp 120 と非共有結合します。これにより、ウイルスが T リンパ球と融合します (gp 120 が CD4 と接触した後)。 さらに、gp 41 は、CD4 受容体が欠損した細胞へのウイルスの侵入を媒介することができます。
スーパーキャプシドマトリックスの下にはタンパク質p 17 (p - タンパク質) が存在します。 最も深いのは、切頭円筒の形状をしたコアです。これがヌクレオカプシドです。 キャプシドは p 24 タンパク質を形成します。キャプシド内にはウイルス ゲノムがあり、5 インチ末端近くで接続された 2 本の同一の非断片的な RNA+ 鎖で表されます。
HIV の構成には次の酵素が含まれます。逆転写酵素、逆転写酵素、RNase、DNA 依存性 DNA ポリメラーゼおよびエンドヌクレアーゼの 3 つのドメインから構成されます。 ウイルスゲノム自体は 9 個の遺伝子で構成されており、その一部は重複してエクソン - イントロン構造を持ち、9 個のウイルス遺伝子は 9 個の構造タンパク質と 6 個の制御タンパク質の合成を制御します。
図1。
HIV感染の原因物質のライフサイクル
I. ウイルスは、T リンパ球 (CD4 細胞) の表面にある特定の受容体分子に結合し、細胞内に侵入し、そのエンベロープを脱ぎ捨てます。
II. を使用したウイルス RNA マトリックスについて
逆転写酵素は DNA コピーを合成し、その後、二本鎖 DNA コピーが完成します。
Ⅲ. DNA コピーは細胞核に移動します (この段階での活性酵素はインテグラーゼです)。 そこでリング構造を形成し、細胞の DNA に組み込まれます。
IV. DNA コピーは細胞内に数年間残ることがあります。 その存在は、特定の抗体によって血液中で検出されます。
V. 身体の二次感染は、DNA コピーの転写、つまりウイルスメッセンジャー RNA の合成を刺激します。
VI. ウイルスメッセンジャー RNA 上で、細胞のリボソームがウイルスタンパク質の合成を実行します。
VII. 新しく合成されたウイルスタンパク質とウイルス RNA から、新しいウイルス粒子が組み立てられます。 細胞からの脱出は細胞死で終わることがよくあります。
細胞との相互作用のメカニズム。 HIV感染の病因
ウイルスは細胞内病原体であり、各ウイルスは特定の細胞型に対する指向性を持っています。 その指向性は、標的細胞上の特定のウイルスに対する受容体の存在と、ウイルスゲノムが細胞ゲノムに統合される能力によって決まります。 受容体はさまざまな種類の細胞上に存在する可能性があります。 受容体の機能は、タンパク質、脂質、タンパク質および脂質の炭水化物成分などのリガンドによって実行されます。 それらは細胞膜上に局在し、ホルモン、栄養素、成長因子、調節因子などの細胞への浸透を確実にします。
受容体は共通の構造的特徴を持っています。つまり、受容体は細胞外に位置する部位、膜内部位、および細胞質に浸された部位から構成されます。
HIV の受容体は、CD4 分化抗原と CD4 非依存性成分です。 CD4 は分子量 55,000 の糖タンパク質であり、その構造は免疫グロブリンの特定の部分と相同性があります。 HIV-1 gp120 を介したウイルスの宿主細胞膜受容体 CD4 への固定は、抗遺伝子提示細胞からのシグナルの認識をブロックします。 ウイルスがさらに複製されると、細胞死、その機能の破壊、その後の免疫不全の発症が引き起こされます。
人体には HIV の受容体を持つ細胞 (CD4+ リンパ球、CD8+ リンパ球、樹状細胞、単球、好酸球、巨核球、ニューロン、ミクログリア、精子) が多数あり、ウイルスが侵入すると細胞変性効果が生じます。それらの多くで観察されています。
主要な受容体である CD4 に加えて、HIV が細胞に侵入するために必要な多くの共受容体、特にケモカイン受容体が存在します。 ケモカインは、細胞を特定の方向に移動させるポリペプチドです。 ヒトでは、約 40 種類の同様のタンパク質が分離されており、それらはアルファ ケモカインとベータ ケモカインに分類されています。 1995 年に R. Gallo の研究室では、CD8 リンパ球からケモカインが単離され、マクロファージから 2 つのタンパク質が単離されました。 それらは、HIV-1 のマクロ貪食性変異体による CD+ 単核細胞の感染を阻止しますが、リンパ球向性変異体による感染は阻止しません。
したがって、CD4抗原とともにHIVのマクロファージへの侵入を阻止するケモカインであるタンパク質と、感染を促進する共受容体であるタンパク質が単離されている。 同時に、共受容体はケモカインの受容体ですが、HIVはそれらを受容体として使用し、その助けを借りて細胞に浸透します。
CD4+ 細胞に侵入すると、HIV は直ちに複製を開始し、CD4+ 細胞の活性が高まるほど、ウイルスの複製プロセスがより速くなります。 CD4+ 細胞を活性化するすべての調節因子は、ウイルスの複製を増加させます。 このような調節因子には、腫瘍壊死因子(TNF)、顆粒球/マクロファージコロニー刺激因子、インターロイキン-6(IL-6)が含まれます。 ウイルスの複製を阻害する負の制御因子には、インターフェロン (IF) やトランスフォーミング成長因子などがあります。
このウイルスは、Tリンパ球だけでなくキラー細胞にも多方向に影響を及ぼします。 後者の活性は病気が進行するにつれて着実に減少します。 病気が進行するにつれて、体の炎症プロセスに対する抵抗力が低下します。 IL-2 と γ-インターフェロンの欠損は、NK 細胞の数が正常であっても、HIV 感染患者の機能活性の低下につながります (Kovalchuk L.V.、Cheredeev A.N.、1991)。
2 種類の CD4+ 細胞、T-helper-1 (Th1) と T-helper-2 (Th2) が同定されています。 Th1 は細胞性免疫を刺激するサイトカインを生成し、Th2 は抗体生成を強化するサイトカインを生成します。 Th1 と Th2 の比率はバランスが取れており、競争力があります。 ある細胞型のサイトカインが過剰発現すると、別の細胞型が抑制されます。 HIV 感染患者では Th1 が抑制され、ウイルスの病理と発がんの両方が確実になります。
ウイルス膜糖タンパク質 gp120 (HIV-2 の場合は gp105) の CD4 細胞受容体に対する親和性によって、細胞構造に対する高度な選択的損傷が決定されるため、CD4+ リンパ球、血液単球、組織マクロファージ、および樹状細胞が関与します。病理学的過程では、まず第一に、そしてより広範囲に、血液、リンパ節、脾臓、皮膚、肺胞および間質性肺のマクロファージ、ミクログリア、および CD4 受容体を持つその他の神経系細胞が影響を受けます。 B および O リンパ球、網様細胞、腸上皮細胞、ランゲルハンス細胞も影響を受け、後者は CD4 + リンパ球よりもさらに感染しやすくなります。 ランゲルハンス細胞は、ウイルスが長期間、場合によっては数年も細胞内に留まるため、HIV が体中に広がるのに非常に重要です。
免疫担当細胞だけでなく多くの CD4 受容体の存在、この受容体を持たない細胞への感染能力によって、HIV のポリトロピーと臨床像の多型が決まります。 CD4 受容体を含む特定の細胞に対する損傷の程度は、細胞膜上のこれらの受容体の密度に依存します。 密度が最も高いのはリンパ球のヘルパー T 亜集団で、これが病気の病因を主に決定します。 しかし、ウイルスによる標的細胞への損傷の程度は、1 つまたは別の種類の細胞内で複製するウイルスの能力にも依存します。 明らかに、複製は主に CD4+ 表現型を持つリンパ球と単球/マクロファージで起こります。
ウイルスが CD4+ リンパ球に対して細胞溶解または合胞体への融合による細胞変性効果を及ぼす場合、単球/マクロファージ内で HIV は中程度の強度で複製します。 ビリオンは細胞の細胞質内でも丸い粒子に形成され、細胞質から出ても細胞壊死作用はありません。 TNF-a、IL-1b、IL-6 の過剰産生に伴い、発熱、貧血、下痢、悪液質、カポジ肉腫における皮膚や粘膜の病理学的変化、および脳症状が HIV 感染に関連しています。 同時に、TNFa は HIV に感染した T ヘルパーに対して直接的な細胞変性効果をもたらします。 同時に、HIV は、前者のタイプのヘルパー T によって合成される IL-2 および g-IF の産生を阻害し、後者のタイプのヘルパー T の機能は阻害しないことが判明しました。 したがって、サイトカイン合成の制御において重要な役割を果たしている HIV は、免疫応答を最初のタイプの T ヘルパーから 2 番目のタイプの T ヘルパーに切り替えることによって、免疫の体液性リンクを刺激します。
細胞がウイルスに感染すると、ウイルスエンベロープは gp41 タンパク質を使用して細胞膜に接続されます。 さらに、gp41 ウイルスタンパク質は、隣接する細胞の膜同士の融合を確実にし、1 つの多核細胞であるシンシチウムを形成します。 この場合、融合体は、互いに感染した細胞と感染していない細胞の両方であり得る。 しかし、シンシチウムは主に、HIV 感染の臨床症状を示す患者から分離されたウイルスによって誘発され、臨床症状を示さない感染者からは分離されません。
ウイルスのゲノムが細胞のゲノムに統合されると、潜伏感染の段階が始まります。 このとき、ウイルスは統合された DNA ゲノム、つまりプロウイルスの形で細胞内に存在します。 最近の研究では、ウイルスが細胞に侵入するとすぐに、翻訳と転写の両方が始まることが示されています。
病気の臨床徴候のない潜伏感染状態は 2 ~ 11 年間続くことがあります。 長い末端反復配列の活性化とウイルスタンパク質をコードする HIV 遺伝子の発現は、この疾患の兆候を示します。
HIV 遺伝子の発現を活性化する多くの因子が特定されています。 これらには、T リンパ球を活性化する因子が含まれます: 特異的抗原 (例、ヘルペス群ウイルス)、非特異的抗原 (例、フィトヘマグルチニンなどのマイトジェン)、サイトカイン (例、腫瘍壊死因子、一部のインターロイキン、インターフェロン ガンマ)、細菌免疫調節物質 (例えば、サルモネラ由来の脂質一リン酸)。 HIV 発現の活性化因子には、デキサメタゾンやヒドロコルチゾンなどのグルココルチコステロイド ホルモン、紫外線照射、過酸化水素、フリー酸素ラジカルなどがあります。 妊娠も感染プロセスを活性化します。 HIV は、精神のバランスが取れている人に比べて、精神的に不均衡で不適応な人々でより進行的に発症します。
細胞内でのウイルス再増殖のメカニズムはまだ完全には理解されていません。 細胞質では、ウイルスの RNA からの情報が逆リバース酵素によって DNA に書き換えられることだけが知られており、最初は一本鎖構造が形成されます。 次に、同じ逆転写酵素が第 2 鎖の形成をもたらし、ウイルスの DNA 転写酵素の直鎖状中間体が核に輸送され、そこでインテグラーゼ酵素の助けを借りて細胞染色体に組み込まれ、プロウイルスに変わります。 。
病気の発症における極めて重要な段階は、ウイルス粒子の集合と感染細胞からのウイルスの新しい子孫の放出です。 集合はリンパ球の原形質膜上で起こり、前駆体タンパク質を含むウイルス粒子のすべての成分がそこに入ります。 ウイルスは細胞の表面で芽を出します。 HIV の際立った特徴は、転写の活性化、前駆体タンパク質の合成、ビリオンの集合とその出芽のプロセスの爆発的な性質です。5 分間で、1 つのリンパ球細胞が最大 5000 個のウイルス粒子を形成することができます。
HIV 感染の病因における重要な問題は、免疫損傷のメカニズムです。 タンパク質 gp120、主要組織適合性複合体 (HLA) クラス II、および CD4 受容体には類似の領域が含まれており、HIV に対して形成される抗体とこれらの構造との交差反応が決定されます。 すべての有核細胞は HLA I 抗原を持っています。 ウイルスはまた、CD8+リンパ球によるウイルス感染細胞の認識に関与するこれらの抗原の合成を妨害し、感染細胞の溶解プロセスを阻害します。
免疫病原学的に、HIV 感染は、免疫系の T リンクおよび B リンクの欠損、補体、食細胞の欠損、および非特異的防御因子の機能の低下によって現れます。 その結果、アレルギー、自己アレルギー、および免疫複合体の病理学的プロセスの兆候を伴うアネルギーが形成されます。 すでにステージ II にある HIV 感染は、CD3+、CD4+、p24+、および gp120+ リンパ球による白血球の絶対数の減少、ナチュラルキラー (NK 細胞) レベルの増加、免疫抑制反応の増加によって特徴付けられます。コンカバリン A とフィトヘマグルチニンによるリンパ球遊走。 免疫の体液性リンクの変化は、IgG + B リンパ球の増加と血清 IgE レベルの 4 ~ 5 倍の増加によって現れます。
免疫の B リンクの変化は、B リンパ球の活性化によって特徴付けられます。 それらの代謝の変化には、血液中の細胞受容体 (P タンパク質) の濃度の増加に伴う免疫グロブリン受容体の交換の半減時間が伴います。 血清免疫グロブリンの総濃度は増加しますが、免疫グロブリンのサブクラスのレベルの不均衡が明らかになります。 したがって、患者の IgG1 と IgG3 の含有量は増加し、IgG2 と IgG4 の濃度は大幅に減少します。 明らかに、IgG2 レベルの増加は、ブドウ球菌、肺炎球菌、インフルエンザ桿菌に対する患者の高い感受性と関連しています。 高ガンマグロブリン血症、つまり血液中を循環する B リンパ球の数の増加にもかかわらず、マイトジェンに対する機能的活性は相対的に低下したままであるため、HIV 患者の B 免疫系は抑制されていると考えられます。 さらに、エイズ患者の末梢血中の B 細胞の数は 3 分の 1 以上減少する可能性があります。
多くの研究は、HIV-1 gp120 と CD4+ リンパ球の膜との相互作用が感染細胞の陰性反応を決定するだけでなく、非存在下でもプログラム細胞死、つまり成熟 CD4+ リンパ球または CD34+ 造血前駆細胞のアポトーシスを引き起こすことを示しています。彼らのウイルス感染について。
免疫細胞に局在するウイルスは、免疫系の手が届かない臓器や組織に侵入します。 感染プロセスの活性化は、抗体の形成を伴う体液性免疫応答を引き起こします。 しかし、ウイルスタンパク質gp120、HLAクラスII、および同様の部分のリンパ球CD4受容体の組成中に存在するため、形成された抗体はそれらと交差反応し、免疫系の機能における協力的な相互作用の違反を引き起こします。 これらすべてが自己アレルギー反応の形成を決定します。 そのため、感染過程の進行中に、主に HIV 抗原、特に gp41 および gp120 に対して遅延型および即時型の過敏症が形成されます。 患者の半数は、主に鼻炎、薬物アレルギー、蕁麻疹、アトピー性皮膚炎、血管浮腫などの明らかなアレルギーを発症し、家庭、表皮、花粉、食物アレルゲンに対する特異的 IgE レベルの増加を伴います。 IgE の総レベルと CD8+ リンパ球の含有量 (Yu.A. Mitin、1997)。
HIV 感染における免疫不全の形成は、CD4 表現型を持つリンパ球の敗北に限定されません。 HLA I タンパク質の合成が阻害されると、CD8 表現型を持つリンパ球、つまり T サプレッサーの機能が阻害されます。 p15 ウイルスタンパク質は、T 細胞による IL-2 および g-インターフェロンの産生を抑制する効果があります。 T 前駆体から T エフェクターを分化するには、IL-2、γ-インターフェロン、および IL-6 が必要であることが知られています。 また、IL-2 およびその他のサイトカインの産生は、体の抗ウイルスおよび抗腫瘍防御を担う細胞傷害性 T リンパ球の機能と密接に関連しています。
免疫系の敗北に加えて、造血組織も病理学的過程に関与します。 この病気は、白血球減少症、貧血、血小板減少症を特徴とします。 顆粒球の機能活性が阻害されます。 骨髄にHIV感染がある患者では、顆粒球、マクロファージ、巨核球のコロニー形成単位の含有量が急激に減少します。 現時点では、幹細胞の増殖活性の阻害の理由について明確な意見はありませんが、CD34+ 細胞に作用するさまざまな HIV 分離株がその機能活性を阻害することが確立されています。 HIV の作用による造血の抑制は、骨髄単球/マクロファージによる腫瘍壊死因子の産生の増加と関連していることもわかりました。
したがって、HIV 感染における免疫系の敗北は全身的であり、細胞性免疫の T リンクおよび B リンクの深い抑制として現れます。 HIV 感染の発症中に、即時型および遅発型過敏症、体液性免疫と非特異的防御因子、リンパ球と単球/マクロファージの機能活性の定期的な変化が発生します。 循環免疫複合体である血清免疫グロブリンのレベルを増加させます。 CD4+ リンパ球の欠損に加えて、CD8+ リンパ球、NK 細胞、好中球の機能欠損も病気の経過とともに増加します。 免疫状態の違反は、免疫複合体疾患に特徴的な症候群である免疫不全の感染性、アレルギー性、自己免疫性およびリンパ増殖性症候群によって臨床的に現れます。 これらすべてが HIV 感染症の全体的な臨床像を決定します。

HIV の細胞への侵入とその増殖の仕組み
生物物理学科。
"エイズ"
完了: アート。 グラム MID-195
プレデインA.E.
プガチェフ O.A.
チェック者: Kuznetsov A.A.
ウラジミール 1997
エイズは、20 世紀末に全人類が直面する最も重要かつ悲劇的な問題の 1 つです。 後天性免疫不全症候群(AIDS)は、免疫系および神経系への損傷を伴って起こり、重度の感染性病変や悪性新生物の発症によって現れる、ウイルス性の病因による疾患です。 エイズは複雑な科学的問題です。 エイズとの戦いは、有効な治療薬の欠如とワクチン接種の不可能によって非常に複雑になっています。 だからこそ、エイズ問題の関連性と感染を防ぐ効果的な方法についての一般住民への完全かつ客観的な情報である健康教育が、エイズの蔓延との戦いにおいて決定的に重要である。 世界保健機関は健康教育にも力を入れています。
最初の感染例はアフリカでは1959年に確認されており、米国では1977年以降に確認されている。 1987 年以来、新しい感染症の蔓延は流行病の様相を呈しています。 この病気は現在、世界 152 か国で登録されています。 現在、世界保健機関は約200万人のエイズ症例を登録しています。 HIV 感染者数に関するデータは情報源によって 1,300 万人から 2,000 万人まで異なりますが、そのうち少なくとも 800 万人がアフリカだけで発生しています。 権威ある予測によると、2000 年には世界の HIV 感染者数は 4,000 万人から 1 億 1,000 万人になるでしょう。 エイズ疾患は制御が困難ですが、その理由は次のとおりです。
1) 有効な治療手段が存在しない。
2)一次予防手段(ワクチン接種)の欠如。
3)エイズの影響を最も受けている集団との接触が困難である。 専門家らはワクチンの開発には8~20年かかるとみている。 この病気は、40〜90%という高い死亡率が特徴です。 最初のエイズの症例が報告されてから長い時間が経ちましたが、この病気が治癒または回復したという事実は一つもありません。 エイズ病原体のキャリアはすべて、潜在的に病気になっている可能性があります。 パスツール研究所のリュック・モンタニエの科学グループによって行われたウイルス学的研究
フランス)と国立がん研究所(米国)のロバート・ギャロは、1983年にエイズの本当の原因、つまり後にHIVと呼ばれるTリンパ向性レトロウイルス、ハイマン免疫不全ウイルス(HIV、ヒト免疫不全ウイルス)の発見を可能にした。
医師はすでに約 20 万人の症例歴を持っているため、エイズの臨床的特徴はこれまでにかなりよく研究されています。 病気を最初に認識することは最も困難です。 病気の進行がさらに進むと、患者は主に 3 つのタイプの障害を患うことになります(残念なことに、これらはさまざまな組み合わせで同時に存在し、特に重度の病気の経過を引き起こす可能性があります)。 まず第一に、患者の半数以上が細菌、真菌、ウイルス、さらには原虫によって引き起こされるさまざまな二次感染症を患っています。 これらは、口腔(「鵞口瘡」)または食道の粘膜のカンジダ症、ニューモシスティスまたはヘルペス性肺炎、小腸または大腸のクリプトスポリジウム症またはサイトメガロウイルス病変、さまざまな臓器および系の結核です。 患者の半数以上は、中枢神経系および末梢神経系の損傷によって引き起こされる神経障害や精神障害も抱えています(これらの障害の原因は、HIV自体とその「同盟者」であるクリプトコッカス、トキソプラズマ、単純ヘルペス、帯状疱疹ウイルスなどの両方です)。 )。 最後に、エイズ患者の 3 人に 1 人は、肉腫、神経膠腫、リンパ腫、黒色腫、その他の「...オーマ」など、さまざまな腫瘍を発症します。
疫学の観点から見ると、エイズは接触および垂直感染メカニズムを持つ人為的感染症です。 感染源は、病気のどの段階にある感染者でもあり、つまり、病気の臨床症状に関係なく感染します。 ウイルスの最も強力な伝染は、患者およびウイルス保因者との性的接触によって起こります。 同性愛者の接触時の感染リスクは特に高く、これは次の 3 つの理由で説明できます。
1) 同性愛者の接触の過程で、精液を伴う病原体が腸粘膜や肛門管の微小外傷を介して性的パートナーのベッドに直接侵入します。 直腸への静脈血供給が豊富であることを考えると、受動的なパートナーの感染リスクは高くなります。 陰茎の皮膚のびらんや亀裂を介してアクティブなパートナーが感染するリスクは非常に高くなります。
2) 直腸の上皮は、ウイルスの gp 120 が直接相互作用する受容体タンパク質 CD 4 が細胞表面に存在するため、エイズウイルスの貯蔵庫として機能し、それによって血行性を確保します。直腸粘膜の微小外傷がない場合でも、受動的なパートナーの体内に病原体が蔓延すること、および上記のメカニズムで能動的なパートナーに感染すること。
3) ランゲルガス細胞 - 直腸粘膜のマクロファージ。表面に CD 4 受容体タンパク質を持ち、その結果 HIV と相互作用する能力を持ち、感染して直腸粘膜から遊走した後、リンパの間質に定着します。さまざまな局在のノードが、マイクロファージシリーズの他の細胞要素に変わります。 形質転換されたマイクロファージはリンパ節内の T4 リンパ球と接触して感染し、体内でのエイズ病原体の蔓延に寄与します (図 1)。
HIV 感染のもう 1 つの基本的な要因は、感染した血液とその成分であり、血液、血漿、凝固系の VIII 因子または IX 因子の製剤の輸血中に感染が起こります。 HIV は、汚染された注射針、注射器、その他の器具を介して感染する可能性があります。
病原体(母親から胎児へ)の垂直伝播メカニズムは、経胎盤的に、または出産時に行われます。
記載されている病原体の伝播経路と要因に従って、疫学分析により、エイズのリスクが高いいくつかのグループを特定することができます。
1. 同性愛者および両性愛者。 現在、世界の他の国と比較してエイズ患者の数が最も多い米国では、患者の 73.6% がこのグループに分類されます。
2. 静脈内薬物投与を使用する薬物中毒者。 米国で登録されているエイズ患者のうち、このカテゴリーの患者の割合は 17% です。
3. 売春婦。 このグループの感染率は40%に達し、アフリカ諸国では最大90%に達します。
4. 血友病患者および時々血液またはその成分の輸血を受ける人。 フランスの専門家による研究 (Sultan Y., 1987) では、フランスでは血友病患者の HIV 感染率が 48% に達しているが、米国では患者の 2/3 以上が AIDS ウイルスに感染していることが示されています (Levine P. H., 1987)。
5. 長期かつ慢性的な経過をたどる梅毒およびウイルス性B型肝炎の患者。 梅毒とエイズの疫学的および部分的な病原性の関係は非常に重要であるため、多くの研究者はエイズを梅毒患者の日和見感染症とさえ考えています。
ウイルス性肝炎とエイズの疫学的な関係に関しては、次のことが証明されています。
a) 米国疾病管理センターに登録されたウイルス性 B 型肝炎患者の約 90% が上記の AIDS リスクグループに属します。
b) ウイルス性 B 型肝炎とエイズの蔓延の指数関数的な性質は非常に似ています。
c) AIDS 患者の約 80% は、B 型肝炎ウイルス感染の血清学的マーカーを持っています。
近年、ウイルス性B型肝炎とエイズの間には、病原体の共通の経路や伝播要因だけでなく、より根本的なメカニズムにも関連性があることが証明されています。 両方の病原体のゲノムには、ヌクレオチド組成の顕著な類似性を特徴とする領域があることが判明した(Noonan C.、1985; Jerom B.、1986)。
6. HIVに感染した母親の子供。 血清陽性の母親の子供は、ケースの 75 ~ 90% で経胎盤感染または出産時に感染します。
エイズウイルスの感染経路と要因を考慮すると、握手、ハグ、キス、家庭用品、食器などを介した接触および家庭内手段によるHIVの感染が強調されなければなりません。 -それは不可能です。 吸血節足動物(蚊、蚊、ダニなど)を介した感染手段による HIV の感染に関する信頼できるデータはありません。
HIV はレトロウイルスのファミリーに属します。つまり、そのゲノム (RNA を含む HIV) がヒトの遺伝子、たとえば血液細胞、リンパ球、または脳細胞のゲノムに組み込まれるウイルスです。
レトロウイルスの名前の由来は、ゲノムにコードされており、RNA テンプレート上で DNA を合成できる、珍しい酵素である逆転写酵素に由来しています。 したがって、HIV は、「ヘルパー」T4 ヒトリンパ球などの宿主細胞内で、そのゲノムの DNA コピーを産生することができます。 ウイルス DNA はリンパ球のゲノムに含まれており、その発現により慢性感染症が発症する条件が生み出されます。 DNAは細胞の遺伝装置に組み込まれ、その生命活動を変化させ、その結果、この細胞内でウイルスタンパク質が形成され始めます。 これらの「レンガ」は折りたたまれてウイルス粒子全体になり、外部に出て、まだ誕生していない他の細胞に侵入します。 親細胞はすぐに死んでしまいます。 HIV が宿主細胞のゲノムに組み込まれているという事実は、感染を抑制するだけでなく破壊する抗ウイルス薬の開発にとって非常に困難な障害となることが判明します。
免疫不全ウイルスは非常に小さく、7 万から 10 万個のウイルス粒子が長さ 1 cm の線に収まります。 HIV はすべてのレトロウイルスに典型的な表面膜を持ち、棒状または円錐状の特徴的な核様体 (コア部分) を含んでいます (図 2)。 ビリオンのコアには 3 種類のタンパク質が同定されています。p24、p18、および p15 で、分子量は 24、18、および 15 キロダルトンで、これらは顕著な抗原性を持っています。 免疫電子顕微鏡検査により、p18タンパク質は内側でウイルスエンベロープに隣接し、p24はコア構造を直接覆う層を形成し、p15はRNA分子に結合することが明らかになった。 ビリオンのコアには 2 つの RNA 分子と逆転写が含まれています (図 3)。 ウイルスのエンベロープには、gp 120 と呼ばれる上膜部分と、gp 41 と呼ばれる膜貫通部分からなる gp 160 糖タンパク質が含まれています。gp 120 のアミノ酸組成は非常に多様です。 これは、近年、HIV の抗原特性が 30% 変化したという事実を説明しています (図 4)。
エイズウイルスのゲノムには、9つの遺伝子を形成する約9200個のヌクレオチドが含まれており、それらは半ヌクレオチド鎖の両側の長い環状反復によって制限されています。 HIV の遺伝子構造は、3 つの構造遺伝子と 6 つの調節遺伝子の存在によって特徴付けられます。 このウイルスは感染時に人体に侵入し、最初は姿を現さず、「適応」してさまざまな臓器や組織に広がります。 HIV 感染のいわゆる潜伏期間は数週間続きます。 この時点ではすでに感染していますが、感染を検出することはほぼ不可能です。 その後、感染者は多くの場合 (常にではありませんが)、急性期の HIV 感染症を発症し、「インフルエンザのような病気」として進行します。
HIV のライフサイクルには、いくつかの連続した段階が含まれます (図 5)。 第 1 段階では、gp 120 ウイルスのエンベロープタンパク質と標的細胞の受容体タンパク質との特異的な相互作用が起こります。 次に、ウイルス粒子はエンドサイトーシスによって細胞に捕捉され、細胞質の膜から放出されます (「脱衣」段階)。 おそらく、細胞プロテインキナーゼによる HIV タンパク質の活性化が、ウイルスの細胞への侵入に基本的な役割を果たしていると考えられます。 このステップの後、逆転写を使用してウイルス RNA テンプレート上で DNA が合成されます。 新たに形成されたウイルス特異的 DNA の分子はリング状の形をとり (環状化)、細胞質から核に移動し、そこで感染細胞のゲノムに組み込まれます (統合)。 ウイルス特異的な DNA の一部は、宿主細胞の DNA と統合されずに細胞質内に長期間残ります。 ウイルス遺伝子の発現は最終的にウイルス特異的な RNA とタンパク質の生成につながり、これが感染細胞の表面から「発芽」する新しいビリオンのその後の集合を決定します。
現在、エイズの原因物質としては、HIV-1、HIV-2、HIV-3 の 3 つが知られています。 HIV-1 (上記) は、主に北アフリカとヨーロッパで病気を引き起こします。 1986 年、パスツール研究所の職員は、西アフリカの患者からエイズの原因物質の別の変異体である HIV 2 を分離しました。 それはサル免疫不全ウイルスによりよく似ています。 現在、エイズ患者およびウイルス保有者の HIV 2 感染率は 0.2% です。 1988 年に、南アフリカに住むエイズ患者から HIV-3 が確認されました。
HIV 2の抗原組成は、HIV 1の抗原組成とは異なる。表面エピ膜糖タンパク質は、gp 120 よりわずかに低い分子量を有し、gp 105 と呼ばれる。 しかし、gp 105 は、標的細胞の k レセプタータンパク質に対して同様の顕著な親和性を示します。 HIV 2 のコアタンパク質の中では、タンパク質 p 26 および p 16 の抗原性特性により同定されました。
HIV 2 のゲノムは HIV 1 よりも若干大きく、9671 個のヌクレオチドを持っています。 レンダリングされた 2 つのエイズ病原体のゲノム構造は、HIV 2 調節 vpx 遺伝子が HIV 1 RNA のほぼ同様の領域に位置する vif 遺伝子とは特徴が異なる点を除いて、一般原則に従って構築されています。 HIV 2 は感染力が弱いという特徴があり、このウイルスによって引き起こされるプロセスは、HIV 1 の感染よりも無症候性保菌期間が長いと考えられています。 HIV 2 と HIV 1 は両方とも、物理的環境要因と最も一般的な消毒剤の作用に対する耐性が比較的低いという特徴があります。 0.5%次亜塩素酸カルシウム溶液、50~70%エチルアルコール溶液の影響下で、ウイルスは数秒以内に不活化されます。 しかし、HIV は紫外線や X 線の作用に対して比較的耐性を示します。
HIV の病原性作用と、免疫担当細胞の受容体装置の構成要素に対するウイルスのエンベロープ構造の高い親和性との間に最も密接な関係があるという事実は、完全に明白であると思われる。 CD4 と呼ばれる細胞受容体に対するウイルス膜糖タンパク質 gp120 (HIV-2 の場合は gp105-) の親和性により、HIV が標的細胞に感染することが可能になります。細胞質膜上では、AIDS の原因物質の標的細胞がヘルパー T リンパ球、マクロファージ、単球であることが明らかになります。 非免疫担当細胞要素から、CNS の星状膠細胞 - グリア細胞、直腸粘膜の上皮細胞および血管内皮細胞は、CD4 のキャリア、したがって HIV 保有者であると考えることができます (Ward J. M. et al., 1987)。 同時に、HIV 感染の発症の最も初期の段階では、T リンパ球のヘルパー/誘導因子 (CD4+ - リンパ球) が敗北します。 これまで、gp120 エンベロープタンパク質が T ヘルパー/インデューサー膜上の CD4 に付着(接着)した後、ウイルス粒子の受動的エンドサイトーシスが発生するという明確な意見は、今日では補足および修正することができます。 以前に記載された gp41 糖タンパク質が、HIV の標的細胞への侵入において極めて重要な役割を果たすことが示されています (Weber J. N.、Weiss R. A.、1988)。 研究者らは、ウイルスが接着した後、結果として生じる超分子複合体 (gp120 (gp105)-CD4) が移動し、T ヘルパー/インデューサー膜上のゾーンが解放されて gp41 と接触すると考えています。 後者は、影響を受けた細胞の原形質膜に「ねじ込み」、その後のビリオンの細胞への侵入が大幅に促進されるようにその特性を変更します。 これは、インビトロでのHIVと標的細胞間の相互作用プロセスに対するgp41に対するモノクローナル抗体の効果の研究結果によって確認されており、それによると、これらの抗体はウイルスと細胞の融合をほぼ完全に阻止した。 得られたデータはおそらくエイズウイルスに対するワクチンの作成に使用されるでしょう。
gp120 分子の構造には、タンパク質受容体の細胞外部分の特定の領域と組成が非常に似ており、したがって抗原特性が非常に似ている領域があることが説得力をもって示されています (Kulberg A. Ya., 1988)。そしてポリペプチドホルモン。 gp120 と指定された受容体タンパク質のアミノ酸組成の相同性の程度は 40 ~ 45% に達します。 13 の HIV 分離株のクラス II およびエンベロープタンパク質の HLA 抗原 (白血球組織適合性抗原) の保存領域のアミノ酸配列の分析により、HLA-DR および HLA-DQ 抗原の N 末端ドメイン (アミノ酸 19) の相同性が明らかになりました。 -25)およびgp41タンパク質のC末端ドメイン(アミノ酸838〜844)(Golding H.ら、1988)。 したがって、表面 HIV 糖タンパク質 gp120 と gp41 は両方とも、AIDS 患者における自己免疫反応の誘導因子です。
HIV 感染を背景とした自己免疫過程の機構の特徴付けに重要な追加事項は、Stricker R.B. et al. (1987) による研究結果であり、それによると、これらの条件下での抗体の異常な産生も HLA に対して向けられているとのことです。 -DR 粘膜のランゲルハンス細胞の表面に見られる多型抗原。
HIV 感染患者における免疫不全の形成における自己攻撃メカニズムの役割の分析を要約すると、エイズ ウイルスの発見者の 1 人であるリュック モンタニエ教授の結論を引用するのが適切です。エイズは自己免疫プロセスに基づいています。 HIV の直接的な細胞変性効果ではなく、ヘルパー T リンパ球に対する効果に焦点を当てています (Montagnier L.、1987)。
しかし、ウイルスの直接的な細胞変性効果は、CD4+ 細胞亜集団の進行性枯渇に伴ってますます重要になり、これは長い間、自己免疫起源の現象として残っています (図 6)。
HIV は、CD4+ リンパ球の死滅を加速することに加えて、ウイルスに感染した細胞集団のサイズを制御する細胞による感染した T ヘルパー/インデューサーの認識プロセスを妨害します。 私たちは、原形質膜上に CD8 受容体を運ぶ T サプレッサー/細胞傷害性リンパ球の一部について話しています。 これらの CD8+ リンパ球は、ウイルス感染細胞の表面にあるウイルス誘発性抗原を「認識」することにより、ウイルス感染細胞を認識します。 しかし、そのような認識に不可欠な条件は、感染細胞の表面に、ウイルス誘導抗原とともに主要組織適合性複合体クラス I (MHC I) のいわゆるタンパク質が存在することであるはずです。 これらのタンパク質は、核を持つすべての細胞の細胞膜上に存在します。 これらの膜抗原を同定すると、CD8+ - リンパ球はウイルスの影響を受けた細胞を破壊します(図 7)。
他のウイルス感染の原因物質とは異なり、HIV は明らかに、CD8+ リンパ球が認識できない構造が変化した MHC I タンパク質の合成をコードしています。 その結果、細胞膜上にウイルス誘発抗原が存在するにもかかわらず、感染した CD4+ 細胞の T 細胞傷害性リンパ球による溶解は起こりません。
感染した CD4+ リンパ球の破壊はある程度までは行われますが、おそらく別の方法で実現されます。 CD4+ 細胞の表面に付着ビリオンがあり、HIV に対する抗体が血流中に存在する場合、そのような細胞は抗体依存性細胞傷害のエフェクターであるリンパ球によって破壊されます。 この仮説は、HIV キャリアである血友病患者の臨床観察で確認されました (Ekert H.、1987)。
それにもかかわらず、このような感染細胞の除去機構は、その代償的性質および佐野原性の方向にもかかわらず、細胞性免疫の機能を確保する上で中心的な役割を果たすCD4+リンパ球の部分集団の枯渇の進行にマイナスの寄与をしている。 実際、CD4+ リンパ球は、一方では抗原提示細胞の表面にある抗原を認識します。 その一方で、細胞間の直接接触やリンホカイン(インターロイキン-2、ガンマ-インターフェロン)の分泌を通じて、免疫応答の動態における免疫担当細胞の協力を確保します。 上記を考慮すると、なぜ CD4+ 細胞の数の減少とその機能的劣性の形成がそのような多面的な不均衡を引き起こし、最終的には免疫応答の欠乏につながるのかが明らかになります。
HIV 感染過程の初期段階、つまり CD4+ 細胞数の顕著な減少がまだ見られない段階では、T ヘルパー/インデューサーの調節機能の障害が、感染症の発症において特に重要であることを強調する必要があります。免疫システムのアンバランス。 上記のことは、Harper ME (1986) による研究結果によって確認されており、それによれば、感染したCD4 + - リンパ球の割合はその数の0.01%を超えない。 感染したリンパ球の数が極度に少ないことと、免疫不全の顕著な症状との間の一見矛盾のもう一つの説明は、おそらく HIV エンベロープの成分であるタンパク質の性質を持つ「可溶性抑制因子」の感染細胞による分泌に関するデータである可能性があります。 可溶性サプレッサー因子は、CD4+ 細胞と他のリンパ球部分集団との協調相互作用を著しく妨害します。
Cheynier R.らの結果。 (1988) によると、HIV-1 はインビトロで CD8+ リンパ球 (T サプレッサー/細胞傷害性細胞) でも活発に複製することができます。 CD8+ 細胞における HIV 複製が in vivo で起こるのであれば、その後のウイルスによる T サプレッサー亜集団の不活化が、HIV 感染者における自己免疫応答の発症に寄与する重要な追加因子であると考えられます。 一方、この現象は、一部のエイズ患者ではヘルパー T とサプレッサー T の両方の末梢プールが枯渇しているという一見驚くべき事実を説明できる可能性があります。
CD4+ 細胞と他のサブクラスのリンパ球の間の機能的接触を破壊するもう 1 つの重要なメカニズムは、CD4+ リンパ球が特殊な細胞によって提供される HIV 抗原を認識できないことです。 抗原提示細胞(マクロファージなど)の表面に現れる抗原をCD4+リンパ球によって同定するプロセスは、後者の細胞膜にもう1種類の主要組織適合性複合体クラスがある場合にのみ可能であることを思い出してください。 II (MHC II) 抗原-タンパク質。 MHC IIタンパク質の受容体を有する抗原認識CD4+リンパ球は、外来抗原とMHC IIタンパク質の両方を同時に識別し、この場合にのみそれらの反応性増殖が起こり、免疫応答が形成されます(図8)。
マクロファージのエイズウイルス感染は、HIV 抗原の CD4 + 依存性認識の違反を伴います。一方で、マクロファージはその表面で MHC II タンパク質の発現を停止しますが、他方では、CD4 + 受容体 - HIV に感染したリンパ球は、マクロファージ II の細胞膜上に現れる MHC タンパク質さえも認識されないように改変されます。 どちらの場合も、CD4+ リンパ球は抗原提示マクロファージの情報を認識しません。
また、マクロファージによるヘルパー T/インデューサーへの抗原提示プロセスの基礎となる、ヘルパー T-ヘルパー/インデューサー表面の CD4 受容体に対するマクロファージ MHC II タンパク質の親和性が、gp120 の親和性と同じくらい近いことも強調すべきです。名前付き受容体の形成に。 感染細胞によって発現される gp120 が CD4 受容体をめぐって MHC II タンパク質と競合し、マクロファージとリンパ球の協力のプロセスを妨害するのはこのためです。
前述の内容は、エイズにおける単核孫細胞系の機能不全の全範囲を網羅しているわけではありません。 患者の単球およびマクロファージは、殺菌および殺真菌活性の低下、および走化性の能力、ならびに免疫グロブリンのFcフラグメントに対する受容体の機能の低下を特徴とする。 Fc受容体の欠陥は、循環免疫複合体によるFc受容体のかなりの部分の遮断と、受容体のリサイクリング強度の低下によるものです。 これらの違反は、エイズ患者の炎症反応活動性の低下の主な理由を説明します。
ナチュラルキラー、キラー、細胞傷害性 T 細胞の細胞傷害特性を持つ免疫担当細胞のサブクラスの機能的生存率は明らかに低下します。 この現象のメカニズムは最終的には確立されていません(図9)。
HIV 感染を背景とした免疫 B システムも影響を受けます。 この場合の B 細胞機能不全の最も特徴的な兆候の 1 つは、B 細胞のポリクローナル活性化であり、高ガンマグロブリン血症 (ポリクローナル ガンマグロブリン血症) の発症につながります。 すべてのクラスの免疫グロブリンの含有量が増加しますが、血清中のクラス A と G は特に異なります。 血清中の免疫グロブリンのレベルは、潜伏期から始まり、HIV 感染の進行とともに増加し、AIDS 関連症状複合体の段階で最大に達します。 進行したAIDSの段階では、IgAを除いて免疫グロブリンの含有量が大幅に減少し、IgAのレベルは増加し続けます。 多くの研究は、その生物学的活性の程度が T リンパ球によって制御されているエプスタイン・バーウイルスなどの潜伏性 B リンパ指向性ウイルスの再活性化による可能性があることを示唆しています。
HIV 感染状態では血清免疫グロブリンの総濃度が増加するという事実にもかかわらず、患者では免疫グロブリン サブクラスのレベルに特徴的な不均衡があり、例えば IgG および IgG 4 が大幅に減少します。 IgG 2 レベルの進行性の低下は、ヘモフィルス、肺炎球菌、黄色ブドウ球菌などの微生物の病原性作用に対する HIV 感染患者の感受性の増加を説明できる可能性があります。 さらに、自発的に抗体を分泌する循環 B リンパ球の数が増加しているにもかかわらず、これらの細胞はマイトジェン (たとえば、ヤマゴボウのマイトジェン) の作用に対して比較的抵抗力があり、また、ネオアンチゲンに対する応答が非常に弱いという特徴もあります。 。 したがって、高ガンマグロブリン血症にもかかわらず、HIV 感染患者の免疫 B 系の機能状態は、重度の低ガンマグロブリン血症を背景としたものと同様です。
エイズは免疫系の欠乏によって現れる病気です。 後者の用語は、細菌、ウイルス、病原性真菌、その他の外来因子から身体を保護する一連の機構を指します。 人体では防御機能を発揮するために、胸腺 (胸腺)、骨髄、リンパ節、脾臓、その他の組織を含む免疫系が存在します。
免疫系の最も重要な細胞は、リンパ球、マクロファージ、単球です。 彼らはHIVの受容体を持っています。 免疫系の主要細胞であるリンパ球は、T リンパ球と B リンパ球に分けられます。 T リンパ球は、ヘルパー T とサプレッサー T に分けられます。 HIV は主に T ヘルパーに影響を及ぼしますが、程度は劣ります。
マクロファージの程度。 神経膠細胞(神経系)もエイズの原因物質に対して非常に敏感です。 HIV は、肝細胞 (肝臓細胞)、心細胞 (心臓細胞)、その他の細胞、さらには骨組織にも直接感染する可能性があります。
ウイルスと人体の細胞の相互作用は、それらの中にある特別なタンパク質構造、いわゆる受容体が存在することによるものです。 ウイルス受容体は、ウイルスと特定の細胞の「親和性」を決定するウイルスの一部です。 細胞受容体は細胞膜の一部であり、その分子構造は特定の分子(ウイルス受容体)に対する選択的親和性とそれらと相互作用する能力を特徴としています。 人体の多くの細胞 (T リンパ球、マクロファージ、神経膠細胞など) は、gp 120 をバイパスしてウイルスエンベロープの抗原と相互作用する特別なエンベロープタンパク質 CD 4 を持っています。ウイルスの糖タンパク質 gp 120 は「適合」します。ロックの鍵のように CD 4 に接続します。 CD 4 と gp 120 の相互作用により、HIV が細胞に付着し、その後ウイルスが細胞に侵入します。
マクロファージは食細胞です。 微生物や他の外来抗原を捕捉する細胞。 マクロファージには、移動可能なマクロファージ (血液細胞単球) と、異なる組織に固定された静止したマクロファージがあります。 マクロファージは、脳にも含めて、ほぼすべての組織に存在します。 したがって、マクロファージは「ユビキタス」細胞と呼ばれます。 マクロファージは、HIV などの体内に侵入した外来物質を最初に認識します。 ヘルパーである T リンパ球と同様に、マクロファージには CD4 受容体があり、HIV がマクロファージに付着して細胞に侵入することを可能にします。 「遍在する」マクロファージは、体全体の HIV の敗北に貢献します。 確かに、T ヘパーとは異なり、マクロファージの表面には CD4 マーカーの分子はそれほど多くありません。 さらに、HIV はマクロファージに損傷を与えますが、マクロファージを破壊することはありません。 エイズウイルスによって損傷を受けたマクロファージは、外来物質の認識がはるかに悪く、それらをうまく「消化」できません。
CD 4 を含む T ヘルパー/インデューサーは、総称して「免疫オーケストラの指揮者」と呼ばれており、免疫応答の発達において中心的な役割を果たしています。 抗原と接触すると、これらの遺伝子は分裂して、インターロイキン 2、インターフェロン、B リンパ球の成長分化因子などのリンホカインを生成することで応答します。 これらのリンホカインは、他の種類のリンパ球、特に細胞傷害性/抑制性 (CD 8) T リンパ球や抗体産生 B リンパ球の増殖と成熟を制御する局所ホルモンとして機能します。 さらに、リンホカインは、単球および組織マクロファージの成熟および機能に影響を与えます。
感染後、最初の抗体の産生は妨げられません。 この時点でのウイルスのエンベロープおよびコアタンパク質に対する抗体の出現は、感染の主な兆候としても機能します。 その後、すべてのクラスの免疫グロブリンの血清濃度が増加します。これは、B リンパ球のポリクローナル活性化を示します。 この理由は完全には明らかではありませんが、ウイルスによる B リンパ球の直接的な活性化があると考えられるかもしれません。 病気の後期には、免疫グロブリンの濃度が低下する傾向があります。
HIV は、T 細胞によって媒介される免疫応答に対して最も強い影響を及ぼします。 他のウイルス感染と同様に、細胞傷害性 CD8 サプレッサー細胞の数は、感染後の最初の数日または数週間で増加する可能性があります。 同時に、健康な血清陽性患者では、リンパ球および T 細胞のさまざまな部分集団のレベルは正常のままである可能性があります。 しかし、この段階でも、試験では対照抗原(破傷風トキソイドや精製タンパク質誘導体など)に対する増殖反応の低下が示されています。 どうやら、これはインターロイキン 2 の生産量が少ないためです。人は長期間 HIV に対する抗体を持ち (つまり、血清陽性)、その間は健康を維持することができます。 それにもかかわらず、CD4-ヘルパー/インデューサーの数は着実に減少しており、これは新たな臨床症状の出現とともに、疾患の進行を示しています。 その後、顕著な臨床像が現れ、CD 8 - リンパ球の数も減少します。
リンパ節腫脹のある患者では、リンパ節生検により多くの肥大した濾胞が明らかになり、多くの場合、細胞枯渇を伴う CD 8 リンパ球の浸潤が見られます。 後期では、リンパ節のサイズが正常に戻ると、卵胞は「燃え尽き」ていることが判明し、正常な構造が失われ、細胞が小さくなります。
最も単純な仮定によれば、免疫不全の原因は、ウイルスによる T ヘルパー/誘導因子の破壊、そしておそらく単球やマクロファージの破壊である可能性があります。 別の可能性としては、CD 4 に結合するウイルスエンベロープ糖タンパク質が、ヘルパー/インデューサーと他の種類の細胞との相互作用に関与しており、これによりヘルパー/インデューサーの通常の活性がブロックされる可能性があります。 自己免疫応答が免疫抑制に関与している可能性があることも示唆されています。 患者では、リンパ球減少症に加えて、好中球減少症、貧血、または血小板減少症が観察されることがありますが、これらの現象は自己免疫抗体の産生によって説明されます。 免疫複合体が患者の血清中に発見されたものの、そのような抗体の形成に関する説得力のあるデータはまだ入手できていない。 ただし、これらはウイルス抗原とそれに対する抗体です。
感染した CD4+ - リンパ球が免疫細胞傷害性 CD4+ - T 細胞の標的として機能する可能性があります。 しかし、もしそうであれば、ウイルスに感染した細胞の破壊は細胞傷害性 T リンパ球の正常な機能であるため、おそらく自己免疫反応ではなく、防御反応について話していることになります。 しかし、この場合、細胞傷害性 T 細胞が実際に CD4+ 細胞を殺すのであれば、これは免疫系に最も有害な影響を与えるに違いありません。
エイズ - 第 1 グループの指標疾患:
食道、気管、気管支、肺のカンジダ症。
肺外クリプトコックス症(ヨーロッパブラストミシス症)
下痢が1か月以上続くクリプトスピリドーシス。
生後1か月以上の患者における、あらゆる臓器(肝臓、脾臓、リンパ節に加えてリラを除く)のサイトメガロウイルス病変。
皮膚に潰瘍性病変を伴う単純ヘルペスウイルス感染症(または1か月以上持続する粘膜、または生後1か月以上の患者では任意の期間のヘルペス性気管支炎、肺炎、または食道炎)。
60歳未満の患者におけるカポジ肉腫。
60歳未満の患者における脳のリンパ腫(原発性)。
13歳未満の小児におけるリンパ球性間質性肺炎または肺リンパ球過形成(LI/LH複合体)。
さまざまな臓器(肺、皮膚、頸部リンパ節、肺門リンパ節を除く、またはそれに加えて)に病変があるグループの細菌によって引き起こされる播種性感染症。
ニューモシスチス肺炎。
進行性多巣性白質脳症。
生後1か月以上の人の中枢神経系のトキソプラズマ症。
エイズ診断は、エイズのマーカー疾患の存在に基づく疑わしいイムノブロットでも行うことができ、患者に免疫不全の他の理由がない場合にのみ信頼性が確認されます。
AIDS マーカー疾患の発症の 3 か月以内に、高用量または長期間の全身コルチコステロイド療法、および他の免疫抑制剤または細胞増殖抑制剤による治療。
AIDSの診断後3か月以内に検出された以下の疾患のいずれか - マーカー感染症、ホジキン病、非ホジキンリンパ腫(原発性脳リンパ腫を除く)、リンパ性白血病、多発性骨髄腫、リンパ網状またはリンパ網のその他の悪性腫瘍組織球性組織、抗免疫芽球性リンパ節腫脹。
3. HIV感染症とは似ていない先天性または後天性免疫不全症(例えば、低ガンマグロブリン血症を伴う)。
HIV 感染が検査室で確実に確認された場合、多くの感染症や腫瘍がエイズ指標疾患のリストに含まれます。
1) 13歳未満の小児における細菌感染症、合併または再発(2年間の観察で2例以上)敗血症、肺炎、髄膜炎、骨または関節の病変、インフルエンザ菌、連鎖球菌によって引き起こされる膿瘍。
2) 播種性コクシジオイデス症(肺外局在)。
3)HIV脳症(「HIV認知症」、「エイズ認知症」)。
4) 肺外局在を伴う播種性低プラズマ症。
5) 下痢が1ヶ月以上続く等胞子症。
6) あらゆる年齢層のカポジ肉腫。
7) あらゆる年齢層の脳のリンパ腫(原発性)。
8)その他のB細胞リンパ腫(ホジキンドールを除く)または未知の免疫表現型のリンパ腫:
a) 小細胞リンパ腫(バーキットリンパ腫など)
b) 免疫芽球性肉腫(免疫芽球性リンパ腫、大細胞リンパ腫、びまん性組織球性、びまん性未分化)。
9) 肺、頸部リンパ節または基底リンパ節の皮膚に加えて病変を伴う播種性マイコバクテリア症(結核ではない)。
10)肺外結核(肺以外の臓器に損傷を伴う)。
11) 非サルモネラ菌「ティフィ」による再発性サルモネラ敗血症
12) HIV ジストロフィー。
急速に増え続ける科学的事実
さまざまな患者グループにおける HIV 感染の性質に関するウイルス学的、免疫学的および分子生物学的領域により、
3 つの主要な質問を定式化します。その答えは、HIV の病因についての理解を大きく前進させるでしょう。
1. 初期の急性ウイルス血症をうまく制御し、リンパ節の胚中心での HIV 複製を抑制する要因は何ですか?
2. ウイルスの複製と免疫系制御の間の不安定なバランスに乱れを引き起こす要因は何ですか?
3. 潜伏期間が長い患者と、数年間エイズを発症する大多数の HIV 感染者との違いは何ですか?
ヒト免疫不全ウイルスの際立った特徴は、感染中に発生するウイルスのさまざまな変異が非常に多様であることです。 これは、HIV 複製の重要な酵素である逆転写酵素によって引き起こされます。逆転写酵素は、細胞ゲノムを転写するときに細胞酵素よりも、ウイルス ゲノムを複製するときよりも 100 万倍頻繁にエラーを起こします (1,000 塩基対あたり 1 個のエラー、つまり、ウイルス ゲノムごとに 10 個のエラー) )。
免疫系は主に蔓延しているウイルス集団に反応し、さらに時間の遅れを伴いながら、新たに出現したウイルスの変異体が特定の細胞内でしばらく妨げられずに増殖する可能性があります。 病気の進行中に、患者の免疫系の選択的な影響下でウイルスの新しい変異体が出現します。 ウイルスのこれらの変異体は、さまざまな生物学的特性によって区別されます。 ウイルスに関する現在の知識レベルに対応した最新の分類によれば、ウイルスの変異体は、細胞培養中で高力価(R/H)で急速に増殖するウイルスと、ゆっくりと少量しか増殖しないウイルスに分類されます。
もう1つの基準は、ウイルスのさまざまな変異体の細胞病原性の特性であり、これは巨細胞の出現という場合もあれば、感染細胞と未感染細胞の融合によって機能的に無能なシンシチウムが形成される場合もある。 ウイルスのこれらの変異体は SI と呼ばれます。 細胞病原性の特性を示さないウイルスの変異体は、NSI と呼ばれます。 最近の研究では、免疫系の選択的作用によって引き起こされる HIV 感染の過程においてのみ、毒性の強い変異体 (R/H/SI) が攻撃性の低い変異体から生じることが確認されています。 これらの高病原性変異体の出現は、リンパ組織および血液中での HIV の爆発的な増殖と相関し、疾患の臨床像を悪化させます。
患者の体内の病原体そのものを特定することによってのみ、HIV 感染とエイズの存在を確実に証明することが可能です。 ただし、これを行うのは非常に困難です。 AIDS を診断するためのより一般的な方法は、さまざまな免疫学的反応 (酵素免疫測定法、蛍光抗体法、ラテックス凝集試験、イムノブロッティング) を使用した特定の抗ウイルス抗体の検出に基づいています。
HIV に対する抗体 (抗 HIV-AT) の検査。
過去 3 年間で、HIV 抗体検査により、ウイルスの疫学に対する私たちの理解が劇的に変わりました。 抗HIV抗体はウイルス感染後3週間から3か月の間に出現し、その後はウイルスがリンパ球の機能や抗体産生をある程度抑制しても、ほぼ常に検出可能になります。 しかし、検出される中和抗体の力価は低く、その効果はわずかであり、感染や病気の発症を顕著に阻止するものではありません。
診断目的のために、HIV は細胞株から大量に分離され、精製され、すべての血清学的検査の抗原として使用されます。 抗 HIV-AT 検査にはいくつかの種類があります。 ほとんどのテストでは抗原と酵素の複合体が使用され、シグナルは特異的に結合した酵素とその基質の間の発色反応です。 他の検査では、放射性同位体、抗原とフルオレセインの結合、またはウイルスでコーティングされたラテックスまたはゼラチン粒子の凝集を使用します。
抗 HIV-AT 検査は 1985 年に商品化されて以来、診断および輸血研究室で広く使用されています。 検査の精度 (感度と特異度の両方) は着実に向上しており、偽陽性や偽陰性は少なくなってきています。
HIV 抗体を「簡単に」検出する検査に加えて、免疫応答の特定の要素を検出するためのより微妙な検査があります。 個々の HIV タンパク質に対する応答は、免疫ブロット法と放射性免疫沈降法によって詳細に研究されています。 これに加えて、血液やその他の体液中の免疫グロブリンの個々のクラスを決定することが可能になります。 特に興味深いのは、抗 HIV クラス M 免疫グロブリン (IgM) で、感染の初期に IgG 抗体よりも若干早く出現するためです。 したがって、この場合、IgM 抗体が最初に形成されます。
検査の簡易版は、最適ではない実験室条件下での抗 HIV-AT の集団スクリーニング用に開発されています。 移植前など急いで結果を知りたい場合にも便利です。 唾液を診断材料として利用する可能性も検討されている。
抗体に加えて、血清にはウイルス抗原、特にビリオンコアの主要タンパク質 (p24) が含まれています。 それに対する抗体がまだ過剰な状態、通常は感染の初期段階で検出できます。 HIV 抗原検査は現在、抗体検査の補助として検討されています。 これらは、感染の初期段階の診断や子供の感染の認識に役立ちます。 後期では、血清中の HIV 抗原の存在は免疫力の低下を示しており、抗ウイルス療法の適応となる可能性があり、抗原検査を繰り返して追跡調査します。
リンパ球から HIV を分離する能力によって示されるウイルス血症は、ウイルスの他のタンパク質に対する抗 p24 および抗体の高い力価を背景に検出できます。 しかし、ウイルスの分離は時間のかかる手順であり、抗体がほとんどまたはまったくない人に対して HIV の検査室診断を成功させるには、定期的に追跡サンプルを採取することがより重要です。 感染後の感染の進行を観察すると、通常、HIV に対する抗体の力価と抗体セットの両方が増加することが示されています。 数か月前またはそれ以前に感染した人は、ほとんどの場合、強い抗ウイルス反応を示します。 したがって、抗 HIV-AT に対する反応が持続的に悪い場合は、割り引いて考える必要があります。
将来的には、抗 HIV-AT 検査がより迅速かつ実用的になる可能性があります。 おそらく、彼らは合成抗原やその他の技術革新を使用するでしょう。 最新の抗 HIV-AT 検査キットは、HIV-2 などの関連レトロウイルスに対する抗体も検出します。 おそらく、ウイルスの構成要素(抗原やゲノム)を検査するためのキットや、単独で使用できるキットが登場するでしょう。
ワクチン開発の機会。
エイズワクチンの開発は複雑で多面的な問題です。 このようなワクチンは、まず次の要件を満たしている必要があります。
a) HIV が中枢神経系の構造 (中枢神経系) に侵入する前に中和を引き起こします。この場合、免疫担当細胞に対するウイルスの利用は最小限になります。
b) HIV のすべての抗原変異体の免疫系の認識を確実にする。
c) 年齢や性別、体内に存在する HIV の量に関係なく、ワクチン接種を受けたすべての人々の保護を保証する。
d) ワクチン自体がエイズの発症を引き起こすリスクを排除する。
原則として、次のタイプのワクチンを作成することが可能です: 不活化サブユニットと合成。 不活化された HIV 株をワクチンとして使用する実験が現在、J. ソーク (米国) の研究室で行われています。 ただし、ワクチン接種の過程でエイズのリスクがある程度あるため、この生物学的製剤の範囲は大幅に制限されています。 このようなワクチンは、すでに HIV に感染している人の免疫反応を刺激するためにのみ使用できます (いわゆる暴露後予防)。これまでのところ、J. ソーク氏が実施したワクチン接種の臨床結果に関する具体的なデータはありません。
免疫系の重要な要素に損傷を与える病原体に対する予防接種は特に困難です。 さらに、HIV は非常に変異しやすいウイルスであり、最近分離された HIV-2 はすべての HIV-1 分離株とは著しく異なることが判明しました。 これまでのところ、ウイルスに対する免疫化の試みはすべて、精製またはクローン化されたエンベロープ糖タンパク質を使用していました。 実験動物では、ウイルスに対する中和抗体の形成を引き起こしますが、残念なことに、それは免疫化に使用された株に対してのみです(型特異的免疫)。
最後に、AIDS に関連する腫瘍 (カポジ肉腫、リンパ腫、黒色腫など) は通常、非常に悪性度に進行し、現代の治療法にもほとんど反応せず、患者を急速に悲劇的な結末に導きます。
2) 公共の場所でエイズに感染する可能性はありますか? 人々が大勢集まる公共の場所に行くことは、その中にエイズ患者や免疫不全ウイルスに感染している人がいる可能性があり、この感染が広がるという点では何の危険もありません。 デモや集会に参加する何千人もの群衆の中で、劇場や映画館を訪れているとき、図書館の本を読んでいるとき、ビジネス電話で話しているとき、エイズに感染することはあり得ません。
恐れることなく、あらゆる種類の公共交通機関 (ピーク時間帯でも地下鉄、バス、トラムなど) を利用したり、プールで泳いだり、ジムでトレーニングしたり、公衆トイレに行ったり、美容院で散髪したり、マニキュアをしてください。 エイズを心配することなく、以前に病人が住んでいたとしてもホテルの部屋を借りて、住民の半数がくしゃみや咳をするキャンプ場に住むことができます。 このような生活環境では、インフルエンザや急性呼吸器疾患、極端な場合には麻疹やおたふく風邪(幼少期にこれらの感染症に罹患しておらず、何らかの理由でワクチン接種を受けていない場合)にかかる可能性がありますが、エイズには感染しません。
3) キスでエイズに感染することはありますか? この質問は非常に複雑で、まだ明確な答えはないようです。 もちろん、感染者の唾液中には常に少量のウイルス粒子が存在しており、いわゆる「ウェット」(「性的」)キスによって、健康な人の体内にウイルス粒子が侵入する可能性があります。 したがって、理論的には、キスをするとき、特に頻繁に、長時間、みんなで並んでキスをする場合、免疫不全ウイルスに感染する可能性があります。 そして同時に、あなたがランダムなパートナーと親密な接触をした場合、エイズを避けることはできません。 しかし、「乾いた」キス、頬への同志のキス、女性や両親の指や手への紳士的なキスなど。 HIV の感染は事実上排除されます。 そして、法律上の結婚を結び、結婚式の前後にキスを交わして忠実な配偶者となる予定の女性の花嫁や若い男性の新郎にとっては、エイズを心配する必要はありません。
4) コンドームはエイズを予防しますか? コンドームを使用すると、免疫不全による感染の可能性が低くなります。 たとえば、米国の売春婦526人を対象とした調査では、これらの女性のうち11%でエイズの原因物質に対する抗体が検出されました。 同時に、客が常にコンドームを使用していた売春婦22人全員がHIV血清学的検査で陰性だった。 それにもかかわらず、機械的避妊薬は、たとえ正しく使用されたとしても、エイズを100%予防できる保証はないことを覚えておく必要があります(感染した性的パートナーとの1年間の継続的な接触による感染の確率は約10〜15%です)。 結論として、エイズに対する最も効果的な予防策は依然としてカジュアルセックスの防止であるということをもう一度強調する必要があります。
5) どうすればエイズが伝染しないのでしょうか? AIDS の原因物質は、患者の血液、その他の体液、さまざまな分泌物中に大量に含まれています。 しかし、家庭環境にいる健康な人にとって、HIV やエイズに感染している人は感染源としてはほとんど危険ではありません。 これは多くの理由によるものです(生存可能なウイルス粒子の数の急速な減少、無傷の皮膚や粘膜から人体に侵入できないこと、健康な人が外部環境の感染物質と直接かつ長期に接触する可能性が低いこと、等。)。
数万人のエイズ患者の長期観察の結果、エイズ病原体は握手やハグ、食器や家庭用品、ベッドや下着、硬貨や紙幣を介して伝染するものではないことが明確に証明されました。 食物、飲料水、果物や野菜のジュース、室内の空気や大気を介してエイズに感染する可能性がわずかでも排除されます。 子どもたちは大人よりも頻繁に家庭内で直接接触しているにもかかわらず、おもちゃや学用品を介して感染が起こった場合にエイズの症例は1件も登録されていません。 したがって、結論は明白です。感染者または病気の人からのエイズの原因物質は、家庭内の手段によって健康な人に伝染することはありません。
6) エイズ流行の進展についてはどのような予測がありますか? 世界保健機関は、エイズ患者の総数は 1997 年末までに 200 万人を超え、2000 年までに数百万人になると推定しています。 おそらく約50万人の新生児がエイズに感染し、そのほとんどが生後3~5年で死亡するだろう。 予測によると、1989年にはヨーロッパのエイズ患者の数は2万人を超え(この予測は的中しました)、1990年には10万人に達するはずでした。 北米とヨーロッパのほとんどの地域では、リスクグループ、特に麻薬中毒者のエイズウイルス感染者数が増加し続けるだろう。 しかし、リスクグループに属さない一般の人の間では、発生率が大幅に増加すると予想されます。 これは、HIV の異性間感染が広範囲に広がっているためです。
7) エイズとの闘いで何か成果はありますか? 間違いなく。 まず第一に、これはエイズとHIV感染症との闘いを組織する特別な科学者グループであるエイズに関する世界計画のWHOの後援の下で創設されたものです。 このグループには、約 200 人の高度な資格を持つ専門家が含まれています。
エイズ監視システムが開発され、順調に機能しており、世界の 177 か国が参加しています(1989 年 1 月 1 日現在、143 か国で約 133,000 人のエイズ患者が登録されています)。 科学的疫学データに基づいて、世界(アフリカ - 250万人、アメリカ - 200万人、ヨーロッパ - 50万人、アジアとオセアニア - 10万人)のHIV感染症の発生率に関する専門家の評価が実施されました。 さまざまな実験動物 (マウス、ウサギなど) を対象とした AIDS および HIV 感染の適切な実験モデルが開発されています。
近年、HIV に対する抗体を 1 ~ 5 分以内に検出でき、標準的な酵素免疫測定法と比べて品質 (主に感度と特異性) が劣らない新しい診断検査システムが開発されました。 遺伝子工学的手法を用いて作られた4つのワクチンは、すでにヒトを対象とした臨床試験の第1段階が行われている。 HIV に対して高い活性を持つ 50 種類以上の新しい化学療法薬が臨床試験中です。
最近、ワールド・ヘルス誌(1989年、第1-2号、30ページ)はエイズに関する「10の戒め」を発表しました。
1) エイズは、世界中に蔓延している全く新しい病気です。
2) エイズウイルスの感染経路と蔓延はすでによく知られています。
3) エイズ原因物質の蔓延方法を知るということは、それを予防する方法を知ることを意味します。
4) エイズウイルスの性感染は予防できる。
5) 血液を介した感染症の伝播を防ぐための信頼できるさまざまな方法があります。
6) エイズ病原体がどのようにして広がらないかを知ることは非常に重要です。
7) エイズウイルスに感染した人々との日常生活におけるコミュニケーションを恐れるべきではありません。
8) エイズに対するワクチンや絶対的に信頼できる薬はないため、感染を防ぐには真実の情報と健康教育が重要な役割を果たします。
9) 現在、世界のすべての国がエイズの世界的な脅威と戦うために立ち上がっています。
10) 力を合わせればエイズの蔓延を阻止できます!
読者に提供される科学的研究は、アクセスしやすく楽しい形式で、エイズの性質とその病原体の蔓延の特徴に関する主要な現代情報が提示され、ウイルスの感染方法と要因が説明されています。 病気のさまざまな症状について簡単に説明し、最新の統計資料を示します。 すべての批判的なコメントは感謝の気持ちを持って受け入れられます。
ヒト免疫不全ウイルスは、レンチウイルス属のレトロウイルスです。 外部的には、直径が 120 ~ 150 nm の球の形状をしています。 HIVが免疫系の細胞に結合する助けを借りて、外殻の一部として、糖タンパク質(gp41膜貫通およびgp120表面)といういくつかのタンパク質があります。 表面糖タンパク質はウイルスの膜上に独特の増殖物を形成し、外観(電子顕微鏡で)は真菌の「帽子」とgp41(その「脚」)に似ています。 ウイルスの基礎であるゲノムは、一本鎖 RNA (2 分子) で表されます。 各分子は、構造遺伝子、制御遺伝子、追加遺伝子の 9 つのウイルス遺伝子によって表されます。 したがって、それらはウイルスの構造、細胞への感染方法、ビリオンの再生に関する情報を伝えます。
 ウイルスゲノムはマトリックスタンパク質とキャプシドタンパク質(それぞれp17とp24)に囲まれており、閉じた円錐形の構造を形成しています。 HIV は逆転写酵素、プロテアーゼ、インテグラーゼなどの酵素を産生する能力を持っていますが、ヒト免疫不全ウイルスはゲノムの変異の影響により非常に早く変化する可能性があります。 ウイルスのほとんどの変異体は互いにわずかに異なりますが、HIV-1 (1983 年に発見)、HIV-2 (1986 年)、HIV-3 (1988 年)、HIV-3 など、大きな違いを持ついくつかの種が分離されています。 4(1986年に初めて発見されたが、少し後に別の種として特定された)。 HIV-1 は主にヨーロッパとアメリカの人口に影響を与えますが、HIV-2 は西アフリカに影響を与えますが、他の種類のウイルスはそれほど広まっていません。
ウイルスゲノムはマトリックスタンパク質とキャプシドタンパク質(それぞれp17とp24)に囲まれており、閉じた円錐形の構造を形成しています。 HIV は逆転写酵素、プロテアーゼ、インテグラーゼなどの酵素を産生する能力を持っていますが、ヒト免疫不全ウイルスはゲノムの変異の影響により非常に早く変化する可能性があります。 ウイルスのほとんどの変異体は互いにわずかに異なりますが、HIV-1 (1983 年に発見)、HIV-2 (1986 年)、HIV-3 (1988 年)、HIV-3 など、大きな違いを持ついくつかの種が分離されています。 4(1986年に初めて発見されたが、少し後に別の種として特定された)。 HIV-1 は主にヨーロッパとアメリカの人口に影響を与えますが、HIV-2 は西アフリカに影響を与えますが、他の種類のウイルスはそれほど広まっていません。
HIV と細胞の相互作用
 HIV は、表面に CD4 受容体を持つ細胞のみと相互作用できます。 これらの細胞のほとんどはマクロファージと T リンパ球です。 ウイルス膜上の表面糖タンパク質 (g120) はリンパ球細胞の CD4 受容体と接触し、その結果、それらは互いに融合し、HIV 遺伝物質が細胞質に浸透します。 この瞬間、ウイルスの逆転写酵素は、ウイルス自身の RNA の 1 本の鎖に基づいて DNA 合成のプロセスを開始します。 逆転写を直接活性化します。 次に、インテグラーゼ酵素は、宿主と新たに合成されたウイルス DNA を結合するプロセスを開始します。 さらに、細胞はそれ自体の代わりにウイルス RNA を合成するように再構成され、その結果、細胞のリボソームが独自のタンパク質や酵素の代わりに大量のウイルス酵素とその構造タンパク質を生成し始めます。 プロテアーゼの触媒作用により、細胞内でビリオンが生成されるプロセスが始まります。 それらの数が過度に大きくなるとすぐに、細胞膜を破壊したそれらは血中に出て、そこで新しいリンパ球やマクロファージに感染します。
HIV は、表面に CD4 受容体を持つ細胞のみと相互作用できます。 これらの細胞のほとんどはマクロファージと T リンパ球です。 ウイルス膜上の表面糖タンパク質 (g120) はリンパ球細胞の CD4 受容体と接触し、その結果、それらは互いに融合し、HIV 遺伝物質が細胞質に浸透します。 この瞬間、ウイルスの逆転写酵素は、ウイルス自身の RNA の 1 本の鎖に基づいて DNA 合成のプロセスを開始します。 逆転写を直接活性化します。 次に、インテグラーゼ酵素は、宿主と新たに合成されたウイルス DNA を結合するプロセスを開始します。 さらに、細胞はそれ自体の代わりにウイルス RNA を合成するように再構成され、その結果、細胞のリボソームが独自のタンパク質や酵素の代わりに大量のウイルス酵素とその構造タンパク質を生成し始めます。 プロテアーゼの触媒作用により、細胞内でビリオンが生成されるプロセスが始まります。 それらの数が過度に大きくなるとすぐに、細胞膜を破壊したそれらは血中に出て、そこで新しいリンパ球やマクロファージに感染します。