Hipertermia a rák kezelésében. A hipertermia, mint a rákkezelés egyik módszere
- közvetlenül elpusztítja a daganatsejteket és metasztázisok 42,5–43 °C hőmérséklet-tartományban hevítve a leghatékonyabb rákkezelés érdekében;
- akár 50%-kal csökkentheti a kemoterápia adagját a daganatellenes hatás egyidejű növekedésével és a toxikus hatás csökkenésével;
- legyőzni az érzéketlenséget daganatok kemoterápiára .
- serkentik az immunrendszert a testet, hogy kapcsolódjon a rák elleni küzdelemhez;
- megvalósíthatóvá tegye a műveletet. Mellrák, szarkóma, petefészekrák, veserák és mások esetén az 1-2 hipertermiás kezelés lehetővé teszi a daganat méretének csökkentését és a műtéti kezelést, beleértve a szervmegőrzést is.
- csökkenti a kiújulás és a metasztázis kockázatát.
Hipertermia rákkezelési terv:
A hipertermiával végzett rákkezelés azonnali eredményei:
| Diagnózis | A mintában szereplő betegek száma | Teljes regresszió | Részleges regresszió | stabilizálódott záció | Az életminőség javítása |
| Emlőrák T 3-4 N 0-3 M 0-1 | 855 | 14,2 % | 38,1 % | 26,4 % | 81,3 % |
| Lokálisan előrehaladott emlőrák T 4 N 2-3 M 0-1 | 121 | - | 47,6 % | 28,6 % | 76,2 % |
| Gyomorrák T2-4 N0-2 M 1 | 270 | - | 22,9 % | 51,4 % | 64,3 % |
| vastagbél rák T2-4 N0-2 M 1 | 245 | - | 11,1 % | 71,1 % | 48,9 % |
| Végbélrák T2-4 N0-2 M 1 | 245 | 4,4 % | 26,7 % | 53,3 % | 64,4 % |
| lágyrész szarkómák T2bN0M 1 | 155 | 3,6 % | 36,4 % | 47,3 % | 83,6 % |
| veserák T1-3a N0-2 M 1 | 211 | - | 36,4 % | 54,5 % | 90,9 % |
| A petefészekrák, a méhnyak, a méhtest T3a-3cN1M0-1 | 140 | 12,5 % | 35,0 % | 37,5 % | 65,0 % |
| A gége rákja T3-4aN0-2M0-1 | 42 | - | 41,7 % | 50,0 % | 91,7 % |
| pajzsmirigy rák T4a-4bN1M0 | 10 | 10,0 % | 30,0 % | 30,0 % | 80,0 % |
Az értékelést az eljárás után egy hónappal végezték el. Az előrehaladott daganatos és kiterjedt metasztázisos betegeket figyelembe vették, akiknél a más kórházakban végzett kezelések hátterében progressziót észleltek. Korábban a betegek legfeljebb 17 kemoterápiás kúrát kaptak.
TELJES REGRESSZIÓ
- az összes elváltozás teljes eltűnése a rák legjobb kezelése.
RÉSZREGRESSZIÓ
- az összes vagy az egyes gócok méretének csökkenése több mint 50%-kal.
STABILIZÁCIÓ
- a gócok 50%-nál kisebb csökkenése új elváltozások hiányában, vagy legfeljebb 25%-os növekedés.
Az eredmények értékelésénél figyelembe vett kontroll vizsgálatok: radiográfia és fluoroszkópia; számítógépes tomográfia vagy mágneses rezonancia képalkotás; PET CT; ultrahang stb.
Halálozás a kemoterápiás általános hipertermiás kezelések során ez a hipertermiás kezelések számának 0,6%-a volt (azaz 100 hipertermiás alkalomból 0,6 ember halhat meg). Az elmúlt 12 évben a klinikán nem volt halálos hipertermia eset.
Mennyi ideig élnek az emberek az általános hipertermiával végzett rákkezelés után?
A számítást az általános hipertermia első ülésének időpontjától végeztük azon betegek esetében, akiknél a klinikai hatás a kezelés (teljes regresszió, részleges regresszió, stabilizáció) eredményeként jelentkezett. A túlélési arányszámítást Kaplan-Meier módszerrel végeztük. Az eredmények jelentősek (P<0,01).
Ellenjavallatok az általános hipertermiával járó rák kezelésére:
- az agy és a gerincvelő daganatai, valamint rák áttétek az agyban;
- súlyos általános állapot: súlyos rákmérgezés, cachexia, légzési elégtelenség III-IV fokú, májelégtelenség, veseelégtelenség, szív- és érrendszeri elégtelenség, súlyos szívritmuszavarok;
- anaemia, leukopenia, thrombocytopenia III-IV súlyosság.
Bővebben a módszerről:
Azt a tényt, hogy a hőmérséklet káros a daganatsejtekre, a legtöbb szakértő nem kérdőjelezi meg.
A sarokkő kérdés az, hogy ez a módszer miért nem mindenütt elterjedt: hogyan melegítsük fel az emberi testet olyan hőmérsékletre, hogy a daganat meghaljon, de a beteg ne?
A különböző országok tudósai több mint fél évszázada kísérletezzen a rák kezelésének módszereivel hőmérséklettel és melegítési időtartamokkal. Szovjet tudósok egy professzor részvételével a 80-as években Gorkij (ma Nyizsnyij Novgorod) zárt tudományos városában megoldotta ezt a problémát. Kifejlesztettek egy technikát az általános elektromágneses hipertermia kezelésére (RF szabadalom "A rosszindulatú daganatok hipertermiás elektromágneses terápiájának végrehajtási módja"082458 sz., 1994. június 27.). A szabadalom tulajdonosa társszerzőkkel van együtt.
A hipertermia hőmérsékleti zónái a rák kezelésében:
1) ha a daganat 38-40 °C-ra melegszik, növekedése fokozódhat;
2) a daganat 40-42 °C elérésekor érzékennyé válik a kemoterápiás gyógyszerekre és az ionizáló sugárzásra;
3) 42,5 °C fölé melegítve a daganatsejtek pusztulását figyelik meg - ez a legfontosabb hatás a rák kezelésében.
A normál szövetek hőmérsékleti rezsimjei kétszer nagyobbak a nagyobb termikus stabilitásuk miatt. Ezért a hipertermia csak a beteg, rosszul működő rákos sejtek számára végzetes.
A K-teszt klinikán a kemoterápiás általános hipertermiát I. D. Karev professzor módszere szerint hajtják végre (RF szabadalmi szám: 2077348, 1997. 04. 20.), és a "YUG-VCHG" otthoni telepítéssel, amelyet együtt fejlesztettek ki. a klinika szakembereinek részvétele.
Az általános hipertermiás eljárás menete:
A rák kezelése során a pácienst fekvő helyzetben egy vízpárnán lévő elektromágneses berendezésre helyezik.
Az általános hipertermiát általános érzéstelenítésben, gépi lélegeztetéssel végezzük. A hőmérséklet szabályozása a végbélben, a nyelőcsőben, a bőrön, a külső hallójáratban elhelyezett érzékelőkkel történik.
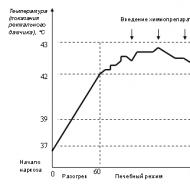
A beteg testhőmérséklete 42,5-43 ° C-ra emelkedik, és 80 percig fennmarad; ez a hőmérsékleti intervallum az alapvető kezelési rend.
A hőmérsékleti rendszert a páciens kezdeti állapotának figyelembevételével választják ki, felmérik a szövődmények kockázatát, értékelik a kemoterápiával végzett általános hipertermia korábbi üléseinek eredményeit.
A foglalkozás során a szív, a máj, az agy mélystruktúráinak felmelegedési szintjét szabályozzuk. Az agyödéma megelőzése érdekében lehűtik. Ha az ülés során a páciens testét 43 °C-ig lehet felmelegíteni, akkor az agy hőmérséklete csak 41 °C-ig emelhető.

Rizs. 2. Az általános hipertermia ülésének hőmérsékleti rendszere
A maximális felmelegedés hátterében kemoterápiás gyógyszereket vezetünk be, és ez lehetséges a gyógyszerek dózisának 50% -kal történő csökkentése a hatás egyidejű növelésével.
Az eljárás során a víz- és elektrolit-egyensúly folyamatos szabályozása történik.
Az ülés végén a készüléket kikapcsolják, és a beteg testtömegétől függően 40-80 percig hűl. Az érzéstelenítésből való eltávolítást 39 ° C hőmérsékleten végezzük.
Az általános eljárás utánhipertermia :
Az ülés befejezését követő első órákban a beteget az intenzív osztályra szállítják, ahol infúziós terápiát végeznek, amelynek célja a víz- és elektrolitveszteség pótlása. A páciens testhőmérséklete a beavatkozás után néhány órán belül visszatér a normál értékre.
A következő 1-7 napban a betegek méregtelenítő infúziós terápián, vérparaméterek laboratóriumi ellenőrzésén esnek át.
Ha több általános hipertermia kemoterápiás kezelést hajtanak végre, a kezelések közötti intervallum három hét.
A kezelési eredményeket erősen befolyásolja az általános hipertermia és a hőmérsékleti rendszer üléseinek száma. A 42,5-43 °C-os hőmérsékleti rendszer alkalmazása 17-20% -kal javítja a kezelés eredményeit, és csökkenti a betegség progressziójában szenvedők számát, mint a 42,3-42,5 °C-os hőmérsékleti rendszerrel. Az egyes betegek hőmérsékleti rendszerének megválasztását az általános állapot, az egyidejű betegségek jelenléte stb.
A rák kezelésében az általános hipertermia optimális száma 4 eljárás 42,5-43 °C-on. Ez elég az eléréshez a legtöbb daganat regressziója, szubjektív hatás elérése és a betegek életminőségének javítása.
Az életminőség és a jólét értékelése hipertermia után:
- a fájdalom szindróma intenzitásának eltűnése vagy csökkenése;
- a fizikai aktivitás növekedése;
- légszomj csökkenése stb.
A betegek a fájdalom intenzitásának jelentős csökkenését tapasztalják már a hipertermiát követő második napon. A gyengeség, légszomj és súlygyarapodás csökkenése általában 7-14 nappal a hipertermia után figyelhető meg. A disszeminált emlőrákban a hipertermia szubjektív hatása 42,5-43 °C hőmérsékleten az életminőség javulását a betegek több mint 95%-ánál észlelték.
Meg kell jegyezni, hogy az atipikus szövetekre gyakorolt hőmérsékleti hatás nem tartozik a rádiófrekvenciás abláció csoportjába, ez egy teljesen más technika. A sugárterápiával kombinálva a termikus expozíciós módszert termoradioterápiának nevezik.
Hipertermia az onkológiában: mi ez?
A nemzetközi onkológiában még nem alakult ki közös vélemény arról, hogy mely hőmérsékleti mutatók a legbiztonságosabbak és egyben a leghatékonyabbak. A kezelés során a testhőmérséklet általában eléri a 39,5 és 40,5 °C közötti szintet, más kutatók azonban 41,8-42 °C közötti hipertermiát határoznak meg, ami Európában és az Egyesült Államokban gyakori. Japánban és Oroszországban a legmagasabb a °C.
A hőmérséklet és az expozíciós idő egymással összefügg. A hosszabb időtartamok és a magasabb hőmérsékletek nagyon hatékonyak a rákos sejtek elpusztításában, de komolyan növelik a toxicitás kockázatát is. A rendezetlen és kompakt érszerkezetű daganatsejtek nagyon nehezen távolíthatók el a hőtől, ami hozzájárul az apoptózis (egyfajta fiziológiásan programozott sejthalál) stimulálásához a viszonyukban vagy a normál halálozásban. Míg az egészséges szövetek jobb hővezető képességgel rendelkeznek, ezért jobban ellenállnak a magas hőmérsékletnek.
Még ha a rákos sejtek nem is pusztulnak el azonnal, a rákterápia vagy a kemoterápia során érzékenyebbé válhatnak az ionizáló sugárzásra. A helyi hipertermia során fellépő hő tágítja a daganat ereit, elősegítve a daganat oxigenizációját (oxigéntelítettségét), ezáltal hatékonyabbá teszi a rákellenes sugárterápiát. Az oxigén egy erős sugárérzékenyítő, amely DNS-károsodások kialakulásával jelentősen növeli az adott dózisú sugárzás hatékonyságát. Az oxigénhiányos daganatsejtek 2-3-szor jobban ellenállnak a sugárkárosodásnak, mint normál oxigénes környezetben.
A hipertermia kemoterápiával kombinálva nagyon hatékonynak bizonyult. A publikált tanulmányok javulást mutattak a 10 éves kiújulásban és az áttétmentes túlélésben azoknál a hólyagrákos betegeknél, akik hipertermiával és kemoterápiával kombinált kezelésben részesültek. A betegek 53%-a élt 10 évig, míg a kemoterápia önmagában csak a betegek 15%-ának biztosította a túlélést.
Az intenzív melegítés a sejtfehérjék denaturálódását és koagulációját okozza, ami gyorsan elpusztítja a daganatsejteket. Hosszabb, mérsékelt melegítés néhány fokkal a normál fölé, finomabb szerkezeti változásokat okozhat a sejtekben. Az enyhe hőkezelés más módszerekkel kombinálva sejthalálhoz vezethet a biológiai pusztulás stimulálása miatt.
A mínuszok közül a szakértők megjegyzik a hősokk számos biokémiai következményeit a normál sejtekben, beleértve a növekedési retardációt és a megnövekedett érzékenységet a későbbi ionizáló radioaktív terápiával szemben.
A hipertermia fokozza a véráramlást a fűtött területen, ami megkétszerezheti a véráramlást a daganatokban. Ez a jelenség fokozza a kemoterápiás szerek pozitív hatását a patológiás területeken.
Az enyhe hipertermia, amely számos fertőző betegség esetén természetesen meleg hőmérsékletet biztosít, stimulálhatja a daganatok elleni természetes immunológiai támadásokat. Ugyanakkor természetes fiziológiai választ is indukál, amelyet termotoleranciának neveznek, és amely megvédi az abnormális sejteket.
Nagyon magas, 50°C feletti hőmérsékletet használnak az ablációhoz – bizonyos daganatok közvetlen megsemmisítéséhez. A technika fémcső formájú betéteket használ közvetlenül a daganatba, amelynek hegyét felmelegítik, ami sejthalált okoz a kerülete mentén.
Érdemes hangsúlyozni, hogy a hipertermiás abláció technikáját Oroszországban még mindig tanulmányozzák, és ritkán használják a gyakorlati gyógyászatban. A tesztek eredményessége azonban nagyon jó kilátásokat vetít előre ennek a módszernek, így hazánkban is.
A helyi, regionális és általános hipertermia módszereinek különbségei és jellemzői
Általában három változatban használják, az indikációktól és a terápiás lehetőségektől függően.
Nagyon kis területet melegítenek, általában magában a daganatban. Egyes esetekben a módszer célja az abnormális sejtek elpusztítása melegítéssel anélkül, hogy a környező szöveteket károsítaná. A hőt a következőkkel stimulálhatjuk:
- ultrarövid hullámok;
- magas rádiófrekvenciák;
- ultrahang energia;
- mágneses hipertermia segítségével.
A daganat helyétől függően a hőt a test felszínére, a szövetek belsejébe vagy a mélyebb területekre lehet alkalmazni tűk vagy szondák segítségével. Az egyik viszonylag gyakori típus a kisméretű daganatok rádiófrekvenciás ablációja. A terápiás cél akkor érhető el a legkönnyebben, ha a daganat a test felszínén van (felületi hipertermia), vagy ha lehetséges a tűk vagy szondák közvetlenül a daganatba történő beszúrása (intersticiális hipertermia).
- Regionális hipertermia
A test nagy része felmelegszik, például egy egész szerv vagy végtag. Jellemzően az eljárás célja a rákos sejtek gyengítése oly módon, hogy a későbbi besugárzással vagy kemoterápiás gyógyszerek hatására elpusztuljanak. Az előző módszerhez hasonlóan a regionális hipertermia is alkalmazhatja ugyanazokat a felületes vagy intersticiális módszereket, vagy támaszkodhat a vér perfúziójára. A perfúziós folyamat során a páciens vérét eltávolítják a testből, felmelegítik és visszavezetik az erekbe, amelyek közvetlenül a kívánt testrészbe vezetnek. Általában a kemoterápiás gyógyszereket egyidejűleg alkalmazzák.
Ennek a megközelítésnek az egyik speciális típusa a folyamatos peritoneális perfúzió, amelyet összetett intraabdominális neoplazmák kezelésére használnak, beleértve az elsődleges hasi mesotheliomát és a gyomorrákot. A forró kemoterápiás gyógyszereket közvetlenül a hasba fecskendezik, hogy elpusztítsák a rákos sejteket.
Az egész test felmelegszik 39-43 °C-ra és magasabbra. A módszert általában metasztatikus rák kezelésére használják. Magában foglalja az infravörös hipertermikus kupolák használatát, amelyek alá a beteg teljes teste kerül, a fej kivételével. Más módszerek közé tartozik a páciens nagyon forró kamrába helyezése vagy fűtött, nedves takarókba csomagolása. A ritka módszerek közül speciális búvárruhákat használnak állandó melegítéssel vagy forró viaszba merítéssel.
Milyen típusú rák kezelhető hipertermiával?
Egyedül a hipertermia egyedülálló képességet mutatott a rosszindulatú daganatok kezelésére. Az is ismert, hogy a technika jelentősen növeli más kezelések hatékonyságát.
Radioaktív sugárzással kombinálva a hipertermia különösen hatásos nagy mennyiségű oxigén jelenlétében, feltéve, hogy az expozíció egyidejűleg legalább egy óráig tart.
Az elmúlt tíz évben a sugárzással kombinált hipertermiát terápiás célokra alkalmazták az alábbi diagnózisokkal rendelkező betegeknél:
- korai stádiumú emlőrák;
- a rák lokalizációjával a fejen és a nyakon;
- prosztata rák.
A neves tudományos publikációk a húgyhólyagrákos betegek 38%-ánál mutatnak javulást kemoterápiával kombinálva, összehasonlítva a kemoterápiával önmagában. Az emlőrákos betegeknél az eredmény a betegek 18%-ánál mutatott jobb választ.
Milyen egyéb rákfajták vannak, amelyek jelentős javulást mutatnak a hipertermia kezelésével?
- Melanoma és bőrrák.
- Lágyszöveti szarkóma.
- Húgyhólyagrák.
- Méhnyakrák.
- Végbélrák.
- A hónalj és a mellkasfal rosszindulatú daganatai.
- Metasztázisok a nyirokcsomókban.
Az oroszországi vizsgálatok érdekes eredményeket mutattak a 43,5-44 °C-os magas hipertermiával kapcsolatban, amikor a módszert a következőkre alkalmazták:
- nyelőcsőrák;
- gégerák;
- májrák;
- HIV-fertőzéssel és az immunrendszer rendellenességeivel.
A daganatok ablációja a hipertermia egyik fajtája.
A rádiófrekvenciás abláció (RFA) valószínűleg a lokalizált hipertermia leggyakrabban használt típusa. A magas frekvenciájú rádióhullámokat a hőmérséklet emelésére használják.
- Vékony tűszondát helyeznek a daganatba rövid időre, általában 10-30 percre.
- A szonda elhelyezése ultrahanggal, MRI-vel vagy CT-vel történik.
- A szonda hegye olyan nagyfrekvenciás áramot ad le, amely 40 és 60°C közötti hőtermelésre képes, ami egy bizonyos területen sejthalált okoz.
- Az elhalt sejteket nem távolítják el, hegszövetekké válnak, és idővel feloldódnak.
Az RFA-t leggyakrabban olyan daganatok kezelésére használják, amelyek műtéti úton nem távolíthatók el, vagy olyan betegeknél, akik különböző okok miatt nem reszekálhatók. Az eljárás ambuláns alapon is elvégezhető. A kiújulásra képes daganatok esetében az abláció ismétlése lehetséges. Ezenkívül az RFA hozzáadható más terápiás intézkedésekhez, beleértve a neoplazma sebészeti eltávolítását, sugárterápiát, kemoterápiát, infúziós terápiát, alkoholos ablációt vagy kemoembolizációt.
Az RFA legfeljebb 5 cm átmérőjű daganatok kezelésére használható.A technika a leghatékonyabb a máj-, vese- és tüdőelváltozások kezelésére. Használatát a test más területein jelenleg vizsgálják. A hipertermiás ablációs kezelés utáni hosszú távú hatékonyság még nem ismert, de a korai eredmények biztatóak.
A hipertermia lehetséges szövődményei és mellékhatásai
A magas hőmérséklet alkalmazása szöveti égési sérülésekhez, a célszerv károsodásához vezethet, különösen regionális kezelés esetén. A károsodás mértéke az expozíciós időtől, a hőmérséklettől és a szövet típusától függően változik. Erre a módszerre a legérzékenyebbek az agy és a tüdő szövetei.
- Ödéma.
- Thrombus képződés.
- Belső vérzés.
- Szív- és érrendszeri rendellenességek.
A radioaktív besugárzással vagy kemoterápiával való kompatibilitás meglehetősen erős toxicitást mutat, amely általában több órával az eljárás után fejeződik ki, és néha meglehetősen súlyos rendellenességeket okozhat.
Az anyag felhasználása és újranyomtatása során az oldalra mutató aktív link szükséges!
Normál élettani körülmények között a hipotalamusz körülbelül 37ºС hőmérsékletet tart fenn, amely a napszaktól függően változhat. A legalacsonyabb arány a kora reggeli órákban figyelhető meg, a testhőmérséklet pedig a nap közepén éri el a maximumot. Estére a test termikus állapota 36,5 - 37 ºС.
Hőmérséklet rákban - tünetek, okok
- 38 ºС feletti hipertermia.
- Krónikus fáradtság.
- Lüktető fejfájás.
- Akut, nedves köhögés.
- A daganat fáj.
Van-e hőmérséklet a rákban? Az onkológiai betegségekben a hipertermiás mutatók főként subfebrilis mutatókra (37 ºС - 38 ºС) emelkednek. Az ilyen hőmérsékleti mutatók az úgynevezett "alacsony lázat" jelzik. A test ezen állapota bizonyos esetekben nem igényel speciális kezelést, különösen akkor, ha a subfebrilis indikátorok rövid ideig megmaradnak.
Milyen legyen a hőmérséklet?
A hipertermia terápiás módszerei
- Intrakavitáris vagy intraluminális megközelítések. Ezeket a módszereket a nyelőcső rákos elváltozásaira és a "végbélrák" diagnosztizálására használják. A technikát speciális fűtött szondával hajtják végre, amelyet a megfelelő szervbe helyeznek be.
Az egész test hipertermia
- Te itt vagy:
- itthon
- RÁK KEZELÉS
- Milyen legyen a hőmérséklet a rák esetén?
2018 onkológia. A webhely összes anyaga csak tájékoztatási célokat szolgál, és nem képezheti az önkezeléssel kapcsolatos döntések alapját, beleértve. Az anyagok minden szerzői joga a megfelelő tulajdonosokat illeti meg
hőmérséklet rákban
A rák lázas állapota a szervezet bakteriális mikroorganizmusokkal vagy vírusokkal való fertőzését jelentheti. Ezenkívül gyakran a rák hőmérsékletét az onkológiai folyamat 3-4 szakaszában figyelik meg.
Normál fiziológiás körülmények között a hipotalamusz körülbelül 37 °C hőmérsékletet tart fenn, amely a napszaktól függően változhat. A legalacsonyabb arány a kora reggeli órákban figyelhető meg, a testhőmérséklet pedig a nap közepén éri el a maximumot. Estére a test termikus állapota 36,5 - 37 ºС.
A rák magas láza a testhőmérséklet 38 °C fölé emelkedésével jár, ami belső kóros folyamat jelenlétére utal. Ezt az állapotot számos ráktípus meglehetősen gyakori tünetének tekintik.
Hőmérséklet rákban - tünetek, okok
A rák fertőző lázát általában a következő tünetek kísérik:
- 38 ºС feletti hipertermia.
- Tapintásra a betegek gyakran forró bőrrel rendelkeznek.
- Hideg érzés és remegés az egész testben.
- Fájdalom a felső és alsó végtagokban.
- Krónikus fáradtság.
- Égő fájdalom vizelés közben.
- Az emésztőrendszer zavarai hasmenés formájában.
- Lüktető fejfájás.
- Gyakori szédülési rohamok.
- Fájdalom a nasopharynxben és a szájüregben.
- Akut, nedves köhögés.
- A lokalizált fájdalom megjelenése a test egyik részén.
- A daganat fáj.
Van-e hőmérséklet a rákban? Az onkológiai betegségekben a hipertermiás mutatók főként subfebrilis mutatókra (37 ºС - 38 ºС) emelkednek. Az ilyen hőmérsékleti mutatók az úgynevezett "alacsony lázat" jelzik. A test ezen állapota bizonyos esetekben nem igényel speciális kezelést, különösen akkor, ha a subfebrilis indikátorok rövid ideig megmaradnak.
A rák esetében a specifikus rákellenes terápia időszakában hőmérséklet is előfordul.
Milyen legyen a hőmérséklet a rák esetén?
Milyen legyen a hőmérséklet a rák esetén? Az onkológiában a lázas állapot három egymást követő fázison megy keresztül:
- Emelje fel a testhőmérsékletet. Bakteriális és vírusfertőzés behatolására vagy kóros folyamat kialakulására válaszul az emberi szervezet megnövekedett számú leukocitát termel, amelyek tömege fokozatosan növekszik a keringési és nyirokrendszerben. Nagyszámú fehérvérsejt érinti a hipotalamusz, ami hipertermiát vált ki. A láz korai szakaszában a beteg nagyon gyakran fázik és reszket. Ez a bőr és az izmok felszíni rétegeinek reakciója a testhőmérséklet emelkedésére. Ennek a jelenségnek a lényege az epidermális erek szűkülése, amely hozzájárul a belső termia maximális megőrzéséhez. A válasz az érrendszer szűkülete következtében kialakuló időszakos izomösszehúzódásnak is tekinthető.
- A hipertermia második fázisában a hőátadási folyamatok kiegyenlítődnek, ami klinikailag a hipertermiás állapot stabilizálásával nyilvánul meg. Így például a tüdőrákban a hőmérséklet hónapokig 37 ºС és 37,5 ºС között lehet, anélkül, hogy különösebben kellemetlen érzést keltene a rákos beteg számára.
- A test hűtése. A hipertermia terminális fázisában a felületes erek megnyílása következik be, ami erős izzadást és ennek következtében a testhőmérséklet csökkenését okozza. Az ilyen folyamatokat általában gyógyszerekkel serkentik, bár egyes klinikai esetekben öntermoreguláció is megfigyelhető.
A hipertermia alkalmazása a rákterápiában
Milyen hőmérséklet szükséges rosszindulatú elváltozással járó rákban a maximális terápiás eredmény eléréséhez? Egyes klinikai esetekben a test 37,5 ºС - 38,0 ºС hőszabályozási mutatói hozzájárulnak a kóros sejtek érzékenységének növekedéséhez a nagyon aktív röntgensugárzás hatásaival szemben. A test hipertermiás állapota sugárterápiával kombinálva gyorsabb rákellenes hatást fejt ki nagyszámú mutált szövet elpusztítása formájában.
A hipertermia terápiás módszerei
A mai napig kidolgozás alatt áll néhány módszer a testhőmérséklet mesterséges emelésére.
Ez a technika helyi hőhatást jelent a test azon részén, ahol már kialakult a rák. A daganat lokalizációjától függően a helyi hipertermia következő típusai léteznek:
- Külső megközelítés, amelyben a hőenergiát vagy a bőr felszínére vagy a bőr alatti rétegre alkalmazzák. Ezek a tevékenységek főként pályázati jellegűek.
- Intrakavitáris vagy intraluminális megközelítések. Ezeket a módszereket a nyelőcső rákos elváltozásaira és a "végbélrák" diagnosztizálására használják. A technikát speciális fűtött szondával hajtják végre, amelyet a megfelelő szervbe helyeznek be.
- A köztes technikák a mélyen lokalizált szervek, például az agy és a gerincvelő onkológiai betegségei esetén javasoltak. Egy speciális rádiófrekvenciás érzékelő helyi érzéstelenítésben kerül a patológia elsődleges fókuszába, ami hipertermiás elváltozásokat okoz benne.
A test vagy a végtagok nagy területeinek melegítéséből áll.
Az egész test hipertermia
Ezt a technikát több metasztatikus elváltozás esetén alkalmazzák. A testhőmérséklet szisztémás emelkedését általában speciális termikus kamrákban érik el.
Fontos tudni:
Megjegyzés hozzáadása Mégsem a választ
Kategóriák:
Az oldalon található információk csak tájékoztató jellegűek! A leírt módszerek és receptek alkalmazása a rák kezelésére önállóan és orvosi konzultáció nélkül nem javasolt!
Szauna rák ellen
Az eset összehozott egy nővel, aki méhrákból gyógyult ki, szó szerint a tűzhelyen feküdt. A betegséget rendkívül elhanyagolták, a negyedik szakaszban. Az orvosok azt hitték, hogy legfeljebb egy évig fog élni. A beteg megtagadta a kemoterápiát, és hazament a faluba. Az idő nagy részét az orosz kályha közelében ülve vagy azon fekve töltötte. Több órán keresztül egymás után kibírta a maximum hőmérsékletet, és még a hátát is takaróba csavarta. Négy évvel később, amikor újra találkoztunk, egészségesnek érezte magát. Ez az eset nagyon érdekelt. Végül is köztudott, hogy a hivatalos onkológiában minden termikus eljárás elfogadhatatlan.
A rák hőkezelésének ötlete azonban nem új keletű, az irodalom már régóta tárgyalja. Ennek az ötletnek a támogatói abból a tényből indulnak ki, hogy a rákos sejtek nagyon érzékenyek az emelkedett hőmérsékletre - 40 ° -on leállnak a fejlődésük. Alexander Vinokurov gyógyító azt állítja, hogy ha 10 napig ilyen hőmérsékletnek vannak kitéve a testen, a rákos sejtek elpusztulnak, míg a normál sejtek nem változnak, teljesen megőrizve funkcióikat.
A hipertermiás eljárások segítségével a legjobb eredményeket emlődaganatok, rosszindulatú limfómák, vastagbél-, prosztata-, gége-, pajzsmirigy-, vese-, gyomor- és bélrák, szarkóma esetén értek el. Az elvégzett vizsgálatok szerint az öt évig ilyen eljárásokkal kezelt 1400 beteg körülbelül 80%-ánál észlelhető javulás – az elsődleges és metasztatikus daganatok növekedésének leállása – mutatkozott. Minden fájdalom megszűnt az első ülés után. A betegség IV. stádiumában lévő betegek több mint 60%-ánál több kezelési alkalom után a metasztázisok és a mérgezés tünetei eltűntek. Az általános hipertermia felvétele a radikális műtét utáni terápiás intézkedések komplexumába jelentősen csökkenti a relapszusok számát és csökkenti a rák kiújulásának kockázatát.
Próbáljuk megérteni a magas hőmérséklet rákos sejtekre gyakorolt hatásának mechanizmusát.
Az egyik elmélet szerint az onkológiai betegségek a vírus RNS-nek a sejt genomjába vagy citoplazmájába való bejutásával járnak. Okkal feltételezhető, hogy a hipertermiás eljárások a vírus és az idegen RNS elválasztásához vezetnek az anyasejttől. Kénytelenek kimenni a szabadba, az immunsejtek martalékává válnak. További sorsuk az immunitás szintjétől függ. Ezért a rák kezelésének egyik legfontosabb területe az immunrendszer erősítése.
De térjünk vissza a magas hőmérséklet sejtekre gyakorolt hatásaihoz. Megállapították, hogy 43,5 ° -os hőmérsékleten a rákos sejtek meghalnak. Ez a kritikus hőmérséklet azonban csak rövid ideig tartható fenn. Ezért véleményem szerint a 40-42 ° -ra összpontosító, de hosszú távú hatású módszerek elfogadhatóbbak.
A hipertermiás kezeléseket kidolgozó tudósok figyelembe vették a daganatsejtek azon képességét is, hogy erőteljesen glükózt fogyasztanak. A tartós glükózhiány természetes korlátozó tényező a rákos sejtek növekedésében és osztódásában. Azt sugallják, hogy ha kifejezetten telíti a vért glükózzal, akkor a rákos sejtek minden korlátozás nélkül elkezdik felszívni azt, és az energia-túlzott állapotba kerül.
Ez a folyamat a hőmérséklet emelkedésével fokozódik. A termikus stimulációt követően aktívan glükózt fogyasztó sejtek a glükóz energiatermeléséből származó hulladékok hasznosításának válságát kezdik átélni. A bennük felhalmozódó szerves savak molekulái a közeg savasságának éles eltolódását idézik elő, ami összeegyeztethetetlen a sejtmembránok ellenállási határaival. Detonátorként működik – az aktív rákos sejtek spontán égése következik be. Ezért a termikus eljárások során tanácsos glükózt adni a páciensnek (például méz formájában).
Az elméleti előrejelzések azonban nem teljesen egyeztek a gyakorlati vizsgálatok eredményeivel. Kiderült, hogy a rákos daganat szerkezetében heterogén. Nem minden sejt van benne az aktív osztódás és a glükóz bőséges felszívódásának állapotában. Mindegyik daganatban vannak aktívan növekvő sejtek és perifériás sejtek privilegizált készletei, amelyek a nyirokrendszerből és a vérerekből félre vannak tolva. A daganat perifériás rétegei egyelőre viszonylagos nyugalomban vannak.
A kísérleti gyakorlat megerősítette, hogy a hipertermia hiperglikémiával (cukorfelesleggel) kombinálva valóban biztosítja a daganatos szövetek pusztulását. Ugyanakkor kiderült, hogy a daganatsejtek egy kis része még mindig nem pusztul el, annak ellenére, hogy tömegének kiterjedt elhalása. Emiatt a betegség hamarosan kiújult. Kiderült, hogy a kiújulás forrása a visszaszorult rákos sejtek, amelyek korábban alvó állapotban voltak. Gazdag szomszédaik elpusztítása után ezek a sejtek felébredtek és növekedni kezdtek.
Így az optimumot meghaladó (43°C vagy több) hipertermikus expozíció, amely az aktív onkosejtek nekrózisához vezet, egyáltalán nem befolyásolja a nyugalmi tumorrétegeket. Az optimális hőmérsékleten belül (legfeljebb 42 °) a nyugalmi állapotból egy aktívabb, ezért hőérzékenyebb állapotba kerül. Csak az expozíciós ciklusok kívánt módját kell kiválasztani, hogy a daganat ne csak az aktívan növekvő központjában, hanem a periféria mentén is eltűnjön.
Sok gyógyító úgy véli, hogy a daganatnak nem szabad elhalódnia (elpusztulnia), hanem lassan el kell múlnia. Ehhez be kell tartani az optimális hőmérsékleti hatás nagyon szűk határait. A felső határon túl tumornekrózis kezdődik. Az optimális határokon belül a daganat lassan rendeződik, amit az immunitás erősödése segít elő. Ezért a hipertermikus terápia időszakában nagyon tanácsos olyan hatékony immunmodulátorokat használni, mint a T-aktivin vagy a diucifon - olyan gyógyszerek, amelyek erősítik az immunrendszert, növelik a limfociták számát a vérben és a nyirokokban, valamint a T-sejtekben, gyilkos sejtek, amelyek elpusztítják az onkosejteket és a mikroorganizmusokat a test belső környezetében. Az e határérték alatti hőmérséklet nem gátolja el a rákos sejteket, sőt esetleg stimulálja is őket. A hivatalos gyógyászatban ezeket a hőmérsékleteket ellenjavalltnak tekintik onkológiai betegségekben. Amikor az onkológusok azt mondják, hogy a melegítés fokozhatja a daganatok progresszióját és metasztázisát, nem veszik figyelembe az ultramagas hőmérséklet hatásait.
Az ultra-magas hőmérséklet azonban, mint már említettük, nem zárja ki a betegség kiújulását. Úgy tűnik, egyes kutatók kudarcait azzal magyarázzák, hogy a kezelés során beállították a korlátozó hőmérsékletet, és nem fordítottak kellő figyelmet a tumorsejtekkel való érintkezés időtartamára. Számomra úgy tűnik, hogy az onkológiai megbetegedések kezelésében a leghatékonyabb az enyhébb hőmérsékletek (40-42 °) alkalmazása hosszabb, így mélyebb és egyenletesebb hatású.
Erre a célra az Alexander Vinokurov által javasolt házi szauna tökéletes (lásd a képet).
Az otthoni szaunában a hőmérsékletet egy elektromos kályha (például egy 1,5 kW teljesítményű közönséges háztartási kályha) tartja fenn, amely 2-3 tégely kövekkel bélelt vizet melegít fel. A víz felforr és elpárolog, lágy gőzt képezve. Mindezt az egyszerű eszközt a szék támlájához erősített fapolcra helyezzük. A polc belső falai alumínium lemezekkel szigeteltek. Használhat alumínium fagyasztót is egy régi hűtőszekrényből. Az elektromos fűtőtestet az oldalán kövekkel kell kibélelni. Fontos, hogy ne érintse meg a polc falait.
A páciens egy széken ül, és a székkel együtt egy takaróba bugyolálják. Kívánatos, hogy ebben a "gubóban" legyen egy elektromos termosztát, amely állandó hőmérsékletet biztosít. A hőmérséklet szabályozására speciális hőmérőt használnak.
Ha a szaunához karfás széket használnak, akkor speciális íveket kell föléjük helyezni, hogy a „gubó” belsejében kis hely maradjon a levegő keringéséhez. A szék háttámlájának nem kell szilárdnak lennie.
Igény szerint a kezek kivehetők, amelyekhez takaró helyett kabátot helyeznek a betegre és gombokkal rögzítik, a derék alatt pedig takaróba tekerik. A fej a hipertermiás eljárások során kívül marad. Az otthoni gőzfürdő egyik fontos előnye, hogy az egész test felmelegszik (fél óra vagy egy óra alatt a testhőmérséklet eléri a 40 °-ot), ugyanakkor az ember szobahőmérsékletű levegőt lélegzik. Egyébként az egyes testrészek vagy szervek helyi fűtése véleményem szerint nem hatékony. Nyilvánvalóan ez a helyi felmelegedéssel szembeni fordított vaszkuláris reakcióknak köszönhető.
A hipertermiás eljárás során ajánlott forró teát (gyógynövényes vagy zöld) inni mézzel - az izzadás fokozása érdekében. Annak érdekében, hogy az izzadság könnyen felszívódjon, vegyen fel pamut alsóneműt. Az eljárás befejezése után kontrasztzuhanyt veszünk, hogy a testet normál hőmérsékletre hűtsük.
Onkológiai betegségek esetén napi két hipertermiás kezelést végeznek (reggel és délután), amelyek 2-4 óráig tartanak. A levegő optimális hőmérséklete 40-42°. A kezelés időtartama 10 nap. 6-10-szer megismételjük napos szünetekkel.
Ezenkívül a vér sejtpusztulási termékektől való megtisztítására javasolt intézkedések: terápiás böjtölés, gyümölcsléterápia (például zöldséglevek, piros, sárga és fekete színű gyümölcsök és bogyók levének vétele), adszorbensek fogyasztása, vegetáriánus ételek, agyagterápia stb. .
Még jobb, ha egy speciális infravörös sugárzású sütőt használunk otthoni szaunához. Sugarai lágyabbak, egyenletesebben, mélyebben hatolnak be a szövetekbe. Ilyen sütők a kereskedelemben is kaphatók otthoni használatra.
Az infravörös hősugárzásnak számos előnye van. Először is könnyebb szállítani. Ez különösen fontos a súlyosan betegek és legyengült emberek számára. Másodszor, mély daganatok és áttétek esetén hatékonyabb. Sajnos az infrafűtés alkalmazására vonatkozó speciális tanulmányokról nem találkoztam információval. Biztos vagyok benne, hogy ez a jövő.
Annak ellenére, hogy a hivatalos gyógyászatban a test felmelegítése onkológiai betegségek esetén ellenjavallt, vannak olyan klinikák Oroszországban és külföldön, ahol ezt a betegséget hővel kezelik. Van egy ilyen klinika például Gorkijban, ahol szarkofág formájában termikus kamrát használnak (mint az itt leírt módszernél, a fej kívül marad). Az eljárások az eszközök felügyelete mellett zajlanak.
Végezetül azt akarom mondani, hogy a test elhúzódó hipertermiája nagyon fiziológiás módszer. Lázhoz hasonlít - a szervezet természetes reakciója a betegség kórokozójára, amikor a szervezet a hőmérséklet emelkedése segítségével küzd a betegséggel.
Népszerű linkek
Legfrissebb cikkek
Népszerű cikkek
A közösségi hálózatokon vagyunk
A cikkek tömeges másolása (oldalonként 5-nél több) tilos.
Másolás engedélyezett csak aktív, nem zárt tól
. Aggodalom a kezelhetetlen mellékhatások miatt (például székrekedés, hányinger vagy tudatzavar. Aggodalom a fájdalomcsillapítóktól való függőség miatt. A kezelés túl költséges lehet a betegek és családjaik számára A szabályozott anyagok szigorú szabályozása A kezeléshez való hozzáféréssel vagy a kezeléshez való hozzáféréssel kapcsolatos problémák Az opiátok nem állnak rendelkezésre gyógyszertárakban a betegek számára Nem elérhető gyógyszerek A rugalmasság kulcsfontosságú a rákos fájdalmak kezelésében Mivel a betegek diagnózisa, a betegség stádiumai, a fájdalomra adott reakcióik és a személyes preferenciák különböznek egymástól, ezért ezeket a sajátosságokat kell vezérelni. 6 gyógyítani vagy legalább stabilizálni a rák kialakulását. Más terápiákhoz hasonlóan egy adott rák kezelésére történő sugárterápia alkalmazásának megválasztása számos tényezőtől függ. Ide tartozik többek között a rák típusa, a beteg fizikai állapota, a rák stádiuma és a daganat elhelyezkedése. A sugárterápia (vagy a sugárterápia a daganatok zsugorodásának fontos technológiája. A nagy energiájú hullámok rákos daganatra irányulnak. A hullámok sejtkárosodást okoznak, megzavarják a sejtfolyamatokat, megakadályozzák a sejtosztódást, és végül a rosszindulatú sejtek pusztulásához vezetnek. A sugárterápia egyik jelentős hátránya, hogy a sugárzás nem specifikus (vagyis nem kizárólag a rákos sejtekre irányul a rákos sejtek számára, és károsíthatja az egészséges sejteket is. A normál és rákos sejtek válaszreakciója szövet a terápiára A daganat és a normál szövetek sugárzásra adott válasza a kezelés előtti és alatti növekedési mintázatától függ. A sugárzás a DNS-sel és más célmolekulákkal való kölcsönhatás révén elpusztítja a sejteket. A halál nem azonnal következik be, hanem akkor következik be, amikor a sejtek megpróbálnak osztódni. a sugárzás hatására az osztódási folyamat meghibásodik, ezt abortív mitózisnak nevezik. Emiatt a sugárkárosodás gyorsabban jelentkezik a gyorsan osztódó sejteket tartalmazó szövetekben, és a rákos sejtek gyorsan osztódnak. A normál szövetek kompenzálják a sugárterápia során elvesztett sejteket azáltal, hogy felgyorsítják a többi sejt osztódását. Ezzel szemben a daganatsejtek a sugárterápia után lassabban kezdenek osztódni, és a daganat mérete csökkenhet. A tumorzsugorodás mértéke a sejttermelés és a sejthalál közötti egyensúlytól függ. A karcinóma egy olyan ráktípus példája, amely gyakran nagy osztódási arányt mutat. Az ilyen típusú rák általában jól reagál a sugárterápiára. Az alkalmazott sugárdózistól és az egyedi daganattól függően a daganat a terápia leállítása után újra növekedhet, de gyakran lassabban, mint korábban. A sugárzást gyakran műtéttel és/vagy kemoterápiával kombinálják, hogy megakadályozzák a daganatok újbóli növekedését. A sugárterápia gyógyító céljai: A gyógyító célokból az expozíciót általában növelik. A sugárzásra adott válasz az enyhétől a súlyosig terjed. Tünetek enyhítése: Ez az eljárás a rák tüneteinek enyhítésére és a túlélés meghosszabbítására irányul, kényelmesebb életkörülményeket teremtve. Ezt a fajta kezelést nem feltétlenül a beteg meggyógyításának szándékával végezzük. Gyakran ezt a fajta kezelést a csontba áttétezett rák okozta fájdalom megelőzésére vagy megszüntetésére adják. Besugárzás műtét helyett: A műtét helyett a besugárzás hatékony eszköz korlátozott számú rákos megbetegedéssel szemben. A kezelés akkor a leghatékonyabb, ha a rákot korán észlelik, de még kicsi és nem metasztatikus. A műtét helyett sugárterápia alkalmazható, ha a rák lokalizációja megnehezíti vagy lehetetlenné teszi a műtét elvégzését anélkül, hogy komoly kockázatot jelentene a betegre. A sebészet a választott kezelés olyan elváltozások esetén, amelyek olyan területen helyezkednek el, ahol a sugárterápia több kárt okozhat, mint a műtét. A két eljáráshoz szükséges idő is nagyon eltérő. A műtét gyorsan elvégezhető a diagnózis felállítása után; a sugárterápia hetekig is eltarthat, amíg teljesen hatásos lesz. Mindkét eljárásnak vannak előnyei és hátrányai. A sugárterápia alkalmazható a szervek megmentésére és/vagy a műtét és annak kockázatainak elkerülésére. A sugárzás elpusztítja a gyorsan osztódó sejteket a daganatokban, míg a műtéti eljárások során néhány rosszindulatú sejt hiányzik. A nagy tumortömegek azonban gyakran oxigénszegény sejteket tartalmaznak a központban, amelyek nem osztódnak olyan gyorsan, mint a daganat felszínéhez közeli sejtek. Mivel ezek a sejtek nem osztódnak gyorsan, nem annyira érzékenyek a sugárterápiára. Emiatt a nagy daganatokat nem lehet pusztán sugárzással elpusztítani. A kezelés során gyakran kombinálják a sugárzást és a műtétet. Hasznos cikkek a sugárterápia jobb megértéséhez: "> Sugárterápia 5 Bőrreakciók célzott terápiával Bőrproblémák Légszomj Neutropénia Idegrendszeri betegségek Hányinger és hányás Nyálkahártya-gyulladás Menopauza tünetek Fertőzések Hiperkalcémia Férfi nemi hormon Fejfájás Kéz- és lábszindróma Hajhullás (alopecia) Limfödéma Ascites Mellhártyagyulladás Ödéma B-vágytalanság Depressziós étvágytalanság kognitív zavarok rium Nyelési nehézség Dysphagia Szájszárazság Xerostomia Neuropathia A specifikus mellékhatásokért olvassa el a következő cikkeket: "> Mellékhatások36 különböző irányú sejthalált okoznak. A gyógyszerek egy része természetes vegyületek, amelyeket különböző növényekben azonosítottak, míg mások laboratóriumban előállított vegyi anyagok. Az alábbiakban röviden ismertetünk néhány különböző típusú kemoterápiás gyógyszert. Antimetabolitok: Olyan gyógyszerek, amelyek megzavarhatják a kulcsfontosságú biomolekulák sejten belüli képződését, beleértve a nukleotidokat, a DNS építőköveit. Ezek a kemoterápiás szerek végső soron megzavarják a replikációs folyamatot (a leány-DNS molekula termelődését és ezáltal a sejtosztódást. Az antimetabolitok példái a következő gyógyszerek: Fludarabine, 5-Fluorouracil, 6-Thioguanine, Flutorafur, Cytarabine. Genotoxikus gyógyszerek: Károsító gyógyszerek DNS Azáltal, hogy ezt a károsodást okozzák, ezek a szerek beavatkoznak a DNS-replikáció és a sejtosztódás folyamatába. Például gyógyszerek: buszulfán, karmusztin, epirubicin, idarubicin. Orsó inhibitorok (vagy mitózisgátlók: Ezek a kemoterápiás szerek a megfelelő sejtosztódás megakadályozását célozzák, kölcsönhatásba lépnek a citoszkeleton olyan összetevőivel, amelyek lehetővé teszik egy sejt két részre osztódását.Például a paklitaxel gyógyszer, amelyet a csendes-óceáni tiszafa kérgéből és félszintetikusan az angol tiszafa kérgéből nyernek (Tiszafa bogyó, Taxus baccata. Mindkét gyógyszer Egyéb kemoterápiás szerek: Ezek a szerek gátolják (lassítják a sejtosztódást olyan mechanizmusok által, amelyek nem tartoznak a fent felsorolt három kategóriába. A normál sejtek ellenállóbbak (rezisztensek a gyógyszerekkel szemben, mert gyakran abbahagyják az osztódást nem kedvező körülmények között. Azonban nem minden normálisan osztódó sejt kerüli el a kemoterápiás gyógyszerekkel való érintkezést, ami ezeknek a gyógyszereknek a toxicitásának bizonyítéka. az osztódók pl. , a csontvelőben és a bél nyálkahártyájában általában szenvednek leginkább A normál sejtek elpusztulása a kemoterápia egyik gyakori mellékhatása A kemoterápia árnyalatairól bővebben a következő cikkekben olvashat: "> Kemoterápia 6
- és a nem kissejtes tüdőrák. Ezeket a típusokat a sejtek mikroszkóp alatti megjelenése alapján diagnosztizálják. A megállapított típus alapján választják ki a kezelési lehetőségeket. A betegség prognózisának és túlélési arányának megértése érdekében íme az Egyesült Államok nyílt forráskódú statisztikái 2014-re mindkét tüdőráktípusra együtt: Új esetek (prognózis: 224 210 Előrejelzett halálozás: 159 260 Nézzük meg közelebbről mindkét típust, sajátosságait és kezelési lehetőségeit. "> Tüdőrák 4
- az Egyesült Államokban 2014-ben: Új esetek: 232 670 halálozás: 40 000 A mellrák a leggyakoribb nem bőrrák a nők körében az Egyesült Államokban (nyílt források becslése szerint 62 570 preinvazív betegség (in situ, 232 670 új invazív betegség). , és 40 000 haláleset. Így hatodik mellrákkal diagnosztizált nőből kevesebb, mint egy hal bele a betegségbe.Összehasonlításképpen a becslések szerint körülbelül 72 330 amerikai nő halt meg tüdőrákban 2014-ben. Mellrák mirigyek férfiaknál (igen, igen, ott ez egy ilyen dolog.Az összes emlőrákos eset és a betegségből eredő halálozás 1%-át teszi ki.A széles körben elterjedt szűrés növelte az emlőrák előfordulási gyakoriságát és megváltoztatta a felismert rák jellemzőit Miért nőtt?Igen, mert a modern módszerek lehetővé tették az alacsony kockázatú rák, a rákmegelőző elváltozások és a duktális rák előfordulásának in situ kimutatását (DCIS. Az USA-ban és az Egyesült Királyságban végzett populációs vizsgálatok a DCIS és az invazív emlőrák előfordulásának növekedését mutatják 1970 óta, ez a menopauza utáni hormonterápia és a mammográfia széles körű elterjedésének köszönhető. Az elmúlt évtizedben a nők tartózkodtak a posztmenopauzális hormonok használatától, és csökkent az emlőrák előfordulása, de nem arra a szintre, amelyet a mammográfiás vizsgálat széles körű alkalmazásával el lehet érni. Kockázati és védőfaktorok Az életkor növekedése a mellrák legfontosabb kockázati tényezője. Az emlőrák további kockázati tényezői a következők: Családi anamnézis o Alapvető genetikai hajlam Szexuális mutációk a BRCA1 és BRCA2 génekben, valamint más emlőrákra hajlamosító génekben Alkoholfogyasztás Mellszövet sűrűsége (mammográfiás) Ösztrogén (endogén: o Menstruációs anamnézis (menstruáció kezdete) ) / késői menopauza o Nincs szülés a kórelőzményben o Idősebb életkor az első gyermek születésénél Hormonterápia kórtörténete: o Ösztrogén és progesztin kombinációja (HRT Orális fogamzásgátlás Elhízás Mozgáshiány Személyes emlőrák kórtörténete Jóindulatú emlőbetegség proliferatív formáinak személyes anamnézisében Mellsugárzás expozíció Az összes emlőrákos nő 5-10%-ánál előfordulhat csíravonal-mutáció a BRCA1 és BRCA2 génekben. A kutatások kimutatták, hogy a BRCA1 és BRCA2 specifikus mutációi gyakoribbak a zsidó származású nők körében. A BRCA2 mutációt hordozó férfiaknál is nagyobb a mellrák kialakulásának kockázata. A BRCA1 gén és a BRCA2 mutációi szintén növelik a petefészekrák vagy más elsődleges rák kialakulásának kockázatát. A BRCA1 vagy BRCA2 mutációk azonosítása után kívánatos, hogy a család többi tagja vegyen részt genetikai tanácsadáson és vizsgálaton. A mellrák kialakulásának kockázatát csökkentő védőfaktorok és intézkedések a következők: Ösztrogénhasználat (különösen méheltávolítás után). Edzésszokás kialakítása Korai terhesség Szoptatás Szelektív ösztrogénreceptor modulátorok (SERM-ek) Aromatáz inhibitorok vagy inaktivátorok Csökkent a mastectomia kockázata Csökkent a peteeltávolítás, ill. eltávolítás Petefészek-petefészek-szűrés Klinikai vizsgálatok kimutatták, hogy a tünetmentes nők mammográfiás szűrése klinikai emlővizsgálattal vagy anélkül csökkenti az emlőrák mortalitást A betegség stádiuma A terápia megválasztása Az emlőrák diagnosztizálására a következő vizsgálatokat és eljárásokat alkalmazzuk: Mammográfia Ultrahang Emlő mágneses rezonancia képalkotás (MRI, ha klinikailag indokolt Biopszia Ellenoldali emlőrák Patológiailag az emlőrák lehet többcentrikus és kétoldali vereség. A kétoldali betegség valamivel gyakoribb az infiltráló fokális karcinómában szenvedő betegeknél. A diagnózis után 10 évig az elsődleges emlőrák kockázata az ellenoldali emlőben 3% és 10% között mozog, bár az endokrin terápia csökkentheti ezt a kockázatot. A második emlőrák kialakulása a hosszú távú kiújulás fokozott kockázatával jár. Abban az esetben, ha a BRCA1 / BRCA2 génmutációt 40 éves kor előtt diagnosztizálták, a második emlőrák kockázata a következő 25 évben eléri az 50%-ot. Az emlőrákban diagnosztizált betegeknél a diagnózis idején kétoldali mammográfiát kell végezni, hogy kizárják a szinkron betegséget. Az MRI szerepe az ellenoldali emlőrák szűrésében és az emlőmegtartó terápiával kezelt nők monitorozásában folyamatosan fejlődik. Mivel kimutatták, hogy a lehetséges betegségek mammográfiáján megnövekedett kimutatási arány, az MRI-t gyakrabban használják kiegészítő szűrésre, a randomizált, ellenőrzött adatok hiánya ellenére. Mivel az MRI-pozitív leletek mindössze 25%-a jelent rosszindulatú daganatot, a kezelés megkezdése előtt kóros megerősítés javasolt. Nem ismert, hogy a betegségfelismerési arány növekedése javítja-e a kezelési eredményeket. Prognosztikai tényezők Az emlőrákot általában a műtét, a sugárterápia, a kemoterápia és a hormonterápia különböző kombinációival kezelik. A következtetéseket és a terápia kiválasztását a következő klinikai és kórtani jellemzők befolyásolhatják (hagyományos szövettani és immunhisztokémiai adatok alapján): A beteg klimaxos státusza Betegség stádiuma A primer tumor fokozata A daganat státusza az ösztrogénreceptorok (ER és progeszteron) állapotától függően receptorok (PR. Szövettani típusok). Az emlőrákot különböző szövettani típusokba sorolják, amelyek közül néhány prognosztikai értékű. Például a kedvező szövettani típusok közé tartozik a kolloidális, velős és tubuláris rák. A molekuláris profilalkotás alkalmazása mellrákban magában foglalja a a következők: ER és PR állapotvizsgálat HER2/Neu státusz Ezen eredmények alapján az emlőrák besorolása: Hormonreceptor pozitív HER2 pozitív Hármas negatív (ER, PR és HER2/Neu negatív Bár néhány ritka öröklött mutáció, mint például a BRCA1 és BRCA2 hajlamosít emlőrák kialakulására a mutáció hordozóiban, a BRCA1 /BRCA2 mutációt hordozók prognosztikai adatai azonban ellentmondásosak; ezek a nők egyszerűen nagyobb kockázatnak vannak kitéve a második mellrák kialakulásának. De nem biztos, hogy ez megtörténhet. Hormonpótló terápia Alapos mérlegelés után a súlyos tünetekkel küzdő betegek hormonpótló terápiát kaphatnak. Nyomon követés Az I., II. vagy III. stádiumú emlőrák elsődleges kezelésének befejezését követő nyomon követés gyakorisága és a szűrés megfelelősége továbbra is vitatott. A véletlen besorolású vizsgálatokból származó bizonyítékok azt mutatják, hogy a rendszeres csontvizsgálatokkal, máj ultrahanggal, mellkasröntgennel és májfunkciós vérvizsgálatokkal végzett követés egyáltalán nem javítja a túlélést vagy az életminőséget a rutin fizikális vizsgálatokhoz képest. Még ha ezek a vizsgálatok lehetővé teszik a betegség kiújulásának korai felismerését, ez nem befolyásolja a betegek túlélését. Ezen adatok alapján az I–III. stádiumú emlőrák miatt kezelt, tünetmentes betegek korlátozott utánkövetése és éves mammográfiája elfogadható nyomon követés lehet. További információk a cikkekben: "> Emlőrák5
- , az uretereket és a proximális húgycsövet speciális nyálkahártya borítja, amelyet átmeneti epitheliumnak (más néven urotheliumnak is neveznek. A húgyhólyagban, a vesemedencében, az ureterekben és a proximális húgycsőben képződő legtöbb rák átmeneti sejtkarcinóma (más néven uroteliális karcinóma, amely átmeneti epitéliumból származik). hám Az átmeneti sejtes húgyhólyagrák lehet alacsony vagy magas fokú: Az alacsony fokú hólyagrák a kezelés után gyakran kiújul a hólyagban, de ritkán támadja meg a hólyag izmos falait, vagy terjed át a test más részeire A betegek ritkán halnak meg a hólyagban rák A magas fokú húgyhólyagrák általában a hólyagban kiújul, és erősen hajlamos arra, hogy a hólyag izmos falait megtámadja, és átterjedjen a test más részeire. sokkal nagyobb valószínűséggel vezet a halálhoz. Szinte minden hólyagrák okozta haláleset erősen rosszindulatú daganatok következménye. A húgyhólyagrák is izom-invazív és nem izom-invazív betegségekre osztható, amelyek az izombélés invázióján alapulnak (más néven detrusor, amely a hólyag izomfalának mélyén található. Az izom-invazív betegség sok nagyobb valószínűséggel terjed át a test más részeire, és általában vagy a hólyag eltávolításával, vagy a hólyag sugár- és kemoterápiás kezelésével kezelik. Amint fentebb megjegyeztük, a magas fokú rákos megbetegedések sokkal nagyobb valószínűséggel izom-invazív rákok, mint az alacsony. - fokú rákos megbetegedések. Így az izominvazív rákot általában agresszívebbnek tekintik, mint a nem izom-invazív rákot. A nem izominvazív betegséget gyakran úgy lehet kezelni, hogy transzuretrális módszerrel eltávolítják a daganatot, és néha kemoterápiát vagy más olyan eljárást alkalmaznak, amelyben gyógyszert injekcióznak. a húgyutakba Húgyhólyag katéterrel a rák elleni küzdelemben. A húgyhólyagban rák krónikus gyulladásos állapotok esetén fordulhat elő, mint például a Schistosoma hematobium parazita okozta hólyagfertőzés, vagy laphám metaplázia következtében; A laphámhólyagrák előfordulási gyakorisága magasabb krónikus gyulladásos állapotokban, mint egyébként. A hólyagban az átmeneti karcinóma és laphámrák mellett adenokarcinóma, kissejtes karcinóma és szarkóma is kialakulhat. Az Egyesült Államokban az átmeneti sejtkarcinómák teszik ki a túlnyomó többséget (a húgyhólyagrákok több mint 90%-át), azonban az átmeneti karcinómák jelentős része laphámsejtes vagy egyéb differenciálódási területekkel rendelkezik Karcinogenezis és kockázati tényezők A rákkeltő anyagok hatásáról komoly bizonyítékok állnak rendelkezésre A húgyhólyagrák kialakulásának leggyakoribb kockázati tényezője a dohányzás. Becslések szerint az összes húgyhólyagrákos megbetegedések felét a dohányzás okozza, és a dohányzás két-két emberben növeli a hólyagrák kialakulásának kockázatát a kiindulási kockázat négyszerese. A kevésbé funkcionális polimorfizmusú N-acetil-transzferáz-2 (úgynevezett lassú acetilátor) dohányosoknál nagyobb a hólyagrák kialakulásának kockázata, mint más dohányosoknál, nyilvánvalóan a rákkeltő anyagok méregtelenítő képességének csökkenése miatt. Egyes foglalkozási expozíciók hólyagrákkal is összefüggésbe hozható, és a hólyagrák magasabb arányáról számoltak be a textilfestékek és a gumi miatt az abroncsiparban; művészek között; bőrfeldolgozó iparágak dolgozói; cipészek; valamint alumínium-, vas- és acélmunkások. A hólyagkarcinogenezissel kapcsolatos specifikus vegyszerek közé tartozik a béta-naftilamin, a 4-amino-bifenil és a benzidin. Míg ezek a vegyszerek manapság általában betiltottak a nyugati országokban, sok más, még mindig használatban lévő vegyszerről is feltételezik, hogy hólyagrákot váltanak ki. A ciklofoszfamid kemoterápiás szer expozícióját a hólyagrák fokozott kockázatával is összefüggésbe hozták. A krónikus húgyúti fertőzések és a S. haematobium parazita által okozott fertőzések szintén összefüggésbe hozhatók a hólyagrák, és gyakran a laphámrák fokozott kockázatával. Úgy gondolják, hogy a krónikus gyulladás kulcsszerepet játszik a karcinogenezis folyamatában ilyen körülmények között. Klinikai jellemzők A hólyagrák általában egyszerű vagy mikroszkopikus hematuria formájában jelentkezik. Ritkábban a betegek panaszkodhatnak gyakori vizelésről, nocturiáról és dysuriáról, ezek a tünetek gyakoribbak a karcinómás betegeknél. A felső húgyúti uroteliális rákban szenvedő betegek fájdalmat tapasztalhatnak a daganatos elzáródás miatt. Fontos megjegyezni, hogy az uroteliális karcinóma gyakran multifokális, ezért a teljes urothelium vizsgálatára van szükség, ha daganatot találnak. A húgyhólyagrákban szenvedő betegeknél a felső húgyutak képalkotása elengedhetetlen a diagnózishoz és a nyomon követéshez. Ez ureteroszkópiával, retrográd pyelogrammal a cisztoszkópiában, intravénás pyelogrammal vagy számítógépes tomográfiával (CT urogram) érhető el. Ezenkívül a felső húgyúti átmeneti sejtes karcinómában szenvedő betegeknél nagy a hólyagrák kialakulásának kockázata; ezeknél a betegeknél időszakos cisztoszkópiára van szükség és az ellentétes felső húgyutak megfigyelése Diagnózis Hólyagrák gyanúja esetén a leghasznosabb diagnosztikai vizsgálat a cisztoszkópia A radiológiai vizsgálat, például a komputertomográfia vagy az ultrahang nem elég érzékeny ahhoz, hogy hasznos legyen a hólyagrák kimutatásában Cisztoszkópia végezhető az urológián Ha rák cisztoszkópia során találnak, a pácienst általában bimanuális vizsgálatra írják elő altatásban és ismételt cisztoszkópiát a műtőben, hogy a daganat transzuretrális reszekciója és/vagy biopszia elvégezhető legyen. Túlélés A hólyagrákban elhunyt betegeknél szinte mindig a hólyagból áttétek vannak más szervekbe. Az alacsony fokú húgyhólyagrák ritkán nő be a hólyag izmos falába, és ritkán ad áttétet, ezért az alacsony fokú (I. stádiumú hólyagrákban) szenvedő betegek nagyon ritkán halnak bele a rákba, azonban többszörös kiújulást is tapasztalhatnak, amelyek kezelést igényelnek. reszekciók.A húgyhólyagrákból eredő halálozások szinte mindegyike súlyos fokú betegségben szenvedő betegek körében fordul elő, amely sokkal nagyobb potenciállal rendelkezik, hogy mélyen behatoljon a hólyag izmos falaiba, és átterjedjen más szervekre.Az újonnan diagnosztizált betegek körülbelül 70-80%-a hólyagrák a hólyag felszínes hólyagdaganatokkal rendelkezik (azaz Ta, TIS vagy T1 stádiumú. Ezeknek a betegeknek a prognózisa nagymértékben függ a daganat fokozatától. A magas fokú daganatokban szenvedő betegeknél jelentős a rákos halálozás kockázata, még akkor is, ha az nem izom-invazív rák Azok a magas fokú daganatos betegek, akiknél felszínes, nem izom-invazív hólyagrákot diagnosztizálnak, a legtöbb esetben nagy eséllyel gyógyulnak meg, sőt izom-invazív betegség esetén is esetenként a beteg gyógyítható. Tanulmányok kimutatták, hogy néhány távoli áttétben szenvedő betegnél az onkológusok hosszú távú teljes választ értek el a kombinált kemoterápiás kezelést követően, bár a legtöbb ilyen betegnél a metasztázisok a nyirokcsomókra korlátozódnak. Másodlagos hólyagrák A hólyagrák hajlamos kiújulni még akkor is, ha a diagnózis idején nem invazív. Ezért bevett gyakorlat a húgyutak megfigyelése a húgyhólyagrák diagnózisa után. Azonban még nem végeztek vizsgálatokat annak felmérésére, hogy a megfigyelés befolyásolja-e a progresszió arányát, a túlélést vagy az életminőséget; bár vannak klinikai vizsgálatok az optimális követési ütemterv meghatározására. Úgy gondolják, hogy az uroteliális karcinóma egy úgynevezett terepi defektust tükröz, amelyben a rák olyan genetikai mutációk következménye, amelyek széles körben jelen vannak a páciens hólyagjában vagy az urotheliumban. Így azoknál az embereknél, akiknél kimetszett hólyagdaganat volt, gyakran később folyamatban lévő daganatok vannak a hólyagban, gyakran az elsődleges daganattól eltérő helyeken. Hasonlóképpen, de ritkábban, daganatok alakulhatnak ki náluk a felső húgyutakban (azaz a vesemedencében vagy az ureterben. A kiújulási mintázatok másik magyarázata az, hogy a daganat eltávolításakor elpusztuló rákos sejtek újra beültethetők egy másikba. helye az urotheliumban.Ezt a második elméletet alátámasztva, hogy a daganatok nagyobb valószínűséggel újulnak meg a kezdeti rák alatt, mint visszafelé. A felső traktus rákja nagyobb valószínűséggel ismétlődik a hólyagban, mint a hólyagrák a felső húgyutakban. A többi a következő cikkekben: "> húgyhólyagrák4
- és a metasztatikus betegségek fokozott kockázata. A differenciálódás mértéke (a daganat fejlődési stádiumának meghatározása nagyban befolyásolja a betegség lefolyását és a kezelés megválasztását. A méhnyálkahártya daganatos megbetegedések számának növekedését tapasztalták a hosszan tartó, ellentétes ösztrogénexpozícióval összefüggésben (fokozott Ezzel szemben a kombinált terápia (ösztrogén + progeszteron megakadályozza a méhnyálkahártya-rák megnövekedett kockázatát, amely a specifikus ösztrogén hatásaival szembeni rezisztencia hiányával jár.A diagnózis felállítása nem a legjobb idő.Azonban tisztában kell lennie azzal, hogy az endometriumrák kezelhető betegség.Figyelje a tüneteket, és minden rendben lesz!Egyes betegeknél szerepet játszhat az endometriumrák "aktivátorában" a korábbi komplex hyperplasia atípiával. A kutatók szerint ennek oka a tamoxifen endometriumra gyakorolt ösztrogén hatása, ezért a tamoxifen-kezelésben részesülő betegeknél rendszeres kismedencei vizsgálaton kell részt venni, és figyelniük kell a kóros méhvérzésekre. Szövettan A rosszindulatú méhnyálkahártya rákos sejtek terjedése részben a sejtdifferenciálódás mértékétől függ. A jól differenciált daganatok hajlamosak korlátozni terjedésüket a méh nyálkahártyájának felszínére; a myometrium expanziója ritkábban fordul elő. A rosszul differenciált daganatokban szenvedő betegeknél sokkal gyakoribb a myometrium inváziója. A myometrium inváziója gyakran előfutára a nyirokcsomók érintettségének és a távoli metasztázisoknak, és gyakran a differenciálódás mértékétől függ. A metasztázis a szokásos módon történik. Gyakori a kismedencei és paraaorta csomópontokra való terjedése. Távoli áttétek előfordulásakor leggyakrabban a következőkben fordul elő: Tüdő. Lágyéki és supraclavicularis csomópontok. Máj. Csontok. Agy. Hüvely. Prognosztikai tényezők Az ektópiás és noduláris tumor terjedésével összefüggő másik tényező a kapilláris-nyiroktér bevonása a szövettani vizsgálatba. A három klinikai stádiumú prognosztikai csoportosítást gondos műtéti stádiumozás tette lehetővé. Azok a betegek, akiknek 1. stádiumú daganata csak az endometriumot érinti, és nincs bizonyíték intraperitoneális betegségre (azaz adnexális kiterjedés), alacsony kockázatnak vannak kitéve (">endometriumrák). 4
A modern élet őrült tempójában nem mindenki tud néhány szabad órát orvoshoz fordulni, még akkor sem, ha rosszul érzi magát. Oldalunk tele van átfogó és megbízható információkkal számos betegség okairól, klinikai megnyilvánulásairól, diagnosztikai és kezelési módszereiről.
A főoldalon található kényelmes alfabetikus index segít gyorsan megtalálni a teljes információt az érdeklődésre számot tartó betegségről, a fejlődés okairól és a tanfolyam jellemzőiről.
- Diagnosztika
Ez a rész ismerteti a betegek vizsgálatához használt általános diagnosztikai lehetőségeket. Az ebben a részben bemutatott cikkek az eljárások ismertetése mellett segítenek megismerni a kapott eredmények átiratát, megtudni, hogy ezek vagy azok a mutatók milyen információkat hordoznak.
A rubrika azoknak is hasznos lesz, akik éppen egy bizonyos diagnosztikai eljárás előtt állnak, mivel segít felkészülni a vizsgálatra, elkerülve ezzel az esetleges hibákat.
- Kezelési módszerek
A kezelési módszerekről szóló rész segít részletesen megismerkedni az innovatív terápia lehetőségeivel az onkológiai természetű betegségek, a méhrák kialakulására való örökletes hajlam, a halláskárosodás, valamint sok más súlyos lefolyású, ill. komoly következmények.
- Elsősegély
Ez egy különösen hasznos rubrika minden ember számára. Ez a rész részletesen leírja azokat a nem szabványos helyzetekre vonatkozó lehetőségeket, amelyekkel bárki találkozhat. Mit kell tenni fagyás esetén, hogyan lehet segíteni fulladásnál, eszméletvesztésnél vagy törésnél, mit kell tenni kígyómarás esetén, mielőtt szakképzett orvosi segítséget nyújtanának az áldozatnak, számos más vészhelyzetet is figyelembe vesznek. Az elsősegélynyújtási ismeretek ismerete segíti a gyors és céltudatos cselekvést, megelőzi az esetleges zavart és késlekedést.
- Betegségek
A legátfogóbb és mindenki számára leghasznosabb a betegségekről szóló rész. A szakasz áttekintése után megismerheti a betegségek széles skálájának első klinikai megnyilvánulásait, diagnosztikai módszereket, standard és egyedi kezelési módszereket. Itt is találhat hasznos tippeket számos ismert betegség megelőzésére.
- Vegyes
Ez a rész is sokak számára hasznos lesz. Ez a rész segít választ kapni a gyakran ismételt kérdésekre. Például: hogyan utazzunk valakihez, aki allergiában szenved? Hogyan gyógyulnak a törések, felgyorsíthatók-e ezek a folyamatok? A manapság olyan népszerű vapes károsak az egészségre? E rovatunk cikkei ezekre és sok más kérdésre is teljes és részletes választ adhatnak.
Oldalunk a kismamák számára is hasznos lesz, mert tájékoztatást ad a védőoltások előnyeiről és ártalmairól, arról, hogy milyen módszerekkel erősíthető az immunrendszer, keményíthető a baba, milyen jelek utalhatnak a gyermek viselkedésében bekövetkezett változásra. betegségek és patológiák fejlődési szakaszai ? Egyszóval sokoldalú forrásunkon minden látogató választ kap az általa keresett kérdésre.
Természetesen egy ilyen kényelmes asszisztens jelenléte, mint a weboldalunk, nem helyettesítheti az orvos teljes körű látogatását. Fontos megjegyezni, hogy ha rosszul érzi magát, az öngyógyítás az állapot jelentős romlásához és a meglévő betegségek progressziójához vezethet.
Portálunk csak oktatási és tájékoztatási célokat szolgál, de nem cselekvési útmutató.
Mielőtt kipróbálná a javasolt kezelési módszereket magán, fontos, hogy szakképzett szakember tanácsát kérje.A hipertermia immár szerepel az NCCN klinikai gyakorlati irányelveiben a visszatérő emlőrák kezelésére. Dr. Arkady Bessantin (Izrael, Tel Aviv) sikeresen alkalmazza ezt a modern technikát mellrákos betegek kezelésében.
A felülvizsgálat célja– az elmúlt évtizedekben végzett klinikai vizsgálatok bemutatása a hipertermia sugárterápiával és/vagy kemoterápiával kombinált alkalmazásáról az emlőrák kezelésére. Ez a cikk részletezi az NCCN alapelveit, amelyek immár magukban foglalják a hipertermia használatát az emlőrák visszatérő bőrelváltozásainak klinikai kezelésére, alátámasztva a hipertermia potenciális pozitív szerepét a daganat kiújulásának helyi szabályozásában.
Hipertermia - túlmelegedés, a túlzott hő felhalmozódása az emberek és állatok testében a testhőmérséklet növekedésével, amelyet olyan külső tényezők okoznak, amelyek gátolják a hőátadást a külső környezetbe, vagy növelik a külső hőáramlást. (Wikipédia)
Bevezetés
Ez az egyik leggyakoribb rákfajta, és komoly problémát jelent, hiszen évről évre nő a megbetegedések száma. Bár az emlőrák korai felismerése jelenleg lehetséges, a betegség korai stádiumában lévő betegek 30%-ánál valószínű, hogy további kiújulása következik be. A lokálisan előrehaladott emlőrákban szenvedő betegek kezelése kemoterápiából, majd radikális mastectomiából (ez olyan műtétből áll, amely az emlő teljes vagy részleges amputációját foglalja magában) és sugárkezelésből, valamint bizonyos esetekben hormonterápiából áll. Bár ez a kombinációs terápia még mindig az optimális választás a helyi tumorkontroll szempontjából, a jobb klinikai eredmény érdekében még mindig új terápiákat kell kiválasztani.
A National Antioxidant Network 2013 (NCCN) alapelveivel összhangban a hipertermia a klinikai gyakorlatban szerepel a visszatérő emlőrák kezelésében. A hipertermia célja, hogy a daganat hőmérsékletét 42-45 ° C-ra emelje, a daganat helyétől függően többféle módszer létezik a hipertermia alkalmazására. Az emlőrákban 5 cm-nél kisebb mélységű daganatok esetében elsősorban a felületes hipertermiát alkalmazzák. A felületes hipertermia sugár- és/vagy kemoterápiával kombinálva hatékonyabbnak bizonyult, mint a sugárterápia vagy a kemoterápia önmagában, mivel a sugárterápia és a hipertermia hatásmechanizmusai kiegészítik egymást. Emellett a hipertermia helyes klinikai alkalmazása is nagy jelentőséggel bír, hiszen a termikus paraméterek, mint például a hőterápia alatti minimális vagy maximális tumorhőmérséklet befolyásolják a kezelés klinikai kimenetelét.
Az ebben az áttekintésben szereplő összes vizsgálatot a Medline-től szerezték be (a MEDlars onLINE MEDLARS (MEDical Literature Analysis and Retrieval System) rövidítése), amely a világ legnagyobb publikált egészségügyi információinak adatbázisa, amely az összes globális publikáció körülbelül 75 százalékát fedi le. 1987-től napjainkig.
Ezek a vizsgálatok bemutatják, hogy a sugárterápiával és/vagy kemoterápiával kombinált hipertermia hogyan hat a mellrákban szenvedő betegekre, és feltárják e kombinált kezelés előnyeit. Az egyes vizsgálatok során kapott adatok megmutatják az elsődleges betegségben vagy az emlőrák visszaesésében szenvedő betegek számát és a kezelésükben alkalmazott terápiás módszereket. A fő értékelt paraméterek a terápiára adott válasz aránya, a teljes és részleges válaszarány, a helyi tumorkontroll és a túlélési arány. Végül a hipertermia által kiváltott toxicitást is figyelembe kell venni.
Eredmények és vita
A felületi daganatok termoradioterápia (RTHT) és sugárterápia összehasonlító vizsgálatának első klinikai eredményeit 1990 előtt publikálták. 1987-ben publikáltak egy tanulmány eredményeit, amelyben a felületes kiújuló rosszindulatú daganatos betegek alacsony dózisú sugárterápiát kaptak lokális hipertermiával vagy anélkül (915 vagy 2450 MHz). A daganatok többsége (53%) emlő adenokarcinóma volt. A teljes és részleges válaszadási arány magasabb volt a kombinált terápiás csoportban, ami arra utal, hogy az alacsony dózisú sugárzással kombinált hipertermia hasznos lehet a felszínes daganatok kiújulásának kezelésében, különösen olyan esetekben, amikor korábban nagyobb dózisú sugárterápiát alkalmaztak. A kezelés során a 3. osztályú toxicitás (azaz a sejtek hámlása a felszínről) hólyagokkal/nedves hámlással 21,2%, illetve 4,2%, a 4. osztályú toxicitás (kis nekrózis (halál) vagy fekélyesedés / masszív fekélyesedés) 24,2 8,3%-kal. Subcutan zsírszövet nekrózist (4. fokozat) 3 betegnél, illetve 1 betegnél jelentettek.
Olyan vizsgálatot végeztek, amely a kombinált kezelés hatékonyságát is bizonyította: 35 visszatérő emlőcarcinomában szenvedő beteg kapott hipertermiát a sugárkezelés mellett, amelyre a besugárzást követő 30 percen belül került sor. A csak sugárterápiában részesülő 9 beteg és 9 RTT-t kapott beteg összehasonlítása azt mutatta, hogy a kezelésre adott válaszarány 33,3% (3/9), illetve 77,7% (7/9) volt. A hipertermiát a szervezet komoly szövődmények nélkül tolerálta.
A Radiation Oncology Therapy Group (RTOG) a felszíni daganatok (beleértve a mellrákot) hipertermia kezelésének értékelésére egy randomizált vizsgálat során összefüggést állapított meg ( egymásrautaltság)a tumor átmérője és a válaszarány között: A vizsgálati eredmények a válasz javulását mutatták, különösen a 3 cm-nél kisebb átmérőjű elváltozásokban, amelyek több mint 2 hipertermiás kezelést kaptak (42,5 °C). A tartós válasz aránya 12 hónap után magasabb volt az RTHT-val kezelt betegeknél, mint a csak sugárterápiával kezelteknél. Ezek az adatok azt mutatják, hogy a hipertermia hozzáadása hosszabb és teljesebb kezelési választ eredményez.
Hipertermia sugárkezeléssel kombinálva előrehaladott vagy lokálisan kiújuló emlőkarcinóma esetén: 40 betegen végeztek vizsgálatokat (10 elsődleges eset és 30 relapszus). Úgy döntöttek, hogy a kisebb elváltozásokkal rendelkező betegek csak sugárterápiát kapnak, míg a nagyobb elváltozásokkal rendelkező betegek RTT-t kapnak. A hipertermiával kezelt daganatok jobban reagáltak a terápiára, mint azok a neoplazmák, amelyek csak sugárterápiát kaptak. Arról is beszámoltak, hogy a sugárkezelésben részesült primer daganatos betegeknél alacsony volt a teljes és részleges válaszreakció és a helyi tumorkontroll, míg ezek az adatok a hozzáadással nőttek. a hipertermia. A műtét után visszatérő daganatokban a sugárkezelést követő lokális kezelésre adott válasz aránya is nőtt a hipertermia hozzáadásával. Arra a következtetésre jutottak, hogy a kombinált kezelés javítja a klinikai eredményt a lokalizált primer és visszatérő emlőrákban szenvedő betegeknél, valamint a daganat mérete is számít. A felületes daganatokban a hipertermia hatékonyabb, ha az elváltozás átmérője kisebb, mint 3 cm.
Az egyik legnagyobb tanulmány a hipertermia hatékonyságának értékelésére 1996-ban jelent meg: ebben az elemzésben összesen 306 lézió szerepelt. Az eredmények 5 különböző randomizált vizsgálatból származtak az emlőrák RTHT-val történő kezelésében (fázis III.) Tanulmányok kimutatták, hogy a hipertermia előnyt jelent, ha a sugárterápiához adják, főleg visszatérő emlőrák esetén, ahol a korábbi sugárkezelés miatt alacsonyabb sugárdózisok. A teljes általános kezelési válaszarány 59% volt RTHT és 41% sugárkezelés esetén.
Egy tanulmány a hipertermia termikus paraméterei és a kezelés kimenetele közötti kapcsolat meghatározására visszatérő emlőrákban szenvedő betegeknél: összehasonlították a kezelésre adott választ RTTT-ben részesülő betegeknél, illetve olyan betegeknél, akik csak sugárterápiát kaptak. Az általános válaszarány 61%, illetve 41% volt. Egy randomizált vizsgálatban értékelték a hődózis szerepét a felületi elváltozások, köztük a mellrák kezelésében. A vizsgálókat a kezelésre adott válasz és a helyi kontroll időtartama érdekelte. A betegeket 2 csoportra osztották. Az első csoportot csak radioterápiával, a második csoportot RTT-vel kezelték. A terápiára adott általános válaszarány és a helyi kontrollpontszám javult a hipertermia hozzáadásával. A helyi kontrollban a legnagyobb javulást azoknál a betegeknél figyelték meg, akik az előző kezelés során már részesültek sugárkezelésben.
2008-as tanulmány: Ebben a vizsgálatban 8 különböző egészségügyi intézmény betegei vettek részt. Mindegyiküknél visszatérő emlőkarcinóma volt, és mindegyikük ismételt besugárzást kapott a helyi kiújulás után. Néhány beteg hipotermiát is kapott a sugárterápia mellett. A kezelésre adott általános válaszarány 67% volt hipotermia esetén és 39% anélkül.
A hipertermia, mint lokálisan kiújuló emlőkarcinóma palliatív kezelésének hatékonyságának igazolása: 30 emlőrákos beteg más hagyományos módszerrel végzett kezelést követően kapott alacsony dózisú sugárzást + 1 órás hipertermia. Az eredmények megerősítették a hipertermia hatását az emlőrák kiújulásának csökkentésére. Ezenkívül az 5 cm-nél kisebb átmérőjű elváltozások jobban reagáltak a kombinált kezelésre.
Az RTHT bizonyítottan biztosítjaHelyi daganatkontroll javítása visszatérő emlőrák kezelésében: 34 beteg kapott RTT-t, 4 beteg kapott kemoterápiát plusz hipertermiát, és 4 beteg csak hipertermiát kapott. Megállapították, hogy csak az RTTT-t kapott betegek reagáltak teljes mértékben a terápiára, és javult a lokális betegségkontroll, 44 lokálisan kiújuló emlőadenocarcinomában szenvedő beteg kapott RTHT-t. A kezelésre adott válaszarányt 1 hónappal a terápia befejezése után elemezték. 12 hónap elteltével a teljes választ elérő betegek 67%-a még mindig pozitív volt. Azt találták, hogy a daganat mérete jelentősen befolyásolja a klinikai kimenetelt.
A hipertermia alkalmazása sugárterápiával kombinálva visszatérő, áttétekkel járó emlőkarcinóma kezelésére: A kezelés hatékonyságának értékelésére 20 beteg bevonásával végeztek vizsgálatot. A betegek többsége (95%) teljes mértékben reagált a kombinált kezelésre, amely hatékony volt kiterjedt diffúz léziók esetén emlőrákban. Ezeknek a betegeknek a túlélési átlaga azonban nem volt kielégítő a kezelt területeken kívüli metasztázisok jelenléte miatt.
A felszíni RTHT alkalmazása visszatérő emlőkarcinómában szenvedő betegeknél: A maximális regresszió során az általános válaszarány 63% volt. A túlélés 2,5 év után 21%, 5 év után pedig 8%. Hollandiában az RTHT a standard kezelés azoknak a korábban expozíciónak kitett betegeknél, akiknél kiújult emlőrák. Tanulmányok kimutatták, hogy a hipertermia és a sugárzás egyidejű alkalmazása jobb klinikai eredményt ad, mint az egymást követő használat. Ezt a módszert felületes daganatos betegeknél alkalmazták. Elsősorban a fej-nyaki onkológiai megbetegedések, valamint az emlő adenocarcinoma eseteit vettük figyelembe. Az emlő adenokarcinóma terápiájára adott válasz 79%-ban teljes, 14%-ban részleges, 7%-ban pedig nem reagált a kezelésre.
A kemoterápia és az RTHT kombinálásának hatékonyságának vizsgálata inoperábilis, visszatérő emlőrákban szenvedő betegeknél: A betegek hetente egyszer, 30 perccel a besugárzás után kaptak kemoterápiát és hipertermiát. A bőrreakció elfogadható volt, de a hármas modalitás jelentős szisztémás toxicitást okozott. Bár a terápiára adott válaszarány magas volt, a helyi kontroll csak néhány hónapig maradt fenn.
Vizsgálatok lokálisan visszatérő emlőrákra: Ebben az esetben a helyi kontroll a kombinált kezelés számos paraméterétől függően érhető el, beleértve az RTHT-ra adott tumorválaszt. Harminckilenc visszatérő emlőrákos nő kapott RTHT-t hipertermiával a sugárkezelés előtt. Az 1 éves túlélés 71%, a 2 éves túlélés 54% volt. 2001-ben jelent meg az Athéni Egyetem Orvostudományi Karának tapasztalata, amelyben RTHT kombinációs terápiát alkalmaztak a felületes daganatok kezelésére. Ebben a vizsgálatban 88 visszatérő mastectomiás emlőrákos beteg és 27 visszatérő supraclavicularis nyirokcsomókban szenvedő beteg vett részt. A teljes kezelési válaszarány 85,2%, illetve 70,4% volt. Ugyanez a tudóscsoport 1 évvel később publikálta az első tanulmányt a liposzómális doxorubicin és az RTHT kombinációjának hatékonyságáról. 15 nőbeteg szenvedett lokálisan előrehaladott, visszatérő emlőrákban. Minden beteg reagált a terápiára. A teljes válaszadási arány 20%, a részleges válaszarány 80% volt. Ben-Yosef és mások felismerték a hipertermia előnyeit, amikor hozzáadták a sugárterápiához, és leírták az RTHT-vel kapcsolatos tapasztalataikat a lokálisan visszatérő emlőrák kezelésében. 15 nő kapott sugárkezelést 45 perces hipertermiával kombinálva (45 °C-on). 15 betegből 6 teljes mértékben reagált a terápiára, 4 beteg részlegesen, 3 beteg pedig nem reagált a terápiára.
Az RTHT alkalmazása lokálisan kiújuló emlőkarcinómában szenvedő betegeknél: 75 lézióból 41 volt korábban besugárzott. Bebizonyosodott, hogy a hipertermia sugárterápiával kombinálva kifejezettebb klinikai hatást fejt ki. A betegek 14%-ánál észleltek bőrfekélyt.
Lokálisan előrehaladott vagy visszatérő emlőrák esetén marginális reszekcióval(marginális kivágás): Ebben a vizsgálatban 15 beteget 2 csoportra osztottak. Az első csoportban a reszekció után RTHT-t kapott elsődleges terápiaként, a második csoportba azokat a visszatérő daganatos betegek alkották, akik szintén ugyanazon a kezelési eljáráson – sugárkezeléssel kombinált hipertermián – átestek.A teljes túlélés az első csoportban 90%, a másodikban 89% volt. csoportban a helyi kontroll aránya 75%, illetve 81%, míg a betegségmentes túlélés 64%, illetve 69% volt. Minden beteg esetében a túlélés, a helyi kontroll és a betegségmentes túlélés 89%, 80% és 68% volt.
Tapasztalatok hipertermiával kombinálva sugárterápiával a felületes daganatok kiújulásakor: Ebben a vizsgálatban az RTHT hatékonyságát olyan kiújult betegségben szenvedő betegeknél értékelték, akik korábban sugárkezelésben részesültek. 18 hónapos követés után a lokális kontroll 72,7%, a betegség stabilizációja 20,5%, a nem kontroll 6,8% volt.
Az ismételt besugárzás hatékonysága hipertermiával kombinálva – 2010-es tanulmány: 78 visszatérő emlőrákban szenvedő beteg reagált a kombinált terápiára. A 3 éves benchmark 78%, az 5 éves benchmark 65% volt. A 3 és 5 éves betegek túlélési aránya 66%, illetve 49% Egy 66 éves, visszatérő emlőrákos nő esetét vettük figyelembe, aki sugárkezelést és kemoterápiát kapott, de nem reagált a kezelésre. Ha azonban a terápiát hipertermiával egészítették ki, a beteg teljes mértékben reagált a kezelésre, végül a kombinált RTHT kezelés jó eredményt adhat komoly toxicitás nélkül. Az RTHT-t 198 visszatérő emlőrákban szenvedő betegnél alkalmazták. A 3 éves benchmark 83%, az 5 éves benchmark 78% volt.
Eredmények és következtetések
Az eredmények azt mutatják, hogy a hipertermia sugárterápiával és/vagy kemoterápiával kombinálva az emlőrák kezelésére növeli a kezelés hatékonyságát.
A hipertermia más terápiás módszerekkel kombinált alkalmazása ígéretes irány a visszatérő emlőrák kezelésében. A terápiára adott válaszarányok magasak, és a sugárterápia összehasonlítása hipertermia kezelési lehetőségként történő kiegészítésével vagy anélkül azt jelzi, hogy a hipertermia előnyt jelent a magasabb válaszarány, a helyi kontrollarány és a kombinált terápia túlélési aránya tekintetében. További kutatásokra van szükség a hipertermia szerepének értékeléséhez az elsődleges emlődaganatok kezelésében, mivel a jelenleg rendelkezésre álló eredmények biztatóak. Végül, tekintettel a hipertermia fej-nyaki rák kezelésében és rosszindulatú melanoma kezelésében való alkalmazására vonatkozó számos tanulmány kielégítő eredményeire, meg kell fontolni a hipertermia integrálását más típusú felületi elváltozások klinikai kezelésébe. Amellett, hogy a hipertermiát a visszatérő emlőrák kezelésére vonatkozó legújabb NCCN-irányelvekben szerepeltetjük, javasoljuk az RTHT alkalmazását más bőrelváltozások és emlőrák elsődleges elváltozásainak kezelésére.