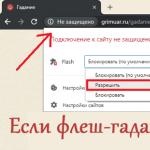
रासायनिक क्रांति. फ्रांसीसी बुर्जुआ क्रांति और विज्ञान। ए. एल. लवॉज़िएर। दहन का ऑक्सीजन सिद्धांत. लवॉज़िए का प्राथमिक रसायन विज्ञान पाठ्यक्रम। लेवॉज़ियर द्वारा "रसायन विज्ञान में क्रांति" "तत्व" की अवधारणा पर पुनर्विचार
पुरातनता का रसायन शास्त्र.
रसायन विज्ञान, पदार्थों की संरचना और उनके परिवर्तनों का विज्ञान, मनुष्य द्वारा प्राकृतिक सामग्रियों को बदलने की अग्नि की क्षमता की खोज से शुरू होता है। जाहिर है, 4000 ईसा पूर्व से ही लोग तांबे और कांसे को गलाना, मिट्टी के उत्पादों को जलाना और कांच बनाना जानते थे। 7वीं शताब्दी तक ईसा पूर्व. मिस्र और मेसोपोटामिया रंग उत्पादन के केंद्र बन गए; सोना, चाँदी तथा अन्य धातुएँ भी वहाँ शुद्ध रूप में प्राप्त होती थीं। लगभग 1500 से 350 ईसा पूर्व तक। रंगों का उत्पादन करने के लिए आसवन का उपयोग किया जाता था, और धातुओं को कोयले के साथ मिलाकर और जलते हुए मिश्रण के माध्यम से हवा चलाकर अयस्कों से गलाया जाता था। प्राकृतिक सामग्रियों को रूपांतरित करने की प्रक्रियाओं को ही रहस्यमय अर्थ दे दिया गया।
यूनानी प्राकृतिक दर्शन.
ये पौराणिक विचार थेल्स ऑफ मिलिटस के माध्यम से ग्रीस में प्रवेश कर गए, जिन्होंने घटनाओं और चीजों की सभी विविधता को एक ही तत्व - पानी तक बढ़ा दिया। हालाँकि, यूनानी दार्शनिक पदार्थों को प्राप्त करने के तरीकों और उनके व्यावहारिक उपयोग में रुचि नहीं रखते थे, बल्कि मुख्य रूप से दुनिया में होने वाली प्रक्रियाओं के सार में रुचि रखते थे। इस प्रकार, प्राचीन यूनानी दार्शनिक एनाक्सिमनीज़ ने तर्क दिया कि ब्रह्मांड का मूल सिद्धांत वायु है: जब विरल होता है, तो वायु आग में बदल जाती है, और जैसे ही यह गाढ़ा हो जाता है, यह पानी बन जाता है, फिर पृथ्वी और अंत में, पत्थर बन जाता है। इफिसस के हेराक्लिटस ने आग को प्राथमिक तत्व मानकर प्राकृतिक घटनाओं को समझाने की कोशिश की।
चार प्राथमिक तत्व.
इन विचारों को ब्रह्मांड के चार सिद्धांतों के सिद्धांत के निर्माता एग्रीजेंटम के एम्पेडोकल्स के प्राकृतिक दर्शन में संयोजित किया गया था। विभिन्न संस्करणों में उनका सिद्धांत दो हजार वर्षों से भी अधिक समय तक लोगों के दिमाग पर हावी रहा। एम्पेडोकल्स के अनुसार, सभी भौतिक वस्तुएँ प्रेम (आकर्षण) और घृणा (प्रतिकर्षण) की ब्रह्मांडीय शक्तियों के प्रभाव में शाश्वत और अपरिवर्तनीय तत्वों - जल, वायु, पृथ्वी और अग्नि - के संयोजन से बनती हैं। एम्पेडोकल्स के तत्वों के सिद्धांत को सबसे पहले प्लेटो द्वारा स्वीकार और विकसित किया गया था, जिन्होंने निर्दिष्ट किया था कि अच्छे और बुरे की अमूर्त ताकतें इन तत्वों को एक दूसरे में बदल सकती हैं, और फिर अरस्तू द्वारा।
अरस्तू के अनुसार, मौलिक तत्व भौतिक पदार्थ नहीं हैं, बल्कि कुछ गुणों - गर्मी, ठंड, सूखापन और नमी के वाहक हैं। यह दृष्टिकोण गैलेन के चार "रस" के विचार में बदल गया और 17वीं शताब्दी तक विज्ञान पर हावी रहा। एक और महत्वपूर्ण प्रश्न जिसने यूनानी प्राकृतिक दार्शनिकों को परेशान किया, वह पदार्थ की विभाज्यता का प्रश्न था। अवधारणा के संस्थापक, जिसे बाद में "परमाणुवादी" नाम मिला, ल्यूसिपस, उनके छात्र डेमोक्रिटस और एपिकुरस थे। उनकी शिक्षा के अनुसार, केवल शून्यता और परमाणु हैं - अविभाज्य भौतिक तत्व, शाश्वत, अविनाशी, अभेद्य, आकार में भिन्न, शून्यता और आकार में स्थिति; उनके "भंवर" से सभी शरीर बनते हैं। डेमोक्रिटस के बाद दो सहस्राब्दियों तक परमाणु सिद्धांत अलोकप्रिय रहा, लेकिन पूरी तरह से गायब नहीं हुआ। इसके अनुयायियों में से एक प्राचीन यूनानी कवि टाइटस ल्यूक्रेटियस कैरस थे, जिन्होंने कविता में डेमोक्रिटस और एपिकुरस के विचारों को रेखांकित किया था। चीजों की प्रकृति के बारे में (डी रेरम नेचुरा).
कीमिया.
कीमिया धातुओं को सोने में परिवर्तित करके पदार्थ को बेहतर बनाने और जीवन का अमृत बनाकर मनुष्य को बेहतर बनाने की कला है। उनके लिए सबसे आकर्षक लक्ष्य प्राप्त करने का प्रयास करते हुए - अतुलनीय धन का निर्माण - कीमियागरों ने कई व्यावहारिक समस्याओं को हल किया, कई नई प्रक्रियाओं की खोज की, विभिन्न प्रतिक्रियाओं का अवलोकन किया, एक नए विज्ञान - रसायन विज्ञान के निर्माण में योगदान दिया।
हेलेनिस्टिक काल.
मिस्र कीमिया का उद्गम स्थल था। मिस्रवासी व्यावहारिक रसायन विज्ञान में प्रतिभाशाली थे, जो, हालांकि, ज्ञान के एक स्वतंत्र क्षेत्र के रूप में अलग नहीं था, बल्कि पुजारियों की "पवित्र गुप्त कला" का हिस्सा था। दूसरी और तीसरी शताब्दी के अंत में कीमिया ज्ञान के एक अलग क्षेत्र के रूप में सामने आई। विज्ञापन सिकंदर महान की मृत्यु के बाद उसका साम्राज्य ध्वस्त हो गया, लेकिन यूनानियों का प्रभाव निकट और मध्य पूर्व के विशाल क्षेत्रों तक फैल गया। 100-300 ईस्वी में कीमिया विशेष रूप से तेजी से विकसित हुई। अलेक्जेंड्रिया में.
लगभग 300 ई.पू. मिस्र के ज़ोसिमा ने एक विश्वकोश लिखा - पिछली 5-6 शताब्दियों में कीमिया के सभी ज्ञान को कवर करने वाली 28 पुस्तकें, विशेष रूप से पदार्थों के अंतर्रूपांतरण (संक्रमण) के बारे में जानकारी।
अरब दुनिया में कीमिया.
7वीं शताब्दी में मिस्र पर विजय प्राप्त करने के बाद, अरबों ने ग्रीको-ओरिएंटल संस्कृति को अपनाया, जो अलेक्जेंड्रियन स्कूल द्वारा सदियों से संरक्षित थी। प्राचीन शासकों की नकल करते हुए, खलीफाओं ने विज्ञान को संरक्षण देना शुरू किया, और 7वीं-9वीं शताब्दी में। पहले रसायनज्ञ प्रकट हुए।
सबसे प्रतिभाशाली और प्रसिद्ध अरब कीमियागर जाबिर इब्न हय्यान (8वीं शताब्दी के अंत में) थे, जो बाद में यूरोप में गेबर के नाम से जाने गए। जाबिर का मानना था कि सल्फर और पारा दो विपरीत सिद्धांत हैं जिनसे सात अन्य धातुएँ बनती हैं; सोना बनाना सबसे कठिन है: इसके लिए आपको एक विशेष पदार्थ की आवश्यकता होती है, जिसे यूनानियों ने ज़ेरियन - "सूखा" कहा, और अरबों ने इसे अल-इक्सिर में बदल दिया (इस तरह "अमृत" शब्द प्रकट हुआ)। अमृत में अन्य अद्भुत गुण होने चाहिए थे: सभी रोगों को ठीक करने और अमरता प्रदान करने के लिए। एक अन्य अरब कीमियागर, अल-रज़ी (सी. 865-925) (यूरोप में रेजेज़ के नाम से जाना जाता है) भी चिकित्सा का अभ्यास करते थे। इस प्रकार, उन्होंने प्लास्टर तैयार करने की विधि और फ्रैक्चर वाली जगह पर पट्टी लगाने की विधि का वर्णन किया। हालाँकि, सबसे प्रसिद्ध डॉक्टर बुखारियन इब्न सिना थे, जिन्हें एविसेना के नाम से भी जाना जाता था। उनकी रचनाएँ कई शताब्दियों तक डॉक्टरों के लिए मार्गदर्शक का काम करती रहीं।
पश्चिमी यूरोप में कीमिया.
12वीं शताब्दी में अरबों के वैज्ञानिक दृष्टिकोण मध्यकालीन यूरोप में प्रवेश कर गए। उत्तरी अफ्रीका, सिसिली और स्पेन के माध्यम से। अरब कीमियागरों के कार्यों का लैटिन और फिर अन्य यूरोपीय भाषाओं में अनुवाद किया गया। सबसे पहले, यूरोप में कीमिया जाबिर जैसे दिग्गजों के काम पर निर्भर थी, लेकिन तीन शताब्दियों के बाद अरस्तू की शिक्षाओं में नए सिरे से रुचि पैदा हुई, खासकर जर्मन दार्शनिक और डोमिनिकन धर्मशास्त्री के कार्यों में, जो बाद में बिशप और प्रोफेसर बन गए। पेरिस विश्वविद्यालय में, अल्बर्टस मैग्नस और उनके छात्र थॉमस एक्विनास। ईसाई सिद्धांत के साथ ग्रीक और अरबी विज्ञान की अनुकूलता के प्रति आश्वस्त होकर, अल्बर्टस मैग्नस ने अध्ययन के शैक्षिक पाठ्यक्रमों में उनके परिचय को बढ़ावा दिया। 1250 में, अरस्तू के दर्शन को पेरिस विश्वविद्यालय में शिक्षण में पेश किया गया था। अंग्रेजी दार्शनिक और प्रकृतिवादी, फ्रांसिस्कन भिक्षु रोजर बेकन, जिन्होंने बाद की कई खोजों की आशा की थी, रसायन विज्ञान संबंधी समस्याओं में भी रुचि रखते थे; उन्होंने साल्टपीटर और कई अन्य पदार्थों के गुणों का अध्ययन किया और काला बारूद बनाने की एक विधि ढूंढी। अन्य यूरोपीय कीमियागरों में अर्नाल्डो दा विलानोवा (1235-1313), रेमंड लुल (1235-1313), और बेसिल वैलेंटाइनस (15वीं-16वीं सदी के जर्मन भिक्षु) शामिल हैं।
कीमिया की उपलब्धियाँ.
शिल्प और व्यापार का विकास, 12वीं-13वीं शताब्दी में पश्चिमी यूरोप में शहरों का उदय। विज्ञान के विकास और उद्योग के उद्भव के साथ। अल्केमिस्ट व्यंजनों का उपयोग धातु प्रसंस्करण जैसी तकनीकी प्रक्रियाओं में किया जाता था। इन वर्षों के दौरान, नए पदार्थों को प्राप्त करने और पहचानने के तरीकों की व्यवस्थित खोज शुरू हुई। अल्कोहल उत्पादन और आसवन प्रक्रिया में सुधार के नुस्खे उभर रहे हैं। सबसे महत्वपूर्ण उपलब्धि मजबूत एसिड - सल्फ्यूरिक और नाइट्रिक की खोज थी। अब यूरोपीय रसायनज्ञ कई नई प्रतिक्रियाएँ करने और नाइट्रिक एसिड, विट्रियल, फिटकरी, सल्फ्यूरिक और हाइड्रोक्लोरिक एसिड के लवण जैसे पदार्थ प्राप्त करने में सक्षम थे। कीमियागरों की सेवाएं, जो अक्सर कुशल डॉक्टर होते थे, उच्चतम कुलीनों द्वारा उपयोग की जाती थीं। यह भी माना जाता था कि कीमियागरों के पास साधारण धातुओं को सोने में बदलने का रहस्य था।

14वीं सदी के अंत तक. कुछ पदार्थों को दूसरे पदार्थों में बदलने में कीमियागरों की रुचि ने तांबा, पीतल, सिरका, जैतून का तेल और विभिन्न दवाओं के उत्पादन में रुचि को जन्म दिया। 15वीं-16वीं शताब्दी में। कीमियागरों के अनुभव का खनन और चिकित्सा में तेजी से उपयोग किया जाने लगा।
आधुनिक रसायन विज्ञान की शुरुआत
मध्य युग का अंत जादू-टोना से धीरे-धीरे पीछे हटने, कीमिया में रुचि में गिरावट और प्रकृति की संरचना के यंत्रवत दृष्टिकोण के प्रसार द्वारा चिह्नित किया गया था।
आईट्रोकैमिस्ट्री।
पेरासेलसस (1493-1541) कीमिया के उद्देश्यों पर पूरी तरह से अलग विचार थे। स्वयं द्वारा चुने गए इस नाम ("सेल्सस से बेहतर") के तहत, स्विस चिकित्सक फिलिप वॉन होहेनहेम ने इतिहास में प्रवेश किया। एविसेना की तरह पेरासेलसस का मानना था कि कीमिया का मुख्य कार्य सोना प्राप्त करने के तरीकों की खोज नहीं है, बल्कि दवाओं का उत्पादन है। उन्होंने रसायन विज्ञान परंपरा से यह सिद्धांत उधार लिया कि पदार्थ के तीन मुख्य भाग हैं - पारा, सल्फर, नमक, जो अस्थिरता, ज्वलनशीलता और कठोरता के गुणों के अनुरूप हैं। ये तीन तत्व स्थूल जगत (ब्रह्मांड) का आधार बनाते हैं और आत्मा, आत्मा और शरीर द्वारा गठित सूक्ष्म जगत (मनुष्य) से जुड़े हैं। बीमारियों के कारणों का निर्धारण करने के लिए आगे बढ़ते हुए, पेरासेलसस ने तर्क दिया कि शरीर में सल्फर की अधिकता से बुखार और प्लेग होता है, पारा की अधिकता से पक्षाघात होता है, आदि। सभी आईट्रोकेमिस्ट जिस सिद्धांत का पालन करते थे, वह यह था कि दवा रसायन विज्ञान का विषय है, और सब कुछ अशुद्ध पदार्थों से शुद्ध सिद्धांतों को अलग करने की डॉक्टर की क्षमता पर निर्भर करता है। इस योजना के अंतर्गत, शरीर के सभी कार्यों को रासायनिक प्रक्रियाओं तक सीमित कर दिया गया था, और कीमियागर का कार्य चिकित्सा प्रयोजनों के लिए रासायनिक पदार्थों को ढूंढना और तैयार करना था।
आईट्रोकेमिकल दिशा के मुख्य प्रतिनिधि जान हेल्मोंट (1577-1644) थे, जो पेशे से डॉक्टर थे; फ्रांसिस सिल्वियस (1614-1672), जिन्होंने एक चिकित्सक के रूप में बहुत प्रसिद्धि प्राप्त की और आईट्रोकेमिकल शिक्षण से "आध्यात्मिक" सिद्धांतों को हटा दिया; एंड्रियास लिबावियस (सी. 1550-1616), रोथेनबर्ग के चिकित्सक। उनके शोध ने रसायन विज्ञान को एक स्वतंत्र विज्ञान के रूप में बनाने में बहुत योगदान दिया।
यंत्रवत दर्शन.
आईट्रोकेमिस्ट्री के प्रभाव में कमी के साथ, प्राकृतिक दार्शनिकों ने फिर से प्रकृति के बारे में पूर्वजों की शिक्षाओं की ओर रुख किया। 17वीं शताब्दी में सामने आया। परमाणुवादी (कॉर्पसकुलर) विचार उभरे। सबसे प्रमुख वैज्ञानिकों में से एक - कणिका सिद्धांत के लेखक - दार्शनिक और गणितज्ञ रेने डेसकार्टेस थे, उन्होंने 1637 में निबंध में अपने विचारों को रेखांकित किया था विधि के बारे में तर्क. डेसकार्टेस का मानना था कि सभी पिंड “विभिन्न आकृतियों और आकारों के कई छोटे कणों से बने होते हैं, ... जो एक-दूसरे से इतने सटीक रूप से फिट नहीं होते हैं कि उनके चारों ओर कोई अंतराल नहीं होता है; ये अंतराल खाली नहीं हैं, बल्कि... दुर्लभ पदार्थ से भरे हुए हैं।" डेसकार्टेस ने अपने "छोटे कणों" को परमाणु नहीं माना, अर्थात्। अविभाज्य; वह पदार्थ की अनंत विभाज्यता के दृष्टिकोण पर कायम रहे और शून्यता के अस्तित्व से इनकार किया। डेसकार्टेस के सबसे प्रमुख विरोधियों में से एक फ्रांसीसी भौतिक विज्ञानी और दार्शनिक पियरे गैसेंडी थे। गैसेंडी का परमाणुवाद मूलतः एपिकुरस की शिक्षाओं का पुनर्कथन था, हालांकि, बाद के विपरीत, गैसेंडी ने ईश्वर द्वारा परमाणुओं के निर्माण को मान्यता दी; उनका मानना था कि भगवान ने एक निश्चित संख्या में अविभाज्य और अभेद्य परमाणु बनाए हैं, जिनसे सभी शरीर बने हैं; परमाणुओं के बीच पूर्ण शून्यता होनी चाहिए। 17वीं शताब्दी में रसायन विज्ञान के विकास में। एक विशेष भूमिका आयरिश वैज्ञानिक रॉबर्ट बॉयल की है। बॉयल ने प्राचीन दार्शनिकों के कथनों को स्वीकार नहीं किया जो मानते थे कि ब्रह्मांड के तत्वों को अनुमान के आधार पर स्थापित किया जा सकता है; यह उनकी पुस्तक के शीर्षक में परिलक्षित होता है संशयवादी रसायनज्ञ. रासायनिक तत्वों के निर्धारण के लिए प्रयोगात्मक दृष्टिकोण (जिसे अंततः अपनाया गया) के समर्थक होने के नाते, उन्हें वास्तविक तत्वों के अस्तित्व के बारे में नहीं पता था, हालांकि उन्होंने उनमें से एक - फॉस्फोरस - की खोज लगभग स्वयं ही कर ली थी। बॉयल को आमतौर पर रसायन विज्ञान में "विश्लेषण" शब्द की शुरुआत करने का श्रेय दिया जाता है। गुणात्मक विश्लेषण पर अपने प्रयोगों में, उन्होंने विभिन्न संकेतकों का उपयोग किया और रासायनिक समानता की अवधारणा पेश की। गैलीलियो गैलीली इवेंजेलिस्टा टोरिसेली के कार्यों के साथ-साथ ओटो गुएरिके, जिन्होंने 1654 में "मैगडेबर्ग गोलार्धों" का प्रदर्शन किया था, के आधार पर बॉयल ने अपने द्वारा डिज़ाइन किए गए वायु पंप और यू-आकार की ट्यूब का उपयोग करके हवा की लोच निर्धारित करने के लिए प्रयोगों का वर्णन किया। इन प्रयोगों के परिणामस्वरूप, वायु की मात्रा और दबाव के बीच व्युत्क्रम आनुपातिकता का प्रसिद्ध नियम तैयार किया गया था। 1668 में, बॉयल लंदन की नव-संगठित रॉयल सोसाइटी के सक्रिय सदस्य बने और 1680 में उन्हें इसका अध्यक्ष चुना गया।
तकनीकी रसायन विज्ञान.
वैज्ञानिक प्रगति और खोजें तकनीकी रसायन विज्ञान को प्रभावित नहीं कर सकीं, जिसके तत्व 15वीं-17वीं शताब्दी में पाए जा सकते हैं। 15वीं सदी के मध्य में. ब्लोअर फोर्ज तकनीक विकसित की गई। सैन्य उद्योग की जरूरतों ने बारूद उत्पादन की तकनीक में सुधार के लिए काम को प्रेरित किया। 16वीं शताब्दी के दौरान. सोने का उत्पादन दोगुना हो गया और चांदी का उत्पादन नौ गुना बढ़ गया। धातुओं के उत्पादन और निर्माण, कांच बनाने, कपड़े की रंगाई, खाद्य संरक्षण और चमड़े की टैनिंग में उपयोग की जाने वाली विभिन्न सामग्रियों पर मौलिक कार्य प्रकाशित किए जा रहे हैं। मादक पेय पदार्थों की खपत के विस्तार के साथ, आसवन विधियों में सुधार किया जा रहा है और नए आसवन उपकरण डिजाइन किए जा रहे हैं। कई उत्पादन प्रयोगशालाएँ, मुख्य रूप से धातुकर्म प्रयोगशालाएँ, सामने आईं। उस समय के रासायनिक प्रौद्योगिकीविदों में हम वन्नोसिओ बिरिंगुशियो (1480-1539) का उल्लेख कर सकते हैं, जिनका उत्कृष्ट कार्य के बारे में आतिशबाज़ी बनाने की विद्या 1540 में वेनिस में मुद्रित किया गया था और इसमें 10 पुस्तकें शामिल थीं जो खानों, खनिजों का परीक्षण, धातु तैयार करने, आसवन, युद्ध की कला और आतिशबाजी से संबंधित थीं। एक और प्रसिद्ध ग्रंथ खनन और धातुकर्म के बारे में, जॉर्ज एग्रीकोला (1494-1555) द्वारा लिखा गया था। जोहान ग्लौबर (1604-1670) का भी उल्लेख किया जाना चाहिए, जो एक डच रसायनज्ञ थे जिन्होंने ग्लौबर का नमक बनाया था।
अठारहवीं सदी
एक वैज्ञानिक अनुशासन के रूप में रसायन विज्ञान।
1670 से 1800 तक, रसायन विज्ञान को प्राकृतिक दर्शन और चिकित्सा के साथ-साथ प्रमुख विश्वविद्यालयों के पाठ्यक्रम में आधिकारिक दर्जा प्राप्त हुआ। 1675 में निकोलस लेमेरी (1645-1715) की पाठ्यपुस्तक प्रकाशित हुई रसायन शास्त्र पाठ्यक्रमजिसने अत्यधिक लोकप्रियता हासिल की, इसके 13 फ्रेंच संस्करण प्रकाशित हुए और इसके अलावा, इसका लैटिन और कई अन्य यूरोपीय भाषाओं में अनुवाद किया गया। 18वीं सदी में यूरोप में वैज्ञानिक रासायनिक समाज और बड़ी संख्या में वैज्ञानिक संस्थान बनाए जा रहे हैं; वे जो अनुसंधान करते हैं उसका समाज की सामाजिक और आर्थिक आवश्यकताओं से गहरा संबंध होता है। अभ्यासशील रसायनज्ञ प्रकट हुए, जो उपकरणों के निर्माण और उद्योग के लिए पदार्थों के उत्पादन में लगे हुए थे।
फ्लॉजिस्टन सिद्धांत.
17वीं शताब्दी के उत्तरार्ध के रसायनज्ञों के कार्यों में। दहन प्रक्रिया की व्याख्याओं पर बहुत ध्यान दिया गया। प्राचीन यूनानियों के अनुसार, जो कुछ भी जल सकता है उसमें अग्नि का तत्व होता है, जो सही परिस्थितियों में निकलता है। 1669 में, जर्मन रसायनज्ञ जोहान जोआचिम बेचर ने ज्वलनशीलता की तर्कसंगत व्याख्या देने का प्रयास किया। उन्होंने सुझाव दिया कि ठोस तीन प्रकार की "पृथ्वी" से बने होते हैं और उनमें से एक प्रकार, जिसे उन्होंने "चिकनी पृथ्वी" कहा, को "ज्वलनशीलता का सिद्धांत" माना गया।
बेचर के अनुयायी, जर्मन रसायनज्ञ और चिकित्सक जॉर्ज अर्न्स्ट स्टाल ने "मोटी पृथ्वी" की अवधारणा को फ्लॉजिस्टन के सामान्यीकृत सिद्धांत - "ज्वलनशीलता की शुरुआत" में बदल दिया। स्टाल के अनुसार, फ्लॉजिस्टन एक निश्चित पदार्थ है जो सभी दहनशील पदार्थों में निहित होता है और दहन के दौरान निकलता है। स्टाल ने तर्क दिया कि धातुओं में जंग लगना लकड़ी को जलाने के समान है। धातुओं में फ्लॉजिस्टन होता है, लेकिन जंग (स्केल) में अब फ्लॉजिस्टन नहीं होता है। इसने अयस्कों को धातुओं में परिवर्तित करने की प्रक्रिया के लिए एक स्वीकार्य स्पष्टीकरण भी प्रदान किया: अयस्क, जिसमें फ्लॉजिस्टन की सामग्री नगण्य है, को फ्लॉजिस्टन से भरपूर चारकोल पर गर्म किया जाता है, और बाद वाला अयस्क में बदल जाता है। कोयला राख में बदल जाता है, और अयस्क फ्लॉजिस्टन से भरपूर धातु में बदल जाता है। 1780 तक, फ्लॉजिस्टन सिद्धांत को लगभग हर जगह रसायनज्ञों द्वारा स्वीकार कर लिया गया था, हालांकि इसने एक बहुत महत्वपूर्ण प्रश्न का उत्तर नहीं दिया: जंग लगने पर लोहा भारी क्यों हो जाता है, हालांकि फ्लॉजिस्टन इससे वाष्पित हो जाता है? 18वीं सदी के रसायनज्ञ यह विरोधाभास इतना महत्वपूर्ण नहीं लगता था; उनकी राय में मुख्य बात, पदार्थों की उपस्थिति में परिवर्तन के कारणों की व्याख्या करना था।
18वीं सदी में ऐसे कई रसायनज्ञ थे जिनकी वैज्ञानिक गतिविधियाँ विज्ञान के विकास के चरणों और दिशाओं पर विचार करने की सामान्य योजनाओं में फिट नहीं बैठती थीं, और उनमें से एक विशेष स्थान रूसी विश्वकोश वैज्ञानिक, कवि और ज्ञानोदय के चैंपियन मिखाइल वासिलीविच लोमोनोसोव (1711-) का है। 1765). अपनी खोजों से लोमोनोसोव ने ज्ञान के लगभग सभी क्षेत्रों को समृद्ध किया और उनके कई विचार उस समय के विज्ञान से सौ वर्ष से भी अधिक आगे थे। 1756 में, लोमोनोसोव ने एक बंद बर्तन में धातुओं को जलाने पर प्रसिद्ध प्रयोग किए, जिसने रासायनिक प्रतिक्रियाओं के दौरान पदार्थ के संरक्षण और दहन प्रक्रियाओं में हवा की भूमिका के निर्विवाद सबूत प्रदान किए: लावोइसियर से पहले भी, उन्होंने धातुओं को जलाने पर वजन में देखी गई वृद्धि के बारे में बताया। उन्हें हवा के साथ मिलाकर. कैलोरी के बारे में प्रचलित विचारों के विपरीत, उन्होंने तर्क दिया कि थर्मल घटनाएँ भौतिक कणों की यांत्रिक गति के कारण होती हैं। उन्होंने कणों की गति से गैसों की लोच की व्याख्या की। लोमोनोसोव ने "कॉर्पसकल" (अणु) और "तत्व" (परमाणु) की अवधारणाओं के बीच अंतर किया, जिसे केवल 19 वीं शताब्दी के मध्य में सामान्य मान्यता प्राप्त हुई। लोमोनोसोव ने पदार्थ और गति के संरक्षण का सिद्धांत तैयार किया, फ्लॉजिस्टन को रासायनिक एजेंटों की सूची से बाहर रखा, भौतिक रसायन विज्ञान की नींव रखी और 1748 में सेंट पीटर्सबर्ग एकेडमी ऑफ साइंसेज में एक रासायनिक प्रयोगशाला बनाई, जिसमें न केवल वैज्ञानिक कार्य किया गया। न केवल छात्रों के लिए व्यावहारिक कक्षाएं संचालित की गईं। उन्होंने रसायन विज्ञान से संबंधित ज्ञान के क्षेत्रों - भौतिकी, भूविज्ञान, आदि में व्यापक शोध किया।
वायवीय रसायन शास्त्र.
फ्लॉजिस्टन सिद्धांत की कमियाँ तथाकथित के विकास के दौरान सबसे स्पष्ट रूप से उभरीं। वायवीय रसायन शास्त्र. इस प्रवृत्ति के सबसे बड़े प्रतिनिधि आर. बॉयल थे: उन्होंने न केवल गैस कानून की खोज की, जो अब उनके नाम पर है, बल्कि हवा इकट्ठा करने के लिए उपकरण भी डिजाइन किए। रसायनज्ञों के पास अब विभिन्न "हवाओं" को अलग करने, पहचानने और उनका अध्ययन करने का एक महत्वपूर्ण साधन है। 18वीं शताब्दी की शुरुआत में अंग्रेजी रसायनज्ञ स्टीफन हेल्स (1677-1761) द्वारा "वायवीय स्नान" का आविष्कार एक महत्वपूर्ण कदम था। - जब किसी पदार्थ को पानी के बर्तन में गर्म किया जाता है और पानी के स्नान में उल्टा उतारा जाता है तो निकलने वाली गैसों को फंसाने का एक उपकरण। बाद में, हेल्स और हेनरी कैवेंडिश ने कुछ गैसों ("हवा") के अस्तित्व की स्थापना की जो सामान्य हवा से अपने गुणों में भिन्न हैं। 1766 में कैवेंडिश ने कुछ धातुओं के साथ एसिड की प्रतिक्रिया से बनने वाली गैस का व्यवस्थित रूप से अध्ययन किया, जिसे बाद में हाइड्रोजन कहा गया। गैसों के अध्ययन में एक महान योगदान स्कॉटिश रसायनज्ञ जोसेफ ब्लैक द्वारा किया गया था, उन्होंने अम्लों की क्षार के साथ प्रतिक्रिया करने पर निकलने वाली गैसों का अध्ययन करना शुरू किया। ब्लैक ने पाया कि खनिज कैल्शियम कार्बोनेट गर्म होने पर विघटित हो जाता है, गैस छोड़ता है और चूना (कैल्शियम ऑक्साइड) बनाता है। जारी गैस (कार्बन डाइऑक्साइड - ब्लैक ने इसे "बाध्य वायु" कहा) को कैल्शियम कार्बोनेट बनाने के लिए चूने के साथ पुनः संयोजित किया जा सकता है। अन्य बातों के अलावा, इस खोज ने ठोस और गैसीय पदार्थों के बीच बंधन की अविभाज्यता स्थापित की।
रासायनिक क्रांति.
जोसेफ प्रिस्टले, एक प्रोटेस्टेंट पादरी जो रसायन विज्ञान के शौकीन थे, ने गैसों को अलग करने और उनके गुणों का अध्ययन करने में बड़ी सफलता हासिल की। लीड्स (इंग्लैंड) के पास, जहाँ उन्होंने सेवा की थी, एक शराब की भठ्ठी थी जहाँ से प्रयोगों के लिए बड़ी मात्रा में "बंधी हुई हवा" (अब हम जानते हैं कि यह कार्बन डाइऑक्साइड थी) प्राप्त की जा सकती थी। प्रीस्टली ने पाया कि गैसें पानी में घुल सकती हैं, और उन्हें पानी के ऊपर नहीं, बल्कि पारे के ऊपर इकट्ठा करने की कोशिश की। इसलिए वह नाइट्रिक ऑक्साइड, अमोनिया, हाइड्रोजन क्लोराइड, सल्फर डाइऑक्साइड (बेशक, ये उनके आधुनिक नाम हैं) एकत्र करने और उनका अध्ययन करने में सक्षम थे। 1774 में, प्रीस्टली ने अपनी सबसे महत्वपूर्ण खोज की: उन्होंने एक ऐसी गैस को अलग किया जिसमें पदार्थ विशेष रूप से चमकते हुए जलते थे। फ्लॉजिस्टन सिद्धांत के समर्थक होने के नाते, उन्होंने इस गैस को "डीफ्लॉजिस्टिकेटेड वायु" कहा। प्रीस्टले द्वारा खोजी गई गैस "फ्लॉजिस्टिकेटेड एयर" (नाइट्रोजन) के विपरीत प्रतीत होती है, जिसे 1772 में अंग्रेजी रसायनज्ञ डैनियल रदरफोर्ड (1749-1819) द्वारा पृथक किया गया था। "फ्लॉजिस्टिकेटेड हवा" में चूहे मर गए, लेकिन "डिफ्लॉजिस्टिकेटेड" हवा में वे बहुत सक्रिय थे। (यह ध्यान दिया जाना चाहिए कि प्रिस्टले द्वारा पृथक गैस के गुणों का वर्णन स्वीडिश रसायनज्ञ कार्ल विल्हेम शीले ने 1771 में किया था, लेकिन प्रकाशक की लापरवाही के कारण उनका संदेश केवल 1777 में छपा।) महान फ्रांसीसी रसायनज्ञ एंटोनी लॉरेंट लैवोज़ियर ने तुरंत प्रीस्टले की खोज के महत्व की सराहना की। 1775 में, उन्होंने एक लेख तैयार किया जिसमें उन्होंने तर्क दिया कि हवा एक साधारण पदार्थ नहीं है, बल्कि दो गैसों का मिश्रण है, उनमें से एक प्रीस्टले की "डीफ्लॉजिस्टिकेटेड हवा" है, जो जलने या जंग लगने वाली वस्तुओं के साथ मिलकर अयस्कों से लकड़ी का कोयला और कोयले में बदल जाती है। जीवन के लिए आवश्यक है. लवॉज़ियर ने उसे बुलाया ऑक्सीजन, ऑक्सीजन, यानी "एसिड पैदा करने वाला" मौलिक तत्वों के सिद्धांत को दूसरा झटका तब लगा जब यह स्पष्ट हो गया कि पानी भी कोई साधारण पदार्थ नहीं है, बल्कि दो गैसों: ऑक्सीजन और हाइड्रोजन के संयोजन का एक उत्पाद है। इन सभी खोजों और सिद्धांतों ने, रहस्यमय "तत्वों" को ख़त्म कर दिया, जिससे रसायन विज्ञान को युक्तिसंगत बनाया गया। केवल वही पदार्थ सामने आये हैं जिन्हें तोला जा सकता है या जिनकी मात्रा किसी अन्य प्रकार से मापी जा सकती है। 18वीं सदी के 80 के दशक के दौरान. लैवोज़ियर ने अन्य फ्रांसीसी रसायनज्ञों एंटोनी फ्रांकोइस डी फोरक्रॉय (1755-1809), गुइटन डी मोरव्यू (1737-1816) और क्लाउड लुई बर्थोलेट के सहयोग से रासायनिक नामकरण की एक तार्किक प्रणाली विकसित की; इसमें 30 से अधिक सरल पदार्थों का वर्णन किया गया है जो उनके गुणों को दर्शाते हैं। यह काम रासायनिक नामकरण विधि, 1787 में प्रकाशित हुआ था।
रसायनज्ञों के सैद्धांतिक विचारों में एक क्रांति जो 18वीं शताब्दी के अंत में हुई। फ्लॉजिस्टन सिद्धांत (यद्यपि स्वतंत्र रूप से) के प्रभुत्व के तहत प्रयोगात्मक सामग्री के तेजी से संचय के परिणामस्वरूप, इसे आमतौर पर "रासायनिक क्रांति" कहा जाता है।
उन्नीसवीं सदी
पदार्थों की संरचना एवं उनका वर्गीकरण।
लैवोज़ियर की सफलताओं से पता चला कि मात्रात्मक तरीकों का उपयोग पदार्थों की रासायनिक संरचना को निर्धारित करने और उनके जुड़ाव के नियमों को स्पष्ट करने में मदद कर सकता है।
आणविक सिद्धांत।
भौतिक रसायन शास्त्र का जन्म.
19वीं सदी के अंत तक. पहला कार्य सामने आया जिसमें विभिन्न पदार्थों के भौतिक गुणों (क्वथनांक और पिघलने बिंदु, घुलनशीलता, आणविक भार) का व्यवस्थित अध्ययन किया गया। इस तरह का शोध गे-लुसाक और वैन्ट हॉफ द्वारा शुरू किया गया था, जिन्होंने दिखाया कि नमक की घुलनशीलता तापमान और दबाव पर निर्भर करती है। 1867 में, नॉर्वेजियन रसायनज्ञ पीटर वेज (1833-1900) और काटो मैक्सिमिलियन गुल्डबर्ग (1836-1902) ने सामूहिक क्रिया का नियम बनाया, जिसके अनुसार प्रतिक्रियाओं की दर अभिकारकों की सांद्रता पर निर्भर करती है। उनके द्वारा उपयोग किए गए गणितीय उपकरण ने एक बहुत ही महत्वपूर्ण मात्रा को खोजना संभव बना दिया जो किसी भी रासायनिक प्रतिक्रिया की विशेषता है - दर स्थिरांक।
रासायनिक ऊष्मप्रवैगिकी.
इस बीच, रसायनज्ञों ने भौतिक रसायन विज्ञान के केंद्रीय प्रश्न - रासायनिक प्रतिक्रियाओं पर गर्मी का प्रभाव - की ओर रुख किया। 19वीं सदी के मध्य तक. भौतिक विज्ञानी विलियम थॉमसन (लॉर्ड केल्विन), लुडविग बोल्ट्ज़मैन और जेम्स मैक्सवेल ने गर्मी की प्रकृति पर नए विचार विकसित किए। लेवॉज़ियर के कैलोरी सिद्धांत को अस्वीकार करते हुए, उन्होंने गति के परिणाम के रूप में गर्मी का प्रतिनिधित्व किया। उनके विचारों को रुडोल्फ क्लॉसियस द्वारा विकसित किया गया था। उन्होंने एक गतिज सिद्धांत विकसित किया जिसके अनुसार अणुओं की निरंतर गति और उनके टकराव के विचार के आधार पर आयतन, दबाव, तापमान, चिपचिपाहट और प्रतिक्रिया दर जैसी मात्राओं पर विचार किया जा सकता है। थॉमसन (1850) के साथ-साथ, क्लैसियस ने थर्मोडायनामिक्स के दूसरे नियम का पहला सूत्रीकरण दिया और एन्ट्रापी (1865), आदर्श गैस और अणुओं के औसत मुक्त पथ की अवधारणाओं को पेश किया।
रासायनिक प्रतिक्रियाओं के लिए थर्मोडायनामिक दृष्टिकोण का उपयोग अगस्त फ्रेडरिक गोर्स्टमैन (1842-1929) ने अपने कार्यों में किया था, जिन्होंने क्लॉसियस के विचारों के आधार पर समाधान में लवण के पृथक्करण को समझाने की कोशिश की थी। 1874-1878 में, अमेरिकी रसायनज्ञ जोशिया विलार्ड गिब्स ने रासायनिक प्रतिक्रियाओं के थर्मोडायनामिक्स का एक व्यवस्थित अध्ययन किया। उन्होंने सामूहिक क्रिया के नियम का सार समझाते हुए मुक्त ऊर्जा और रासायनिक क्षमता की अवधारणा पेश की, और विभिन्न तापमानों, दबावों और सांद्रता (चरण नियम) पर विभिन्न चरणों के बीच संतुलन का अध्ययन करने में थर्मोडायनामिक सिद्धांतों को लागू किया। गिब्स के काम ने आधुनिक रासायनिक थर्मोडायनामिक्स की नींव रखी। स्वीडिश रसायनज्ञ स्वंते ऑगस्ट अरहेनियस ने आयनिक पृथक्करण का सिद्धांत बनाया, जो कई विद्युत रासायनिक घटनाओं की व्याख्या करता है, और सक्रियण ऊर्जा की अवधारणा पेश की। उन्होंने विलेय पदार्थों के आणविक भार को मापने के लिए एक विद्युत रासायनिक विधि भी विकसित की।
एक प्रमुख वैज्ञानिक, जिनकी बदौलत भौतिक रसायन विज्ञान को ज्ञान के एक स्वतंत्र क्षेत्र के रूप में मान्यता मिली, जर्मन रसायनज्ञ विल्हेम ओस्टवाल्ड थे, जिन्होंने कैटेलिसिस के अध्ययन में गिब्स की अवधारणाओं को लागू किया। 1886 में उन्होंने भौतिक रसायन विज्ञान पर पहली पाठ्यपुस्तक लिखी, और 1887 में उन्होंने (वैंट हॉफ के साथ मिलकर) फिजिकल केमिस्ट्री (ज़ीट्सक्रिफ्ट फर फिज़िकालिस्चे केमी) पत्रिका की स्थापना की।
बीसवी सदी
नया संरचनात्मक सिद्धांत.
परमाणुओं और अणुओं की संरचना के बारे में भौतिक सिद्धांतों के विकास के साथ, रासायनिक संबंध और रूपांतरण जैसी पुरानी अवधारणाओं पर पुनर्विचार किया गया। पदार्थ की संरचना के बारे में नये विचार उभरे।
परमाणु मॉडल.
1896 में, एंटोनी हेनरी बेकरेल (1852-1908) ने रेडियोधर्मिता की घटना की खोज की, यूरेनियम लवण से उपपरमाण्विक कणों के सहज उत्सर्जन की खोज की, और दो साल बाद, पति-पत्नी पियरे क्यूरी और मैरी स्कोलोडोव्स्का-क्यूरी ने दो रेडियोधर्मी तत्वों को अलग किया: पोलोनियम और रेडियम . बाद के वर्षों में, यह पता चला कि रेडियोधर्मी पदार्थ तीन प्रकार के विकिरण उत्सर्जित करते हैं: ए-कण, बी-कण और जी-किरणें। फ्रेडरिक सोड्डी की खोज के साथ, जिसने दिखाया कि रेडियोधर्मी क्षय के दौरान कुछ पदार्थों का दूसरों में परिवर्तन होता है, इन सभी ने उस चीज़ को नया अर्थ दिया जिसे प्राचीन लोग ट्रांसम्यूटेशन कहते थे।
1897 में, जोसेफ जॉन थॉमसन ने इलेक्ट्रॉन की खोज की, जिसके आवेश को 1909 में रॉबर्ट मिलिकन द्वारा उच्च सटीकता के साथ मापा गया था। 1911 में, थॉमसन की इलेक्ट्रॉन अवधारणा के आधार पर, अर्न्स्ट रदरफोर्ड ने परमाणु का एक मॉडल प्रस्तावित किया: परमाणु के केंद्र में एक सकारात्मक रूप से चार्ज किया गया नाभिक होता है, और नकारात्मक रूप से चार्ज किए गए इलेक्ट्रॉन इसके चारों ओर घूमते हैं। 1913 में, नील्स बोह्र ने क्वांटम यांत्रिकी के सिद्धांतों का उपयोग करते हुए दिखाया कि इलेक्ट्रॉनों को किसी में नहीं, बल्कि कड़ाई से परिभाषित कक्षाओं में स्थित किया जा सकता है। परमाणु के रदरफोर्ड-बोह्र ग्रहीय क्वांटम मॉडल ने वैज्ञानिकों को रासायनिक यौगिकों की संरचना और गुणों को समझाने के लिए एक नया दृष्टिकोण अपनाने के लिए मजबूर किया। जर्मन भौतिक विज्ञानी वाल्टर कोसेल (1888-1956) ने सुझाव दिया कि किसी परमाणु के रासायनिक गुण उसके बाहरी आवरण में इलेक्ट्रॉनों की संख्या से निर्धारित होते हैं, और रासायनिक बंधनों का निर्माण मुख्य रूप से इलेक्ट्रोस्टैटिक इंटरैक्शन की ताकतों द्वारा निर्धारित होता है। अमेरिकी वैज्ञानिक गिल्बर्ट न्यूटन लुईस और इरविंग लैंगमुइर ने रासायनिक बंधन का इलेक्ट्रॉनिक सिद्धांत तैयार किया। इन विचारों के अनुसार, अकार्बनिक लवण के अणुओं को उनके घटक आयनों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन द्वारा स्थिर किया जाता है, जो इलेक्ट्रॉनों को एक तत्व से दूसरे (आयनिक बंधन) में स्थानांतरित करने के दौरान बनते हैं, और कार्बनिक यौगिकों के अणु - इलेक्ट्रॉनों के बंटवारे के कारण (सहसंयोजक बंधन)। ये विचार रासायनिक बंधन की आधुनिक अवधारणाओं का आधार हैं।
नई शोध विधियाँ।
पदार्थ की संरचना के बारे में सभी नए विचार केवल 20वीं शताब्दी में हुए विकास के परिणामस्वरूप ही बन सके। प्रायोगिक तकनीकें और नई शोध विधियों का उद्भव। 1895 में विल्हेम कॉनराड रोएंटगेन द्वारा एक्स-रे की खोज ने एक्स-रे क्रिस्टलोग्राफी की विधि के बाद के निर्माण के आधार के रूप में कार्य किया, जो क्रिस्टल पर एक्स-रे के विवर्तन पैटर्न से अणुओं की संरचना को निर्धारित करना संभव बनाता है। इस पद्धति का उपयोग करके, जटिल कार्बनिक यौगिकों की संरचना को समझा गया - इंसुलिन, डीऑक्सीराइबोन्यूक्लिक एसिड (डीएनए), हीमोग्लोबिन, आदि। परमाणु सिद्धांत के निर्माण के साथ, नए शक्तिशाली स्पेक्ट्रोस्कोपिक तरीके सामने आए जो परमाणुओं और अणुओं की संरचना के बारे में जानकारी प्रदान करते हैं। विभिन्न जैविक प्रक्रियाओं, साथ ही रासायनिक प्रतिक्रियाओं के तंत्र का अध्ययन रेडियोआइसोटोप ट्रेसर का उपयोग करके किया जाता है; चिकित्सा में विकिरण विधियों का भी व्यापक रूप से उपयोग किया जाता है।
जैवरसायन.
यह वैज्ञानिक अनुशासन, जो जैविक पदार्थों के रासायनिक गुणों का अध्ययन करता है, पहले कार्बनिक रसायन विज्ञान की शाखाओं में से एक था। 19वीं शताब्दी के अंतिम दशक में यह एक स्वतंत्र क्षेत्र बन गया। पौधे और पशु मूल के पदार्थों के रासायनिक गुणों के अध्ययन के परिणामस्वरूप। पहले जैव रसायनज्ञों में से एक जर्मन वैज्ञानिक एमिल फिशर थे। उन्होंने कैफीन, फेनोबार्बिटल, ग्लूकोज और कई हाइड्रोकार्बन जैसे पदार्थों को संश्लेषित किया, और एंजाइमों के विज्ञान में एक महान योगदान दिया - प्रोटीन उत्प्रेरक, पहली बार 1878 में अलग किए गए। एक विज्ञान के रूप में जैव रसायन के गठन को नए विश्लेषणात्मक तरीकों के निर्माण द्वारा सुविधाजनक बनाया गया था . 1923 में, स्वीडिश रसायनज्ञ थियोडोर स्वेडबर्ग ने एक अल्ट्रासेंट्रीफ्यूज डिजाइन किया और मैक्रोमोलेक्यूल्स, मुख्य रूप से प्रोटीन के आणविक भार को निर्धारित करने के लिए एक अवसादन विधि विकसित की। स्वेडबर्ग के सहायक अर्ने टिसेलियस (1902-1971) ने उसी वर्ष इलेक्ट्रोफोरेसिस की विधि बनाई, जो विद्युत क्षेत्र में आवेशित अणुओं के प्रवास की गति में अंतर के आधार पर विशाल अणुओं को अलग करने की एक अधिक उन्नत विधि थी। 20वीं सदी की शुरुआत में. रूसी रसायनज्ञ मिखाइल सेमेनोविच त्सवेट (1872-1919) ने एक अधिशोषक से भरी ट्यूब के माध्यम से उनके मिश्रण को पारित करके पौधों के रंगद्रव्य को अलग करने की एक विधि का वर्णन किया। इस विधि को क्रोमैटोग्राफी कहा गया। 1944 में, अंग्रेजी रसायनज्ञ आर्चर मार्टिन और रिचर्ड सिंह ने विधि का एक नया संस्करण प्रस्तावित किया: उन्होंने ट्यूब को फिल्टर पेपर के साथ अवशोषक के साथ बदल दिया। इस तरह पेपर क्रोमैटोग्राफी सामने आई - रसायन विज्ञान, जीव विज्ञान और चिकित्सा में सबसे आम विश्लेषणात्मक तरीकों में से एक, जिसकी मदद से 1940 के दशक के अंत और 1950 के दशक की शुरुआत में विभिन्न प्रोटीनों के टूटने से उत्पन्न अमीनो एसिड के मिश्रण का विश्लेषण करना संभव हो गया। प्रोटीन की संरचना निर्धारित करें. श्रमसाध्य शोध के परिणामस्वरूप, इंसुलिन अणु (फ्रेडरिक सेंगर) में अमीनो एसिड का क्रम स्थापित किया गया था, और 1964 तक इस प्रोटीन को संश्लेषित किया गया था। आजकल, जैव रासायनिक संश्लेषण विधियों का उपयोग करके कई हार्मोन, दवाएं और विटामिन प्राप्त किए जाते हैं।

औद्योगिक रसायन शास्त्र.
संभवतः आधुनिक रसायन विज्ञान के विकास में सबसे महत्वपूर्ण चरण 19वीं शताब्दी का निर्माण था। विभिन्न अनुसंधान केंद्र मौलिक के अलावा व्यावहारिक अनुसंधान में भी लगे हुए हैं। 20वीं सदी की शुरुआत में. कई औद्योगिक निगमों ने पहली औद्योगिक अनुसंधान प्रयोगशालाएँ बनाईं। संयुक्त राज्य अमेरिका में, ड्यूपॉन्ट रासायनिक प्रयोगशाला की स्थापना 1903 में हुई थी, और बेल प्रयोगशाला की स्थापना 1925 में हुई थी। 1940 के दशक में पेनिसिलिन और फिर अन्य एंटीबायोटिक दवाओं की खोज और संश्लेषण के बाद, बड़ी दवा कंपनियाँ उभरीं, जिनमें पेशेवर रसायनज्ञ कार्यरत थे। मैक्रोमोलेक्युलर यौगिकों के रसायन विज्ञान के क्षेत्र में कार्य का अत्यधिक व्यावहारिक महत्व था। इसके संस्थापकों में से एक जर्मन रसायनज्ञ हरमन स्टुडिंगर (1881-1965) थे, जिन्होंने पॉलिमर की संरचना का सिद्धांत विकसित किया था। रैखिक पॉलिमर के उत्पादन के तरीकों की गहन खोज से 1953 में पॉलीइथाइलीन (कार्ल ज़िग्लर) और फिर वांछित गुणों वाले अन्य पॉलिमर के संश्लेषण का मार्ग प्रशस्त हुआ। आज, पॉलिमर उत्पादन रासायनिक उद्योग की सबसे बड़ी शाखा है।
रसायन विज्ञान में सभी प्रगतियाँ मनुष्यों के लिए लाभदायक नहीं रही हैं। 19 वीं सदी में पेंट, साबुन और वस्त्रों के उत्पादन में हाइड्रोक्लोरिक एसिड और सल्फर का उपयोग किया जाता था, जो पर्यावरण के लिए एक बड़ा खतरा था। 20 वीं सदी में प्रयुक्त पदार्थों के पुनर्चक्रण के साथ-साथ मानव स्वास्थ्य और पर्यावरण के लिए खतरा पैदा करने वाले रासायनिक कचरे के प्रसंस्करण के कारण कई कार्बनिक और अकार्बनिक सामग्रियों का उत्पादन बढ़ गया है।
साहित्य:
फ़िगुरोव्स्की एन.ए. रसायन विज्ञान के सामान्य इतिहास पर निबंध. एम., 1969
जुआ एम. रसायन शास्त्र का इतिहास. एम., 1975
अजीमोव ए. रसायन विज्ञान का एक संक्षिप्त इतिहास. एम., 1983
लेवोज़ियर की विधि, दहन का ऑक्सीजन सिद्धांत, तत्व की अवधारणा पर पुनर्विचार, रासायनिक घटनाओं पर विचारों में वैश्विक परिवर्तन, जो फ्रांसीसी वैज्ञानिक ए.एल. के काम के परिणामस्वरूप हुआ। लवॉज़ियर को पारंपरिक रूप से रासायनिक क्रांति कहा जाता है। 1. दहन की ऑक्सीजन अवधारणा के साथ फ्लॉजिस्टन सिद्धांत का प्रतिस्थापन; 2. रासायनिक पदार्थों की संरचना की स्वीकृत प्रणाली का संशोधन; 3. रासायनिक तत्व की अवधारणा पर पुनर्विचार; 4. पदार्थों के गुणों की उनकी गुणात्मक और मात्रात्मक संरचना पर निर्भरता के बारे में विचारों का निर्माण। ए. लावोइसियर ने अपने शोध को भौतिक-रासायनिक दृष्टिकोण पर आधारित किया, जो उस समय के भौतिकी के प्रयोगात्मक तरीकों और सैद्धांतिक अवधारणाओं के लगातार अनुप्रयोग द्वारा प्रतिष्ठित था। उस समय भौतिकी के सैद्धांतिक विचारों के बीच केंद्रीय भूमिका आई. न्यूटन के गुरुत्वाकर्षण बल के सिद्धांत द्वारा निभाई गई थी। आई के अनुसार, इस गुरुत्वाकर्षण का माप शरीर का वजन है। द्रव्यमान के वजन की आनुपातिकता पर न्यूटन की स्थिति, भौतिक तरीकों (वजन) द्वारा निर्धारित की जा सकती है। इन विचारों का परिणाम भौतिक कणों की सबसे आवश्यक संपत्ति के रूप में वजन की धारणा थी। एंटोनी लॉरेंट लावोइसियर 1743-1794 ए. लावोइसियर ने रासायनिक प्रतिक्रियाओं में पदार्थों की मात्रा निर्धारित करने के लिए व्यवस्थित रूप से सटीक वजन का उपयोग करना शुरू किया। अपने कई पूर्ववर्तियों के विपरीत, ए. लवॉज़ियर ने परस्पर क्रिया करने वाले पदार्थों के कुल वजन को बनाए रखने के सामान्य सिद्धांत के आधार पर, रासायनिक प्रक्रिया में शामिल सभी पदार्थों (गैसीय पदार्थों सहित) का वजन किया। अर्थात्, उनकी मात्रात्मक पद्धति पदार्थ के संरक्षण के सिद्धांत पर आधारित थी - शास्त्रीय प्राकृतिक विज्ञान की एक मौलिक स्थिति, जिसे प्राचीन काल में व्यक्त किया गया था। ए लावोइसियर ने न केवल वजन, बल्कि शुरुआती पदार्थों और प्रतिक्रिया उत्पादों (घनत्व, तापमान, आदि) की अन्य भौतिक विशेषताओं को भी निर्धारित किया। भविष्य में मात्रात्मक मापदंडों को मापने से उन रासायनिक परिवर्तनों के विस्तृत तंत्र को स्पष्ट करना संभव हो गया जिनका पहले से ही गुणात्मक अध्ययन किया जा चुका था। उन्होंने एक रिटॉर्ट में पारे की एक तौली हुई मात्रा रखी, जिसकी लंबी घुमावदार गर्दन तरल पारे के ऊपर उलटी हुई घंटी से संचार करती थी। प्रयोग से पहले, न केवल रिटॉर्ट और घंटी में पारे के ऊपर हवा की मात्रा मापी गई, बल्कि पूरे उपकरण का वजन भी निर्धारित किया गया। फिर रिटोर्ट को 12 दिनों तक लगभग पारे के क्वथनांक तक गर्म किया गया। धीरे-धीरे, रिटॉर्ट में पारे की सतह लाल पपड़ियों से ढक गई। जब इन शल्कों (पारा ऑक्साइड) की संख्या बढ़ना बंद हो गई तो प्रयोग रोक दिया गया। उपकरण को ठंडा करने के बाद, बनने वाले उत्पादों की मात्रा की सटीक गणना की गई। यह पता चला कि: पूरे उपकरण का कुल वजन नहीं बदला, हवा की मात्रा कम हो गई, ली गई हवा का वजन उतना ही कम हो गया जितना पारा का वजन बढ़ गया (ऑक्साइड के गठन के कारण)। प्रीस्टली विधि का उपयोग करके मर्क्यूरिक ऑक्साइड (रिटॉर्ट ए) से ऑक्सीजन प्राप्त करना। पारा एक गोलाकार बर्तन बी में जमा होता है, और ऑक्सीजन गैस आउटलेट ट्यूब सी से सिलेंडर डी में गुजरता है, जहां यह तरल पारा के ऊपर एकत्र होता है। चित्र को पूरा करने के लिए, परिणामी पारा ऑक्साइड को इकट्ठा करना, प्रीस्टले की विधि के अनुसार इसे विघटित करना और प्राप्त ऑक्सीजन की मात्रा को मापना आवश्यक था। जैसा कि कोई उम्मीद कर सकता है, इस तरह के प्रयोग को पुन: प्रस्तुत करने से लैवोज़ियर को ऑक्सीजन की वही (संभावित त्रुटि के भीतर) मात्रा मिली जो पारा द्वारा हवा से अवशोषित की गई थी। ए. लेवॉज़ियर ने फॉस्फोरस वाली प्लेट को पानी में तैर रहे एक कॉर्क स्टैंड पर रखा, फॉस्फोरस को गर्म तार से आग लगा दी और तुरंत इसे कांच की घंटी से ढक दिया। अंदर की जगह में गाढ़ा सफेद धुआं भर गया। जल्द ही फॉस्फोरस खत्म हो गया और पानी बढ़ने लगा और घंटी में भरने लगा। कुछ देर बाद पानी बढ़ना बंद हो गया। - ऐसा लगता है कि मैंने पर्याप्त फास्फोरस नहीं लिया। सारी हवा उससे नहीं जुड़ सकी. हमें प्रयोग दोहराना होगा. लेकिन फॉस्फोरस की दोगुनी मात्रा के साथ एक दूसरे प्रयोग ने एक समान परिणाम दिया: पानी उसी स्तर तक बढ़ गया। यहां तक कि दसवीं बार किए गए प्रयोग से भी यही नतीजा निकला। - फॉस्फोरस वायु के केवल पांचवें भाग के साथ संयोजित होता है। क्या वायु सचमुच एक जटिल मिश्रण है? लेवॉज़ियर ने सल्फर के दहन का भी अध्ययन किया। जलते समय, यह हवा के केवल पांचवें हिस्से के साथ संयुक्त होता है। इसके बाद वैज्ञानिक ने धातुओं के जलने का अध्ययन करना शुरू किया। जब लेवॉज़ियर द्वारा उपयोग किए गए उपकरणों को लंबे समय तक कैल्सीनेशन के अधीन किया गया, तो धातुएं धातु की राख में बदल गईं, लेकिन जब कोयले के साथ मिलाया गया और उच्च तापमान पर गर्म किया गया, तो राख फिर से धातु में बदल गई। हालाँकि, इस प्रक्रिया से एक गैस निकली जिसे रसायनशास्त्री "बाध्यकारी वायु" (कार्बन डाइऑक्साइड) कहते हैं। लेवॉज़ियर अच्छी तरह से समझते थे कि दहन गैसों से जुड़ा था, लेकिन फिर भी कोई निश्चित निष्कर्ष नहीं निकाल सके। इस प्रकार गैसों के अध्ययन की आवश्यकता उत्पन्न हुई। "बाध्यकारी वायु" क्या है? क्या यह चूना पत्थर में निहित है? जब चूना पत्थर को गर्म किया जाता है और उसे बुझे हुए चूने में बदल दिया जाता है तो यह कैसे उत्पन्न होता है? धात्विक पारा और पारा (II) ऑक्साइड। क्या दहन में हमेशा हवा शामिल होती है? यदि ऐसा है, तो इस मामले में कौन सा पदार्थ अधिक जटिल है - धातु या धातु की राख? ए लावोइसियर का स्पष्ट मानना था कि हवा में दो भाग होते हैं - उनमें से एक दहन का समर्थन करता है (यह कैलक्लाइंड होने पर धातुओं के साथ जुड़ जाता है), दूसरा दहन का समर्थन नहीं करता है और जीवित जीव इसमें मर जाते हैं। दहन के दौरान, शरीर हवा के इस सक्रिय भाग को अवशोषित करते हैं, जिसे उन्होंने "अच्छी हवा" कहा। यह इस तथ्य को भी स्पष्ट करता है कि परिणामी उत्पाद मूल उत्पाद से भारी है। वैज्ञानिक इस निष्कर्ष पर पहुंचे कि दहन अपघटन की प्रक्रिया नहीं है, बल्कि हवा के हिस्से के साथ संबंध की प्रक्रिया है। इसके अलावा, हवा का यह हिस्सा फ्लॉजिस्टन विलायक का यांत्रिक कार्य नहीं करता है, बल्कि दहन प्रक्रिया के रसायन विज्ञान में भाग लेता है, जिससे नए यौगिकों का निर्माण होता है। रिटॉर्ट में पारा ऑक्साइड के अपघटन का अवलोकन 1775 की शुरुआत में, ए. लावोइसियर गनपाउडर और नाइट्रेट के कार्यालय के निदेशक बने। इस संबंध में उन्होंने बारूद बनाने में प्रयुक्त सामग्री पर शोध करना शुरू किया। लेवॉज़ियर ने साबित किया कि साल्टपीटर और नाइट्रिक एसिड में "अच्छी हवा" होती है; दहन के दौरान सल्फर और फास्फोरस इस प्रकार की हवा के साथ मिलते हैं, और परिणामस्वरूप पदार्थों में एसिड के गुण होते हैं। - शायद सभी अम्लों में यह गैस होती है? - उन्होंने खुद से एक से अधिक बार सवाल पूछा। लेवोज़ियर ने नई गैस का नाम ऑक्सीजन रखा। दहन के ऑक्सीजन सिद्धांत के मूल सिद्धांत 1777 में तैयार किए गए थे। 1. इस सिद्धांत के अनुसार, दहन केवल ऑक्सीजन की उपस्थिति में हो सकता है, और प्रकाश और आग निकलती है। 2. जले हुए पदार्थ का वजन ठीक अवशोषित हवा की मात्रा से बढ़ता है। 3. जब धातुएँ जलती हैं, तो ऑक्सीजन के साथ संयोजन के परिणामस्वरूप धात्विक चूने का निर्माण होता है। 4. गैर-धात्विक पदार्थों को जलाते समय - एसिड (उस समय एसिड एनहाइड्राइड को इसी तरह कहा जाता था)। ए लावोइसियर ने प्रदर्शित किया कि कोयले के दहन के दौरान कार्बन डाइऑक्साइड बनता है, और कई प्राकृतिक (कार्बनिक) निकायों के दहन के दौरान भी निकलता है। इससे ए. लवॉज़ियर को कार्बनिक पदार्थों की गुणात्मक और मात्रात्मक संरचना निर्धारित करने के लिए एक सुविधाजनक विधि प्रस्तावित करने का अवसर मिला। कार्बन डाइऑक्साइड की संरचना का निर्धारण करने से ए. लावोइसियर को श्वसन के रसायन विज्ञान (ऑक्सीजन का अवशोषण और कार्बन डाइऑक्साइड की रिहाई) की सही समझ की रूपरेखा तैयार करने की अनुमति मिली, जिसका दहन प्रक्रियाओं के साथ घनिष्ठ सादृश्य पहले ही बार-बार नोट किया गया है (जे द्वारा काम करता है) मेयो, जी. बोएरहावे, जे. प्रीस्टली, आदि) गैसों के साथ प्रयोग के लिए रासायनिक उपकरण। ए.एल. लावोइसियर की पुस्तक "फंडामेंटल्स ऑफ एंटीफ्लॉजिस्टन केमिस्ट्री" से। संस्करण 1792 लाल लौह अयस्क (हेमेटाइट) Fe2Oz कार्बन डाइऑक्साइड के निर्माण के तरीकों और गुणों का अध्ययन करने से ए. लावोइसियर को दहन के ऑक्सीजन सिद्धांत का विस्तार करने और पदार्थों के ऑक्सीकरण-कमी के दृष्टिकोण से कई रासायनिक प्रक्रियाओं की व्याख्या करने की अनुमति मिली। अर्थात्, दहन प्रक्रियाओं के अध्ययन से, वैज्ञानिक सामान्य रूप से ऑक्सीकरण प्रतिक्रियाओं का अध्ययन करने के लिए आगे बढ़े। उदाहरण के लिए, ए. लावोइसियर ने प्रतिक्रियाओं का अध्ययन किया: 2Fe2O3 + 3C = 3CO2 + 4Fe 2Fe + 3H2O = Fe2O3 + 3H2 कोयला और फिर भी उन्हें एक प्रश्न का उत्तर नहीं मिला; इसका संबंध "ज्वलनशील हवा" के दहन से था, जो धातुओं को एसिड में घोलकर प्राप्त की जाती थी और आसानी से जल जाती थी। नए सिद्धांत के अनुसार, लावोइसियर के अनुसार उत्पाद भारी होने चाहिए, उन्हें पूरी तरह से पकड़ना संभव नहीं था, और वजन हमेशा कम होता था। यहां एक और कठिनाई थी. एसिड के सिद्धांत के अनुसार, "ज्वलनशील वायु" (हाइड्रोजन) को ऑक्सीजन के साथ मिलकर एक एसिड बनाना चाहिए, लेकिन इसे प्राप्त करना संभव नहीं था। लावोइसियर ने इस जटिल समस्या पर इंग्लैंड से आए भौतिक विज्ञानी और रसायनज्ञ चार्ल्स ब्लागडेन के साथ चर्चा करने का फैसला किया, जिन्हें उन्होंने अपने असफल प्रयोगों के बारे में विस्तार से बताया। - मेरे मित्र हेनरी कैवेंडिश ने साबित किया कि यदि आप एक बंद बर्तन में साधारण हवा को "ज्वलनशील हवा" के साथ मिलाते हैं और मिश्रण को आग लगाते हैं, तो बर्तन की दीवारों पर छोटी बूंदें बन जाएंगी - "ज्वलनशील हवा" के दहन का उत्पाद। कैवेंडिश ने निर्धारित किया कि ये पानी की बूँदें थीं। - एक अद्भुत खोज. इसका मतलब यह है कि पानी कोई तत्व नहीं, बल्कि एक जटिल पदार्थ है। मैं तुरंत इन प्रयोगों को दोहराना चाहूँगा और स्वयं देखना चाहूँगा। हाइड्रोजन के उत्पादन और संग्रह के लिए जी. कैवेंडिश का उपकरण ए. लावोइसियर ने जी. कैवेंडिश और जे. वॉट द्वारा इसी तरह के प्रयोगों के बाद दहनशील हवा और ऑक्सीजन से पानी के संश्लेषण पर एक प्रयोग किया (ए. लावोइसियर के साथ-साथ, जी द्वारा भी इसी तरह के प्रयोग किए गए थे) मोंगे), लेकिन इन वैज्ञानिकों के विपरीत, ए. लावोइसियर ने इस संश्लेषण की व्याख्या ऑक्सीजन सिद्धांत के दृष्टिकोण से की, जिसमें दिखाया गया कि "दहनशील हवा" (जिसे उन्होंने "हाइड्रोजन" नाम देने का प्रस्ताव दिया) और ऑक्सीजन तत्व हैं, और पानी उनका है। मिश्रण। (एक विद्युत चिंगारी के साथ हाइड्रोजन और ऑक्सीजन के मिश्रण को प्रज्वलित करके पानी की संरचना निर्धारित करने के लिए एक प्रयोग के दौरान) प्रयोगों के परिणामस्वरूप, ए. लावोइसियर इस निष्कर्ष पर पहुंचे कि पदार्थों के वजन के संरक्षण का नियम सार्वभौमिक है कानून। ऑक्सीकरण का सिद्धांत भी सामान्य है और इसका कोई अपवाद नहीं है। जल, अम्ल और धातु ऑक्साइड जटिल पदार्थ हैं, जबकि धातु, सल्फर और फास्फोरस सरल पदार्थ हैं। इसने रासायनिक यौगिकों की संरचना की पूरी प्रणाली पर विचारों को पूरी तरह से बदल दिया। फ्लॉजिस्टन मौजूद नहीं है, और हवा गैसों का मिश्रण है। ए. लावॉज़ियर ने ये विचार शिक्षाविदों के सामने व्यक्त किए, जिनके सामने उन्होंने अपने प्रयोगों का प्रदर्शन किया। हालाँकि, उनमें से अधिकांश लावोइसियर के काम को मान्यता नहीं देना चाहते थे; उन पर प्रीस्टली और कैवेंडिश के अध्ययन से अपने विचार उधार लेने का आरोप लगाया गया था। शिक्षाविदों ने बार-बार कहा है कि वे गैसपार्ड मोंगे का जिक्र करते हुए पानी के अपघटन पर इसी तरह के प्रयोगों के बारे में जानते हैं। लवॉज़ियर की प्राथमिकता को मान्यता नहीं दी गई। शोध में शामिल होने के बजाय, वैज्ञानिकों ने इस बात पर बहस की कि इस घटना की खोज किसने की। वैज्ञानिक जगत में समर्थन न मिलने पर, लेवोज़ियर ने फिर भी अपना काम जारी रखा। अब उन्होंने प्रसिद्ध भौतिक विज्ञानी और गणितज्ञ पियरे साइमन लाप्लास के साथ सहयोग किया। वे एक विशेष उपकरण बनाने में कामयाब रहे जिसके साथ पदार्थों के दहन के परिणामस्वरूप निकलने वाली गर्मी को मापना संभव था। यह तथाकथित बर्फ कैलोरीमीटर था। शोधकर्ताओं ने जीवित जीवों द्वारा उत्सर्जित गर्मी का भी विस्तृत अध्ययन किया। उत्सर्जित कार्बन डाइऑक्साइड की मात्रा और शरीर द्वारा उत्पन्न गर्मी को मापकर, उन्होंने साबित किया कि भोजन शरीर में एक विशेष तरीके से "जलता" है। इस दहन से उत्पन्न गर्मी शरीर के सामान्य तापमान को बनाए रखने का काम करती है। लैवोज़ियर-लाप्लास बर्फ कैलोरीमीटर ने 18वीं शताब्दी में कई ठोस और तरल पदार्थों की ताप क्षमता, साथ ही विभिन्न ईंधनों के दहन की गर्मी और जीवित जीवों द्वारा जारी गर्मी को मापना संभव बना दिया। उदाहरण के लिए, आंतरिक कक्ष में किसी जानवर (या अन्य वस्तु) द्वारा छोड़ी गई गर्मी आंतरिक "बर्फ जैकेट" में बर्फ को पिघलाने पर खर्च की गई थी। बाहरी भाग ने आंतरिक भाग के तापमान को स्थिर बनाए रखने का काम किया। जारी गर्मी को बर्तन में बहने वाले पिघले पानी का वजन करके मापा गया था। लाप्लास लावोइसियर के विचारों की सत्यता के प्रति आश्वस्त थे और उनके सिद्धांत को स्वीकार करने वाले पहले व्यक्ति थे। 1785 में, क्लॉड लुईस बर्थोलेट, जो उस समय बहुत प्रसिद्ध हो गए थे, लावोइसियर के सिद्धांत के समर्थन में सामने आए। कुछ समय बाद, लैवोज़ियर को तत्कालीन सबसे प्रमुख रसायनज्ञों एंटोनी फोरक्रोइक्स और गुइटन डी मोरव्यू ने समर्थन दिया। लाप्लास पियरे-साइमन 1749 -1827 फ्रांसीसी गणितज्ञ, मैकेनिक, भौतिक विज्ञानी और खगोलशास्त्री फोरक्रोइक्स एंटोनी-फ्रेंकोइस (1755-1809) फ्रांसीसी रसायनज्ञ और राजनीतिज्ञ पद्धतिगत दृष्टि से, ए.एल. के कार्यों द्वारा उत्पन्न रसायन विज्ञान में क्रांति का एक महत्वपूर्ण परिणाम। लवॉज़ियर के अनुसार, "रासायनिक तत्व" की अवधारणा की सामग्री में बदलाव आया था। तत्वों को किसी वस्तु में पहले से मौजूद उसके अपघटन के उत्पादों के रूप में नहीं देखा जाने लगा, बल्कि उस अंतिम सीमा के रूप में देखा जाने लगा, जिस तक पदार्थ सैद्धांतिक रूप से विघटित हो सकते हैं। तत्वों को सामग्री के रूप में माना जाने लगा, संरचना के विश्लेषणात्मक रूप से निर्धारित टुकड़े, गुणात्मक रूप से नए संरचनाओं में अविभाज्य और उनके द्वारा बनाए गए जटिल निकायों के किसी भी रासायनिक परिवर्तन की प्रक्रिया में संरक्षित होते हैं। विश्लेषण की वजन पद्धति के उपयोग के लिए धन्यवाद, ए लावोइसियर के कार्यों में, तत्वों के सीमित सेट और उनकी गुणात्मक विविधता के बारे में विचार बने। इससे विविध गुणात्मक और मात्रात्मक तात्विक संरचना के परिणामस्वरूप रासायनिक पदार्थों की विविधता को समझाने का एक दृष्टिकोण सामने आया। यह माना गया कि प्रत्येक गुणात्मक रूप से परिभाषित पदार्थ में हमेशा एक सटीक परिभाषित और अद्वितीय मात्रात्मक संरचना होती है। परिवर्तनशील संरचना वाले यौगिक (बर्थोलाइड्स) और आइसोमेरिज्म की घटना उस समय ज्ञात नहीं थी। कार्बनिक पदार्थों के तात्विक विश्लेषण के लिए ए. लावोइसियर का उपकरण 18वीं शताब्दी में, रसायनज्ञों ने अम्लता की समस्या में दहन की समस्या से कम रुचि नहीं दिखाई, क्योंकि ये दोनों समस्याएं उस समय के विश्लेषणात्मक अनुसंधान की दो मुख्य दिशाओं के अनुरूप थीं ( अपघटन "सूखा" - आग की मदद से, और "गीला तरीका" - एसिड का उपयोग करके)। ए लावोइसियर के कार्यों के प्रकाशन से पहले, यह माना जाता था कि सभी एसिड की संरचना में एक निश्चित एकल प्राथमिक एसिड होता है, जो पूरे यौगिक को अम्लता की गुणवत्ता देता है। ए लावोइसियर ने सल्फ्यूरिक, फॉस्फोरिक और नाइट्रिक एसिड (आधुनिक अवधारणाओं में - SO3, P2O5, N2O5) के अपघटन पर प्रयोगों के आधार पर, इन यौगिकों में ऑक्सीजन की उपस्थिति के साथ अम्लता की संपत्ति को जोड़ा (इसलिए नाम ऑक्सीजन - ऑक्सीजेनियम - अम्ल-उत्पादक, खट्टा सिद्धांत)। ए. लेवॉज़ियर के अनुसार एसिड एक दूसरे से भिन्न होते हैं क्योंकि वे ऑक्सीजन, एक एसिड रेडिकल से जुड़े होते हैं। ऑक्सीजन को एसिड का एक आवश्यक तत्व माना जाता था, और, कुछ समय के लिए, यहां तक कि म्यूरिक (हाइड्रोक्लोरिक) एसिड को ऑक्सीजन के साथ म्यूरिक रेडिकल के एक यौगिक के रूप में दर्शाया गया था, और क्लोरीन को म्यूरिक एसिड का ऑक्साइड माना जाता था। गुइटन डी मोरव्यू लुई बर्नार्ड (1737-1816) फ्रांसीसी रसायनज्ञ और राजनीतिज्ञ गुइटन डी मोरव्यू पहली बार लावोइसियर से दहन के सिद्धांत के बारे में नहीं मिले थे: "मुझे नहीं पता कि आप कितनी रुचि रखते हैं, लेकिन रासायनिक यौगिकों के नामों में पूरी अराजकता है . - मैं आपसे पूरी तरह सहमत हूँ। - मेथोडोलॉजिकल इनसाइक्लोपीडिया का रासायनिक अनुभाग वर्तमान में प्रकाशन के लिए तैयार किया जा रहा है। और चूंकि, अभी भी मौजूद नामों का उपयोग करके, सभी प्रश्नों के व्यापक उत्तर देना असंभव है, इसलिए मैंने रासायनिक यौगिकों का एक नया नामकरण संकलित करना शुरू किया। निःसंदेह, मुझे अग्रणी रसायनज्ञों की सहायता की आवश्यकता है। - दहन के सिद्धांत और इस प्रक्रिया में ऑक्सीजन की भूमिका के आधार पर, मैं कुछ धारणाएँ बना सकता हूँ। आइए धातु की राख लें - ऑक्सीजन के साथ धातु का एक यौगिक। आइए ऑक्सीजन ऑक्साइड के साथ तत्वों के संयोजन को कहते हैं। फिर जिंक राख जिंक ऑक्साइड होगी, लौह राख लौह ऑक्साइड होगी, इत्यादि। "बाध्यकारी वायु" क्या है? मैं पहले ही सिद्ध कर चुका हूं कि यह कार्बन और ऑक्सीजन का एक यौगिक है। अत: इसे कार्बन मोनोऑक्साइड ही कहना होगा। 1787 में, गुइटन डी मोरव्यू ने "द मेथड ऑफ़ केमिकल नॉमेनक्लेचर" प्रकाशित किया, जिसके निर्माण में लावोज़ियर, फोरक्रोइक्स और बर्थोलेट ने भाग लिया। साधारण पिंडों की तालिका लैवोज़ियर ए.एल. लवॉज़ियर रासायनिक भाषा का परिवर्तन रसायन विज्ञान में वैश्विक परिवर्तनों का परिणाम था और इसका लक्ष्य प्रत्येक पदार्थ को एक नाम देना था जो उसकी संरचना और रासायनिक गुणों को दर्शाता हो (इस बिंदु तक, एक पदार्थ के कई नाम हो सकते थे, जो अक्सर दिए जाते थे) मौका)। नए नामकरण में, प्रत्येक पदार्थ को उसके सामान्य (उदाहरण के लिए, एसिड) और विशिष्ट गुणों (उदाहरण के लिए, सल्फ्यूरिक, नाइट्रिक, फॉस्फोरिक एसिड) के दृष्टिकोण से माना जाता था। मौलिक संरचना डेटा के आधार पर विशिष्ट गुण निर्धारित किए गए थे। नामकरण ने रासायनिक जानकारी के आदान-प्रदान को बहुत सुविधाजनक बनाया; सामान्य तौर पर इसके बुनियादी सिद्धांत आज तक संरक्षित हैं। लावोइसियर उस समय अपनी महानतम रचनाओं में से एक - रसायन विज्ञान की पाठ्यपुस्तक, पर काम कर रहे थे, जिसके संकलन की आवश्यकता लंबे समय से थी। आधुनिक सिद्धांतों की नींव को स्पष्ट रूप से बताने के लिए, प्रकृति में घटनाओं को नए तरीके से समझाना आवश्यक था। रसायन विज्ञान में नई उपलब्धियाँ क्रिस्टोफ़ल ग्लेसर और निकोलस लेमेरी की पुरानी पाठ्यपुस्तकों में परिलक्षित नहीं हुईं। 1788 के अंत तक पाठ्यपुस्तक तैयार हो गई। पांडुलिपि की तैयारी का अधिकांश श्रेय मैडम लैवोज़ियर को था, जिन्होंने पाठ्यपुस्तक के तीसरे भाग को कलात्मक रूप से डिजाइन किया था। ए. लावोइसियर की पाठ्यपुस्तक का शीर्षक पृष्ठ ए. लावोइसियर की पाठ्यपुस्तक के पहले भाग में दहन के ऑक्सीजन सिद्धांत की प्रस्तुति, गैसों के निर्माण और अपघटन पर प्रयोगों का विवरण, सरल पदार्थों का दहन, एसिड का निर्माण, एक विवरण शामिल था। वायुमंडल और जल की संरचना, और नया नामकरण। दूसरे भाग में "सरल निकायों की तालिका" शामिल थी, जो व्यावहारिक रूप से रासायनिक तत्वों का पहला वर्गीकरण था (कुल 33 तत्व प्रस्तुत किए गए थे)। तालिका में वास्तविक तत्व और कुछ यौगिक (उदाहरण के लिए, क्षार धातु ऑक्साइड) दोनों शामिल थे जिन्हें उस समय विघटित नहीं किया जा सकता था (लेकिन, जैसा कि ए. लावोइसियर ने नोट किया था, बाद में विघटित किया जा सकता था)। तालिका में, दो सिद्धांत तत्वों के रूप में दिखाई देते हैं - कैलोरी और हाइड्रोजन, जिनका कोई वजन नहीं होता है, लेकिन उनकी उपस्थिति लगातार रासायनिक प्रक्रियाओं से जुड़ी होती है। तत्वों को ऊष्मा और प्रकाश का श्रेय उस समय के भौतिकी में कैलोरी के सिद्धांत के प्रसार का परिणाम था। इस सिद्धांत में ऊष्मा को एक प्रकार का वातावरण माना गया जो सभी पिंडों के कणों को घेरे हुए है और कणों के एक दूसरे से प्रतिकर्षण का कारण है। लेवॉज़ियर का झुकाव रासायनिक प्रतिक्रियाओं में गर्मी अवशोषण की घटना के साथ-साथ ठोस से तरल और तरल से गैसीय अवस्था में पदार्थों के संक्रमण के दौरान, पदार्थ के साथ कैलोरी के संयोजन के परिणामस्वरूप होने वाली घटना को समझाने का था। उनका मानना था कि किसी पदार्थ की ठोस, तरल और गैसीय अवस्था उसमें मौजूद गर्मी की मात्रा पर निर्भर करती है, गैसों के बारे में पहले के विचारों के विपरीत जो तरल पदार्थ, "गैर-वाष्पीकरणीय" तरल पदार्थ और स्थायी ठोस पदार्थों में बिल्कुल गैर-संघनित होती हैं। लेवोज़ियर ने लिखा है कि ठोस अवस्था में, शरीर को बनाने वाले कणों के बीच आकर्षण बल प्रतिकारक बलों से अधिक होता है, तरल अवस्था में वे समतल हो जाते हैं, और गैसीय अवस्था में, कैलोरी के प्रभाव में, प्रतिकारक बल प्रबल होते हैं आकर्षण की शक्तियों पर. एकत्रीकरण की विभिन्न अवस्थाओं में मौजूद रहने के लिए सभी भौतिक स्थूल पदार्थों की क्षमता का विचार रासायनिक क्रांति का एक और महत्वपूर्ण पहलू बन गया। रासायनिक प्रतिक्रियाओं में तत्वों के संरक्षण के नियम और पदार्थों के द्रव्यमान के संरक्षण के नियम की प्रायोगिक पुष्टि ने ए. लावोइसियर को रासायनिक समीकरणों के संकलन की शुरुआत करने की अनुमति दी, अर्थात। रासायनिक परिवर्तनों का भौतिक संतुलन। ए लावोइसियर ने लिखा: "अध्ययन के तहत निकायों के सिद्धांतों (तत्वों) और विश्लेषण के माध्यम से बाद में प्राप्त किए गए सिद्धांतों (तत्वों) के बीच समानता या समीकरण के अस्तित्व को मानना आवश्यक है।" ऑक्सीजन के साथ कागज (ए) और तांबे (बी) की प्रतिक्रियाएं यह ध्यान दिया जाना चाहिए कि ए लावोइसियर के काम से बहुत पहले, पदार्थ की संरचना पर मूल विचार रूसी वैज्ञानिक एम.वी. द्वारा व्यक्त किए गए थे। लोमोनोसोव। "एलिमेंट्स ऑफ मैथमेटिकल केमिस्ट्री" पुस्तक में उन्होंने लिखा है कि सभी पिंड कणिकाओं से बने होते हैं, जिनमें बदले में एक निश्चित संख्या में तत्व होते हैं। कणिकाएँ सजातीय होती हैं यदि वे समान संख्या में समान तत्वों से बनी हों, एक दूसरे से समान रूप से जुड़ी हों। कणिकाएं विषमांगी होती हैं यदि उनके तत्व समान नहीं हैं और अलग-अलग तरीकों से या अलग-अलग संख्या में परस्पर जुड़े हुए हैं। शरीरों की अनंत विविधता इसी पर निर्भर है। शरीर तब सरल होते हैं जब वे सजातीय कणिकाओं से बने होते हैं, और जब वे कई असमान कणिकाओं से बने होते हैं तो मिश्रित होते हैं। निकायों के गुण यादृच्छिक नहीं हैं; वे उनके घटक कणिकाओं के गुणों पर निर्भर करते हैं। आइए पहले पर विचार करें - गर्मी। यह क्या दिखाता है? एक भारहीन तरल पदार्थ जो एक शरीर से दूसरे शरीर में प्रवाहित हो सकता है? नहीं। गैलीलियो का यह भी मानना था कि कणिकाएँ गति में थीं। मेरी राय में यह कणिकाओं का प्रथम एवं मुख्य गुण है। लेकिन आंदोलन से गर्मी पैदा होती है। हर कोई जानता है कि जब कोई पहिया घूमता है तो उसकी धुरी गर्म हो जाती है। शरीर की कणिकाएं चलती हैं, अपनी धुरी पर घूमती हैं, एक-दूसरे के खिलाफ रगड़ती हैं और गर्मी पैदा करती हैं... यूलर को लिखे एक पत्र में, मिखाइल वासिलीविच ने प्रकृति में परिवर्तनों पर अपने विचारों को रेखांकित किया: "प्रकृति में होने वाले सभी परिवर्तन इस तरह से होते हैं कि अगर किसी चीज़ में कुछ जोड़ा जाता है, तो किसी चीज़ से उसे हटा दिया जाता है। इस प्रकार, जितना पदार्थ एक शरीर में जोड़ा जाता है, उतना ही दूसरे से नष्ट हो जाता है, मैं कितने घंटे सोने में बिताता हूं, उतना ही मैं जागने से लेता हूं, आदि। चूंकि यह प्रकृति का एक सार्वभौमिक नियम है, इसलिए यह भी लागू होता है गति के नियमों के अनुसार: एक शरीर जो अपने धक्के से दूसरे को चलने के लिए उत्तेजित करता है, वह अपनी गति से उतना ही खो देता है जितना वह दूसरे से संचार करता है, उसके द्वारा संचालित होता है..." - ऐसे विचार जो लोमोनोसोव से पहले किसी ने व्यक्त नहीं किए थे। बॉयल ने बर्तनों को गर्म करने के बाद क्यों खोला? ऐसे मामले में, जहाजों से कुछ वाष्पित हो सकता है और उनका वजन बदल सकता है। प्रयोगों को दोहराना आवश्यक है, लेकिन सभी अवलोकन और माप एक बंद बर्तन में करें। इसमें हवा है. लोमोनोसोव ने एक विशेष बर्तन तैयार किया, उसमें सीसे का बुरादा डाला, फिर धौंकनी से आग को भड़काया और बर्तन की गर्दन को तब तक गर्म किया जब तक कि कांच नरम न हो जाए। एक क्लैंप का उपयोग करके, उसने गिलास को सील कर दिया और तुरंत बर्तन को आग पर रख दिया। अब उसे पूरा विश्वास हो गया कि जहाज के अंदर कुछ भी नहीं आएगा और उसमें से कुछ भी बाहर नहीं निकलेगा। धौंकनी आखिरी बार फूली, और अब नीली लपटें कोयले के लाल-गर्म ढेर में गायब हो गईं। लोमोनोसोव ने बर्तन को सावधानी से मेज पर रखा और अगला बर्तन तैयार करना शुरू कर दिया। प्रयोग को कई बार दोहराया जाना था, न केवल सीसा, बल्कि अन्य धातुओं को भी कैल्सीन करना: लोहा, तांबा ... लोमोनोसोव ने ठंडे बर्तनों का वजन किया, उन्हें एक बड़ी भट्टी में कोयले पर रखा और आग को भड़काना शुरू कर दिया। पहले तो धौंकनी धीरे-धीरे चली, लेकिन धीरे-धीरे हवा का प्रवाह तेज़ हो गया और इसके साथ ही नीली लपटें दिखाई देने लगीं। जहाज की दीवारें लाल हो गईं और सीसे का बुरादा पिघल गया। चमचमाती चाँदी-सफ़ेद बूँदें तुरंत भूरे-पीले लेप से ढक गईं। लाल तांबे का बुरादा काले-भूरे पाउडर में बदल गया। लोहे का बुरादा काला पड़ गया। मुझे आश्चर्य है कि क्या "कैलोरी" जहाजों में प्रवेश कर गई? क्या यह धातुओं के साथ मिला हुआ था? अगर ऐसा है तो बर्तन का वजन बढ़ना चाहिए. लेकिन तराजू से पता चला कि सभी जहाजों का वजन अपरिवर्तित रहा! कैथरीन द्वितीय की लोमोनोसोव की प्रयोगशाला की यात्रा धातु की राख के बारे में क्या? हमें इसके वजन की तुलना धातु के वजन से करनी होगी। अगले दिन शोधकर्ता ने प्रयोग दोहराये। उन्होंने बर्तन को सील करने से पहले धातु के बुरादे का वजन किया। कैल्सीनेशन के बाद, उसने बर्तनों को फिर से तौला, फिर उन्हें खोला और परिणामी धातु की राख को तौला। राख पहले ली गई धातु से भारी थी! - ये प्रयोग रॉबर्ट बॉयल की राय का खंडन करते हैं। धातुएँ "कैलोरी" के साथ संयोजित नहीं होती हैं: आखिरकार, बर्तन का वजन नहीं बदलता है। यह निर्विवाद है. और फिर भी राख भारी है. - लोमोनोसोव ने फिर सोचा। हालाँकि, बर्तन में एक निश्चित मात्रा में हवा थी... शायद धातुएँ वायु कणिकाओं के साथ मिल जाती हैं? चूंकि बर्तन में धातु की राख भारी हो गई है, इसका मतलब है कि बर्तन में हवा का वजन उसी मात्रा में कम हो गया है। बाहरी हवा की आपूर्ति के बिना, धातु का वजन अपरिवर्तित रहेगा! ऐसे युग में रहते हुए जब रसायन विज्ञान एक विज्ञान के रूप में उभर रहा था, लोमोनोसोव फ्लॉजिस्टन सिद्धांत के गलत विचारों के बावजूद, ऐसे सामान्यीकरण तक पहुंचने में सक्षम थे जो अभी भी भौतिक और रासायनिक विज्ञान का आधार बनते हैं। वह पदार्थ और ऊर्जा के संरक्षण का नियम बनाने वाले पहले व्यक्ति थे, उन्होंने उस पथ को इंगित करने वाले पहले व्यक्ति थे जिसका कई वैज्ञानिकों ने अनुसरण किया।
जब से मानवता इस ग्रह पर प्रकट हुई है, उसने अपेक्षाकृत शांत और स्थिर जीवनशैली अपनाई है, समान भोजन का सेवन किया है, समान स्रोतों से पानी लिया है और समान हवा में सांस ली है। हाल तक, हमारे और बाकी प्रकृति के बीच एक नाजुक संतुलन था, और पर्यावरण या जलवायु में किसी भी तरह के बदलाव के साथ, विकास के गैर-रोक पाठ्यक्रम के कारण शक्ति संतुलन फिर से बराबर हो गया था।
हमारे शरीर में मानसिक क्षमताओं और एक निश्चित मात्रा में सहनशक्ति की उपस्थिति के कारण, एक जैविक प्रजाति के रूप में मनुष्य ने प्रकृति में हस्तक्षेप करने और पर्यावरण को बदलने की क्षमता विकसित की है। औजारों का निर्माण, आग की खोज, जानवरों को पालतू बनाना, जंगली पौधों की खेती, पहली बस्तियों का निर्माण - ये सभी प्रगति और सभ्यता की राह पर पहले कदम थे।
यह लोगों के लिए महत्वपूर्ण था, लेकिन ये सभी कमजोर प्रयास थे, क्योंकि एक व्यक्ति बड़ा नुकसान नहीं पहुंचा सकता था, क्योंकि लोगों की छोटी आबादी अभी भी पूरी तरह से प्रकृति की शक्तियों पर निर्भर थी और इसकी थोड़ी सी भी सनक से कांप जाती थी। समय के साथ-साथ लोगों की बढ़ती हुई सघनता, उनके आक्रमण न केवल और अधिक लगातार होते गए, बल्कि इन आक्रमणों की प्रकृति और भी अधिक लक्षित होती गई। इससे यह तथ्य सामने आया कि, अंततः, पिछली शताब्दी के उत्तरार्ध में, लोगों की प्रक्रियाओं में तेजी लाने की क्षमता इतनी बदल गई कि "हमारे अपने विकास की गति" से हमें खतरा होने लगा।
वाचोव्स्की बंधुओं के दिमाग की उपज - द मैट्रिक्स, दिमाग में आती है, जहां, विडंबना यह है कि लोगों द्वारा बनाई गई मशीनों का उपयोग लोग स्वयं जैविक रूप से लाभकारी ईंधन के रूप में करने लगे। वर्तमान वास्तविकता उन विचारों को प्रेरित करती है जिन्हें उपरोक्त ब्लॉकबस्टर में बहुत रंगीन रूप से दर्शाया गया है: लोग लंबे समय से कई तंत्रों, मशीनों और पदार्थों का आविष्कार करने में परिष्कृत रहे हैं, अपने स्वयं के जीवन को "सुधारने" की इच्छा से, यानी सभ्य बनने के लिए इन सभी को उचित ठहराते हैं।

अधिक स्पष्टता के लिए, आइए हम रासायनिक "आविष्कारों" के इतिहास की ओर रुख करें और, जैसा कि पहले ही कहा गया है, पिछली शताब्दी के उत्तरार्ध को संख्याओं में देखें। ग्राफ स्पष्ट रूप से बीसवीं सदी के उत्तरार्ध में रासायनिक पदार्थों के आविष्कारों की संख्या में वृद्धि को दर्शाता है। जैसा कि आप देख सकते हैं, पिछली शताब्दी के 50 के दशक में रासायनिक उद्योग में वास्तविक उछाल शुरू हुआ, और 1975 तक आंकड़ों में 1,000,000 सिंथेटिक रासायनिक सामग्री दर्ज की गई। इसके अलावा विभिन्न देशों में रसायनज्ञों की "सफलताओं" की विशेषता यह थी कि उनमें सालाना लगभग 1000 नए रसायन शामिल होते थे। पिछली सहस्राब्दी के अंत तक, मानवता "उपयोग में" थी, अर्थात। व्यापक रूप से उपयोग में 60,000 से अधिक कृत्रिम रूप से उत्पादित रसायन थे।

इस प्रकार के "आविष्कारों" की सबसे बड़ी संख्या मानवता की जीवन समर्थन श्रृंखला की सबसे कमजोर कड़ियों से संबंधित है, अर्थात्:
आमतौर पर उपयोग की जाने वाली सामग्रियों का उत्पादन
- कपड़े
- रोधक
- कोटिंग्स
सबसे अधिक उपभोग किए जाने वाले उत्पादों का उत्पादन और खपत
- पोषक तत्वों की खुराक
- प्रसंस्करण और भंडारण में प्रयुक्त पदार्थ
- औषधियों में प्रयुक्त पदार्थ
सामान्य और सुलभ ऊर्जा स्रोतों और मीडिया का उपयोग
- भूमि
- वायु

हमारे द्वारा बनाया गया रसायनों का यह चक्र पहले से ही हमारे जीवन का हिस्सा है; और हमें, किसी भी प्रजाति की तरह, जीवित रहने के लिए इसका उपयोग करना चाहिए, इसके अनुकूल होना चाहिए, या, कम से कम, इससे बचना चाहिए। इस अवधारणा को समझा जा सकता है यदि हम इस सतत प्रक्रिया में अपनी भागीदारी, हां, भागीदारी के तथ्य को स्वीकार करते हैं - एक तरफ, हम निर्माता हैं, और दूसरी तरफ, हम इस चक्र का एक उत्पाद हैं। इसलिए, हमारे स्वयं के विकास या हमारे ज्ञान में कोई भी मोड़ स्वयं पर आता है।
कभी-कभी, हमारे प्रयोगों से हमें लाभ हुआ, जैसा कि पेनिसिलिन के मामले में हुआ, जिसने युद्धों और शांतिकाल में दस लाख से अधिक लोगों की जान बचाई। और कुछ ऐसे भी हैं जिनके बारे में स्वयं उनके खोजकर्ता भी भूलना चाहेंगे - सामूहिक विनाश के सबसे शक्तिशाली हथियारों में से एक, सरीन गैस (जिसे जर्मन रसायनज्ञों द्वारा घातक दुर्घटना से खोजा गया था जो अधिक कीटनाशक बनाने की कोशिश कर रहे थे) को याद करना उचित होगा प्रभावी, द्वितीय विश्व युद्ध की पूर्व संध्या पर)। तीसरी खोजों की प्रकृति हमारे लिए, साथ ही हमारे लिए भी स्पष्ट नहीं है, क्योंकि वे बस खुद को बदल देती हैं: मानव शरीर पर मादक दवाओं के प्रभाव का उदाहरण देने की शायद कोई आवश्यकता नहीं है। हालाँकि पुरानी दुनिया में और फिर दुनिया के अन्य हिस्सों में फार्मेसी की शुरुआत में, उन्हें उन दवाओं के रूप में प्रस्तुत किया गया जिनकी लोगों को ज़रूरत थी।
ऐसा प्रतीत होता है कि यदि किसी पदार्थ का आविष्कार लोगों के लाभ को ध्यान में रखकर किया गया था, तो कुछ ऐसे तथ्य क्यों सामने आते हैं जिनके बारे में हमें संदेह भी नहीं था? व्यवहार में, सब कुछ काफी सरल है - कृत्रिम पदार्थों का खतरा इस तथ्य में निहित है कि हम उनके पूरे अनियंत्रित अस्तित्व के दौरान संपर्क में आने पर उनके प्रभाव के बारे में किसी भी विश्वसनीय सटीकता के साथ कुछ भी नहीं जानते हैं।
इसे एक प्राथमिक उदाहरण से दिखाया जा सकता है: हम लंबे समय से जानते हैं, जैसा कि हमें लगता है, ऑक्सीजन के बारे में सब कुछ। ऑक्सीजन हमारे शरीर के लिए बेहद महत्वपूर्ण है, लेकिन शुद्ध ऑक्सीजन हमें मार सकती है। चूंकि प्रकृति में अशुद्धियों के बिना ऑक्सीजन नहीं मिलती, इसलिए हम इसका इस रूप में उपभोग नहीं कर पाते हैं। जैसा कि आप देख सकते हैं, हम जीवन की जंजीरों में बिल्कुल वैसे ही भाग लेते हैं जैसे प्रकृति ने हमें सिखाया है; और कोई भी विचलन (और यहां हमने उस पदार्थ को बेहतर बनाने की कोशिश की जिसकी हमें आवश्यकता है) घातक साबित होता है। यहां मुख्य बात यह है कि हम किसी भी पदार्थ के बारे में पूरी तरह से आश्वस्त हो सकते हैं कि हम नहीं जानते कि इसके संभावित हानिकारक प्रभाव कब तक प्रकट नहीं हो सकते हैं।
क्रांति की आवश्यक विशेषताओं में से एक, जिसे हम आज भी बढ़ती चिंता के साथ देख रहे हैं, आविष्कृत उत्पादों, सामग्रियों, रचनाओं और उनके लेबलिंग के संबंध में जानकारी की स्वतंत्रता पर अघोषित प्रतिबंध है। यद्यपि अधिक से अधिक देश भोजन, दवा, कपड़े आदि की संरचना के बारे में जानकारी प्रदान करने के लिए अनिवार्य आवश्यकताएं पेश कर रहे हैं, फिर भी रोजमर्रा की जिंदगी में यह निर्धारित करना लगभग असंभव है कि, उदाहरण के लिए, आपका वाशिंग पाउडर, पेंट, प्लास्टिक उत्पाद, आदि। .कुछ भी शामिल है! इस संबंध में सबसे उत्तेजक बात उन व्यक्तियों को छिपाना है जो इस गोपनीयता व्यवस्था की स्थापना में सीधे तौर पर शामिल हैं।
अनावश्यक रसायनों की अधिकता पहले से ही इतनी स्पष्ट हो गई है कि कोई भी नई सामग्री, पॉलिमर या विकल्प के आविष्कार के बारे में उत्साहित नहीं है। इसकी मुख्य पुष्टि पर्यावरण के अनुकूल उत्पादों के प्रति लोगों की बढ़ती इच्छा है। "नरक का रास्ता अच्छे इरादों से बना है," कोई उस रास्ते के बारे में कह सकता है जिससे सभी लोगों को "रासायनिक क्रांति की जीत" को रोकने के लिए गुजरना पड़ता है।
वैज्ञानिक प्रगति में हालिया रुझान जीव विज्ञान, आनुवंशिकी और सभी हरी चीजों की ओर एक बड़े बदलाव का संकेत देते हैं। सबसे अधिक संभावना है, लोगों की आँखें रसायन विज्ञान और परमाणु ऊर्जा से परे प्रकृति की अनंत संभावनाओं के प्रति "खुली" होंगी, और वे इस निष्कर्ष पर पहुंचेंगे कि यदि किसी चीज़ की आपूर्ति नवीकरणीय नहीं है, तो लंबे समय तक प्रयास करने का शायद कोई मतलब नहीं है। इस सीमित तत्व के लिए टर्म प्लान।
लेवॉज़ियर के काम ने शायद रसायन विज्ञान में वही क्रांति पैदा की जो खगोल विज्ञान में कोपरनिकस की खोज से ढाई शताब्दी पहले हुई थी। वे पदार्थ जिन्हें पहले तत्व माना जाता था, जैसा कि लावोइसियर ने दिखाया, जटिल "तत्वों" से युक्त यौगिक बन गए। लैवोज़ियर की खोजों और विचारों का न केवल रासायनिक सिद्धांत के विकास पर, बल्कि रासायनिक ज्ञान की संपूर्ण प्रणाली पर भी जबरदस्त प्रभाव पड़ा। उन्होंने रासायनिक ज्ञान और भाषा के आधार को इतना बदल दिया कि रसायनज्ञों की अगली पीढ़ियाँ, संक्षेप में, उस शब्दावली को भी नहीं समझ सकीं जो लावोइसियर से पहले इस्तेमाल की गई थी। इस आधार पर, बाद में यह माना गया कि लावोइसियर की खोजों तक "सच्चे" रसायन विज्ञान पर चर्चा नहीं की जा सकती थी। रासायनिक अनुसंधान की निरंतरता को भुला दिया गया। केवल रसायन विज्ञान के इतिहासकारों ने ही रसायन विज्ञान के विकास के वास्तविक मौजूदा पैटर्न को फिर से बनाना शुरू किया। साथ ही, यह पाया गया कि लैवोज़ियर की "रासायनिक क्रांति" उनके सामने एक निश्चित स्तर के रासायनिक ज्ञान के अस्तित्व के बिना असंभव होती।
लवॉज़ियर ने एक नई प्रणाली के निर्माण के साथ रासायनिक ज्ञान के विकास का ताज पहनाया, जिसमें पिछली शताब्दियों की रसायन विज्ञान की सबसे महत्वपूर्ण उपलब्धियाँ शामिल थीं। हालाँकि, यह प्रणाली, काफी विस्तारित और संशोधित रूप में, वैज्ञानिक रसायन विज्ञान का आधार बन गई।
सबसे पहले, लवॉज़ियर ने तत्व की पुरानी अवधारणाओं को नई अवधारणाओं से प्रतिस्थापित किया। लावोइसियर के समय तक प्रायोगिक और व्यावहारिक रसायन विज्ञान में प्रगति ने अरस्तू और कीमियागरों के काल्पनिक तत्वों को त्यागना संभव बना दिया था। लेवॉज़ियर के कार्य के बाद, एक तत्व को ऐसा पदार्थ कहा जाने लगा जिसे किसी भी रासायनिक माध्यम से और अधिक विघटित नहीं किया जा सकता था। यह परिभाषा बहुत सख्त नहीं होनी चाहिए. आख़िरकार, लेवोज़ियर को अभी तक यह नहीं पता था कि विशेष तरीकों और तरीकों की मदद से बाद में उन पदार्थों को अलग करना संभव होगा जो उस समय "अविभाज्य" थे। लैवॉज़ियर द्वारा प्रस्तावित एक तत्व की परिभाषा प्रगतिशील थी: इसने रसायनज्ञों को स्पष्ट मानदंड दिए, लेकिन तत्वों के अध्ययन के लिए विभिन्न तरीकों के उपयोग पर सख्त सीमाएं नहीं लगाईं। रसायन विज्ञान के विकास के लिए लावोइसिए की परिभाषा अत्यंत उपयोगी रही। इसने सभी उपलब्ध तरीकों से पदार्थों को विघटित करने के प्रयासों को प्रेरित किया। इस प्रकार 19वीं शताब्दी के पूर्वार्ध में अधिकांश रासायनिक तत्वों की खोज की गई।
आधारशिला अवधारणा - रासायनिक तत्व - में बदलाव के साथ नई रासायनिक प्रणाली को नई शब्दावली की भी आवश्यकता थी, जिसमें पदार्थों के नाम सरल और अधिक समझने योग्य होंगे। इसके अलावा, विभिन्न पदार्थों के पहले से मौजूद नाम, उनके रासायनिक सार को प्रतिबिंबित किए बिना, इतने जटिल और समझने में कठिन थे कि उन्हें जल्दी ही भुला दिया गया। 1787 में, लेवोज़ियर ने पेरिस में विज्ञान अकादमी में उस विशेष आयोग के काम के परिणामों की घोषणा की, जिसके नेतृत्व में उन्होंने एक नया रासायनिक नामकरण तैयार किया था। आयोग के सदस्यों - फ्रांस के प्रमुख रसायनज्ञों - गुइटन डी मोरव्यू, बर्थोलेट और फोरक्रोइक्स ने रासायनिक तत्वों को नए नाम दिए और उनकी संरचना में शामिल तत्वों के नामों को ध्यान में रखते हुए जटिल निकायों के नाम लिखने का प्रस्ताव रखा। तब से, तत्वों को ऐसे पदार्थ कहा जाने लगा है जिन्हें रासायनिक विश्लेषण द्वारा भागों में अलग नहीं किया जा सकता है, उदाहरण के लिए, धातु, फास्फोरस, सल्फर, ऑक्सीजन और हाइड्रोजन। दो या दो से अधिक तत्वों से युक्त सभी पदार्थों को यौगिक माना जाता था।
तत्वों के नाम इस प्रकार चुने गए कि वे किसी दिए गए पदार्थ की प्रतिक्रिया की विशेषताओं को प्रतिबिंबित करें। तो, वह तत्व जॉन प्रीस्टले"डिफ्लॉजिस्टिकेटेड एयर" माना जाता है, शीले - "उग्र वायु", और लावोइसियर - "महत्वपूर्ण वायु", नए नामकरण के अनुसार ऑक्सीजन (ओहुडेप) कहा जाने लगा, क्योंकि दहन के बाद इस गैस ने कई पदार्थों को "एसिड" में बदल दिया। "दहनशील वायु" को हाइड्रोजन कहा जाता था क्योंकि जब यह ऑक्सीजन में जलती थी तो पानी बनता था। आयोग के निर्णय के अनुसार, "दम घोंटने वाली हवा" को नाइट्रोजन ("दम घोंटने वाला पदार्थ") कहा जाने लगा क्योंकि यह गैस दहन और श्वसन को "अवरुद्ध" कर देती थी।
अम्लों को उनके नाम उन तत्वों के आधार पर मिलते हैं जिनसे वे बने हैं। इसलिए, एसिड में से एक, जिसमें सल्फर भी शामिल था, अब "विट्रियल का तेल" नहीं, बल्कि सल्फ्यूरिक एसिड कहा जाता था। आयोग ने फॉस्फोरस युक्त एसिड को फॉस्फोरिक एसिड कहने का निर्णय लिया; एक अम्ल जिसमें कार्बन-कार्बोनिक अम्ल होता है।
नई शब्दावली प्रगतिशील थी क्योंकि यौगिकों के नाम उनकी संरचना को दर्शाते थे। इससे नवीनतम प्रायोगिक अनुसंधान डेटा को ध्यान में रखते हुए, पदार्थों के व्यवस्थितकरण में काफी सुविधा हुई।
लेवोज़ियर ने रसायन विज्ञान में एक क्रांतिकारी क्रांति की। लेकिन 18वीं सदी के सभी रसायनशास्त्री इसे समझ नहीं पाए। जॉन प्रीस्टले, शीले और कैवेंडिश, जिन्होंने स्वयं इस "क्रांतिकारी तख्तापलट" की तैयारी में इतना महत्वपूर्ण योगदान दिया, फ्लॉजिस्टन सिद्धांत के अनुयायी बने रहे। उन्होंने अपनी खोजों को पुराने सिद्धांतों के आलोक में समझाने की कोशिश की। केवल लवॉज़ियर ही इन घटनाओं पर पूरी तरह से अलग-अलग दृष्टिकोण से विचार करने में कामयाब रहे। ग्रेन जैसे कुछ रसायनज्ञों ने दोनों प्रणालियों को एक साथ जोड़ने का प्रयास किया। हालाँकि, लगभग दो दशकों के बाद, लावोज़ियर का ऑक्सीजन सिद्धांत आम तौर पर स्वीकृत हो गया। 19वीं सदी की शुरुआत में. ऐसे रसायनज्ञों को ढूंढना मुश्किल था जो अपने काम में "भाषा" और फ्लॉजिस्टन सिद्धांत की अवधारणाओं का उपयोग करेंगे।
नए सिद्धांत के प्रावधानों, नई अवधारणाओं और उन्हें निरूपित करने वाले शब्दों के व्यापक उपयोग ने रसायनज्ञों द्वारा वेन्ज़ेल और रिक्टर (फ्लॉजिस्टन सिद्धांत के शासनकाल के दौरान किए गए) के प्रयोगात्मक अध्ययनों के परिणामों की व्याख्या और समझ की सुविधा प्रदान की।
लगभग उसी समय, रसायन विज्ञान में एक और महत्वपूर्ण समस्या हल हो गई: यह दिखाया गया कि कैसे और किस मात्रात्मक संबंध में तत्व एक दूसरे के साथ संयुक्त होते हैं। प्राउस्ट ने पदार्थों की संरचना की स्थिरता के नियम की खोज की: रासायनिक तत्व निश्चित (स्थिर) वजन अनुपात में एक दूसरे के साथ जुड़ते हैं। उसी समय, जॉन डाल्टन ने एकाधिक अनुपात के कानून की खोज की: दो तत्वों के वजन अनुपात जो अलग-अलग यौगिक बनाते हैं (उदाहरण के लिए, सी और ओ सीओ या सीओ 2 बनाते हैं) में सरल पूर्णांक 1: 1, 1 का रूप होता है : 2, 1:3 और आदि। व्यवहार में इस कानून के निष्कर्षों का व्यापक रूप से उपयोग करते हुए, 19वीं शताब्दी की शुरुआत में डाल्टन। एक नया परमाणु सिद्धांत (रासायनिक परमाणुवाद) बनाया, और जैकब बर्ज़ेलियस ने थोड़ी देर बाद सापेक्ष परमाणु भार [परमाणु द्रव्यमान] निर्धारित किया और तत्वों और उनके यौगिकों के लिए पदनाम प्रस्तावित किए, जो आज तक लगभग पूरी तरह से संरक्षित हैं। इस प्रकार, शास्त्रीय रसायन विज्ञान के सबसे महत्वपूर्ण सिद्धांतों का निर्माण किया गया।
परिणामस्वरूप, 19वीं सदी की शुरुआत में। ज्ञान और उत्पादन गतिविधि के अन्य क्षेत्रों में रसायन विज्ञान का स्थान भी बदल गया है। रसायन विज्ञान एक पूरी तरह से स्वतंत्र वैज्ञानिक अनुशासन बन गया, जिसने 19वीं-20वीं शताब्दी की औद्योगिक क्रांति में तेजी से महत्वपूर्ण भूमिका निभाई।
रासायनिक क्रांति
फ्रांसीसी बुर्जुआ क्रांति और विज्ञान
फ्लॉजिस्टन सिद्धांत को उखाड़ फेंकने से जुड़ी रसायन विज्ञान में क्रांति फ्रांसीसी बुर्जुआ क्रांति के साथ मेल खाती है। निःसंदेह, इस तथ्य को आकस्मिक नहीं माना जा सकता। रासायनिक क्रांति काफी हद तक सामाजिक-आर्थिक परिवर्तनों और समाज के मानसिक जीवन में बदलाव का परिणाम थी। एफ. एंगेल्स ने इन घटनाओं को निम्नलिखित शब्दों में वर्णित किया: “फ्रांस में जिन महान लोगों ने आसन्न क्रांति के लिए अपने सिर को प्रबुद्ध किया, उन्होंने स्वयं अत्यंत क्रांतिकारी कार्य किया। वे किसी भी प्रकार के किसी बाहरी अधिकारी को नहीं पहचानते थे। धर्म, प्रकृति की समझ, समाज, राजनीतिक व्यवस्था - यह सब सबसे निर्दयी आलोचना के अधीन था; हर चीज़ को तर्क की अदालत के सामने पेश होना था और या तो अपने अस्तित्व को सही ठहराना था या इसे छोड़ देना था... समाज और राज्य के सभी पिछले रूपों, सभी पारंपरिक विचारों को अनुचित माना गया और पुराने कूड़े की तरह त्याग दिया गया; दुनिया अब तक केवल पूर्वाग्रहों द्वारा निर्देशित रही है, और संपूर्ण अतीत केवल खेद और तिरस्कार के योग्य है।
रासायनिक क्रांति भी विज्ञान में, मुख्य रूप से रसायन विज्ञान और भौतिकी में गहन परिवर्तनों का हिस्सा थी।
कई फ्रांसीसी वैज्ञानिकों ने क्रांति के दौरान सामाजिक और राजनीतिक गतिविधियों में प्रत्यक्ष भाग लिया (जी. मोंगे, एल. कार्नोट, एफ. फोरक्रोइक्स, आदि)। उनके प्रस्तावों के अनुसार, देश में शिक्षा का पूर्ण सुधार किया गया। पूर्व-क्रांतिकारी फ़्रांस के विश्वविद्यालय पूरी तरह से कैथोलिक पादरी के प्रभाव में थे, वे एक पुरानी प्रणाली के अनुसार पढ़ाते थे। विश्वविद्यालयों और देश के उद्योग के बीच कोई संबंध नहीं थे। पेरिस एकेडमी ऑफ साइंसेज और अन्य वैज्ञानिक संस्थान भी वस्तुतः जीवन से अलग हो गए थे। वैज्ञानिकों के प्रस्तावों के परिणामस्वरूप, 1793 में कन्वेंशन ने उच्च शिक्षा के आयोजन की एक नई प्रणाली को मंजूरी दी। 1794 में शिक्षण की कला सिखाने के लिए नॉर्मल स्कूल की स्थापना की गई और सिविल इंजीनियरों को प्रशिक्षित करने के लिए पॉलिटेक्निक स्कूल खोला गया। अन्य विशेष शैक्षणिक संस्थाएँ भी उभरीं। पुराने रॉयल बॉटैनिकल गार्डन को प्राकृतिक इतिहास संग्रहालय में बदल दिया गया है। विज्ञान और शिल्प की राष्ट्रीय संरक्षिका (भंडार) की स्थापना की गई। इन सभी उपायों का उद्देश्य विज्ञान और शिक्षा को जीवन और उत्पादन की माँगों के करीब लाना था।
बुर्जुआ क्रांति का युग फ्रांस में विज्ञान के उत्कर्ष द्वारा चिह्नित किया गया था। 18वीं सदी के अंत में. फ़्रांस में आगे बढ़े
कई प्रतिभाशाली वैज्ञानिक (जे. लैग्रेंज, जी. मोंगे, एन. कार्नोट, पी. लाप्लास) और उत्कृष्ट रसायनज्ञों और जीवविज्ञानियों की एक आकाशगंगा।
ए. एल. लावोइसिएर
फ्रांसीसी बुर्जुआ क्रांति के युग में रसायन विज्ञान के विकास में सबसे प्रमुख भूमिका ए.एल. लावोइसियर की थी। इस वैज्ञानिक की उत्कृष्ट वैज्ञानिक गतिविधि को बड़े पूंजीपति वर्ग के विशिष्ट संदिग्ध वित्तीय लेनदेन के साथ जोड़ा गया था। ए. लवॉज़ियर के सामाजिक-राजनीतिक विचारों को उनके नवीन वैज्ञानिक कार्यों के साथ उन्नत और सुसंगत नहीं कहा जा सकता है।
एंटोनी लॉरेंट लैवॉज़ियर का जन्म 26 अगस्त, 1743 को हुआ था। उन्होंने कानून की डिग्री प्राप्त की, लेकिन प्राकृतिक विज्ञान, विशेष रूप से रसायन विज्ञान में रुचि रखते थे, और साहित्य का भी अध्ययन किया। विश्वविद्यालय से स्नातक होने के बाद, ए. लावोज़ियर ने अपना कानूनी करियर छोड़ दिया और अपना ध्यान प्राकृतिक विज्ञान के क्षेत्र में काम पर केंद्रित किया। उन्होंने कई खनिज संबंधी यात्राएँ कीं, जिसके दौरान उनकी रुचि कई खनिजों और पीने के पानी की रासायनिक संरचना में हुई।
1764 में, ए. लवॉज़ियर ने स्ट्रीट लाइटिंग की सर्वोत्तम विधि के लिए पेरिस अकादमी द्वारा घोषित एक प्रतियोगिता में भाग लिया। नए प्रकार के लैंप विकसित करते समय, उन्होंने बहुत दृढ़ता दिखाई और स्वर्ण पदक प्राप्त किया। 1768 में, ए. लवॉज़ियर को विज्ञान अकादमी का सहायक चुना गया और साथ ही वह आबादी से करों के संग्रह में शेयरधारक बन गए। भारी मुनाफा प्राप्त करके, फार्म-आउट के शेयरधारक लोगों की सामान्य नफरत से घिरे हुए थे। 1771 में उन्होंने एक धनी कर किसान, अन्ना मारिया पोल्ज़ की बेटी से शादी की।
1775 में, ए. लवॉज़ियर को फ़्रांस में बारूद और साल्टपीटर व्यवसाय का प्रबंधक नियुक्त किया गया था। वह आर्सेनल चले गए और अपने खर्च पर एक अच्छी तरह से सुसज्जित प्रयोगशाला स्थापित की। यहां 15 वर्षों तक उन्होंने गहन प्रायोगिक अनुसंधान किया और लगातार विभिन्न वैज्ञानिक आयोगों में भाग लिया।
1789 में शुरू हुई क्रांति ने ए. लवॉज़ियर को उससे दूर कर दिया
रसायन विज्ञान में वैज्ञानिक कार्य. क्रांति के पहले वर्षों में, उन्होंने आर्थिक समस्याओं से निपटा, वजन और माप पर आयोग के सदस्य, राष्ट्रीय खजाने के आयुक्त आदि थे। उन्होंने जल्द ही क्रांति के प्रति नकारात्मक रवैया रखना शुरू कर दिया।
1792 में, राजघरानों के साथ संबंधों के कारण, उन्हें बारूद व्यवसाय के प्रबंधक के पद से मुक्त कर दिया गया। मार्च 1792 में, नेशनल असेंबली के डिक्री द्वारा, खेती को समाप्त कर दिया गया। अगस्त 1793 में, विज्ञान अकादमी को बंद कर दिया गया, और उसी वर्ष अक्टूबर में, कन्वेंशन ने पूर्व कर किसानों को गिरफ्तार करने का निर्णय लिया। जांच के बाद, क्रांतिकारी न्यायाधिकरण द्वारा ए. लावोइसियर सहित 28 पूर्व कर किसानों को मौत की सजा सुनाई गई। 8 मई, 1794 को लावोइसियर को दोषी ठहराया गया।
कुछ वैज्ञानिकों (जे. प्रीस्टली, एस. ब्लागडेन, जे. वाट, आदि) ने उनकी कई प्रमुख खोजों की प्राथमिकता पर विवाद किया। हालाँकि, यह ध्यान दिया जाना चाहिए कि लावोज़ियर के नाम को लेकर चल रही बहस का अर्थ बुर्जुआ-राष्ट्रवादी है।
दहन का ऑक्सीजन सिद्धांत
ए लावोइसियर के पहले प्रकाशनों में से एक संस्मरण "ऑन द नेचर ऑफ वॉटर" (1769) था। यह काम पानी को ज़मीन में बदलने की संभावना के सवाल पर समर्पित था। 101 दिनों तक, ए. लावोइसियर ने एक कांच के पेलिकन बर्तन में पानी गर्म किया और (के. शीले की तरह) पानी में भूरी धरती की पत्तियों के निर्माण की खोज की। के. शीले के विपरीत, ए. लवॉज़ियर ने इस धरती का रासायनिक विश्लेषण नहीं किया, लेकिन बर्तन और सूखे पत्तों का वजन करके उन्होंने स्थापित किया कि वे कांच के विघटन के परिणामस्वरूप प्राप्त हुए थे।
इस प्रकार उस प्रश्न को हल करने के बाद जो उस समय वैज्ञानिकों के मन में था, ए. लवॉज़ियर ने "हवा की प्रकृति पर" अध्ययन की रूपरेखा तैयार की। विभिन्न रासायनिक प्रक्रियाओं में हवा के अवशोषण पर डेटा का अध्ययन और विश्लेषण करने के बाद, उन्होंने एक व्यापक शोध योजना तैयार की: "वे ऑपरेशन जिनके माध्यम से," उन्होंने लिखा, "हवा के बंधन को प्राप्त करना संभव है, वे हैं: पौधे की वृद्धि, पशु श्वसन, कुछ परिस्थितियों में - भूनना, और अंत में, कुछ (अन्य) रासायनिक प्रतिक्रियाएँ। मैंने स्वीकार किया कि मुझे इन प्रयोगों से शुरुआत करनी होगी।"
1772 के उत्तरार्ध में, ए. लावोइसियर पहले से ही विभिन्न पदार्थों, मुख्य रूप से फास्फोरस, के दहन में प्रयोगों में व्यस्त थे। उन्होंने पाया कि फॉस्फोरस के पूर्ण दहन के लिए बड़ी मात्रा में हवा की आवश्यकता होती है। इस तथ्य के लिए उन्होंने जो स्पष्टीकरण दिया वह भी दार्शनिक था। हालाँकि, उन्होंने जल्द ही विज्ञान अकादमी को एक संस्मरण प्रस्तुत किया जिसमें उन्होंने लिखा: "... मैंने पाया कि दहन के दौरान सल्फर का वजन बिल्कुल भी कम नहीं होता है, बल्कि, इसके विपरीत, बढ़ जाता है, यानी। 1 पाउंड सल्फर से आप कर सकते हैं 1 पाउंड से अधिक विट्रियल प्राप्त करें... फॉस्फोरस के बारे में भी यही कहा जा सकता है;
यह वृद्धि दहन के दौरान बंधी हवा की भारी मात्रा के कारण होती है”1। इसके अलावा, ए. लवॉज़ियर का सुझाव है कि कैल्सीनेशन के दौरान धातुओं के द्रव्यमान में वृद्धि को हवा के अवशोषण द्वारा भी समझाया गया है।
अगले वर्ष, ए. लवॉज़ियर ने धातुओं के कैल्सीनेशन पर शोध शुरू किया। वह दहन प्रक्रियाओं में हवा के अवशोषण पर आगे के प्रयोगों पर भी रिपोर्ट करता है और हवा में निहित पदार्थ और दहन प्रक्रिया के दौरान जलने वाले पदार्थों से जुड़े पदार्थों के बारे में बोलता है (अभी तक स्पष्ट रूप में नहीं)। धातुओं के कैल्सीनेशन पर प्रयोगों का वर्णन करते हुए, ए. लवॉज़ियर ने इस तथ्य की पुष्टि की कि इस प्रक्रिया के दौरान हवा को अवशोषित किया गया था।
दहन प्रक्रियाओं और विभिन्न पदार्थों पर उच्च तापमान के प्रभाव के व्यापक अध्ययन के लिए, ए. लावोइसियर ने दो बड़े लेंसों के साथ एक बड़ी आग लगाने वाली मशीन बनाई, जिसकी मदद से उन्होंने हीरे जलाए। इन सभी अध्ययनों के परिणाम फ्लॉजिस्टन सिद्धांत के बिल्कुल विपरीत थे। ए. लवॉज़ियर को अपने निष्कर्ष तैयार करने में बेहद सावधानी बरतनी पड़ी। लेकिन उन्होंने योजना के अनुसार काम करना जारी रखा, और फ्लॉजिस्टन सिद्धांत की पूर्ण निराधारता के प्रति अधिक आश्वस्त हो गए। 1774 में ए. लावॉज़ियर ने इस सिद्धांत पर सीधा हमला किया। विभिन्न पदार्थों को जलाने पर अपने प्रयोगों के परिणामों का विश्लेषण करते हुए, वह जल्द ही इस निष्कर्ष पर पहुंचे कि हवा एक साधारण शरीर नहीं है, जैसा कि 18 वीं शताब्दी के वैज्ञानिकों ने सोचा था, बल्कि विभिन्न गुणों वाली गैसों का मिश्रण है। मिश्रण के एक भाग ने दहन का समर्थन किया। अनुभवजन्य रूप से, ए. लवॉज़ियर ने इस धारणा को खारिज कर दिया कि यह ब्लैक की "स्थिर हवा" है, इसके विपरीत, उन्होंने तर्क दिया कि यह हिस्सा "सांस लेने के लिए सबसे सुविधाजनक" है;
इस समय (70 के दशक में), ऑक्सीजन की खोज "हवा में" थी और अपरिहार्य हो गई थी। दरअसल, के. शीले ने 1772 में और जे. प्रीस्टली ने 1774 में ऑक्सीजन की खोज की थी। ए. लवॉज़ियर तुरंत ऑक्सीजन की खोज में नहीं आए। "चूने" के निर्माण के साथ धातुओं के कैल्सीनेशन का अध्ययन करते हुए, उनका मानना था कि हवा का "सबसे अधिक सांस लेने योग्य" भाग धात्विक "चूने" से प्राप्त किया जा सकता है, अर्थात, किसी भी धातु के ऑक्साइड से। हालाँकि, उनके प्रयास असफल रहे, और केवल नवंबर 1774 में (जे. प्रीस्टली के साथ एक बैठक के बाद) उन्होंने पारा ऑक्साइड के साथ प्रयोग करना शुरू कर दिया।
ए. लवॉज़ियर ने इन प्रयोगों को दो तरह से किया। उन्होंने कोयले के साथ मर्क्यूरिक ऑक्साइड को शांत किया और ब्लैक की "स्थिर हवा" प्राप्त की, और मर्क्यूरिक ऑक्साइड को भी गर्म किया। परिणामी गैस, उनकी राय में, हवा का सबसे शुद्ध हिस्सा थी। ए. लवॉज़ियर भी इस निष्कर्ष पर पहुंचे कि "स्थिर वायु" कोयले के साथ "स्वच्छ" वायु का एक संयोजन है। अकादमी को अपनी रिपोर्ट में उन्होंने "सबसे शुद्ध" कहा
हवा का हिस्सा" भी "बहुत सांस लेने योग्य" या "जीवन देने वाली हवा" है।
ए लावोइसियर ने अपने संस्मरण "एक्सपेरिमेंट्स ऑन एनिमल ब्रीदिंग" में महत्वपूर्ण निष्कर्ष तैयार किए थे: 1. सांस लेते समय, वायुमंडलीय हवा के शुद्ध "सांस लेने के लिए सबसे उपयुक्त" हिस्से के साथ ही बातचीत होती है। बाकी हवा सिर्फ एक निष्क्रिय माध्यम है जो सांस लेने के दौरान नहीं बदलती है। 2. धातुओं के कैल्सीनेशन के बाद रिटॉर्ट में बची हुई खराब हवा के गुण उस हवा के गुणों से भिन्न नहीं होते हैं जिसमें जानवर कुछ समय से रहा है।
1777 की शुरुआत में, ए. लवॉज़ियर ने फ्लॉजिस्टन के सिद्धांत का खुलकर विरोध किया। अपने एक संस्मरण में, उन्होंने लिखा: “रसायनज्ञों ने फ्लॉजिस्टन को एक अस्पष्ट सिद्धांत बना दिया है, जिसे सटीक रूप से परिभाषित नहीं किया गया है और इसलिए यह किसी भी स्पष्टीकरण के लिए उपयुक्त है जिसमें वे इसे पेश करना चाहते हैं। कभी-कभी यह शुरुआत महत्वपूर्ण होती है, कभी-कभी नहीं; कभी यह मुक्त अग्नि है, कभी यह पृथ्वी तत्व से संयुक्त अग्नि है; कभी-कभी यह वाहिकाओं के छिद्रों से होकर गुजरता है, कभी-कभी वे इसके लिए अभेद्य होते हैं। यह एक साथ क्षारीयता और तटस्थता, पारदर्शिता और अस्पष्टता, रंग और रंग की कमी की व्याख्या करता है; यह एक वास्तविक प्रोटियस है, जो हर पल अपना रूप बदलता है।"
यह दिलचस्प है कि ए. लावोइसियर के ये शब्द एम.वी. लोमोनोसोव के शब्दों की याद दिलाते हैं, जिन्होंने 1744 में "उग्र पदार्थ" के बारे में लिखा था, जो या तो शरीर के छिद्रों में प्रवेश करता है, "... मानो किसी प्रकार की प्रेम भावना से आकर्षित हो , फिर हिंसक तरीके से उन्हें छोड़ देता है, जैसे कि आतंक से उबर गया हो"1 2.
अपने संस्मरण "ऑन कम्बशन इन जनरल" (1777) में, ए. लवॉज़ियर ने दहन घटना का निम्नलिखित विवरण दिया: "1. किसी भी दहन के साथ, "उग्र पदार्थ" या प्रकाश निकलता है। 2. पिंड बहुत कम प्रकार की वायु में ही जल सकते हैं, या यूँ कहें कि दहन केवल एक ही प्रकार की वायु में हो सकता है, जिसे प्रीस्टले ने फ्लॉजिस्टन रहित कहा है और जिसे मैं "शुद्ध" वायु कहूँगा। जिन पिंडों को हम दहनशील कहते हैं, वे न केवल खालीपन या किसी अन्य हवा में नहीं जलते, बल्कि वहां वे उतनी ही तेजी से बाहर निकल जाते हैं, जैसे कि उन्हें पानी में डुबोया गया हो... 3. किसी भी दहन के साथ, "शुद्ध" का विनाश या अपघटन होता है। » हवा, और जले हुए शरीर का वजन बिल्कुल अवशोषित हवा की मात्रा से बढ़ता है। 4. किसी भी दहन के साथ, जलता हुआ शरीर एसिड में बदल जाता है... इसलिए, यदि आप सल्फर को घंटी के नीचे जलाते हैं, तो दहन का उत्पाद सल्फ्यूरिक एसिड होगा... "3.
बाद की स्थिति के आधार पर, ए. लवॉज़ियर एसिड का एक सिद्धांत बनाते हैं जो एसिड के संयोजन से बनते हैं
ज्वलनशील पदार्थों से शुरुआत। इसके संबंध में, उन्होंने इस एसिड बनाने वाले सिद्धांत को "ऑक्सीजन" (एसिड या ऑक्सीजन का उत्पादन) नाम दिया। एसिड के बारे में ए. लावोइसियर का सिद्धांत कई ज्ञात तथ्यों से असंगत निकला। इस प्रकार, हाइड्रोक्लोरिक एसिड ऑक्सीजन की भागीदारी के बिना बनता है। इस मामले में ए. लवॉज़ियर को इस एसिड की संरचना को समझाने के लिए कल्पना का सहारा लेने के लिए मजबूर होना पड़ा। उन्होंने स्वीकार किया कि हाइड्रोक्लोरिक एसिड में एक विशेष सरल शरीर - म्यूरियम - होता है जो एसिड में ऑक्सीकृत अवस्था में होता है। इसलिए, हाल तक, फार्मासिस्टों द्वारा हाइड्रोक्लोरिक एसिड को म्यूरिक एसिड कहा जाता था।
हाइड्रोजन के दहन के दौरान पानी के निर्माण का तथ्य भी लेवोज़ियर के एसिड के सिद्धांत का खंडन करता है। कई वर्षों तक, लैवोज़ियर ने पानी में एसिड के निशान का पता लगाने की असफल कोशिश की। साथ ही, उन्होंने पानी में हाइड्रोजन और ऑक्सीजन का आयतन अनुपात (12:22.9, यानी लगभग 1:2) भी स्थापित किया। हालाँकि, उन्होंने इस परिणाम को कोई महत्व नहीं दिया। पानी के अपघटन के दौरान, उन्होंने लोहे के बुरादे से पानी पर क्रिया की और हाइड्रोजन प्राप्त किया। ये अध्ययन फ्लॉजिस्टन सिद्धांत को उखाड़ फेंकने के लिए डिज़ाइन किए गए प्रयोगों की एक नियोजित श्रृंखला में अंतिम थे।
बता दें कि कुछ वैज्ञानिकों द्वारा ए लावोइसियर की खोजों को प्राथमिकता देने के दावे निराधार निकले। वास्तव में, ऑक्सीजन की खोज अनिवार्य रूप से ए. लावोइसियर की है, न कि के. शीले और जे. प्रीस्टली की, जो एफ. एंगेल्स के शब्दों में, "फ़्लॉजिस्टिक श्रेणियों के बंदी" बने रहे और उन्हें समझ नहीं आया कि उन्होंने वास्तव में क्या खोजा था। . "और भले ही," एंगेल्स ने आगे लिखा, "ए. लावोइसियर ने ऑक्सीजन का विवरण नहीं दिया, जैसा कि उन्होंने बाद में दावा किया, दूसरों के साथ-साथ और उनसे स्वतंत्र रूप से, फिर भी, संक्षेप में, उन्होंने ऑक्सीजन की खोज की, न कि उन दोनों की, जिन्होंने केवल इसका वर्णन किया, बिना यह जाने कि वे वास्तव में क्या वर्णन कर रहे थे"
रसायन विज्ञान लेवोज़ियर का प्राथमिक पाठ्यक्रम
दहन और श्वसन के एंटीफ्लॉजिस्टिक ऑक्सीजन सिद्धांत की नींव विकसित करने की प्रक्रिया में, ए. लावोइसियर के पास अपने नए विचारों के आलोचकों की कोई कमी नहीं थी। इस आलोचना के सिलसिले में उन्हें नए प्रयोग करने पड़े, नए सामान्यीकरण व्यक्त करने पड़े और चरण दर चरण सामने रखी गई आपत्तियों की असंगति सिद्ध करनी पड़ी। साथ ही, उन्होंने विभिन्न मुद्दों का समाधान किया जो सीधे तौर पर इच्छित अनुसंधान योजना से संबंधित नहीं थे। इस प्रकार, उन्हें धातु पर तनु अम्लों की क्रिया के तहत हाइड्रोजन निर्माण की क्रियाविधि के प्रश्न पर जी. कैवेंडिश के स्पष्टीकरण का खंडन करना पड़ा। ए लावोइसियर ने बताया कि इस मामले में हाइड्रोजन धातु के अपघटन के परिणामस्वरूप नहीं, बल्कि एसिड को पतला करने वाले पानी के अपघटन के परिणामस्वरूप जारी होता है (उस समय एसिड ऑक्साइड को एसिड माना जाता था)।
दहन परिघटनाओं की व्याख्या करने में जिन मुद्दों पर विवाद हुआ उनमें ताप की प्रकृति का प्रश्न भी शामिल था। ए. लावोइसियर गर्मी के गतिज सिद्धांत से अच्छी तरह परिचित थे, लेकिन वह परमाणुविज्ञानी नहीं थे और इसलिए एम.वी. लोमोनोसोव के विपरीत, कैलोरी पदार्थ की स्थिति में बने रहे। साथ ही, उन्होंने कैलोरी को प्राथमिक तरल पदार्थों में से एक माना, और इस प्रकार, इस मुद्दे पर उनकी स्थिति रूढ़िवादी फ्लॉजिस्टिक्स की स्थिति के साथ मेल खाती थी।
ए. लावोइसियर को प्रतिक्रियाओं के थर्मल प्रभावों के अग्रणी होने का श्रेय दिया जाता है। पी. लाप्लास के साथ मिलकर, उन्होंने एक कैलोरीमीटर डिज़ाइन किया और 15 वर्षों तक थर्मल प्रभावों को निर्धारित करने पर काम किया, जिससे थर्मोकैमिस्ट्री की नींव रखी गई। कार्बनिक पदार्थों की संरचना की विशेषताओं को स्थापित करने के लिए ए. लावोज़ियर भी श्रेय के पात्र हैं। विश्लेषण के आधार पर उन्होंने पाया कि कार्बनिक पदार्थों में कार्बन, हाइड्रोजन और ऑक्सीजन होते हैं। फिर नाइट्रोजन और फास्फोरस को इन सरल पिंडों में मिलाया गया।
लेवोज़ियर ने रसायन विज्ञान के सबसे महत्वपूर्ण सिद्धांतों में से एक पदार्थ की अविनाशीता के सिद्धांत को माना। ज्ञात है कि फ़्लोजिशियनों ने इस सिद्धांत को नज़रअंदाज़ कर दिया है, उदाहरण के लिए, धातुओं के द्रव्यमान एनपीएनएफ कैल्सीफिकेशन में वृद्धि की व्याख्या करते समय। इस सिद्धांत को तैयार करने के बाद, ए. लावोइसियर ने अंगूर के रस के किण्वन के परिणामस्वरूप अल्कोहल के निर्माण के उदाहरण से इसका वर्णन किया:
अंगूर का रस = कार्बोनिक एसिड + अल्कोहल।
1785 के आसपास, ए. लवॉज़ियर के मन में अपने द्वारा खोजे गए नए तथ्यों और ऑक्सीजन सिद्धांत के दृष्टिकोण से विभिन्न घटनाओं की व्याख्याओं को एक संक्षिप्त "रसायन विज्ञान के प्राथमिक पाठ्यक्रम" में व्यवस्थित रूप से प्रस्तुत करने का विचार आया। इस पाठ्यक्रम को तैयार करने में, उन्हें विशेष रूप से सिद्धांतों, या सरल पदार्थों के सिद्धांत के विकास, रासायनिक नामकरण के निर्माण और रसायन विज्ञान में नई समस्याओं के निर्माण से संबंधित कई मूलभूत मुद्दों पर शोध और समाधान करना पड़ा। ऑक्सीजन सिद्धांत के आधार पर उत्पन्न हुआ।
पाठ्यक्रम के लिए "प्रारंभिक प्रवचन" में, ए. लवॉज़ियर सरल निकायों के बारे में बोलते हैं: "तो, रसायन विज्ञान अपने लक्ष्य की ओर, अपनी पूर्णता की ओर, निकायों को विभाजित, उप-विभाजित और आगे उप-विभाजित करने की ओर बढ़ता है, और हम नहीं जानते कि इसकी सफलता की सीमा क्या है होगा। इसलिए हम यह दावा नहीं कर सकते कि जिसे आज सरल माना जाता है वह वास्तव में सरल है। हम केवल यह कह सकते हैं कि यह या वह पदार्थ केवल रासायनिक विश्लेषण द्वारा विभाज्यता की सीमा है और हमारे ज्ञान की वर्तमान स्थिति में इसे और अधिक विभाजित नहीं किया जा सकता है।
तत्वों के बारे में आगे बोलते हुए, ए. लावोइसियर इस अवधारणा की एक स्पष्ट परिभाषा नहीं देते हैं: “तो, मैं कहूंगा कि यदि तत्वों का नाम सरल या अविभाज्य अणुओं को दर्शाता है जो शरीर बनाते हैं, तो हम शायद उन्हें नहीं जानते हैं; यदि, इसके विपरीत, हम तत्वों या सिद्धांतों के नाम के साथ विश्लेषण द्वारा पहुंची अंतिम सीमा के विचार को जोड़ते हैं, तो वे सभी पदार्थ जिन्हें हम अभी तक किसी भी तरह से विघटित नहीं कर पाए हैं, वे हमारे लिए तत्व हैं।
यह परिभाषा मूलतः बॉयल से मेल खाती है।
एक और प्रश्न जो "रसायन विज्ञान के प्राथमिक पाठ्यक्रम" पर काम करते समय ए. लावोइसिए के सामने उठा, वह था रासायनिक नामकरण का विकास। रसायन विज्ञान काल में, जब प्रतीकवाद और पदार्थों के सामान्य नामों को एन्क्रिप्ट करने की इच्छा व्यापक थी, कई पदार्थों को अलग-अलग लेखकों से यादृच्छिक और अक्सर अलग-अलग नाम प्राप्त हुए। नए खोजे गए पदार्थों को यादृच्छिक नाम देने की परंपरा भविष्य में भी जारी रही। ऐसी परिस्थितियों में, रासायनिक नामकरण की कोई प्रणाली नहीं बनाई जा सकी।
18वीं सदी में यहां तक कि रसायनज्ञों और तर्कशास्त्रियों को भी रासायनिक नामकरण की एक प्रणाली बनाने की तत्काल आवश्यकता महसूस हुई, क्योंकि शताब्दी के उत्तरार्ध में ज्ञात पदार्थों की संख्या तेजी से बढ़ी। प्रमुख फ्लॉजिस्टिक रसायनज्ञों में से एक, गिटोन डी मोरव्यू (पृष्ठ 68) ने 1782 में फ्लॉजिस्टन के सिद्धांत के आधार पर रासायनिक नामकरण की एक प्रणाली विकसित करना शुरू किया। इसी समस्या से जूझ रहे ए. लावोइसिएर ने डी मोरव्यू को अपनी ओर आकर्षित करने के प्रयास किए, जिसमें उन्हें 1786 में सफलता मिली। कुछ समय पहले, उस समय के सबसे प्रमुख रसायनज्ञों में से एक, सी. एल. बर्थोलेट, ए. लावोइसिए के साथ शामिल हुए (पृष्ठ 68) ) , और उसके बाद - ए फोरक्रोइक्स।
इन वैज्ञानिकों के साथ गठबंधन में, ए. लवॉज़ियर ने पेरिस अकादमी के नामकरण आयोग का आयोजन किया, जिसने 1786 में काम शुरू किया। एक साल बाद, विकसित नामकरण प्रकाशित किया गया था। यह सरल निकायों के नामों पर आधारित था, जिनकी सूची (और वर्गीकरण) स्वयं ए. लावोइसियर द्वारा संकलित की गई थी। नए नामों में आयोग ने ऑक्सीजन (ऑक्सीजन), हाइड्रोजन (हाइड्रोजन) और नाइट्रोजन के नामों को मंजूरी दी। अंतिम नाम, अंतर्राष्ट्रीय "नाइट्रोजेनियम" से भिन्न, ए. लवॉज़ियर द्वारा प्रस्तावित किया गया था और इस तथ्य के बावजूद स्वीकार किया गया था कि
"रसायन विज्ञान के प्राथमिक पाठ्यक्रम" के परिचय में ए. लवॉज़ियर ने लिखा: "रसायन विज्ञान के प्रारंभिक पाठ्यक्रम में निकायों के घटक और प्राथमिक भागों पर एक अध्याय की अनुपस्थिति अनिवार्य रूप से आश्चर्य का कारण बनेगी, लेकिन मैं खुद को यहां नोट करने की अनुमति दूंगा प्रकृति के सभी पिंडों को केवल तीन या चार तत्वों से युक्त मानने की इच्छा ग्रीक दार्शनिकों से हमें मिले पूर्वाग्रह से आती है।"
निकायों के प्राथमिक घटकों के मुद्दे को हल करने के लिए, ए. लावोइसियर के पास आवश्यक तथ्यात्मक डेटा नहीं था और उन्हें मुख्य रूप से अपने स्वयं के शोध के परिणामों पर भरोसा करने के लिए मजबूर होना पड़ा। शायद इसीलिए उनके विचार अस्पष्ट और असंगत हैं।
आयोग के सदस्यों ने इसे असफल माना और "नाइट्रोजन" नाम सुझाया। "नाइट्रोजन", "क्षारजन"। ए लावोइसियर के प्रस्ताव के अनुसार, "नाइट्रोजन" शब्द का अनुवाद "बेजान" शब्द से किया गया है। हालाँकि, यह अनुवाद गलत है। वास्तव में, शब्द "नाइट्रोजन", जो ग्रीक भाषा में मौजूद नहीं है, अलकेमिकल शब्दकोष से लिया गया है, जहां इसका अर्थ "दार्शनिक पारा" था।
जटिल पदार्थों (अम्ल, क्षार, लवण, आदि) के नाम सरल पिंडों के व्युत्पन्न के रूप में स्थापित किए गए थे। एसिड बनाने वाले तत्व (सल्फेट, सल्फाइट, सल्फाइड, आदि) के ऑक्सीकरण की डिग्री के आधार पर एसिड और लवण के नाम (अंत में) संशोधित किए गए थे। नाइट्रिक एसिड के लवण, तत्व के नाम के विपरीत, नाइट्रेट कहलाते थे।
नए नामकरण के संबंध में, ए. लावोइसियर के "एलिमेंट्री कोर्स" में एसिड बनाने वाले तत्वों की ऑक्सीकरण अवस्था के अनुसार एसिड, लवण और अन्य यौगिकों की वर्गीकरण तालिकाएँ शामिल हैं। "रासायनिक नामकरण" के परिशिष्ट में रसायनज्ञ पी. ए. एडे (1763-1834) और जे. ए. गैसेंफ्रैट्ज़ (1755-1827) द्वारा प्रस्तावित सरल निकायों के प्रतीक शामिल हैं, जिन्हें, हालांकि, मान्यता नहीं मिली।
जहाँ तक सरलतम निकायों की बात है, "प्राथमिक पाठ्यक्रम" में ए. लवॉज़ियर ने निम्नलिखित चार समूहों पर प्रकाश डालते हुए उनकी एक सूची दी: ,
1. सरल पदार्थ, प्रकृति के तीनों साम्राज्यों में प्रतिनिधित्व करते हैं, जिन्हें शरीर के तत्व माना जा सकता है: प्रकाश, कैलोरी, ऑक्सीजन, नाइट्रोजन और हाइड्रोजन।
2. सरल गैर-धात्विक पदार्थ जो ऑक्सीकरण करते हैं और एसिड का उत्पादन करते हैं: सल्फर, फास्फोरस, कोयला, म्यूरिक एसिड रेडिकल, हाइड्रोफ्लोरिक एसिड रेडिकल, बोरिक एसिड रेडिकल।
3. सरल धात्विक पदार्थ जो ऑक्सीकृत होते हैं और अम्ल उत्पन्न करते हैं: सुरमा, चांदी, आर्सेनिक, बिस्मथ, कोबाल्ट, तांबा, टिन, लोहा, मैंगनीज, पारा, मोलिब्डेनम, निकल, सोना, प्लैटिनम, सीसा, टंगस्टन, जस्ता।
4. सरल पदार्थ, नमक बनाने वाले और मिट्टी वाले: चूना, मैग्नीशिया, बैराइट, एल्यूमिना, सिलिका।
इस तालिका के एक नोट में, ए. लावोइसियर ने उल्लेख किया कि उन्होंने सरल पदार्थों की सूची में "स्थायी" (कास्टिक) क्षार को शामिल नहीं किया है, क्योंकि इन पदार्थों में स्पष्ट रूप से एक जटिल संरचना होती है।
ए. लेवॉज़ियर की तालिका में 23 सरल पिंड, 3 मूलक, 2 अम्ल, 5 पृथ्वियां और 2 भारहीन तरल पदार्थ हैं। तालिका के नाम में
स्पष्ट विसंगतियाँ हैं। भारहीन तरल पदार्थों की शुरूआत के अलावा, इसमें "पृथ्वी" सरल पदार्थों के रूप में दिखाई देती है और अंत में, धातुओं को एसिड के सामान्य सिद्धांत के अनुसार एसिड बनाने वाले तत्वों के रूप में वर्गीकृत किया जाता है। यह तालिका विज्ञान के इतिहास में सरल पिंडों को वर्गीकृत करने का पहला प्रयास था।
ए. लावोइसियर द्वारा "रसायन विज्ञान का प्राथमिक पाठ्यक्रम" उनकी पत्नी (एम. लावोइसियर) द्वारा खूबसूरती से निष्पादित चित्रों के साथ 1789 में दिखाई दिया, लगभग फ्रांसीसी बुर्जुआ क्रांति की शुरुआत के साथ। इस पाठ्यक्रम की उपस्थिति ने वास्तव में रासायनिक क्रांति को चिह्नित किया, जैसा कि ए. लावोइसियर ने स्वयं पाठ्यक्रम में बताया था। सच है, नए रसायन विज्ञान के अभी भी कई विरोधी थे, जैसे जे. प्रीस्टले, जिन्होंने सक्रिय रूप से फ्लॉजिस्टन के सिद्धांत की वकालत की। लेकिन विरोधियों की संख्या तेजी से कम हो गई। इस प्रकार, अंग्रेजी फ्लॉजिस्टियन आर. किरवान (1733-1812) ने 1787 में "एस्से ऑन फ्लॉजिस्टन एंड द कॉन्स्टिट्यूशन ऑफ एसिड्स" पुस्तक प्रकाशित की। ए. लावोइसियर और उनके सहयोगियों ने इस पुस्तक के प्रकाशन पर निम्नलिखित तरीके से प्रतिक्रिया दी: पुस्तक द्वारा आर. किरवान का फ्रेंच में अनुवाद किया गया और ए. लावोइसियर, सी. बर्थोलेट, जी. डी मोरव्यू, ए. फोरक्यू-फॉय और जी. मोंगे द्वारा लिखित प्रत्येक अध्याय पर टिप्पणियों के साथ प्रकाशित किया गया। इन टिप्पणियों में, |आर के सभी मुख्य प्रावधान विनाशकारी आलोचना। अंत में, उन्हें अपने विचारों की त्रुटि स्वीकार करने के लिए मजबूर होना पड़ा और 1796 में ऑक्सीजन सिद्धांत में शामिल हो गए। /: हालांकि, रसायनज्ञों की पुरानी पीढ़ी से संबंधित हिस्टोन सिद्धांत के प्रतिनिधियों की आपत्तियों के बावजूद, ऑक्सीजन सिद्धांत और उसके आधार पर निर्मित नए रसायन विज्ञान ने एक बड़ी जीत हासिल की और फिर भी यह नहीं कहा जा सकता कि "रासायनिक क्रांति" पूरी हो गई, जैसा कि ए. लावोइसियर ने स्वयं सोचा था, "रसायन शास्त्र के प्राथमिक पाठ्यक्रम" के जारी होने के साथ और रसायन विज्ञान में परमाणुवाद की शुरूआत के बाद ही रसायनज्ञों की अगली चौथी पीढ़ी द्वारा इसे काफी हद तक पूर्ण रूप से पूरा किया गया।